摘要
背景
受伤的叶子拟南芥蒂利亚纳生产R.难以置信o抗氧化S.种(ROS),并对病原菌产生抗性Botrytis cinerea在地方一级。调用植物对伤口的这种快速响应W.盎司我nducedR.esistance(我们)。然而,这种反应的分子机制以及伤口和ROS产生之间的信号级联仍然很大程度上未知。钙是一种保守信号,参与植物的许多非生物胁迫反应,而且钙途径的作用非常迅速。
结果
本研究的结果表明,在ROS生产中损害了用钙通道抑制剂(维拉帕米)或钙螯合剂(草酸钙)或钙螯合剂(草酸钙和EGTA)的叶子。此外,用维拉帕米,EGTA或草酸盐处理的叶子更容易受到影响b .灰质受伤后。钙化变化的细胞内测量表明,在伤口位点缠绕在细胞中伤害后的几秒钟,瞬时钙动力学表明。通过更稳定的ROS爆裂,在同一区域中遵循细胞溶质钙的这种变化。
结论
这些数据进一步扩展了我们对伤口,钙流入和ROS生产之间的连接的知识。此外,他们首次提供了在伤害之后的证据,在同一位置的ROS中的爆发之前,钙改变在卷曲中。
背景
角质层的损伤,保护植物的空中部位的疏水层,导致水的损失,促进各种病原体的入口。根据最近的发现,本教科书陈述必须有些差别。例如,当豆子或豆子叶子拟南芥蒂利亚纳用真菌表皮酶对植物进行异位处理,它们显示出对真菌病原体的抗性[1,2].此外,答:芥工程化以表达靶向细胞壁的真菌皮蛋白酶也表达了强的电阻[2].增加的内透渗透性允许更好地对感染期间产生的elicitors感知[3.].为了进一步探索这些观察结果,我们将拟南芥叶片表面损伤作为修饰表皮屏障的一种替代方法。这导致了对b .灰质[4].这一矛盾的发现最终被解释为,当观察到这种伤诱导抗性仅在植物受伤后保持在高湿度时才表达。此外,包括H2O2和o.2-可以在伤口部位的几分钟内检测答:芥用镊子压碎的叶子。活性氧先于并且似乎与对b .灰质在伤处接种[5].事实上,伤口诱导的ROS没有被检测到,并且对b .灰质在受伤后在干燥条件下培育的植物中丢失[5].压力荷尔蒙abScisic.一个cid (ABA)与干燥条件下ROS的损失密切相关。ABA在干燥条件下损伤后90分钟内积累,而ABA合成受损突变体在相同条件下仍产生ROS,表现出较强的抗性[5].有趣的是,表皮通透性增加的突变体也表现出与完全免疫相关的高ROS产量[5].这些实验自然地导致了为什么工厂未能对造成的组织损伤作出反应的原因b .灰质在自然情况下。在自然条件下,弱ROS的产生仅在接种后后期观察到b .灰质(接种后12小时)尽管用真菌的角质层分解。当表明真菌在感染部位释放草酸,钙螯合剂,在感染部位时,该问题最终澄清了这种问题。在感染部位,通过释放草酸,钙螯合剂干扰ROS积累[5].草酸盐可能产生的干扰b .灰质钙使钙可能涉及ROS形成和随后的丝。在植物疗法细菌中存在干扰钙信号的另一个例子,其产生与同时作用的多糖米icrobial一个ssociated米olecularp模式(MAMPs)和具有钙螯合作用的毒性因子[6].
在这项工作中,我们已经调查了钙累积和电线涉及钙的假设b .灰质在叶子中答:芥.我们的实验表明,在受伤的叶片中,钙的变化是相关的,发生在相同的位置,但比ROS更早。
结果
在扰乱钙通量的分子上应用可防止损伤和WIR后活性氧的产生
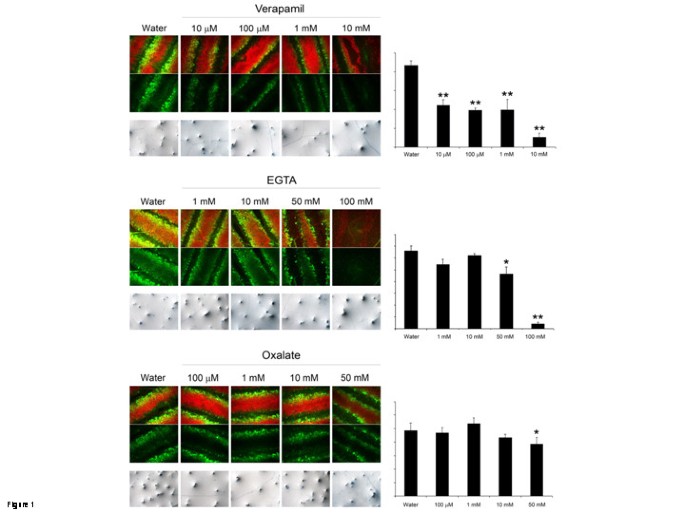
伤员答:芥在渗透后的渗透后,叶会在几分钟内产生ROS - 与5-(和-6)-Carboxy-2,7-d我cHlorodihydrofLuorescein.d我一个cetate (DCF-DA)探针[5)(图1).我们使用了药理学方法来检查钙在伤口诱导的ROS形成中的重要性。钙通道阻断剂(维拉帕米)或钙螯合剂(EGTA或草酸盐)被用作拟南芥叶上侧的小液滴。3小时后,除去液滴并在这些位点受伤。Verapamil(从10μm开始),EGTA(从50毫米开始)和草酸盐(从50 mm开始)所有受影响的伤口诱导的ROS形成(图1).利用这种方法,我们无法知道有多少化合物渗透到细胞外空间。在与估计的细胞外钙浓度(1-10 mM)相同的浓度范围内,螯合剂的影响是可见的[7].只有在伤害前对离体叶片进行真空渗透时,在较低浓度时才可检测到所测化合物的剂量-反应效应(附加文件)1).在台班蓝试验测定的浓度下,这些化合物均不影响细胞活力(图)1).
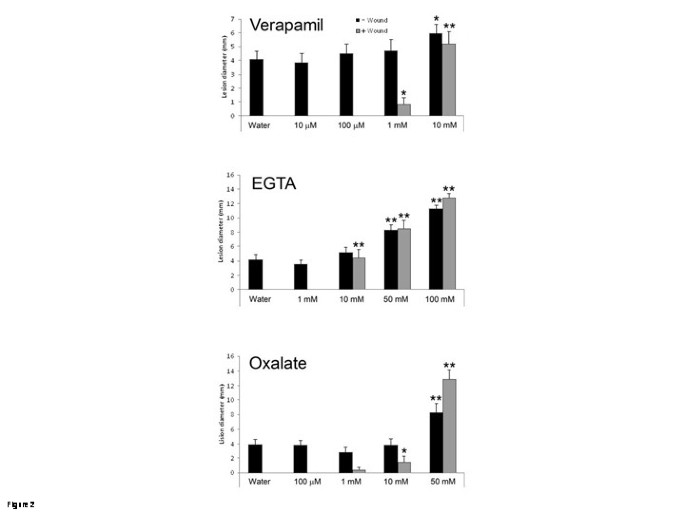
WIR的一个特点就是受伤答:芥叶子对这种坏死营养真菌产生了抗性b .灰质[5].因此,我们测试维拉帕米和螯合剂是否影响WIRb .灰质.将被测分子滴在叶片上,3小时后,去除水滴,损伤叶片,悬浮液b .灰质孢子被放置在伤口部位。3 d后,受伤对照组得到充分保护,未受伤水处理对照组出现典型症状b .灰质感染(感染部位坏死)2).与它们对创伤诱导ROS形成的影响相似,维拉帕米(始于1 mM)、EGTA(始于10 mM)和草酸(始于10 mM)均影响WIR(图)2).用草酸盐和EGTA处理的植物没有伤害显示出增强的病变大小,表明钙在基底阻力中可能参与(图2).综上所述,这些结果表明钙可能参与了损伤感知与诱导ROS和WIR的通路。
细胞内的胞质钙浓度在损伤后增加,随后显示ROS破裂
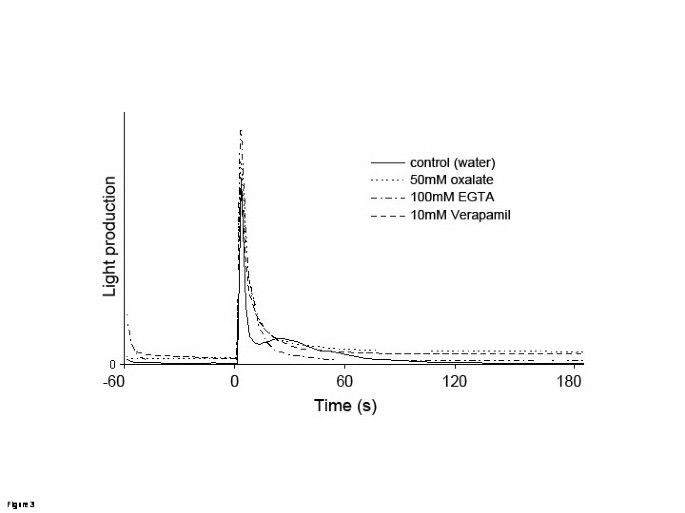
为了进一步检查钙信号在伤害时涉及ROS积累的情况下,如果伤口诱导使用转基因诱导胞质钙浓度的变化答:芥表达光蛋白Aequorin的植物[8].然后通过将叶片在发光计中引入叶片中的叶片来评估卷曲前的基础水平和稳定性,其中每3秒立即被发光一次,持续一分钟。此次发生后,叶片直接在发光计中伤害,并进行读数三分钟。在水浸润的叶片中,伤口导致可重复的动力学,由0到6岁之间的强度和瞬态信号组成,与伤口事件重合(图3.).在第一个峰值之后,大约在25-30秒后,出现第二次振幅较小的暂态增加。与对照相比,抑制剂处理的叶片中第二个发光峰被消除。
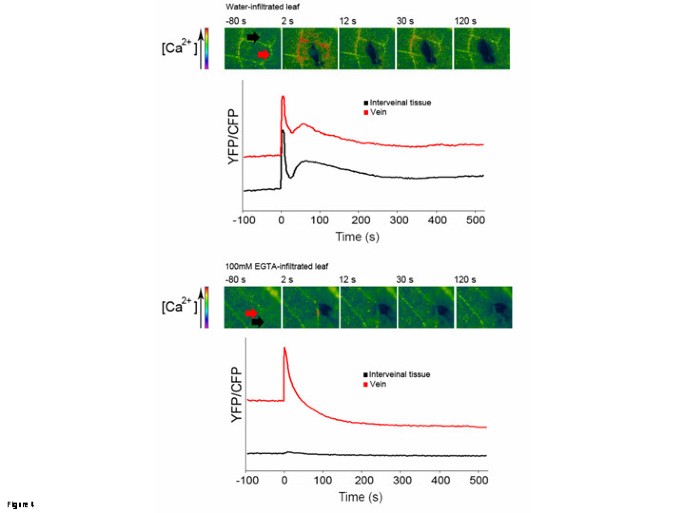
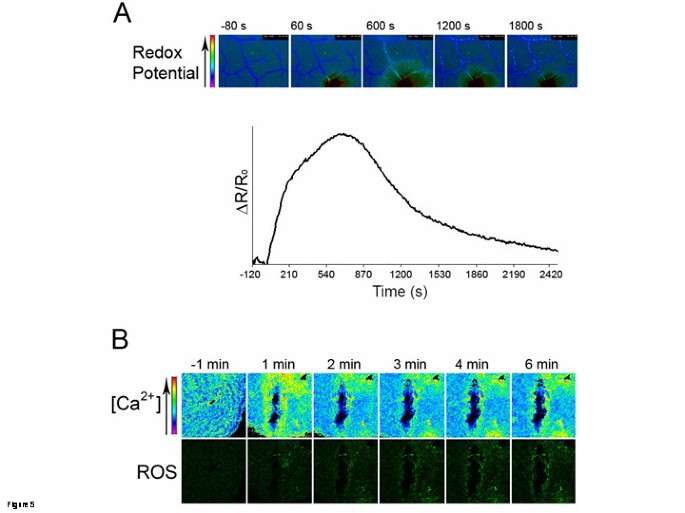
使用A进一步检查细胞内钙的变化答:芥表达黄色Cameleon 3.6荧光共振能量转移的CA2+Cytosol中的传感器[9,10].伤口导致YFP / CFP比率的第一瞬态和陡峭增加(伤口后的0至2s),然后是一秒钟,更小但更持续的伤害(伤口后Ca 30s)(图4).钙的增加仅限于伤口近端细胞,并在构成表皮和血管组织的细胞中观察到。用100 mM EGTA处理叶片(黑线和箭头)时,表皮脉间组织中的两个钙峰均消失。令人惊讶的是,在egta处理过的叶片中,只有第二个钙峰被消除了(图)4).使用植物表达氧化还原敏感生物传感器罗格(rogfp2)[11也可以监测损伤对胞质氧化还原电位的影响。损伤导致邻近受损组织的探针氧化迅速增加(图)5A),反映出明显与观察到的ROS产生相关的效应(图1).在伤害后10-12分钟后,Rogfp2的氧化达到了最大值(图5一种)。此后,可以观察探针氧化的较慢降低,可能是由于由于设备限制而在潮湿的条件下不保持损坏的叶子的事实。造成伤害后的ROS产生额外的努力将钙信号与ROS共同定位。用共聚焦激光扫描显微镜在观察之前,用ROS敏感探针DCF-DA渗滤YC3.6表达叶片。伤口后钙和RO的变化时间过程是图中的5B.伤口导致伤口部位的钙信号的快速发射(在黄色,上部图中5b)随着时间的推移迅速下降。荧光的外观(绿色,下部图5b)由DCF-DA探针的ROS感测引起的,也在伤口部位局部化,但在钙信号后发生。这些结果表明钙的变化早于ROS,两者都发生在伤口部位。
讨论
钙作为早期信号与非生物和生物应力的含义已经报道了[12- - - - - -16].在这里,我们重点讨论了钙在WIR中的重要性答:芥树叶。受伤的叶片产生了一种快速和局部的ROS爆发,并在接种时显示强的阻力b .灰质[5].我们已经检查了钙水平的变化是否因ROS和WIR与ROS和WIR相关。
我们使用维拉帕米、EGTA或草酸盐的药理学方法表明,钙水平干扰和创伤诱导ROS形成的损失之间存在相关性(图)1).这些化学物质是已知的作用于钙稳态和他们的应用在叶片伤害前也抑制WIRb .灰质(图2).总体而言,这些抑制剂干扰ROS的浓度与诱导线的浓度之间存在对应关系。由于用钙抑制剂处理的非受伤的叶子也更容易受到病原体发作(图2).钙通道阻滞剂和螯合剂干扰了受伤后的早期步骤,而没有损伤细胞,这是由生命染色显示的(图)1).我们的研究结果表明钙在受伤知觉和WIR之间起到中介信号的作用b .灰质.该结论支持先前关于钙在诱导抗性过程中钙的重要性的观察[13,17].
但是钙的作用到底发生在哪里呢?叶片损伤导致细胞几乎立即被压碎,细胞的完整性和区隔性丧失。ROS形成和诱导WIR的钙信号在伤口部位附近的细胞中发生[5].这意味着几乎瞬时传输来自被压碎的细胞到邻居的信息。茉莉酸盐迅速产生并从细胞转移到细胞和整个工厂中[18].虽然这里使用的实验设置与Glauser等人的报告类似。[18],茉莉酸盐不太可能涉及,因为在茉莉酸盐合成中受影响的突变体仍然表达电线[4])。从被压碎的细胞向邻近细胞的快速信号可能是通过钙本身传递的:损伤后的失分割导致钙的瞬间和局部增加,将从细胞质延伸到质浆。维拉帕米或钙螯合剂可以阻止钙波从受伤部位进入完整的邻近细胞。
有可能看到受伤后树叶中钙含量的变化吗?我们使用了表达aequorin或Yellow Cameleon 3.6蛋白的植物。两种报告线只表明胞质钙的变化。使用这两种报告,可以获得创伤后胞质钙振荡的可重复性动力学。在受伤后的最初几秒内出现一个尖峰。这个峰值是短暂的,只持续了几秒钟。第二个峰出现在伤后30秒左右,比第一个峰持续时间长约30秒(图)4).这种钙信号很难解释,因为它代表的是一片组织,而不是单个孤立的细胞。事实上,抑制剂或钙螯合剂对叶子组织的影响是不同的。100mM EGTA治疗阻断了静脉间组织损伤引起的两个钙峰,但它完全阻止了静脉中的第二个峰(图)4).这些结果与使用aequorin表达植物的观察结果一致,其中只有第二个峰通过钙抑制剂或螯合剂的处理被阻止(图)3.).表达aequorin的植物对于我们的目的来说是一种不那么精确的方法:为了获得一个可检测的信号,整个叶子在一个宽阔的表面上被损伤,应该被分析,脉间组织和脉都被不区分地包括在定量中。因此,在这个实验中读取的发光值是由单个组织推导的单一动力学的总和。更重要的是,已知aequorin在某些条件下是非线性响应的,如果在采样的细胞群中钙的浓度不均匀,那么aequorin的总体光发射由最响应的亚群主导[19].由于这些原因,由变形龙表达植物获得的钙动力学更可靠,并限定在特定的兴趣区域,使受伤后的钙动力学有更精确的概念。这两个峰值都与ROS的形成和WIR的诱导有关,它们对作用于细胞外的钙抑制剂的敏感性意味着钙通过质浆转运。
钙质水平发生变化的同一组细胞也会产生ROS吗?FRET实验结合ROS标志物DCF-DA的引入,显示了损伤区域周围细胞钙水平的变化,并伴有表明ROS爆发的绿色荧光变化(图)5b)。在伤口刺激之后,随着ROS的荧光增加,在几分钟内遵循增加的钙水平引起的荧光,指示a)两种方法和b)钙的分致变化在ROS积累之前。用叶中嵌入叶中的细胞获得的这些结果与许多关于培养细胞的观察结果一致,其中钙峰前面先于ROS [17].因此,我们对同一位点活性氧形成前的钙变化的研究结果与我们的假设一致。同样值得注意的是,除了短暂的钙和ROS的产生,损伤部位周围细胞的氧化状态也发生了变化,这很可能是由ROS的爆发引起的。这些条件可能导致各种分子的氧化,例如细胞中存在的活性半胱氨酸,因此可能触发其他下游反应[20.].此前有报道称,WIR需要基础水平的谷胱甘肽b .灰质[4].损伤事件后,谷胱甘肽不会在Col-0野生型中进一步积累,但损伤导致谷胱甘肽- s -转移酶(GST1基因。这些结果表明,谷胱甘肽在丝期间的解毒中起作用,而不是建立可能干扰ROS驱动的细胞氧化的降低电位。然而,鉴于强烈ROS突发的细胞毒性,不能排除谷胱甘肽可能仍然是抗氧化分子形成氧化爆发。ROS在线的作用目前尚不清楚。报告表示ROS在信令中的作用[21,而另一些人则提出了ROS在细胞壁增强中发挥作用的模型[22].我们已经证明活性氧在对抗WIR中是必不可少的b .灰质[5].
什么感觉蛋白可能是钙的目标?钙是已知的第二信使激活四种不同的钙传感器蛋白:cal米Odulins(CAM),C一个米-l艾克蛋白质(cml),calcium -d句子pRotin.kINASES(CDPK)和calcineurinB-l象蛋白(CBLs) [23,24].在拟南芥基因组的34个CDPK中[25], CDPK6最近被报道参与激发子调控的ROS和原生质体的先天免疫答:芥[26].在马铃薯Cpk6,ortholog的答:芥CPK5,可直接磷酸化膜结合的NADPH氧化还原酶RBOH-D,刺激其对病原体的ROS产生的活性[27].然而,我们之前的研究已经排除了RBOH-D参与WIR [5].在这里,我们经受了考验cpk5,cpk6和CPK11,单、双、三突变体[26]但是电线仍然活跃,突变体是完美的能够在伤害后产生ROS(数据未显示)。现在需要进一步的工作来识别感应钙的组件。
结论
总之,这项工作证明了钙作为创伤诱导信号的早期信使的重要性,导致抵抗b .灰质.在受伤后的几秒钟内,钙浓度会发生短暂的变化,随后在相同的位置会出现一系列ROS和细胞氧化的变化。这突出了生产的重要性b .灰质草酸作为干扰钙的效应剂。
方法
工厂维修
拟南芥蒂利亚纳种子生态型哥伦比亚(Col-0)在腐殖质和珍珠岩(3:1)的巴氏灭菌混合土壤上生长。种子在4℃保存2天后转入生长室。光照12 h /黑暗12 h,相对湿度60-70%,日温20-22℃,夜温16-18℃。WT植物从诺丁汉拟南芥砧木中心(诺丁汉,英国)获得。
的文化b .灰质,接种,染色菌丝,伤口手术
b .灰质BMM菌株由Brigitte Mauch-Mani (Neuchâtel大学,瑞士)提供,在Difco (Becton Dickinson,http://www.bd.com)马铃薯葡萄糖琼脂(39 g l-1).将孢子在水中收获并通过玻璃棉过滤以除去菌丝。6μL孢子悬架的液滴(5×104孢子毫升-1)沉积在4周龄植物的叶片上,以在3天后定量病变尺寸(mm)。接种植物在覆盖托盘中保持高湿度。通过用实验室镊子轻轻按压薄层来伤害叶子。接种b .灰质在伤口后10分钟内进行,通过将伤口位点放置在伤口位点上的液滴。通过沸腾接种的叶片染色5分钟的含酒精的黑蛋白醇台盼蓝的真菌结构和死亡植物细胞。染色的叶片在氯水合物中被广泛清除(2.5g ml-1)通过温和摇动,在室温下,然后使用具有明亮场设置的Leica DMR显微镜观察。
钙通道抑制剂和钙螯合剂治疗方法
通过施加含有叶片表面抑制剂的6μl液滴进行尿布米(Sigma-Aldrich),EGTA和草酸的处理。将所有化合物溶解在水中,并通过连续稀释液进行不同的浓度,用水作为对照。当渗透钙稳态抑制剂时,将叶片置于50mL注射器管中,没有针填充有10ml含有适当抑制剂的溶液,然后封闭盖子,活塞轻轻拉动5次。
活性氧的检测
使用荧光探针5-(和6)-carboxy-2',7'-二氯二氢荧光荧光蛋白(DCMF-DA)(Sigma-Aldrich)检测ROS。在标准缓冲液(1mM KCl,1mM MgCl)中,在60μm的DCF-DA中磨损或造成伤员或3×3分钟)。(1mm KCl,1mM MgCl2, 1mm CaCl2用NaOH调节pH至6.1)。然后在DCF-DA缓冲液中快速冲洗叶片,使用带有GFP滤光片的徕卡DMR表面荧光显微镜观察(激发波长480/40 nm,发射波长527/30 nm)(徕卡)。显微镜图像保存为TIFF文件,并使用Image J version 1.44 (NIH)进行密度定量处理。在一次实验中,软件设置对每张分析的图像保持相同,在处理前从每张图像中减去背景值2到6。为了共同定位ROS和钙,用DCF-DA染色,用488 nm (470/40 nm)的激发光和525/50 nm的FITC/GFP发射光,用500 nm的二色镜观察ROS。
检测的钙
利用转基因技术监测胞质钙浓度的变化答:芥在花椰菜花叶病毒启动子35S的控制下表达aequorin的植物(来自杜伦大学Marc Knight)。将4周龄aequorin表达植株的叶片置于10 μM coelenterazine (CTZ)中,在黑暗中过夜,使CTZ与aequorin结合。在CTZ培养过夜后,叶子被叶柄轻轻操纵,用钙抑制剂或水真空渗透作为对照,保持5分钟。然后通过将叶子引入光度计(天狼星,天狼星)来评估损伤前发光信号的基础水平和稳定性。(Berthold检测系统),每隔3秒立即记录一次发光值,持续1分钟。在此之后,直接在光度计上伤叶并读数3分钟。实验重复10次,并显示一个具有代表性的结果。
延时钙和Rogfp2成像
表达胞质定位Cameleon YC3.6的16 - 21日龄植株全叶[9或表达roGFP2氧化还原传感器[11]被放置在一个顶部开放的房间里。树叶成像在活的有机体内尼康Ti-E(尼康,JP,http://www.nikon.com/)使用CFI Planfluor 4x A.n.0,13干燥目标。激发光线是由440nm(436/20 nm)的荧光灯先前的荧光灯200 pro(现有科学,英国)生产,用于罗格布2470/40nm和405/40nm之间的440nm和405/40nm。用Hamamatsu双CCD摄像机ORCA-D2(Hamamatsu,Photonics,JP)收集图像。对于Cameleon分析,FFP / YFP光学块A11400-03(用于CFP的发射1 483/32 NM,用于CPvenus的CFPUS与二向镜子510nm的CPvenus)(Hamamatsu,Photonics,JP)用于同时发生CFP和CPVenus收购。曝光时间为400毫秒,具有2x2 CCD分布和图像,每2秒收购。对于两个激发波长,通过505-530 nm的带通滤波器收集Rogfp2排放。暴露时间为470/40nm励磁的2x2 CCD分布为2×2 CCD分箱,300 ms,用于405/40 NM激励和每5秒获取的405/40 NM激励和图像的2×2 CCD分箱。过滤器和二向色镜是从Chroma(Chroma Technology Corporation,USA)购买的。NIS元素(尼康,JP)用作控制显微镜,发光器,相机和采集后分析的平台。 With respect to time course experiments, fluorescence intensity was determined over regions of interest (ROIs) that correspond to the region surrounding the wounded site. The wounding was made with forceps. Since imaged areas do not contain any background, the latter was not subtracted. For Cameleon analysis cpVenus and CFP emissions of the analyzed ROIs were used for the ratio (R) calculation (cpVenus/CFP) and plotted versus time. For roGFP2 analysis the two emissions of the analyzed ROIs were used for the ratio (R) calculation (405/488) and normalized to the initial ratio (R0) and plotted versus time (ΔR/R0). Experiments have been repeated 10 times and one representative result is shown.
参考
- 1.
角质酶和其他脂解酯酶保护豆叶免受感染辣椒.植物营养与肥料学报,1998,11:514-522。10.1094 / MPMI.1998.11.6.514。
- 2.
Chassot C, Nawrath C, Metraux JP:角质层缺陷导致对一种主要植物病原体完全免疫。植物学报,2007,49:972-980。10.1111 / j.1365 - 313 x.2006.03017.x。
- 3.
Bessire M,Chossot C,Jacquat Ac,Humphry M,Borel S,Petetot JMC,MetroAux JP,Nawrath C:拟南芥的可渗透角质层导致强烈的抵抗力Botrytis cinerea.中国海洋大学学报(自然科学版),2007,26(4):457 - 461。10.1038 / sj.emboj.7601658。
- 4.
Chassot C, Buchala A, Schoonbeek H, Metraux JP, Lamotte O:拟南芥叶片的伤害可以产生强大但短暂的防止葡萄孢感染的保护作用。植物学报,2008,55:555-567。10.1111 / j.1365 - 313 x.2008.03540.x。
- 5.
L'Haridon F, Besson-Bard A, Binda M, Serrano M, Abou-Mansour E, Balet F, Schoonbeek H-J, Hess S, Mir R, Leon J, et al: A permeable cuticle is associated with the release of reactive oxygen species and induction of innate immunity. PLoS Pathog. 2011, 7: e1002148-10.1371/journal.ppat.1002148.
- 6.
Aslam S,Erbs G,Morrissey K,Newman M-A,Chinchilla D,Boller T,Molinaro A,Jackson R,Cooper R:MAMPS签名,协同,尺寸和费用:对感知或移动性和主导反应的影响。莫尔植物途径。2009,10:375-387。10.1111 / J.1364-3703.2009.00537.x。
- 7.
acta optica sinica(植物学报),2011,34(4):559 - 563。植物科学学报。2011,2:85-
- 8.
Knight MR, Campbell AK, Smith SM, Trewavas AJ:转基因植物aequorin报告了触摸和冷休克和激发子对细胞质钙的影响。自然。1991,352:524-526。10.1038 / 352524 a0。
- 9.
Krebs M,持有K,活页夹A,Hashimoto K,Den Herder G,Deniske M,Kudla J,Schumacher K:基于FRET的遗传编码传感器允许CA的高分辨率直播电池成像2+动力学。植物学报,2012,69:181-192。10.1111 / j.1365 - 313 x.2011.04780.x。
- 10.
Nagai T, Yamada S, Tominaga T, Ichikawa M, miyaaki A:扩展了Ca荧光指示器的动态范围2+通过圆形置换的黄色荧光蛋白。Proc Natl Acad Sci U S A. 2004,101:10554-10559。10.1073 / pnas.0400417101。
- 11.
Meyer AJ, Brach T, Marty L, Kreye S, Rouhier N, Jacquot JP, Hell R:氧化还原敏感的GFP在拟南芥蒂利亚纳是一种定量生物传感器的氧化还原电位的细胞谷胱甘肽氧化还原缓冲液。植物学报,2007,52:973-986。10.1111 / j.1365 - 313 x.2007.03280.x。
- 12.
桥本:钙信号:植物信息处理的主导货币。acta botanica sinica(云南植物研究),2010,22(4):541-563。10.1105 / tpc.109.072686。
- 13.
植物防御信号通路中的钙。植物学报,2006,35(6):769 - 774。10.1111 / j.1469-8137.2006.01777.x。
- 14.
应对应激:钙和钙/钙调素调控基因表达的作用。acta botanica sinica, 2017, 36(6): 772 - 772。10.1105 / tpc.111.084988。
- 15.
Stael S, Wurzinger B, Mair A, Mehlmer N, Vothknecht UC, Teige M:植物细胞器钙信号:一个新兴领域。中国生物医学工程学报。2012,31(4):457 - 461。10.1093 / jxb / err394。
- 16.
Braam J:联系:植物对机械刺激的反应。新的植物学家。2005,165:373-389。
- 17.
RANF S,ESCHEN-LIPPOLD L,PECHER P,LEE J,SCHEEL D:在防御响应到微生物或损坏相关分子模式期间的钙信令和早期信号元件之间的相互作用。工厂J111,68:100-113。10.1111 / J.1365-313x.2011.04671.x。
- 18.
Glauser G,Grata e,Dubugnon L,Rudaz S,农民EE,Wolfender J-L:贾斯诺特合成和拟南芥积累的空间和时间动态伴随着伤害。J Biol Chem。2008,283:16400-16407。10.1074 / JBC.M801760200。
- 19.
Brini M, Marsault R, Bastianutto C, Alvarez J, Pozzan T, Rizzuto R:转染aequorin检测胞质钙2+浓度([加入2+c)。一个关键的评估。中国生物医学工程学报。10.1074 / jbc.270.17.9896。
- 20。
大豆酪氨酸特异性蛋白磷酸酶的氧化还原调控。生物化学学报。2005,44(4):491 - 498。10.1021 / bi047324a。
- 21。
Orozco-Cardenas ML, Narvaez-Vasquez J, Ryan CA:过氧化氢作为第二信使诱导番茄植株对伤害、系统素和茉莉酸甲酯的防御基因。植物学报。2001,13:179-191。
- 22.
Asselbergh B,Curner K,Franca Sc,Audenaert K,Vuylsteke M,Van Breusegem F,Hofte M:抵抗力Botrytis cinerea在Sitiens中,脱离酸缺陷型番茄突变体,涉及表皮中及时生产过氧化氢和细胞壁修饰。植物理性。2007,144:1863-1877。10.1104 / pp.107.099226。
- 23.
植物钙解码机制的研究。生物化学。2011,93:2054-2059。10.1016 / j.biochi.2011.05.019。
- 24.
钙调神经氨酸b样钙传感器CBL1和CBL9及其相互作用的蛋白激酶CIPK26调控拟南芥NADPH氧化酶RBOHF。植物学报。2013,6:559-569。10.1093 / mp / sst009。
- 25.
Hrabak EM, Chan CWM, Gribskov M, Harper JF, Choi JH, Halford N, Kudla J, Luan S, Nimmo HG, Sussman MR, et al:拟南芥蛋白激酶CDPK-SnRK超家族。植物生理学报。2003,32(6):636 - 642。10.1104 / pp.102.011999。
- 26.
Boudsocq M,Willmann Mr,McCormack M,Lee H,Shan L,He P,Bush J,Cheng Sh,Sheen J:差分天生免疫信号通过CA2+传感器蛋白激酶。《自然》,2010,464:418-422。10.1038 / nature08794。
- 27.
Kobayashi M, Ohura I, Kawakita K, Yokota N, Fujiwara M, Shimamoto K, Doke N, Yoshioka H:钙依赖蛋白激酶通过马铃薯NADPH氧化酶调节活性氧的产生。acta botanica sinica(云南植物研究),2007,19(4):457 - 461。10.1105 / tpc.106.048884。
确认
瑞士国家科学基金会的财政支持到Jean-PierreMétraux和“Fircab20_RBFR10S1LJ_001)到Alex Costa的”Fircero“(FiRB2010_RBFR10S1LJ_001)被令人惊讶地承认了
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
EB:ROS染色和量化,台盼蓝染色,b .灰质感染。AC:延时钙和roGFP2成像,手稿制备。FL:实验的概念化,手稿的关键修改。实验的概念化,手稿的撰写,手稿的关键修改。MB:实验的概念化,使用aequorin表达植物的钙内流动力学,ROS和钙共染色,手稿撰写。所有作者阅读并批准了最终的手稿。
电子辅料
受伤的渗透
附加文件1:答:芥叶子与钙通道阻滞剂和钙螯合剂取消了ROS生产。不同浓度的维拉帕米、EGTA和草酸盐真空渗透离体叶片。损伤叶片,用DCF-DA染色,荧光显微镜观察(ROS为绿色,叶绿素自身荧光为红色)。ROS信号的密度分析显示在每个图像系列的右侧。星号表示使用学生的显著差异T.测试相对于水处理对照;*P< 0.05,* *P< 0.01。(TIFF 255 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Beneloujaephajri,E.,Costa,A.,L'Haridon,F。等等。生产活性氧物质和伤口诱导的抗性拟南芥蒂利亚纳对Botrytis cinerea依赖于钙的爆发。BMC植物杂志13,160(2013)。https://doi.org/10.1186/1471-2229-13-160
已收到:
接受:
发表:
关键词
- 拟南芥蒂利亚纳
- Botrytis cinerea
- 角质层
- 受伤
- 反抗
- 钙
- 罗斯