摘要
背景
皮质微管形成一个动态网络,不断经历收缩(灾难)、暂停和重建(拯救)。这种动态系统的优点是它可以在短时间内调解适当的响应。微管在决定植物细胞壁中纤维素微纤维沉积的方向方面起着至关重要的作用。后者是围绕着原生质体的固体外骨骼。它形成了连接大多数细胞的物理框架,并必须承受组织内的拉伸应力。在这里,我们描述了外部施加压力对生长中的拟南芥叶片微管组织的影响。
结果
对携带gfp标记的TUA6蛋白的转基因植物进行共聚焦显微镜检查,观察到对生长中的拟南芥叶片施加额外的机械压力会引发单个细胞内微管的过度捆绑。此外,微管似乎在邻近的细胞中排列整齐,形成了一种“连续的”超细胞模式。这种效应在施加外力后3小时内就会发生,而且是年龄依赖性的,因此只有在播种后19天(DAS)的叶片细胞才会受到施加压力的影响。
结论
当外部压力施加在发育中的拟南芥叶片上时,微管聚集并重新排列形成看似连续的超细胞模式。由于微管引导纤维素合酶复合物,这种观察到的重组模式可能会影响纤维素沉积,有助于在特定位置加强细胞壁,以应对额外施加的压力。年龄效应是合理的,因为积极塑造细胞壁的年轻细胞更容易受到机械应力变化的影响,而在年龄大于19 DAS的叶片中,细胞壁更坚固,因此可以承受施加的力。
背景
令人信服的证据支持这样一种观点,即发育中的组织的生物物理方面是生长的共同决定因素[1,2].在植物中,细胞壁形成了一个相互连接的框架,将所有细胞粘合在一起,并必须承受所有遇到的压力[3.].组织内的张力产生于不同细胞层之间(组织应力)[4- - - - - -6]和相邻细胞之间的差异,这是生长速率不同的结果[2].此外,植物细胞壁在压力下表现得像一个弹性容器。在原生质体的液泡中,渗透驱动的水吸收产生所谓的“膨压”[5,7推着墙。
为了承受所有这些压力,纤维素微原纤维的晶体阵列被沉积在壁上。这些微纤维提供抗拉强度,这取决于取向模式和整体基质组成,包括其他壁成分,如半纤维素和果胶[8].重要的是,这种强化墙在生长过程中需要获得一定的可塑性,以便变形和扩张。这些事件在细胞水平上通过纤维素合酶(CESA)复合体的定向引导进行严格管理,通过修饰邻近纤维素微纤维之间的半纤维素系链来确定纤维素微纤维的取向[9],通过靶向传递/激活调节细胞壁特性的细胞外蛋白和改变外质体pH值[10].
上述过程大多涉及细胞骨架,这是一个跨越皮层区域的动态网络,由微管和肌动蛋白丝组成。后者处理胞外囊泡的靶向运输[11- - - - - -13],而微管通过引导膜中的CESA复合物来影响新沉积的纤维素微原纤维的定位[14- - - - - -18].
本研究展示了拟南芥叶片铺装细胞中微管对施加压力的响应。应力反应包括在施加外力的3小时内微管形态的重组。其特征是微管明显平行排列。此外,相邻细胞中的微管似乎形成了一个拱形的模式,形成了一个连续的超细胞模式的印象。这种反应以年龄依赖的方式发生,只有播种后19天(DAS)的嫩叶才容易受到胁迫。
结果
Supracellular模式
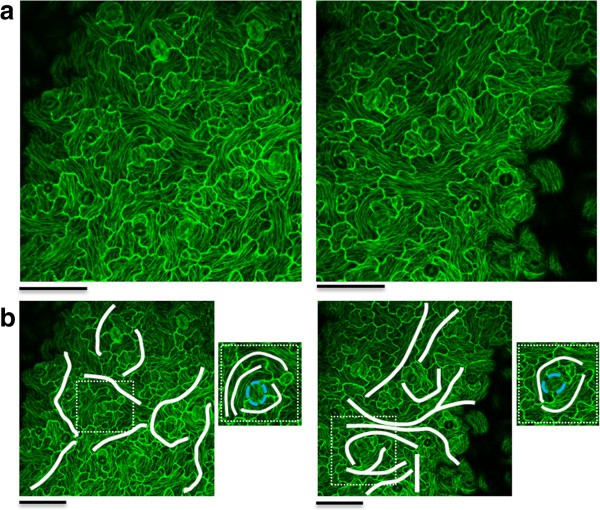
为了在叶片表皮上施加外部压力,我们将表达微管标记TUA6-GFP的拟南芥叶片放置在显微镜载片和盖载片之间,观察到长时间的孵育诱导近轴表皮铺装细胞内的微管强烈排列。数字1a在孵育3小时后显示有代表性的z堆投影。有趣的是,这种模式似乎在邻近的细胞中继续,这意味着在组织水平上有很强的协调性(图1b).如图中放大的切片图像所示,气孔周围的模式明显出现1b.需要指出的是,该转基因系缺乏毛体。
微管应激随时间的变化
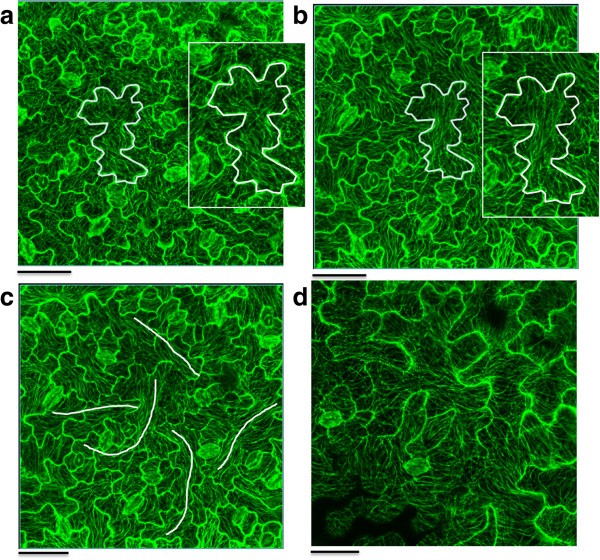
为了评估微管反应的时间过程,在3小时内监测微管,每60分钟记录一次微管模式。这是对不同年龄的叶片进行的,从播种后14天到22天(DAS)。在所有样品中,微管在初始时间点以相当随机的模式组织(图2a).然而,180分钟后,微管明显对齐,如图15 DAS的铺装细胞所示2b.此外,还可以观察到图中白线所示的超细胞模式2c.然而,在22 DAS时,没有看到类似的影响,这意味着一种年龄相关的现象(图2d)。
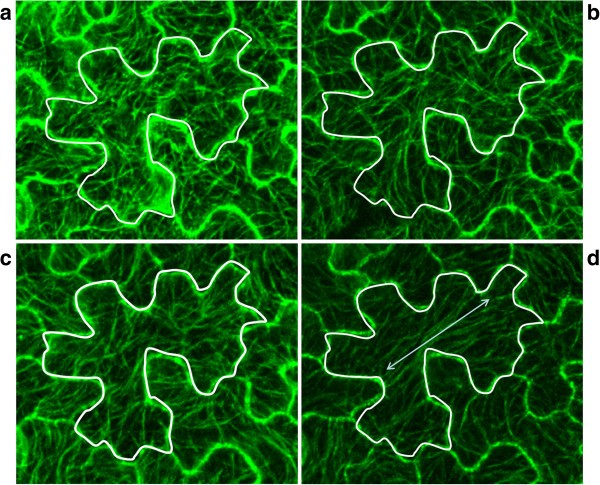
数字3.更详细地说明了一个15 DAS老叶在180分钟内微管模式的变化。这显示了120分钟后微管的巨大变化,在此之后微管按照细胞内的一个轴排列(图3.d)。
触发压力反应
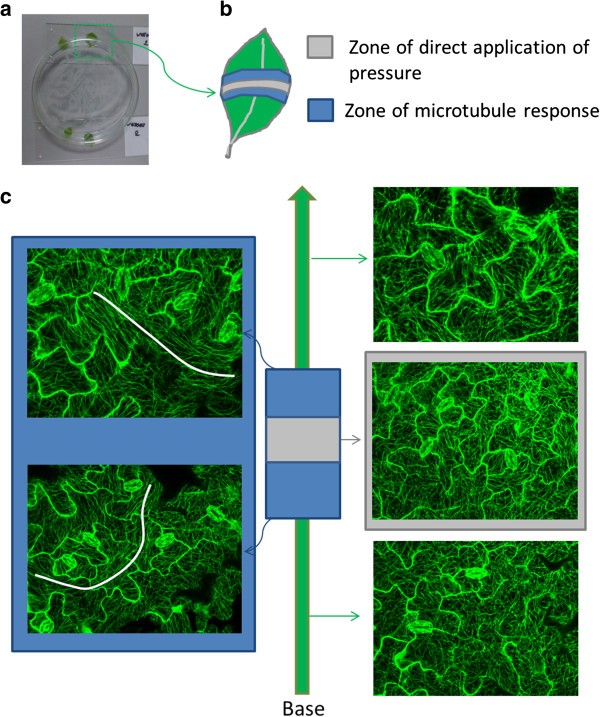
为了确定导致重组的触发器,测试了不同的实验条件(表1).对于正常的共聚焦可视化,从幼苗上剪下叶片,放在盖下的水中,评估不同个体操作的效果。结果表明,从该植物上剪下的叶子,放在显微镜载玻片上的小水滴上3小时,没有观察到超细胞模式。同样,将叶子浸入水中也不会诱发应激模式。只有当叶片被放置在显微镜载片和盖片之间3小时时,微管才出现强烈的束结,即使叶片仍然附着在植株上。20株DAS的叶片在响应上有差异,3株中有2株的微管模式没有显著变化(表4)1).这反映了如前所述的对施加应力的逐渐的年龄依赖性的阻力。验证盖条覆盖所造成的缺氧效果[19]时,在玻璃滑块和盖滑块之间采用了带有垫片的特殊腔体(图4a).长达6.5小时的成像没有显示之前描述的微管应激反应(图4b).这些结果为以下假设提供了强有力的证据,即覆盖层施加的压力是微管向“连续的”超细胞模式束结和重排的引发因素。事实上,定向施加外部压力可诱导形成跨越整个叶片细胞的排列紧密的微管。为了更局部地施加压力,一个玻璃培养皿被倒置放在叶子上(图5a).在叶片不同位置拍摄的图像(图1)5b和c)表明,19个DAS老叶的应力响应在靠近施加压力的细胞中最为显著(图5C,蓝色区域),可以观察到弯曲的超细胞模式。叶片末端(底部和顶部)细胞内的微管没有反应(图)5c,绿区)。在培养皿接触叶片的接触区,未观察到明显的微管束结。在22 das老叶中,即使在双重载荷作用下,也没有应力响应。
讨论
微管形成一个动态网络,不断经历聚合、解聚合和暂停[20.].这种不断的重建使我们能够对环境信号做出快速而充分的反应。既往有微针局部机械刺激后微管反应的报道[21].在这里,我们展示了在全局施加压力下的微管重组,这被视为平行束的强对齐。此外,相邻细胞之间的微管似乎经常遵循彼此的方向,形成一种看似“连续的”超细胞模式。当施加均匀的压力时,通过在叶片顶部放置盖片,一个显著的特征是微管在气孔周围绕圈排列。对这种模式的一种可能的解释是,在缺乏毛状体气孔的TUA6-GFP细胞系中,毛状体气孔高于表面,吸收所有的压力,并为周围的细胞产生一个圆形的拉伸场6a)微管“感知”这些压力的变化,并根据这种模式排列。同样,当局部压力以杆状形式施加时(如培养皿)(图5B),创建一个线性前端,可沿垂直于接触面积轴的方向拉伸细胞。这也可以解释为什么在接触区微管模式没有观察到明显的变化,因为这个位置的力是严格垂直的。然而,在应力模式和微管排列之间没有直接的相关性;超细胞形态呈弯曲状,且不遵循整体负荷作用方向。这可能意味着应力场不是简单的线性的,这可能是因为细胞的组织和单个细胞的复杂几何结构。有可能是气孔充当了“桅杆”的作用,导致了应力模式的偏离,因为气孔似乎位于细胞上模式的中心(图5c).将叶片的更大区域可视化,以绘制微管模式,并观察这与施加压力时叶片中的应力之间的关系,这将是有趣的。
这种特殊的微管阵列的好处可能在于随后对纤维素微纤维沉积在细胞壁中的方向进行修饰。由于细胞和叶片组织需要保持它们的完整性,可能需要加强细胞壁来抵抗额外的承受力。事实上,哈曼特也讨论过类似的影响等.[1对于芽尖分生组织中的微管,这些微管对由细胞消融引起的差异应力作出反应。细胞壁中微原纤维的类似组织导致了观察到的垂直于影响应力的各向异性膨胀[22].当外界施加压力时,叶片中的力会发生变化,因此细胞需要以适当的方式应对新的环境。这也可以解释年龄依赖性效应。年轻的细胞积极地塑造它们的细胞壁是合理的等.,未发表的结果),更容易受到机械应力的变化,而在较老的叶片,壁更坚固,因此可以承受施加的力。
这些结果指出了研究叶片微管取向时的一个重要的潜在伪影来源,例如表型或发育研究。用于成像微管的实验装置需要仔细验证,以确保叶片的安装不会在观察时间内改变微管的方向。在观察拟南芥叶片时,为了排除样品制备的副作用,应尊重最大2小时的时间窗。
方法
利用哥伦比亚0 (Col-0)背景中标记α-微管蛋白6的绿色荧光蛋白(GFP)的融合结构(glTUA6-GFP),观察了第四叶正面铺层细胞的微管[27].从嫩枝的叶柄处剪下叶片,放在蒸馏水中的显微镜载玻片和盖玻片之间。
为检验年龄效应,对播后15 ~ 20天和22 d的叶片进行3 h微管形态监测。使用尼康C1激光扫描共聚焦显微镜(尼康,Melville, NY),配备氩和氦/氖激光,使用63x平面萤光透镜(NA: 1.95)和GFP自动过滤装置对皮层微管模式进行可视化。制作z叠片,将连续的幻灯片合并为最大投影图像,用于观察。
在不同的条件下,通过切下叶片,将其放置在显微镜载玻片上3小时,或将其浸入蒸馏水的玻璃培养皿(直径50毫米)进行测试。此外,还制备了一份仍然附着在植物上的第四片叶子的样品。如Sawchuk中所述,在显微镜载玻片和盖玻片之间有间隔的特殊腔体et al。[28,以监测树叶长达6.5小时(图4a).一个正常的样本,将叶片置于水中的微观滑片和覆盖滑片之间,作为阳性对照。使用尼康C1激光扫描共聚焦显微镜(尼康,Melville, NY)在所有治疗3小时后观察微管。阴性对照为新制样品。这些图像是在叶子的底部、中间和顶部拍摄的。这是对19和20 DAS的叶子进行的。
将直径60毫米的玻璃培养皿放置在19和22 DAS的叶片上,以诱导局部压力(如图所示)5).玻璃培养皿的总重量为17克,这意味着它的重量/周长比为0.90克/厘米。对22个DAS老叶进行额外重量(总重量34 g)的试验。微管的图像是在施加压力的下方和邻近区域以及叶片更远的位置拍摄的。
在所有测试条件下取样三片叶子,并通过目视观察对应力模式的存在进行评分。每片叶子至少拍摄5张照片。当在超过50%的图像中检测到高度捆绑的微管时,它们被积极地评价为压力模式的存在。
参考文献
Hamant O, Heisler MG, Jönsson H, Krupinski P, Uyttewaal M, Bokov P, Corson F, Sahlin P, Boudaoud A, Meyerowitz EM, Couder Y, Traas J:机械信号在发育模式中的作用拟南芥.科学通报,2008,32(5):555 - 555。10.1126 / science.1165594。
Uyttewaal M, Burian A, Alim K, Landrein B, Borowska-Wykret D, Dedieu A, Peaucelle A, Ludynia M, Traas J, Boudaoud A, Kwiatkowska D, Hamant O:机械应力通过卡塔蛋白作用,放大相邻细胞间生长速率的差异拟南芥.中国生物医学工程学报,2012,29(4):439-451。10.1016 / j.cell.2012.02.048。
细胞壁是如何调节植物生长的?中国生物医学工程学报,2005,29(4):369 - 369。10.1093 / jxb / eri247。
Peters WS, Tomos AD:组织张力的历史。中国科学(d辑)。10.1093 / aob / 77.6.657。
生长的外表皮壁:复合结构的设计和生理作用。中国机械工程,2008,29(5):564 - 564。10.1093 / aob / mcn015。
[J]:生长协调与芽表皮的关系。植物学报,2008,11:42-48。10.1016 / j.pbi.2007.10.009。
Somerville C, Bauer S, Brininstool G, Facette M, Hamann T, Milne J, Osborne E, Paredez A, Persson S, Raab T, Vorwerk S, Youngs H:一种理解植物细胞壁的系统方法。科学通报,2004,30(4):361 - 361。10.1126 / science.1102765。
王晓燕,王晓燕,王晓燕,Höfte H:高等植物细胞各向异性扩张的调控。中国生物医学工程学报,2010,32(3):319 -324。10.1016 / j.crvi.2010.01.007。
Vissenberg K, Martinez-Vilchez IM, Verbelen J-P, Miller JG, Fry SC:拟南芥根部延伸区木糖葡聚糖内转糖基化酶活性及其供体底物的体内协同作用。植物学报,2000,12:1229-1237。
Staal M, De Cnodder T, Simon D, Vandenbussche F, Van Der Straeten D, Verbelen J-P, Elzenga T, Vissenberg K:细胞外壁碱化对细胞伸长有抑制作用拟南芥由乙烯前体1-氨基环丙烷-1-羧酸(ACC)形成。植物生理学报,2011,36(5):559 - 561。10.1104 / pp.110.168476。
韦森尼·戈,戈尔韦·梅:重塑细胞骨架的生长和形态:综述和一些新观点。植物学报,2003,24(3):381 - 381。10.1146 / annurev.arplant.54.031902.134818。
Bannigan A, Baskin TI:细胞定向扩张-转向肌动蛋白。植物生态学报,2004,23(4):619-624。10.1016 / j.pbi.2005.09.002。
植物细胞骨架对细胞扩张的空间控制。中国生物医学工程学报,2005,29(5):371 - 371。10.1146 / annurev.cellbio.21.122303.114901。
Paredez AR, Somerville CR, Ehrhardt DW:纤维素合成酶的可视化显示了与微管的功能联系。科学通报,2006,32(4):359 - 359。10.1126 / science.1126551。
Crowell EF, Bischoff V, Desprez T, Rolland A, Stierhof YD, Schumacher K, Gonneau M, Höfte H, Vernhettes S:微管上高尔基体暂停调节拟南芥纤维素合成酶复合物的分泌。植物生态学报,2009,29(4):381 - 381。10.1105 / tpc.108.065334。
Gutierrez R, Lindeboom JJ, Paredez AR, Emons AMC, Ehrhardt DW:拟南芥皮质微管将纤维素合酶运送到质膜,并与纤维素合酶运输室相互作用。细胞生物学杂志,2009,11(7):797-808。10.1038 / ncb1886。
李硕,雷磊,Somerville CR,顾勇:纤维素合酶相互作用蛋白1 (CSI1)连接微管和纤维素合酶复合体。中国生物医学工程学报,2012,29(5):559 - 561。10.1073 / pnas.1118560109。
Bringmann M, Li E, Sampathkumar A, Kocabek T, Hauser MT, Persson S: pam - pom2 /纤维素合成酶INTERACTING1在纤维素合成酶与微管的功能结合中是必不可少的拟南芥.植物学报,2012,24:163-177。10.1105 / tpc.111.093575。
Kitsios G, Alexiou KG, Bush M, Shaw P, Doonan JH:一种周期蛋白依赖性蛋白激酶CDKC2与拟南芥剪接体成分共定位并调节其分布。植物学报,2008,32(3):366 - 366。10.1111 / j.1365 - 313 x.2008.03414.x。
Shaw S, Kamyar R, Ehrhardt D:持续微管踏铣拟南芥皮质数组。科学通报,2003,30(4):447 - 447。10.1126 / science.1083529。
Hardham AR, Takemoto D, White RG:拟南芥表皮细胞机械刺激后的快速动态亚细胞重组模拟真菌和卵菌攻击的反应。植物生物学杂志,2008,8:63-10.1186/1471-2229-8-63。
[J]:植物营养茎尖的生长与形态发生Anagallis薄荷L.中国生物医学工程学报,2003,32(3):366 - 366。
M Uyttewaal, Traas J, Hamant O:整合身体压力、生长和发展。植物学报,2010,13:46-52。10.1016 / j.pbi.2009.10.004。
黑穗苋的分化、器官发生与细胞壁定向构造。2二维模型的应力分离。[J] .科学通报,1994,25(5):557 - 557。10.2307 / 2441182。
Cleary AL, Hardham AR:压力诱导大鼠表皮细胞皮质微管重定向Lolium rigidum叶子。植物细胞物理学报,1993,34(7):1003-1008。
Heisler MG, Hamant O, Krupinski P, Uyttewaal M, Ohno C, Jönsson H, Traas J, Meyerowitz EM:芽尖分生组织中PIN1极性和微管方向的对齐揭示了形态发生和生长素运输之间的th- 8耦合。科学通报,2010,8 (10):e1000516-10.1371/journal.pbio.1000516
Ueda K, Matsuyama T, Hashimoto T:转基因活细胞微管的可视化拟南芥.中国生物工程学报,1999,29(4):359 - 359。10.1007 / BF01279267。
Sawchuk MG, Head P, Donner TJ, Scarpella E:拟南芥叶片发育的时移成像显示原形成层形成的动态模式。植物学报,2007,29(5):569 -571。10.1111 / j.1469-8137.2007.02193.x。
确认
作者要感谢Robert Kumpf博士的艺术贡献和比利时国家-比利时科学政策大学间吸引极地项目[IUAP VI/33]、弗兰德斯研究基金会(FWO)和安特卫普大学的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
EJ进行了实验并起草了手稿。EJ、JPV和KV设计实验并编辑稿件。所有作者阅读并批准了最终稿件。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
Jacques, E. Verbelen, JP。拟南芥叶片中的机械胁迫以“连续的”超细胞模式定向微管。BMC植物杂志13日,163(2013)。https://doi.org/10.1186/1471-2229-13-163
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-163
关键字
- 拟南芥
- 细胞的发展
- 叶
- 机械应力
- 微管