摘要
背景
不同野生品种对枯萎病的易感性不同拟南芥.六个抗尖孢镰刀菌(RFO)数量性状位点(qtl)控制着色剂Columbia-0 (Col-0)的抗性和对Taynuilt-0的敏感性尖孢镰刀菌福马特殊形而上学matthioli(FOM)在由F .的一个回交衍生的重组群体中被检测到1混合(公元前1).特别是RFO1QTL似乎与其他三个位点相互作用,RFO2,RFO4而且RFO6,归属于基因At1g79670。
结果
当对FOM的抗性映射到一个新的BC中时1其中功能缺失突变体At1g79670取代野生型成为Col-0亲本,RFO1的主要影响和RFO1的相互作用RFO2,RFO4而且RFO6均不存在,表明At1g79670单独占RFO1QTL。两个qtl的抗性,RFO3而且RFO5,独立于RFO1并在新公元前复制1人口。在分析第三个公元前1种群,对第二种病原体的抵抗力,病圃福马特殊形而上学conglutinans第1种(FOC1)的主要效应位点RFO7被确认。
结论
天生的数量抗性病圃很大程度上是特定于感染的特殊形式因为不同RFO基因座负责FOM和FOC1的抗性。BC植物数量抗病性状的定位1由序列之间的杂交产生的种群拟南芥在全基因组基因分型高效、经济和可获得的情况下,获取可以成为常规程序。
背景
枯萎病拟南芥是一种理想的病理系统,定位,鉴定和表征基因负责宿主抵抗血管枯萎真菌。答:芥这是植物分子遗传和基因组研究的杰出课题,易受三种系统发育不同的致病形式或特殊形式的土壤传播真菌的感染尖孢镰刀菌[1,2].在野外,病圃福马特殊形而上学conglutinans(船),病圃福马特殊形而上学raphani而且病圃福马特殊形而上学matthioli(FOM)与疾病隔离芸苔属植物品种,萝卜(萝卜)及园畜(Matthioli incana),分别[3.].枯萎病答:芥概述野外宿主疾病症状的发展[1].
不同加入量的反应答:芥对于不同的形式,从完全抗性到随时易感性不等[1].例如,标准实验室加入的Columbia-0 (Col-0)对FOM完全抗性,但对FOC1仅表现出部分抗性。另一方面,Taynuilt-0 (Ty-0)对FOM敏感,但也对FOC1表达部分抗性。
两种策略被用于绘制导致种群表型变异的基因图谱[4- - - - - -6].当感兴趣的群体是野生的,并且是由不确定数量的未定义的杂交产生的,全基因组关联(GWA)研究使用连锁不平衡的证据来关联负责性状的基因内部或附近的序列多态性。在工厂中进行GWA研究答:芥是1001个基因组计划的主要动机,该计划已经生成了数百种野生植物的全基因组序列答:芥[7,8].事实上,检测功能序列的多样性答:芥使用GWA的报告[9,10].然而,GWA研究很少发现导致现有动植物种群变异的序列多样性的一小部分[5,9,11].
遗传连锁可用于将与性状相关的基因映射到染色体间隔上。然而,这种方法要求所研究的人群来自已确定亲本之间的受控杂交;而且,只有区分亲本的遗传多样性被检测出来。尽管如此,连锁分析已经成为检测和定义复杂性状的基因的一种强大而成功的方法答:芥[12].
与易于近亲繁殖的植物种类,例如答:芥,重组自交系(RI)群体几乎专门用于绘制和定义自然性状的遗传位点[12,13].RI群体最简单的形式源于具有不同基因型的亲本之间的异交。亲本独特的重组基因型在几十到数百个RI系中被捕获,这些RI系是由F个体繁殖产生的2自交受精和单籽后代。经过几代近亲繁殖后,RI子代基本上成为纯合子,从而成为真正的繁殖RI系。然而,在QTL分析开始之前,在不引入选择的情况下进行RI群体的繁殖和策划是一项大量的时间和精力投资。产生RI群体的努力被一个事实所抵消,即RI系是不朽的,可以重新测试无数次,并在单独的研究中重复使用,但只需要进行一次基因分型。现在有几十个已发表的国际水稻群体是由野生杂交的答:芥[12,14- - - - - -16].最近,一种产生单倍体的技术答:芥使双单倍体的产生成为可能[17].像RI系一样,双单倍体是纯合子的,因此是不朽的,但需要更少的世代来创造。
其他交配策略生成重组映射群体的时间和精力比生成RI系更少。特别是BC1种群是由连续两代的杂交产生的。亲本基因型之间的初始异交产生F1Hybrid,然后回交到它的循环父结点。每个结果BC1杂种从复发亲本继承一组非重组染色体,从F1混合动力车。由于由单个减数分裂产生的交叉可以明确地分配给重组染色体,因此BC1交配方案常用于生成模型种群,以评估QTL分析的新方法[18- - - - - -20.].此外,回交是传统育种方案中寻求将新性状引入优良作物品种的常见特征[21].
BC的吸引力1由于对广泛的基因分型的需要,以及对天然性状的研究很少,种群受到了损害答:芥使用BC1用于全基因组作图的种群[1,12,22].因为每个BC1杂种具有独特的重组基因型,需要对每个被测BC进行基因分型1混合基因组。没有BC亲本的全基因组序列信息1在人类群体中,发现序列多态性并将其开发成一组合适的DNA标记用于全基因组作图是一个费时费力的过程。
尽管如此,先前的BC基因分析1群体分析表明,Col-0对FOM的定性抗性是一个多基因性状[1].六个RFOqtl在Col-0和Ty-0杂交后回交抗性F产生的群体中分离,反映了Col-0的抗性和Ty-0的敏感性1与易感亲本Ty-0杂交。在RFO位点,RFO1对FOM的抵抗力有最强的关联。RFO1似乎还和另外三个人有互动RFO位点,即RFO2,RFO4而且RFO6,因为这三个相互作用的位点只有在重组BC时才有显著的关联1杂交种也遗传col0等位基因RFO1(RFO1-C).RFO2是一个受体样蛋白(RLP)基因,与PSY1肽受体基因同源,PSY1R[23].的RFO1-连锁基因At1g79670被命名RFO1因为At1g79670的Col-0序列作为转基因增强了Ty-0的抗性,而At1g79670的功能缺失等位基因(rfo1)会降低Col-0的抗性[1].At1g79670是受体样激酶(RLK)基因的壁相关激酶样激酶亚家族的成员。
在这里,我绘制了两个新公元前的枯萎病抗性1(i)研究At1g79670是否单独导致了归因于该药的耐药性RFO1QTL,包括与RFO2,RFO4而且RFO6,以及(ii)检查是否相同或不同RFOqtl介导了对不同类型特殊的抗性病圃.在此过程中,我提出了一种全基因组基因分型的方法,使复杂数量性状的映射成为常规程序。重要的是,由于全基因组序列现在可用于大多数已研究的种质,同样的方法可以应用于任何一对亲本之间的杂交拟南芥登记入册。
结果
抗FOM在rfo1
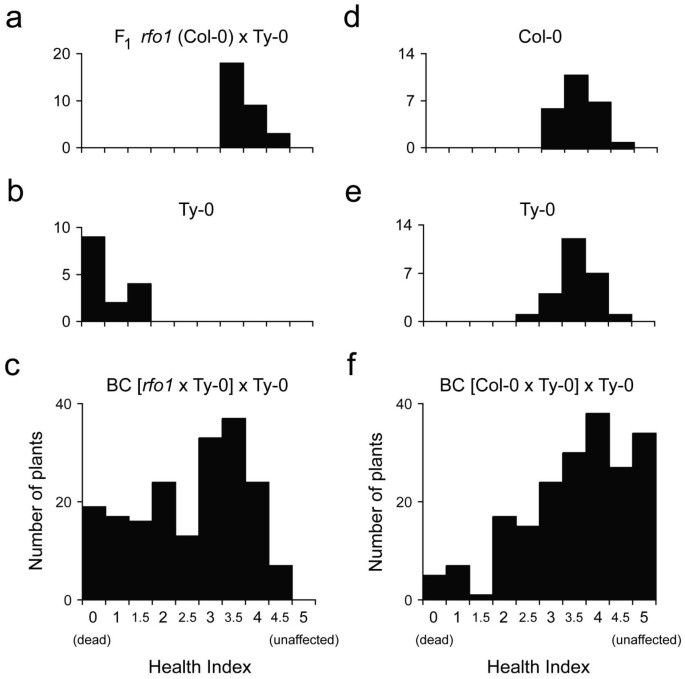
在对FOM抗性的先前映射中,RFO1是六个中最重要的一个吗RFO位点在答:芥,RFO1是上位性的,或增强的抵抗,其他三个RFO位点(1].理论上讲,RFO1QTL可以代表一个基因,也可以代表多个基因。要欣赏At1g79670是否负责全部或部分归因于阻力RFO1QTL显示FOM抗性在一个新的BC上1包括人口rfo1,是Col-0遗传背景中T-DNA插入和缺失编码序列导致的At1g79670功能缺失等位基因[1,24].同样的交叉方案,产生原始的Col-0和Ty-0 (C-T) BC1人口,被用来产生新的rfo1和Ty-0 (r公元前- t)1人口除外rfo1取代野生型作为Col-0亲本:杂交rfo1Ty-0得到F1然后回交到Ty-0。在数量上的差异是新的抗性r-T和原始C-T居群将包括At1g79670的贡献。
在C-T群体中,对FOM的抗性在C-T群体中分离r-T群体为多基因性状,以BC为主1杂交种表现出的抗性介于亲本或亲本之间[1].枯萎病在F1杂交,Ty-0亲本和公元前190年1杂交体采用健康指数(HI)进行评估,HI是一个从0(死亡)到5(未受影响)的序数量表,详见方法。在感染后18天(dpi),广泛分布的HI评分记录了BC的抗病性的广度1杂交和大概抗性基因型的多样性(图1c).相反,父母始终表现出抵抗或敏感。大多数F1混合动力车(图1a)以及卑诗省的少数民族1混合动力车(图1c)仅表现出轻微症状(HI评分为> 3);而在另一个极端,大多数Ty-0型父母(60%,图1b)以及10%的BC1混血儿都死了(图1c).因此,BC之间的抗性分离1杂交与单基因遗传不一致,因为单个位点在回交中会产生1:1的分离比,即。一种像F1与Ty-0亲本一样易感。
40个CHR标记的全基因组连锁
为加快抗性定位,采用BC基因型方法学1混合动力车在开发时考虑到了效率和经济。在此之前,RFO利用分布在5条染色体上的24个SSLP标记的全基因组基因型在C-T群体中绘制qtl答:芥[1].然而,对一个BC中的一个SSLP进行基因分型1一个PCR样本的杂交是分析的瓶颈。例如,如果使用相同的24个SSLPs对190个fom感染的BC进行基因分型1混合动力车r-T人群,这项工作将需要处理不少于4560个PCR样本。相反,如方法中所述,每个BC中40个标记位点的全基因组基因型1仅从三个多重PCR样本中获得杂交。与SSLPs基因分型相比,新方法给出了BC的全基因组基因型1由三分之二多的标记组成的杂交,在八分之一的PCR样本中获得。
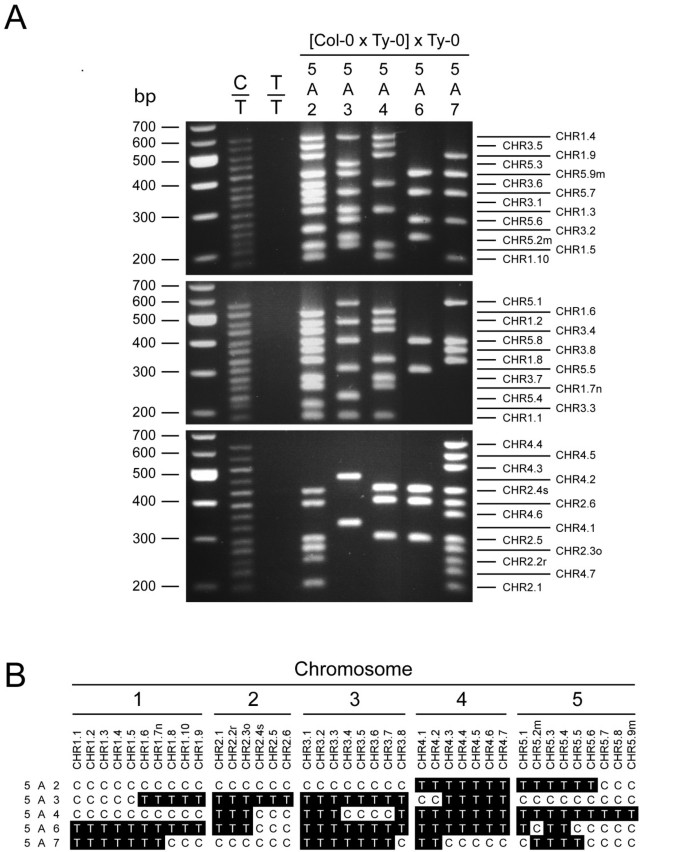
40个CHR标记的表型占主导地位,CHR标记的引物对直接从Col-0 DNA进行PCR扩增,而不是从Ty-0 DNA进行扩增(图2a).在单个多重PCR样本中扩增多达14个标记对应的DNA产物,然后使用标准琼脂糖凝胶电泳按大小分离,如5个具有代表性的BC的3个多重PCR样本所示1图中的混合2a.因为BC1杂交株在任意位点均为Col-0/Ty-0 (C/T)或Ty-0/Ty-0 (T/T),分别根据pcr扩增标记DNA是否存在(C)或缺失(T)进行基因型评分(图)2b)。
用CHR标记进行全基因组基因分型。(一)采用琼脂糖凝胶电泳对40个col -0特异优势标记的多重PCR产物进行大小分离,并用溴化乙锭染色。DNA阶梯(最左边的通道)的碱基对(bp)大小在左边。从Col-0和Ty-0 F中pcr扩增标记DNA1混合(C/T),加入Ty-0 (T/T)和C-T BC1混合动力车,5A2, 5A3, 5A4, 5A6和5A7。右边的线表示标记带的预期位置。标记被命名为CHRx.n,在那里x染色体和n是染色体上的相对位置。(b)公元前5年标记物的基因型1杂交来自于表型的结合(一).标记是按照它们在染色体上的位置排列的。基因型C/T (C)为黑上白型,基因型T/T (T)为黑上白型。
两者CHR标记间的遗传连锁rt和C-T居群与标记序列的邻近性和顺序一致拟南芥参考基因组(版本TAIR10,http://www.arabidopsis.org).中重组频率对应的全基因组遗传图谱r-T和C-T填充显示在附加文件中1:图S1和附加文件2:图S2。在r-T群体中,标记间隔的平均、中位数和总基因组距离分别为15.8、12.9和551 cM,个体标记间隔的范围为4.8 ~ 27.1 cM。(见附加文件)3.各区间的重组频率和遗传距离见表S1)。在原始C-T群体中,39个显性标记和1个SSLP标记(取代链接的CHR2.4标记)的平均、中位数和总基因组距离分别为14.1 cM、14.5 cM和516 cM(见附加文件)4:各区间的重组频率和遗传距离见表S2)。
CHR标记物的可靠性
有人担心显性CHR标记不如共显性SSLP标记可靠。标记DNA的缺失是基因型T/T的表型,可能是C/T基因型Col-0 DNA PCR扩增不足导致的假阴性结果,这种情况下C/T基因型会被误称为T/T。另一方面,共显性SSLPs可以防止假阴性误报,因为标记引物在所有样品中指导Ty-0 DNA的扩增,证实PCR是有效的。
在C-T人群中比较SSLPs和CHR标记的结果。正如预期的那样,SSLP标记的一半基因型(50.4%,标准差为3.4%)和CHR标记的一半基因型(50.9%,标准差为3.0%)都是T/T,因此无论是共显性SSLP还是col -0特异性CHR标记都不容易产生过量的T/T。
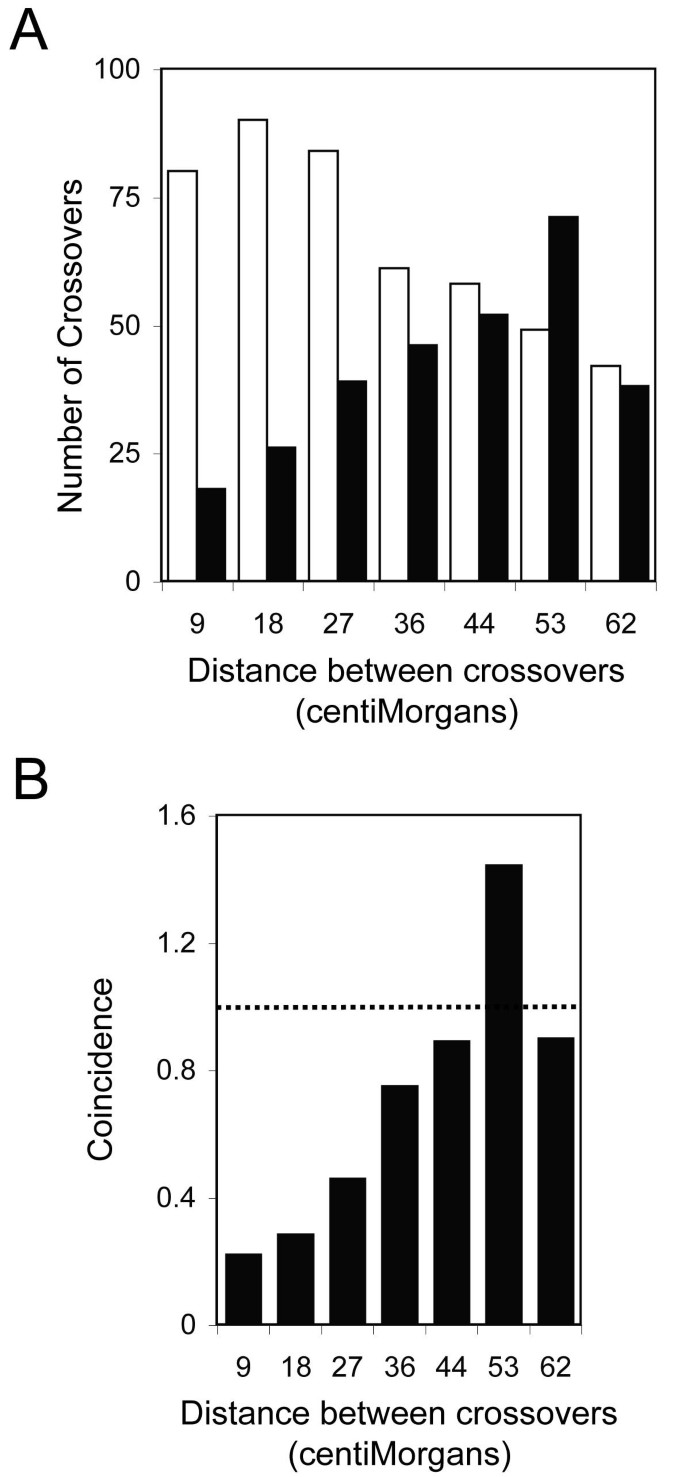
通过在C-T群体中结合39个显性标记和24个SSLP标记的基因型的数据集中检查重组,进一步审查了显性标记的可靠性。错误的标记基因型会夸大相邻标记区间的交叉实例数,因为紧密连接的标记通常共享相同的基因型。在分隔63个标记的区间内,平均重组频率为8.7%,因此在公元前234年,相邻区间对预计只会发生一到两次交叉事件1混合动力车。在大多数情况下,一个被错误命名的基因型会被具有相反基因型的标记所包围,从而出现假交叉的间隔。然而,合并后的标记数据集并没有过多的相邻双交叉,而是明显缺乏相连的双交叉(图2)3.a).由相邻区间内重组频率的乘积和预测出共80次双交叉,而相邻区间内的交叉仅观察到18次。重要的是,双杂交的显性标记(10)和SSLPs(8)所占比例相似。因此,显性标记并不比SSLPs更有可能具有与两侧标记不同的基因型。此外,随着分离交叉的标记间隔数量的增加,两个间隔中的交叉数量预计会下降,而观察到的双交叉数量随着交叉事件的分离而增加(图3.一个)。
交叉干扰
用交叉干扰解释了联交的不足答:芥[25].重合是交叉干扰的一种度量方法,定义为在两个标记区间内观测到的交叉频率除以相同区间内重组频率的乘积[26].正干扰具有小于1的符合值,表明在一个区间内的交叉抑制了在另一个区间内的交叉。在图3.b,当交叉距离小于36 cM时,观察到正干扰。符合值接近1或大于1分别表示无干扰或负干扰。过渡的负干扰,这是一个常见的观测正值干扰存在,是明显的交叉时,分离约53厘米,在图中3.b (26].此外,在所有BC中都观察到明显的连系双交叉缺陷1这里检查了种群。在相邻标记间隔中,只有19%到33%的预期双交叉实际上在这5个国家中被观察到拟南芥染色体。(关于预期和观察到的双交叉的染色体分布,请参见附加文件5:表S3)
没有RFO1QTL不含At1g79670
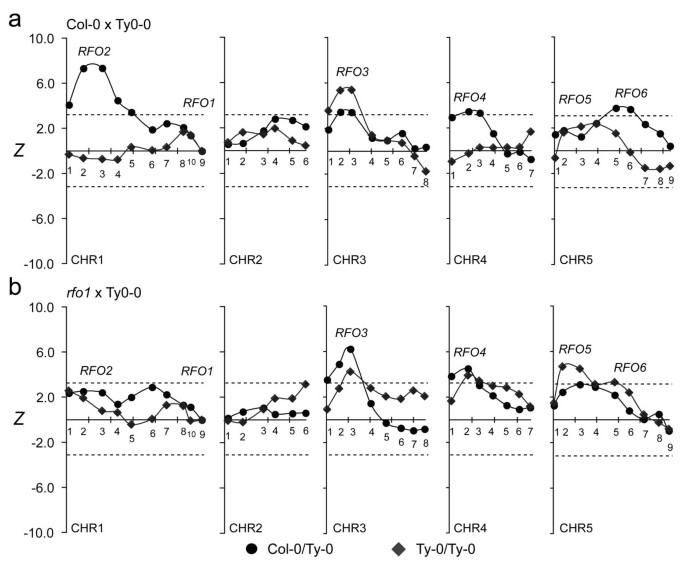
在r-T人群,使用Mann-Whitney秩和检验评估CHR标记物的耐药性相关性,如先前在[1].简单地说,公元前1混合动力车r-T人群根据HI得分从最易感到最耐药进行排名。在每个标记处,都有一个标准化的统计数据Z列举了公元前的军衔划分1C/T和T/T杂交,的符号和大小Z表明了遗传关联的方向和强度。抗性与C/T基因型有显著相关Z大于3.3,与T/T何时Z小于-3.3(什么时候p排列试验结果< 0.05)。
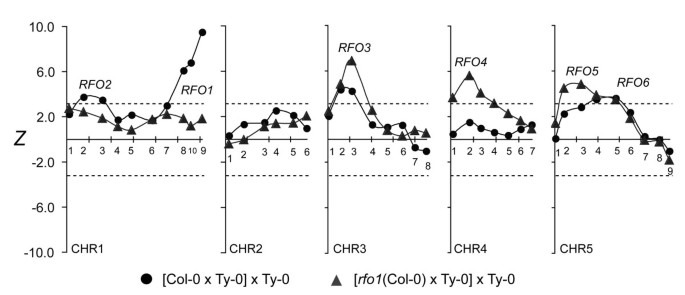
在r-T群体在1号染色体上均未检测到起主要作用的QTLRFO1而且RFO2位于1号染色体上,对C-T群体的耐药性做出了重大贡献(图4) [1].在r-T群体,抗性与Col-0等位基因的相关性RFO1- - -RFO2-链接标记CHR1.9和CHR1.3均无统计学意义(图4).因此,rfo1废除了重大的贡献RFO1而且RFO2.在C-T群体中,RFO2与C/T含量高的植物的抗性密切相关RFO1在T/T的植物中不存在(图5) (1].在r- t的人口,RFO2-连锁标记与BC抗性无显著相关性1杂交种C/T或T/T为RFO1(图5b)。
RFO1 -条件抵抗FOM。感染fom的亚群(一)C-T和(b)r- t公元前1人口数量取决于是否BC1混合动力车继承RFO1-C(C/T,圆形)或不是(T/T,菱形)。参见图4用于描述情节细节。
rfo1也抑制了明显的相互作用RFO1或者(CHR5.6-linked)RFO6或(CHR4.2-linked)RFO4.从之前的工作来看,耐药性与5号染色体上的两个位点有关:RFO5产生独立的阻力RFO1而RFO6只在公元前明显1同样是C/T的杂交RFO1(图5) (1].在r-T群体,CHR5.6与BC抗性无显著相关性1有或没有混血儿RFO1-C(图5b).同样,两者之间的明显相互作用RFO1和(CHR4.2-linked)RFO4不明显的r-T群体,而在RFO4在C-T群体中,只有在同样具有C-T的植物中才明显RFO1-C(图5) (1].在r-T群体中,标记CHR4.2与一个主要QTL相关,与基因型无关RFO1(图5b)。
如前所述,RFO3而且RFO5表达独立的抵抗RFO1[1].事实上,RFO3而且RFO5与耐药有较强的相关性r-T群体比C-T群体的-比较峰值Z值在RFO3 -链接(CHR3.3)和RFO5-linked (CHR5.34.不包括RFO3,RFO4而且RFO5,与FOM抗性无其他显著相关性。
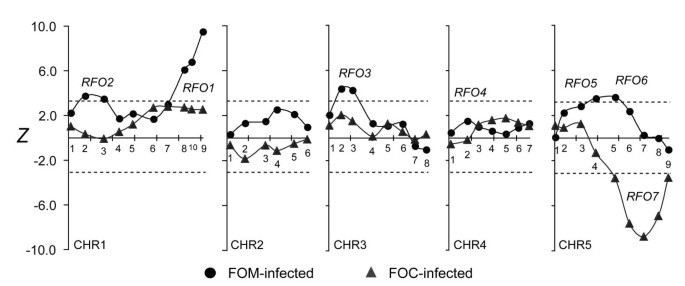
RFOqtl是病原体特异性的
检查是否相同或不同RFO基因座提供了不同的抗性病圃病原体,耐药性在公元前第三年进行了调查1而是被FOC1感染的人群。200例foc1感染BC的HI评分1图中所示为16 dpi的杂交种和两个亲本配种Col-0和Ty-01分别是D e f。两个亲本都表现出对FOC1的部分抗性,HI得分中位数为3.5(图2)1d, e)1与父母相比,混血儿表现出更广泛的症状严重程度(图1f): BC的17%1杂交种不受影响(HI = 5.0),而所有亲本至少表现出轻微症状;以及公元前的15%1杂种表现出比亲本任何一方更严重的症状(HI < 2.0)。因此,三分之一的foc1感染BC1杂交种表现出一种在亲本中均未见的极端表型。
RFO7对FOC1具有抗性
从foc1感染C-T群体中CHR标记物之间的重组频率获得的全基因组遗传图谱与TAIR10参考基因组中的标记物序列顺序一致(见附加文件)6:全基因组遗传图谱(图S3)。标记之间的间隔范围为4.0 ~ 24.9 cM,平均、中位数和总基因组距离分别为13.5、12.8和472 cM7:各标记区间的重组频率和遗传距离见表S4)。
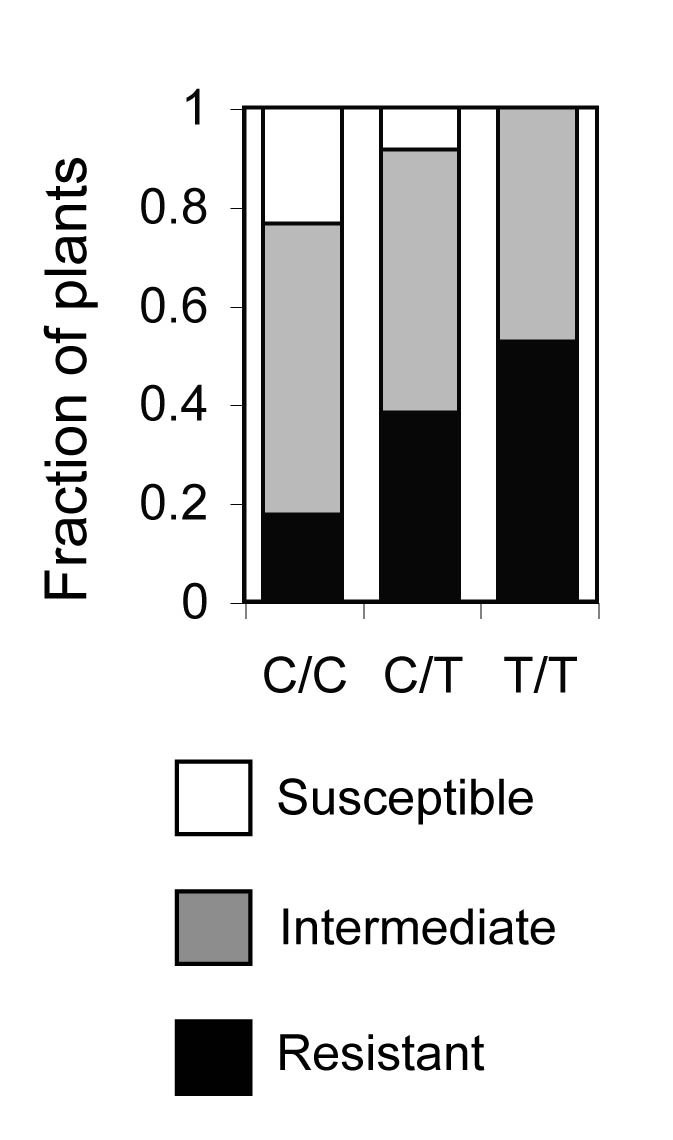
在40个CHR标记物上评估与FOC1耐药性的相关性。为了便于比较,Z图中并列了foc1感染C-T和fof感染C-T群体中标记物的统计数据6.在标记CHR5.7处的单一主要效应QTL (Z= -8.77)相关基因型T/T对FOC1抗性较强。因为之前所有的RFO与C/T基因型耐药相关的QTL和CHR5.7以前没有与耐药相关的QTL,该QTL是新的,并被命名RFO7.在F2Col-0和Ty-0的后代,基因型为C/CRFO7与C/T基因型相比,-链接的SSLP CIW9对FOC1更敏感,表明C/T基因型的Col-0和Ty-0等位基因对FOC1更敏感RFO7表示不完全支配(图7).
与FOC1耐药有关。在fom感染(圆形)和foc1感染(三角形)的C-T群体中,检验统计量Z列举抗性与标记基因型的相关性,并用线连接链接值。参见图4用于描述情节细节。
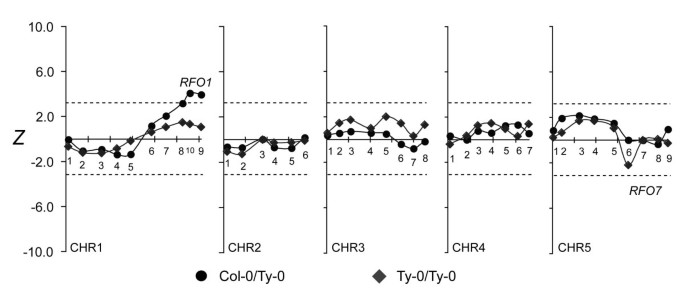
在此之前,RFO1显示对FOC1和FOM具有抗性[1].在foc1感染的C-T人群中,耐药性与RFO1 -连接CHR1.9的意义值得怀疑(Z= 2.54,p= 0.28)。然而,在BC中1在CHR5.7处杂合子(C/T)的杂种减少了RFO7,抗性与RFO1有显著性(图8).
RFO7-条件抗性FOC1。foc1感染C-T BC的亚群1人口数量取决于是否BC1混合动力车继承RFO7-C(C/T,圆形)或不是(T/T,菱形)。参见图4用于描述情节细节。
讨论
可以想象,不止一个基因可能负责基因的不同方面RFO1QTL。然而,QTL分析包括rfo1与最简单的解释是一致的:一个基因对RFO1也有明显的相互作用RFO2,RFO4而且RFO6.RFO2而且RFO6都没有被发现r-T种群,抗性RFO4,它依赖于RFO1-C在C-T人群中,是独立的RFO1在r人口- t。
为什么RFO4,它只有在RFO1-C在C-T群体中是一个主要的QTLr-T总体缺失RFO1-C很难解释。的表达式RFO4受到枯萎病进展的细微差异或环境因素的影响,如C-T和r-T人群在不同的场合感染相似的病毒。此外,名义上来自相同的Col-0和Ty-0的亲本,可能在遗传上(或表观遗传上)不相似,因为不同的杂交产生了两个种群。
总的来说,从独立的fof -感染人群中获得的结果是一致的,新研究中的qtlr-T总体与之前检测到的一致RFO3,RFO4而且RFO5在C-T种群中。事实上,3个qtl的抗性相关性在水稻中表现得更强r人口- t。作为抗性来源的Col-0在感染FOM时很少表现出枯萎症状,并且可能表现出超过足够的抗性。由于症状严重程度难以区分较耐药植物,损失RFO1-C在r-T人群无疑改善了BC的疾病评估1杂交,从而检测RFO法。
在FOC1和fof感染人群中检测到的qtl的位置和来源表明对FOC1和fof感染人群的数量抗性病圃主要是针对感染的特殊形式。值得注意的是,对FOC1的抗性与一个新的QTL密切相关,RFO7尽管Col-0和Ty-0对FOC1表达了相似的部分抗性。除了RFO7, 1号染色体上的一个区域与耐药性有边际关联RFO1-链接标记在BC1杂合子为RFO7.然而,之前的研究清楚地表明rfo1和转基因RFO1影响对FOC1和FOM的抗性。因此,虽然RFO1可能对三种十字花科感染有非特异性的抵抗作用formae特殊,看来RFO1对FOM的抵抗力也有更强、更具体的影响。
只有来自供体父母的显性性状在BC中表达1人口,所以RFOCol-0的等位基因对Ty-0的等位基因是隐性的,不能检测到。然而,F1杂化,Col-0/Ty-0和rfo1/Ty-0表示对病圃在很大程度上是一种显性特征。与此相关的抗性RFO7在F中得到证实2子代和位置克隆已经确定了负责三个的单个基因RFO法,RFO1,RFO2而且RFO3[1,23,27].四个已经确认的RFO位点,三个qtl,RFO1,RFO3而且RFO7,表示不完全支配。
抗性和易感等位基因的核苷酸序列RFO1,RFO2而且RFO3编码明显功能,全长横跨膜的受体蛋白。因此,两个等位基因之间的竞争或产物的干扰,而不是抗性Col-0等位基因的基因剂量,可能解释了天然的不完全优势RFO等位基因。因为RLKs和RLP之间的物理相互作用对植物的信号传递至关重要[28],基因间的相互作用RFO1而且RFO2可能是相应的RFO1 RLK和RFO2 RLP直接相互作用的证据。然而,由于耐药是一种复杂的表型,涉及发生在宿主不同部位和感染周期不同时间的过程,观察到的遗传相互作用可能揭示耐药的优先级RFO1之前RFO2没有直接的互动。此外,当抗性和易感等位基因都不是零等位基因时,遗传相互作用的解释是模糊的。例如,结果与rfo1清楚地表明RFO1-C在RFO1-RFO2然而,互动,仍然不清楚是否RFO1-C抑制抗性RFO2-T或增强抵抗力RFO2-C。
的QTL常规分析答:芥局限于区分现有国际扶轮群体的父母的自然特征;否则,新RI线的生成需要大量的时间和精力投入[4,5].与此同时,全基因组序列的可用性越来越高,例如,从1001个基因组计划开始,这使得序列多样性达到数百个拟南芥登记入册。如图所示,使用BC可以在6个月内构思并完成区分任何两个已测序品系(包括突变基因型)的性状映射1人群。
BC的映射1如果基因分型是有效的、可获得的和经济的,种群可以成为常规程序。在这方面,1001个基因组计划中可用的全基因组序列是识别附加特异性多态性的宝贵资源[29].Col-0特异性显性标记的引物序列很容易从Col-0和Ty-0的基因组序列中选择,据报道这些序列在Col-0和Ty-0中具有多态性。以同样的方式,显性标记可以被设计来区分任何两个已序列的附加。事实上,我们已经重复使用了大多数col -0特异性标记进行BC基因分型1来自Col-0和Zdr-1或Kondara杂交的群体(未发表的观察)。
基因分型方法的设计考虑了效率和经济性。从粗叶制备开始,仅用3组多重PCR引物扩增40个显性标记的多重PCR DNA,并使用标准琼脂糖凝胶电泳进行显像。200个感染foc1的BC1用略多于6个96孔PCR样本板对杂交株进行全基因组基因分型。多重PCR样本中的标记在琼脂糖凝胶中呈阶梯状条带,当所有标记都存在时。由于标记引物的退火区分了Col-0和Ty-0基因型,标记可以任意分配序列长度,在琼脂糖凝胶中显示为规则间隔的条带。
使用显性标记获得的结果与共显性SSLP标记获得的结果一样可靠[1].在多重PCR中,当多达14对引物组合在一起时,不会扩增出不可预见的PCR产物,并且没有单独确认的引物对与其他引物组合在一起时失败。
理论上,国际扶轮人口的杂交数量大约是BC的两倍1人口(30.].然而,除非高密度DNA标记用于RI系的基因分型,否则RI系中的额外重组在很大程度上仍未得到重视[31].在产生RI系的近交周期中,杂交倾向于在连接位点上积累,因此RI系的重组具有负干扰的外观。98 Col-0/L中断点的高分辨率分析呃例如,RI系发现,17%的杂交间隔只包含一个基因[32].
用于BC全基因组连锁分析1种群中,40个等距标记足以捕获大多数重组。如前所述,在BC中只有一组同源染色体1杂交是重组。平均标记距离为15厘米,我估计在BC省只有7%的交叉没有被发现1种群,因为大约四分之三的预期双交叉在标记间隔将被正干扰抑制。此外,我利用了男性减数分裂中明显更高的重组(与女性减数分裂相比)答:芥在生成BC时1混合动力汽车(33: Ty-0为回交母本,F -0为回交母本1杂种是重组染色体的来源,是父本。
交叉的数量或重组的数量与单个QTL是否被检测到关系不大[4,13].相反,重组频率影响一个QTL图谱位置的分辨率,重组频率越低,染色体上靠近的多个QTL的分辨率越低。如果尚未解决的基因座对一个性状表达相反的影响,那么两个或多个连锁基因座的检测可能会被抑制。事实上,在Col-0/L中已经报道了生长速率在210 kbp区间内两个相反的qtl呃重组(34].
QTL定位只是识别和表征潜在性状基因的第一步。在这方面,BC中的映射1群体也是有利的,因为个体(或特定的组合)qtl可以立即在自育BC的后代中重新评估和精细映射1混合动力车。即使经过了可能致命的测试,比如对FOM的抗性,我也能从236个测试的C-T BC中收集到144个种子1混合动力车。尽管有一半的基因组在公元前1杂交是杂合的,平均来说,种子收集于公元前16年1Ty-0在4个或更少的染色体间隔(占基因组的30%或更少)上基本纯合和杂合的杂交。RFO在这些杂合区间的qtl将在子代中再次分离。
结论
在BC中定量测定枯萎病抗性的全基因组图谱是快速和可复制的1重组种群答:芥.在两个独立的公元前1群体对FOM的抗性与qtl相关RFO3,RFO4而且RFO5.因为RFO1,RFO2而且RFO6在公元前是不存在的1包括人口rfo1的主要作用和上位相互作用RFO1仅归因于At1g79670,在rfo1.公元前三世纪1人群中,对第二种病原体FOC1的耐药性反而与RFO7,一个新的主要效应QTL。Pathogen-specificRFOqtl在很大程度上对FOM和FOC1两种病原体的抗性起作用。
方法
日益增长的答:芥
Ty-0种子(CS6768)和rfo1(Salk_077975)来源于拟南芥生物资源中心。种子用10%家用漂白剂和0.1% Triton X-100表面消毒15分钟,用无菌水冲洗3次。种子在移栽前播撒在泥炭颗粒上(Jiffy-730, Grower 's Solution Inc., Cookeville, TN)或首先在植物营养琼脂(PNA)上发芽[1].植物以平面(1 ' × 2 ')排列,5行,10列,并指定:第一行(1到6),第二行(A到E),第三列(1到10)。在中等强度(100 ~ 140 μmol m)的冷白色荧光灯下生长-2证券交易委员会-1),在25至28°C的温度下,每天12小时,用水或化肥灌溉(PlugCarePlus, Greencare Fertilizers, Inc., Kankakee, IL)。
感染病圃
尖孢镰刀菌福马特殊形而上学conglutinans种族1 (FOC1,分离物777)和尖孢镰刀菌福马特殊形而上学matthioli(FOM,分离物726)来自P.H.威廉姆斯,通过H.C.基斯特勒[3.,35].病圃培养物在-80°C保存于50%甘油中,在Czapek Dox培养基上生长(Oxoid Ltd.,汉普郡,英格兰),并按照[1].从200 C-T BC的3周树龄植株开始125株大小相近的Col-0和Ty-0植株被FOC1侵染;190年,r- t公元前1, 25rfo115株Ty-0植株感染FOM。用过量的洗净分生孢子(2 × 106分生孢子毫升-1).的FOM-infectedr-T人群在感染后11天(dpi)对三种早期症状进行评分:(i)叶片发育迟缓,(ii)叶片上翘和(iii)花青素积累,使用1(严重)到4(未受影响)的分级量表。在第18和23 dpi时,用健康指数(HI)对受感染的植物进行评分,该指数与[1],范围从0(死亡植物)到5(未受影响的植物),间隔为0.5。foc1感染的C-T人群在10、13和16 dpi进行了相似的评分。在最后的时间点,植物被排序:对于感染foc1的C-T群体,40株植物的每一株都被单独排列,从1(最敏感)到40(最耐药);还有感染了fomm病毒的人r-T BC群体,所有190株植物一起排名,从1(最敏感)到190(最抗)。fom感染的C-T BC人群的感染和评分描述在[1].(见附加文件)8:用于包含所有三个BC表型数据的电子表格1人口)。
CHR标记基因分型
拟南芥信息资源(TAIR)中染色体的物理长度和遗传长度的比例http://www.arabidopsis.org), 10、6、8、7和9 CHR标记分别分布在染色体1、2、3、4和5上。在每条染色体上,在端粒附近放置两个标记,其余标记的核苷酸位置在TAIR10的参考Col-0序列中按规则间隔排列。
在标记的核苷酸近似位置,标记序列为Ty-0全基因组测序中高度分化或“未测序”的参考序列(http://signal.salk.edu/atg1001).根据QIAGEN公司Multiplex PCR手册(QIAGEN Inc., Valencia, CA)的建议,使用Primer3Plus软件在高度发散的参考序列中选择适当的引物序列对[36].用3组PCR引物同时扩增13、13或14个标记的DNA产物。每组多重PCR引物均设计成DNA产物大小的对数级数,长度从200 bp到650 bp不等,这使得琼脂糖凝胶电泳分离产物时,标记条带的间距有规律。引物序列和基因组位置在附加文件中9:表S5。每组引物的DNA产物的大小和顺序在附加文件中10:表S6。采用QIAGEN Multiplex PCR试剂盒,按照微卫星位点方案进行PCR扩增。5 μL的反应量包括1 μL粗叶DNA制剂、2.5 μL 2× QIAGEN Master Mix、1 μL 10×引物混合物(每种寡核苷酸引物各含2 μM)和1.5 μL水。PCR扩增产物经2%琼脂糖凝胶电泳分离。粗叶片DNA制剂按[37].参见附加文件8:用于所有BC省所有标记的基因型数据的电子表格1人群。简单序列长度多态性(SSLP) C4H的基因型数据,来自先前的研究[1],在fom感染C-T人群的分析中取代了CHR2.4s。
利用Kosambi作图函数计算标记之间的遗传距离[13].遗传联系支持了三个公元前标记的假定的物理联系1人群。附加文件中提供了三个映射种群中标记的链接数据3.:表S1,附加文件4:表S2和附加文件7:表S4。
检测抗枯萎病相关性
一个公元前1人口n植物按HI分数排序,从1(最易感)到n(最耐药)。在排名中,较晚的HI分数优先于较早的HI分数。比较两种可能基因型C/T和T/T的秩分布,采用Mann-Whitney (M-W)检验,其结果以标准化统计量表示(Z),为分离两种基因型平均rank的标准差单位。(见附加文件)11:表S7,取值为Z在公元前3年的CHR标记上1人口)。对于一个主要效应QTL,阈值为Z公元前三世纪1通过10,000次试验的置换试验确定种群[18].从分布上看最高Z在试验值中,阈值为Z在p= 0.01 (Z0.01)为3.86;而且,Z0.05是3.36;而且,Z0.20是2.80。在r -T人口,Z0.01= 3.73;而且,Z0.05= 3.27;而且,Z0.20= 2.77。在foc1感染的C-T人群中,Z0.01= 3.63;而且,Z0.05= 3.16;而且,Z0.20= 2.68。概率阈值Z还确定了一个主要QTL的基因型条件QTL [20.].对于foc1感染的C-T群体,对基因型为T/T (Z0.01= 3.54;而且,Z0.05= 3.10;而且,Z0.20= 2.67)或C/T (Z0.01= 3.51;而且,Z0.05= 3.08;而且,Z0.20= 2.63) atRFO7有关CHR5.7。对于fof感染的植物,测试了T/T (For fof)的亚群体r- t的人口,Z0.01= 3.56;而且,Z0.05= 3.13;而且,Z0.20= 2.67;对于C-T总体,Z0.01= 3.55;而且,Z0.05= 3.12;而且,Z0.20= 2.66)或C/T(用于r- t的人口,Z0.01= 3.52;而且,Z0.05= 3.12;而且,Z0.20= 2.64;对于C-T总体,Z0.01= 3.88;而且,Z0.05= 3.34;而且,Z0.20= 2.81) atRFO1有关CHR1.9。
参考文献
- 1.
Diener AC, Ausubel FM:对镰孢镰刀菌1的抗性是拟南芥的显性抗病基因,不具有种族特异性。中国生物医学工程学报,2005,27(3):344 - 344。10.1534 / genetics.105.042218。
- 2.
杨晓明,李晓明,李晓明。拟南芥模式植物的研究进展。植物学报,2010,29(3):344 - 344。10.1111 / j.1365 - 313 x.2009.04086.x。
- 3.
Bosland PW, Williams PH:基于致病性同工酶多态性、营养相容性和地理来源对十字花科植物枯萎菌的评价。[J] .计算机工程学报,1997,33(4):357 - 357。10.1139 / b87 - 282。
- 4.
Tanksley SD:多基因映射。中国科学(d辑),1998,27(4):344 - 344。10.1146 / annurev.ge.27.120193.001225。
- 5.
Keurentjesa JJB, Willems G, van Eeuwijk F, Nordborg M, Koornneef M:拟南芥QTL定位的群体类型比较。植物资源学报,2011,29(3):366 - 366。10.1017 / S1479262111000086。
- 6.
Kover PX, Mott R:拟南芥生态和进化相关性状的遗传基础。植物学报,2012,15:212-217。10.1016 / j.pbi.2012.02.002。
- 7.
Nordborg M, Weigel D:植物下一代遗传学。自然科学进展,2008,38(4):344 - 344。10.1038 / nature07629。
- 8.
Weigel D, Mott R:拟南芥1001个基因组计划。中国生物工程学报,2009,10:107-10.1186/gb。
- 9.
自然科学学报,2010,38(4):344 - 344。10.1038 / nature08800。
- 10.
Chao DY, Silva A, Baxter I, Huang YS, Nordborg M, Danku J, Lahner B, Yakubova E, Salt DE:重金属ATPase3是拟南芥叶片镉自然变异的主要决定因素。公共科学学报,2012,8:e1002923-10.1371/journal.pgen.1002923。
- 11.
Visscher PM, Brown MA, McCarthy MI, Yang J: GWAS发现五年。王志强,王志强,2012,30(1):1 - 7。10.1016 / j.ajhg.2011.11.029。
- 12.
胡晓明,李文杰,王晓明,等。拟南芥遗传变异的研究进展。中国植物学报,2004,29(3):344 - 344。10.1146 / annurev.arplant.55.031903.141605。
- 13.
Alonso-Blanco C, Koornneef M, van Ooijen JW, Salinas J, Sanchez-Serrano JJ: QTL分析。分子生物学方法。锡考克斯,新泽西州:施普林格协议;2006:79 - 99。
- 14.
Cavanagh C, Morell M, Mackay I, Powell W:从突变到MAGIC:作物植物基因发现、验证和传递的资源。植物学报,2008,11:215-221。10.1016 / j.pbi.2008.01.002。
- 15.
O'Neill CM, Morgan C, Kirby J, Tschoep H, Deng PX, Brennan M, Rosas U, Fraser F, Hall C, Gill S, Bancroft I:拟南芥数量性状研究的6个重组自交系新群体。应用物理学报,2008,29(3):344 - 344。10.1007 / s00122 - 007 - 0696 - 9。
- 16.
Simon M, Loudet O, Durand S, Bérard A, Brunel D, Sennesal F-X, Durand- tardif M, Pelletier G, Camilleri C:拟南芥5个大型重组自交系群体的数量性状位点定位。中国生物医学工程学报,2008,38(4):344 - 344。10.1534 / genetics.107.083899。
- 17.
Seymour DK, Filiault DL, Henry IM, Monson-Miller J, Ravi M, Pang A, Comai L, Chan SW, Maloof JN:拟南芥双单倍体系的快速建立及其定量性状位点定位。美国国家科学研究院。2012, 39(4): 457 - 457。10.1073 / pnas.1117277109。
- 18.
邱吉尔,杜奇,罗伟林:定量性状映射的经验阈值。遗传学报,1994,38(3):344 - 344。
- 19.
Kruglyak L, Lander ES:一种映射数量性状位点的非参数方法。中国生物医学工程学报,2003,19(4):344 - 344。
- 20.
Doerge RW, Churchill GA:影响数量性状的多个位点的排列试验。中国生物医学工程学报,1998,29(4):344 - 344。
- 21.
F医院:回交方案的选择。中国生物医学工程学报,2005,30(3):344 - 344。10.1098 / rstb.2005.1670。
- 22.
Kuittinen H, Sillanpaa MJ, Savolainen O:拟南芥适应的遗传基础:开花时间。应用理论,1997,95:573-583。10.1007 / s001220050598。
- 23.
沈杨,Diener AC:拟南芥对镰刀菌2的抗性与酪氨酸-硫肽信号通路在根感染易感性和抗性中的作用。公共科学学报,2013,9:e1003525-10.1371/journal.pgen.1003525。
- 24.
Leisse TJ,阿隆索JM,斯金CJ,陈H,希恩P,史蒂文森DK,齐默尔曼J,巴拉哈斯P, Cheuk R, Gadrinab C,海勒C, Jeske, Koesema E,迈耶斯CC,帕克H, Prednis L,安萨里Y,白菜N,迪恩H, Geralt M, Hazari N, Hom E,圆锥形石垒,穆赫兰C, Ndubaku R,施密特,古兹曼P, Aguilar-Henonin L,施密德M,魏盖尔D,卡特德玛珊德T, Risseeuw E, Brogden D,泽柯,克罗斯比西城,贝瑞CC,艾克尔JR:拟南芥全基因组插入突变。科学通报,2003,30(3):344 - 344。10.1126 / science.1086391。
- 25.
哥本哈根GP, Housworth EA, Stahl FW:拟南芥的交叉干扰。遗传学杂志,2002,160:1631-1639。
- 26.
Mezard C, Vignard J, Drouaud J, Mercier R:跨界之路:植物有发言权。植物学报,2007,23:91-99。10.1016 / j.tig.2006.12.007。
- 27.
杨志强,李志强,李志强,等:植物对枯萎病的定量抗性与受体激酶基因的多样性有关。matthioli。中国农业科学,2013,30(3):344 - 344。10.1111 / nph.12368。
- 28.
Lee JS, Kuroha T, Hnilova M, Khatayevich D, Kanaoka MM, McAbee JM, Sarikaya M, Tamerler C, Torii KU:配体-受体对对气孔模式的直接相互作用。基因开发,2012,26:126-136。10.1101 / gad.179895.111。
- 29.
Ossowski S, Schneeberger K, Clark RM, Lanz C, Warthmann N, Weigel D:拟南芥天然菌株的短读序列分析。基因组学报,2008,18:2024-2033。10.1101 / gr.080200.108。
- 30.
Burr B, Burr FA:用于玉米分子定位的重组自交系:理论和实践考虑。植物学报,1999,7:55-60。
- 31.
重组自交系的基因组。中国生物医学工程学报,2005,29(3):344 - 344。10.1534 / genetics.104.035212。
- 32.
Singer T, Fan Y, Chang HS, Zhu T, Hazen SP, Briggs SP:拟南芥重组自交系全基因组外显子阵列杂交的高分辨率图谱。公共科学学报,2006,2:e144-10.1371/journal.pgen.0020144。
- 33.
Drouaud J, Mercier R, Chelysheva L, Bérard A, Falque M, Martin O, Zanni V, Brunel D, Mézard C:拟南芥4号染色体的性别特异性交叉分布及干扰水平变化。公共科学学报,2007,3:1096-1107。
- 34.
王志刚,王志刚,王志刚:遗传互作和平衡多态性对复杂性状变异的影响。自然科学学报,2005,34(3):344 - 344。10.1038 / nature03480。
- 35.
王志强,王志强,王志强,王志强:镰孢镰刀菌株间亲缘关系分析。植物病理学杂志,2001,31(3):331-336。10.1094 /发朵- 81 - 331。
- 36.
Untergasser A, Nijveen H, Rao X, Bisseling T, Geurts R, Leunissen JA: Primer3Plus, Primer3的增强web界面。中国生物医学工程,2007,35:W71-W74。10.1093 / nar / gkm306。
- 37.
杨晓明,张晓明,张晓明,等。拟南芥侧根形成途径的研究。中国生物医学工程学报,2004,29(4):344 - 344。10.1101 / gad.9.17.2131。
确认
我感谢K. Hirschi, J. Merriam和F. Laski阅读了手稿的草稿。我非常感谢加州大学洛杉矶分校生命科学学院院长提供的研究资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他没有竞争利益。
电子辅助材料
BC的基因型和表型
附加文件8:1三种混合动力车病圃来华的人群。(xl712kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取的文章,根据创作共用署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Diener, A.C. BC省镰刀枯萎病抗性的常规图谱1的数量拟南芥.BMC植物生物学13日,171(2013)。https://doi.org/10.1186/1471-2229-13-171
收到了:
接受:
发表:
关键字
- 拟南芥
- 尖孢镰刀菌
- 定量抗病性
- QTL定位
- 交叉干扰