摘要
背景
与二倍体相比,基因组加倍可能对多倍体的形态、活力和生理产生多层次的影响。我们研究了属于该属的两个体细胞新诱导多倍体系统,即二倍体-自体四倍体和三倍体-自体六倍体的自多倍体发生的相关变化Hylocereus(仙人掌科)。对气孔、果实、种子、胚和花粉进行了研究。使用建立的气相色谱-质谱(GC-MS)和超高效液相色谱(UPLC) Q-TOF-MS/MS(飞行时间)协议对果肉和种子进行代谢物分析。
结果
同源多倍体系产生的四分体数量较少,花粉粒较大,活力较低,气孔较大,密度较低,果实较小,种子数量较少,活力较低。果实和种子中糖的丰度低于供体,氨基酸、三羧酸(TCA)循环中间产物、有机酸和类黄酮含量增加。二倍体和三倍体供体的主要果实色素β花青素在基因组加倍后下降。两个同源多倍体Hylocereus因此,株系表现出不利的变化,同六倍体的结果比同四倍体的结果更明显。
结论
诱导的同种四倍体和同种六倍体株系表现出与其供体株系不同的形态学和细胞学特征,并伴有显著的代谢改变。有人认为,在同六倍体系的果实中发生了发育停滞,因为它们的果皮显示出更丰富的酸和还原糖。我们得出的结论是,基因组加倍并不一定会带来适应度优势,自多倍化诱导的改变程度取决于供体基因型的遗传背景。
背景
基因组复制是获得更多基因副本的主要机制之一,从而将遗传和进化的新颖性引入生物体[1,2].大多数开花植物的谱系反映了一轮或多轮的古代多倍体[3.,4].因此,多倍体被认为是一种适应机制,在植物物种形成中起着重要作用[5- - - - - -7].近一个世纪以来,植物研究人员对染色体组起源形成多倍体的机制表示了兴趣,重点关注这种过程在短期和长期的后果。8,9].天然和新形成的异源多倍体的研究拟南芥,芸苔属植物,甘氨酸,Gossypium,Tragopogon而且小麦属植物为异体多倍体化的基因组和遗传后果提供了重要的见解[10- - - - - -18].由于这种多倍体具有两个不同的基因组,可能是同源染色体——因此是杂交——而不是多倍体本身可以解释随之而来的形态学、生理和基因组修饰[19].与异体多倍体相比,在单一物种中出现并携带同源染色体的同源多倍体受到的科学关注较少,这可能是因为它们的形态往往与其二倍体祖先的形态相似,因此它们可能无法被明显识别[5,20.- - - - - -23].事实上,倍性本身的影响只能在体细胞染色体加倍后获得的同源多倍体中得到准确的研究——与供体植物的基因组剂量不同——而不能在杂交后代中得到准确的研究。
人工体细胞自多倍体可同时实现在活的有机体内而且在体外通过使用抗有丝分裂试剂,即中期抑制剂[24].这些方法涉及模拟自然系统,可用于合成具有改进性状的体细胞同源多倍体,例如,果实和花的大小更大,自相容性更好,抗胁迫能力更好,生物量和一些次生代谢产物含量增加等[24].研究表明,人工多倍体诱导的反应显著影响新形成的同源多倍体的形态和生理[25- - - - - -27].最近,Aversano等人。[28]报道了两个合成同源四倍体中甲基化途径的改变,尽管形态解剖分析没有显示复制供体系和二倍体供体系之间有任何明显差异,从而表明这些变化是随机的。由染色体重复引起的代谢改变仅在有限的研究中进行了研究,而且这些研究仅针对特定的次级代谢产物,例如黄酮醇和生物碱,因此“错过”了与自多倍化相关的整体代谢变化。在一些物种中,例如Chamomilla recutita,佩妮米切尔,丹参,青蒿,人参,每克组织中黄酮类化合物和萜类化合物的产量在多倍体中高于二倍体[29- - - - - -33].
鉴于自多倍体在植物进化和农业中的重要意义,以及对这一现象的研究不足,我们试图通过开发人工体细胞自多倍体来研究与基因组增殖相关的形态性状、细胞学变化和代谢改变。我们假设自多倍化会引起细胞学、形态学和代谢方面的变化,更具体地说,DNA含量与气孔、花粉和果实大小等形态学特征以及DNA含量与代谢物之间存在很强的正相关。
作为我们研究的模式植物,我们使用了半附生植物的种类Hylocereus(Berger)布里顿和玫瑰(仙人掌科)。由于这些物种具有水仙酸代谢,因此对极端干旱格外耐受,这一重要特性使它们成为旱地农业中的外来水果作物[34].两种供体植物的腋生营养芽,二倍体(2n= 2x = 22)种Hylocereus monacanthus和一个合成的同素三倍体(2n= 3x = 33),即S-75,用抗丝分裂试剂处理,产生人工同源多倍体4x和6x,分别如先前报告[35].
对这两个复制系及其相应的供体进行了细胞学和形态学研究。此外,通过气相色谱(GC)质谱(MS)和超高效液相色谱(UPLC) Q-TOF-MS/MS(飞行时间)分析,研究了果肉和种子的中枢代谢和靶向次生化合物的变化。在诱导体细胞自多倍体的背景下,讨论了结果和由此产生的品系的遗传和育种价值。
结果
流式细胞分析
两个人工同源多倍体[4 .x(编号D-27)和6x(指定为D-2.3)]是由二倍体产生的h . monacanthus和同异三倍体S-75。为了验证这两个同源多倍体系基因组复制的成功,我们使用流式细胞分析定量了2C-DNA含量。
在两种同源多倍体系相对于-à-vis各自的对照系中观察到荧光强度的增加,显示总2C-DNA增加了一倍或接近一倍(表1)1和附加文件1),即二倍体为4.2±0.1 pg/2Ch . monacanthus同体三倍体S-75和同体六倍体D-2.3分别为5.9±0.3 pg/2C和13.7±0.1 pg/2C1).这些结果与之前报道的染色体计数一致[36],从而验证了基因组加倍的成功。
气孔大小和密度
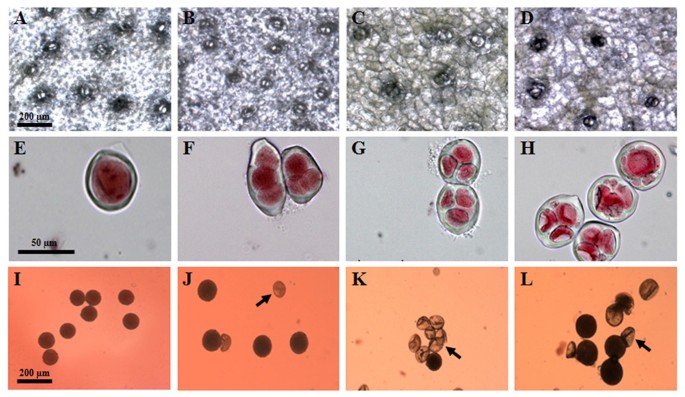
根据我们的假设,我们观察到了DNA含量与气孔大小和密度之间的相关性(表1).更具体地说,气孔大小的显著增加伴随着气孔密度的显著降低与倍性水平的增加有关。气孔平均尺寸分别为53.1、56.0、63.7和69 μm,气孔密度分别为13.6、12.6、9.4和8.1个/ mm2分别对供体二倍体、同种四倍体D-27、对照同种三倍体S-75和同种六倍体D-2.3进行了观察(表21和图1模拟)。
细胞学观察
自多倍化确实诱导了细胞学变化,表现为正常四分体形成频率的显著降低。在二倍体中四分体出现的频率h . monacanthus几乎100%,表明减数分裂正常(表1).而同种四倍体D-27、同种三倍体S-75和同种六倍体D-2.3的四倍体出现频率则有所下降,分别降至78.3、74.6和30.2%(表2)1).在同四倍体D-27中观察到多倍体和三倍体,而在同三倍体S-75和自六倍体D-2.3中观察到多倍体、三倍体、二倍体和单倍体(表2)1和图1情况)。
花粉颗粒直径和可染性
同样,DNA含量与花粉颗粒直径之间也存在相关性。两种同源多倍体系的花粉粒均比供体系大25%左右1和图1我)。同样,花粉染色性与倍性水平相关,但对两种同源多倍体的影响并不相同。而二倍体的可染性则略有下降h . monacanthus(97.1%)到同四倍体D-27(86.6%),从异三倍体S-75(11%)到同六倍体D-2.3(52%)观察到稳定性的增加,意味着活力的恢复(表2)1).
胚珠数,果实和种子性状,种子萌发
仅在同源四倍体D-27中观察到自多倍体与胚珠数的相关性。在二倍体中,平均每个子房有5036个胚珠h . monacanthus,在同四倍体D-27中,观察到每个子房的胚珠显著减少至3,048个1).而同种异体三倍体S-75与自六倍体D-2.3胚珠数差异无统计学意义(表2 - 3)1).两种同源多倍体系的果实重量、种子重量和数量以及发芽率与各自供体系相比均发生了变化(表2)1和图2),表明基因组加倍对这些组织有显著影响。两个同源多倍体品系的果实重量均低于各自供体品系,其中同六倍体D-2.3的果实重量下降幅度远高于同四倍体D-27(分别为53%和19%)。在两个同源多倍体品系中,重量的减少主要是由于果肉重量的减少,而不是果皮重量的减少。这些结果被两个同源多倍体系较低的果肉/果皮比所证实1和图2模拟)。
两种同源多倍体株系的总种子数均显著降低,即同源四倍体和同源六倍体的总种子数分别减少33%和70%1).在同异三倍体S-75和自六倍体D-2.3中也观察到不可存活的棕皮种子。两个同源多倍体的种子重量也存在差异。同四倍体D-27的种子重量(2.92 mg)明显重于二倍体供体的种子(2.57 mg),而同六倍体D-2.3的种子重量(2.29 mg)低于同三倍体供体(3.86 mg)(表2)1和图2情况)。
同源多倍体的萌发率显著降低。二倍体供体种子的发芽率最高,几乎达到90%,而同四倍体D-27的种子发芽率下降相对较小,达到81%(表2)1).从同体三倍体S-75中取出的黑色种子尽管外观和形状正常,但发芽率却很低(50%),自六倍体D-2.3的发芽率最低,低至30%(表3)1).
平均种子重量和种子发芽率的研究结果表明,同源多倍体系和各自供体之间的种子特性存在较大差异。因此,下一步是寻找胚胎大小和形状的形态学差异。因此,种皮被小心地打开,胚被释放出来。从视觉上看,胚和种子大小之间有明显的相关性(表2)1和图2我)。从同源四倍体D-27的果实中获得的种子和胚胎比从二倍体供体中分离得到的种子和胚胎大h . monacanthus(图2i j)。与高平均种子重量(3.86 mg)的相关性预期一样,同素三倍体S-75的胚胎最大2K)。从自六倍体D-2.3中获得的种子和胚胎明显较小,其特征为异常形状和斑块坏死和黑色组织(图2L)。
水果品质分析
从果肉酸度(pH)、总可溶性固形物(TSS)和含水量等方面评价了自多倍体化对果实品质的影响。仅在自六倍体D-2.3中观察到pH值下降和TSS水平降低。从所有四个品系获得的果实的果肉中,水分含量相似(约84%),这意味着自多倍体化后的代谢变化不依赖于水分1).
自多倍体化后初级代谢谱的改变
为了研究自多倍体对中枢代谢的影响,使用建立的基于gc - ms的协议对自多倍体和供体系的果肉和种子样品进行了分析[37].根据Fernie等人最近提出的方法对结果进行分析。[38].使用建立的文库(http://gmd.mpimp-golm.mpg.de/),并比较同源多倍体系与其供体的相对含量。使用方差分析(ANOVA)检验差异的统计学意义(附加文件2而且3.).
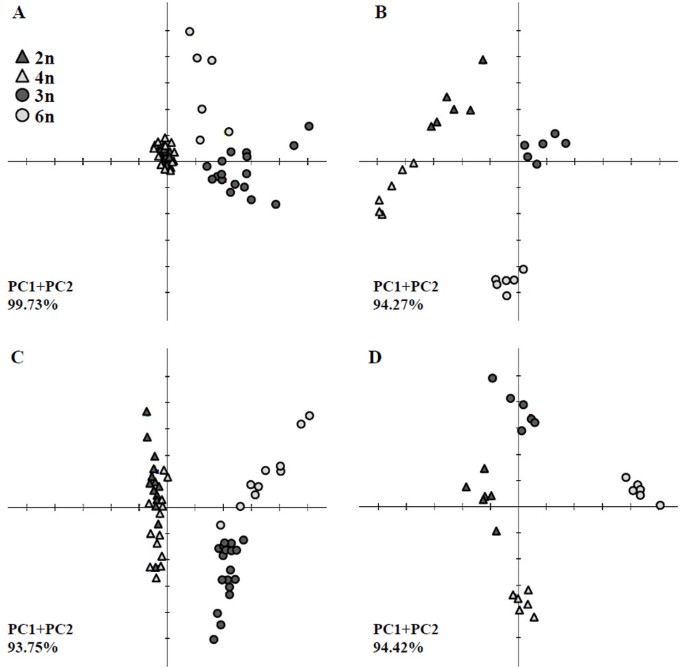
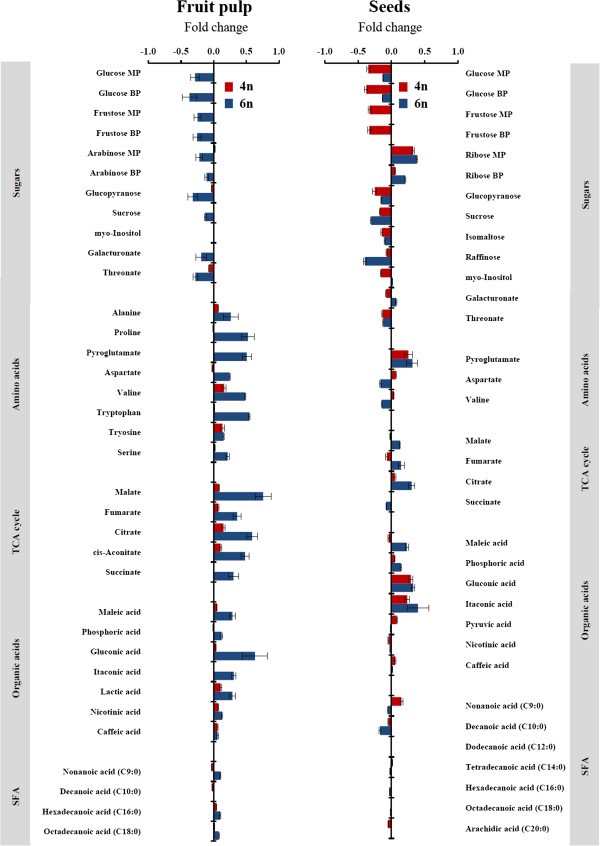
同源多倍体系果肉中代谢物数据的PCA显示,随着遗传改变,中心代谢发生了广泛的变化(图3.和附加文件4).主成分的检测显示,同源六倍体和供体同种异体三倍体样品之间存在明显差异,而同源四倍体和供体二倍体样品之间没有明显差异(图3.A).研究自多倍化对中枢代谢个体代谢产物水平的影响。根据主成分分析,所鉴定的代谢物均无显著变化(P在同四倍体果肉样品中< 0.01)。相比之下,自六倍体果肉样品中鉴定的35种代谢物中有22种代谢物发生了显著变化。值得注意的是,大多数氨基酸、三羧酸循环(TCA)循环中间产物和有机酸丰度的显著增加(2- 5.7倍)与基因组大小的增加相关,其中TCA循环代谢物的变化最为显著(图4).在上述变化模式下,大多数糖的含量变化模式与之相反。11种确定的糖中有6种的浓度低了1.8- 2.4倍,包括葡萄糖和果糖,这是两种含量最高的糖。饱和脂肪酸的代谢在两个重复系中没有差异(图4).
从种子样本中获得的PCA分析显示,两个重复系及其各自供体之间存在明显差异(图2)3.B).种子样品代谢丰度的显著变化采用方差分析(P< 0.01)。种子中的代谢物模式与在果肉样品中观察到的相似,即糖的丰度显著降低,同时氨基酸、TCA循环中间产物和有机酸的积累(图4).在鉴定的35种代谢物中,11种在同四倍体种子样品中显示出显著变化,15种在同六倍体样品中显示出显著变化。在同四倍体种子中,大多数糖的含量下降了1.2- 2.4倍,而在同六倍体种子中,较少的糖含量发生了显著变化,其含量下降了2.5倍(图2)4).在糖中,核糖(主要产物和副产物)表现出明显的变化模式,在两个复制系中增加了2.5倍(图4).虽然在两个重复系的种子中氨基酸、TCA循环产物和有机酸的几种代谢产物均有所增加,但单葡萄糖酸表现出显著的(ANOVA)增加(图4).虽然在种子中发现了比果肉中更多的饱和脂肪酸,但从两个复制系获得的种子样品中这些代谢物的浓度没有显著差异。这一发现表明,诱导的自多倍体化对果实和种子组织中脂肪酸的代谢没有显著影响(图4).
为了了解果肉和种子样品中的初级代谢反应是如何受到基因组复制的影响,我们检测了两个同源多倍体系的每个组织的变异系数(CV)。一般来说,与种子样品相比,供体和复制系的果肉样品的CV值更高,这意味着种子组织的中心代谢更稳定(附加文件)5).结果表明,来自两个复制系的果肉样品的代谢差异增加,自六倍体样品的代谢差异更高,这意味着基因组复制对水果初级代谢组的影响(附加文件)5).在种子样本中,代谢方差几乎没有改变,这表明种子中心代谢组受基因组复制的影响较小(附加文件)5).
自多倍化后继发代谢谱的改变
我们假设自多倍化引起的扰动将导致次生代谢的直接和间接调节。使用基于UPLC-QTOF-MS/ ms的协议,我们研究了果肉和种子提取物中12种最丰富的鉴定化合物的相对含量(附加文件)6而且7).在免费化学数据库ChemSpider (http://www.chemspider.com/),并根据它们的相对峰值响应面积进行量化(见方法)。利用这12种最丰富的代谢物对果肉和种子样品进行了主成分分析,结果表明同源四倍体和二倍体供体h . monacanthus表现出相似的代谢特征,但自体六倍体与供体同素三倍体S-75之间存在明显差异;这些结果表明,自多倍化对次生代谢的影响在自六倍体系所产果实中更为显著3.C).对种子样品的主成分分析显示,每个复制系与其各自的供体系之间存在显著差异(图3.D)。
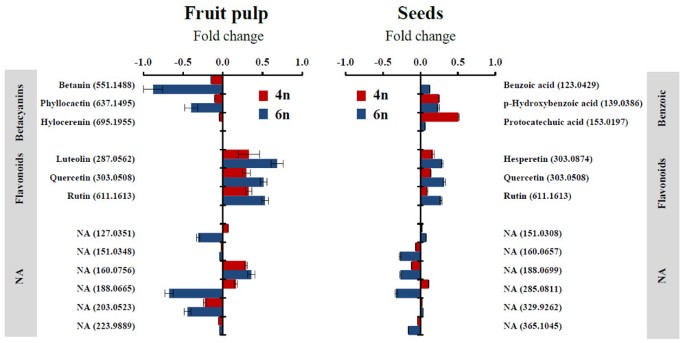
在果肉中含量最多的化合物是三种甜菜花青素色素,甜菜素,叶根动素,和甜菜花青素,这些都是以前在甜菜花青素中发现的Hylocereus物种(39- - - - - -43].这些色素在二倍体供体中更为丰富h . monacanthus与其各自的同四倍体系相比,同三倍体S-75与其各自的同六倍体系(附加文件)6).两个重复系的甜菜素和phyllocactin含量均显著降低,且同六倍体的甜菜素和phyllocactin含量分别降低1.4倍和7.5倍,phyllocactin减少1.3倍和2.5倍;数字5).两个重复系中花苞素浓度的降低没有统计学意义(图5).
木犀草素、槲皮素和芦丁这三种黄酮类化合物在复制系的果肉样品中的浓度显著增加,其中自六倍体的积累量(变化4.9倍)高于自四倍体的积累量(变化2.1倍)(图)5).
除了甜菜花青素和黄酮类化合物外,6种丰富但未鉴定的代谢物在供体系和同源多倍体系的种子提取物中显示出显著变化。然而,我们根据公共图书馆注释它们的努力并不成功(附加文件)6).这些代谢物中的三种(注释为m / z127.0351, 188.0665,和203.0523),浓度显著降低,高达4.7倍,而一种代谢物(m / z160.0756)显著增长2.3倍。总的来说,这些未标注的代谢物在果肉样品中也出现了类似的变化模式,尽管幅度较小(图2)5).
种子中丰富的代谢物是三种黄酮类化合物、三种苯甲酸和六种未标注的代谢物(其中三种未标注的代谢物也在果肉样品中观察到)(附加文件)7).黄酮槲皮素和芦丁的变化模式与在果肉中发现的相同,在同四倍体和同六倍体系的种子样品中,相对于-à-vis它们的供体系,其浓度分别显著增加了1.5倍和2.1倍(图2)5).苯甲酸衍生物在两个重复系中也比它们各自的供体增加(图5).变化最显著的是同源四倍体系的种子样品p-羟基苯甲酸和原儿茶酸分别增加1.8倍和3.2倍(图5).这两种代谢物在自六倍体系的种子样品中也有所增加,尽管增加的程度要小得多。最后,六种未注释的代谢物中有四种(m / z160.0657、188.0699、285.0811和365.1045)在两种同源多倍体株系种子中均显著降低5).
讨论
我们的结果表明,自多倍体化伴随着负面效应,导致植物的整体适应度下降。这些缺点包括花粉和种子活力受损,种子萌发率降低,果实尺寸变小,四分体数量减少。正如预期的那样,基因组加倍后,果实和种子也发生了显著的形态学和细胞学变化。在这两种组织中,糖的浓度下降,氨基酸、TCA循环中间产物和有机酸的相对丰度显著增加。对果肉中次级代谢物的针对性分析显示,几种类黄酮的丰度增加,而主要β -氰胺的浓度下降。
由于植物细胞大小与基因组大小相关,因此可以说多倍体化与细胞、组织和器官大小的整体增加有关[44].细胞结构的改变可能会对调节功能产生影响,因为支持更大基因组生长的成本[45].在这项工作中,每个供体及其同源多倍体之间的比较发现——与基因组大小的增加并行——气孔大小和花粉直径的增加以及气孔密度的减少。类似的形态变化在许多其他物种中也有报道[46,47]并与基因组大小(c值)的增加有关,但不一定与(异基因或自基因)倍性水平的增加有关[47].在玉米例如,一个倍性系无性系的形态比较(1x, 2x3x和图4x)说明基因组剂量对所研究的13个性状的强烈影响[48].然而,与基因组剂量相关的形态变化并不一定是规律。例如,对两个野生物种的研究茄属植物合成的同源四倍体与其二倍体供体在气孔大小和密度方面没有一致的差异[28],表明形态性状的变化与同源多倍体没有系统关联。在气孔大小和花粉直径增加的同时,我们的两种同源多倍体系都产生了明显更小的果实和更低的种子数量,这意味着基因组加倍似乎对植物形态产生了有害影响。在其他诱导的同源多倍体中也报道过这种形态变化[26,27,49].在我们的研究中,同种四倍体系果实大小的减小可能是由于胚珠数量的减少,尽管种子重量增加,但黑皮种子数量却减少了。虽然同体三倍体S-75和自六倍体D-2.3胚珠数量相似,但自六倍体黑皮种子数量和种子重量显著减少。同种四倍体的果实重量和结实率的下降,更重要的是,同种六倍体的果实重量和结实率的下降,说明了同种四倍体的倍性水平增加对植物适应性的不利影响Hylocereus物种。这一结论得到了以下事实的支持:诱导自染色体倍体(8x)h . megalanthus株系(从发芽种子中获得)在早期阶段停止发育并流产,结果几乎为零结果[50].我们发现的意义在于,细胞的增大(如花粉或气孔)是基因组大小(c值)增加的结果,但这些变化与其他植物器官的增大(如果实重量或胚珠数量)没有系统的联系。
先前在二倍体花粉母细胞中观察到两条同源染色体配对、二价形成和规则染色体分离h . monacanthus[51],符合正常四分体的形成(99.8%)和高花粉可染性(97.1%)。在基因组加倍后,在同源四倍体D-27中观察到花粉的可染性和四分体的形成有微小但显著的下降,同时多分体的频率显著增加。尽管花粉母细胞的细胞学研究和多分体形成的机制超出了这项工作的范围,但我们可以假设,由于染色体数量翻倍,减数分裂受到了影响,导致多分体而不是四分体的形成。这种多倍体不太可能形成可活的花粉粒,从而降低了同源四倍体系的花粉可染性。尽管在同素三倍体S-75中观察到的四分体数量相对较高(74.6%),但花粉的可染性非常低(11.1%)。因此,我们假设四分体、三分体和多分体的大多数产物包含不完整的染色体补体,因此不太可能产生功能正常的雄性配子。三倍体植物的育性很少为零[52],基因组加倍提供了新的同源染色体组,就像在我们的自体六倍体系中发生的那样,导致部分恢复生育能力(52.2%)。
我们还观察到,随着倍性水平的提高,总种子数总体上减少。而胚珠数/种子数在二倍体、同四倍体和同三倍体系中比例相似(64-65%),在同六倍体D-2.3中约为19%。这些结果表明,同体三倍体S-75的雌性配子的育性高于雄性配子,而自六倍体D-2.3的情况则相反。在种子萌发方面,萌发率越低,倍性越高,但自六倍体D-2.3的影响更严重(30%),种子质量极低,种子形状异常,胚组织坏死;这些发现再次反映了在最高倍性水平上的有害变化。这些结果与先前发表的研究结果一致,即多倍体种子质量的增加不一定与快速和/或成功的发芽有关[53].
虽然已表明异源多倍体化导致快速的遗传和表观遗传修饰,导致多层次的细胞扰动[14,16],一直认为同源多倍体不涉及这种改变,因为复制事件源于相同的同源基因组[22,54].诱导的同源多倍体系可能表现出增强的代谢物产生,这是一种有用的植物材料,可用于获得次生代谢物产生方面的快速遗传改进[55].然而,一些研究表明,基因组剂量对代谢物的产生有不同的影响。四倍体的Lycopersicum esculentum对多倍体化表现出不同的酶反应,即苹果酸脱氢酶、酸性转化酶和酸性磷酸酶活性增加,而过氧化物酶活性降低,中性磷酸酶和酯酶浓度不受影响(在[53])。在由二倍体产生的四倍体系的代谢比较中Cucumis巨大成功L., Filipecki等。[56]得出结论,代谢谱的差异是组织培养反应性的,与四倍体基因组变化的范围没有直接关系。我们在此注意到,虽然上述所有研究都对理解基因剂量的影响做出了有价值的贡献,但这些研究针对的是特定的代谢物。在我们的研究中,基于gc - ms的代谢物分析显示,随着基因组剂量的增加,代谢物发生了协调变化。由于自多倍体作用,糖含量显著降低,同时氨基酸和有机酸含量显著增加。这些反应与我们的果实质量测量相关,表明单是自六倍体果实表现出较低的pH值和TSS值。发育停滞很可能是果实代谢变化的原因,表现为果实体积变小。这一观点得到了其他物种发育诱导的代谢变化的支持。例如,Carrari和Fernie [57]观察到,在番茄果实成熟过程中,糖水平显著增加,大多数氨基酸和TCA循环中间产物减少。作为对非生物和/或生物胁迫的反应,次生代谢产物的合成增加在植物中经常被观察到。例如,比较非胁迫移植物和轻度胁迫仙人掌茎的表皮层产生的β -花青素的分布,表明胁迫茎的β -花青素水平更高[58].在甜菜属叶片、损伤和细菌浸润之后是氧化破裂诱导的β氰苷合成[59].叶表皮细胞Mesembryanthemum crystallinum在强光照射下显示黄酮醇和β -氰苷的快速细胞特异性积累[60].
的果实Hylocereus物种的特征是独特的甜菜花青素色素,包括先前确定的代谢物甜菜素,叶根动蛋白和甜菜花青素[40],这些色素使肉呈红色,并具有抗氧化和抗增殖活性[61,62].β -花青素受细胞分裂素正向调控[63,64]和ABA的负面影响[65].在我们从两个重复系中提取的果肉样品中,自多倍化后次生代谢物中最显著的变化是主要β -花色苷的减少。这种减少伴随着几种类黄酮的显著增加,如木犀草素、芦丁和槲皮素。芦丁及其转化为槲皮素和下游类黄酮的产物与叶片的发育变化和衰老有关[66,67].上述证据和早期研究表明,从甜菜花青素的生物合成向黄酮醇的转变可能是通过调节二氢黄酮醇还原酶实现的,二氢黄酮醇还原酶是类黄酮途径中第一个参与花青素生物合成的酶,它催化nadph依赖性的二氢黄酮醇还原为白花青素[68].
人们早就知道,在果肉和种子的发育过程中会发生结构和代谢变化,果实和种子组织之间存在相互作用[69].我们也知道,成分代谢变化发生在种子发育过程中[70,71].然而,没有关于自多倍体化后种子代谢变化的数据,也没有比较该过程后种子和果肉组织代谢模式的研究。我们的结果表明,种子中初级代谢物的变化模式与果实中观察到的相似。然而,在种子中,属于氨基酸、TCA循环中间产物和有机酸组的代谢物丰度的增加不像在果实中观察到的那样明显。这些观察结果,以及与果肉相比,种子样品的CV值较低,表明种子中有更稳定的初级代谢网络,受自多倍化驱动的基因组扰动的影响较小。
结论
我们的结果表明,自多倍体化在Hylocereus物种导致多层次的负变异,这些负变异密切相关。这两个复制系都受到基因组加倍的显著影响,因此,减数分裂行为发生改变,果实、种子和胚胎的形态特征都发生改变,代谢途径也发生改变。此外,代谢产物分析显示了广泛的代谢变化,这可能与果实成熟过程和/或细胞应激有关。
关于新的同源多倍体的进化意义和育种潜力——与先前报道的工作一致——我们得出结论,对同源多倍体的反应——在形态学、细胞学和代谢上表现出来——是物种特异性的,取决于供体基因型的遗传背景,而不是基因组加倍的过程。
方法
植物材料和生长条件
本研究的植物材料为二倍体Hylocereus monacanthus(Lem)。Br。罗斯,2岁n= 2x= 22,入世89-028;同素三倍体s - 75,2n= 3x= 33,是二倍体之间的种间-倍性杂交h . monacanthus四倍体Hylocereus megalanthus[(Schum。(前沃佩尔莫兰[鲍尔;以及它们合成的同源多倍体,即同源四倍体h . monacanthus(命名为D-27)和自六倍体S-75(命名为D-2.3)。D-27和D-2.3系的体细胞自多倍体化过程和染色体计数已有报道[35].两株供体植物及其体细胞同源多倍体进行营养繁殖:插枝种植在15升的花盆中,所有植物在每天2升的水和浓度为100 ppm的23:7:23 NPK肥料的施肥制度下生长。该研究是在以色列贝尔谢瓦内盖夫本-古里安大学Bergmann校区的一个有50%树荫的温室中进行的,连续两个结果季(2009-2010年和2010-2011年)。
流式细胞分析
通过比较二倍体的核DNA含量来评估基因组大小h . monacanthus同素三倍体S-75与相应的同源多倍体系D-27和D-2.3,如Cohen和Tel-Zur [50].每一行至少分析了四次,以验证可重复性。
气孔大小和密度
将表皮层从完全展开的成熟枝条中分离出来,然后用两滴双重蒸馏水放置在显微镜载玻片上。测定了二倍体的气孔密度h . monacanthus通过计算每1mm的气孔数量,可以得到同体三倍体S-75、同四倍体D-27和同六倍体D-2.32区域。对于每一行,从五种植物的不同分支上观察了45个领域。显微照片使用蔡司Axiocam Imager A1光学显微镜拍摄,气孔大小使用蔡司Axiocam MRc 5相机测量,AxioVision程序版本4.6.3.0 SP1。
细胞学观察
从二倍体上采集花蕾h . monacanthus将同种异体三倍体S-75、同多倍体D-27和D-2.3分别在3:1乙醇:冰醋酸中固定24 h。然后将芽保存在70%乙醇中,4°C。将孢子用2%的乙酰胭脂胺滴染色,在蔡司Axiocam A1光学显微镜下观察,并使用AxioVision程序(4.6.3.0 SP1版)使用蔡司Axiocam MRc 5相机拍摄。从每个系中提取约500-700个,并根据结构进行分类。
花粉颗粒直径和可染性
在开花时采集四种株系的花粉粒,用2%的乙胭脂胺染色(选择乙胭脂胺是因为它对储存的花粉有很好的效果)。每一株系测量了至少10种不同花的大约300-500粒花粉。显微照片使用蔡司Axioimager A1光学显微镜,蔡司Axiocam MRc 5相机,AxioVision程序,版本4.6.3.0 SP1。
胚珠数,果实和种子性状,种子萌发
在花期采集4个品系各7个花蕾,统计每个花蕾的胚珠数。从2个供体系和2个同源多倍体系成熟时采集果实,分析形态性状。测定每个株系至少25个果实的总果重、果皮和果肉重以及总籽数/果数。平均种子重量由每个品系的500粒种子确定。
每系只对100粒黑色包衣种子进行发芽试验。通过将20颗种子放在培养皿中的湿滤纸上,计算10天后发芽的种子数量,研究了种子萌发情况。
对各品系15个果实提取的果汁进行了果实品质参数测定。通过测量pH值来确定果汁的酸度(Eutech Instruments, CyberScan pH 510)。TSS用折射仪测定(PR-100, Atago,日本)。水分含量是通过从种子中分离出大约15毫克的纸浆,在杂交烤箱(Thermo Electron Corporation, Hybaid Shake ' n ' Stack烤箱)中在70℃下干燥材料,然后重新称重来确定的。
GC-MS和UPLC-QTOF-MS/MS提取和分析代谢物
取果浆(150 μl用滤网与种子分离)或种子样品(25mg干种子)装入2 ml试管中,在液氮中快速冷冻,-80℃氩气下保存,待进一步分析。样品根据建立的GC-MS/LC-MS协议进行处理[37,72],即GC-MS DSQII (thermofisher Ltd.)中的初级代谢物分析和配备电喷雾电离(ESI)接口的UPLC- qtof -MS/MS系统中的次级代谢物分析(LC, Waters Acquity UPLC系统;MS, Waters Q-TOF Premier)在Bing等人描述的条件下运行。[73].对于GC-MS数据,质谱搜索使用Xcalibur®数据系统(2.0.7版本)中纳入的国家标准与技术研究所(NIST, Gaithersburg, MD, USA)算法,与德国Golm的Max-Planck植物生理学研究所(http://csbdb.mpimp-golm.mpg.de/csbdb/gmd/msri/gmd_msri.html),最后归一化为内标瑞比醇。通过UPLC-QTOF-MS/MS获得的原始数据由MassLynx®软件(Waters)(4.1版)记录。通过化学数据库ChemSpider (http://www.chemspider.com/).化合物的定量是根据色谱图中每个质量信号经过帕累托标度后的相对峰响应面积,归一化为内标氨苄青霉素[74].
统计分析
在二倍体之间进行比较h . monacanthus同四倍体D-27和同三倍体S-75和同六倍体D-2.3之间。采用方差分析计算GC-MS和UPLC-QTOF-MS/MS分析的统计学意义(P< 0.01),学生的t以及(P< 0.05)用于评价所有细胞学、形态学和果实质量分析的统计学显著性,均通过JMP程序8.0版进行。主成分分析(PCA)用于显示对照和诱导同源多倍体系之间代谢物分布的整体差异。所有pca均采用免费软件包TMEV [75默认加权协方差估计函数。变异系数(CV)值在Microsoft Excel上计算,方法是分别取来自供体和同源多倍体系的果肉或种子样品的每一个代谢物的标准偏差与平均值的比值。然后,将得到的CV值分为12个区间,每个区间的增量为0.1,并估计其相对频率。
缩写
- 气相:
-
气相色谱-质谱联用
- 主成分分析:
-
主成分分析
- 柠檬酸:
-
三羧酸循环
- TOF:
-
飞行时间
- TSS:
-
总可溶性固形物
- UPLC:
-
超高效液相色谱法
- 简历:
-
方差系数。
参考文献
- 1.
Ohno S:通过基因复制进化。纽约:施普林格;1970.
- 2.
Grant V:植物物种形成。纽约:哥伦比亚大学出版社;1971.
- 3.
Jiao Y, Wickett NJ, Ayyampalayam S, Chanderbali AS, Landherr L, Ralph PE, Tomsho LP, Hu Y, Liang H, Soltis PS, Soltis DE, Clifton SW, Schlarbaum SE, Schuster SC, Ma H, Leebens-Mack J, DePamphilis CW:种子植物和被子植物的祖先多倍体。自然科学,2011,473:97-102。10.1038 / nature09916。
- 4.
Vande Peer Y, Fawcett JA, prost S, Sterck L, Vandepoele K:开花的世界:一个重复的故事。植物科学进展,2009,14:680-688。10.1016 / j.tplants.2009.09.001。
- 5.
Soltis PS, Soltis DE:遗传和基因组属性在多倍体成功中的作用。美国国家科学研究院。2000, 37(4): 457 - 457。10.1073 / pnas.97.13.7051。
- 6.
贝内特医学博士:植物多倍体的观点-古代和新。中国生物医学工程学报,2004,26(4):411-423。10.1111 / j.1095-8312.2004.00328.x。
- 7.
Jackson S,陈志军:多倍体的基因组和表达可塑性。植物学报,2010,13:153-159。10.1016 / j.pbi.2009.11.004。
- 8.
被子植物的多倍体研究。植物科学进展,1997,2:470-476。10.1016 / s1360 - 1385(97) 01154 - 0。
- 9.
杨晓明,杨晓明,杨晓明,等:开花植物多倍体形成的途径、机制及速率。生态学报,1998,29:467-501。10.1146 / annurev.ecolsys.29.1.467。
- 10.
Soltis DE, Soltis PS:分子数据和多倍体的动态性质。植物营养学报,1994,18(3):344 - 344。
- 11.
Adams KL, Wendel JF:探索棉花多倍体的基因组奥秘。中国生物医学工程学报,2004,29(3):344 - 344。10.1111 / j.1095-8312.2004.00342.x。
- 12.
陈志军,王金林,田玲,Lee HS,王jyj,陈敏,Lee JSJ, Josefsson C, Madlung A, Watson B, Lippman Z, Vaughn M, Pires JC, Colot V, Doerge RW, Martienssen RA, Comai L, Osborn TC:拟南芥多倍体效应全基因组分析模型系统的建立。中国生物医学工程学报,2004,29(3):349 - 349。10.1111 / j.1095-8312.2004.00351.x。
- 13.
Doyle JJ, Doyle JL, Rauscher JT, Brown AHD:多年生大豆二倍体和多倍体网状结构的进化(甘氨酸亚属甘氨酸).环境科学学报,2004,29(3):344 - 344。
- 14.
李志刚,李志刚,李志刚:异源多倍体化对小麦基因组遗传和表观基因重组的影响。中国生物医学工程学报,2004,29(3):349 - 349。10.1111 / j.1095-8312.2004.00346.x。
- 15.
Lukens LN, Quijada PA, Udall J, Pires JC, Schranz ME, Osborn TC:古代和近代基因组的冗余和可塑性芸苔属植物作物物种。中国生物医学工程学报,2004,29(3):344 - 344。10.1111 / j.1095-8312.2004.00352.x。
- 16.
Tate JA, Ni ZF, Scheen AC, Koh J, Gilbert CA, Lefkowitz D, Chen ZJ, Soltis PS, Soltis DE:同源位点的进化与表达Tragopogon miscellus(菊科),是最近相互形成的异源多倍体。中国生物医学工程学报,2006,29(3):344 - 344。10.1534 / genetics.106.057646。
- 17.
马查普曼,伯克JM:遗传分化与杂交物种形成。进化,2007,61:1773-1780。10.1111 / j.1558-5646.2007.00134.x。
- 18.
董文文,Adams KL:天然多倍体和人工合成多倍体在非生物胁迫下复制基因转录组的差异贡献。环境科学学报,2011,29(3):344 - 344。10.1111 / j.1469-8137.2011.03650.x。
- 19.
Doyle JJ, Flagel LE, Paterson AH, Rapp RA, Soltis DE, Soltis PS, Wendel JF:植物基因组合并和加倍的进化遗传学。年Rev gen 2008, 42: 443-461。10.1146 / annurev.genet.42.110807.091524。
- 20.
植物物种形成以来多倍体研究进展。环境科学学报,2004,29(3):344 - 344。
- 21.
Soltis DE, Soltis PS, Schemske DW, Hancock JF, Thompson JN, Husband BC, Judd WS:被子植物的同源多倍体:我们是否严重低估了物种的数量?分类学报,2007,56:13-30。
- 22.
Parisod C, Holderegger R, Brochmann C:同源多倍体的进化结果。中国农业科学,2010,27(3):344 - 344。10.1111 / j.1469-8137.2009.03142.x。
- 23.
Havananda T, Brummer EC, Doyle JJ:苜蓿同源多倍体进化的复杂模式(紫花苜蓿;豆科)。学报学报,2011,29(3):344 - 344。10.3732 / ajb.1000318。
- 24.
胡建平,李志刚,王志刚,王志刚,王志刚。植物有丝分裂染色体体外增殖的研究进展。植物科学学报,2011,29(4):359-373。10.1007 / s11240 - 010 - 9786 - 5。
- 25.
刘志刚,刘志刚,刘志刚,刘志刚。六倍体基因组大小与植物发育的关系季.遗传学报,1993,21(4):555- 556。10.1038 / hdy.1993.179。
- 26.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。木瓜粳稻).植物科学学报,2006,34(4):366 - 366。10.1007 / s11240 - 005 - 9029 - 3。
- 27.
盖奎德,李志刚,李志刚:西瓜多倍体诱导研究(Cirullus lanatus(研究)。Matsum和Nakai。中国农业生物学报,2009,25:110-118。
- 28.
阿versano R, Caruso I, arone G, De Micco V, Scognnamigilo N, Carputo D:随机变化影响茄属植物自多倍体化后的野生物种。应用物理学报,2013,32(3):344 - 344。10.1093 / jxb / ers357。
- 29.
高世林,朱丹丹,蔡志华,徐丹丹:秋水仙素处理的同种四倍体植物的芽培养丹参知母。植物科学学报,1998,27(3):344 - 344。10.1007 / BF02318968。
- 30.
李志强,李志强,李志强:多倍体对黄酮类化合物含量的影响佩妮“米歇尔”。植物化学学报,1996,42:361-363。10.1016 / 0031 - 9422(95) 00893 - 4。
- 31.
Svehlikova V, Repcak M:二倍体和四倍体芹菜素含量的变化Chamomilla recutita(l)Rauschert。中国生物医学工程学报,2000,2:439 - 439。10.1055 / s - 2000 - 5957。
- 32.
Jesus-Gonsalez L, Weahters PJ:四倍体青蒿毛状根比二倍体产生更多的青蒿素。中国生物医学工程学报,2003,29(4):344 - 344。
- 33.
金银生,韩永杰,白琪:多倍体诱导对人参不定根生物量和皂苷积累的影响。植物学报,2004,47:356-360。10.1007 / BF03030551。
- 34.
米兹拉希Y,书呆子A:攀爬和柱状仙人掌:新的干旱土地水果作物。对新作物和新用途的展望。编辑:雅尼克J.亚历山大:ASHS出版社;1999:358 - 366。
- 35.
Tel-Zur N, Dudai M, Raveh E, Mizrahi Y:原位藤本仙人掌(仙人掌科)染色体加倍诱导。科学通报,2011,29(4):457 - 457。10.1016 / j.scienta.2011.04.027。
- 36.
李志刚,李志刚,李志刚,李志刚,李志刚。藤本仙人掌属植物的表型和基因组特征分析。中国农业科学,2011,27(3):457 - 457。10.1007 / s10722 - 010 - 9643 - 8。
- 37.
李志刚,李志刚,李志刚,李志刚。植物代谢产物的气相色谱质谱分析。自然科学学报,2006,1:387-396。10.1038 / nprot.2006.59。
- 38.
Fernie AR, Aharoni A, Willmitzer L, Stitt M, Tohge T, Kopka J, Carroll AJ, Saito K, Fraser PD, DeLuca V:报告代谢物数据的建议。植物学报,2011,23:2477-2482。10.1105 / tpc.111.086272。
- 39.
Wybraniec S, Platzner I, Geresh S, Gottlieb HE, Haimberg M, Mogilnitzki M, Mizrahi Y:藤本仙人掌中的甜菜花青素Hylocereus polyrhizus.植物化学学报,2001,34(4):344 - 344。
- 40.
魏布兰克,瓦瓦克-维德拉,米兹拉希1和C13新型脱羧β -花青素的核磁共振波谱结构鉴定。光子学报,2006,44(3):344 - 344。10.1016 / j.tetlet.2006.01.046。
- 41.
蔡玉珍,邢杰,孙敏,Corke H:甜菜花青素的快速鉴定苋属植物三色,Gomphrena globosa,Hylocereus polyrhizus采用基质辅助激光解吸/电离四极离子阱飞行时间质谱(MALDI-QIT-TOF MS)。中国农业科学,2006,29(4):457 - 457。10.1021 / jf0609983。
- 42.
Esquivel P, Stintzing FC, Carle R:不同品种果实色素模式及颜色表达Hylocereussp.基因型。食品科学与技术。2007,8:451-457。10.1016 / j.ifset.2007.03.022。
- 43.
Wybraniec S, Nowak-Wydra B, Mitka K, Kowalski P, Mizrahi Y:水稻果实中微量甜菜素Hylocereus物种。植物化学学报,2007,29(3):344 - 344。10.1016 / j.phytochem.2006.10.002。
- 44.
康多洛西E,鲁迪埃F, Gendreau E:植物细胞大小控制:通过倍性生长?。植物学报,2000,3:488-492。10.1016 / s1369 - 5266(00) 00118 - 7。
- 45.
heessen DO, Jeyasingh PD, Neiman M, Weider LJ:与基因组大小相关的元素成本。生态环境学报,2009,25:75-80。
- 46.
谭光艳,邓gm:气孔长度、气孔频率和花粉粒直径与倍性水平的关系叶片山谷里去。作物科学,2003,13:332-334。10.2135 / cropsci1973.0011183X001300030014x。
- 47.
黄C,穆雷BG:基因组大小的变化与不同多倍体事件相关Plantago(车前草科)。中华医学杂志,2012,30(4):344 - 344。
- 48.
李文杰,李文杰,李文杰,等:植物对倍性变化响应的遗传变异玉米[j] .理论与实践,2006,29(1):77 - 77。10.1007 / s00122 - 006 - 0414 - z。
- 49.
张启勇,罗旭峰,刘玲,郭春峰:在体外紫薇四倍体的诱导(Lagerstroemia籼l .)。植物学报,2010,30(1):67 - 67。10.1007 / s11240 - 009 - 9660 - 5。
- 50.
Cohen H, Tel-Zur N:植物自多倍体化的形态学改变和自交不亲和破裂Hylocereus物种(仙人掌科)。《植物学报》,2012,34(4):344 - 344。10.1007 / s10681 - 011 - 0536 - 5。
- 51.
利希滕维格J,阿博S, Nerd A, Tel-Zur N, Mizrahi Y:攀缘仙人掌的细胞学和交配系统Hylocereus而且Selenicereus.中国机械工程学报,2004,27(4):344 - 344。10.2307 / 2657005。
- 52.
Bretagnolle F, Thompson JD:具有体细胞染色体数的配子——它们的形成机制及其在同源多倍体植物进化中的作用。环境科学学报,2004,29(3):344 - 344。10.1111 / j.1469-8137.1995.tb03005.x。
- 53.
Levin DA:开花植物的多倍体和新颖性。自然科学进展,2003,22(1):1-25。10.1086/284115。
- 54.
Comai L:多倍体的优点和缺点。自然科学,2005,6:836-846。
- 55.
Dhawan OP, Lavania UC:通过诱导多倍体提高次生代谢产物的生产力:综述。《自然科学》,1996,27(3):344 - 344。10.1007 / BF00021879。
- 56.
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明。黄瓜组织培养和同源四倍体代谢特征的变化(Cucumis巨大成功l .)。应用物理学报,2006,44(3):344 - 344。10.1007 / BF03194594。
- 57.
Carrari F, Fernie AR:番茄果实发育的代谢调节。中国机械工程学报,2006,29(3):344 - 344。10.1093 / jxb / erj020。
- 58.
Wybraniec S, Stalica P, Spórna A, Mizrahi Y:用LC-DAD-ESI-MS/MS研究嫁接和轻胁迫仙人掌表皮层β -氰胺素的分布。中国农业科学,2010,29(4):357 - 357。10.1021 / jf100065w。
- 59.
Sepúlveda-Jiménez G, Rueda-Benítez P, Porta H, Rocha-Sosa M:红甜菜中甜菜苷的合成(甜菜属)叶片被损伤和细菌渗透所诱导,在此之前会发生氧化爆发。中国生物医学工程学报,2004,29(4):344 - 344。10.1016 / j.pmpp.2004.08.003。
- 60.
黄志刚,李志刚,黄志刚,黄志刚,黄志刚:黄酮类醇与甜菜花青素积累的光谱依赖性Mesembryanthemum crystallinum在增强的紫外线辐射下。植物生态学报,2002,26(3):344 - 344。10.1046 / j.1365-3040.2002.00895.x。
- 61.
吴立龙,徐华伟,陈玉春,赵成昌,林毅,何佳:红火龙果的抗氧化和抗增殖活性。食品化学学报,2006,29(3):319-327。10.1016 / j.foodchem.2005.01.002。
- 62.
Osorio-Esquivel O, Alicia-Ortiz M, Alvarez VB, Dorantes-Alvarez L, Giusti MM:酚类物质,甜菜花青素和抗氧化活性仙人掌属植物joconostle水果。食品科学学报,2011,44:2160-2168。10.1016 / j.foodres.2011.02.011。
- 63.
托马斯·TH·比丁顿:修正版苋属植物快速测定植物提取物中细胞分裂素的甜菜花青素生物测定方法。植物学报,2003,27(3):344 - 344。10.1007 / BF00386279。
- 64.
杨晓明,李志刚,李志刚:脱落酸、细胞分裂素和赤霉素对甜菜花青素合成的影响苋属caudatus.生物化学学报,2004,27(4):344 - 344。10.1111 / j.1399-3054.1977.tb04079.x。
- 65.
Ray SD, Guruprasad KN, Laloraya MM:脱落酸逆转抑制甜菜花青素合成的酚类化合物苋属caudatus幼苗。化学工程学报,2004,27(3):379 - 379。10.1111 / j.1399-3054.1983.tb04164.x。
- 66.
坎迪尔·FE, Grace MH, Seigler DS, Cheeseman JM:多酚类化合物大片损坏叶片发育和衰老过程中叶片的变化。树结构的乐趣。2004,18:518-528。
- 67.
Suzuki T, Honda Y, Mukasa Y: UV-B辐射、低温和干燥胁迫对苦荞芦丁浓度和芦丁葡萄糖苷酶活性的影响(Fagopyrum tataricum树叶)。植物科学学报,2005,29(3):344 - 344。10.1016 / j.plantsci.2005.01.007。
- 68.
岛田S,高桥K,佐藤Y, Sakuta M:石竹属非花青素产生种二氢黄酮醇4-还原酶cDNA。植物物理学报,2004,45:1290-1298。10.1093 /卡式肺囊虫肺炎/ pch156。
- 69.
王志刚,王志刚:果实的发育过程。植物科学学报,1993,23(3):344 - 344。
- 70.
鲍德华,李志刚,李志刚,李志刚。植物种子发育的研究进展拟南芥生态型WS。植物化学与工程学报,2002,30(4):344 - 344。10.1016 / s0981 - 9428 (01) 01350 - x。
- 71.
Mounet F, lamair - chemley M, Maucourt M, Cabasson C, Giraudel JL, Beborde C, Lessire R, Gallusci P, Bertrand A, Gaudillere M, Rothan C, Rolin D, Moing A:番茄果肉和种子在果实发育过程中的定量代谢特征:ANN和PCA补充分析。代谢组学,2007,3:273-288。10.1007 / s11306 - 007 - 0059 - 1。
- 72.
韦克沃斯W, Loureiro ME,温泽尔K, Fiehn O:差异代谢网络揭示沉默植物表型的影响。美国国家科学研究院。2004, 30(4): 589 - 589。10.1073 / pnas.0303415101。
- 73.
宾B, Sikron N, Gendler T, Kazachkova Y, Barak S, Grafi G, Khozin-Goldberg I, Fait A:种子代谢响应的生态变异及其与种子活力的关系。中国生物医学工程学报,2011,29(3):344 - 344。
- 74.
Doerfler H, Lyon D, Nagele T, Sun X, Fragner L, Hadacek F, Egelhofer V, Weckwerth W:综合GC-MS和LC-MS代谢组学数据中的格兰杰因果关系揭示了初级和次级代谢的界面。代谢组学,2012,9:564-574。
- 75.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M, Sturn A, Snuffin M, Rezantsev A, Popov D, Ryltsov A, Kostukovich E, Borisovsky I, Liu Z, Vinsavich A, Trush V, Quackenbush J: TM4:用于微阵列数据管理和分析的免费开源系统。生物技术,2003,34:374-378。
致谢
我们非常感谢Noga Sikron博士在GC-MS和UPLC-QTOF-MS/MS代谢分析方面的技术支持,以及Inez Mureinik女士对手稿的编辑。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
AF, NTZ构思了这项研究。HC进行了实验和数据分析。AF协调了研究的代谢。NTZ协调了细胞学和形态学研究。HC, AF和NTZ撰写了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
流式细胞术分析供体和同源多倍体系。
附加文件1:(A)二倍体的图h . monacanthus, (B)同四倍体系D-27, (C)同三倍体S-75, (D)同六倍体系D-2.3。二倍体的G0/G1峰位h . monacanthus将加入89-028与对照同种异体三倍体S-75及同源多倍体D-27和D-2.3进行比较,测定倍性水平。每一行至少分析了四次,以验证可重复性。(pdf 36kb)
果肉GC-MS分析的初级代谢物相对含量和同源多倍体系的(log10)倍变化。
附加文件2:质谱搜索利用Xcalibur®数据系统中的算法,最终通过内部标准ribitol归一化。MP =主产物,BP =副产物。星号表示代谢物含量的显著变化(P方差分析< 0.01)。Fold change表示同源多倍体系与其各自对照系之间各代谢物相对含量的(log10)变化。(pdf 96kb)
种子GC-MS分析的初级代谢产物相对含量和同源多倍体系的(log10)倍变化。
附加文件3:质谱搜索利用Xcalibur®数据系统中包含的算法,最终由内部标准ribitol归一化。MP =主产物,BP =副产物。星号表示代谢物含量的显著变化(P方差分析< 0.01)。Fold change表示同源多倍体系与其各自对照系之间各代谢物相对含量的(log10)变化。(pdf 96kb)
主成分分析(PCA)的代谢物特征值。
附加文件4:在对果肉和种子组织的GC-MS和UPLC-QTOF-MS/MS数据集进行的每个pca中,以下所示的代谢物是成分1和成分2的特征值最高的7种代谢物。括号中的值表示m / z每一种代谢物。MP =主产物,BP =副产物。(pdf 29kb)
12870 _2013_1781_moesm5_esm.pdf
附加文件5:同源多倍体系果肉和种子样品的变异系数(CV)分析A - B,来自果肉(A)和种子(B)的CV分析。变异系数(CV)值通过取来自两个同源多倍体系的果肉或种子样品的每个主要代谢物的标准偏差与平均值的比值来计算。然后,将得到的CV值分为12个区间,每个区间的增量为0.1,并估计其相对频率。(pdf 121kb)
果肉UPLC-QTOF-MS/MS分析次生代谢产物相对含量及同源多倍体系(log10)倍变化。
附加文件6:质谱搜索采用MassLynx®数据系统中的算法,最终通过内部标准氨苄青霉素归一化。星号表示代谢物含量的显著变化(P方差分析< 0.01)。Fold change表示同源多倍体系与其各自对照系之间各代谢物相对含量的(log10)变化。括号中的值表示m / z每一种代谢物。NA =无注释。(pdf 70kb)
种子UPLC-QTOF-MS/MS分析次生代谢产物相对含量及同源多倍体系(log10)倍变化。
附加文件7:质谱搜索利用MassLynx®数据系统中的算法,最终通过内部标准氨苄青霉素归一化。星号表示代谢物含量的显著变化(P方差分析< 0.01)。Fold change表示同源多倍体系与其各自对照系之间各代谢物相对含量的(log10)变化。括号中的值表示m / z每一种代谢物。NA =无注释。(pdf 72 kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
科恩,费特,A. & Tel-Zur, N.形态学,细胞学和代谢的后果自多倍化Hylocereus(仙人掌科)的物种。BMC植物生物学13日,173(2013)。https://doi.org/10.1186/1471-2229-13-173
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-173
关键字
- 流式细胞术
- 果实和种子性状
- 花粉直径和活力
- 初级和次级代谢
- 气孔大小和密度
- 合成体细胞同源多倍体