摘要
背景
果实呈红色是苹果的一个重要性状,其主要原因是植物类黄酮代谢产物花青素的积累。花青素的生物合成由结构基因和调节基因决定。植物组织色素沉着模式主要由调控基因的表达谱控制。在这些调控基因中有MYB转录因子(TFs),其中双重复序列(R2R3)类被认为是最大的,它们与花青素生物合成途径有关。虽然三MdMYB如果在苹果中发现了核苷酸序列几乎相同的R2R3 MYB TFs,那么很可能存在于苹果基因组中的其他R2R3 MYB TFs也参与了苹果果实的红色色素沉着的调节。
结果
在这项研究中,一部小说R2R3 MYB从苹果中分离并鉴定了基因。这MYB基因与基因密切相关拟南芥AtMYB3,并被指定为MdMYB3.该TF属于植物MYB转录因子的4亚群R2R3家族。这个苹果MdMYB3将基因定位到苹果遗传图谱的第15连锁群上。成绩单的MdMYB3在所有被分析的组织中都能检测到,包括叶子,花和果实。然而,红皮苹果外皮中MdMYB3转录本高于黄绿皮苹果外皮。当这个基因异位表达在烟草简历。小哈瓦那SR1,转基因烟草株系携带花MdMYB3表现出增加的色素沉淀和积累的花青素和黄酮醇水平高于野生型花。过度的MdMYB3导致了几个类黄酮途径基因的转录激活,包括CHS,气,UFGT,FLS的.而且,过表达MdMYB3的转基因植物的花梗和雌蕊花柱都比野生型植物的花梗和花柱长,这表明该转录因子参与了花发育的调控。
结论
本研究在苹果基因组中发现了一个新的MYB转录因子。这个TF,被指定为MdMYB3,参与多个类黄酮通路基因的转录激活。此外,该TF不仅调控苹果果皮中花青素的积累,还参与调控花的发育,特别是雌蕊的发育。
背景
果皮颜色是苹果果实品质的一个重要决定因素。一般来说,消费者更喜欢红皮苹果,因为他们认为红皮苹果味道更好。1].苹果果实的着色是由于花青素的积累,花青素是一类植物类黄酮代谢产物。类黄酮在植物中无处不在,在植物生长过程中发挥着重要作用,包括紫外线防护、抗病、防御草食动物,以及为花和种子提供色素以吸引传粉者和种子传播者[2,3.].更重要的是,越来越多的证据表明类黄酮有益于人类健康,如降低心血管疾病、肥胖、糖尿病、肺病和癌症的发病率[4- - - - - -8].
花青素的生物合成途径已经建立,花青素途径基因已在矮牵牛花、鲷鱼花等多种模式植物中分离和鉴定拟南芥[9,10].花青素的生物合成由结构基因和调节基因决定。结构基因在转录水平受调控基因调控,因此植物色素沉着模式主要由调控基因的表达谱控制[11,12].
三种转录因子(tf),包括基本螺旋-环-螺旋(bHLH), R2R3 MYB和WD40蛋白,主要调控花青素生物合成途径的基因,包括迄今报道的所有植物物种,包括苹果[13,14].据报道,MYB转录因子在植物次生代谢、发育、信号转导和抗病等调控途径中发挥多种功能[15].它们是根据dna结合域中高度保守的不完美重复的数量分类的,由单个或多个重复组成。在这些MYB转录因子中,双重复序列(R2R3)类被认为是最大的,在拟南芥[16],与花青素生物合成途径有关。
R2R3 MYB转录因子的调控可以发生在花青素生物合成途径的不同步骤。例如,紫苏中的R2R3 MYB tf (白苏子)控制所有参与花青素生物合成的结构基因的转录[17].MYBA在葡萄(葡萄)专门调节花青素产生的下游基因,但不影响早期的步骤[18].与其他转录因子一样,R2R3 MYB转录因子的调控可以激活或抑制这些基因的表达。例如,MYB tf等拟南芥PAP1,AtPAP2,AtMYB113,AtMYB114[19,20.)、葡萄VvMYB1a[21),而非洲菊混合动力GhMYB10[22积极调节花青素的生物合成。在过表达草莓的转基因植株中观察到类黄酮积累受到抑制FaMYB1[23),金鱼草AmMYB308[24),拟南芥AtMYB4[25),而拟南芥AtMYBL2它编码一个单重复R3-MYB蛋白[26,27].
近年来,有关苹果果实颜色结构和调控基因的研究已被报道。马吕斯×释放有Borkh)。例如,诱导花青素生物合成途径中的大多数结构基因,可显著增加苹果皮中花青素的积累[28].三个转录因子,MdMYB10,MdMYB1,MdMYBA,已在苹果中分离鉴定。29- - - - - -31].在这三个tf中,MdMYB10负责红肉的颜色,而MdMYB1而且MdMYBA控制苹果果皮的红色。这三个MdMYB基因在核苷酸序列上几乎相同,随后有报道称在连锁群9上具有不同的等位基因[32,33].最近,Chagné等人[34的研究表明,苹果果实的红肉皮层表型与增强的表达有关MYB110a的比喻MYB10的功能分析MYB110a在烟草中已经发现它参与了花青素生物合成的上调。苹果果实的颜色差异很大,从黄色、绿色或红色不等,红色色素沉着模式也各不相同。苹果果皮的红色似乎不可能仅仅由一个位点控制。
与花青素生物合成相关的MYB转录因子的分离和表征是理解和操纵果实着色的重要关键一步。在本研究中,一个MYB TF,指定MdMYB3,已通过apple表达序列标签(EST)数据库识别[35以及基于bac的苹果基因组物理图谱[36].的MdMYB3基因在红皮苹果品种外果皮中的表达量高于黄绿皮苹果品种。转基因花卉overexpressingMdMYB3与野生型花相比,积累更高水平的花青素,有更长的花梗和花柱。这些结果强烈表明MdMYB3它不仅调节花青素的生物合成,而且参与花和雌蕊的发育。
结果
序列的特征MdMYB3在苹果
从cv中分离到编码R2R3 MYB的基因组DNA序列。GoldRush。当此序列对拟南芥基因组序列数据库(http://www.arabidopsis.org/Blast/index.jsp),一个最好的打击AtMYB3基因被找到,因此该基因被指定为MdMYB3.的MdMYB3基因由三个外显子和两个内含子以及两个串联重复序列组成(TC)。16(助教)12,在5 '非翻译区(UTR)被指定为SSR1,以及一个二核苷酸(GT)5,在最后一个外显子中被指定为SSR2(图1A).全长cDNAMdMYB3全长1193 bp,编码310个氨基酸和位于核苷酸序列162位的ATG起始密码子和位于1094位的TGA终止密码子。
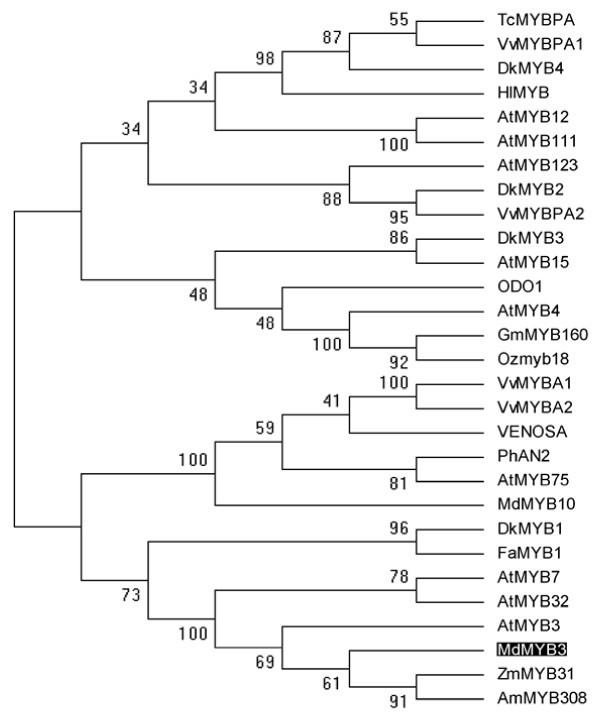
基于不同植物R2R3 MYB编码基因氨基酸序列的系统发育分析表明MdMYB3非常密切相关的拟南芥AtMYB3,AtMYB4,AtMYB7(图2),属于植物MYB转录因子第4亚群R2R3家族[37].MdMYB3和几个先前报道的MYB转录因子之间的氨基酸序列比对,包括拟南芥AtMYB3 AtMYB4 AtMYB7和AtMYB32,草莓属ananasaFaMYB1,玉米ZmMYB31揭示了MdMYB3由R2和R3 dna结合域组成(图3.).一种R/ b型bHLH结合基序([D/E]Lx2(R / K) x3.Lx6Lx3.R,先前由齐默尔曼等人报道。[38],在MdMYB3的R3-DNA结合区域被识别(图3.).此外,MdMYB3包含两个保守主题LIsrGIDPxT/年代HRx我/l(C1-motif)和pdLNLD/ELxiG/年代c端(C2-motif),先前发现于亚群4的R2R3 MYB编码基因中。而两个保守基序的下游c端则表现出较高的散度。MdMYB3有50%的氨基酸序列与AtMYB3相同。
由植物中编码R2R3 MYB基因的氨基酸序列衍生的系统发生树。苹果MdMYB3是阴影的。系统发育分析使用最大简约法进行。分支上的数字对应于1000个重复分析的bootstrap估计,并逐步添加分类群。GenBank的登录编号如下:葡萄VvMYBPA1(BAD18977),葡萄VvMYBPA2(BAD18978),Theobroma可可TcMYBPA(ADD51352),草莓属ananasaFaMYB1 (AF401220),Diospyros柿子DkMYB4(AB503701),忽花布HiMYB(CBI83257),拟南芥AtMYB123(Q9FJA2),DkMYB2(AB503699),拟南芥AtMYB12 (NP_182268),拟南芥AtMYB111 (NP_199744),Diospyros柿子DkMYB3(AB503670),拟南芥AtMYB15(Y14207),Diospyros柿子DkMYB1(AB503698),佩妮x矮牵牛ODO1 (AAV98200),拟南芥AtMYB4(BAA21619),大豆GmMYB160 (ABH02907),栽培稻44612年Ozmyb18 (cad),马吕斯×释放有MdMYB8 (DQ267899),拟南芥AtMYB75 (NP_176057),马吕斯×释放有MdMYB10 (ABB84753),佩妮矮牵牛PhAN2 (AAF66727),玉米ZmMYB31 (NM_001112479),金鱼草majusVENOSA (ABB83828),葡萄VvMYBA1 (BAD18977)葡萄VvMYBA2 (BAD18978)。
用ClustalW2程序比较苹果中MdMYB3和其他植物中R2R3 MYB蛋白的推导氨基酸序列(http://www.ebi.ac.uk/Tools/msa/clustalw2/).apple MdMYB3以粗体突出显示。R2和R3重复被框起来。bHLH基序以灰色表示,C1和C2基序以黑色突出显示。具有100%、80%和60%同一性的保守序列分别用星号、两个点和一个点标记。
的映射MdMYB3苹果基因图谱上的基因
两对引物位于SSR1和SSR2重复序列的两侧MdMYB3设计了基因,并用该基因对F1“Co-op 16”x“Co-op 17”交叉的人口。两个亲本在SSR1和SSR2位点分别为杂合子和纯合子(图1B).选择SSR1位点侧翼引物筛选F1“Co-op 16”x“Co-op 17”杂交的后代。结果,在该子代中鉴定出了三个基因型,分别为“hh”(上带)、“hk”(上带和下带)和“kk”(下带)1C).基于我们最近构建的苹果遗传连锁图谱[36),苹果MdMYB3基因被锚定在15连锁群上(图1D)。
表达谱的MdMYB3在苹果
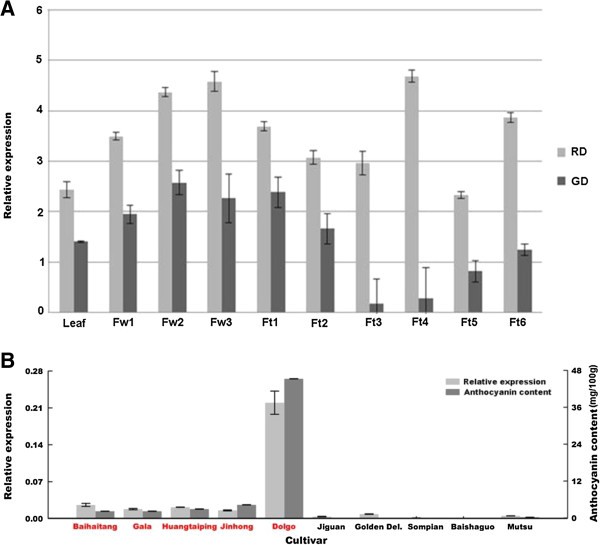
表达谱的MdMYB3在苹果cvs。Red Delicious(红皮水果)和Golden Delicious(黄皮水果)被调查。定量实时(qRT -PCR)分析显示MdMYB3转录本在所有被分析的组织中积累,包括叶、花和果实4A).总的来说,学生的成绩水平MdMYB3所有分析组织的cv均较高。Red Delicious比cv中的要好。金色的美味。的积累MdMYB3“红好吃”花的转录本在整个花的发育过程中不断增加,并在花完全开放时达到峰值MdMYB3“金香”花的开花时间在气球期(花蕾闭合,但仍呈气球状)达到峰值,然后略有下降,直到盛开(花完全开放)。成绩单的MdMYB3在两个cvs的果实中。红鲜和金鲜在授粉初期呈上升趋势,授粉后44天呈轻微下降趋势。随后,转录物的积累MdMYB3在果实中。金香渐增,直至成熟;而cv。红香果在果实IV期达到高峰,在果实成熟时保持较高水平。
在此基础上,选取了10个苹果品种,研究了苹果与苹果之间的关系MdMYB3成熟果实外果皮中花青素积累的基因表达。总的来说,MdMYB3转录本在红皮水果的外果皮中表达量高,但在黄绿皮水果的外果皮中表达量低或不表达(图4B).这些表达谱伴随着这些苹果品种皮层组织中花青素含量的相似谱(图4B).这一发现进一步证实了MdMYB3与苹果花青素积累有关。
的功能分析MdMYB3在烟草
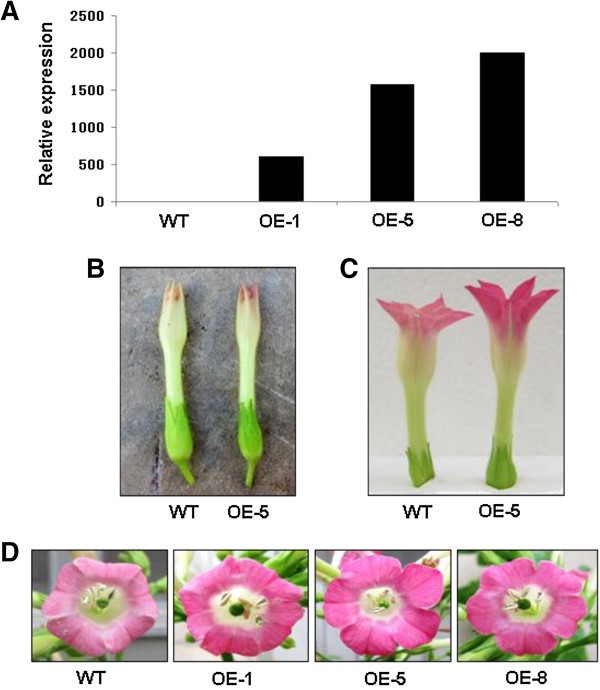
的编码序列MdMYB3在花椰菜花叶病毒(CaMV) 35S的构成启动子驱动下,将其引入烟草中,得到3个T2被命名为OE-1、OE-5和OE-8的转基因株系被生成。转基因株系的花比野生型花颜色更深。例如,OE-5系植物的花冠在花发育的早期阶段就比野生型植物的花冠呈现出粉红色(图5)5B).随后在花期早期,OE-5的花冠几乎是深粉色的,而野生型的花冠是浅粉色的(图)5C). 3个转基因株系的花冠在开花(完全开放的花)前的色素沉着都持续增加,其粉红色明显较野生型植株深,接近紫红色(图)5D)。
LC/MS/MS分析结果表明,转基因烟草花的类黄酮含量高于野生型烟草花(表2)1).例如,转基因花中的花青素含量比野生型花高2- 4倍。此外,转基因花中两种原花青素成分儿茶素和表儿茶素含量分别比野生型花高1.1- 1.4倍和1.3- 4.5倍。这些发现表明MdMYB3参与了烟草花中类黄酮的生物合成调控。
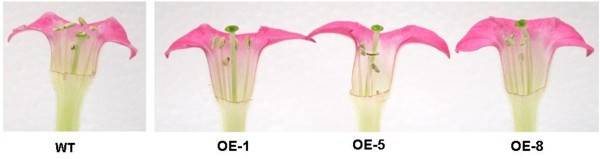
野生型和转基因株系之间除了花的颜色和色素外,在花的长度和雌蕊花柱长度等其他形态性状上也存在差异。例如,在盛开时,转基因株系OE-5的烟草植株的花比野生型植株的花长,平均长8-10毫米(图5C).此外,转基因花的雌蕊花柱长度也比野生型花长,平均长10- 14mm,因此柱头位于花药之上(图)6).
烟草转基因花中苯丙素和类黄酮途径结构基因的表达谱MdMYB3
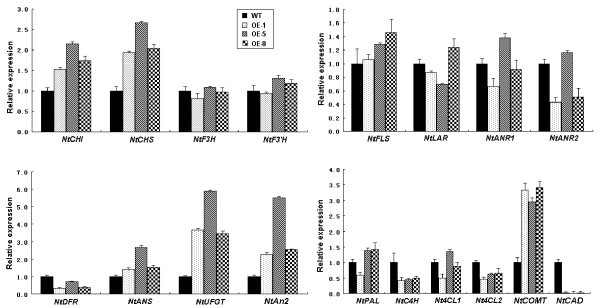
在野生型和转基因烟草植株的花中评估了参与苯丙素和类黄酮生物合成途径的15个结构基因的转录本(图7).在这15个基因中,类黄酮特异性基因包括NtCHI,如果说NtANS,NtUFGT,NtAn2,NtCOMT3个转基因株系的转录本积累模式相似,与野生型花相比,转录本显著上调(图1)7).此外,成绩单NtDFR和三个苯丙素通路基因包括NtC4H,Nt4CL2,NtCAD与野生型植株相比,这三个转基因株系的花中基因表达均表现出相似的下调模式。其余基因在花转基因系中的表达模式均与野生型植株不同。
苯丙素和类黄酮途径基因在黄花中表达分析2携带转基因烟草系MdMYB3使用中存在。归一化调整为苹果的表达肌动蛋白基因和值是三次技术复制的平均值。对3个转基因株系的花中相对于野生型植物花中的转录水平进行了定量分析。缩写对应如下:CHI:查尔酮异构酶;CHS:查耳酮合酶;F3H:黄酮类3-hydroxylase;F3'H:类黄酮3 ' -羟化酶;读者:黄酮醇合成酶;DFR: dihydroflavonol还原酶;政治:leucoanthocyanidin还原酶;答:花青素合成酶; UFGT: glucose transferase; ANR: anthocyanidin reductase; C4H: cinnamate-4-hydroxylase; 4CL: 4-coumaroyl-CoA ligase; PAL: phenylalanine ammonia lyase; COMT: caffeoyl-CoA o-methyltransferase; and CAD: cinnamyl alcohol dehydrogenase.
讨论
多个R2R3转录因子已被报道参与许多植物的花青素生物合成[14].然而,目前还不清楚是否有额外的基因座,除了MdMYB10轨迹。使用第二代重测序,Chagné等[34]已经在两个等位基因周围60kb的区域内识别出33个snpMYB110a而且MYB110b与苹果果实红色果肉(或皮层)色素沉着的调节有关。染色体的位置MYB110a被认为是发生在Maloideae家族苹果进化过程中的全基因组复制事件[34].这是意料之中的,因为苹果物理和遗传图谱的整合已经证明了苹果基因组中存在全基因组和片段复制,并为苹果复杂的多倍体祖先起源提供了进一步的认识。36].本研究发现了一种新的R2R3 MYB转录因子MdMYB3在苹果中已分离到该基因,在烟草花中的异位表达表明该基因与花的颜色、花梗长度和花柱/柱头发育有关。
苹果MdMYB3是否参与花青素生物合成途径的调控
当编码DNA序列时MdMYB3被炸向拟南芥基因组序列数据库(http://www.arabidopsis.org/Blast/index.jsp),检测到MYB tf的第4亚组命中,包括AtMYB3,AtMYB7,AtMYB4e值分别为3e-25、2e-23和1e-21。虽然AtMYB3而且AtMYB7没有被功能描述,AtMYB4据报道,它是木质素生物合成途径的阻遏剂[25].值得注意的是MdMYB3该基因与Lin-Wang等报道的MYB阻遏子不同。[39].虽然,这是最初的预期MdMYB3会有类似的功能AtMYB4,转基因烟草株系花过表达MdMYB3积累了比野生型植物更高水平的花青素,导致颜色色素沉淀增加。花中基因表达谱分析2转基因系进一步揭示了这一点MdMYB3有助于激活NtCHI,如果说,NtANS,NtUFGT,NtAn2基因,和某种程度的压抑有关NtDFR基因。这些结果清楚地表明MdMYB3参与花青素生物合成途径的调控。参与花青素合成激活的亚群4 MYB基因的功能在玉米中也有报道[40].玉米ZmMYB31基因是密切相关的MdMYB3的过度表达拟南芥已报道增强花青素途径基因的转录,包括气,F3H,F3'H,DFR.
最近,烟草中的R2R3 MYB调节剂,NtAn2,已被分离并报道为烟草生殖组织中控制花青素产生的关键基因[41].有趣的是,在这项研究中,表达水平NtAn2在转基因烟草株系花中过度表达MdMYB3显著高于野生型植物(图7).赵等人。[42都报告说拟南芥MYB4含有MYB结合位点基序a (a /C)C(a /T) a (a /C)C。MYB4蛋白可以与自身的MYB结合基序相互作用,从而通过一种自动调节机制调节自身的表达。我们分析了烟草的启动子序列NtAn2(加入基因库。FJ472650),发现MYB结合位点motif AACTAAC位于起始密码子上游-817 ~ -811 bp处。澄清…的作用MdMYB3在花青素生物合成的调控中,MdMYB3蛋白是否能结合于花青素的启动子区域,值得进一步研究NtAn2这可能随后导致转录激活NtAn2.然而,不能排除这种可能性MdMYB3可能正调控类黄酮结构基因的表达CHS而且UFGT.此前有报道称UFGT在红皮肤的简历里。红色美味显著高于黄色皮肤的cv。金冠苹果(43].在此,我们进一步证明了这一点MdMYB3强烈激活的转录UFGT转基因烟草株系花中的基因。需要进一步的研究来确定MdMYB3蛋白是否可以结合到的启动子区域MdUFGT并有助于增加花青素的积累。
在本研究中,异位表达MdMYB3烟草中的花青素积累主要在生殖组织中检测到。在携带苹果的转基因烟草株系中也有类似的发现MdMYBA基因(30.以及转基因拟南芥排队拿苹果MdMYB1[29].相比之下,其他一些花青素相关的转录因子,如葡萄VlMybA1-1,非洲菊GMYB10、西红柿LeANT1,拟南芥AtPAP1能够诱导整个植物的花青素积累[18,19,22,44].此前,有报道称MYB基因能够激活bHLH转录,从而与bHLH形成复合物,促进花青素的积累[45,46].在这项研究中,MdMYB3可能不能作为bHLH激活剂。相反,它可能与组织特异性bHLH结合激活两者的转录NtAn2或其他花青素通路基因,导致花中花青素积累。
在苹果,MdMYB10而且MdMYB1强烈上调大多数类黄酮结构基因,包括MdCHI,MdCHS,MdF3H,MdLDOX,MdDFR,MdUFGT[29,31].相比之下,在这项研究中,MdMYB3激活的转录NtCHI,如果说,NtUFGT基因在烟草花中,但它抑制了转录NtDFR基因。此外,结构基因表达水平如NtF3H,NtF3'H,NtFLS,NtLDOX在本研究中,转基因烟草的花中检测到的平均含量与野生型烟草的花中检测到的含量相似。这些发现表明MdMYB3在调控花青素的生物合成途径上可能与植物不同MdMYB10而且MdMYB1.这与系统发育分析结果一致MdMYB3分开MdMYB10/MdMYB1.此外,MdMYB3位于第15染色体上,在红皮苹果品种的皮层中表达量高于黄绿皮苹果品种。因此,似乎MYB TFs不是MdMYB10/MdMYB1位于第9染色体上,可能也参与了苹果红皮肤颜色的调节。
系统发育分析表明MdMYB3有密切的关系拟南芥AtMYB12而且AtMYB111。这两个拟南芥MYB转录因子正调控的表达CHS,FLS的,F3H基因,因此负责黄酮醇的积累[47].同样在这项研究中,MdMYB3激活了如果说而且NtFLS在转基因烟草的花中。总的来说,转基因烟草植株花中山奈酚和槲皮素的含量高于野生型植株(表2)1).因此,苹果似乎MdMYB3基因也参与了黄酮醇积累的正向调控。有趣的是,拟南芥AtMYB12不包含类似R/ b的bHLH结合基序,因此其功能独立于bHLH辅助因子[48].然而,MdMYB3具有类似于R/ b的bHLH结合基基,这表明它可以与bHLH形成配合物来调节花青素的生物合成。因此,苹果很可能MdMYB3基因已经从功能上脱离了拟南芥AtMYB12.
苹果的功能分化MdMYB3从其密切相关的基因
的MdMYB3吉恩和草莓簇拥在一起FaMYB1(图2).异位表达FaMYB1在烟草中抑制花青素和黄酮醇的积累,导致花色素沉着的强烈减少[23].过度的FaMYB1在烟草花中下调了晚期类黄酮生物合成基因的转录。相比之下,MdMYB3本研究中基因强烈上调了花青素和黄酮醇合成相关基因的表达,包括CHS,气,UFGT,答,FLS的基因。FaMYB1含有一个保守的c2基序pdLNLD/ELxiG/年代c端,负责抑制转录[25].c2基序也存在于MdMYB3的c端,但其第一个氨基酸序列已由Phe变为Ser(图3.).目前尚不清楚是否单一氨基酸取代导致了MdMYB3和FaMYB1之间观察到的功能差异。
苹果MdMYB3基因也与玉米密切相关ZmMYB31基因和拟南芥AtMYB32而且AtMYB4基因.这后三个基因已被报道作为木质素生物合成途径的阻遏因子。例如,AtMYB4而且AtMYB32下调表达C4H而且COMT的基因和被认为是木质素生物合成的阻遏因子[25,49].很可能ZmMYB31抑制转录的COMT的,F5H,摘要:,4 cl基因,导致木质素生物合成水平降低[40].因此,人们认为MdMYB3和与其密切相关的基因具有相似的功能。不出所料,过度表达MdMYB3烟草花中显著抑制木质素生物合成途径相关基因的转录C4H而且4氯;此外,它还严重抑制了计算机辅助设计参与单木质酚生物合成的基因(图7).然而,的表达NtCOMT在过度表达转基因系的花中MdMYB3显著高于野生型植物(图7).这些结果表明MdMYB3可能从4亚群MYB基因中分离出来,比如AtMYB4而且AtMYB32.
苹果MdMYB3与花雌蕊花柱发育的调控有关吗
有报道称AtMYB32而且AtMYB4可通过改变苯丙类途径的通量,影响花粉壁的组成来影响花粉发育[49].例如,一个AtMYB32插入突变体的拟南芥显示异常花粉粒部分或完全缺乏细胞内容物[49].在本研究中,亚群4 R2R3家族也参与了生殖组织的发育。表达转基因烟草系MdMYB3与野生型花相比,有较长的花梗和较长的花柱。特别有趣的是那些拉长的花柱,因为它们导致柱头位于花的花药位置。这表明,MdMYB3也参与雌蕊发育的调控。类似的观察结果以前曾报道过金鱼草AmMYB308的同义词MdMYB3[24].当AmMYB308在转基因烟草中过度表达,已观察到细长的花柱,导致柱头突出,并有助于罕见的自花授粉[24].然而,与本研究中注意到的形态学观察不同,转基因烟草的花过表达AmMYB308与野生型烟草相比,它们的体积更小,花青素含量更低。
综合来看,这项研究证明了这一点MdMYB3在植物生长发育中起着重要而多重的作用。通过对转基因烟草株系的功能分析,发现过表达MdMYB3烟草花中增加花青素的积累,增加花梗的长度,更重要的是花柱的长度。
结论
在本研究中,一种新的R2R3 MYB转录因子(TF)MdMYB3在苹果基因组中发现了参与花青素生物合成途径的基因。该转录因子已被鉴定并映射到苹果遗传图谱的连锁群lg15上。该转录因子的转录本可在叶、花和果实中检测到;然而,在红皮苹果外皮中,MdMYB3转录本高于黄绿皮苹果外皮,从而调节苹果果皮中花青素的积累。该转运因子在烟草中的异位表达表明,它通过激活NtAn2的转录,从而诱导多个类黄酮生物合成通路基因,具有调控作用。更有趣的是,这个转录因子还通过改变花的雌蕊长度参与花的发育。
方法
植物材料
采集苹果树不同发育阶段的叶片、花朵和果实。红色美味和金色美味。此外,水果的cvs。白海棠、嘎拉、黄太平、金红、道哥、鸡冠、金鲜、Sompain、白沙果、Mutsu等也在成熟时采集。
苹果MdMYB3基因基因组DNA的分离
拟南芥AtMYB3(AT1G22640)攻击我们的apple EST数据库(http://titan.biotec.uiuc.edu/cgi-bin/ESTWebsite/estima_start?seqSet=apple),以及一个同源EST组合(accession no。Apple_0223.1923.C1.Contig3505)被发现。对NCBI中apple EST数据库中的EST序列进行blast分析,得到一个EST序列(GenBank登录号为;包含R2和R3域的CO868594被恢复。根据EST序列设计了一对引物(5 ' -GGGAGAGCACCTTGTTGTGAG-3 ' /5 ' -GATCTCGTTGTCGGTTCTTCC-3 '),并将其用于cv的筛选BAC文库。GoldRush使用基于pcr的筛选方法,如Xu等人先前描述的。[50].反应包括94°C 3分钟,然后94°C 35 s, 55°C 30 s, 72°C 60 s, 33个循环,最后在72°C延长8分钟。随机选取一个BAC阳性克隆进行测序,以恢复苹果中编码MdMYB3的基因组序列。
苹果MdMYB3基因cDNA序列的恢复
使用FGENESH-M程序分析编码MdMYB3的基因组序列(http://www.softberry.com),并预测一个开放阅读框(ORF)。根据预测的ORF设计了一对引物(5 ' - ggagcaccttgttggtgag -3 ' /5 ' - actgacaattgctgcatgc -3 '),用于从cv叶片中扩增cDNA。GoldRush。对PCR产物进行测序,得到一个大小为872 bp的cDNA片段。cDNA片段序列与NCBI EST数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并鉴定出包含完整编码区的cDNA。随后,设计了一对引物(5 ' - ctgatccagaagaaaacagatg -3 ' /5 ' -TGGATTCAAAGCAGGTCTGTG-3 ')来扩增全编码区MdMYB3从简历。GoldRush进一步验证预测的ORF。
表达载体构建与烟草转化
一对引物(5 ' -TGACTCTAGACTGATCCAGAAGAAGAAAC-3 atac / 5GAGCTCTGGATTCAA agag -3 ')用于放大的编码区MdMYB3使用校对DNA聚合酶铂®可以(Invitrogen)按照制造商的说明。包含正向和反向引物Xba我和囊I限制部位分别在5 '端。根据制造商的协议,使用Zero Blunt®PCR克隆试剂盒(Invitrogen)将钝端PCR产物连接到PCR®-Blunt载体上。表达载体经直接测序确定。的编码序列MdMYB3被引入到pBI121克隆载体中,构建物被用于农杆菌属烟草的-介导转化(烟草简历。小哈瓦那SR1)由Han等人描述。[43].来自三个经证实的独立转基因T0株系的T1种子过表达MdMYB3携带单个转基因拷贝,包括OE-1、OE-5和OE-8,自交产生T2植株。
在温室中种植野生型和T2转基因烟草植株,采集盛花(完全开放的花)进行基因表达分析和类黄酮化合物含量分析。采集后,所有样品在液氮中冷冻,并在-80°C保存,直到需要。
的映射MdMYB3基因连接到苹果连锁图上
一个SSR标记在一个5 '的非翻译区域MdMYB3是用来筛选F1从“Co-op 16”和“Co-op 17”的杂交中衍生出的人口图谱。SSR标记引物序列为:正向5 ' - tcacctcttcaaacaacacac -3 '和反向5 ' - tgctctccccatctgttctt -3 '。PCR产物在2% (w/v)隐喻凝胶上检测。根据Han等人的说法,链接映射是使用JoinMap 4.0版本构建的。[36].
实时聚合酶链反应分析
根据制造商的说明,使用RNAqueous Kit (Ambion)从叶片和花组织中提取总RNA。根据Gasic等人描述的协议,从水果组织中分离RNA。[51].每个组织的总RNA (2 μg)处理DNaseI (Invitrogen),用于cDNA合成。第一链cDNA合成使用Oligo (dT)引物,使用SuperScript III RT kit (Invitrogen),按照制造商的说明进行。特定的引物MdMYB3每个黄酮相关基因的设计均采用bio Workbench 3.2版本(http://workbench.sdsc.edu).用于设计引物的特异引物序列和基因登录号已在附加文件中列出1S1:表。
SYBR Green real-time PCR检测总体积为25 μl,包括12.5 μl的2× SYBR Green I Master Mix (Applied Biosystems)、0.2 μM(每个)特异性引物和100 ng的模板cDNA。扩增程序为95°C 10 min的1个循环,随后95°C 15 s, 60°C 1 min的40个循环。每个循环的最后一步检测荧光产物。扩增后,分析PCR产物的融化温度,以确定PCR产物的特异性。在60°C到90°C范围内,以0.5°C/秒的速度缓慢加热,同时持续监测荧光信号,得到熔化曲线。没有cDNA模板的阴性对照与每次分析一起进行,以评估整体特异性。在7300实时PCR系统(Applied Biosystems)的96孔板中进行扩增。所有实验样品均重复运行。一个苹果肌动蛋白基因作为本构对照。周期阈值之间的差异(Ct)和靶基因的肌动蛋白用基因得到目标基因的相对转录水平,计算为2 exp-(Ct目标-Ct肌动蛋白).
类黄酮的分析
花青素和黄酮醇提取50毫克细细研磨的组织1毫升1%盐酸/甲醇(v / v),在室温下在黑暗中,连续摇晃1 h和离心机13000 rpm 15分钟。100μL的整除的上层清液被转移到一个新的管,和acid-hydrolyzed通过添加30μL盐酸3 N,在70°C 1 h和孵化热循环(热Hybaid MBS 0.25秒,热科学)。原花青素(PAs)用1ml 70% (v/v)丙酮含0.1% (w/v)抗坏血酸盐提取,并在室温下黑暗中孵育24小时,如Takos等人所述[29].提取液在室温下13000转离心15分钟,将清上清转移到新的管中。取200 μL浸膏,35℃干燥,100 μL 1% (v/v) hcl -甲醇和100 μL 200 mM醋酸钠(pH 7.5)重悬。
采用LC/MS/MS和山奈酚、槲皮素、花青素、儿茶素和表儿茶素(Sigma)的商业标准一起测定黄酮含量。LC/MS/MS分析在配有1200 Agilent HPLC分析仪(1.5.1版本,Applied biosystems)的5500 QTRAP质谱分析仪(AB Sciex)上进行,用于数据采集和处理。采用Phenomenex色谱柱(3 μ C6-Phenly 11A, 4.6 × 50 mm)进行分离。流速为0.3 mL/min,流动相为A(0.1%甲酸在H2O)和B(0.1%甲酸在乙腈中)。自动进样器保持在5℃。儿茶素和表儿茶素的梯度为:0 min, 90% A;10分钟,50% A;13-18分钟,0% A;18.1 ~ 25 min, 90% a。注射量为20 μl。花青素、山奈酚和槲皮素的梯度为:0 min, 70% A;7-12.5分钟,0% A;注射13 ~ 20 min, 70% a。注射量为10 μL。质谱计采用正电喷雾电离操作。 Multiple reaction monitoring (MRM) was used to quantify catechin and epicatechin (m/z 291.0-- > 139.2), cyanidin (m/z 287.2-- > 213.2), kaempferol (m/z 287.1-- > 153.2), and quercetin (m/z 303.1-- > 153.1). The electrospray voltage was set to 5500 V; the heater was set at 600°C; the curtain gas was at 35 psi; and GS1 and GS2 were both at 60 psi. Analysis of each sample was repeated three times using three biological replicates.
缩写
- AN2:
-
Anthocyandin
- 答:
-
花青素合成酶
- 2 bhlh:
-
基本helix-loop-helix
- 气:
-
查耳酮黄烷酮异构酶
- CHS:
-
查耳酮合酶
- 4 cl:
-
4-Coumarate:辅酶a连接酶
- C4H:
-
肉桂酸4-hydroxylase
- COMT的:
-
Catechol-o-methyltransferase
- 衣冠楚楚的:
-
几天后授粉
- DFR:
-
Dihydroflavonol还原酶
- MYB:
-
成髓细胞
- PAP-1:
-
花青素色素的生产
- 苏维埃社会主义共和国:
-
简单序列重复
- TF:
-
转录因子
- UFGT:
-
Udp葡萄糖类黄酮3-o-葡萄糖转移酶。
参考文献
- 1.
King MC, Cliff MA:从新的和成熟的苹果品种的视觉属性预测消费者喜好的模型的开发。中国生物医学工程学报,2002,29(5):563 - 566。
- 2.
L:为什么白花这么多,白花这么少?植物生态学报,1998,16(1):1 - 6。
- 3.
谢弗·HM,谢弗·V,利维·DJ:植物和动物之间的相互作用如何标志着交流的新见解。生态学报,2004,29(4):369 - 369。10.1016 / j.tree.2004.08.003。
- 4.
Nijveldt RJ, NoodE V, Van Hoorn DEC, Boelens PG, Van Norren K, Van Leeuwen PAM:黄酮:可能的作用机制和潜在的应用综述。中华临床医学杂志,2004,24(4):418- 424。
- 5.
Boyer J, Liu RH:苹果植物化学物质及其健康益处。中国科学(d辑:自然科学版)。10.1186 / 1475-2891-3-1。
- 6.
Ruxton CHS, Gardner EJ, Walker D:纯果蔬汁也能预防癌症和心血管疾病吗?对证据的审查。食品科学与营养学报,2006,29(5):559 - 561。10.1080 / 09637480600858134。
- 7.
Gerhauser C:苹果、苹果汁和苹果成分的癌症化学预防潜力。中国生物医学工程学报,2008,29(4):447 - 447。10.1055 / s - 0028 - 1088300。
- 8.
Prasad S, Phromnoi K, Yadav VR, Chaturvedi MM, Aggarwal BB:黄酮类化合物靶向炎症途径预防和治疗癌症。中国生物医学工程学报,2010,38(4):447 - 447。10.1055 / s - 0030 - 1250111。
- 9.
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的一个丰富多彩的模型。植物生理学报,2001,27(4):489 - 489。10.1104 / pp.126.2.485。
- 10.
田中Y,佐佐木N,大谷A:植物色素的生物合成:花青素,β -甜菜碱和类胡萝卜素。植物学报,2008,32(4):356 - 356。10.1111 / j.1365 - 313 x.2008.03447.x。
- 11.
霍尔顿TA,康沃尔EC:花青素生物合成的遗传学和生物化学。植物科学学报,1997,15(4):381 - 381。
- 12.
Grotewold E:植物色素的遗传学和生物化学。植物生态学报,2006,29(4):761-780。10.1146 / annurev.arplant.57.032905.105248。
- 13.
strack R, Werber M, Weisshaar B: R2R3-MYB基因家族拟南芥.植物生态学报,2001,27(4):447-456。10.1016 / s1369 - 5266(00) 00199 - 0。
- 14.
Allan AC, Hellens RP, Laing WA:使水果着色的MYB转录因子。植物学报,2008,13:99-102。10.1016 / j.tplants.2007.11.012。
- 15.
Jin H, Martin C:植物myb基因家族的多功能性和多样性。植物生物学杂志,1999,41:577-585。10.1023 /: 1006319732410。
- 16.
Feller A, MacHemer K, Braun EL, Grotewold E:植物MYB和bHLH转录因子的进化和比较分析。植物学报,2011,26(4):489 - 489。10.1111 / j.1365 - 313 x.2010.04459.x。
- 17.
Saito K, Yamazaki M:花青素生物合成后期的生物化学和分子生物学:以紫苏为模式植物为例。植物学报,2002,32(4):359 - 361。10.1046 / j.1469-8137.2002.00440.x。
- 18.
小林S、石丸M、平冈K、本田C:京穗葡萄myb相关基因(葡萄属labruscana)调节花青素的生物合成。植物生态学报,2004,25(4):366 - 366。10.1007 / s00425 - 002 - 0830 - 5。
- 19.
Borevitz JO, Xia YJ, Blount J, Dixon RA, Lamb C:激活标记鉴定了一种苯丙类生物合成的保守MYB调控因子。植物学报,2000,12:2383-2393。
- 20.
张丽娟,赵敏,李伟,张丽娟:拟南芥幼苗中TTG1/bHLH/Myb转录复合体对花青素生物合成途径的调控。植物学报,2008,32(4):359 - 359。10.1111 / j.1365 - 313 x.2007.03373.x。
- 21.
Kobayashi S, Goto-Yamamoto N, Hirochika H:葡萄皮肤颜色的逆转录转座子诱导突变。科学通报,2004,30:982-10.1126/ Science. 1095011。
- 22.
黄文华,黄文华,黄文华,黄文华,黄文华,黄文华。植物中花青素合成的活性研究非洲菊矮牵牛(菊科)表明保守的蛋白质-蛋白质和蛋白质-启动子之间的相互作用,古老的分化的单子叶和单子叶。植物生理学报,2003,31(3):381 - 381。10.1104 / pp.103.026039。
- 23.
Aharoni A, De Vos CH, Wein M, Sun Z, Greco R, Kroon A, Mol JN, O 'Connell AP:草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇积累。植物学报,2001,28:319-332。10.1046 / j.1365 - 313 x.2001.01154.x。
- 24.
Tamagnone L, Merida A, Parr A, Mackay S, Culianez-Macia FA, Roberts K, Martin C:抗鼻草中的AmMYB308和AmMYB330转录因子调控转基因烟草中苯丙素和木质素的生物合成。植物学报,1998,10:135-154。
- 25.
Jin H, Cominelli E, Bailey P, Parr A, Mehrtens F, Jones J, Tonelli C, Weisshaar B, Martin C: AtMYB4转录抑制控制拟南芥紫外线防护防晒霜的产生。中华医学杂志,2000,19:6150-6161。10.1093 / emboj / 19.22.6150。
- 26.
Dubos C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L: MYB转录因子拟南芥.植物科学进展,2010,15:573-581。10.1016 / j.tplants.2010.06.005。
- 27.
Matsui K, Umemura Y, Ohme-Takagi M: AtMYBL2是一种具有单一MYB结构域的蛋白质,是拟南芥花青素生物合成的负调控因子。植物学报,2008,38(4):394 - 394。10.1111 / j.1365 - 313 x.2008.03565.x。
- 28.
Honda C、Kotoda N、和田M、近藤S、小林S、Soejima J、Zhang Z、Tsuda T、Moriguchi T:花青素生物合成基因在苹果皮染红过程中协调表达。植物生理与生物化学,2002,40:955-962。10.1016 / s0981 - 9428(02) 01454 - 7。
- 29.
Takos AM, Jaffe FW, Jacob SR, Bogs J, Robinson SP, Walker AR:光诱导下MYB基因表达调节红苹果花青素生物合成。植物生理学报,2006,32(4):366 - 366。10.1104 / pp.106.088104。
- 30.
Ban Y, Honda C, Hatsuyama Y, Igarashi M, Bessho H, Moriguchi T:苹果皮肤发生红色发育的关键调控因子MYB转录因子基因的分离与功能分析植物生理学报,2007,38(4):378 - 378。10.1093 /卡式肺囊虫肺炎/ pcm066。
- 31.
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC:苹果果实的红色是由于MYB转录因子的活性,MdMYB10.植物学报,2007,29(4):427 -427。10.1111 / j.1365 - 313 x.2006.02964.x。
- 32.
Chagné D, Carlisle CM, Blond C, Volz RK, Whitworth CJ, Oraguzie NC, Crowhurst RN, Allan AC, Espley RV, Hellens RP, Gardiner SE:绘制候选基因(MdMYB10),苹果的果肉和叶子呈红色。中国生物医学工程学报,2007,29(3):366 - 366。
- 33.
Lin-Wang K, Bolitho K, Grafton K, Kortstee A, Karunairetnam S, McGhie TK, Espley RV, Hellens RP, Allan AC:与蔷薇科花青素生物合成途径调控相关的R2R3 MYB转录因子植物生物学杂志,2010,10:50-10.1186/1471-2229-10-50。
- 34.
Chagné D, Lin-Wang K, Volz RK, How NM, Rouse S, Brebdolise S, Carlisle CM, Kumar S, De Silva N, Micheletti D, McGhie T, Crowhurst RN, Storey RD, Velasco R, Hellens RP, Gardiner SE, Allan AC:一个古老的苹果MYB转录因子复制负责新的红色果瓤表型。植物生理学报,2013,29(4):379 - 379。10.1104 / pp.112.206771。
- 35.
Gasic K, Gonzalez DO, thimapuram J, Liu L, Malnoy M, Gong G, Han Y, Vodkin LO, Aldwinckle HS, Carroll NJ, Orvis KS, Goldsbrough P, Clifton S, Pape D, Fulton L, Martin J, Theising B, Wisniewski ME, Fazio G, Feltus FA, Korban SS:苹果大表达序列标签集合的比较分析与功能注释植物基因组学报,2009,2:23-38。10.3835 / plantgenome2008.11.0014。
- 36.
韩勇,郑东,Vimolmangkang S, Khan MA, Beever JE, Korban SS:苹果物理和遗传图谱的整合证实了苹果基因组的全基因组和片段复制。中国生物医学工程学报,2011,29(5):533 - 536。10.1093 / jxb / err215。
- 37.
Kranz HD, Denekamp M, Greco R, Jin H, Leyva A, Meissner RC, Petroni K, Urzainqui A, Bevan M, Martin C, Smeekens S, Tonelli C, Paz-Ares J, Weisshaar B:研究r2rd - myb基因家族成员的功能特征拟南芥芥。植物学报,1998,16(3):366 - 366。10.1046 / j.1365 - 313 x.1998.00278.x。
- 38.
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF:综合识别拟南芥MYB转录因子与R/ b样BHLH蛋白相互作用。植物学报,2004,30(4):326 - 326。10.1111 / j.1365 - 313 x.2004.02183.x。
- 39.
Ling-Wang K, Micheletti D, Palmer J, Volz R, Espley R, Hellens RP, Chagne D, Rowan DD, Troggio M, Iglesias I, Allan AC:高温通过调节花青素调节复合体降低苹果果实颜色。植物细胞学报,2011,34:1176-1190。10.1111 / j.1365-3040.2011.02316.x。
- 40.
Fornalé S, Shi X, Chai C, Encina A, Irar S, Capellades M, Fuguet E, Torres JL, Rovira P, Puigdomènech P, Rigau J, Grotewold E, Gray J, Caparrós-Ruiz D: ZmMYB31直接抑制玉米木素基因,重定向苯丙类代谢通量。植物学报,2010,32(4):366 - 366。10.1111 / j.1365 - 313 x.2010.04363.x。
- 41.
张丽娟,张丽娟,张丽娟,张丽娟,张丽娟。烟草中R2R3型MYB调控因子的分离及其功能分析。植物学报,2010,31:1061-1076。10.1007 / s00425 - 010 - 1108 - y。
- 42.
赵娟,张伟,赵颖,龚旭,郭亮,朱刚,王旭,龚铮,Schumaker KS,郭颖:SAD2是拟南芥UV-B反应中必需的一种β样输入蛋白,通过介导MYB4核转运。植物学报,2007,29(3):369 - 369。10.1105 / tpc.106.048900。
- 43.
Han Y, Vimolmangkang S, Soria-Guerra RE, Rosales-Mendoza S, Zheng D, Lygin AV, Korban SS:氮胁迫下拟南芥tt7突变体中苹果f3’h基因异位表达与花青素积累有关。植物生理学报,2011,29(4):366 - 366。
- 44.
Mathews H, Clendennen SK, Caldwell CG, Liu XL, Connors K, Matheis N, Schuster DK, Menasco DJ, Wagoner W, Lightner J, Wagner DR:激活标记在番茄中识别花青素生物合成、修饰和运输的转录调控因子。植物学报,2003,15:1689-1703。10.1105 / tpc.012963。
- 45.
黄酮类化合物:生物化学通路的调节和进化的彩色模型。植物科学进展,2005,10:236-242。10.1016 / j.tplants.2005.03.002。
- 46.
Czemmel S, strackr, Weisshaar B, Cordon N, Harris NN, Walker AR, Robinson SP, Bogs J:葡萄R2R3-MYB转录因子VvMYBF1在葡萄果实发育过程中调控黄酮醇合成。植物生理学报,2009,29(4):359 - 359。10.1104 / pp.109.142059。
- 47.
strake R、Ishihara H、Huep G、Barsch A、Mehrtens F、Niehaus K、Weisshaar B:密切相关的r2p3 - myb转录因子的差异调控控制黄酮醇在不同部位的积累拟南芥幼苗。植物学报,2007,30(5):366 - 366。10.1111 / j.1365 - 313 x.2007.03078.x。
- 48.
Mehrtens F, Kranz H, Bednarek P, Weisshaar B:拟南芥转录因子MYB12是一种黄酮醇特异性苯丙类生物合成调控因子。植物生理学报,2005,38(4):394 - 394。10.1104 / pp.104.058032。
- 49.
Preston J, Wheeler J, Heazlewood J, Li SF, Parish RW: AtMYB32在花粉发育过程中是必需的拟南芥.植物学报,2004,29(4):369 - 371。10.1111 / j.1365 - 313 x.2004.02280.x。
- 50.
徐明民,Korban SS,宋建强,蒋建明:苹果品种GoldRush细菌人工染色体文库的构建。植物学报,2002,595:103-112。
- 51.
Gasic K, Hernandez A, Korban SS:从富含多酚和多糖的不同苹果组织中提取RNA,构建cDNA文库。植物生物学杂志,2004,22:437a-437g。10.1007 / BF02772687。
确认
感谢韩振海教授和张新忠教授提供的苹果。该项目由美国农业部- nifa - scri赠款AG 2009-51181-06023提供资金支持。此外,经费由第1号研究项目办公室提供。65-325,国家863计划资助项目(2011AA0020401),中国科学院国际高级科学家客座教授资助项目(2011T2S25)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
SV:实验概念化,序列表征,映射,功能分析MdMYB3,类黄酮的分析,写的手稿;YH:实验概念化、制图和对手稿的批判性修改;GW:苹果多基因型表达分析实验;SSK:实验概念化;对稿件进行批判性修改。所有作者阅读并批准了最终稿件。
Sornkanok Vimolmangkang、韩月鹏对这项工作也有同样的贡献。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原始作品的名称正确。创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
文末芒康、韩、杨、魏、桂。et al。苹果MYB转录因子,MdMYB3,参与调控花青素的生物合成和花的发育。BMC植物杂志13日,176(2013)。https://doi.org/10.1186/1471-2229-13-176
收到了:
接受:
发表:
关键字
- 花青素
- 苹果
- MYB转录因子
- 马吕斯×有明显
- 类黄酮
- 生殖器官