摘要
背景
蔗糖转运蛋白(SUTs)在调节同化物从源组织到汇组织的转运中起着重要作用。鉴定和表征新的SUT在经济上重要的作物如小麦中的S提供了它们在决定种子产量中的作用的见解。然而,到目前为止,只有一个SUT小麦的赤蛋白已被报道并进行了功能鉴定。本研究报道了一种新的细菌的分离和鉴定SUT,指定为TaSUT2,及其同源物(TaSUT2A,TaSUT2B和TaSUT2D)在六倍体小麦(小麦l .)。
结果
TaSUT2A和TaSUT2B每个基因编码一种含有506个氨基酸的蛋白质,而TaSUT2D编码一种含有508个氨基酸的蛋白质。预测这些蛋白的分子质量为~ 54 kDA。对这三个同源物的氨基酸序列进行拓扑分析发现,它们含有12个跨膜螺旋,这被描述为包括所有已知植物SUTs的糖苷-戊糖-己糖醛酸阳离子同向转运体家族的独特特征,以及一个似乎定位于蔗糖结合位点并与之构象相关的组氨酸残基。酵母SUSY7 /ura3用TaSUT2A,TaSUT2B和TaSUT2D能够吸收蔗糖并在含蔗糖作为唯一碳源的培养基上生长;然而,我们对植物细胞的亚细胞定位研究显示TaSUT2定位于细胞质。的表达式TaSUT2在源中检测到,包括旗叶叶片、旗叶鞘、花梗、颖片、古叶和外稃以及汇(种子)组织。小麦3个基因组对总表达量的相对贡献TaSUT2随着组织和发育阶段的不同而不同。在细胞层面上,TaSUT2主要表达于发育中的种子的叶脉和叶片的叶肉细胞。
结论
本研究证实TaSUT2是一种新的小麦SUT蛋白。鉴于TaSUT2定位于细胞质,蔗糖暂时储存在源组织和汇组织的液泡中,我们的数据表明TaSUT2参与了蔗糖的细胞内分配,特别是液泡和细胞质之间的分配。
背景
蔗糖是植物中糖的主要运输形式。淀粉是谷类作物产量的主要决定因素,它在种子中的沉积依赖于这种糖分子从源组织通过韧皮部的供应。韧皮部由筛元(SE)和伴细胞(CC)组成,它们通过称为胞间连丝的许多细胞间连接连接在一起,形成SE-CC复合物[1]。SE负责远距离运输蔗糖和其他有机物质,而cc则为SE提供蛋白质和能量[2,3.]。韧皮部蔗糖的装载和卸载是通过共质体和外质体进行的。共塑转运涉及蔗糖通过胞间连丝在细胞间的转运,而胞外转运涉及蔗糖通过蔗糖转运蛋白(SUT)在细胞膜上的主动转运[3.,4],主要发生在没有胞间连系的情况下。编码SUTs的基因已经从许多植物物种中被鉴定出来,包括水稻等谷类作物(栽培稻) [5大麦(大麦芽) [6],玉米(玉米) [7]和小麦(小麦) [8],形成小的基因家族[9]。迄今为止鉴定的所有植物SUTs都是糖苷-五糖-己糖醛酸(GPH)阳离子同调子家族的成员,该家族是主要促进剂超家族的一部分,其特征是12个跨膜跨越螺旋[10,11]。此外,植物SUTs的第一个细胞外环含有组氨酸残基,如拟南芥SUT1的His-65,作为焦碳酸二乙酯(DEPC)介导的蔗糖转运活性抑制的靶标[12]。结果表明,该残基是受DEPC抑制反应保护的底物。这一点以及通过用其他氨基酸取代组氨酸而不影响SUTs的转运活性来消除SUTs对DEPC的敏感性的能力表明,DEPC敏感的组氨酸残基位于蔗糖结合位点或与蔗糖结合构象。
的时空表达分析SUT谷类作物中S的研究为了解其在种子发育过程中的生理作用提供了新的思路。例如,SUT1在玉米生殖生长过程中,玉米的叶片、叶鞘、茎、穗皮和花梗高度表达;的表达式ZmSUT1叶片中光同化物质的含量随着光同化物质含量的增加而增加,这反映了其在韧皮部负荷中的作用[7,13]。与这一观察结果一致,韧皮部负荷受损zmsut1突变体引起叶片中碳水化合物的积累,导致植物变绿、衰老和生长减慢[14]。这三个TaSUT1同源物位于小麦A、B和D基因组的4号染色体上,在旗状叶片、叶鞘和节间中表达水平相似[8],这表明它们在韧皮部蔗糖负荷中起着同样的作用。的转录丰度TaSUT1在这些组织中,抽穗前转录量最高,开花后立即下降,而在发育中的种子中转录量明显增加。一项用共塑荧光素示踪剂的研究表明,小麦旗叶SE-CC复合体缺乏胞间连丝连接[15],支持这一假设TaSUT1参与韧皮部蔗糖的装载。此外,所有SUT大米的S [5,16和两个已知的SUT大麦[6]显示在源叶中表达。先前的研究也表明,小麦小花的非叶面组织,包括颖片、外稃和旧叶,具有光合作用能力,并为小麦种子贡献了10%至44%的光同化物质[17,18]。与此一致的是TaSUT1在抽穗前后的麦穗颖片中均有检测到,尽管其含量低于旗叶叶片和鞘中的含量[8],这表明它在穗状花序中产生的蔗糖的韧皮部负荷中起作用。
谷类作物的叶鞘将叶片与茎节连接起来,从而形成韧皮部导管,作为光同化物远距离运输的途径[15]。与节间一起,它们也作为种子灌浆早期产生的多余碳水化合物的临时储存,以水溶性碳水化合物的形式,主要是果聚糖。在小麦灌浆过程中,约有50%的光同化物质在重新动员之前暂时储存在叶鞘和节间,此时来自叶片的光同化物质供应不足以满足汇的需求[19]。在再动员过程中,蔗糖在韧皮部的重新装载中起着重要的作用OsSUT1和TaSUT1由于它们的转录本分别存在于水稻和小麦的叶鞘和茎组织中[5,15,16]。假设在小麦节间,羧基荧光素染料以共质体的方式从韧皮部移出[15的存在TaSUT1该组织的转录本也表明其在回收泄漏到韧皮部质中的蔗糖方面的作用,从而提供了有效的光同化转运机制。
之前的研究表明SUT1在水稻、大麦和小麦等不同谷类作物的发育种子中高度表达。在大米、SUT1在种子灌浆前期和后期表达水平相近[20.]。的反义表达OsSUT1对旗叶的光合作用无影响,但导致种子灌浆受损,发芽迟缓[21]。的SUT1而大麦在种子发育中期表达量最高。会议记录OsSUT1和HvSUT1主要分布在母体的珠心突起、糊粉组织和分离胚乳腔和胚乳的子代转移细胞中[6,20.]。此外,研究表明抗ossut1抗体可与发育中的小麦种子的核珠突起和糊粉组织的质膜结合[22]。由于谷类种子的母、子组织缺乏共生联系;这些结果表明SUT1在韧皮部后蔗糖从母体到子代的转运过程中发挥了重要作用。
植物SUTs被分为5个亚科,SUT1至SUT5 [23]。基于它们在氨基酸水平上的显著相似性,OsSUT2和HvSUT2被分配到su4亚家族,而不是单子叶特异性的SUT3或SUT5亚家族[9],并且发现这些基因在来源组织和吸收组织中都有表达[6,24]。的表达式HvSUT2在发育过程中,种子在早期和后期相对占优势[6,而OsSUT2只局限于早期阶段[24]。在培育大麦种子的过程中HvSUT2已经被证明有几乎相似的细胞定位HvSUT1[6]。最近的蛋白质组学和绿色荧光蛋白(GFP)融合蛋白研究表明,SUT4亚家族的一些成员,包括HvSUT2和OsSUT2,以及来自其他物种的成员,如拟南芥(AtSUT4)、荷花(LjSUT4)和杨树(PtaSUT4),都定位于液泡tono质体[25- - - - - -27],这表明这些蛋白质参与了蔗糖的液泡储存及其通过细胞质到细胞质的运输。一致地,基因敲除突变OsSUT2和RNAi介导的PtaSUT4在水稻和杨树的源叶中,由于蔗糖从液泡向细胞质室的运输减少,分别引起蔗糖的积累[27,28]。
植物SUTs在以蔗糖形式的光同化物质从源组织到汇组织的分配中起重要作用,从而决定种子产量。识别和表征新的SUTs,因此,提供了对蔗糖运输调控的见解。虽然小麦是世界上最重要的经济作物之一,但只有一种小麦SUT迄今为止,基因已被识别和表征[8]。本研究确定了一种新的SUT,指定为TaSUT2,以及来自六倍体小麦(t . aestivum简历。AC Andrew),并利用酵母异种系统确定了它们作为sut的亚细胞定位和功能。的总表达式TaSUT2研究了这三个基因组在不同发育阶段源组织和汇组织中的相对贡献。
方法
植物生长条件和组织收集
小麦(t . aestivum简历。AC Andrew)和六倍体小麦的三个二倍体祖细胞;t . urartu(A基因组供体;登录号CN38564)神盾神盾(B基因组供体;加入# CN108020),和山羊草属tauschii(D基因组供体;登记号PI560538)用于本研究。成熟的干种子在潮湿的无菌whatman# 1滤纸上,在培养皿中(每个培养皿15颗种子)黑暗中吸收三天。发芽的幼苗种植在1加仑的锅中(每锅1苗),其中含有Sunshine Mix #4 (LA4;Sungro Horticulture, Bellevue, WA, USA)和~19 g矿物质补充剂(Cornell混合物;碳酸钙100克,渗钙150克,过磷酸钙120克,微量元素2克,铁螯合1.5克[13.2%],锌螯合0.7克[14%]),深度约2厘米。然后将花盆置于18°C/14°C(昼/夜)的生长室中,16/8 h光周期,冷白色荧光(F96T12/CW/VHO;Sylvania, Danvers, MA, USA)光(175 μmol m)2年代1),直到收获。
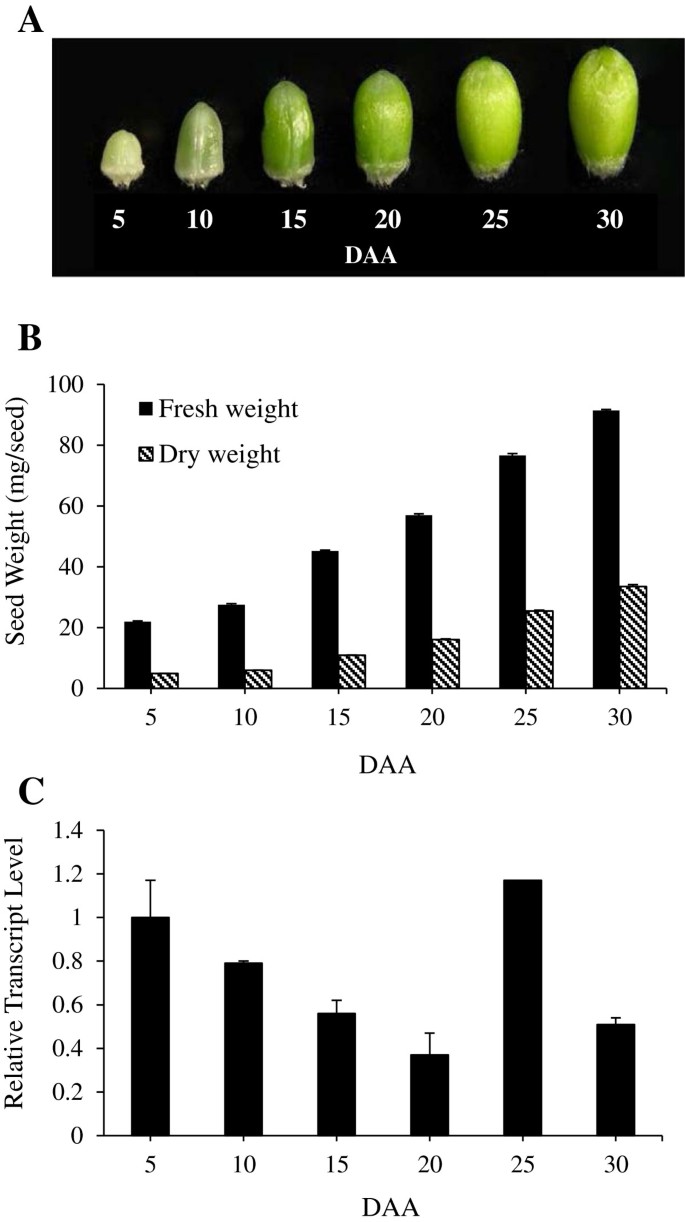
从15至35天的植物中收获的嫩叶。利用AC Andrew和三个二倍体祖细胞克隆了TaSUT25 .在所有其他研究中,组织采集于抽穗(花前8天)和花后不同天(DAA)。在抽穗处收获的营养组织包括旗叶片、旗叶鞘和花梗。为了收集不同DAA的组织,植物在黄色花药第一次挤压时被标记,这一阶段被认为是0 DAA。上面描述的营养组织以及正在发育的穗是从单个主蘖或次生分蘖上收获的(每株每复制一个分蘖;3个重复)在5、10、15、20、25和30 DAA。为了尽量减少样品之间的差异,种子和非种子成分,包括颖片,外稃和原叶,从每个穗(6-10个小穗;每小穗2-3小花)。组织在液体N中冷冻2在收获后立即保存,然后在-80°C保存,直至下次使用。
RNA提取和cDNA合成
按照制造商的建议,使用RNeasy Plant Mini Kit (Qiagen, Hilden, Germany)从营养组织中提取总RNA(每个样品约100 mg新鲜重量)。从发育中的种子中提取总RNA的方法如前所述[29]。然后使用RevertAid™H负第一链cDNA合成试剂盒(Fermentas, Glen Burnie, MD, USA)按照制造商的方案进行cDNA合成。
分子克隆TaSUT2互补脱氧核糖核酸
从六倍体小麦幼叶中提取cDNA样本。利用先前鉴定的保守编码区设计的特定引物扩增AC AndrewSUT2大麦基因[GenBank:AJ272308] [6]、玉米[GenBank:AY639018] [30.]和大米[GenBank:AY137242] [5]。将所得PCR片段克隆到pGEM-T Easy载体(Promega, Madison, WI, USA)并测序。采用SMARTer RACE cDNA扩增试剂盒(Clontech, Mountain View, CA, USA),从新分离的部分片段设计基因特异性引物,用RACE- pcr鉴定5 '和3 '端片段。将5′RACE和3′RACE的扩增产物克隆到pGEM-T Easy载体(Promega)中测序。端到端PCR后,对得到的DNA片段进行测序,然后在GenBank数据库中进行BLAST检索。
的识别TaSUT2从六倍体小麦的A、B和D基因组中提取
的三个同源物TaSUT2(TaSUT2A,TaSUT2B和TaSUT2D),从cv.幼叶中制备cDNA样品。AC安德鲁和六倍体小麦的三个二倍体祖先,t . urartu(基因组捐献者)Ae。speltoides(B基因组供体)和Ae。tauschi(D基因组供体),使用TaSUT2特定的引物。放大后的片段TaSUT2,TuSUT2, AesSUT2和AetSUT2将其克隆到pGEM-T Easy载体(Promega)中进行测序。产生的dna的基因组起源TaSUT2通过比较它们各自的核苷酸序列与来自三个二倍体祖细胞的核苷酸序列确定。
序列与系统发育分析
的序列同源性TaSUT2A, TaSUT2B和TaSUT2D和其他谷物一起SUT采用DNAMAN (http://www.lynnon.com/pc/alignm.html),并利用开放阅读框(ORF)查找器(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)。这三个的orfTaSUT2同源物通过JustBio翻译工具翻译成氨基酸序列(http://www.justbio.com/index.php?page=hosted-tools),然后用DNAMAN进行蛋白序列同源性分析。TaSUT2A、TaSUT2B和TaSUT2D的分子质量采用蛋白分子量计算器软件(http://www.sciencegateway.org/tools/proteinmw.htm)。利用TMpred软件(http://www.ch.embnet.org/software/TMPRED_form.html) [31]。为了确定这3个TaSUT2s与其他已知植物sut的系统发育关系,使用ClustalW程序将它们的氨基酸序列与来自单子叶和双子叶植物的40个sut对应的氨基酸序列进行比对(http://www.ebi.ac.uk/Tools/msa/clustalw2) [32]。使用分子进化遗传分析(MEGA, version 5)软件(http://www.megasoftware.net) [33用泊松校正模型和500重复自举法进行系统发育检验。为了预测三种同源物的染色体位置TaSUT2,检索国际小麦基因组测序联盟(IWGSC)调查序列库中与小麦的cDNA序列相邻的DNA序列(contigs)TaSUT2A,TaSUT2B和TaSUT2D查询。
TaSUT2在酵母中的异源表达
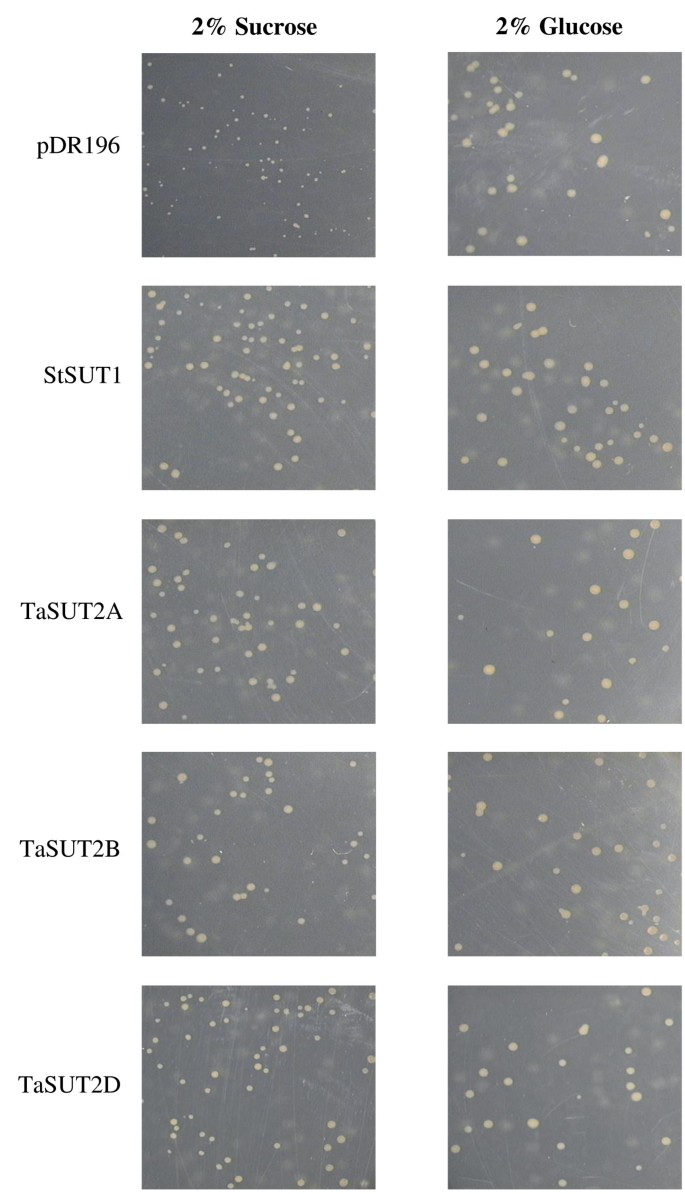
这三者的功能TaSUT2通过在突变体SUSY7/细胞中异种表达其各自的cdna来检测摄取蔗糖的同源物ura3酵母(酿酒酵母)应变[34],由于缺乏细胞外转化酶,不能利用外部蔗糖作为唯一的碳源。为此,全长编码序列为TaSUT2A,TaSUT2B和TaSUT2D克隆到酵母表达载体pDR196中[35],产生pDR196-TaSUT2构建体。在对每个插入序列进行验证后,将构造转换为SUSY7/ura3细胞,随后在含2%蔗糖,pH 5.2作为唯一碳源的合成完全培养基(SC)上,在30°C下培养10天。所有的转化子也在含有2%葡萄糖的培养基上培养,pH为5.8,作为碳的唯一来源。SC介质已按上文所述制备[36],用pDR196转化的SUSY7/ura3细胞含有先前表征的高亲和力马铃薯SUT1 [37]和空载体pDR196分别作为阳性对照和阴性对照。
TaSUT2-YFP融合蛋白的瞬时表达
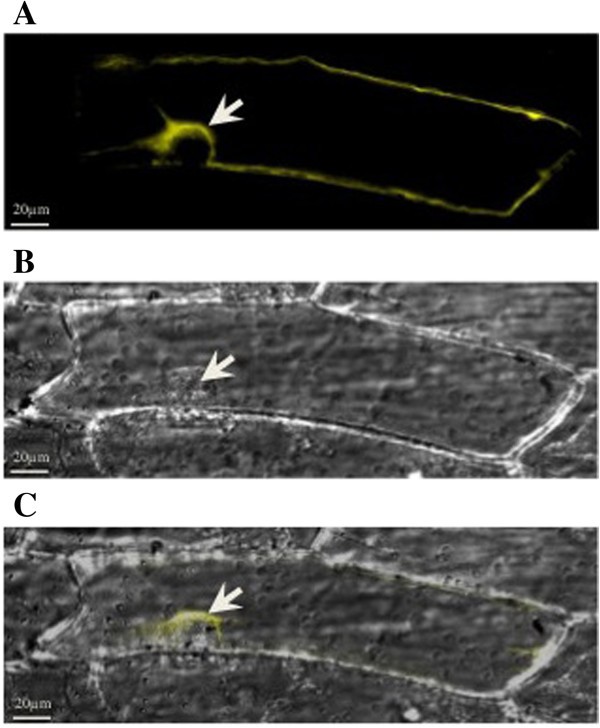
为了确定TaSUT2在亚细胞水平上的定位,首先在pEarleyGate 101载体上以黄色荧光蛋白(YFP)的N端为框架亚克隆其cDNA [38]。TaSUT2-YFP融合蛋白在洋葱(洋葱)表皮细胞通过金粒子轰击使用氦生物粒子输送系统(PDS-1000, Bio-Rad, Hercules, CA, USA)。使用德国卡尔蔡司公司Axio Imager Z1显微镜(曝光时间1555-ms)采集荧光细胞图像,并使用AxioVision软件(卡尔蔡司公司)进行分析。
实时qPCR检测
为了进行实时qPCR分析,使用Primer3软件设计了TaSUT2, 5 ' -TACGGAGTCCTGCTCTGTCA-3 ' /5 ' -CTCGTCGCTTCCGAAAGTA-3 '和Taβ-actin(作为参比基因),5 ' -CCTTCCACATGCCATCCTTC-3 ' /5 ' -GCTTCTCCTTGATGTCCCTTAC-3 '特异性引物(http://frodo.wi.mit.edu/primer3/)。为了检测来自三个基因组的所有转录本,TaSUT2引物是从三个同源物的保守区域设计的。采用Maxima SYBR Green/ROX qPCR Master Mix (Fermentas)进行实时qPCR检测。反应混合物中含有2 μL cDNA (100 ng/ μL), 10 μL Maxima SYBR Green/ROX qPCR Master Mix, 0.6 μL正向引物(10 μM;300 nM终浓度),0.6 μL反向引物(10 μM;300 nM终浓度)和6.8 μL水,总反应体积为20 μL。在Mx3000P实时PCR系统(Stratagene, La Jolla, CA, USA)上进行扩增和荧光信号检测,使用以下热循环条件:在95°C下初始变性和DNA聚合酶激活10分钟,然后在95°C下变性15秒,在60°C下退火和延伸1分钟,在96孔光学反应板上覆盖光学帽(Bio-Rad)。的相对转录水平TaSUT2由2决定——ΔΔCt[39]。
基因组特异性半定量PCR
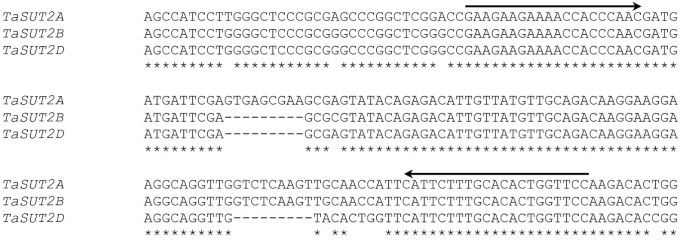
的3 '未翻译(UTR)多态性区域的正向和反向引物TaSUT2A,TaSUT2B和TaSUT2D(图1)被用来扩增三个不同的片段,对应于来自cDNA样本的每个同源物。PCR产物在12%聚丙烯酰胺凝胶上垂直分离(丙烯酰胺:双丙烯酰胺比例为29:1)。用溴化乙啶凝胶染色后,将DNA片段可视化,并使用gel Doc XR系统(Bio-Rad)捕获凝胶图像。使用Quantity One软件(Bio-Rad)确定每个同源物扩增子对应的PCR产物的条带强度,然后归一化到背景信号。
原位杂交
将4颗DAA种子和1月龄植株最年轻的完全展开叶片的横切面固定在4%多聚甲醛(w/v)的1X缓冲钾盐水(PBS)中,然后包埋在石蜡间质体中。合成地高辛(DIG)标记的核探针在体外从pGEM-T Easy载体(Promega)转录,该载体含有605 bp的cDNA片段,在三者之间保守TaSUT2使用T7和SP6 RNA聚合酶和digi -RNA标记试剂盒(罗氏诊断公司,印第安纳波利斯,美国)。正义探针和反义探针在65°C下进行碱性水解,得到约150 bp的片段,然后在- 80°C下保存,待进一步使用。预杂交处理后,组织切片(10 μm)杂交,然后进行杂交后处理,清洗和抗体处理,如前所述[40]。然后用Western Blue (Promega)染色过夜,然后在显微镜下观察(DC500;Leica, Wetzlar,德国)。
结果
分子克隆TaSUT2
从白藜芦醇幼叶组织中提取cDNA样品的扩增t . aestivum简历。AC安德鲁与向前和反向引物设计的保守区域SUT2大麦的同源物(HvSUT2)、米饭(OsSUT2)和玉米(ZmSUT2)产生了特定的部分cDNA片段TaSUT2.从部分cDNA片段中提取基因特异性引物进行RACE-PCR,然后进行端到端PCR,得到推定的编码TaSUT2序列长度为1518bp。用编码的DNA序列在GenBank数据库中检索TaSUT2透露,TaSUT293%的人认同HvSUT2, 80%的人两者都认同OsSUT2和ZmSUT2.
的识别TaSUT2来自小麦六倍体的三个二倍体祖先
六倍体小麦各二倍体祖先叶片组织cDNA的扩增t . urartu(基因组捐献者)Ae。speltoides(B基因组供体)和Ae。tauschi(D基因组供体)具有特异性的正向和反向引物TaSUT2RACE-PCR产生的DNA片段与假设相符SUT2每个祖先的。核苷酸测序和ORF finder分析表明TuSUT2A,AesSUT2B和AetSUT2D基因编码的DNA序列分别为1518、1518和1524 bp,分别编码506、506和508个氨基酸,相似性超过99%。
的识别TaSUT2s从六倍体小麦的A、B和D基因组中提取
转化产生的多个菌落的测序大肠杆菌(DH5α)细胞TaSUT2RACE-PCR结果显示存在三个同源物TaSUT2在六倍体小麦中。将它们的编码区和各自的未翻译片段序列与三个二倍体祖先的序列进行比较,使我们能够确定它们的基因组起源。的编码区核苷酸序列和未翻译片段TaSUT2A百分百的认同TuSUT2.同样,编码片段和未翻译片段的DNA序列TaSUT2D百分百的认同AetSUT2.而,TaSUT2B与编码DNA序列的一致性低于100% (99.5%)AesSUT2由于碱基置换较少。
三个人的染色体位置TaSUT2小麦六倍体的同源物
BLAST检索IWGSC调查序列库中的DNA序列TaSUT2A,TaSUT2B和TaSUT2D从5号染色体的A、B和D基因组中选出了7个e值小于2e的最佳配对组-42年超过81%的人认同TaSUT2用于匹配序列范围从168到741 bp的cdna(附加文件1:表1)。这些结果使我们能够预测染色体5A, 5B和5D作为三个同源物的位置TaSUT2存在于小麦基因组中。
小麦六倍体TaSUT2基因序列及系统发育分析
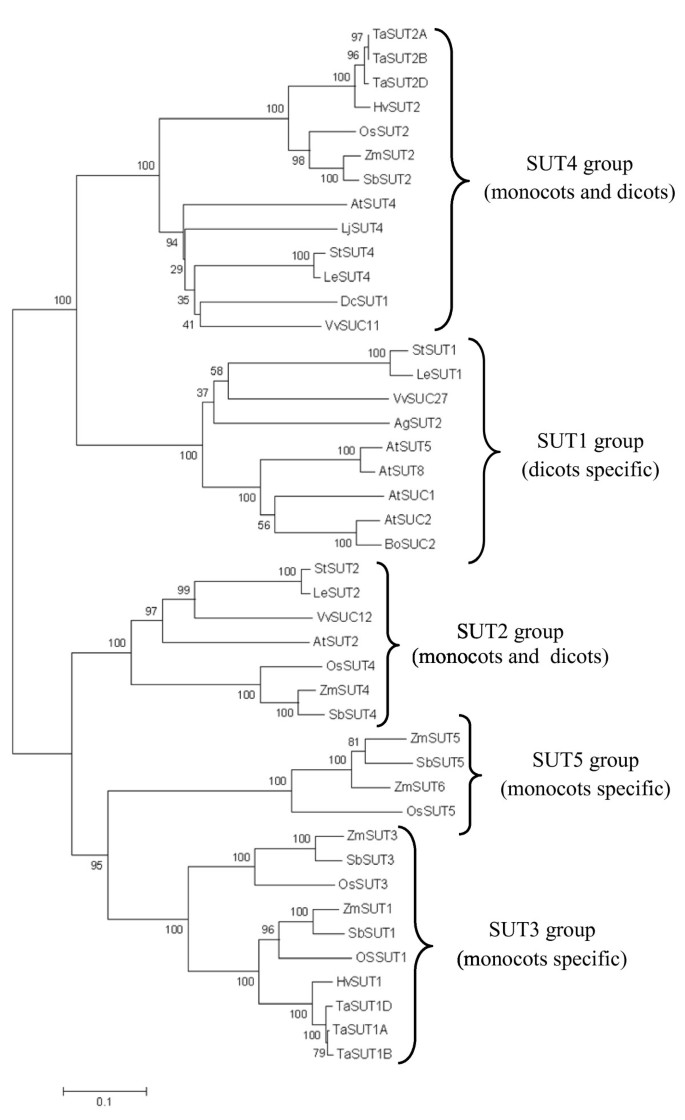
的编码DNA序列的比较同源性分析TaSUT2A,TaSUT2B和TaSUT2DDNAMAN分析结果表明,它们的同源性为99.1%,同源性为90.1%SUT2稻谷,大麦和玉米。使用JustBio翻译工具对他们预测的orf进行翻译表明TaSUT2A,TaSUT2B和TaSUT2Dcdna编码506、506和508个氨基酸,估计分子质量分别为53.87、53.87和53.92 kDa。预测的TaSUT2A、TaSUT2B和TaSUT2D的氨基酸序列彼此的同源性超过99.3%,与HvSUT2、OsSUT2和ZmSUT2蛋白的同源性达到92.6%(图2)2)。在GenBank数据库中进行BLAST检索分析,发现菌株的三个同源物TaSUT2是GPH阳离子同调子家族的新成员,所有其他植物sut都属于这个家族。利用TMpred程序进行的蛋白质拓扑预测表明,这三种蛋白质都含有12个跨膜螺旋(图1)2)。此外,小麦的三个SUT2s包含从功能性植物sut的高度保守区域衍生的一致序列[5]和似乎定位于SUTs的蔗糖结合位点或与之构象相关的组氨酸残基(图2)2)。利用MEGA软件基于TaSUT2A、TaSUT2B和TaSUT2D的氨基酸序列,以及单子叶和双子叶种中其他具有代表性的sut进行系统发育树的生成,结果表明这3个TaSUT2s都是SUT4亚家族的成员(图2)3.),主要含有扁桃体局部sut。一致地,TaSUT2s包含假定的液泡靶向二亮氨酸基序列(LXXLL),在su4亚家族的所有成员的细胞质n端发现(图2)2)。
TaSUT2与其他植物SUTs的系统发育关系。基于氨基酸序列相似性建立了系统发育树TaSUT2A,TaSUT2B和TaSUT2D与利用MEGA程序从代表性单子叶植物和双子叶植物中鉴定的SUTs [33]。采用Neighbor-Joining法推断其进化史。在引导测试(500个复制)中,相关分类群聚集在一起的复制树的百分比显示在分支旁边。进化距离是用泊松校正法计算的,以每个位点的氨基酸取代数为单位。分析涉及40个SUTs的氨基酸序列:芹菜graveolens,AgSUT2 AF167415;小麦, TaSUT1A, AAM13408;TaSUT1B AAM13409.1;TaSUT1D AAM13410.1;大麦芽, HvSUT1, CAJ20123.1;HvSUT2 CAB75881.1;栽培稻, OsSUT1, BAI83443.1;OsSUT2 BAC67163.1;OsSUT3 BAB68368.1;OsSUT4 BAC67164.1;OsSUT5 BAC67165.1;玉米,ZmSUT1 NP_001104840;ZmSUT2 AAT51689;ZmSUT3 ACF86653.1;ZmSUT4 AATS91375.1;ZmSUT5 ACF85284.1;ZmSUT6 ACF86653.1;茄属植物tuberosum, StSUT1, CAA48915.1;StSUT2 AAP43631.1;StSUT4 AAG25923.2;拟南芥, atsu1, CAA53147.1;AtSUC2 CAA53150.1;AtSUT2 AAC32907.1;AtSUT4 AAG09191.1;AtSUT5 BAB11624.1;AtSUT8 AAC69375.1;Lycopersicon esculentum, LeSUT1, CAA57726.1;LeSUT2 AAG12987.1;LeSUT4 AAG09270.1;葡萄,VvSUC11 AAF08329.1;VvSUC12 AAF08330.1;VvSUC27 AAF08331.1;胡萝卜胡萝卜, DcSUT1A, CAA76367.1;高粱二色的, SbSUT1, ACY69230.1;SbSUT2 XX_00243677.1;SbSUT3 XP_002467275.1;SbSUT4 EES06059.1;SbSUT5 XP_002454058.1;芸苔属植物oleracea, BoSUC2, AAL58072.1;Lotus粳稻, ljsu4, AJ538041。
小麦六倍体三种TaSUT2s蛋白的功能分析
确定了三种tasut2的功能在体外通过突变体SUSY7/的互补分析ura3酵母菌系,通常不能在含蔗糖培养基上生长。SUSY7 /ura3用pDR196转化的细胞含有这三种成分TaSUT2homeologues (TaSUT2A, TaSUT2B和TaSUT2D)及StSUT1(作为阳性对照)与用载体对照转化的相应细胞相比,在含蔗糖作为唯一碳源的培养基上表现出更快的生长(图2)4)。在含葡萄糖培养基中进一步分析发现SUSY7/ura3细胞被TaSUT2和StSUT1,而病媒控制在葡萄糖作为碳的唯一来源上表现出相当的生长速度(图2)4)。
TaSUT2的亚细胞定位
通过TaSUT2- yfp融合蛋白在洋葱表皮细胞中的瞬时表达分析TaSUT2在亚细胞水平的定位,发现在细胞核内部液泡周围的结构上有强烈的yfp荧光信号(图1)5),表明TaSUT2定位于细胞质而不是质膜。
的表达TaSUT2在种子发育过程中
的总表达式TaSUT2利用实时荧光定量pcr技术对5、10、15、20、25和30 DAA的种子发育情况进行了研究。5 - DAA启动种子中新鲜物质和干物质积累与较高的转录物丰度相关TaSUT2(图6)。然而,随着种子发育到20daa,鲜重和干重的进一步增加,伴随而来的是蛋白质丰富度的逐渐下降TaSUT2记录。随着种子生长从20 DAA持续增加到25 DAATaSUT2转录本增加了3倍,达到与5个DAA种子相似的水平。25 ~ 30 DAA的种子生长表现为TaSUT2记录。
的表达TaSUT2在源组织中
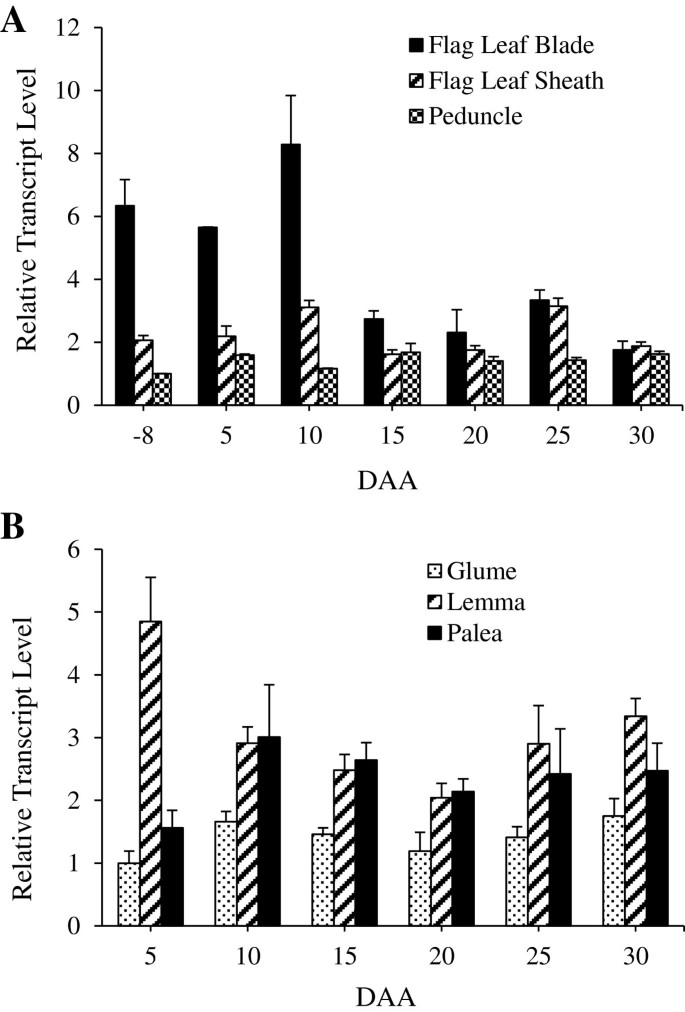
的总表达式TaSUT2还研究了旗叶叶片、叶鞘和花梗(穗状花序和5、10、15、20、25和30 DAA处)以及小花的非叶组织(5、10、15、20、25和30 DAA处),包括颖片、外稃和稃。会议记录TaSUT2在所有检查组织中均检测到(图7A, B)TaSUT2在抽穗期和种子发育早期(5 ~ 10 DAA),旗叶的转录本相对较高,之后下降了5倍,并在30 DAA时保持在相似水平(图2)7A)表达TaSUT2旗叶鞘和花梗组织在本研究中检测的种子发育的所有阶段几乎相似,除了抽穗时花梗的水平略低。发育小花的非叶面外稃和颖花组织显示出相似的丰度TaSUT2转录本,尽管在早期外稃中明显有较高的丰度(5daa;数字7B).颖片衍生的模式TaSUT2转录本丰度几乎与外稃和古胚组织相似,但水平相对较低。
扩增每个同源物独有的片段TaSUT2
三种同源物之间的核苷酸同源性很高(~99%)TaSUT2不能允许我们设计编码区衍生的引物,能够分别扩增每个同源物的扩增子。BLAST搜索的编码DNA序列TaSUT2A,TaSUT2B和TaSUT2D与IWGSC调查序列库比对发现,来自小麦A、B和D基因组的序列包含部分编码序列(序列同源性超过99%)和每个同源物各自的3 ' UTR区域。对三个基因组的3 ' UTR序列进行比对,发现了一个多态区,该多态区可以为每个同源物产生一个独特的扩增子(134 bp)TaSUT2A;125 bpTaSUT2B116 bpTaSUT2D;数字1)。用聚丙烯酰胺凝胶对cv. cDNA扩增产物进行分离。AC Andrew组织,其引物集旨在跨越多态的3 ' UTR区域(图2)1)产生了三个不同的DNA片段,对应于来自每个基因组的扩增子(附加文件2:图S1)。
基因组对总表达的贡献TaSUT2
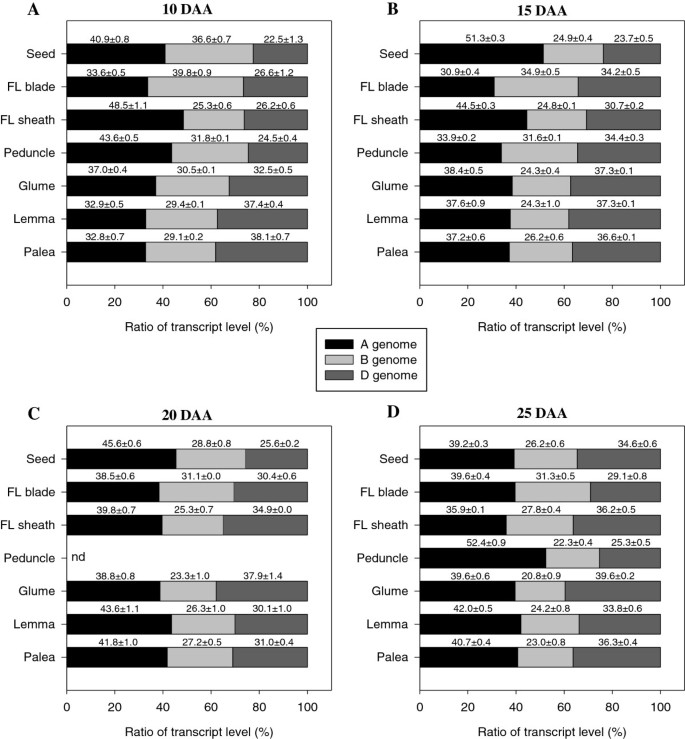
每个基因组对总表达量的转录贡献TaSUT2采用半定量RT-PCR技术对种子快速灌浆期(10 - 25 DAA)的库和源组织进行了检测。我们的研究结果表明,基因组的贡献随组织和阶段的不同而不同(图2)8)。在种子中,基因组A贡献最大;然而,它的贡献因阶段而异(39%至51%)。在10 DAA时,旗叶片的营养源组织中,基因组B是主要贡献者(40%),其次是基因组A(34%),然后是基因组D(27%)。当旗叶发育到10 - 15 DAA时,B和D基因组的贡献水平相等,略高于基因组a,在后期20 - 25 DAA(39% - 40%),基因组a似乎是主要的贡献者。虽然基因组A在10 - 20 DAA期间对旗叶鞘的贡献最大(40% - 49%),但在25 DAA时,A和D基因组对旗叶鞘的贡献相同,且水平高于基因组B。在花梗中,基因组A对10 DAA和25 DAA的贡献最大(44%至52%),然而,三个基因组对15 DAA的贡献几乎相等。在穗的非种子源组织中,基因组A在颖花中的贡献在10 DAA时占主导地位,但在后续阶段,A和D基因组的贡献几乎相等,均高于B。在外稃和古茎组织中,基因组D在10 DAA时贡献最大(38%),而在15 DAA时,A和D基因组的贡献相同(高于B)。在20 - 25 DAA阶段,这些组织中基因组A的贡献最大,其次是D,其次是B。考虑到所有组织和发育阶段,基因组A的平均贡献(40%)高于基因组D(32%)和基因组B(28%)。
细胞定位TaSUT2发育中的种子和源叶片的转录本
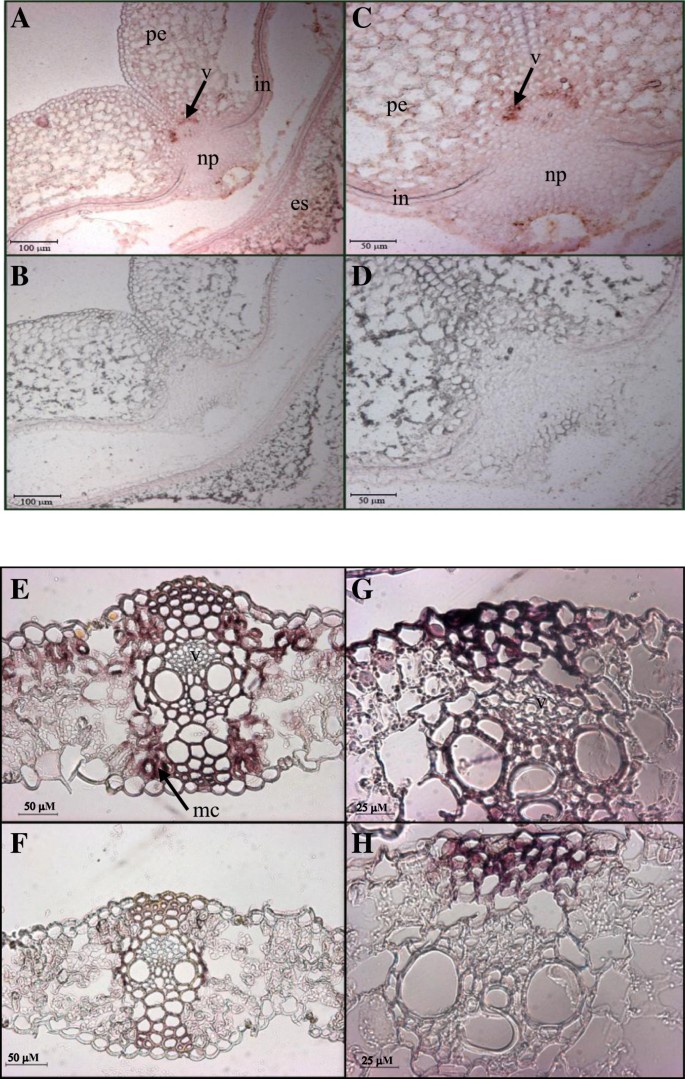
的本地化TaSUT2在发育中的种子和源叶片中检测了细胞水平的转录本原位用605bp的编码DNA片段合成探针进行杂交TaSUT2同源物,以便从三个基因组中检测所有转录本。的强烈信号TaSUT2转录本主要定位于发育中的种子的维管脉中(图2)9A, C)和叶片表皮下叶肉细胞(图2)9E, G)。
细胞定位TaSUT2小麦种子和叶片中的转录本。用二氧基标记反义探针对4个DAA小麦种子中部横切面进行探针检测(A, C)和有意义(B, D)TaSUT2riboprobes。的TaSUT2转录本主要定位于静脉(见图中箭头所示的红棕色染色)A、C)。微信号(浅粉色)也可见于珠心突起的尖端和被内(一个,C).一个和B,C和D分别是5倍和10倍的放大倍率。用二氧素标记反义探针探测了1月龄小麦最年轻完全展开叶片的横切面(E, G)和有意义(F、H)TaSUT2riboprobes。的TaSUT2转录本主要定位于表皮下叶肉细胞(见图中箭头所示的红棕色染色)E).静脉内可见微弱信号(浅粉色染色)(E,G).E和F,G和H分别是10倍和20倍的放大倍率。横截面与控制感探针杂交(B, D和F、H)没有产生信号。v,静脉;Np,核状投影;在皮肤;es,胚乳;pe、果皮;MC,叶肉细胞。
讨论
淀粉在谷类作物种子中的沉积至少部分是由蔗糖从源组织中的转运所决定的。蔗糖跨细胞膜屏障的转运是由SUTs介导的,编码这些蛋白质的基因已经从包括水稻、玉米和大麦在内的许多谷类作物中被鉴定和功能表征[23]。然而,到目前为止,只有一个SUT(TaSUT1)已在六倍体小麦中被鉴定和鉴定[8,15,41]。为了更好地了解小麦同化物从源组织向发育中的种子分配的调控,分离和表征更多的同化物是很重要的。为此,在本研究中,我们鉴定了一种新植物的三个同源物SUT吉恩,被指定为TaSUT2研究了它们的功能、亚细胞定位以及时空和基因组特异性表达模式。的TaSUT2A,TaSUT2B和TaSUT2D基因的orf分别为1518 bp、1518 bp和1524 bp,分别编码含有506、506和508个氨基酸的蛋白质(图2)2),估计分子质量为~54 kDa。类似于在TaSUT1[8),TaSUT2A, TaSUT2B和TaSUT2D基因差异主要在3 ' UTR区(图2)1)。
来自序列和系统发育分析的几条证据表明,新发现的同源物TaSUT2对假定的sut进行编码。首先,它们的cDNA和推导出的氨基酸序列具有很高的同源性SUT2稻谷、大麦和玉米的s(90%)和相应的蛋白质(93%)(图2)2)。其次,它们的蛋白质含有12个跨膜螺旋(图2)2),是所有已知植物sut所属的GPH阳离子同调子家族成员的独特特征[10,11],以及从功能性sut的高度保守区域导出的一致序列(图2)2) [5]。第三,在所有已知的植物SUTs中保守的组氨酸残基,似乎定位于SUTs的蔗糖结合位点或与SUTs构象相关[12]存在于TaSUT2s的第一个细胞外环中(TaSUT2A和TaSUT2B中的His-61, TaSUT2D中的His-63;数字2)。的部分cDNA序列具有显著的相似性TaSUT2A,TaSUT2B和TaSUT2D与来自染色体5A, 5B和5D的contigs(附加文件)1表S1)表明这些基因位于5号染色体上;建立差异染色体的位置之间TaSUT1,位于第4号染色体上[8),而TaSUT2.
在系统发育上,TaSUT2A、TaSUT2B和TaSUT2D蛋白被归为SUT4亚家族,包括低亲和力和细胞体定位的双子叶SUT4s和单子叶SUT2s,而不是单子叶特异性的SUT3,包括TaSUT1和SUT5亚家族(图2)3.) [42]。此外,TaSUT2s含有假定的液泡靶向二亮氨酸基序列(LXXLL),在SUT4亚家族的所有成员的细胞质n端发现,但AtSUT4具有KRVLL [43]。同样,我们使用YFP融合蛋白对TaSUT2进行亚细胞定位分析,结果显示TaSUT2是一个tono质体定位的SUT(图2)5)。TaSUT2A、TaSUT2B和TaSUT2D与TaSUT1相应同源物的低相似性(< 45%)解释了TaSUT1和TaSUT2蛋白在系统发育上的遥远关系。同样,HvSUT1和HVSUT2之间的相似度仅为42% [6]分别被分为两个不同的SUT亚家族,SUT3和SUT4(图2)3.) [9]。到目前为止,SUSY7/ura3酵母突变株已被用作研究植物SUTs生物学功能的工具。这种酵母突变株不能利用外部蔗糖,因为它的胞质和细胞外转化酶被敲除[44]。然而,如果SUT在其质膜中表达,则细胞质溶胶中植物蔗糖合酶的表达使突变菌株能够在蔗糖上生长。SUSY7/的补充ura3含有TaSUT2A、TaSUT2B和TaSUT2D的酵母细胞使酵母细胞能够摄取蔗糖,并在以蔗糖为唯一碳源的培养基上生长(图2)4)。这一结果与TaSUT2定位于细胞质不一致,因为从培养基中摄取蔗糖需要一个质膜定位的SUT。因此,在异源系统中TaSUT2很可能错定位到质膜上,而这种错定位产物导致了酵母SUSY7/的互补ura3突变体。SUSY7/的互补结果相似ura3大麦细胞质定位HvSUT2酵母细胞[j]6],杨树的PtaSUT4 [27]和水稻OsSUT2的表达优化[28已被报道。然而,植物SUT在酵母中的异源表达并不一定揭示它们的亚细胞定位[25]。
为了深入了解的生理作用TaSUT2,我们分析了其在种子形成前后源组织(旗叶叶片和鞘、花梗、颖片、外稃和荚膜)和汇组织(正在发育的种子)中的总表达量(图2)6和7)。的表达式TaSUT2在种子发育的早期(5-10 DAA)和后期(25 DAA),叶绿素含量相对较高(图2)6),而TaSUT1在种子灌浆的中/快速阶段(16-20 DAH)高表达[8]。因此,TaSUT1和TaSUT2在种子发育过程中可能在功能和时间上起着不同的作用。与这些结果一致,的表达式HvSUT2在种子发育的早期和后期相对较高,而HvSUT1在中期占主导地位[6]。的本地化TaSUT2发育中的种子脉络中的转录本(图2)9A, C)表明TaSUT2s参与了静脉中液泡细胞和细胞质细胞间蔗糖的分配。
小麦的种子灌浆主要由旗叶产生的光同化物质支持[45]。因此,相对较高的丰度TaSUT2花前和种子发育早期(5-10 DAA)源旗叶片中的转录本(图2)7A)可能提示TaSUT2在叶片中蔗糖的细胞内分配中的作用,从而调节同化物从叶片到种子组织的分配。另一种小麦SUT的基因,TaSUT1定位于质膜并参与韧皮部装载的基因在抽穗前后的旗叶片中也有表达,但抽穗后的表达量低于抽穗前的表达量[8]。这表明这两个基因在调节蔗糖从源组织到汇组织的转运方面具有互补性;的TaSUT2控制胞浆内蔗糖的稳态TaSUT1调节韧皮部的蔗糖负荷。始终如一地,质体定位SUT2大麦的S [6]和米饭[24]在源叶组织中表达。此外,OsSUT2表达rnai抑制的水稻和杨树突变体PtaSUT4表现为叶片中蔗糖的积累增加,从而导致水稻株高、分蘖数和种子重量降低,而普通水稻叶片与茎生物量比增加[27,28]。的转录丰度下降TaSUT2在籽粒灌浆后期,旗叶叶片的衰老和液泡中储存蔗糖的积累减少有关[19,46]。的本地化TaSUT2叶片叶肉细胞转录本(图29E, G)可能暗示了它们在调节叶片组织中这些细胞内的细胞内蔗糖分配方面的重要性。
小麦的部分茎梗和叶鞘组织暴露在入射辐射下,因此可以进行光合作用并产生光同化物,约占小麦种子干物质的9%至12% [18,46]。也有研究表明,小麦小花的颖片、外稃和外稃组织的光合作用贡献了小麦种子所吸收的10%至44%的光同化物[17,18]。因此,的表达式TaSUT2在花梗和叶鞘(图7A),以及穗的颖片、外稃和稃(图2)7B)可能表明它参与了这些组织中蔗糖从液泡到细胞质的细胞内运输。与此一致的是,谷物的源组织主要是在它们的液泡中暂时储存蔗糖而不是暂时的淀粉[47- - - - - -49]。从我们的基因组特异性半定量RT-PCR分析中可以看出,三个小麦基因组对总表达量的贡献TaSUT2随着组织和发育阶段的不同而变化(图2)8),表明它们各自具有特定的时空作用TaSUT2同源物在测定TaSUT2活性中的作用。
结论
这项研究表明TaSUT2在系统发育上,它属于主要包含液泡膜SUT的su4亚家族。这些结果及其在基因水平上的时空表达模式表明,TaSUT2参与了糖汇和源组织中液泡和细胞质细胞间的蔗糖交换。然而,阐明的最终生理作用TaSUT2需要对蔗糖转运活性、蔗糖-淀粉途径中代谢物水平、总体种子产量和其他产量参数的变化进行突变分析。
缩写
- 答:
-
同伴复杂
- DAA:
-
开花后几天
- 挖掘:
-
Digoxigenin
- 加仑小时:
-
Glycoside-pentoside-hexuronide
- PBS:
-
钾缓冲盐水
- SE:
-
筛的元素
- SUT:
-
蔗糖转运蛋白。
参考文献
- 1.
黄建伟,李建平,李建平,等。蔗糖在种子发育过程中的筛后转运。[J] .植物生理学报,1995,22(2):681-702。10.1071 / PP9950681。
- 2.
李建军,李建军,李建军,等。高等植物糖转运蛋白的研究进展。植物科学进展,2000,5:283-290。10.1016 / s1360 - 1385(00) 01681 - 2。
- 3.
truerit E:蔗糖转运蛋白的重要性。中国生物医学工程学报,2001,31(2):569 - 571。10.1016 / s0960 - 9822(01) 00085 - 9。
- 4.
高等植物蔗糖转运体的分子生理学。生物工程学报,2007,31(1):379 - 379。10.1016 / j.febslet.2007.03.048。
- 5.
黄青木,李春华,李春华,等。水稻蔗糖转运基因家族的研究进展。植物生理学报,2003,44(4):563 - 567。10.1093 /卡式肺囊虫肺炎/ pcg030。
- 6.
魏世克,李春华,李春华,李春华,李春华,李春华,李春华,李春华,李春华,王春华,王春华,王春华,王春华,王春华,等。蔗糖转运蛋白在大麦种子中的表达及其对种子发育和淀粉积累的影响。植物学报,2000,21(1):455-467。10.1046 / j.1365 - 313 x.2000.00695.x。
- 7.
黄春华,李春华,李春华,黄春华,黄春华。玉米蔗糖转运蛋白基因的克隆与表达分析。植物生理学报,1999,40:1072-1078。10.1093 / oxfordjournals.pcp.a029489。
- 8.
黄春华,黄春华,黄春华,黄春华,黄春华,黄春华,黄春华,黄春华。小麦蔗糖转运蛋白基因的克隆与表达。植物化学学报,2002,25(5):453-462。10.1023 /: 1019846832163。
- 9.
库恩C:蔗糖转运蛋白与植物发育。植物信号传导中的转运体和泵。编辑:Geisler M, Venema K.纽约:Springer;2011:225 - 251。
- 10.
Lalonde S, Wipf D, Frommer WB:碳和氮有机形态在源和汇之间的转运机制。植物学报,2004,35(5):341-372。10.1146 / annurev.arplant.55.031903.141758。
- 11.
黄春华,李春华,李春华,等。蔗糖在植物体内的转移。光合作用:质体生物学,能量节约和碳同化,光合作用和呼吸的研究进展。编辑:Eaton-Rye JJ, Tripathy BC, Sharkey TD。纽约:斯普林格出版社;201:2703 - 729。34
- 12.
Lu JMY, Bush博士:质子-蔗糖同调体中的His-65是一种必需氨基酸,其位点定向诱变修饰增加了转运活性。科学通报,1998,35(5):925 - 930。10.1073 / pnas.95.15.9025。
- 13.
陈建军,陈建军,陈建军,等。玉米籽粒碳水化合物的研究进展。玉米碳氮还原与利用调控编辑:Shannon JC, Knievel DP, Boyer CD。Rockville:美国植物生理学家协会;198:6135 - 148。
- 14.
李建军,李建军,李建军,等。蔗糖转运蛋白1在玉米叶片韧皮部转运中的作用。[J] .中国生物医学工程学报,2009,35(6):881-892。10.1093 / jxb / ern335。
- 15.
王晓东,王晓东,王晓东,Patrick JW, Offler CE, Furbank RT:小麦蔗糖转运蛋白TaSUT1在营养组织中的表达和定位分析。植物学报,2004,29(2):559 - 564。10.1007 / s00425 - 004 - 1232 - 7。
- 16.
王晓明,王晓明,王晓明,等。水稻蔗糖转运蛋白基因的克隆与表达。植物生理学报,1997,38(3):389- 396。10.1093 / oxfordjournals.pcp.a029134。
- 17.
Kriedemann P:小麦穗的光合作用。中国生物医学工程学报,1996,30(3):349-363。
- 18.
王志明,魏爱玲,郑德明:不同穗型冬小麦品种非叶器官光合特性及其与穗粒质量的关系。植物生态学报,2001,39(3):559 - 564。10.1023 /: 1013743523029。
- 19.
Schnyder H:小麦和大麦灌种过程中碳水化合物储存和再分配的研究进展。中国生物医学工程学报,1993,32(3):393 - 398。10.1111 / j.1469-8137.1993.tb03731.x。
- 20.
王晓东,王晓东,王晓东,王晓东,王晓东。水稻种子中蔗糖转运蛋白OsSUT1的细胞定位和功能。[J] .植物生理学报,2001,28(2):1187-1196。
- 21.
Scofield GN, Hirose T, Gaudron JA, Upadhyaya NM, Ohsugi R, Furbank RT:水稻蔗糖转运基因OsSUT1的反义抑制导致种子灌浆和萌发受损,但不影响光合作用。植物学报,2002,29(2):815-826。10.1071 / PP01204。
- 22.
Bagnall N,王晓东,Scofield GN, Furbank RT, Offler CE, Patrick JW:小麦种子母系和子代组织中蔗糖转运相关基因的表达。[J] .植物生理学报,2000,27(2):109 -1020。
- 23.
黄春华,李春华,李春华,等。水稻根系碳分配的遗传调控:蔗糖转运体和染色位点在韧皮部负荷中的作用。植物生理学报,2009,29(4):771 - 781。10.1104 / pp.108.129049。
- 24.
孙英杰,徐海龙,龚文奎,翟海龙,孟凯,王玉青,魏晓林,肖国锋,朱志:水稻蔗糖转运基因OsSUT2M和OsSUT5Z的克隆与表达分析。植物生态学报,2009,35(2):557 - 557。10.1111 / j.1744-7909.2007.00596.x。
- 25.
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。植物生理学报,2006,32(1):394 - 394。10.1104 / pp.106.079533。
- 26.
赖德华,李建军,李建军,李建军,等。莲叶液泡型蔗糖转运蛋白LjSUT4的功能分析。植物生理学报,2008,32(1):379 - 379。10.1007 / s11103 - 008 - 9370 - 0。
- 27.
李春华,李春华,李春华,等。白杨蔗糖转运蛋白家族的研究进展。植物学报,2011,35(5):757- 757。10.1111 / j.1365 - 313 x.2010.04463.x。
- 28.
加工JS,秋霁,Reinders李西南,Yoo Y,老爷PQ,崔某人,爆炸G,公园,曹MH, Bhoo SH, G,哈恩TR,病房JM,全JS: tonoplast-localized蔗糖转运蛋白的功能受损大米,OsSUT2,限制了空泡的储备蔗糖的运输和影响植物生长。植物生理学报,2011,27(5):379 - 379。10.1104 / pp.111.176982。
- 29.
李忠,崔克汉:一种从含高淀粉的种子胚乳中快速提取高质量RNA的方法。生物技术,2005,38:872-10.2144/05386BM05。
- 30.
王勇,王鑫,程伟:玉米蔗糖转运蛋白SUT4 mRNA的表达。2004年,NCBIhttp://www.ncbi.nlm.nih.gov/nucleotide/47571318,
- 31.
李建军,李建军,李建军,等。膜跨越蛋白片段的研究进展。中国生物化学杂志,1999,19 (4):391 - 391
- 32.
Thompson JD, Higgins DG, Gibson TJ: CLUSTALW:通过序列加权、位置特定间隙惩罚和权重矩阵选择提高渐进式多序列比对的灵敏度。中国生物医学工程学报,1994,22(2):673- 680。10.1093 / nar / 22.22.4673。
- 33.
李建军,李建军,李建军,李建军,等。基于最大似然、进化距离和最大简约性的分子进化遗传分析。中华生物医学工程学报,2011,28(2):731- 739。10.1093 / molbev / msr121。
- 34.
李建军,李建军,李建军,等。菠菜蔗糖载体cDNA的克隆及其在酵母中的功能表达。中国生物医学工程学报,2001,31(4):387 - 398。
- 35.
陈建军,陈建军,陈建军,等。拟南芥NTR1基因的克隆与表达分析。生物工程学报,1997,37(3):264-268。10.1016 / 0014 - 5793(95) 00853 - 2。
- 36.
Rose MD, Winston F, Hieter P:酵母遗传学方法,实验室课程手册。纽约:冷泉港实验室出版社;1990.
- 37.
张建军,张建军,张建军,等。细胞内源转运蛋白AtSUT2 n -末端对底物亲和力的影响。生物医学工程学报,2002,45(4):189-194。10.1016 / s0014 - 5793(00) 02180 - 3。
- 38.
李建军,李建军,李建军,李建军,李建军,李建军。植物功能基因组学与蛋白质组学研究。植物学报,2006,45(5):616-629。10.1111 / j.1365 - 313 x.2005.02617.x。
- 39.
Livak K, Schmittigen TD:实时荧光定量PCR分析相关基因表达数据——ΔΔCt方法。方法,2001,25:402-408。10.1006 / meth.2001.1262。
- 40.
杨建军,杨建军,刘建军,等。裸子植物生长素免疫定位基因的克隆及其在云杉体胚发育过程中的表达。植物物理学报,2009,29(2):483-496。10.1093 / treephys / tpn048。
- 41.
王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东。小麦种子萌发过程中糖转运途径的研究。植物生理学报,2006,41(1):1255-1263。10.1104 / pp.106.082719。
- 42.
植物蔗糖转运蛋白的研究进展。植物学报,2010,13(3):588 - 598。
- 43.
李建军,李建军,李建军,等。植物蔗糖吸收转运蛋白的研究进展。植物科学前缘,2012,3:22-
- 44.
Lalonde S, Boles E, Hellmann H, Barker L, Patrick JW, Frommer WB, Ward JM:糖载体的双重功能:转运和糖感知。植物学报,1999,11(1):727 -726。
- 45.
MA Ali, Hussain M, Khan MI, Ali Z, Zulkiffal M, Anwar J, Sabir W, Zeeshan M:春小麦(Triticum aestivum)灌浆期光合器官与产量属性的源库关系。中国生物医学工程学报,2010,31(2):559 - 559。
- 46.
孔磊,王峰,冯斌,李生,司健,张波:小麦外露梗的结构与光合特性——小麦灌浆的重要光合物质来源。植物生态学报,2010,32(1):481 - 481。
- 47.
李建军,李建军,李建军,等。植物代谢过程中液泡转运蛋白的研究进展。[J] .实验学报,2007,58:83-102。
- 48.
Neuhaus HE:主要代谢物在植物液泡膜上的运输。生物工程学报,2007,31(2):523 - 526。10.1016 / j.febslet.2007.02.003。
- 49.
植物胞内代谢物转运体的研究。植物学报,2010,31(3):21-53。10.1093 / mp / ssp108。
致谢
这项工作得到了加拿大自然科学与工程研究委员会和赫斯基能源公司的资助。作者感谢John Ward博士(明尼苏达大学)提供pDR196载体StSUT1基因和SUSY7/ura3酵母菌株,以及切尔西·麦克杜格尔的技术支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
BA构思并设计了实验。BA和KD分析数据并撰写稿件。KD、SM和FG进行实验。ABB和CS为项目方向提供了材料和投入。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2013_1385_moesm1_esm.pdf
附加文件1:表S1:表现出显著同一性的最佳命中配置TaSUT2互补脱氧核糖核酸。在国际小麦基因组测序联盟调查序列库中搜索与小麦的cDNA序列相邻的DNA序列TaSUT2A,TaSUT2B和TaSUT2D查询。以E值判断对齐评分的显著性。(pdf 158kb)
12870 _2013_1385_moesm2_esm.pdf
附加文件2:图S1:每个TaSUT2同源物特有的DNA片段扩增。用聚丙烯酰胺凝胶分离了cv组织中产生的三个不同的DNA片段。AC Andrew通过设计一个引物集来跨越三个同源物的多态性3 ' UTR区域。车道1、2和3表示每个同源物扩增子对应的PCR产物,车道4表示DNA阶梯。(pdf 117kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Deol, k.k., Mukherjee, S., Gao, F.。et al。一种新植物三种同源物的鉴定与鉴定蔗糖转运蛋白在六倍体小麦(小麦l .)。BMC Plant Biol13日,181(2013)。https://doi.org/10.1186/1471-2229-13-181
收到了:
接受:
发表:
关键字
- Homeologous基因
- TaSUT2
- 蔗糖转运蛋白
- 基因表达
- 组织来源
- 发展的种子
- 小麦