摘要
背景
关于果实组织微结构的发育和果实生长过程中细胞壁的变化,以及具有不同软化行为的品种之间这些发育过程的差异,目前缺乏信息。在这项研究中,我们比较了两个苹果品种在果实发育和成熟过程中表现出不同的软化速率。我们研究了这些不同的软化行为是否在成熟阶段乙烯诱导软化的后期或在果实膨胀和成熟的早期表现出来。
结果
“Scifresh”(缓慢软化)和“Royal Gala”(快速软化)苹果早在细胞扩张阶段就显示出皮层微结构和细胞粘附的差异。在果实早期发育过程中,“Scifresh”苹果与“Royal Gala”相比,硬度损失较小,干物质积累更多,这表明资源分配的差异会影响组织结构特性。“Scifresh”中的三细胞连接富含高度酯化的果胶,有助于增强细胞粘附力,并在细胞扩张过程中增加对大空气空间发展的阻力。因此,“Scifresh”的成熟果实比“Royal Gala”的细胞更大,棱角更分明,气孔更少,组织更致密。在成熟的“Scifresh”中,更强的细胞黏附导致细胞破裂而不是像“Royal Gala”中看到的那样通过细胞到细胞分离导致组织破裂。cdta可溶性果胶在两个品种的发育过程中存在差异,这表明其参与了细胞粘附。在果实发育的早期阶段,果胶甲基酯酶活性较低,加上缺乏免疫可检测的PG,与' Scifresh '中细胞黏附增加有关。
结论
我们的研究结果表明,导致苹果果实软化率差异的细胞壁结构在果实生长的早期发育,早于成熟过程的诱导。
背景
苹果品种在成熟过程中表现出不同的软化速率,成熟后硬度也会有所不同[1].我们的目的是确定苹果果实软化行为的这些差异何时会显现出来;在果实发育的早期阶段,细胞分裂停止,细胞扩张开始,形成复杂的三维皮层组织;或者在发育后期,当果实接近完全大小并开始成熟时。在这项研究中,我们探索了皮层微结构在苹果发育和成熟过程中软化行为中的作用。
苹果在生长过程中经历两个不同的阶段:一个是在盛花后持续3-5周的细胞密集分裂阶段,另一个是细胞扩张阶段,此时细胞分裂停止[2].随着果实的生长和体积的增大,质量的增加主要是通过水分的吸收和薄壁细胞体积的增加[3.].在果实膨胀过程中,硬度下降,这与细胞包装密度降低、细胞体积和空气空间增加相吻合[4].因此,细胞壁不仅要在生长过程中保持结构的完整性,还要允许细胞大小和相关的细胞外空气空间的扩张。目前,关于果实生长过程中组织微结构的发展和细胞壁的变化的信息很少,更不用说这些发育过程在具有不同软化行为的品种之间的差异了。相反,人们对细胞壁化学和微结构的变化给予了相当大的关注[5,6然而,这对于理解重要的微观结构特征在生长过程中发展的适用性有限。
组织微结构的评估是复杂的,因为它受到许多不同的细胞成分的影响,需要多种互补的方法来建立一个关于品种差异的可靠观点。使用苹果定位群体来调查纹理属性与细胞大小和形状之间关系的研究产生了不一致的结果,其中一项研究未能检测到细胞大小的数量性状位点(QTL),尽管检测到了纹理属性的QTL [7].相比之下,第二项研究表明细胞大小和结构特性之间存在显著相关性[8].对成熟的商业苹果品种的进一步研究加强了细胞大小和质地之间的联系,其中感官上多汁性的增加与更大的细胞大小和更密集的组织有关[9].
组织微结构的另一个重要方面是相邻细胞之间的相互连接,以及它们如何构成三维结构。细胞间黏附是重要的,因为它影响组织的断裂路径,并有助于组织衰竭的模式。对苹果断裂表面的检查,以及对不同类型水果的更广泛的调查,显示出两种主要的组织衰竭:1)细胞破裂,导致细胞内容物释放;2)细胞间分离,相邻细胞分离而不发生细胞破裂[10- - - - - -12].研究还表明,细胞破裂可归为赤道破裂,或称为顶部或底部破裂,这可能影响细胞内容物释放的速度[9].这些结果加强了从中间层的溶解和相邻细胞的分离方面了解细胞壁化学性质的必要性,同时考虑到软化过程中不同类型的果胶在细胞连接区的空间分布。
同源半乳糖醛酸(HG)果胶被认为在细胞间粘附中起主要作用,因为它通常存在于两个相邻细胞相邻的细胞壁的中间板层区域[13].在这里,汞的未酯化半乳糖醛酸残基被认为通过钙交联提供了相邻细胞之间的主要结合[14].可能在调节细胞粘附特性中发挥作用的酶是果胶甲基酯酶(PME)和内聚半乳糖醛酸酶(PG),其中PG被认为在PME产生的未酯化半乳糖醛酸残基范围内解聚HG [15].
多项研究报道了PG在苹果中的发生和活性[16- - - - - -19]但PG蛋白的低丰度和在大多数情况下无法检测到的酶活性已经将研究转向了转基因方法[20.- - - - - -22].表达与成熟有关MdPG1' Royal Gala '基因在冷藏过程中被诱导[23],而在' Royal Gala '中下调其表达增加了细胞黏附,减少了软化[21],而同一基因的过度表达导致' Royal Gala '叶片细胞间分离增加[20.],表明PG在细胞间黏附丧失中起作用。PME蛋白存在于大多数植物组织中,并以多种亚型存在。在苹果中,PME活性在生长过程中增加,在成熟相关的软化过程中降低[24],但其作用不如PG明确。除了果胶相关的变化外,木葡聚糖和木葡聚糖内转葡萄糖酶/水解酶(XTH)等酶也在苹果果实质地和软化的发展中发挥重要作用[8,25].最近在苹果中的研究表明乙烯诱导XTH基因表达增加,从而强调了XTH在苹果果实软化过程中对木葡聚糖修饰的作用[26].
在本文中,我们确定了“Scifresh”(商业销售的Jazz™)在果实发育和软化过程中的微观结构特性,这种苹果品种在成熟过程中缓慢失去硬度,尽管乙烯产量高,并将其与“Scifresh”的亲本“Royal Gala”进行比较,后者在成熟过程中软化更快,但乙烯产量同样高。这种方法的优点是成熟表型不会被乙烯产量的差异所混淆,从而能够更可靠地评估结构特征对软化的相对贡献。通过使用不同的技术组合,我们研究了不同品种在细胞大小和细胞包装、断裂模式、抗拉强度和细胞间粘附性方面的差异。免疫定位,细胞壁分离和尺寸排除色谱被用来检查相邻细胞之间的果胶差异,以及在生长和成熟过程中细胞外空气空间形成的区域。研究了果胶改性酶果胶甲基酯酶(PME)和聚半乳糖醛酸酶(PG)的参与。
结果
“Scifresh”和“royal Gala”在生长和成熟过程中的一系列生理参数不同
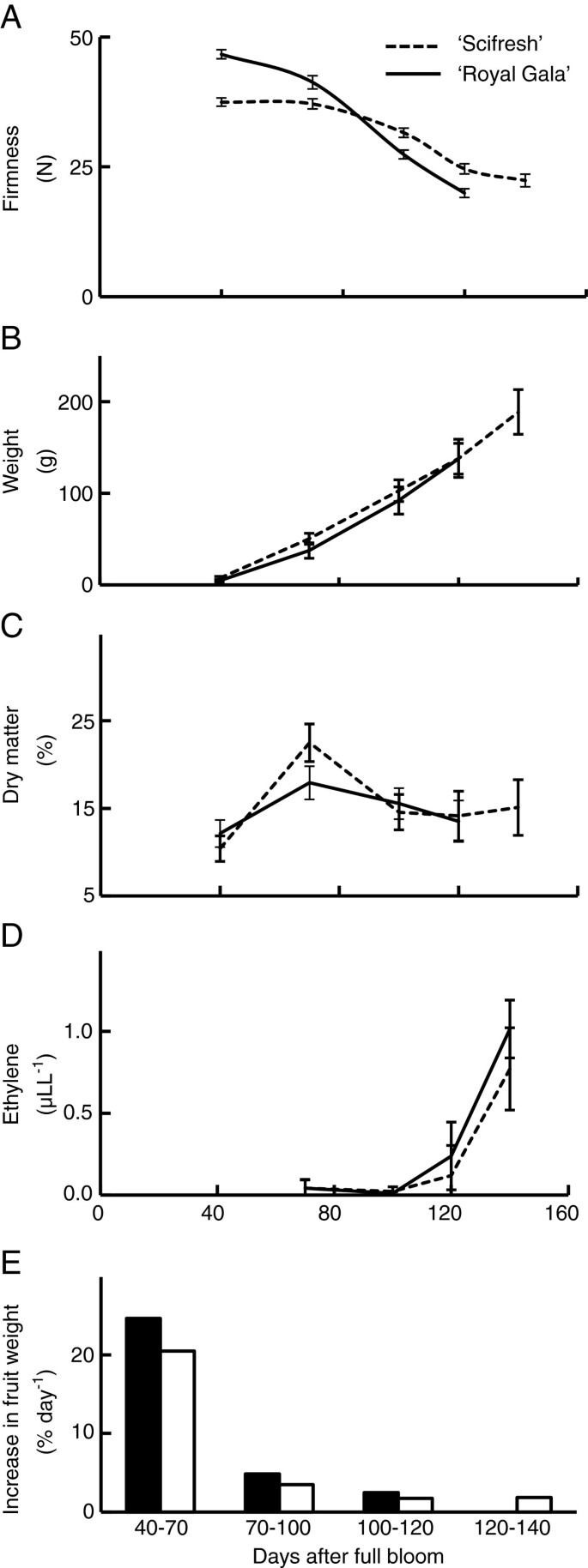
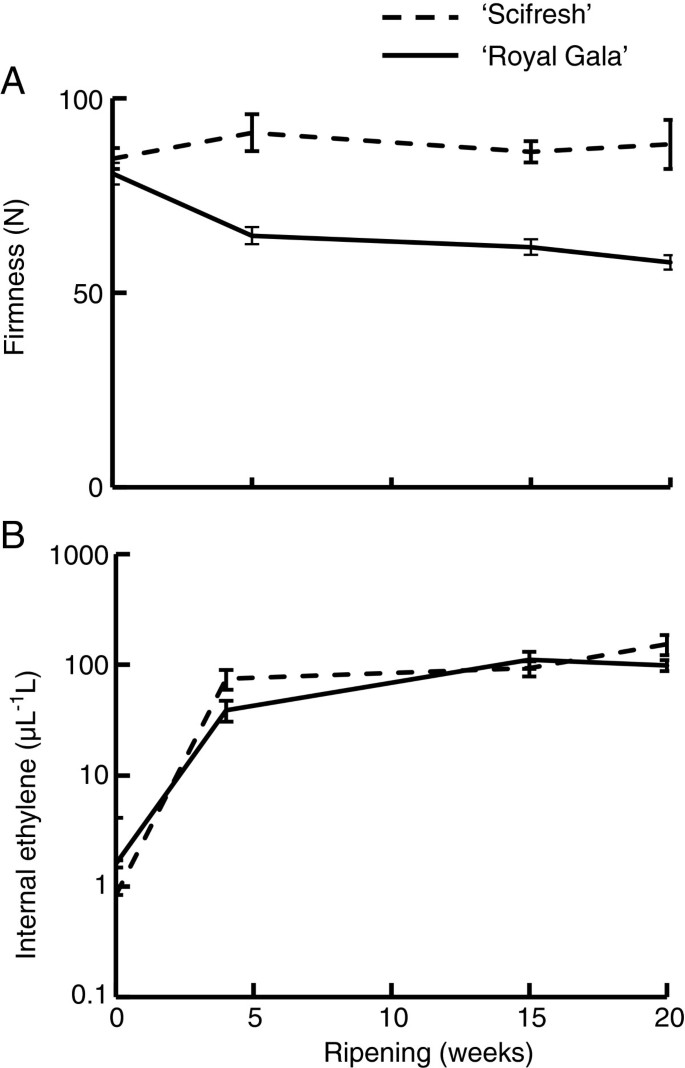
两种苹果品种的硬度在果实生长过程中呈下降趋势,但初始硬度和随后的下降速度不同。在40 DAFB时,“Royal Gala”水果比“Scifresh”水果更硬,但成熟后软化速度更快,硬度更低1A).“新鲜”苹果有一个滞后阶段,硬度损失最小,在40到70 DAFB之间。两个品种的果实重量增加幅度相似(图1B),这与坚定度的下降相吻合。然而,硬度的下降并不完全是由于水果的生长,因为“Scifresh”的硬度滞后阶段并不伴随着较慢的生长。两个品种的干重积累相似,唯一的差异是“Scifresh”积累的干物质比“Royal Gala”多70 DAFB(图1C).对于“Scifresh”,干物质积累的峰值与硬度损失滞后阶段的结束相吻合(图1A)和快速增长阶段(图1E),表明不同品种在果实生长过程中干重同化和结构特征的差异。两个品种在果实生长和成熟过程中果实内部乙烯浓度具有可比性1D),乙烯含量在100 ~ 120 DAFB之间发生突变。这两个品种在成熟过程中也产生了相似的乙烯浓度,但在软化率上有很大的差异(图2).在成熟过程中,' Royal Gala '的硬度下降了约35%,而' Scifresh '的硬度在同一时期实际上没有变化2一个)。
“Scifresh”皮层组织细胞更大,密度比“Royal Gala”更大
皮层组织的冷冻扫描电镜图显示,两个品种在果实期的细胞大小相似3.A, C),但在成熟阶段,“Scifresh”的细胞比“Royal Gala”的细胞大(图3.B, D,同等大小的水果。成熟果实的平均细胞直径为166±13.8 μm (n= 15),成熟的“皇家加拉”果实平均细胞直径为107±11.7 μm (n= 15)。这些发现与[一致]27他发现,用另一种方法,“Scifresh”细胞的面积比“Royal Gala”细胞大49%。我们的研究结果表明,“Scifresh”的细胞在果实生长过程中比“Royal Gala”的细胞扩张速度更快,但两个品种的果实大小相似。在这两个品种中,在果实和成熟阶段观察到较大的细胞间空气空间的发展(图3.).对空气空间体积的估计表明,一旦果实成熟,“Scifresh”的皮层组织密度比“Royal Gala”高(图2)3.E)。
在“Scifresh”中,成熟组织的断裂面显示更多的细胞破裂和更大的细胞粘附
使用传统的扫描电子显微镜,在成熟组织中观察到骨折模式的明显差异(图4模拟)。“Royal Gala”组织主要在细胞之间断裂,导致最小的细胞破裂(图4A, C),而“Scifresh”组织破裂更多发生于细胞破裂,相邻细胞之间细胞分离的证据很少(图4B, D).拉伸试验用于量化将皮层组织拉开所需的力。在果实发育的早期阶段(100 DAFB和成熟),两个品种的抗拉性能相似,在果实生长的最后阶段(100 DAFB到成熟),两者的抗拉强度都有所下降。一旦成熟,“Royal Gala”所需的力量比“Scifresh”少50%4E).这些拉伸特性支持断裂表面图像(图4A-D)通过在“皇家加拉”中显示细胞分离与相邻细胞之间的弱粘合力有关。
在整个发育过程中,“Scifresh”中的细胞连接充满了高度酯化的果胶,但在“Royal Gala”中没有
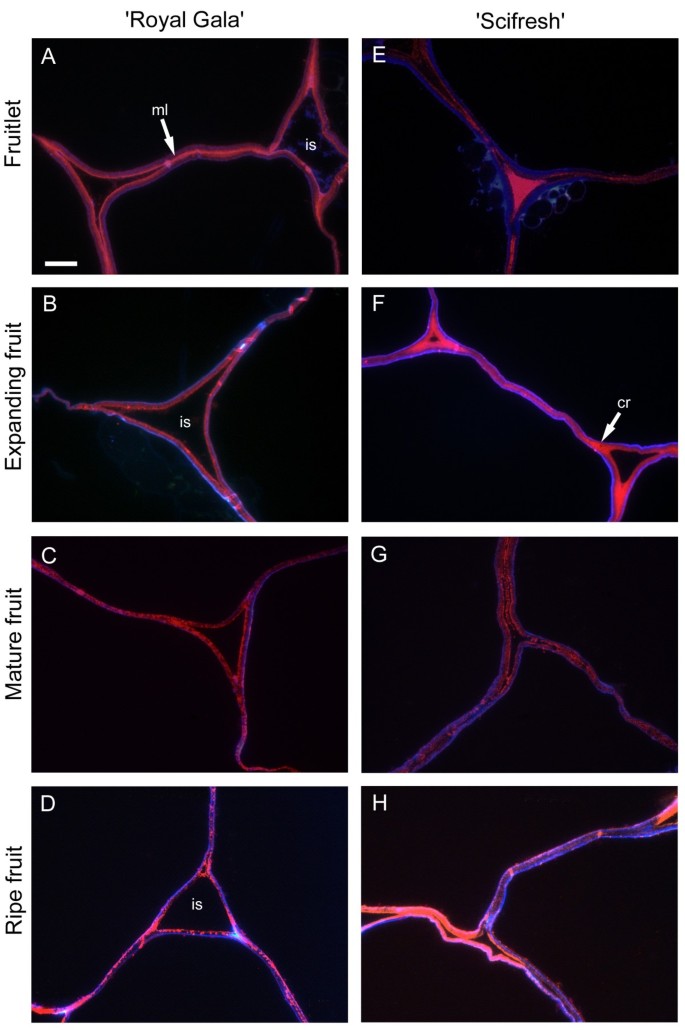
单克隆抗体LM19针对果胶的非甲基化或低甲基化HG区,在两个品种的组织中以两种不同的模式标记细胞壁,在中间板层区域和在三细胞连接的角落(图5;粉色标签)。两个品种的标记模式相似,在小果和膨大果中最明显,在成熟果和成熟果中最弱。在“Scifresh”中,在所有发育阶段,细胞间隙似乎都比“Royal Gala”中小,这支持密度测量(图3.E).细胞间空间,特别是在果芽期和膨大期的“Scifresh”中,其角落充满了非酯化或低酯化的果胶,而“Royal Gala”中这种表位在细胞间空间中似乎较少(图5).与钙氟共染切片(图5;蓝色标记)显示两个品种的细胞壁内向细胞腔方向的纤维素染色。额外的文件1:图S1为低倍率下LM19抗体的绿色荧光标记。
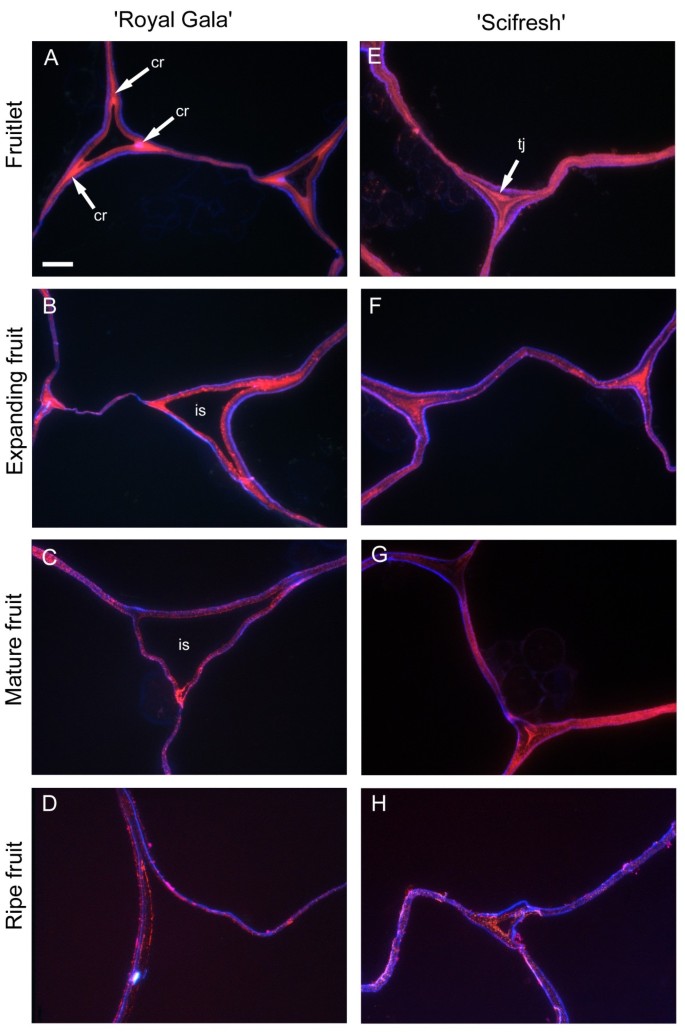
LM20,针对甲基酯化程度更高的HG区域,在三细胞连接的角落强烈标记为“Royal Gala”小果和膨胀的果实,而在“Scifresh”更紧密的细胞中,该表位更多地出现在整个连接区域,而不仅仅局限于角落(图)6,粉红色标签)。在“Scifresh”中,中间的片层区域也标记得更强烈,表明与“Royal Gala”相比,这些区域的汞酯化程度更高。在“Royal Gala”中,细胞间隙在水果生长过程中扩大,而在“Scifresh”中,细胞间隙保持与小果实阶段相似。与LM19一样,“Scifresh”小果和膨胀果的细胞间隙充满了酯化果胶(图19)6).此外,在“Scifresh”水果中,三细胞连接中酯化果胶的强烈标记一直持续到成熟,而成熟的“Royal Gala”水果则表现出较弱的标记。在两个品种的成熟果实中,标记变弱,尽管仍集中在中间的片层区域,但在填充三细胞连接的细胞间隙中没有标记。与钙氟共染切片(图6;蓝色标记)显示两个品种的细胞壁内向细胞腔方向的纤维素染色。额外的文件2:图S2和附加文件3.:图S3显示了LM20抗体的绿色荧光标记。
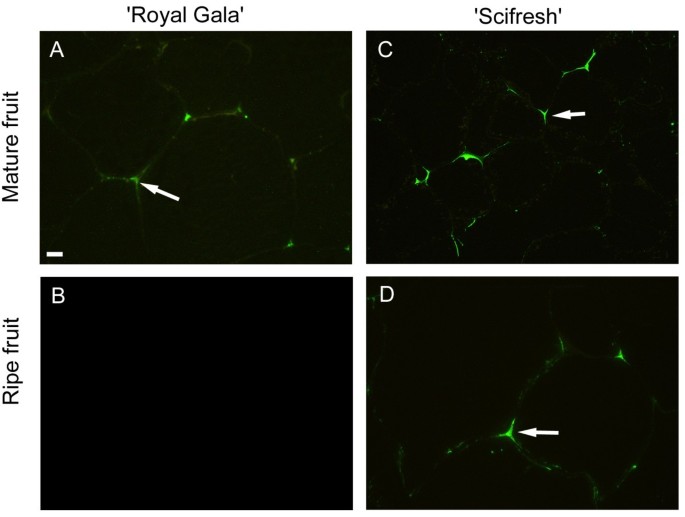
甲基酯化程度足够低(<40%)且含有至少9个连续的非酯化半乳糖醛酸残基的汞区可与钙等二价阳离子相互作用[28].单克隆抗体2F4特异性于这些钙交联HG表位。在两个品种的成熟果实中都检测到细胞壁被2F4标记,但在' Royal Gala '软化过程中消失,在' Scifresh '中仍然存在(图)7).在这两个品种中,标记局限于连接区,特别是三细胞连接区。在整个细胞壁没有发现标记,在中间片层也很少发现标记,这证实了钙交联HG表位仅限于细胞角和坑场的中间片层[29].在两个品种的果实中都没有检测到标签(未显示),而膨胀的果实也没有检测到。
在果实生长早期,不同品种的细胞壁产量和组成差异最大
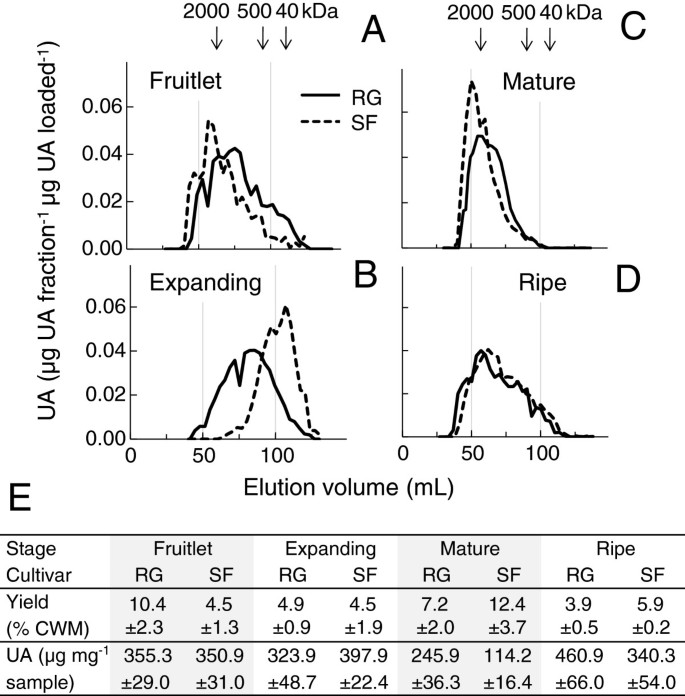
在两个品种中,以鲜重为基础的果仁细胞壁物质含量最高,在生长、成熟和成熟过程中呈下降趋势1).除了小果期外,“Royal Gala”的细胞壁材料产量明显高于“Scifresh”,两个品种的产量相当。果胶相关的糖糖醛酸、鼠李糖、阿拉伯糖和半乳糖的总和表明,果胶的数量超过非纤维素糖总量的80%(表1).
两个品种之间最大的差异是在果实阶段观察到的,更坚固的' Royal Gala '果实的醛酸含量约为' Scifresh '的两倍,但中性糖含量较低(表2)1).尽管“Scifresh”一开始在小果中含有较少的糖醛酸,但在生长和成熟过程中,它的相对糖醛酸含量下降得比“Royal Gala”慢,直到在成熟水果的细胞壁中,“Scifresh”的糖醛酸含量较高。总的来说,在果实生长和成熟过程中,两个品种中所有中性糖和糖醛酸的含量都有所下降,其中半乳糖和阿拉伯糖含量下降最为明显。
从70 DAFB开始,在硬度、干物质和生长速度方面,果实生理发生了重大变化(图1A, D, E),增长率百分比(图1E)与细胞壁材料的变化百分比进行比较,以确定细胞壁材料的产量是否反映在生长上。为了进行比较,计算净细胞壁含量并作为附加文件显示4:图S4显示了生长过程中细胞壁物质损失百分比与增长率的差异。该方法表明,净细胞壁含量的沉积强烈反映了生长,快速生长期(40 ~ 70 DAFB之间)也是净细胞壁含量最大的阶段。这两个品种在整个发育过程中具有相似的净细胞壁含量模式,一些证据表明' Royal Gala '在40至70 DAFB之间沉积更多。在70 ~ 100 DAFB之间,两个品种的净细胞壁含量沉积减慢,在果实接近成熟时可以忽略不计。
可溶性cdta果胶的产量、组成和分子量分布在生长和成熟过程中存在显著差异
不同品种间cdta可溶性果胶的分子量分布在生长和成熟阶段差异最大,而组成和产量差异最大的是在成熟阶段(图8).cdta提取的多醛酸酯在两个品种果实中的分子量分布非常相似,但在果实膨胀时,“Scifresh”比“Royal Gala”的下降幅度更大(图8在“Scifresh”中,这种减少伴随着cdta可溶性果胶产量的增加,而在“Royal Gala”中则没有(图)8E).随着果实成熟,“Scifresh”中cdta可提取多醛酸盐的分子量分布显著增加,与“Royal Gala”相似。在“Scifresh”中,这种增加伴随着cdta可溶性果胶产量的增加和其醛酸含量的降低(图8E).在成熟过程中,两个品种的分子量分布变宽,在成熟期和成熟期保持可比性(图8C, D)。在这两个品种中,产量下降了三分之一,而每毫克多糖的糖醛酸含量增加(图8E)。
果实发育早期果胶甲基酯酶活性的差异可能会影响两个品种在发育后期细胞壁的甲基酯化程度
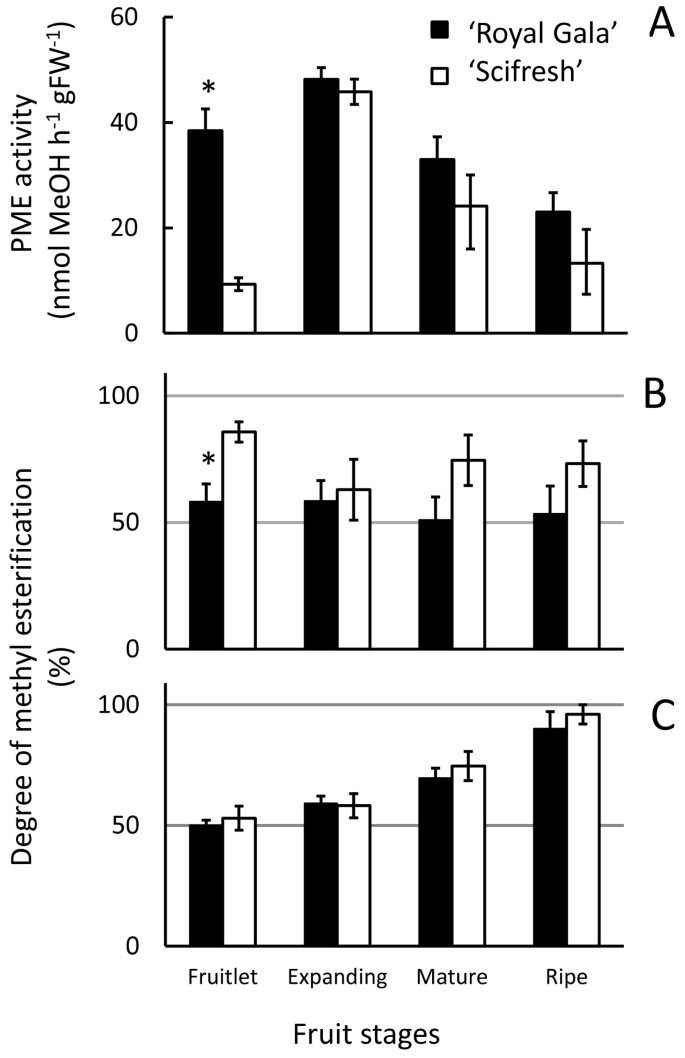
果胶甲基酯酶(PME)活性在小果期观察到显著差异,“Scifresh”的活性约为“Royal Gala”的四分之一(图)9A).然而,当“Scifresh”水果的数量增加时,PME的活动增加到“Royal Gala”中的相同水平。结果期后,PME活性持续下降,两品种间差异不大。
总的来说,细胞壁物质的甲基酯化程度(DE)在两个品种的发育过程中保持相对稳定(图9B).“Scifresh”细胞壁材料的DE普遍高于“Royal Gala”,但在果实膨大期DE与“Royal Gala”相似(图9B).两个品种果实中cdta可溶性果胶的DE最低,在发育过程中均有所增加,且DE水平相似(图9C)。
讨论
“皇家佳酿”苹果和“科学新鲜”苹果有着相似的基因背景;' Royal Gala '是' Scifresh '的母公司。它们在生长季节有相当大的重叠,生长速度、果实大小等生理特征相似,成熟过程中淀粉降解、可溶性固形物浓度和乙烯产量相似。尽管有这些相似之处,但它们的细胞微结构和软化行为却截然不同。《皇家庆典》在水果水果阶段比《科学新鲜》更加坚定。然而,' Royal Gala '在生长、成熟和成熟过程中失去硬度更快,结果比' Scifresh '更软,在果实成熟后硬度损失很小。这些不同的软化速率在时间上与乙烯的产生无关,因为与其他苹果相比,这两个苹果都是高乙烯产生者[1].“Scifresh”证明,一个苹果品种有可能具有高乙烯产量,但在很长一段时间内软化速度缓慢。我们的工作表明,软化不仅仅是由乙烯产生控制的,但乙烯信号通路、乙烯敏感性或在乙烯合成开始之前建立的细胞壁结构特征的差异也可能起作用。
一般来说,苹果小果实的细胞小,细胞壁厚,结构松散,无定形,可以迅速膨胀[2,25].在我们的研究中,两个品种在果期的细胞大小差不多;然而,“Scifresh”细胞壁材料的产量要低得多。因此,在这个阶段,(较软的)“Scifresh”水果的细胞壁必须比(较硬的)“Royal Gala”水果的细胞壁要薄。果实的细胞壁已经显示出不同的成分,与“Scifresh”果实的细胞壁相比,更坚固的“Royal Gala”果实具有更高的糖醛酸,但更低的中性糖(侧链)含量,伴随着更高数量的纤维素葡萄糖和更低程度的果胶酯化。在40 ~ 70 DAFB的细胞扩张阶段,两个品种的细胞壁材料产量减少了2 ~ 3倍,而果实大小(按质量计算)增加了25 ~ 30倍。这表明,在水果生长过程中,细胞壁是“净”合成的,而不仅仅是随着细胞的扩张,细胞壁逐渐变薄。尽管“Scifresh”比“Royal Gala”积累了更多的干重,但它的细胞壁合成率略低,但似乎更有效地维持了更强的细胞壁,从而保持了组织的结构坚固性,这可以通过在快速生长阶段软化的滞后阶段来衡量。
在成熟的水果中,“Scifresh”的皮层细胞明显比“Royal Gala”的皮层细胞更大。由于两个品种成熟果实的硬度非常相似,似乎细胞的生长和大细胞的发育不一定会损害细胞壁的强度,从而损害组织的硬度。这也可能表明' Royal Gala '和' Scifresh '之间的壁延伸动力学存在差异,后者已被证明受到作用于木葡聚糖的α-膨胀素的影响,从而导致壁松动[30.],以及延伸蛋白,其较高水平的表达与组织承受更高拉伸应力的能力有关[31].
“Scifresh”不仅能够在果实发育早期分配资源以强化组织,而且还能以一种允许细胞快速扩张的方式进行沉积。这种快速的细胞扩张阶段之前也被认为是一个高能量需求阶段,在这个阶段,许多基因在糖代谢和积累方面受到不同的调节[32];通过减少果实负荷来增加碳水化合物的可用性,可以促进果实生长早期的细胞生产[33].可能在“Scifresh”果实的膨大过程中(在这个阶段表现出比“Royal Gala”更高的干物质积累),以蔗糖、果糖或山梨醇形式存在的碳源优先优化为结构壁的构建,而不是其他细胞过程。此外,这也可能表明“Royal Gala”和“Scifresh”膨胀果中代谢糖和新合成糖之间的周转差异。在不同品种的苹果中受到不同调控的关键酶,如膨胀素、其他细胞壁相关基因以及淀粉代谢基因的基因表达水平[34],值得在未来的研究中进行更多的研究。
细胞壁材料的提取[35]表明,“Scifresh”水果比“Royal Gala”具有更高比例的更紧密结合的果胶和半纤维素,与“Royal Gala”相比,“Scifresh”可能具有更强的纤维素-果胶和/或纤维素-半纤维素网络,细胞壁特征一直存在到成熟阶段。“Scifresh”苹果可以适应细胞膨胀,同时不影响结构硬度,这一观察结果与[36]和[37他们报告说,具有较大细胞的苹果品种具有更好的保存质量和较慢的成熟速度,这可能是由于与较小细胞的较高呼吸频率相比,较低的呼吸频率。
据报道,细胞棱角分明的苹果更结实。27].与球形细胞相比,六角形细胞具有更多的小面,具有更大的粘附面积[38].“Scifresh”成熟果实的细胞比“Royal Gala”更大、更有棱角,并且具有更高的皮层密度,这表明空间更小,因此细胞与细胞的接触面积更大。这也可能表明膨胀压力较高,这有助于提高苹果果实的硬度[5].膨压为非木本植物组织提供了机械刚性,是生长的驱动力,但同时它产生了倾向于分离细胞的巨大力。因此,细胞粘附依赖于精确定位于最大应力点的强化区强度,即相邻细胞相遇的细胞连接处[39].在这些细胞连接处,“Scifresh”充满了高度酯化的果胶,从小果期到整个发育过程中,用LM20进行免疫标记显示。在“Royal Gala”果实中,这种标记远没有在“Scifresh”中那么强烈,也许是在这些三细胞连接中果胶的存在较低,解释了两个品种之间观察到的细胞大小差异。
从小果实到成熟果实,“Scifresh”保持了较强的细胞粘附性、较少的间隙和较高的细胞密度,而与“Scifresh”相比,成熟的“Royal Gala”组织断裂表面显示出较少的细胞破裂和更多的细胞分离。细胞破裂是感知多汁性的主要因素,要发生这种情况,细胞间的粘附性必须很强。更少的细胞间接触和更多的细胞间空气空间与成熟苹果柔软干燥的感觉有关。9,这在成熟的《皇家庆典》中很明显,但在《科学新鲜》中却没有。此外,在' Royal Gala '的成熟过程中,拉伸强度或拉伸组织的力(直到成熟阶段都是相同的)大幅下降,但在' Scifresh '中没有。抗拉强度取决于细胞的黏附强度,但也取决于细胞壁的整体强度,即抗断裂或弹性[40].也许在“Scifresh”中,即使在成熟阶段,也能保持强大的细胞粘附力的驱动力之一是三细胞连接角落中存在的果胶酸钙,这在两种水果的成熟阶段通过2F4免疫标记观察到,但在“Royal Gala”中,在成熟阶段没有检测到。
细胞壁的cdta可溶性部分含有果胶,果胶被认为是相邻细胞之间的重要连接成分,其成分、酯化程度和聚合物长度决定了这种“胶水”的强度。cdta -可溶性果胶的甲基酯化程度(DE)在两个品种之间非常相似,并且在发育过程中缓慢升高。然而,cdta可溶性部分DE的增加并不一定意味着生物合成,正如[41],但酯化程度更高的果胶随着成熟逐渐可提取。根据[42], HG与DE大于60%(显著存在于成熟和成熟两个品种的cdta可溶性果胶中)可以通过均半乳糖醛酸甲基酯化块之间的疏水相互作用和氢键形成凝胶。这些块状物越长,形成的凝胶就越强。尽管两个品种在整个发育过程中cdta可溶性果胶的DE相似,且分子量分布(膨大果期除外)仍然较大,但产量在两个品种之间存在差异,且在整个生长和成熟过程中与果实硬度相关,因为果实越硬产量越高。有趣的是,在膨大的果实中,两个品种中cdta可溶性果胶的分子量分布都有所下降,但“Scifresh”的下降幅度比“Royal Gala”更大。人们可以推测,分子量分布的减少可能有助于细胞扩张,因为这些果胶分子的长度较短可能导致内聚强度降低。由于“Scifresh”中的果胶分子相当短,“Scifresh”细胞可能会膨胀得更多,与“Royal Gala”相比,产生更大的细胞大小。
在细胞壁材料中,在整个发育过程中,“Scifresh”的DE总体上高于“Royal Gala”,这与该品种整体上较低的PME活性相吻合。与我们的研究一致的是,苹果中的PME在生长过程中增加,在成熟相关的软化过程中减少[24].PME的作用影响外质体pH值并改变细胞壁水解酶的活性[43]并改变果胶网络的刚性[44].据报道,果胶壁内甲酯基团的分布模式在决定果胶性质方面也很重要[42,45].与“Royal Gala”相比,高酯化HG区域的lm20标记在“Scifresh”细胞壁的整个中间片层和连接区更广泛,而“Royal Gala”的标记更局限于三细胞连接的角落。' Royal Gala '中甲酯基团的定位可能表明块状微结构域,这被认为会导致PG等酶的运动受限,PG对低酯化HG有偏好[46].有趣的是,免疫检测成熟相关的PG1蛋白只在快速软化的“Royal Gala”果实中发现,而在“Scifresh”果实中没有发现,从而证实PG表达可能依赖于品种,并在决定苹果果实质地中发挥重要作用[47,48].' Royal Gala '果实中较高的PME活性可能导致更多的非酯化HG的生成,为PG的作用提供更多的底物,从而为' Royal Gala '中的果胶解聚和更快的软化奠定了基础。
在成熟的‘Scifresh’中缺乏与成熟相关的PG1蛋白(图10)使得“Scifresh”和转基因PG1反义“Royal Gala”苹果之间有了一些令人信服的相似之处[21].和“Scifresh”一样,反义苹果在成熟阶段比野生“Royal Gala”的抗拉强度更高,因此细胞粘附力更强,细胞破裂率也更高。然而,没有证据表明反义苹果的气孔减少或细胞密度增加,表明这些特征与PG1无关。反义“皇家庆典”苹果的软化速率也低于野生型“皇家庆典”苹果;然而,它们的软化速度仍然快于Scifresh,这证实了除了PG之外,还有其他因素参与了苹果的软化。“Scifresh”和PG1反义“Royal Gala”与野生型“Royal Gala”细胞黏附的差异可能与果胶含量的差异有关。“Scifresh”(35]和反义' Royal Gala ' [21与野生型' Royal Gala '相比,PG具有更高的cdta可溶性果胶产量,而水溶性果胶产量较少,这意味着PG对果胶的溶解有一定影响。
结论
我们已经确定了一个苹果品种(“Scifresh”),尽管乙烯产量高,但果实软化缓慢,这为研究细胞壁和组织微结构提供了一个系统,没有乙烯的混杂影响。通过比较“Scifresh”和软化更快的“Royal Gala”,我们发现了组织微结构和细胞壁特性的差异,这些差异可能会影响成熟过程中的软化速度。这些结构特性早在盛花后40 ~ 70天就已形成,远早于诱导成熟和成熟过程。与“Royal Gala”相比,“Scifresh”水果的细胞更大,细胞间的粘附力更强,空间更小。细胞间强烈的粘附似乎是由于果胶在细胞角落的沉积增加,果胶的相互作用如此强烈,以至于在细胞扩张和成熟过程中很少有空间能够发育。“Scifresh”中缺乏免疫可检测的PG,很可能加强了这种表型。这可能是因为这些在细胞连接处的强果胶相互作用,细胞在细胞内断裂,而不是像“皇家庆典”中那样在细胞间断裂。
方法
果实材料及生理评价
苹果果实(马吕斯x有明显“Scifresh”和“Royal Gala”的样本来自新西兰北部哈夫洛克的植物与食品研究果园。在每个阶段,从四棵苹果树上(并排生长,暴露在相同的管理制度下)在相似的位置采集5个苹果,每个品种20个果实。根据开花后的天数(DAFB)、大小、果皮颜色、淀粉和可溶性固形物含量对果实阶段进行分类。在40 DAFB下采样的水果,此时水果处于细胞分裂阶段的结束和细胞扩张的开始[2,被称为“水果”。在细胞扩张阶段采样两个中间时间点,70和100 DAFB,并称为“扩张果实”。根据淀粉清除程度,成熟的“皇家加拉”水果在120 DAFB下取样,而“Scifresh”在140 DAFB下取样,因为它们在达到与“皇家加拉”相同的生理年龄之前有更长的发育周期,被称为“成熟”水果。然后,这些水果在0.5°C的环境大气压和湿度下成熟20周,并称为“成熟水果”。
用穿刺法评估果实的硬度[49]和拉伸试验[21],由于水果大小的限制,后者仅从100 DAFB起评估。穿刺试验使用两个直径为5mm(小果到成熟果实)或11mm(成熟果实到成熟果实)的圆柱形探针,使用TA。纹理分析仪(稳定微系统,英国)。内部乙烯浓度[49]和干物质浓度[50]是从总共20个水果库中的3个散装重复样品中确定的。通过测量1 cm的体积位移来确定成熟果实的皮质组织密度3.切除组织块[4].
在这些评估之后,将果皮组织切丁,立即在液氮中冷冻,并在-80°C保存,用于细胞壁分析和酶活性测定。显微组织准备如下所述。
常规扫描电子显微镜(SEM)
将苹果切片从皮肤纵向切至皮层组织(不包括核心组织),并固定在2%多聚甲醛和0.1%戊二醛0.1 M磷酸盐缓冲液(pH 7.2)中。片段在磷酸盐缓冲液中洗涤,并在从10%到100%无水乙醇的乙醇系列中脱水(以10%的增量)。这些片段在Balzers CPD030临界点干燥器(Balzers,列支敦士登)中使用液态CO干燥2作为过渡流体。干燥的材料被安装在阳极氧化铝存根上(ProSciTech,澳大利亚),带有碳胶标签(ProSciTech),边缘涂上导电银液(ProSciTech),晾干1小时。材料在SEM涂层单元E5100(极化龙设备有限公司,英国)中溅射涂金,并储存在硅珠上(Scharlau,西班牙)在一个密封容器中,直到成像。扫描电子显微镜使用Quanta 250扫描电镜(FEI, Hillsboro, USA),加速电压为15 kV。
冷冻扫描电子显微镜
低温扫描电镜使用极化龙PP2000低温转移系统(QuorumTechnologies, United Kingdom)连接到FEI Quanta 250扫描电子显微镜[51].“Royal Gala”和“Scifresh”苹果大小匹配,皮层组织样本被切割并安装在含有胶体石墨和OCT™化合物混合物的样品盒中(Sakursa Finetek,荷兰)。立即将组织冷冻在液氮浆液中,转移到PP2000系统的制备室中,在那里将组织断裂,露出表面以供观察。在-90°C的温度下,将冰升华到部分蚀刻表面15分钟,溅射涂上金/钯,转移到扫描电镜的冷冻阶段(-150°C),并在10 kV的加速电压下观察。
Immunolabelling
用LR White树脂(英国London resin Company Ltd)浸渍上述制备的固定和乙醇脱水切片,然后放入含有LR White树脂的明胶胶囊(ProSciTech) [52].硬化后(55°C, 48 h)取出胶囊,使用金刚石刀和Leica UCT超微切片仪(Leica,德国)对嵌入组织进行切片,切片(200 nm)在Superfrost®聚l -赖氨酸载玻片(25× 75× 1 mm, Biolab,美国)上风干。用于标记的抗体有LM19、LM20 [53]和2F4,均由PlantProbes(英国)提供。
用LM19和LM20标记,切片用含0.1% Tween 80 (PBS-T)的磷酸盐缓冲生理盐水湿润10分钟,然后用0.1%牛血清白蛋白c (BSA-c;Aurion,荷兰)在PBS-T中阻断非特异性标记(15分钟),然后用一抗(在PBS-T中0.1% BSA-c中稀释1:20 v/v)在4°C的潮湿室中孵育过夜。然后在PBS-T中清洗玻片。
对于2F4,在免疫标记之前的化学去酯化步骤是必要的,以揭示表位。简单地说,切片在0.05 M NaOH (pH 12.4)中室温孵育30分钟,然后如上所述加入BSA-c,以阻断非特异性结合。尽管这种处理可能会引入人工因素或以某种方式改变表位-抗原结合位点的原始丰度,但由于在两个苹果品种上进行了相同的处理,这使它们具有可比性。然后切片在含5% (w/v)低脂奶粉的TCaS缓冲液(20 mM Tris-HCl pH 8.2, 1 mM CaCl2, 150 mM NaCl)中孵育1小时,以阻断非特异性标记,随后在含0.05% (v/v) Tween 20和1% (w/v)低脂奶粉的TCaS缓冲液中用一抗2F4[稀释1:20 (v/v)]在4°C的潮湿室中孵育过夜,并在TCaS缓冲液中清洗载片[54].
所有样本的二抗标记相同。用山羊抗大鼠IgG AlexaFluor 488 (Molecular Probes, Oregon, USA)在PBS中稀释1:1:600 (v/v),在黑暗中室温孵育2小时。
切片进一步在1 mL 0.01%氟钙(荧光增白剂28,Sigma)中室温孵育6分钟[55]以区分可能没有抗体标记的细胞壁边界。切片用超纯水清洗,在室温下晾干,然后使用防褪色剂Citifluor (Citifluor,英国)盖在载玻片上[52].
阴性对照组仅用一抗(200 μL山羊抗大鼠IgG AlexaFluor 488在PBS中1:600稀释),切片在黑暗中孵育2 h后成像,结果为阴性(图像未显示)。
切片使用Olympus Vanox AHT3复合显微镜(Olympus Optical, Tokyo, Japan)进行观察,带有用于抗体标记的蓝干涉滤光片和用于钙氟染色的UV滤光片,并使用CoolSnap彩色数码相机系统(Photometrics, USA)进行成像。在Windows XP上使用Adobe Photoshop Version 6.0对图像进行进一步处理。显示了两组图像;高倍倍率钙氟双重标记(蓝色)和抗体标记对比增强,通过改变色调角度为红粉色(图)5,6),以及抗体免疫荧光标记为绿色(图7和附加文件1:图S1,附加文件2:图S2,附加文件3.:图S3)。
细胞壁材料及cdta可溶性果胶的制备
利用20个苹果皮层组织的复合样本进行细胞壁分离和提取,并将其分为3个水果子样本,形成3个提取重复。细胞壁制备方法如[56],得到水溶性部分和细胞壁材料,但在二甲基亚氧化物提取后,用α-淀粉酶(40 U/mL) (Megazyme,爱尔兰)和普聚糖酶(20 U/mL) (Megazyme)在37°C培养1 h消化去除果果中残留的淀粉。从细胞壁材料(2.5 g)中提取cdta -可溶性果胶,如[56].
尺寸排除色谱法
CDTA可溶性果胶(2.5 mg)溶于0.5 mL水中,用Sepharose CL-2B (GE Healthcare, USA)色谱柱(2.5× 100 cm)洗脱,在0.05 M醋酸铵缓冲液(pH 5.0)中,平均流速为5 mL h-1.收集各馏分(20分钟)并测定糖醛酸[57].用右旋糖酐(GE Healthcare)蓝右旋糖酐(2 MDa)、T500 (500 kDa)和T40 (40 kDa)对色谱柱进行校准。
果胶甲基酯酶(PME)提取及活性测定
研磨的冷冻苹果组织(0.25 g)在0.5 mL 0.2 M MES、7.5 mM四硫酸钾、10 mM二硫苏糖醇、1.7 M NaCl (pH 6.0)和25 mg聚乙烯聚吡啶烷酮中提取。对混合物进行漩涡、离心和上清液回收。将颗粒重新悬浮在0.25 mL的提取缓冲液中,并在冰上孵卵20分钟,如上所述回收上清液。组合上清液为PME提取物。测定PME活性[58],通过与醇氧化酶和n -甲基苯并噻唑啉酮-2-腙反应来定量释放的甲醇量。反应混合物中含有PME提取物(10 μL)、Tris-HCl pH 7.5 (100 mM) (20 μL)、0.5 U/mL乙醇氧化酶(5 μL;Pischia pastoris, Sigma-Aldrich), 3 mg·mL-1n -甲基苯并噻唑啉酮-2-腙(8 μL;默克,美国)2O (7 μL)和0.5 mg·mL-1酯化柑橘果胶(DE >85%;Sigma-Aldrich)在50 mM NaCl pH 7.0 (10 μL)中处理。在30°C孵育20 min后,加入40 μL (5 mg·mL)终止反应-1硫酸亚铁铵(BDH,英国)在磺胺酸(Medica Pacifica, NZ)和吸光度读数在620 nm。PME活性以每小时每克新鲜重量释放的摩尔甲醇来表示,基于甲醇的标准曲线。活性测定分三次进行。
聚半乳糖醛酸酶(PG)提取和Western blotting
从冰冻苹果组织(0.1 g)中提取蛋白质,加入1 mL 7 M尿素、2 M硫脲、40 mM Tris、75 mM DTT、4% CHAPS,用冷丙酮沉淀浓缩。蛋白质通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE) (Mini-PROTEAN®TGX™,BIO-RAD,美国)分离,电印迹到聚二氟乙烯膜上,并按照[21].用抗血清将蛋白质免疫标记至苹果PG1 (1:10 00 (v/v),稀释于含5%脱脂奶粉的TBS缓冲液中)。膜用抗兔碱性磷酸酶偶联二抗(Sigma-Aldrich)孵育,PG结合使用1-Step™NBT/BCIP (Thermo Scientific, USA)进行可视化。
分析方法
糖醛酸的测定方法见[57].甲基酯化程度(DE)由[59]果胶皂化后用气相色谱法定量甲醇。多糖在50 mM柠檬酸、1 M NaCl和1 M NaOH的溶液中在4°C下皂化过夜。混合物用柠檬酸和25毫米中和n-丙醇作为内标添加。样品(1 μL)在BP20色谱柱上用GC-FID分析[(15 m × 0.25 μm) Fischer Scientific, UK;烘箱温度80°C,氦气流速1.5 psi;探测器温度为240°C],并进行两次测量。DE计算为甲醇与糖醛酸的摩尔比,基于已知甲醇量的标准曲线。
统计分析
采用Microsoft Excel 2007 for Windows软件进行单因素(细胞壁材料硬度和产率)或双向(成分和酶测定结果)方差分析。均值比较使用Fisher最小显著性差异(LSD)后验P≤0.05使用SPSS (Version 15.0)软件(IBM,美国)。
缩写
- CDTA:
-
Trans-1 2-diaminocyclohexane-N, N, N ', N ' -tetraacetic酸
- DAFB:
-
盛开后的日子
- 德:
-
甲酯化程度
- 德勤:
-
二硫苏糖醇
- HG:
-
Homogalacturonan
- LM:
-
利兹单克隆抗体
- PBS-T:
-
含0.1% Tween80的磷酸盐缓冲盐水
- 答:
-
聚半乳糖醛酸酶
- 中外职业:
-
果胶methylesterase
- SD:
-
标准偏差
- SE:
-
标准错误
- UA:
-
糖醛酸。
参考文献
Oraguzie NC, Volz RK, Whitworth CJ, Bassett HCM, Hall AJ, Gardiner SE:苹果种质资源收集中Md-ACS1等位型和收获季节对低温贮藏果实软化的影响。生物技术学报,2007,44:212-219。10.1016 / j.postharvbio.2006.12.013。
杨晓明,杨晓明,杨晓明,杨晓明:苹果果实生长模式的外线性模型。中国生物医学工程学报,2003,26(4):349 - 349。
普拉特C:苹果花和果实,形态学和解剖学。园艺学报,1998,10:273-308。
Volz RK, Harker FR, Lang S:“Gala”苹果在果实发育过程中硬度下降。地球科学进展,2003,29(4):497 - 497。
Tong C, Krueger D, Vickers Z, Bedford D, Luby J, El-Shiekh A, Schackel K, Ahmadi H:“蜜脆”苹果、亲本和“美味”苹果贮藏期间软化相关变化的比较。地球科学进展,1999,29(4):344 - 344。
蔡国强,尹淑娟:苹果成熟前软化对细胞大小和细胞壁成分的影响。HortSci。2004, 39: 1227-1230。
King GJ, Lynn JR, Dover CJ, Evans KM, Seymour GB:苹果(Malus pumila Mill.)果实质地遗传变异的数量性状位点解析。应用理论,2001,32(3):344 - 344。10.1007 / s001220000530。
王晓明,王晓明,王晓明,王晓明。苹果子代细胞壁多糖和半纤维素酶活性的研究进展。中华生物医学杂志,2011,49:1104-1109。10.1016 / j.ijbiomac.2011.09.007。
alan - wojtas P, Sanford KA, McRae KB, Carbyn S:描述苹果纹理的综合微观结构和感官方法。地球科学进展,2003,29(3):366 - 366。
Harker FR, Hallett IC:低温贮藏期间与苹果果实粉状发展相关的生理变化。HortSci。1992, 27: 1291-1294。
Harker FR, Redgwell RJ, Hallett IC, Murray SH:新鲜水果的质地。园艺的评论。20卷。编辑:Janick J.纽约:John Wiley & Sons Inc: 1997,122-202。
Harker FR, Stec MGH, Hallett IC, Bennett CL:实质植物组织的纹理:拉伸和其他仪器和感官测量组织强度和多汁性之间的比较。采后生物技术,1997,11:63-72。10.1016 / s0925 - 5214(97) 00018 - 5。
Knox JP, Linstead PJ, King J, Cooper C, Roberts K:果胶酯化在细胞壁内和根尖发育组织之间受到空间调控。植物学报,1998,18(4):344 - 344。
Thompson AJ, Tor M, Barry CS, Vrebalov J, Orfila C, Jarvis MC, Giovannoni JJ, Grierson D, Seymour GB:一种新型多性番茄成熟突变体的分子和遗传特征。植物科学学报,2004,27(3):389 -389。10.1104 / pp.120.2.383。
陈晓明,陈晓明,陈晓明:转基因植物细胞壁代谢与果实软化品质的关系。植物化学学报,2001,47:331 - 334。10.1023 /: 1010656104304。
巴特利IM:苹果外聚半乳糖醛酸酶。植物化学学报,1998,18(3):344 - 344。10.1016 / s0031 - 9422(00) 94148 - 7。
王志刚,王志刚,王志刚,王志刚。苹果温控贮藏的细胞壁组成与果实软化。科学通报,1996,29(6):531 - 531。
吉冈浩,李志刚,杨志刚,杨志刚:梨和苹果果实软化过程中细胞壁聚脲酮的甲氧基化程度和分子质量。科学学报。1992, 27(1): 1 -6。
吴倩,吴倩,吴倩。苹果内聚半乳糖醛酸酶及其在果实成熟过程中的表达。中国农业科学,2003,27(3):357 - 357。
Atkinson RG, Schröder R, Hallett IC, Cohen D, MacRae EA:多聚半乳糖醛酸酶在转基因苹果树中过度表达导致一系列涉及细胞粘附变化的新表型。植物科学学报,2002,29(4):344 - 344。10.1104 / pp.010986。
Atkinson RG, Sutherland PW, Johnston SL, Gunaseelan K, Hallett IC, Mitra D, Brummell DA, Schröder R, Johnston JW, Schaffer RJ:下调POLYGALACTURONASE1对苹果果实硬度、抗拉强度和水分损失的影响。中国生物医学工程学报,2012,29(3):329。10.1186 / 1471-2229-12-129。
Wakasa Y, Kudo H, Ishikawa R, Akada S, Senda M, Niizeki M, Harada T:具有长期贮藏潜力的苹果果实中一种内聚半乳糖醛酸酶基因的低表达。生物技术学报,2006,39:193-198。10.1016 / j.postharvbio.2005.10.005。
Tacken E, Ireland H, Kularajathevan G, Karunairetnam S, Wang D, Schultz K, Bowen J, Atkinson RG, Johnston JW, Putteril J, Hellens RP, Schaffer RJ:乙烯和低温对苹果聚半乳糖醛酸酶1基因调控和果实软化的作用。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.109.151092。
古老,李志刚,李志刚,李志刚。苹果生长成熟过程中细胞壁修饰酶活性的研究。中国生物医学工程学报,2007,29(3):357 - 357。10.1016 / j.postharvbio.2006.10.002。
Percy AE, Melton LD, Jameson PE:苹果果实发育和成熟过程中细胞壁中的木葡聚糖和半纤维素。植物科学学报,1997,25(3):344 - 344。10.1016 / s0168 - 9452(97) 04618 - 9。
Muñoz-Bertomeu J, Miedes E, Lorences EP:乙烯处理苹果和番茄果实中木葡聚糖内转葡萄糖化酶/水解酶(XTH)基因的表达及XET活性。中国植物学报,2013,30(1):344 - 344。10.1016 / j.jplph.2013.03.015。
McAtee PA, Hallett IC, Johnston JW, Schaffer RJ:一种快速分离水果细胞大小和形状的方法。植物学报,2009,5:5-11。10.1186 / 1746-4811-5-5。
Morris ER, Powell DA, Gidley MJ, Rees DA:果胶的构象和相互作用I.聚半乳糖酸钙凝胶态和固态态的多态性。中华药理学杂志,2002,26(3):357 - 357。10.1016 / 0022 - 2836(82) 90484 - 3。
Bush MS, Marry M, Huxham IM, Jarvis MC, McCann MC:马铃薯结节形成过程中果胶表位的发育调控。植物学报,2001,29(2):379 - 379。10.1007 / s004250100570。
Park YB, Cosgrove DJ:木葡聚糖缺失突变体xxt1/xxt2细胞壁生物力学特性的变化。中国生物医学工程学报,2012,29(4):344 - 344。10.1104 / pp.111.189779。
陈勇,陈志强,陈志强,陈志强:延伸蛋白超家族在原代细胞壁结构中的作用。中国生物医学工程学报,2011,29(3):344 - 344。10.1104 / pp.110.169011。
李敏,冯峰,程磊:苹果果实发育过程中糖代谢与积累相关基因的表达模式。PLoS ONE。2012, 7 (3): e33055。10.1371 / journal.pone.0033055。
Dash M, Johnson LK, Malladi A:减少果实负荷通过提高碳水化合物的可用性、改变细胞生产相关基因的表达和增加细胞生产来影响苹果的早期果实生长。环境科学学报,2013,38(3):344 - 344。
Janssen BJ, Thodey K, Schaffer RJ, Alba R, Balakrishnan L, Bishop R, Bowen JH, Crowhurst RN, Gleave AP, Ledger S, McArtnery S, Pichler FB, Snowden KC, Ward S:苹果花蕾到成熟果实发育的全局基因表达分析。中国生物医学工程学报,2008,28(4):329。10.1186 / 1471-2229-8-16。
Ng JKT:奥克兰大学食品科学系。两个苹果品种不同质地的发展:细胞壁研究。博士论文。2012
Smith WH:苹果果肉的组织结构与生长和衰老有关。中华医学杂志,2004,18(3):349 - 349。
李志刚,李志刚:苹果果实壁发育:薄壁细胞生活史的研究。应用物理学报,2004,19(4):366 - 366。10.1093 / jxb / 19.3.496。
Vincent JFV:苹果果肉的密度和硬度之间的关系。中国农业科学,2007,29(4):344 - 344。10.1002 / jsfa.2740470406。
贾维斯MC,布里格斯SPH,诺克斯JP:植物细胞间粘附和细胞分离。植物细胞环境学报,2003,26:977-989。10.1046 / j.1365-3040.2003.01034.x。
德贝丽,李志刚,李志刚,李志刚。成熟和膨松对梨拉伸性能的影响:细胞和组织变化的微观研究。中国科学:地球科学,2004,25(3):357 - 357。
马西特P, Baron A, Drilleau JF:贮藏对苹果细胞壁多糖酶解的影响。高分子学报,1996,29:381 - 381。10.1016 / s0144 - 8617(96) 00043 - 4。
Willats WG, Orfila C, Linberg G, Bucholt HC, Van Abeleek GJWM, Voragen AGJ, Marcus SE, Christensen TMIE, Mikkelsen JD, Murray BS, Knox P:植物细胞壁中果胶均半乳糖酸甲基酯化程度和模式的调控:果胶甲酯酶作用、基质性质和细胞粘附的意义。中国生物医学工程学报,2001,26(3):344 - 344。10.1074 / jbc.M011242200。
格里尼翁C, senenac H:外质体的pH值和离子条件。植物化学学报,2001,29(3):344 - 344。10.1146 / annurev.pp.42.060191.000535。
马建平,杨建平,杨建平,杨建平,马建平:柑橘果胶甲基酯酶对模型半乳糖醛酸的酶法改性:1。纳米结构表征、酶的作用模式及影响因素,农业食品化学学报,2011,59:2717-2724。10.1021 / jf104845j。
Ralet MC, Crepeau MJ, Lefebvre J, Mouille G, Hofte H, Thibault JF:拟南芥突变体果胶中均半乳糖醛酸结构域数量的减少增强了聚合物的灵活性。生物活性物质学报,2008,29(4):344 - 344。10.1021 / bm701321g。
Steele NM, McCann MC, Roberts K:成熟番茄细胞壁的果胶修饰发生在不同的结构域。中国农业科学,2004,27(3):357 - 357。
魏健,马峰,石松,齐霞,朱霞,袁娟:苹果成熟过程中细胞壁降解相关酶活性及基因表达的变化及采后调控。中国生物医学工程学报,2010,29(4):344 - 344。10.1016 / j.postharvbio.2009.12.003。
Longhi S, Hamblin MT, Trainotti L, Peace CP, Velasco R, Costa F:基于候选基因的方法验证了Md-PG1是影响苹果(Malus x domestica Borkh)果实质地的主要QTL。中国生物医学工程学报,2013,26(3):344 - 344。10.1186 / 1471-2229-13-37。
庄士伟,王敏,王晓峰,王晓峰,王晓峰。苹果对乙烯敏感性的差异对苹果早熟和晚熟事件的协调起调控作用。应用物理学报,2009,30(2):379 - 379。10.1093 / jxb / erp122。
帕尔默JW, Harker FR, Tustin SD, Johnston JW:果实干物质浓度:一种新的苹果质量指标。中国农业科学,2010,30(4):457 - 457。10.1002 / jsfa.4125。
Woolf AB, Wibisono R, Farr J, Hallett I, Richter L, Oey I, Wohlers M, Zhou J, Fletcher GC, Requejo-Jackman C:高压加工对牛油果切片的影响。中国食品科学,2013,18:65-73。
萨瑟兰P,哈利特I,琼斯M:利用抗体探测细胞壁结构和发展:个人的观点。新西兰林业科学,2009,39:197-205。
杨晓明,李志强,李志强,李志强,等。果胶同源半乳糖醛酸单克隆抗体的研究进展。碳水化合物学报,2009,34(2):344 - 344。
lines F, Van Cutsem P:悬浮培养胡萝卜细胞壁中果胶多糖的分布。中国生物工程学报,1994,27(3):344 - 344。10.1007 / BF01384453。
Wood PJ:直接染料与多糖相互作用的特异性。碳水化合物,1980,85:271-287。10.1016 / s0008 - 6215(00) 84676 - 5。
Melton LD, Smith BG:植物细胞壁的分离和细胞壁多糖的分离。食品分析化学手册:水,蛋白质,酶,脂类和碳水化合物。编辑:Wrolstad RE.新泽西州:John Wiley & Sons Inc: 2005, 697-719。
Blumenkrantz N, asbo - hansen G:定量测定糖醛酸的新方法。生物化学学报,2003,23(4):484-489。10.1016 / 0003 - 2697(73) 90377 - 1。
Anthon GE, Barrett DM:三种比色剂在乙醇氧化酶测定甲醇中的比较。果胶甲基酯酶测定的应用。中国农业科学,2004,29(4):457 - 457。10.1021 / jf035284w。
McFeeters RF, Armstrong SA:植物细胞壁中果胶甲基化的测量。中国生物化学杂志,2004,29(4):344 - 344。10.1016 / 0003 - 2697 (84) 90407 - x。
确认
本研究由新西兰商业、创新和就业部(CO6X0705)资助。作者要感谢Erin O 'Donoghue教授我们酯化程度的方法,以及David Brummell和Ross Atkinson对手稿的批判性阅读。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
JWJ、LDM、BGS、RS、ICH和JN构思并设计实验,JN完成所有实验,MIH和RP协助进行果实评估和酶测定,PWS协助进行免疫标记。RS、JN进行数据分析,JN、RS、JWJ、BGS、ICH、LDM撰写论文。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2013_1391_moesm1_esm.jpeg
附加文件1:图S1:用抗体LM19在' Royal Gala ' (A-D)和' Scifresh ' (E-H)苹果皮层组织中低酯化均半乳糖醛酸的免疫荧光标记。水果:40 DAFB;膨胀果:70 DAFB;成熟果实:120 DAFB (RG) 140 DAFB (SF);成熟水果:0.5°C下20周。在(A)杆= 50 μm的所有显微照片。是:细胞间隙。(jpeg2mb)
12870 _2013_1391_moesm2_esm.jpeg
附加文件2:图S2:在' Royal Gala ' (A-D)和' Scifresh ' (E-H)苹果皮层组织中用抗体LM20对高度酯化的均半乳糖醛酸进行免疫荧光标记。水果:40 DAFB;膨胀果:70 DAFB;成熟果实:120 DAFB (RG) 140 DAFB (SF);成熟水果:0.5°C下20周。在(A)杆= 50 μm的所有显微照片。是:细胞间隙。(jpeg2mb)
12870 _2013_1391_moesm3_esm.jpeg
附加文件3:图S3:在高倍镜下,' Royal Gala ' (A)和' Scifresh ' (B, C)果实皮层组织中,用抗体LM20对高度酯化均半乳糖醛酸进行免疫荧光标记。条形= 10 μm所有显微照片。A图显示“Royal Gala”果实切片,三细胞连接处角(cr)有明显的lm20标记模式,中间层(ml)区域染色非常强烈,特别是细胞间隙(lis)的内衬。面板B和C是“Scifresh”水果部分,显示了与“Royal Gala”不同的标签模式。图B显示三细胞交界处,lm20标记强烈,完全填满该区域。在所有观察切片中,“Scifresh”果实中70-80%的三细胞连接完全染色,而“Royal Gala”果实中只有30-40%的三细胞连接显示这种模式。图C显示了位于5个标记有LM20的细胞之间的“Scifresh”连接区,但细胞间隙(lis)的内层没有标记,这与“Royal Gala”小果(a)中观察到的模式相反。这强调了两个苹果品种细胞壁中高度酯化的均半乳糖醛酸的不同位置。(jpeg707kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取的文章,根据创作共用署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
吴志强,Schröder, R., Sutherland, P.W.et al。在苹果(Malus x domestica)果实生长过程中,细胞壁结构导致软化速率的品种差异。BMC植物生物学13,183(2013)。https://doi.org/10.1186/1471-2229-13-183
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-183
关键字
- 苹果
- 细胞粘附
- 细胞壁
- 水果坚定
- 免疫荧光标记
- 微观结构
- 果胶