抽象的
背景
喜树碱是一种特异性结合拓扑异构酶I的植物生物碱,抑制其活性并在DNA中诱导双链断裂并激活细胞应答对DNA损伤。
结果
玉米培养细胞在不同浓度的喜树碱的存在下培养。Camptothecin抑制培养的细胞生长,诱导基因组DNA降解,并诱导32kDa Ca2+/镁2+-依赖性核酸酶活性。这种核酸酶,我们称之为CaMNUC32,被锌抑制2+在酸性pH下,它主要定位于细胞核内,能切割单链和双链DNA,对单链DNA具有较高的活性。二维电泳结合质谱分析表明CaMNUC32属于I型S1/P1核酸酶家族成员。这种类型的核酸酶通常是锌2+但我们的结果支持先前的迹象,s1型核酸酶具有广泛的酶活性,包括Ca2+/镁2+-依赖的。
结论
我们已经鉴定和表征了CaMNUC32,一个32 kDa Ca2+/镁2+-拓扑异构酶I抑制剂喜树碱在玉米培养细胞中诱导的S1/P1家族依赖性核酸酶。
背景
拓扑异构酶I(拓步)是通过切割和重新加入一条DNA链[催化超螺旋DNA的松弛的酶1].TOPI活动对于分隔细胞至关重要,以释放DNA复制叉的进展产生的扭转。喜树碱(CPT)是一种特异性结合TOPI的植物生物碱,稳定在DNA和TOPI之间形成的复合物[2].在DNA复制期间捕获的TOPI-CPT复合物和复制叉之间的碰撞产生DNA断裂,诱导DNA损伤的反应,并取决于剂量,细胞死亡[3.].cpt诱导的DNA损伤反应也在植物中被观察到[4.].例如,CPT诱导玉米未成熟胚胎的DNA损伤,诱导参与DNA修复的基因转录,参与细胞分裂的基因抑制,参与应激反应的几种蛋白质的积累,以及一些核酸酶活性的诱导[5.].先前已经观察到响应DNA损伤剂的核酸酶活化[6.-8.].
真核核酸酶参与DNA限制,修复,重组,转置和编程细胞死亡(PCD)等几种方法[9.-11].植物核酸酶可以根据其催化性能被分类成组,其主要是二价金属离子的要求。植物具有核酸内切酶,锌两大类2+- 依赖和加利福尼亚州2+依赖核酸内切酶[9.那12]和参考文章。已经确定了一些其他亚组,它们的核溶解活性受到其他离子(如镁)的刺激2+[13],明尼苏达州2+[14]或co.2+[15].
Zn.2+- 依赖性核酸酶(也称为I型核酸酶或S1型核酸酶)包括酸性和中性酶,其分子量在30至45kDa之间,并且有效地降解RNA和变性DNA,但不是双链DNA。一些Zn2+- 例如,植物中描述了依赖性核酸酶,例如Mung Bean核酸酶[16],Zen1来自Zinnia Elegans.参与气管成分的分化[17],rabidopsis bfn1 [18]和Endo2 [19], 和别的 [20].加利福尼亚州2+-依赖性核酸酶包括中性酶[8.那17那21].例如,拟南芥Ca2+依赖的CAN核酸酶[22],杜仲Oliv。eucan1和eucan2 ca2+参与次生木质部发育依赖性核酸酶[23]和黄瓜ca2+在其他可能的功能中,-依赖核酸酶CsCaN参与了雌性黄瓜花发育过程中原始花药特异性DNA损伤[24].
确定一种核酸酶的催化需求是了解其生物学功能的必要条件。在正常情况下,植物细胞核和细胞质的pH值为中性(7.5左右),钙的浓度较低2+锌2+,质外体和液泡的pH值更酸性(约5.5)[25].液泡通常含有较高浓度的锌2+,胞质内Ca浓度较高2+细胞质中。然而,这种情况会因不同的刺激而改变。例如,在PCD过程中,液泡膜破裂产生高浓度的锌2+在细胞溶胶中也变得更加酸[26].也有报道说,由于钙的增加,一些胁迫会使胞质钙浓度升高2+质外体流入[27].这些变化可能改变特定核酸酶的活性。
在本文中,我们识别和表征CA2+/镁2+依赖性核酸酶其活性由CPT玉米培养细胞中诱导。我们培养的玉米细胞与CPT和我们观察到的钙增加2+- 依赖核酸酶活性与之前在玉米CPT处理的胚胎中观察到的核酸酶活性相似[5.].该核酸酶具有32kDa的质量,由CA激活2+和米格2+,受锌的抑制2+和EDTA。它可以切割单链和双链DNA,对单链DNA具有较高的活性,主要定位于细胞核。通过二维凝胶内分析和MALDI-TOF MS方法,以及凝胶内胰酶切,我们确定了负责核酸酶活性的蛋白,该蛋白属于S1/P1 I型内切酶家族。
结果
Campetecin在玉米培养细胞中的生长停滞和DNA碎片诱导
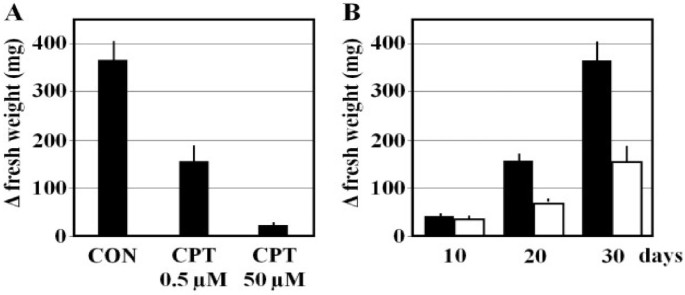
拓扑异构酶I抑制剂喜树碱(CPT)在加入培养基时产生玉米培养细胞生长的减少(图1A).浓度为0.5 μM CPT的愈伤组织鲜重比对照减少58%,浓度为50 μM CPT的愈伤组织鲜重比对照减少94%。生长抑制是持续的,所以鲜重的生长差异随着时间的增加而增加(图)1B) 。
核局部的CA2+/镁2+CPT在培养细胞中诱导的依赖性内核酸溶液活性
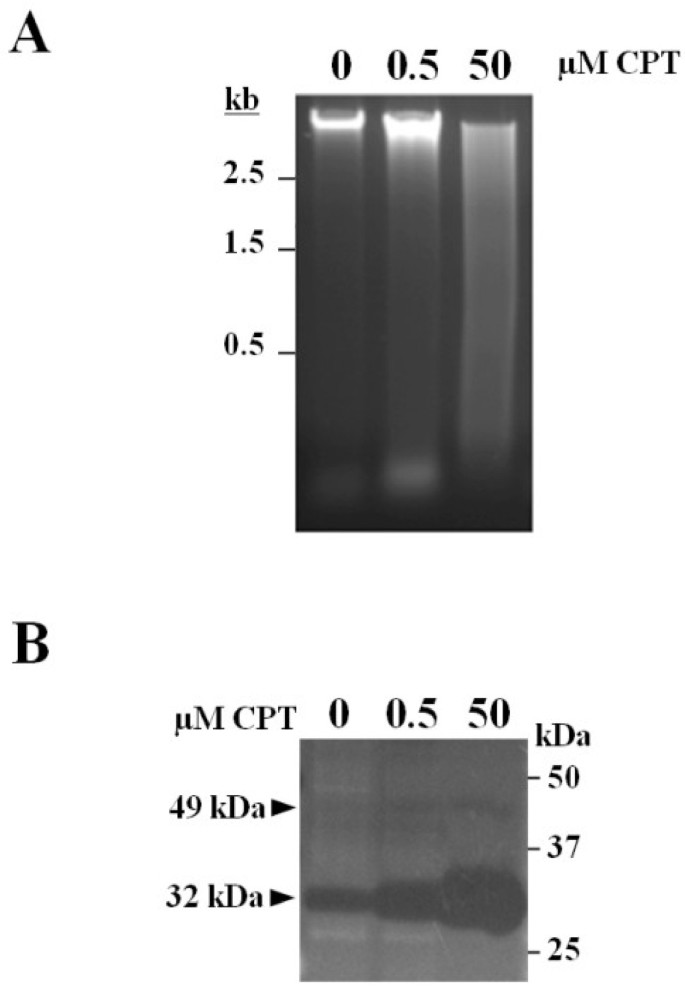
从CPT处理的玉米培养细胞中提取的基因组DNA片段的平均大小明显小于从未处理细胞中提取的基因组DNA片段(图1)2A) 这些差异在用50μM CPT处理的细胞中尤其明显,但在用0.5μM CPT处理的细胞中也很明显。
在Ca存在的情况下,用凝胶dna酶活性测定法分析培养细胞中存在的核酸酶2+和米格2+(数字2B).在处理和未处理的细胞的蛋白提取物中检测到分子质量为32 kDa的内切酶活性,但活性水平与培养基中CPT的浓度呈正相关。另一个估计分子量为49 kDa的核酸酶活性也被观察到,尽管它的活性要低得多,并且在CPT反应中没有变化。
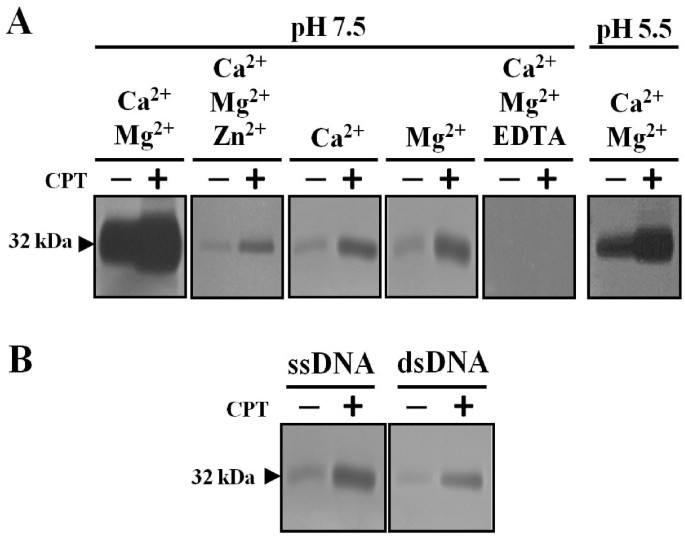
为了确定32 kDa CPT诱导核酸酶的催化要求,我们在不同培养条件下进行凝胶核酸酶分析(图3.A) 我们分析了三种二价金属离子对核酸酶活性的影响:锌2+,约2+和米格2+。Zn.2+和加利福尼亚州2+是植物核酸酶中最常见的金属离子辅因子,而Mg2+核酸酶活性。32kDa核酸酶活性仅在CA存在下略微存在2+或镁的存在下2+,尽管cpt处理的样本在这两种情况下都高于对照。然而,当凝胶在Ca存在的情况下孵育时,获得了非常高的活性2+和米格2+,显示cpt处理的细胞活性增加。Ca2+和米格2+-依赖性核溶解活性被1mM EDTA和锌强烈抑制,尽管不是完全抑制2+至少在我们的条件下。这一发现证实了常见的观察结果,即Ca2+-依赖的核酸酶活性可被锌抑制2+[9.].由于质量和阳离子偏好,我们称该核酸酶Camnuc32(CA2+/镁2+-依赖性核酸酶(32 kDa)。
pH值是另一个决定核酸酶活性的重要因素。大多数植物核酸酶在酸性或中性pH时活性最高[21].我们将32kDa核酸酶活性的强度与CA的存在进行了比较2+和米格2+在pH5.5和pH 7.5处孵育(图3.A).虽然在pH 5.5时也观察到活性,但它远低于pH 7.5时。在这两种情况下,从cpt处理的细胞中提取的样本的活性都更高。
植物核酸酶显示不同的特异性朝它们的底物,因此,我们使用单链和双链DNA分析的核酸水解活性。32 kDa的核酸酶能够水解单链和双链DNA,但示出了更高的活性对单链分子(图3.B) .在经CPT处理或未经CPT处理的样品中,对单链DNA的较高亲和力没有改变。
CaMNUC32亚细胞定位和亚型
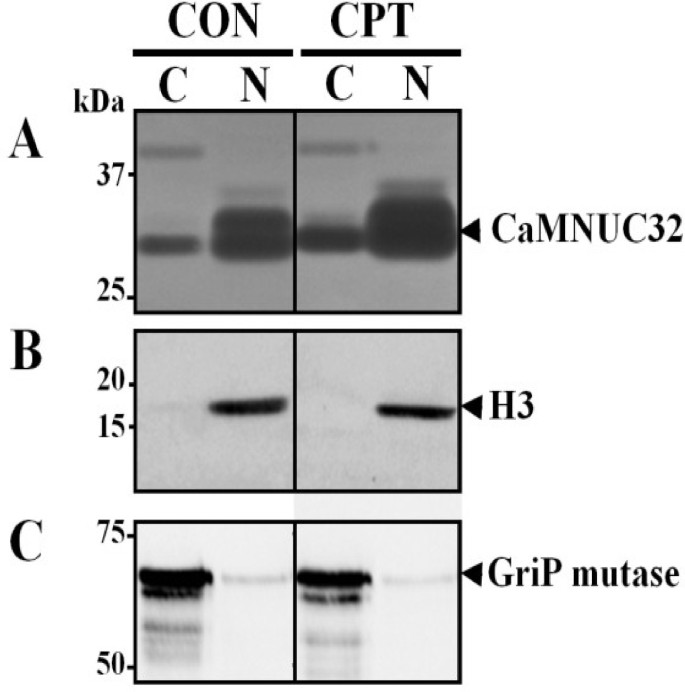
为了确定CaMNUC32的亚细胞定位,我们进行了细胞破碎实验。在细胞质和细胞核提取物中分析核酸酶活性(图4.A).通过免疫检测核定位蛋白(组蛋白3,图)来检测核组分的纯度4.B)和细胞质定位蛋白(GriP突变酶,图4.C)在这些试验中至少观察到四个核酸酶活性条带。前面观察到的(图2B)约49未CPT处理的样品中诱导的kDa的核酸酶活性只有在细胞质中存在。CaMNUC32的核活性主要是,但不完全,在核部分,本地化未彩管处理的样品中改变本地化。
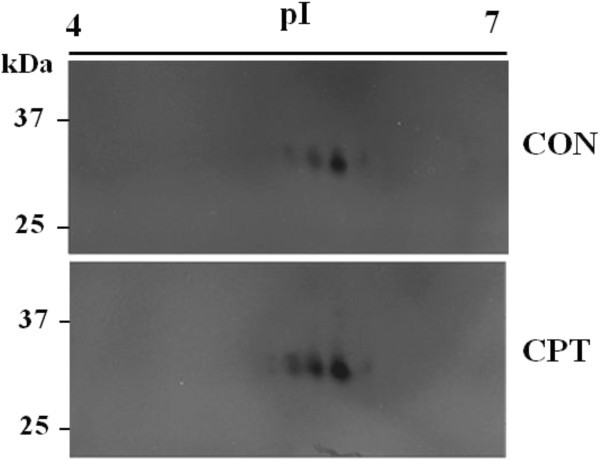
在这些凝胶内检测中观察到两个核酸酶活性条带,其分子量非常接近CaMNUC32(图)4.一种)。在核样品中观察到核酸酶的活动,并且在CPT处理的样品中,两个带的强度都较高。对CPT的类似行为,类似的亚细胞定位和类似大小表明它们是相同核酸酶的不同同种型,尽管我们也不能丢弃它们对应于不同核酸酶的可能性。为了澄清这一点,我们尝试了2D-In-In凝胶核酸酶活性测定。首先,我们检查了如果在用于2D凝胶的条件下保存Camnuc32活性。烷基化剂碘乙酰胺(IAA)的存在强烈抑制Camnuc32核酸酶活性,而还原剂二硫代噻唑(DTT)仅略微降低其活动(附加文件1:图S1)。随后,2D进行实验使用标准协议但省略使用IAA第二条带平衡步骤。当总提取物进行双向电泳分析,CaMNUC32活性在四个主要斑点划分与分子量,但示出不同的等电特性(PI 5.5,等电点5.7,等电点6.0,等电点6.2,大约)(图微小差异5.).除了在PI 5.3周围的额外活动之外,CPT产生了所有四个斑点的强度的增加,但没有产生CAMNUC32的等电性能的显着变化。核酸酶活性的分布模式表明Camnuc32蛋白质的翻译后修饰,但我们不能规则,它们对应于具有类似质量和不同PI的不同核酸酶。
Camnuc32是S1 / P1系列的I型内切核酸酶
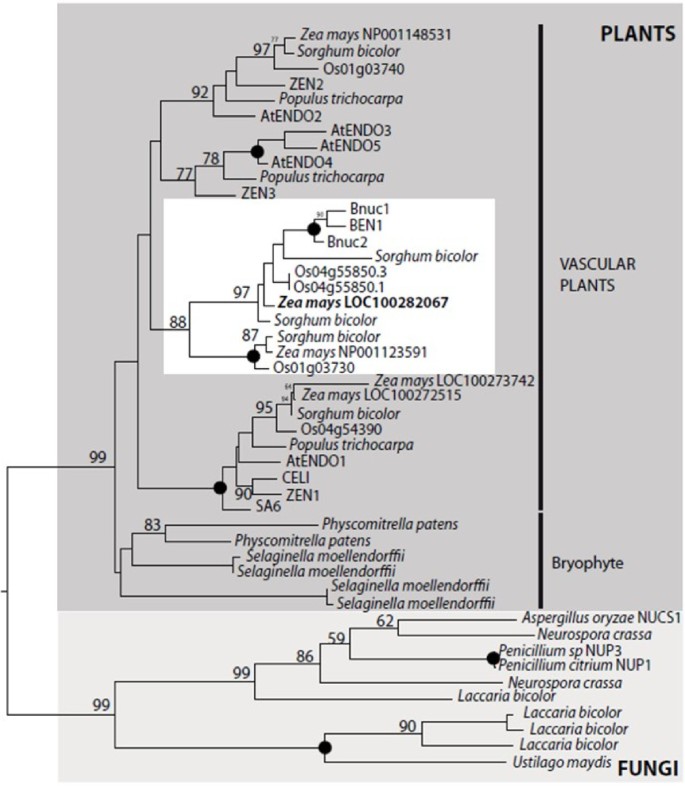
为了鉴定与CaMNUC32核酸酶活性有关的蛋白,用2-DE检测CPT处理的玉米细胞核蛋白提取物,然后进行核酸酶活性测定。如前所述,检测到四种活性,质量相近,pI不同(补充文件)2:图S2)。切除了较高活性的三个斑点(H1,H 2和H 3)。我们只拍摄了斑点的下部,以避免检测到的核酸酶活性,分子量略高于Camnuc32(图4.A).斑点切除后,凝胶胰蛋白酶消化,MALDI-TOF-MS胰蛋白酶肽和数据库搜索只有H2点提供了阳性数据。H2位点的消化包含一个肽(K.TCADKYAAESAK.L),与玉米PA3核酸酶(GeneBank, NP_001148452)相匹配,吉祥物评分为47,蛋白覆盖率为4%。尽管玉米基因组调查揭示了4个可能编码PA3核酸酶的位点,但蛋白质序列比对表明,tryptic peptide序列与LOC100282067基因的玉米蛋白编码完全匹配(附加文件)3.:图S3)。有趣的是,该蛋白质的预测质量和PI与H2点观察结果非常相似:32.0与32.8kDa,5.50与5.55 pi(预期与观察到)。植物S1-核酸酶的系统发育分析表明,三个主要基团在血管植物中分化,由Zen1 / AtenCO1,Zen2 / AtenCO 2和Zen3 / AtenCO 3表示,而Camncu32位于仅由谷物核酸酶组成的特定组中,明显不同于组-1和组2(图6.)因此,玉米与第1组具有清晰的同源性,以AtENDO1/ZEN1表示,第2组对应于AtENDO2/ZEN2[28].由于低的统计支持以及任何谷物包含明确的直系同源物成3组(AtENDO3 / ZEN3),核酸酶的这个特定簇很可能是在谷物的组3。
I型核酸酶的系统发育分析。从JGI Genome门户网站获得了完全基因组测序的植物物种的推定蛋白序列(http://genome.jgi-psf.org/).通过使用100-oveStraps重复推断使用最大似然法(RAXML)来推断系统发育树。对于每个疏水车,显着的引导节点支持值(高于50%)被注释,而100%值由黑点表示。由质谱(以粗体)鉴定的玉米核酸酶位于仅由谷物核酸酶(白方形)组成的特定组,与Zen1 / Atenco1(第1组)和Zen2 / Atenco2(第2组)表示的组成的特定组包括其他玉米成员。
讨论
本研究的目的是鉴定可能与喜树碱抑制玉米培养细胞生长有关的核酸酶。我们的结果表明,至少存在一种核酸酶,其活性是在CPT处理平行诱导的。我们的凝胶核酸酶分析表明,在CPT处理期间,一个32 kDa核酸酶的活性增加。与酸性pH值相比,这种活性在中性pH值中更高,在两种Ca存在时也更高2+和米格2+,而在单离子的存在下减少。EDTA抑制活性并减少Zn2+。对SSDNA观察到更高的核溶解活性,但它也朝向DSDNA活跃。核酸酶活性主要是虽然不属于核。
CaMNUC32显示的核酸酶活性的二维模式表明,该蛋白受到翻译后修饰,正如一些Ca的报道一样2+端依赖核酸酶(29]S1核酸酶在原核生物系统中的异源表达表明,翻译后事件对其活性至关重要[28那30那31]糖基化是一个很好的候选者,负责翻译后的变化,因为S1核酸酶和Ca2+-依赖性DNA酶被认为是糖蛋白[10那29].然而,可能会考虑其他翻译后的过程[32].
加利福尼亚州2+/镁2+-具有类似性质的依赖性核酸酶以前曾在不同的系统中被描述过2+/镁2+-依赖性核酸酶,在中性pH下表现出较高的活性,并被锌抑制2+[10].加利福尼亚州2+/镁2+-依赖核酸酶也被鉴定在小麦粒珠心细胞进行PCD,并被锌抑制2+[13].在小牛胸腺染色质中观察到类似的28 kDa核酸酶[33].Arabidopsis Can1和Can2核酸酶是中性,CA2+-对单链DNA、双链DNA和RNA底物显示不同特异性的依赖性核酸酶[22].然而,大多数人的身份2+/镁2+-依赖性核酸酶仍不确定[8.].
我们的2-DE核酸酶活性测定与斑点切除和凝胶内胰蛋白酶消化后的MALDI-TOF MS相关,表明CaMNUC32是I型内切酶S1/P1家族的成员。尽管结果提供了非常有限的序列覆盖率(附加文件3.:图S3),事实是,鉴定的蛋白质是一个推定的核酸酶,具有预测的分子质量和pI非常类似于观察到的,这为结果提供了足够的信心。I型S1/ p1 -核酸酶与来自中国的S1型核酸酶具有氨基酸序列同源性Aspergillus oryzae.传统的定义是需要锌2+为了活化和结构稳定,在酸性区域中具有pH值,含有30至43kDa,并且能够降解单链DNA [34那35]虽然它们中的一些有能力消化单链和双链DNA的能力[17].结果表明,部分s1型核酸酶为Ca2+/镁2+中性pH值最佳的依赖性核酸酶。事实上,这不是类似案例的第一个报告。例如,从芹菜中分离的S1样核酸酶CEL1作为Zn报告2+-镁2+端依赖酶(36[最近,已经表明,除了Zn之外,还表明拟南芥中的S1样系核酸酶2+-依赖酶,它还包括由钙激活的核酸酶2+和Mn.2+它们的最适pH值和底物特异性不同[12].总之,这些结果揭示了植物s1样核酸酶具有令人惊讶的广泛的酶活性。这也表明植物核酸酶的生化分类与它们的系统发育分类并不完全吻合。I型S1/ p1 -核酸酶不再被认为是Zn的同义词2+依赖的核酸。的各种各样的离子激活或抑制植物S1样核酸酶的发现为未来研究由这些酶催化的反应机制的新观点。S1样家族似乎对增加其催化性能的多样性发展。在真菌S1和P1核酸酶在细胞外的DNA和RNA [降解发挥作用37那38],而在植物中,大多数数据表明s1样核酸酶和PCD之间存在联系。需要进一步的分析来证明CaMNUC32参与PCD。其活性与DNA降解的相关性表明了这一功能。它的主要核定位也与PCD中的一个作用兼容,尽管它也兼容其他功能,如DNA修复或重组。CaMNUC32活性虽然较低,但也可以在细胞质中观察到,但这与PCD功能并不矛盾。例如,BFN1核酸酶位于早衰叶细胞的细胞质结构中,当组织衰老时,在细胞核周围观察到更多的BFN1 [39].另一方面,我们也观察到CaMNUC32在未经处理的细胞中的活性,原则上,这可能与PCD功能相矛盾。我们不能抛弃培养中的一些细胞正在经历一个衰老的过程。另一方面,在PCD不发生的组织中也检测到核酸酶活性,例如,在拟南芥成熟茎中显示低水平的BFN1活性[18].为了明确地将CaMNUC32与PCD联系起来,还需要进一步的分析。
结论
我们鉴定了一个32 kDa的核酸酶,我们称之为CaMNUC32,它的活性是由拓扑异构酶I抑制剂喜树碱在玉米培养细胞中诱导的。这种核酸酶的活性是Ca2+/镁2+-依赖于锌,并被锌抑制2+和EDTA。它能切割单链和双链DNA。MALDI-TOF MS经凝胶蛋白酶解提示CaMNUC32属于S1/P1 I型内切酶家族。
方法
细胞培养和治疗方法
我们用玉米(Zea Mays.)玉米细胞在MSE培养基(MS维生素,20 g l)上生长-1蔗糖,0.5g l-1MES,2.4-D 2mg-ml-1, 2 g l-1Gellite pH 5.8),并保持在26°C、45%湿度和16/8 h的光周期。必要时,向培养基中添加在DMSO(Sigma)中稀释的喜树碱(CPT),并向对照实验中添加相同体积的DMSO。每个处理至少进行三次独立实验。
DNA的分离和琼脂糖电泳
玉米愈伤组织在液氮中冷冻,并用研钵和杵研磨。用提取缓冲液(100 mM Tris–HCl,pH 8.0,50 mM EDTA,500 mM NaCl,10 mMβ-巯基乙醇,2%(w/v)SDS)提取DNA。在37°C条件下,在RNASE(60 ngμl)存在下培养10分钟,去除受污染的RNA-1).用苯酚:氯仿:异戊醇(25:24:1)提取后,用两体积无水乙醇沉淀DNA,再重悬于TE (10 mM Tris-HCl, 1 mM EDTA, pH 8.0)缓冲液中。DNA在1.5% (w/v)琼脂糖凝胶上分离,溴化乙啶染色。
蛋白质提取物的制备
从冷冻在液氮中的玉米愈伤组织中获得总蛋白提取物,用研钵和杵研磨,然后再悬浮在提取缓冲液中(150 mM Tris–HCl,pH 6.8,0.5 mM PMSF,20μM leupeptin)。匀浆在4°C下以12.000x g离心5分钟进行澄清。根据以下步骤制备玉米培养细胞的核蛋白和细胞质蛋白提取物:[40].
凝胶内核酸酶活性测定
核酸酶活性测定按照前面描述的方法进行[13那41]微小修改。蛋白提取物(10微克蛋白质)进行含有SDS-PAGE凝胶50微克毫升-1单链小牛胸腺DNA和50 μg ml-1牛血纤维蛋白原(Sigma公司)。在加样缓冲液制备样品(1%(W / V)SDS,62.5毫摩尔Tris-HCL,pH 6.8的,10%(V / V)甘油,10mM的β巯基乙醇),并加热2分钟,在100℃。电泳在20mA,在室温下进行。电泳后,将凝胶在25%(V / V)异丙醇,10毫摩尔Tris-HCL,pH 7.0的30分钟洗涤两次,然后两次在10mM的Tris-HCl 30分钟,pH为7.5。1毫米氯化钙:然后将凝胶在37℃下用这些化合物的一些温育过夜,在10mM的Tris-HCl,pH 7.5中2, 1毫米氯化镁2, 5毫米ZnSO4.和/或1 mm EDTA。在相同的条件下进行PH5.5测定,但在25mM乙酸钠pH 5.5中替换10mM Tris-HCl pH 7.5。最后,用1μgml染色凝胶-1溴化乙锭15分钟。在紫外线灯箱上拍摄核酸酶活性。
二维核酸酶活性测定
将蛋白质提取物重悬于再水化缓冲液中(7M尿素,2m硫脲,2%3 - [(3-胆氨基丙基丙基)-dimethylaminio] -1-丙烷磺酸盐(CHAPA),14mM DTT,18mM Tris-HCl和0.001%(w / v)溴苯酚蓝),并加载到7或11cm pH 4-7线性IPG条带(Amersham Biosciences)的第一维度。对于核提取物,并根据制造方法使用蛋白质脱盐栓塞柱(Pierce)通过缓冲液交换加入去磷酸化蛋白质再水解缓冲液。在室温下再水化条带6小时,在ICGphor系统(Amersham Biosciences)至10h,1.5小时,1.5小时,1.5小时,1.5小时,在2000 V,1.5小时,1.5小时,在2000V,1.5小时,1.5小时,在2000V,1.5小时,在2000V,1.5小时,1.5小时,在2000V,1.5小时,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,在2000V,1.5小时,1.5H)在ICGphor系统(Amersham Biosciences)中进行6小时。,1.5小时,4000 v,2小时,8000 V,然后保持8000 V,直到总共达到至少65000 VH。然后,在平衡缓冲液(50mM Tris,pH 8.8,6M脲,2%(w / v)Sds,30%甘油和0.04%(w / v)溴苯酚蓝,然后在平衡中,IPG条平均平衡15分钟含有10mg的缓冲液-1DTT 15分钟。使用10%SDS聚丙烯酰胺凝胶在第二尺寸中溶解蛋白质,并且如上所述进行DNase活性测定。
Western印迹分析
的提取物进行SDS / PAGE(10%丙烯酰胺)。电泳后,将蛋白以0.8毫安厘米电吸印到硝酸纤维素膜(Amersham Bioscience)上-2使用半干转移试剂盒(Bio-Rad)持续1小时。使用含有10%(w/v)奶粉的PBS-T缓冲液(20 mM Tris–HCl,pH 7.5,150 mM NaCl,0.1%吐温-20)封闭膜,并通过在20 ml PBS-T和1:1000组蛋白H3抗体(细胞信号技术®)或1:500多克隆握变位酶中在4°C下过夜培养膜来免疫化学标记蛋白质[42].随后的检测通过Chemolumpicencence测定(来自Roche的抗兔IgG辣根过氧化物酶缀合物)和Supersignal®WestFemto(Pearce)进行。
质谱
从二维凝胶中提取蛋白斑点,经胰蛋白酶消化,ESI-Q-TOF-MS/MS鉴定。采用基质辅助激光解吸电离时间质谱(MALDI-TOFMS)的肽质量指纹图谱或肽序列分析对蛋白进行鉴定。最后,在巴塞罗那科技园的蛋白质组学平台上进行了纳米液相色谱-纳米电喷雾串联质谱(ESI-Q-TOF-MSMS)。使用Protein Prospector v 3.4.1 (UCSF Mass Spectrometry Facility, University of California)和MASCOT软件包从PMF数据中识别蛋白质。使用SEQUEST软件(thermoinstruments, Spain)从串联质谱分析中初步鉴定蛋白,然后手工确认序列数据。在UniProtKB/Swiss-Prot蛋白知识库和NCBInr数据库20050416上进行序列搜索(2.440.549条序列;825.977.590序列)和20060729序列(3.822.560序列;1.317.468.070残基)使用蛋白质全系列先生和π.未应用分类限制。我们使用以下参数进行搜索:1缺失切割;固定和可变修饰分别为胱氨酸的氨基甲基和蛋氨酸的氧化。肽质量和片段耐受性分别为200 ppm和0.25 Da。对于吉祥物搜索,个体离子得分>47 indi同一性或广泛同源性(p < 0.05).
参考文献
- 1.
Champoux JJ:DNA Topoisomerases:结构,功能和机制。annu rev biochem。2001,70:369-413。10.1146 / annurev.biochem.70.1.369。
- 2.
Pommier Y:Topoisomerase I抑制剂:山腓和超越。NAT Rev癌症。2006,6:789-802。10.1038 / NRC1977。
- 3.
PiRet B,Piette J:Topoisomerase Poisons在ACH-2和CEM细胞中激活转录因子NF-κB。核酸RES。1996年,24:4242-4248。10.1093 / nar / 24.21.4242。
- 4.
De Jong Aj,Hoeberichts Fa,Yakimova et,Maximova E,Woltering EJ:番茄细胞中化学诱导的凋亡细胞死亡:伴侣样蛋白酶的涉及。Planta。2000,211:656-662。10.1007 / S004250000341。
- 5。
Sánchez-Pons N, Irar S, garia - muniz N, Vicient CM:喜树碱暴露玉米胚胎的转录组和蛋白质组学分析。植物营养与肥料学报。2011,11:91。10.1186 / 1471-2229-11-91。
- 6。
废弃基因组:核酸酶在细胞凋亡中的作用。中国生物医学工程学报,2005,26(6):677-688。10.1038 / nrm1715。
- 7。
Reape TJ,McCabe PF:植物中凋亡的编程细胞死亡。新植物。2008,180:13-26。10.1111 / J.1469-8137.2008.02549.x。
- 8。
Aleksandrushkina Ni,Vanyushin BF:内切核酸酶及其参与植物细胞凋亡。Russ J植物理体。2009,56:291-305。10.1134 / S1021443709030017
- 9。
Sugiyama M,Ito J,Aoyagi S,Fukuda H:内切核糖酶。植物mol biol。2000,44:387-397。10.1023 /答:1026504911786。
- 10.
江艾尔,郑义,李继,张W:锌依赖性核核酸酶负责盐诱导的水稻根尖细胞中的盐诱导的编程细胞死亡中的DNA梯。J植物理性。2008,165:1134-1141。10.1016 / J.Jplph.2007.12.008。
- 11
发芽小麦颗粒的盾片经历细胞程序性死亡:一种参与核拆除的酸性核酸酶的鉴定。中国生物医学工程学报。2012,31(4):593 - 598。10.1093 / jxb / ers199。
- 12
Lesniewicz K,Karlowski WM,Pienkowska JR,Krzywkowski P,Poreba E:类似植物S1的核酸酶家族已经进化出高度多样的催化能力。植物细胞生理学。2013,54:1064-1078。10.1093/pcp/pct061。
- 13
Domínguez F, Cejudo FJ:从正在经历程序性细胞死亡的小麦细胞中鉴定一个核定位核酸酶,该酶能够触发人类细胞细胞核的DNA片段和凋亡形态学。中国生物化学学报,2006,29(6):529-536。10.1042 / BJ20051809。
- 14
何X,Kermode AR:白云杉(云杉)种子大配子体细胞程序性死亡过程中的核酸酶活性和DNA断裂。植物分子生物学。2003,51:509-521。10.1023/A:1022319821591。
- 15
兰斯顿BJ,白S,琼斯ML:在衰老特异性核酸酶在乙烯 - 不敏感的(etr1-1)转基因矮牵牛花冠衰老过程中延迟了的DNA片段化和诱导增加。J Exp Bot。2005年,56:15-23。
- 16。
Johnson PH,Laskowski M:绿豆核酸酶I.II.双链脱氧核糖核酸的抗性和富含腺苷和胸苷区域对酶水解的敏感性.生物化学杂志,1970,245:891-898。
- 17。
ZEN1是在管状细胞程序性死亡过程中核DNA降解的关键酶。acta botanica sinica(云南植物研究),2002,14(4):427 - 434。10.1105 / tpc.006411。
- 18。
Pérez-Amador MA, Abler ML, De Rocher EJ, Thompson DM, van Hoof A, LeBrasseur ND, Lers A, Green PJ:拟南芥叶片和茎衰老过程中诱导的BFN1双功能核酸酶的鉴定。植物生理学报。2000,22(4):449 - 454。10.1104 / pp.122.1.169。
- 19。
柯振英,赖玉玲,刘文英,林超,陈永涛,陈丽芬,林天宇,肖JF:拟南芥的n -糖基化的催化作用和功能需求。中国食品科学,2012,30(6):569 - 574。10.1021 / jf300945c。
- 20.
Podzimek T, Matoušek J, Lipovová P, Poučková P, Spiwok V, Santrůček J:三种具有抗癌潜力的植物核酸酶的生化特性。植物科学学报,2011,40(6):751 - 756。10.1016 / j.plantsci.2010.10.006。
- 21.
王志强,王志强,王志强,等。花椰菜幼苗发育过程中核酸酶的研究进展。植物营养与肥料学报,2010,27(4):591 - 598。10.1016 / j.jplph.2010.03.011。
- 22.
Lesniewicz K,Poreba E,Smolarkiewicz M,Wolff N,Stanislawski S,Wojtaszek P:植物质膜结合葡萄球菌样DNA酶作为一种新型真核核酸酶。BMC Plant Biol.2012,12:195.10.1186/1471-2229-12-195。
- 23
陈HM,庞Y,曾杰,丁Q,尹SY,刘聪,吕木兹,崔坤,何晓青:钙依赖性DNA酶参与杜仲次生木质部发育。综合植物生物学杂志。2012,54:456-470.10.1111/J.1744-7909.2012.01134.x。
- 24
顾Ht,王DH,李X,何CX,徐Zh,白SN:含乙烯诱导的含钙诱导的钙依赖性核酸酶的表征,其在黄瓜花发育中差异表达。新植物。2011年,192:590-600。10.1111 / J.1469-8137.2011.03825.x。
- 25
Martin JB, Bligny R, Rebeille F, Douce R, legguay JJ, Mathieu Y, Guern J:核磁共振对液体培养植物细胞内pH值的研究。植物生理学报,1998,30(4):591 - 598。10.1104 / pp.70.4.1156。
- 26
液泡在植物细胞死亡中的作用。细胞死亡与不同。2011,18:1298-1304。10.1038 / cdd.2011.70。
- 27
Tena G,Boudsocq M,Sheen J:植物天然免疫中的蛋白激酶信号网络。Curr Opin plant Biol.2011,14:519-529.10.1016/J.pbi.2011.05.006。
- 28。
Triques K,Sturbois B,Gallais S,Dalmais M,Chauvin S,Clepet C,Aubourg S,Rameau C,Caboche M,Bendahmane A:拟南芥的特征意味着豌豆中的突变发现应用。工厂J. 2007,51:1116-1125。10.1111 / J.1365-313x.2007.03201.x。
- 29。
高敏感反应、细胞死亡和机械应激诱导的核酸酶活性和DNA片段的研究。植物生态学报,2003,23(4):591 - 598。10.1023 /: 1005868402827。
- 30.
Oleykowski CA,Bronson Mullins CR,Godwin AK,Yaung AT:使用新型植物内切酶进行突变检测。核酸研究,1998,26:4597-4602.10.1093/nar/26.20.4597。
- 31.
Pimkin男,Caretti E,Canutescu A,杨JB,科恩H,陈Y,Oleykowski C,Bellacosa A,杨AT:重组核酸酶CEL我从芹菜和SP我从菠菜中检测突变。BMC Biotechnol。2007年,7:29 10.1186 / 1472-6750-7-29。
- 32.
驯鹿J,Sickmann A:模拟:超出蛋白质磷酸化和糖基化的后期修饰。Biomol Eng。2007,24:169-177。10.1016 / J.Bioeng.2007.03.002。
- 33.
Nikonova LV、Zotova RN、Umanskii SR:Ca2+、Mg2的分离 + -小牛胸腺染色质的依赖性核酸酶。Biokhimia。1989,54:1709-1718。
- 34.
Desai Na,Shankar V:单链特异性核酸酶。FEMS Microbiol Rev.2003,26:457-491。10.1111 / J.1574-6976.2003.TB00626.x。
- 35
直到BJ,Burtner C,Comai L,Henikoff S:单链特定核酸酶不匹配裂解。Nucl酸res。2004,32:2632-2641。10.1093 / nar / gkh599。
- 36
杨B,文X,Kodali NS,Oleykowski CA,米勒CG,KulinskiĴ,Besack d,杨JA,科瓦尔斯基d,杨AT:净化,克隆和CEL我核酸酶的表征。生物化学。2000,39:3533-3541。10.1021 / bi992376z。
- 37
Balabanova L,Gafurov Y,Pivkin M,Terentyeva N,Likhatskaya G,Rasskazov V:海洋真菌melinii青霉的细胞外S1型核酸酶。海洋生物技术。2012,14:87-95.10.1007/s10126-011-9392-5。
- 38
Seper A,Fengler VH,Roier S,Wolinski H,Kohlwein SD,Bishop AL,Camilli A,Reidl J,Schild S:细胞外核酸酶和细胞外DNA在霍乱弧菌生物膜形成中起着重要作用。Mol Microbiol.2011,82:1015-1037.10.1111/J.1365-2958.2011.07867.x。
- 39
Farage Barhom S,Burd S,Sonego L,Mett A,Belausov E,Gidoni D,Lers A:拟南芥衰老和细胞死亡相关BFN1核酸酶的定位:从内质网到碎片核。Mol Plant.2011,4:1062-1073.10.1093/mp/ssr045。
- 40.
Domínguezf,莫雷诺J,Cejudo FJ:一种嗜酸虫蛋白诱导的核酸酶在经历编程的细胞死亡的小麦葡萄酮细胞中局部地定位。J Biol Chem。2004,279:11530-11536。10.1074 / jbc.m308082200。
- 41.
Thelen MP,Northcote DH:一种来自DNA的核酸酶的鉴定和纯化Zinnia Elegans.L.:一种潜在的木本发生分子标记。Planta.1989,179:181-195.10.1007/BF00393688。
- 42.
casella J, Urena J, Ludevid D, Carreras J, Climent F:大鼠磷酸甘油酸变异同工酶的免疫学特性。Acta bioologica sinica, 2003,23(4): 427 - 434。10.1016 / 0167 - 4838(88) 90254 - 3。
致谢
我们感谢F.J塞胡多博士(IBVF-CSIC,塞维利亚,西班牙),作为一个NSP短暂停留称为主机。我们也感谢P. Fontanet博士(CRAG,巴塞罗那,西班牙)的玉米细胞培养的支持,和博士。D. Ludevid和M.里耶拉博士(CRAG,巴塞罗那,西班牙),用于提供分别与多克隆抗GRIP变位酶和抗RAB17抗体。这项工作得到了补助BIO2004-01577和计划国立InvestigaciónCientíficaŸTECNICA(部:西恩西亚ŸTECNOLOGIA,西班牙),由中心CONSOLIDER上Agrigenomics AGL2009-09151和由加泰罗尼亚的Xarxa德Referencia恩Biotecnologia支持。NSP是由来自理事会全国高级科学调查德Científicas(CSIC)的资助。该出版物是由信息资源的单位进行研究(CSIC)的支持。
作者信息
从属关系
相应的作者
补充资料
利益争夺
作者声明他们没有相互竞争的利益。
作者的贡献
NSP和CV设计并执行了大部分实验,分析了数据并撰写了手稿。两位作者都阅读并批准了手稿。
电子补充材料
12870 _2013_1387_moesm1_esm.pptx
图S1: IAA和DTT对核酸酶活性的影响。从玉米培养细胞中提取15 μg总蛋白,在0.5 μM CPT(+)或DMSO(-)对照培养基中培养30天,进行核酸酶活性测定。测定是在1 mM钙离子存在下进行的2和1 mm mgcl2,25毫克毫升-1碘乙酰胺(IAA)和/或10毫克毫升-1二硫苏糖醇(DTT), pH为7.5。(PPTX 97 KB)
12870_2013_1387_MOESM2_ESM.pptx
附加文件2:图S2:与MALDI-TOF MS分析的二维内凝胶测定中与核酸酶活性相关的蛋白质。在0.5μmCPT存在下在孵育30天后在玉米培养细胞中获得的核蛋白质提取物中核糖酶活性的核酸酶活性斑点。(PPTX 163 KB)
12870_2013_1387_moesm3_esm.ppt.
附加文件3:图S3:氨基酸序列(CLUSTALW)的氨基酸序列(CLUSTALW)从拟南芥中核酸酶,来自水稻的核酸酶PA3和来自玉米mRNA的推导蛋白序列。所有序列中的保守残留物标记为灰色的,由质谱法鉴定的胰蛋白酶肽的保守残留物标记为红色。玉米蛋白质,由质谱序列NP_001148452(LOM1002820)和玉米序列(LOM100282067,NP_001123591,LOM100282147,LOM100272515 Y LOC100273742)。米序列:OSENTO1(LOC_OS01G03730),OSENTO2(LOC_OS04G55850.1),OSENDO3(LOC_OS01G03740),OSENDO4(LOC_OS004G54390)和拟南芥序列:ATENCO1(AT1G11190),ATENDO2(AT1G68290),ATENCO3(AT4G21590),ATENCO4(AT4G21585),ATENCO5(AT4G21600)。(PPT 1 MB)
作者的原始提交的图像文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Sánchez-pons,n。,vico,c.m.识别I类型CA2+/镁2+-喜树碱诱导的玉米细胞依赖性内切酶。植物生物学13,186(2013)。https://doi.org/10.1186/1471-2229-13-186
收到了:
公认:
发表:
关键词
- 喜树碱
- DNA降解
- 玉米
- 核酸酶