摘要
背景
PIN- formed (PIN)外排载体通过在质膜(PM)中表现出动态和不同的不对称定位模式,有助于生长素的极性运输和植物发育。PIN的中央亲水环(HL)的磷酸化与PIN运输的调节有关。最近,我们报道了PIN3- hl中的一个可磷酸化基序(M3)对PIN3的极性、细胞内运输和生物学功能是必要的。在本研究中,我们使用根毛系统进行PIN活性测定,研究了该基序在长hl PIN中是否具有功能保守性。
结果
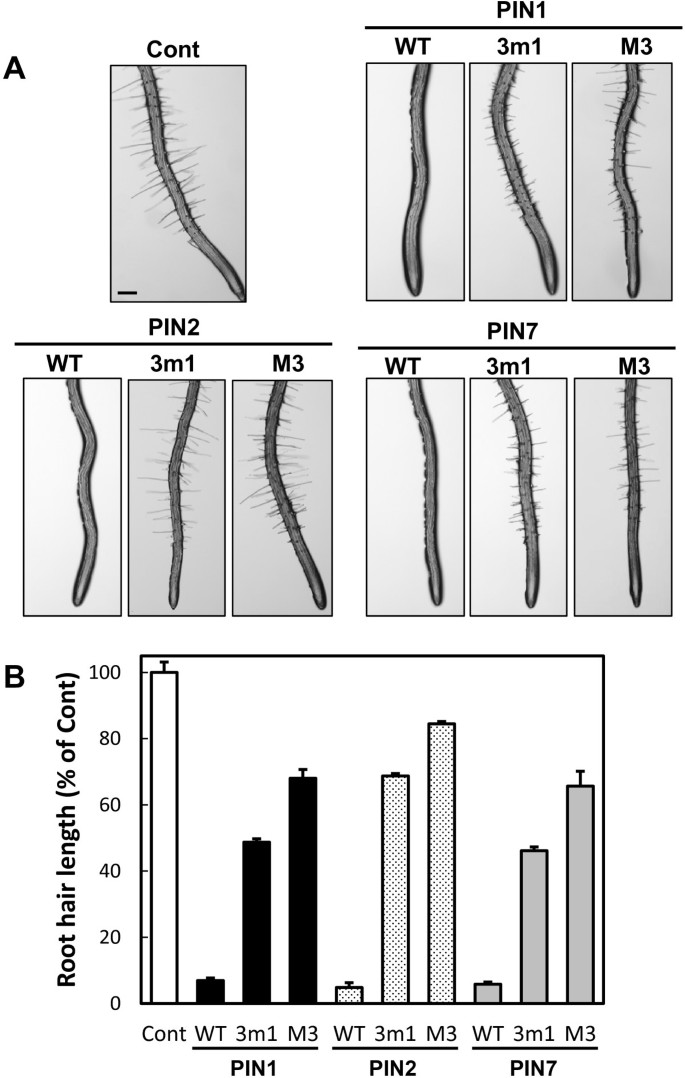
根毛特异性过表达的野生型PIN1、2或7通过消耗根毛细胞中的生长素水平,极大地抑制了根毛生长,而过表达的M3磷酸化缺陷PIN突变体不能抑制根毛生长。与这种根毛表型一致的是,M3磷酸化缺陷的PIN1和PIN7的PM定位被部分中断,导致生长素外流减少,根毛生长恢复。在这些磷酸化突变PIN系中brefeldin a间隔的部分形成也表明它们的PM靶向被部分破坏。另一方面,与PIN1和PIN7突变蛋白相比,p3 -磷酸化缺陷的PIN2蛋白几乎检测不到。然而,wortmannin处理后突变的PIN2蛋白水平几乎恢复到野生型的PIN2水平,这表明与其他pin不同,PIN2的M3基序与PIN2运输到液泡溶解途径有关。
结论
这些结果表明,M3磷酸化基序在调节长hl PIN的细胞内转运方面功能保守,但其转运的具体功能在PIN成员之间存在分歧。
背景
生长素在植物生长发育中起着重要作用。生长素的细胞间定向转运和浓度梯度的形成是其生物学功能的关键。弥漫性细胞生长素外排由于细胞内生长素的电离而无效,因此质膜(PM)中不对称定位的生长素外排载体在生长素极性运输中起着关键作用[1].
PIN- formed (PIN)生长素外排载体蛋白具有独特的非对称亚细胞分布,受环境和发育线索的动态调控,其突变导致生长素梯度形成和植物生长发育的缺陷[2].的拟南芥PIN家族由8个成员组成,其中6个PIN (PIN1 - 4, 6和7)有一个长长的中央亲水环(HL;298-377个氨基酸残基)连接两端的5个跨膜螺旋。这些“长”pin主要本地化到PM。相反,其他两个pin (PIN5和8)具有非常短的HL(27-46个残基),定位于内质室(内质网,PIN5)或定位于内质室和PM (PIN8) [3.- - - - - -5].
长pin在不同细胞类型的PM中表现出不同的极性定位[6- - - - - -11].尽管从头合成的长PIN对称地定位于PM,但随后的内吞和定向回收(胞出)过程的循环决定并维持特定的PIN极性[12,13].长pin的内吞/循环过程受环境和细胞信号的协调和调节[13,14].
蛋白质磷酸化和去磷酸化与生长素运输和PIN运输有关[13].没有直接的证据表明TM结构域在PIN的生长素运输中的作用,但一些证据支持这一观点,即HL在调节PIN蛋白的细胞内运输中起作用。长pin的HL含有一些激酶靶向的磷酸化基序。蛋白激酶抑制剂抑制细胞生长素运输[15,16],并干扰PIN蛋白向PM的运输[16].PINOID (PID,一种丝氨酸/苏氨酸[S/T]蛋白激酶)的突变或过表达改变了生长素运输活性,并导致与生长素运输缺陷相关的表型[16- - - - - -18].有人提出,通过PID(和相关激酶)和蛋白磷酸酶PP2A之间的拮抗活性,磷酸化状态的变化调节了pin的亚细胞极性[19,20.].因此,已经证明了PIN-HL可以被PID和相关激酶磷酸化在体外以及在原生质体磷酸化试验中,PIN-HL的磷酸化位点是pin极性和生物学功能所必需的[20.- - - - - -24].
最近,我们报道了一个名为M3的可磷酸化基序,在PIN3- hl中包含5个S/T残基(4个S和1个T),对PIN3的极性和细胞内运输是必要的[25].根毛特异性过表达的野生型PIN3通过输出根毛细胞中的生长素,极大地抑制了根毛的生长,而过表达磷酸化缺陷的M3突变型PIN3不能抑制根毛的生长。要恢复根毛生长,至少需要五个S/T残基中有三个磷酸化缺陷突变。由于PM靶向性的缺陷,PIN3在根毛细胞中的PM定位被磷酸化缺陷突变破坏并内化。M3磷酸化缺陷突变对PIN3亚细胞定位的影响也被观察到在其原生表达域,根中柱鞘细胞中,导致外侧PM的定位异常和向地性缺陷。M3 motif序列在所有长pin中是保守的。在本研究中,我们使用根毛PIN活性测定系统,研究了该基序在长PIN中是否具有功能保守性。
结果
为了检验M3 motif在长pin中的功能守恒性,我们选择了PIN7(最接近PIN3,附加文件1:图S1A)和另外两个研究良好的长引脚,PIN1和PIN2。M3 motif中的5个可磷酸化S/T残基是严格保守的,包括PIN1、2和7在内的长pin中很少有例外([25,附加文件1:图S1B)。大部分来自PIN1、2和7的M3 S/T残基预计可被NetPhos 2.0 (http://www.cbs.dtu.dk/services/NetPhos/, [26]),以及PIN3残基(附加文件1:图S1C)。PIN2显示出一个独特的特征,它的M3基序缺乏一个假定的磷酸化丝氨酸,被丙氨酸取代(PIN2中的A212,附加文件1:图S1C)。虽然M3的磷酸化位点是保守的,但磷酸化位点之间的顺序是有多样性的。长引脚的这些M3特征既表明了功能上的保守性,也可能表明了特定的发散性。
拟南芥根毛细胞中PIN1、PIN2和PIN7的生长素外排活性需要M3基序
在之前的研究中,我们将M3 S/T位点划分为两个子基序,3m1包含前三个S残基,2m3包含最后两个T/S残基(附加文件1:图S1B)。3个m1 S残基的突变导致PIN3的磷酸化、转运、外排活性和生物学功能的缺陷,而2个m3突变则没有[25].为了评估M3 motif在PIN1、PIN2和PIN7生长素外排活性中的功能,我们生成了磷酸化缺陷(S到A) M3(所有5个S/T残基)和3个m1(前3个S残基)突变PIN:GFP(绿色荧光蛋白)融合构建物,它们在根毛中特异性表达棒曲霉素A7启动子(ProE7, [27,28)在拟南芥植物中。正如先前报道的那样,这种根毛系统被用来间接估计pin的生长素外流活性,因为根毛的生长依赖于根毛细胞中的生长素水平[3.,16,29,30.].
与我们以前的报告一致[3.],根毛特异性过表达野生型PIN1、PIN2或PIN7通过消耗根毛细胞中的生长素水平,极大地抑制了4 d龄幼苗的根毛生长(图1).另一方面,这种pin介导的根毛抑制被3个m1或M3突变显著抑制,尽管M3突变一致显示比3个m1突变更能恢复根毛生长(图1)1),与之前PIN3的结果相似[25].在三个pin中,PIN2的3个m1和M3突变体的根毛生长恢复最好(图1B).这些结果在每个PIN的15个独立转基因系中是可重复的(附加文件1:图S2)。
在PIN3的情况下,3 m1和M3突变通过中断PIN3向PM的运输抑制了其生长素外排活性,从而抑制了其根毛[25].为了测试这是否与PIN1, PIN2和PIN7相同,我们检查了这些pin的突变形式的亚细胞定位。
M3基序是PM靶向根毛细胞中PIN1和PIN7所必需的
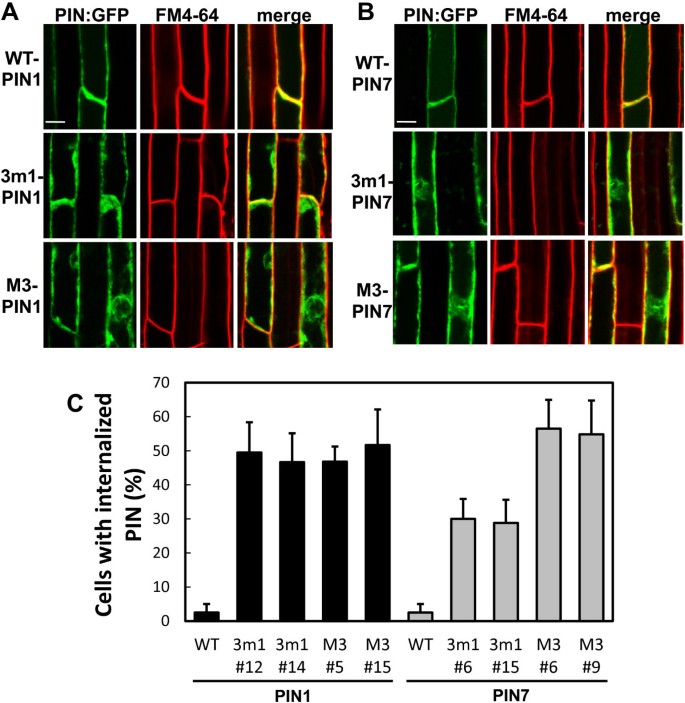
为了确定突变pin是PM还是内部定位,gfp标记的pin首先与根毛细胞内吞示踪剂FM4-64共观察。野生型PIN1和PIN7在PM与FM4-64信号重叠,而3个m1-和m3 -突变型PIN1和PIN7表现出相当大的内部定位,尽管它们在PM也有部分定位(图)2).突变的PIN1和PIN7的这种内部定位模式在10个独立的转基因系中得到了一致的观察1:图S3和图S4)。对3个m1-和M3- pin的两个代表性转基因株系的观察表明,PIN1内化发生在~50%的根毛细胞中,而在类似条件下,PIN7内化发生在~30%的3个m1和~55%的M3突变株系中(图2)2C).这些数据支持这样的观点,即3 m1或M3基序中可能存在磷酸化缺陷的突变显著削弱了PIN1和PIN7靶向PM的能力,从而抑制了pin介导的根毛抑制。
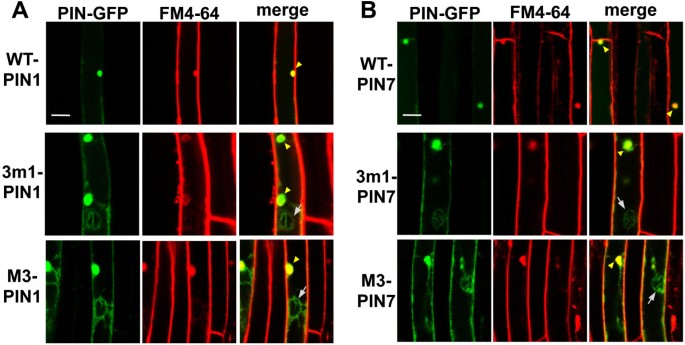
胞吐抑制剂brefeldin A (BFA)导致PIN蛋白内部积累到所谓的“BFA分隔室”,这表明PIN的pm定位[31,32].为了明确PIN1和PIN7突变蛋白的亚细胞定位,将蛋白合成抑制剂环己酰亚胺(CHX)和BFA联合处理转基因幼苗。野生型PIN1和PIN7蛋白的信号与BFA区室中FM4-64蛋白的信号完全重叠,而3个m1或M3突变型PIN1和PIN7蛋白仅与FM4-64染色的BFA区室部分共定位(图3.和附加文件1:图S5)。内部突变PIN信号的缺失和BFA腔室重叠进一步支持了PIN1和PIN7靶向PM的能力被3 m1和M3磷酸化缺陷突变部分破坏的观点。
M3突变导致PIN2通过根毛细胞中的液泡溶解途径快速降解
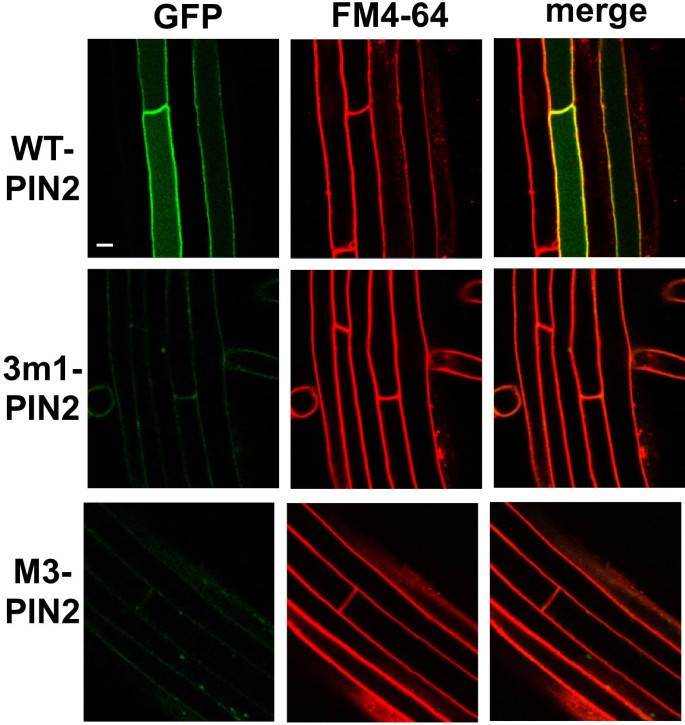
与磷酸化缺陷的PIN1和PIN7不同,突变的PIN2蛋白表现出完全不同的转运行为。虽然野生型PIN2明显定位于PM,但磷酸化缺陷的3m1 -或M3-PIN2蛋白在根毛细胞中几乎检测不到;这在观察到的所有五个独立的转基因系中是一致的(图4和附加文件1:图S6A)。这一结果与根毛抑制试验的结果一致,3个m1或M3突变体PIN2s对根毛生长的抑制作用(对3个m1和M3的抑制作用分别为~30%和~15%)比突变体PIN1或PIN7弱得多(图1)1B)。
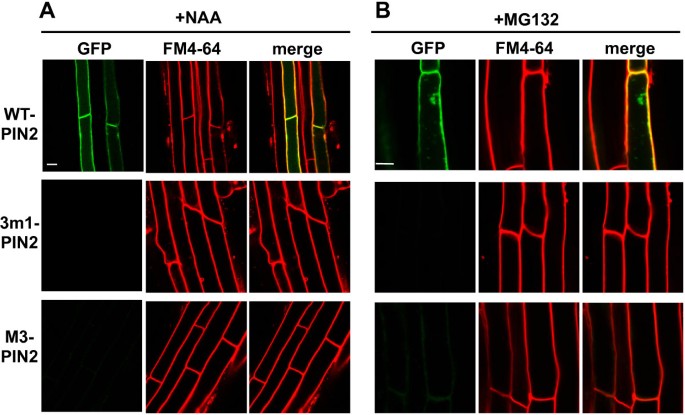
这些突变的PIN2蛋白在细胞中的低表达可能是由于突变蛋白的翻译失败或降解,因为突变的转基因基因似乎是正常转录的,如RT-PCR分析所示1:图S6B)。由于如前文所述,突变体PIN2蛋白对根毛生长存在一定的残留抑制作用,因此可以想象,突变体PIN2蛋白的某一部分可能短暂停留在PM中,导致生长素输出活性较弱,然后发生内吞降解。为了验证这一想法并恢复细胞中突变的PIN2蛋白,我们使用生长素(1-萘乙酸,NAA)抑制PM中网格蛋白依赖性的PIN内吞[33], MG132抑制泛素化/蛋白酶体介导的PIN内化和降解[34,35]和wortmannin抑制液泡溶解途径[36].
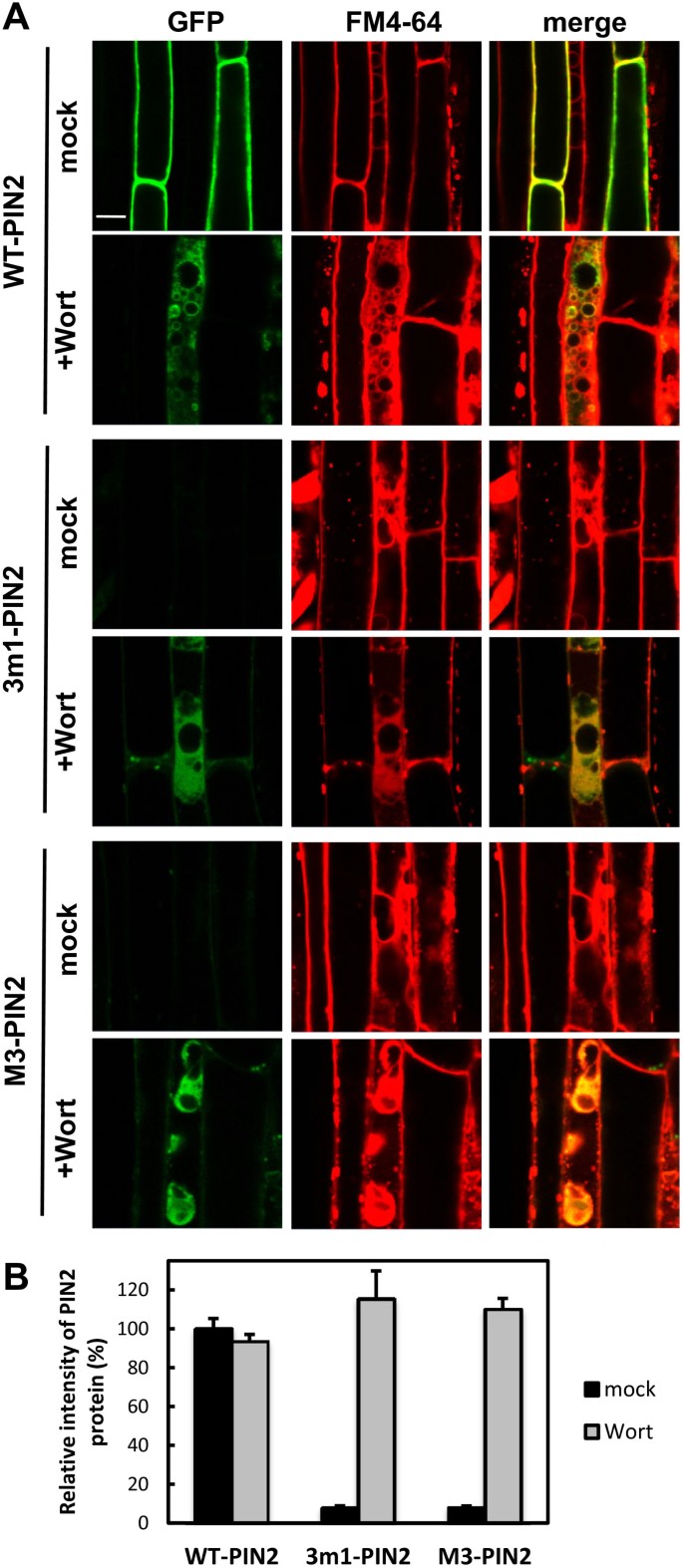
NAA (5 μM,作用2 h)对根毛细胞中野生型PIN2或恢复的3个m1-或M3-PIN2蛋白的pm定位没有太大影响(图5A和附加文件1:图S7)。MG132 (25 μM,作用2.5 h)使野生型PIN2蛋白部分在根毛细胞内部积累,但未能恢复突变型PIN2信号(图2)5B和附加文件1:图S8)。Wortmannin是磷脂酰肌醇-3-激酶的抑制剂,抑制PIN蛋白和FM4-64向液泡的运输[13].Wortmannin处理(前处理12小时和FM4-64处理2小时)恢复了根毛细胞中3个m1和M3突变PIN2:GFP蛋白的GFP信号(图6和附加文件1:图S9)。当观察到两个突变型PIN2结构各有5个独立的谱线时,wortmannin恢复突变型PIN2信号的强度与野生型PIN2信号的强度相似(图1)6和附加文件1:图S9),这意味着野生型和突变型PIN2的翻译效率相似,但3 m1或M3的磷酸化缺陷PIN2蛋白比野生型更易进入裂解途径。
讨论
在本研究中,我们研究了最初在PIN3- hl中发现的磷酸化基序M3是否调节PIN3的极性和细胞内运输[25],已在其他长环PIN中功能保守,使用根毛测定系统估计PIN活性和观察细胞内PIN运输。在本研究和以前的研究中研究的4个拟南芥长环pin (PIN1、2、3和7)中,M3 motif似乎是这些长pin正常细胞内运输的必要条件。
在拟南芥的PIN成员中,PIN7与PIN3的亲缘关系最为密切1图S1A),其HL氨基酸序列具有74%的同源性。此前有研究报道,PIN3和PIN7蛋白在拟南芥根的相同组织中表达,极性相同,如中柱细胞中的基极性[6,8]和极柱[8,9].这些观察结果表明,PIN3和PIN7的细胞内行为可能受到类似的细胞内运输机制的调控。这使我们假设,在PIN7-HL中M3基序的功能将与PIN3-HL中M3基序在其转运调控方面的功能相当。我们之前的研究表明,磷酸化缺陷的M3-PIN3完全位于根毛细胞内部(液泡)[25].然而,本研究中的M3-PIN7蛋白部分内部定位,相当数量的突变PIN7保留在PM中(图2和附加文件1:图S3和图S4)。根据其部分PM定位,突变体PIN7蛋白在根毛细胞中对BFA表现出与M3-PIN3蛋白不同的响应;即突变体PIN3无重叠[25但突变的PIN7蛋白与BFA隔室部分重叠(图3.和附加文件1:图S5)。
三个长PIN子组(' PIN3, 7,和4群集',' PIN1 '和' PIN2 ')的M3基序显示出不同的结构(附加文件1:图S1, [25])。与PIN1和PIN2相比,PIN3、7和4簇成员在S212和S215之间有6-7个氨基酸残基的缺口。即使在PIN3、7和4个聚类成员中,尽管S209和S215之间的残基高度保守,但S215和T222之间的残基表现出相当大的序列差异1:图S1, [25])。此外,虽然PIN3和PIN7的表达模式和亚细胞极性基本相似,但也发现了它们在亚细胞极性上的微小差异。例如,在根中柱鞘细胞中,PIN3定位于内外侧和基底侧[8,25],而PIN7在同一细胞类型中无极性[37].M3- pin3和M3- pin7在根毛细胞中部分不同的转运行为可能是由于M3基序的细微分化所致。
PIN2在正常生长条件下或对环境刺激(如重力刺激或黑暗条件)的响应中会发生主动降解,其裂解空泡靶向和降解与泛素化/蛋白酶体活性相关[12,34,35,38- - - - - -40].这些结果表明,PIN2的多种分子线索参与了其降解反应的调控。这些分子线索可能位于PIN2-HL中,本研究表明M3基序可能是其中之一。我们的研究结果中有几条证据支持PIN2的M3基序参与了PIN2降解的想法,特别是通过调节至少在根毛细胞中的液泡溶解运输速率。首先,PIN2的3m1或M3突变使细胞内的PIN2蛋白降低到几乎无法检测的水平4和附加文件1:图S6A)。第二,突变对PIN2蛋白水平的影响似乎是由于PIN2的降解而不是转录或翻译,因为突变的PIN2基因的转录是正常的(附加文件1:图S6B),突变型PIN2的wortmannin恢复蛋白水平与野生型PIN2相似(图S6B)6和附加文件1:图S9)。第三,3个m1或M3突变的PIN2蛋白通过wortmannin(一种液泡溶解途径的抑制剂)在根毛细胞中恢复,而不是通过生长素(一种网格蛋白依赖性内吞作用的抑制剂)。因为在渥曼宁处理后,野生型和突变型PIN2之间观察到相似的蛋白水平,但在没有渥曼宁的情况下,突变型PIN2蛋白检测不到(图6和附加文件1:图S9),很可能是M3磷酸化位点的突变促进了突变PIN2蛋白向液泡裂解途径的运输。
另一方面,MG132的结果是有趣的,它不能抑制M3-(和3m1) PIN2的溶泡通路。这种蛋白酶体抑制剂被发现可以抑制PM中PIN2的内化或空泡靶向[34,35],且PIN2的泛素化参与了该过程[38].到目前为止,尚不清楚蛋白酶体介导的降解如何促进PIN2运输到裂解液泡,以及PIN2泛素化是否直接与蛋白酶体介导的降解有关。蛋白酶体定位于细胞核和细胞质[41],液泡介导的蛋白质降解与蛋白酶体介导的蛋白质降解不同[42].在这方面,我们可以提出两种可能性。首先,PIN2的泛素化可能是空泡靶向的信号,而不是蛋白酶体介导的细胞质降解的信号。在这种情况下,可能存在一些蛋白酶体敏感的细胞质蛋白因子,参与了泛素化PIN2的空泡运输。其次,细胞质蛋白酶体和液泡蛋白酶可能共同降解PIN2,其方式与酵母中a因子转运体(Ste6p)的降解类似[42].第一种可能性更可行,因为MG132对PIN2内吞和空泡转运的抑制作用更明显[34,35].在本研究中,MG132无法阻止M3- (3m1)-PIN2的空泡转运,这促使我们推测,M3 (3m1)基序的磷酸化可能是PIN2正常空泡转运所必需的,它与PIN2- hl的泛素化和蛋白酶体敏感转运成分等其他因素协调调节。M3 (3 m1)磷酸化的损伤可能会破坏调节的液泡转运,并将PIN2转运直接重定向到液泡。
总之,我们的结果表明,PIN2中的M3 motif可能专门调节蛋白质降解的裂解空泡运输。前面提到的在各种条件下经常观察到PIN2蛋白降解的事实可能反映了PIN2更容易受到蛋白质运输机制的影响而降解。M3-(和3m1) PIN2与其他M3- pin的不同行为使我们推测,PIN2 M3基序的特殊功能可能是由于其特定的结构。PIN2的M3基序不仅在S212和S215之间有额外的氨基酸残基,而且在M3基序中还包括额外的丝氨酸残基,而不是在长PIN M3基序中保存的5个S/T残基1:图S1B, [25])。此外,拟南芥PIN2 M3基序的S212位点被丙氨酸取代。可以想象,PIN2 M3的这些独特特征可能促使PIN2更频繁地运输到液泡溶解途径。
包括M3基序,至少有三个磷酸化基序从长PIN HL结构域中被鉴定出来[43].PIN1-和PIN2-HLs的“TPRXS”基序中的丝氨酸残基(其中X为任何氨基酸残基)已被证明是磷酸化的,并在PIN极性中起作用[22,23].长PIN HLs有三个TPRXS重复序列,其突变可增加影响发育表型[23].另一个基序' Ser337/Thr340 '是PIN1正确极性和生物学功能所必需的[44].
M3 motif由3个m1和2个M3区域组成,其中2 M3区域对应于第一个TPRXS motif(附加文件1:图S1, [25])。我们之前的研究表明,仅PIN3中3 m1(带有三个丝氨酸残基)的突变就足以引起表型效应,如其PM靶向性、极性和生物学功能的改变[25].相反,2 m3突变本身对这些表现型没有任何可检测到的影响[25].此外,3m1突变影响PID-或wag1介导的PIN3-HL磷酸化,而2m3突变则没有影响[25].我们之前对2个m3突变的PIN3的结果与在第一个TPRXS突变的PIN1的结果相似[22],但与PIN2的结果不同,在第一个TPRXS中S的突变显著降低了PID或wag介导的PIN2磷酸化,并影响了发育表型[23].这些结果表明,来自不同pin的相同TPRXS基序可能对不同的激酶具有不同的亲和力或特异性[43].尽管3个m1和2个m3的突变一起比3个m1突变的影响要大得多,但3个m1突变单独对长pin的运输行为和活性有相当大的影响(图1,2,4, [25])。这些数据表明,3m1基序提供了长pin,具有部分独立的磷酸化编码,用于调节其亚细胞运输。然而,应该注意的是,我们目前的结果是基于根毛模型系统。研究单个PIN在表达最多的细胞中应该有助于确定3m1基序在原生PIN运输和植物发育中的作用。以往的研究和本研究共同表明,长pin - hl中存在多个磷酸化位点,不同pin之间的保守磷酸化位点功能不同,以及不同AGC激酶的靶向性不同。此外,考虑到不同pin和激酶之间不同的细胞类型特异性表达模式,PIN-HL上的磷酸化编码的不同组合将调节长pin的细胞类型和分子特异性转运行为。
结论
我们的研究结果表明,长PIN的M3基序在细胞内PIN转运的功能上是保守的。此外,长PIN之间的M3结构的差异可能导致其在PIN运输中的特定作用的差异,因此M3的突变导致PM靶向作用的完全(对PIN3)或部分(对PIN1和PIN7)失效,并促进空泡裂解运输(对PIN2)。亚细胞PIN极性的动态对调节局部生长素梯度形成和最终不同的发育过程非常重要,这些过程受环境和发育刺激的永久变化的影响。PIN-HL结构域的磷酸化使pin具有改变其亚细胞运输行为的能力。此外,PIN- hl结构域的多个磷酸化位点及其在特定结构上的差异可能会产生不同的磷酸化编码,以驱动内外部刺激的动态PIN运输。
方法
植物材料和生长条件
拟南芥(拟南芥本研究以哥伦比亚生态型(Col-0)为野生型。所有种子生长在含有半强度Murashige和Skoog (MS)营养混合物(Sigma-Aldrich)、1%蔗糖、0.5 g/L MES (pH 5.7)和0.8%琼脂糖的琼脂糖培养皿上。所有种子在4°C低温处理3天,在22°C光照16 h /暗8 h的光周期下萌发。拟南芥改造是通过根癌土壤杆菌(菌株C58C1)介导的浸润[45].将转化植株选择在含湿霉素的培养皿(10 mg/mL)上。对T2植株进行根毛长度估计和显微分析。
转基因结构
修饰克隆位点的二元载体pCAMBIA1300-NOS [46被用于转基因构建。的拟南芥EXPANSIN A7启动子(ProE7,27,28])用于PIN基因的根毛特异性表达。ProE7:YFP, ProE7:PIN1:GFP, ProE7:PIN2:GFP和ProE7:PIN7:GFP结构在前面已经描述过[3.,16].用PCR方法对PIN1-HL、PIN2-HL和PIN7-HL假定的磷酸化位点进行定点突变,生成ProE7:3 m1-PIN:GFP和ProE7:M3-PIN:GFP,使用前面提到的ProE7:PIN:GFP结构物作为模板和附加文件中列出的引物1:表S1。这些磷酸化突变的PIN:GFP片段被克隆到指定的酶位点(附加文件1:表S1)包含ProE7片段的二进制向量。
根毛长度的测量
如前所述,测量4日龄幼苗的根毛长度[47].根的数字照片在显微镜(DFC425C,徕卡)40倍放大下拍摄。测量根两侧30 ~ 45根的根毛长度。
PIN-GFP信号的显微观察与定量
采用卡尔蔡司LSM700共聚焦激光扫描显微镜观察GFP(绿色)和FM4-64(红色)荧光。用488/490-555 nm和555/640激发/发射滤波器组分别检测到绿色和红色荧光。在4日龄幼苗中观察到PIN:GFP融合蛋白的定位。为了观察BFA、MG132、生长素或渥曼素处理后PIN:GFP的亚细胞定位,将幼苗在半强度液体MS培养基中培养指定的时间。对照(模拟)液体培养基中含有等量的溶剂二甲基亚砜(0.04%)。观察前分别施用FM4-64 (2 μM)、BFA (25 μM)、CHX (50 μM)、MG132 (25 μM)、NAA (5 μM)和wortmannin (20 μM)。如前所述,使用Adobe Photoshop直方图菜单从7-9株幼苗的根毛细胞中估计添加或不添加wortmannin的PIN2:GFP信号的相对强度[27,48].
加入数据
本文基因的拟南芥信息资源(TAIR)登录号分别为At1G12560 (EXPANSIN A7)、At1G73590 (PIN1)、At5G57090 (PIN2)、At1G70940 (PIN3)、At2G01420 (PIN4)、at2g16530 (PIN5)、At1G77110 (PIN6)、At1G23080 (PIN7)、At5G15100 (PIN8)。
缩写
- 论坛:
-
Brefeldin一
- CHX:
-
环己酰亚胺
- 霍奇金淋巴瘤:
-
亲水的循环
- 乙酰天冬氨酸:
-
1-naphthaleneacetic酸
- 销:
-
PIN-FORMED
- 下午:
-
等离子体膜
- TM:
-
跨膜。
参考文献
毛国强,李志强,李志强,Zažímalová E:植物生长素的转运。植物激素。编辑:Davies PJ。Dordrecht: Kluwer学院出版社:2004,437-470。
王晓燕,王晓燕,王晓燕,等。植物生长素转运介导发育的分子和细胞研究进展。植物科学进展,2007,12:160-168。10.1016 / j.tplants.2007.03.006。
刚古利A,李淑娟,赵敏,李ora, Ryu H, Cho H- t:拟南芥根毛细胞pin -形成蛋白的生长素转运活性差异。植物生理学报,2010,29(4):366 - 366。10.1104 / pp.110.156505。
Mravec J, Skupa P, Bailly A, Hoyerova K, Krecek P, Bielach A, Petrasek J, Zhang J, Gaykova V, Stierhof YD,等:er定位的PIN5转运蛋白介导植物激素生长素的亚细胞稳态。自然学报,2009,459:1136-1140。10.1038 / nature08066。
索楚克,埃德加,斯卡佩拉:植物生长素运输途径对叶脉网络的影响。科学通报,2013,9:e1003294。10.1371 / journal.pgen.1003294。
Blilou I, Xu J, Wildwater M, Willemsen V, Paponov I, Friml J, Heidstra R, Aida M, Palme K, Scheres B: PIN生长素外排促进网络控制拟南芥根系的生长和模式。自然学报,2005,433:39-44。10.1038 / nature03184。
Friml J, Benková E, Blilou I, Wisniewska J, Hamann T, Ljung K, Woody S, Sandberg G, Scheres B, Jürgens G, Palme K: AtPIN4介导拟南芥植物生长素的下沉驱动梯度和根模式。细胞学报,2002,108:661-673。10.1016 / s0092 - 8674(02) 00656 - 6。
王晓燕,王晓燕,王晓燕,王晓燕,等。拟南芥生长素外排调控因子PIN3在植物向性调控中的作用。自然学报,2002,415:806-809。10.1038 / 415806。
丁志强,王晓燕,王晓燕,王晓燕,等。重力诱导下植物根细胞中生长素通量极化作用的研究。美国国家科学研究院。2010, 36(4): 447 - 447。10.1073 / pnas.1013145107。
Luschnig C、Gaxiola RA、Grisafi P、Fink GR: EIR1是拟南芥中生长素转运过程中必需的根特异性蛋白。基因学报,1998,12:2175-2187。10.1101 / gad.12.14.2175。
Müller A, Guan C, Galweiler L, Tanzler P, Huijser P, Marchant A, Parry G, Bennett M, Wisman E, Palme K: AtPIN2定义了拟南芥根向地性控制的基因座。中华医学杂志,1998,17:6903-6911。10.1093 / emboj / 17.23.6903。
李晓明,李晓明,李晓明,李晓明,等。植物生长素外排载体PIN2的空泡靶向降解研究。美国国家科学研究院。2008, 35(4): 447 - 447。10.1073 / pnas.0808073105。
Ganguly A, Sasayama D, Cho HT:磷酸化对蛋白质转运极性的调节。细胞生物学杂志,2012,33:423-430。10.1007 / s10059 - 012 - 0039 - 9。
王晓峰,王晓峰,王晓峰,等:植物细胞中pin的动态极性定位及其发育可塑性。中华医学杂志,2010,29:2700-2714。10.1038 / emboj.2010.181。
Delbarre A, Muller P, Guern J:短寿命和磷酸化蛋白有助于载体介导的外排。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.116.2.833。
Lee shsh, Cho H-T: PINOID在拟南芥根毛细胞和烟草细胞中正向调节生长素外排。植物学报,2006,18:1604-1616。10.1105 / tpc.105.035972。
benbennett SRM, Alvarez J, Bossinger G, Smyth DR:拟南芥pinoid突变体的形态发生。植物学报,2003,23(5):555 - 557。10.1046 / j.1365 - 313 x.1995.8040505.x。
Benjamins R, Quint A, Weijers D, Hooykaas P, Offringa R: PINOID蛋白激酶通过促进生长素极性转运调节拟南芥器官发育。《发展》,2001,128:4057-4067。
Friml J, Yang X, Michniewicz M, Weijers D, Quint A, Tietz O, Benjamins R, Ouwerkerk PB, Ljung K, Sandberg G, Hooykaas PJ, Palme K, Offringa R:尖-基PIN极性靶向中pinoid依赖的二元开关引导生长素外排。科学通报,2004,30(4):563 - 566。10.1126 / science.1100618。
Michniewicz M、Zago MK、Abas L、Weijers D、Schweighofer A、Meskiene I、Heisler MG、Ohno C、Zhang J、Huang F、Schwab R、Weigel D、Meyerowitz EM、Luschnig C、Offringa R、Friml J: PP2A和PINOID对PIN磷酸化的拮抗调控作用引导生长素通量。细胞科学,2007,30:1044-1056。10.1016 / j.cell.2007.07.033。
朱丽都M, Müller I, Willige BC, Nill C, Jikumaru Y, Li H, Schwechheimer C:拟南芥中D6蛋白激酶的极性定位在植物生长素的高效转运中是必需的。科学进展,2009,36(6):627-636。10.1242 / dev.028365。
Dhonukshe P,黄F, galvana - ampudia CS, Mähönen AP, Kleine-Vehn J, Xu J, Quint A, Prasad K, Friml J, Scheres B, Offringa R:质膜结合的AGC3激酶在TPRXS(N/S)基序磷酸化PIN生长素载体,指导根尖PIN回收。科学通报,2010,38(3):355 - 355。10.1242 / dev.052456。
黄芳,Zago MK, Abas L, Van MA, galvana - ampudia CS, Offringa R:拟南芥PIN基序的保守磷酸化引导PIN1极性和生长素运输。植物学报,2010,22:1129-1142。10.1105 / tpc.109.072678。
丁铮,Galván-Ampudia CS, Demarsy E, Łangowski Ł, Kleine-Vehn J,范Y, Morita MT, Tasaka M, Fankhauser C, Offringa R, Friml J:拟南芥PIN3生长素转运蛋白的光介导极化和光向光响应。细胞生物学杂志,2011,13:447-452。10.1038 / ncb2208。
Ganguly A, Lee shsh, Cho HT:拟南芥PIN-FORMED3磷酸化位点的亚细胞定位和生物学作用的功能鉴定。植物学报,2012,29(4):447 - 447。10.1111 / j.1365 - 313 x.2012.05030.x。
Blom N, Gammeltoft S, Brunak S:基于序列和结构的真核蛋白磷酸化位点预测。中华分子生物学杂志,1999,29(4):356 - 361。10.1006 / jmbi.1999.3310。
Cho H-T, Cosgrove DJ:拟南芥根毛起始和扩展蛋白基因表达的调控。植物科学进展,2004,15(4):357 - 357。10.1105 / tpc.006437。
Kim DW, Lee SH, Choi SB, Won SK, Heo YK, Cho M, Park YI, Cho H-T:不同根毛分布模式被子植物根毛细胞特异性顺式元件的功能保护。植物学报,2006,18:2958-2970。10.1105 / tpc.106.045229。
Cho M, Lee OR, Ganguly A, Cho H-T:生长素信号:短和长。植物生物学杂志,2003,19(5):689 - 689。10.1007 / BF03030615。
Cho M, Lee SH, Cho HT: p -糖蛋白4在拟南芥根毛细胞和烟草细胞中显示生长素外排转运体样作用。植物学报,2007,19:3930-3943。10.1105 / tpc.107.054288。
Geldner N, Friml J, Stierhof YD, Jürgens G, Palme K:生长素运输抑制剂阻断PIN1循环和囊泡运输。自然,2001,413:425-428。10.1038 / 35096571。
Geldner N, Anders N, Wolters H, Keicher J, Kornberger W, Muller P, Delbarre A, Ueda T, Nakano A, Jurgens G:拟南芥GNOM ARF-GEF介导核内体循环、生长素转运和生长素依赖性植物生长。细胞学报,2003,12:219-230。10.1016 / s0092 - 8674(03) 00003 - 5。
Paciorek T, Zazímalová E, Ruthardt N, Petrásek J, Stierhof YD, Kleine-Vehn J, Morris DA, Emans N, Jürgens G, Geldner N, Friml J:生长素抑制细胞内吞作用,促进细胞自身外排。自然学报,2005,35:1251-1256。10.1038 / nature03633。
Abas L, Benjamins R, Malenica N, Paciorek T, Wisniewska J, Moulinier-Anzola JC, Sieberer T, Friml J, Luschnig C:拟南芥生长素外排促进因子PIN2的胞内转运和蛋白水解参与根向地性。细胞生物学杂志,2006,8:249-256。10.1038 / ncb1369。
Laxmi A,潘杰,Morsy M,陈瑞:光照对拟南芥生长素外排载体PIN2胞内分布的影响。科学通报,2008,3:e1510。10.1371 / journal.pone.0001510。
Matsuoka K, Bassham DC, Raikhel NV, Nakamura K:两种液泡分选信号对wortmannin的不同敏感性表明烟草细胞中存在不同的分选机制。中国生物医学工程学报,2004,24(3):366 - 366。10.1083 / jcb.130.6.1307。
Marhavý P, Bielach A, Abas L, Abuzeineh A, Duclercq J, Tanaka H, Pařezová M, Petrášek J, Friml J, Kleine-Vehn J, Benková E:细胞分裂素调节PIN1生长素外排载体的内胞转运控制植物器官发生。开发学报,2011,21:796-804。10.1016 / j.devcel.2011.08.014。
Leitner J, Petrásek J, Tomanov K, Retzer K, Parezová M, Korbei B, Bachmair A, Zazímalová E, Luschnig C: PIN2生长素载体蛋白lysine63连接泛素化调控拟南芥根系生长的激素调控适应。美国国家科学研究院。2012, 39(4): 527 - 527。10.1073 / pnas.1200824109。
Jaillais Y, Fobis-Loisy I, Miège C, Rollin C, Gaude T: AtSNX1定义了拟南芥生长素载体运输的核内体。自然学报,2006,443:106-109。10.1038 / nature05046。
万宇,Jasik J,王磊,郝浩,Volkmann D, Menzel D, Mancuso S, baluikka F,林杰:拟南芥根向光性中Phototropin1光传感器与基于pin2的生长素极性转运的信号传感器NPH3。植物学报,2012,24:551-565。10.1105 / tpc.111.094284。
Peters J-M, Franke WW, Kleinschmidt JA: 26s蛋白酶体的独特19s和20s亚复合体及其在细胞核和细胞质中的分布。中国生物医学工程学报,1994,29(4):379 - 379。
泛素-蛋白酶体系统在酿酒酵母中a因子转运体Ste6p液泡降解中的作用。分子生物学杂志,1998,18:779-789。
Ganguly A, Cho HT:磷酸化编码与pin - formed的细胞类型特异性转运有关。植物信号行为学报,2012,7:1215-1218。10.4161 / psb.21432。
张杰,nozyzynski T, Pĕnčík A, Rolčík J: PIN磷酸化足以介导PIN极性和生长素的直接转运。美国国家科学研究院。2010, 37(3): 447 - 447。10.1073 / pnas.0909460107。
Bechtold N, Pelletier G:在植物中,农杆菌介导的拟南芥成体植株真空浸润转化。拟南芥协议。编辑:Martinez-Zapater JM, Salinas J. Totowa,新泽西州:Humana: 1998,259-266。
李或,金世杰,金海杰,洪景杰,Ryu SB,李世强,Ganguly A, Cho H-T:拟南芥根中pin -形成蛋白转运到质膜所需的磷脂酶A2。植物生态学报,2010,29(4):447 - 447。
林超,崔慧生,赵洪涛:拟南芥根毛特异性EXPANSIN A7基因在根毛伸长过程中的作用。细胞生物学杂志,2011,31:393-397。10.1007 / s10059 - 011 - 0046 - 2。
Won S- k, Kumari S, Choi S-B, Cho M, Lee SH, Cho H-T:从禾本科根毛中筛选出了根毛特异性EXPANSIN B基因。细胞生物学杂志,2010,30:369-376。10.1007 / s10059 - 010 - 0127 - 7。
确认
这项工作得到了美国农村发展局中期职业研究员计划(2011-0017242,NRF, MEST)和下一代生物绿色21计划(TAGC PJ00820701和SSAC PJ00951404)的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
DS完成了大部分实验。DS和HTC设计实验,分析数据,并撰写手稿。AG和MP参与了共焦工作。所有作者阅读并批准了最终稿件。
电子补充材料
12870 _2013_1399_moesm1_esm.pdf
附加文件1:图S1: M3 motif在长引脚的保存。图S2。独立转基因系的根毛长度。图S3。M3磷酸化缺陷的PIN1系共聚焦图像。图S4。M3磷酸化缺陷的PIN7系共聚焦图像。图S5。bfa处理过的M3磷酸化缺陷PIN7系的根毛细胞共聚焦图像。图S6。M3磷酸化缺陷PIN2系共聚焦图像及表达分析。图S7。生长素处理过的M3磷酸化缺陷PIN2系共聚焦图像。图S8。mg132处理过的M3磷酸化缺陷的PIN2线共焦图像。图S9。wortmannin处理过的M3磷酸化缺陷PIN2系共聚焦图像。表S1。引物列表。(pdf 13mb)
权利与权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
笹山,D,刚古利,A,朴,M。et al。在拟南芥根毛细胞中,长环pin - formed的细胞内运输中,M3磷酸化基序在功能上是保守的。植物生物学13日,189(2013)。https://doi.org/10.1186/1471-2229-13-189
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-189
关键字
- 生长素
- 生长素运输
- 亲水环(引脚)
- 磷酸化
- PIN-FORMED(销)
- 蛋白质贩卖
- 根头发