摘要
背景
植物生长素的含量和分布在植物发育过程中起着重要作用。除了其他代谢过程,各种生长素载体控制活性生长素的细胞水平,因此,是细胞生长素稳态的主要调节因子。尽管生长素转运体具有发展的重要性,但仍缺乏一种简单的中高通量方法来评估载体活动。本研究表明,在烟草亮黄2 (BY-2)细胞培养中,载体驱动的细胞生长素耗损与核生长素信号的减少有关。
结果
我们开发了一种易于使用的基于瞬态单细胞的系统来检测载波活性。我们使用生长素响应启动子元件DR5信号输出的相对变化来间接可视化生长素载体活性。通过对生长素信号和运输的药理学和遗传干扰,证明了瞬态方法的可行性。作为概念的证明,我们提供了突出的生长素运输蛋白PIN- formed (PIN)2和PIN5分别在质膜和内质网(ER)调节细胞生长素稳态的视觉证据。我们的数据表明,PIN2和PIN5对生长素转运抑制剂1-萘酞酸(NPA)具有不同的敏感性。此外,假定的PIN-LIKES (PILS)生长素载体在内质网中的活性对我们系统中的NPA不敏感,表明NPA阻断细胞间生长素运输,但不阻断细胞内生长素运输。
结论
这种基于单细胞的系统是一种有用的工具,通过它,假定的生长素载体(如PINs、PILS和WALLS ARE THIN1 (WAT1))的活性可以以中高通量的方式间接可视化。此外,我们的单细胞系统可能也有助于研究其他激素信号通路,如细胞分裂素。
背景
植物生长素是控制植物生长发育的重要激素。在细胞水平上,生长素调节细胞分裂、细胞扩张和细胞分化[1].生长素主要通过多步信号通路发挥作用:Aux/IAA蛋白是生长素反应因子(ARF)转录因子的抑制因子。生长素直接与核共受体转运抑制反应/生长素F-BOX蛋白(TIR/AFB)和Aux/IAA结合。生长素结合导致Aux/IAA转录抑制因子随后降解[2- - - - - -4].随后,生长素的感知导致ARF转录因子的去抑制,启动转录重编程。
生长素的时空分布取决于生长素代谢(生物合成、偶联和降解)和细胞生长素转运蛋白的活性[5].迄今为止,已鉴定出各种生长素载体[6],其中最突出的是auxin RESISTANT1/LIKE AUX1 (AUX/LAX)类的生长素流入载体、多药耐药(b型)亚家族的ABC转运体和PIN- formed (PIN)生长素载体[7- - - - - -9].生长素载体的药理和遗传干扰已经说明了生长素运输机制对植物发育各个方面的重要性[10].特别是经典的生长素转运抑制剂,如1-萘酞酸(NPA) [11- - - - - -13],是评估各种生长素载体介导的发育过程的宝贵工具。通常,生长素载体介导细胞生长素在质膜上的输入或输出,从而调节核生长素信号的生长素可用性(载体驱动的细胞生长素稳态)。然而,最近,PIN蛋白的一个亚类,如PIN5和PIN8,已被证明存在于内质网(ER),并可能通过调节细胞内生长素区室化进入ER腔来控制细胞生长素稳态[14- - - - - -16].然而,另一个进化上独特的PIN-LIKES (PILS)假定的生长素载体家族在ER中发挥作用,表明细胞内生长素运输的广泛发育和进化重要性[17- - - - - -19].
大量生长素载体的运输能力及其对生长素运输抑制剂的敏感性已在植物细胞系统中进行了分析,如拟南芥烟草原生质体或亮黄-2 (BY-2)细胞培养物(烟草),以及在异种细胞系统中,如酵母细胞和哺乳动物细胞[9,14,20.- - - - - -23].这些详细的生长素运输实验是研究运输活动和机制的重要工具。然而,开发更简单的方法来评估生长素载体的活性是可取的。已经提出了一种间接可视化载体驱动生长素稳态的替代方法[24,25].该生物测定方法利用游离生长素水平对根毛伸长的刺激作用。生长素载体的根毛特异性表达及其对根毛长度的作用被用于间接观察载体驱动的生长素稳态。然而,邻近组织中的生长素通量也有助于调节根毛生长[26],防止联合使用异位载体表达及其对生长素转运抑制剂的敏感性。此外,稳定的转基因株系的生成耗时可能会限制这种生物测定方法在高通量应用中的使用。
另一个常用的监测生长素信号的工具是合成的高度生长素响应启动子DR5,由大豆GH3启动子中的生长素响应元件(AuxRE)的连续重复生成[27].此前,DR5启动子活性被认为可以指示各种组织中核生长素信号的相对速率[28- - - - - -33].DR5已被用于可视化生长素信号的最大值和最小值,然而,在所有细胞中,这并不与实际生长素水平相关,这可能是由于细胞类型依赖的线索[32,34,35].
在这里,我们提出了一个新的单细胞系统,使用DR5启动子,以解决影响细胞生长素稳态和最终生长素信号通路的细胞机制。我们发现了DR5启动子活性与烟草BY-2细胞生长素水平波动之间的相关性。我们的数据表明,的瞬时表达式DR5rev:单体红色荧光蛋白(mRFP)核生长素信号的报告可以用来说明烟草BY-2细胞生长素信号的相对状态。通过这种单细胞为基础的系统,监测生长素载体诱导的细胞生长素信号的变化,间接反映生长素载体的活性。作为概念证明,我们评估了突出的PIN生长素载体活性,并确认了它们对细胞生长素稳态/信号通路的影响[14,21].此外,药理学方法揭示了质膜上PIN2和ER上PIN5的活性调控是不同的。此外,我们表明这种基于单细胞的系统可以类似地用于研究其他假定的载体,如PILS和WAT1,甚至可能用于研究其他激素途径,如细胞分裂素。
结果
烟草BY-2细胞生长素载体活性的间接可视化
在之前的研究中,合成的生长素响应启动子元件DR5与单体融合招标书或绿色荧光蛋白报告基因(DR5rev:mRFP/绿色荧光蛋白) [30.,36,37]用于可视化组织内生长素响应最大值,并被建议间接估计生长素分布[29,30.,33].然而,植物组织中的生长素分布和基于dr5的生长素信号并不总是相关的,这可能是由于细胞类型依赖的线索[32].
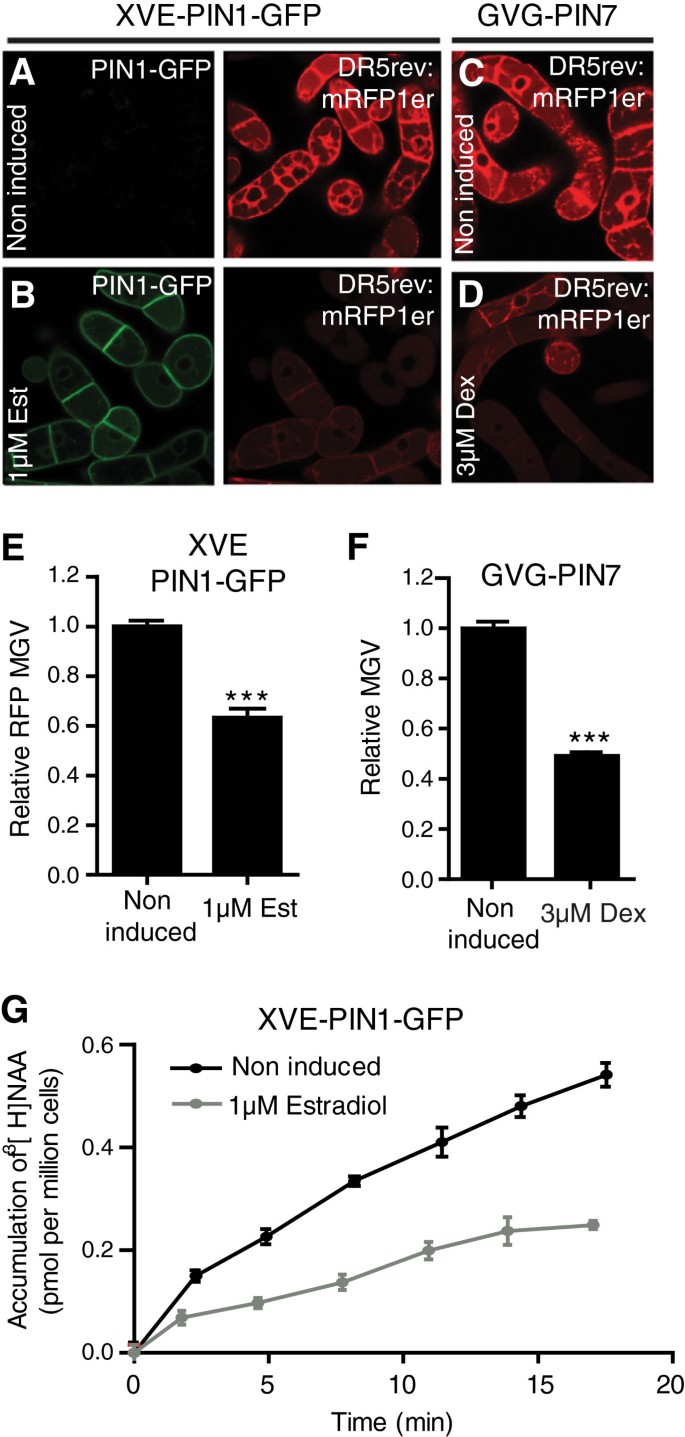
为了减少细胞类型依赖效应,我们测试了DR5启动子是否可以用于烟草BY-2细胞培养中,以间接估计生长素载体活性。为了研究烟草BY-2细胞中生长素载体活性与DR5启动子活性之间的相关性,我们稳定地转化了烟草BY-2细胞DR5rev:mRFP将该构建物导入转基因BY-2系中进行诱导PIN1绿色荧光蛋白[38]或PIN7[21)表达式。PIN1和PIN7是质膜局部生长素外排载体,对植物生长发育具有重要意义[6,21].感应的PIN1绿色荧光蛋白而且PIN7,导致细胞生长素耗竭[21],与非诱导细胞相比,DR5rev:mRFP信号强度降低,反映了较低的核生长素信号(图1A -1F、附加文件1:图S1A)。DR5rev:RFP信号强度由诱导细胞群(n > 150个单细胞)相对于未诱导对照细胞群(n > 150个单细胞)的平均平均灰度值(MGV)表示。
稳定转化烟草BY- DR5启动子活性改变与细胞生长素积累的相关性2细胞。烟草BY-2细胞稳定转化,生长素响应DR5rev:mRFP雌二醇(Est)可诱导XVE-PIN1-绿色荧光蛋白或地塞米松(Dex)诱导GVG-PIN7构造。(一个,B)归纳PIN1-绿色荧光蛋白与共聚焦成像显示的非诱导细胞相比,雌二醇可明显降低DR5rev:mRFP(红色)信号强度。(C,D)地塞米松依赖性诱导PIN7与非诱导细胞相比,DR5rev:mRFP信号强度明显降低。(E图中描述了DR5rev:mRFP信号强度的平均灰度值(MGV)PIN1诱导细胞和非诱导细胞(n = 150)。(FDR5rev的MGV:mRFP信号强度inPIN7诱导细胞和非诱导细胞(n = 150)。(G) [3.H]非诱导型和雌二醇诱导型NAA积累测定(XVE-PIN1-绿色荧光蛋白)细胞。误差条表示标准误差。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。
在雌二醇诱导下PIN1-绿色荧光蛋白在表达BY-2细胞群时,我们观察到DR5rev:mRFP与PIN1-GFP信号强度呈负相关(附加文件1:图S1B和S1C),表明PIN1-GFP活性高时,核生长素信号水平较低。
为了明确描述PIN1-GFP和PIN7的生长素载体活性,我们在相同的细胞系上进行了生长素积累试验,并观察到放射性标记的合成生长素1-萘乙酸([3.H]NAA)在雌二醇诱导PIN1-绿色荧光蛋白表达细胞与非诱导细胞相比(图1G).我们的研究结果表明DR5rev:mRFP信号强度(图1A-F)与细胞生长素积累相关(图1G),可能是由于载体诱导细胞生长素含量的变化和随后生长素信号通路的改变。
我们得出结论,在我们的实验条件下,DR5启动子活性可以在BY-2细胞中间接地观察生长素载体依赖的细胞生长素稳态调节。
以单细胞为基础的系统中生长素载体瞬时表达的过程
在BY-2细胞中,生长素信号的可视化可用于间接监测载体驱动的细胞生长素稳态。为了建立一个中高通量的检测方法,我们详细阐述了瞬时表达生长素载体的程序。粒子轰击是一种易于使用的程序,可在低质粒浓度下实现高转化效率,并且在部分自动化的情况下,具有高通量使用的潜力[39,40].我们调整了之前描述的粒子轰击程序[39,40用于烟草BY-2的高效瞬态转化(见材料和方法)。为了获得高蛋白表达水平,使用指数生长期的BY-2细胞培养。DNA浓度在0.05 μg/μl至1 μg/μl之间足以实现瞬时表达,并导致DNA浓度与表达水平之间的相关性,从而实现基因表达的微调(数据未显示)。通过两种质粒在不同浓度比下的转化来测试共转化效率,并计算共转化水平(附加文件1:表S1)。虽然依赖于浓度,但总的来说共转化效率非常高(在0.05 μg/μl时,两种质粒的共转化效率约为90%),这使得两种质粒能够有效地共转化(附加文件)1:表S1)。因此,BY-2粒子轰击可以作为一种有效共表达感兴趣基因的合适方法。
瞬态单细胞系统监测生长素信号
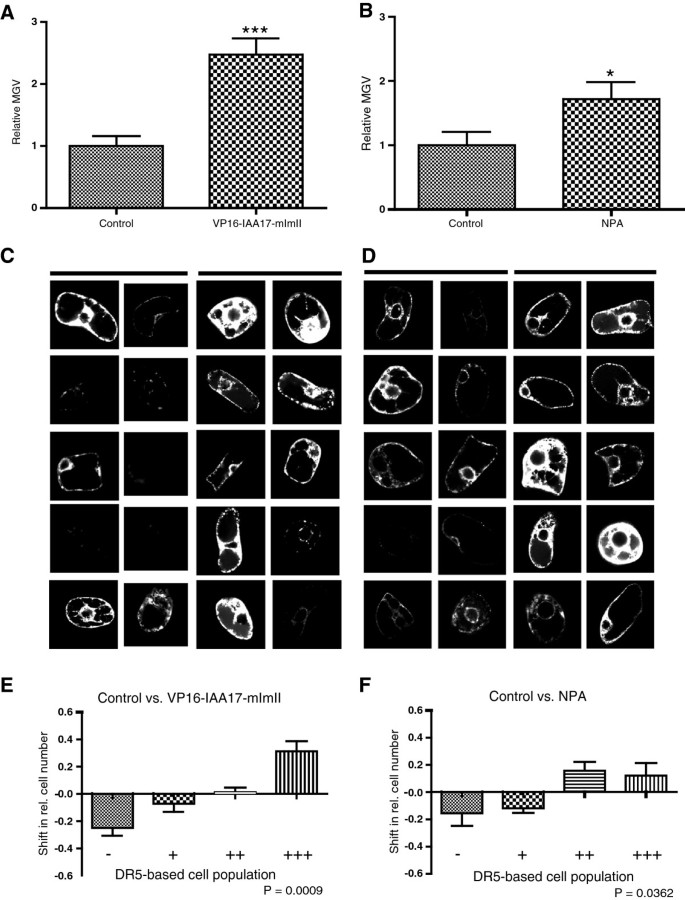
为了初步测试DR5在BY-2细胞中的瞬时表达是否可以用于观察两个感兴趣的样品之间生长素信号水平的定性差异,我们将烟草BY-2细胞与生长素反应进行了瞬时共转化DR5rev:mRFP构建并稳定生长素信号阻遏剂IAA17mImII与单纯疱疹病毒VP16的激活域融合。这种结构导致植物细胞中的组成性生长素信号传导[41,42].与之共转化的细胞中,DR5rev:mRFP(反映生长素信号)的平均灰度值(MGV)较高DR5rev:mRFP而且35个年代:VP16IAA17mImII比对照细胞表达DR5rev:mRFP惰性内质网(ER)标记35个年代:HDEL绿色荧光蛋白(图2A -2C).为了进一步阐述DR5/生长素信号通路的相对变化,我们根据相对MGV将转化细胞群细分为4类。单个细胞的相对MGV低于0.5 (2-1)、相对MGV大于0.5 (2-1)及1以下(2 .0),高(++),相对MGV在1 (2)0)和2 (21)和非常高(+++),相对MGV值高于2 (21).(图2E和附加文件1:图S2)。这种替代可视化使我们能够追踪两个样本之间低、中、高和非常高RFP信号强度下相对细胞数量的变化,并比较DR5rev:mRFP信号强度的更细微差异。35S:VP16-IAA17mImII增强了我们系统中的生长素信号,相应地降低了低/中相对细胞数,增加了强或很强RFP信号强度的细胞数(图2E)。
生长素信号和运输能力改变对细胞生长素稳态的影响。(一个,B)图表表示DR5rev:mRFP信号强度的相对平均平均灰度值(MGV)。误差条表示标准误差(n = 60)。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(一个)共表达DR5rev:mRFP稳定版的IAA17融合到VP16激活域(35个年代:VP16-IAA17mImII),引起本构生长素信号,显著提高了相对平均MGV35个年代:HDEL-绿色荧光蛋白-表达对照细胞。(B)与标准培养培养基相比,NPA处理导致MGV/DR5信号通路增加。(C) 10张对照细胞(左图)和过表达细胞的代表性图片VP16-IAA17-mImII(右面板)。(D)左图为未处理的对照组细胞,右图为NPA处理的细胞,各有10张代表性图片。(E,F)图描述了转换细胞的相对数量的变化,在两个样本寻址之间显示了低(-)、中(+)、高(++)和非常高(+++)DR5rev:mRFP信号VP16-IAA17-mImII表达或NPA处理(量化的详细描述,见附加文件1:图S2)。误差条表示标准误差(n = 3次重复,至少有50个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;表示p值。
这些结果表明,瞬态DR5rev:mRFPBY-2细胞的表达可用于监测核生长素信号的定性差异。
接下来,我们研究了我们的单细胞系统是否可以用于解决生长素运输机制。因此我们处理DR5rev:mRFP生长素转运抑制剂NPA可减少细胞生长素外排,从而增加细胞生长素水平[43].正如预期的那样,在我们的瞬态实验中,NPA处理显著增加了DR5信号的相对发生率(图2B,2D和2F),揭示了NPA对细胞生长素外排和细胞生长素稳态的作用可以在我们的单细胞系统中被监测。
我们的研究结果表明,基于DR5和单细胞的系统可以用于定性监测生长素信号的变化。然而,为了以一种有意义的方式使用该系统,需要仔细选择实验设计,因为DR5活性已被建议不单纯反映生长素信号。植物激素油菜素内酯影响几种生长素反应基因的表达以及DR5启动子的活性拟南芥[34,35](附加文件1:图S3A及S3B)。然而,在我们的实验条件下,油菜素内酯处理并没有增加的平均MGVDR5rev:mRFP转化烟草BY-2细胞(附加文件1:图S3C-S3E)。这一发现表明,油菜素类固醇没有增加BY-2细胞中的生长素信号,或者我们的方法不够敏感,无法追踪细微的差异,例如油菜素类固醇诱导的生长素信号。
生长素载体在单细胞系统中的运输和定位
为了进一步评估该方法的可用性,我们研究了PIN生长素载体活性对细胞生长素信号通路的影响。最初,通过研究暂态by -2转化后的PIN传输/定位,确定了推测高PIN蛋白活性的时间框架。跨膜蛋白,如PIN蛋白,共翻译插入ER膜。质膜定位的PIN蛋白,如PIN1,随后从内质网输出,并被分选到质膜[44].相反,PIN5蛋白则停留在内质网膜上,在那里发挥调节(细胞内)生长素稳态的作用[14].
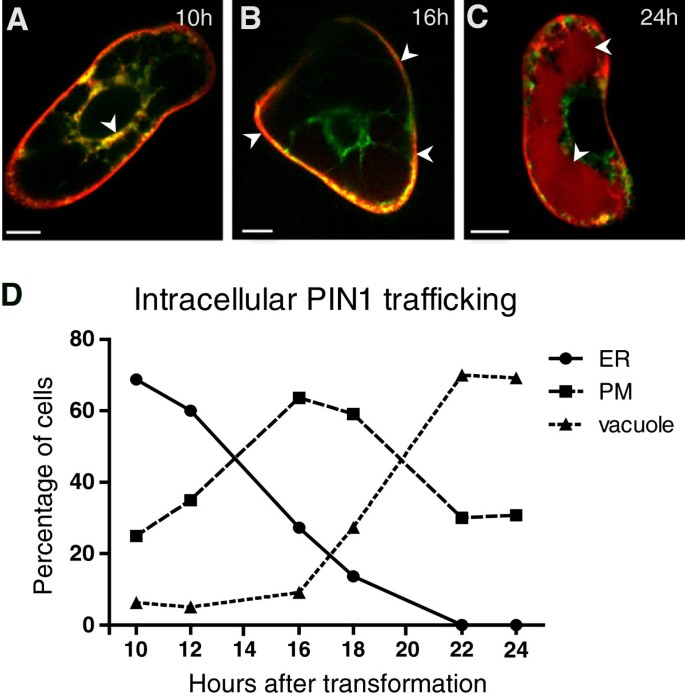
转化后10小时,我们观察到大多数转化细胞(87%)中PIN1-RFP与惰性ER标记HDEL:GFP共定位(图)3.一个和3.D),表明新合成的PIN蛋白水平较高,而在转化后16小时,在大多数分析细胞中,PIN1-RFP在内质网中不存在,仅在质膜上可见(在给定的共聚焦设置下)(图3.B和3.D,它在哪里活动;21].之后,质膜上具有强PIN1-RFP信号的细胞百分比随着时间的推移而减少(图3.D)。质膜上PIN1定位的减少与液泡中PIN1- rfp发生率的增加相关(图3.C和3.D),提示PIN1通过裂解降解翻转[45].
总的来说,PIN1蛋白在转化后16 h-18 h在质膜上显示了明显的定位和高活性。在该时间点(转化后17小时),其他PIN蛋白,如PIN2-GFP和PIN5-GFP,也强烈定位于质膜和ER(图4一个和4分别B)。我们认为16 ~ 18 h是分析PIN生长素载体活性的合适时间范围。
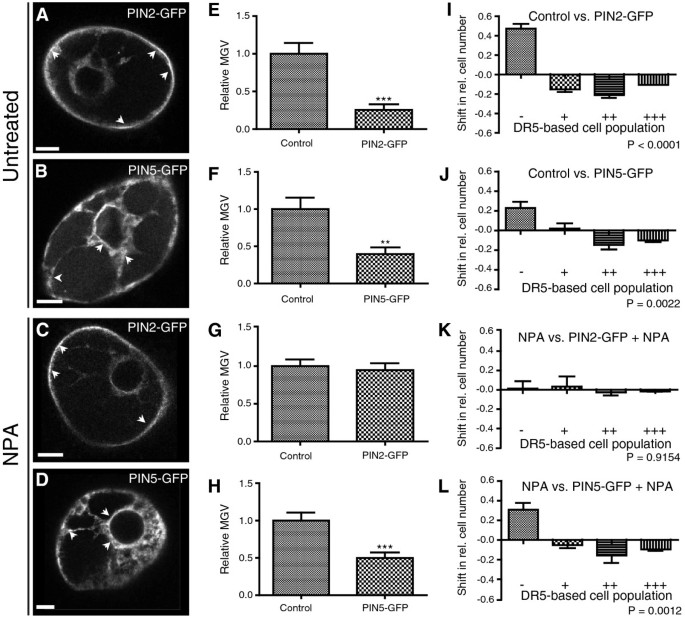
PIN蛋白活性对细胞生长素稳态的影响。(一个) PIN2-GFP优先定位于质膜。(BPIN5-GFP的典型核周ER定位。(C,D在生长素转运抑制剂NPA (10 μM NPA富集培养基)的存在下,PIN2-GFP和PIN5-GFP的定位不受影响。箭头分别描述PM和ER的优先PIN2和PIN5定位。Bars = 10 μm。(E,我,F,J)共同转化的细胞DR5rev:mRFP,要么35个年代:PIN2-绿色荧光蛋白或35个年代:平快-绿色荧光蛋白DR5rev:mRFP信号强度低于对照细胞表达DR5rev:mRFP以及惰性ER标记35个年代:HDEL-绿色荧光蛋白.(G,H,K,l) NPA存在时,PIN5-GFP表达降低DR5rev:mRFP信号强度,而PIN2-GFP不表达。(E-H)图表表示DR5rev:mRFP信号强度的相对平均平均灰度值(MGV)。误差条表示标准误差(n = 60)。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(我-l)图表描述了两个样本之间显示低(-)、中(+)、高(++)和非常高(+++)DR5rev:mRFP信号强度的转换细胞的相对数量的变化(关于量化的详细描述,请参阅附加文件1:图S2)。误差条表示标准误差(n = 3次重复,至少有50个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;表示P值。
生长素转运蛋白PIN的活性影响生长素信号通路
接下来,我们利用DR5和单细胞为基础的系统研究了PIN生长素载体活性对细胞生长素信号通路的影响。细胞与DR5rev:mRFP而且35个年代:PIN2-绿色荧光蛋白DR5rev:mRFP信号强度低于对照细胞表达DR5rev:mRFP以及惰性ER标记35个年代:HDEL-绿色荧光蛋白(图4一个,4E和4I).这些观察结果与PIN诱导细胞生长素积累减少相一致(图1a - i),表明由于质膜上pin2 -生长素外排载体活性增强,生长素信号通路降低。
PIN5是一种内质网定位的生长素载体,被描述为促进生长素从细胞质运输到内质网。这种生长素在内质网中的封存可能会降低生长素在核生长素信号通路中的可用性[14].与这些假设相一致的是平快绿色荧光蛋白表达引起DR5rev:mRFP信号强度显著降低(图4B,4F和4J)。
我们得出结论,基于DR5和单细胞的系统可以用于间接监测质膜和ER定位PIN生长素转运蛋白的活性。
生长素转运抑制剂NPA在单细胞系统中抑制PIN2作用,但不抑制PIN5作用
如上所述,的表达式PIN2绿色荧光蛋白促进生长素从细胞流出,因此,降低细胞内生长素信号的水平(图4E和4I).生长素转运抑制剂NPA处理后,PIN2与NPA处理相比,生长素信号通路没有降低HDEL绿色荧光蛋白表达对照细胞(图4G和4重要的是,NPA对质膜上PIN2的瞬时定位没有明显影响(图4C),表明我们的单细胞系统监测了NPA对PIN2生长素转运活性的抑制作用[21,23].
与PIN2相比,平快绿色荧光蛋白表达式(图4D)即使在NPA存在的情况下,生长素信号也会降低(图4H和4L)。这种NPA敏感性的差异表明PIN2和PIN5的NPA作用机制和/或生长素转运机制不同。这一发现与NPA在质膜上的结合活性一致[46].为了进一步评估假定的生长素载体在ER中的NPA不敏感性,我们分析了系统中PILS假定的生长素载体活性。PILS5定位于内质网,最近被描述为减少核生长素信号,这可能是由于生长素封存到内质网[17].与PIN5相似,我们观察到在NPA存在时,DR5信号的PILS5依赖性下降(附加文件)1:图S4)。因此,我们假设NPA在BY-2细胞培养物中抑制ER的细胞间生长素运输,但不抑制细胞内生长素运输。
我们的结论是,单细胞为基础的系统是一种敏感的方法,不仅可以监测载体驱动的生长素稳态,而且还可以评估生长素载体对生长素运输抑制剂的敏感性。这些数据表明,我们的瞬态方法可以用于研究生长素载体功能的遗传或药理学干扰。
WAT1蛋白活性影响细胞生长素稳态
为了评估该方法是否适用于监测其他假定的转运体的活动,我们共同表达了DR5rev:mRFP与墙很薄(WAT1)(图5A). WAT1是一种囊体定位的跨膜蛋白,属于药物/代谢物转运体超家族。WAT1活性通过未知机制影响色氨酸和/或生长素代谢而影响生长素稳态[47].我们使用基于单细胞的系统来研究WAT1是否影响BY-2细胞中的细胞生长素信号。共同转化的细胞DR5rev:mRFP而且35个年代:WAT1:绿色荧光蛋白DR5rev:mRFP信号强度低于对照细胞表达DR5rev:mRFP而且35个年代:绿色荧光蛋白:绿色荧光蛋白(图5B和5C),表明WAT1蛋白活性对核生长素信号通路有负作用。这些数据表明,我们基于单细胞的系统可视化了WAT1对细胞生长素稳态的影响,原则上可以用于间接评估各种载体蛋白的活性。
WAT1的作用:GFP蛋白对细胞生长素稳态的影响。(一个优先WAT1:GFP定位于液泡体(箭头)。Bar = 10 μm。(b,c)细胞中DR5rev:mRFP表达强度降低35个年代:WAT1:绿色荧光蛋白与对照细胞共表达相比DR5rev:mRFP而且35个年代:绿色荧光蛋白:绿色荧光蛋白.(B)该图表示DR5rev:mRFP信号强度的相对平均平均灰度值(MGV)。误差条表示标准误差(n = 60)。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(C)图描述了两个样本之间转换细胞的相对数量的变化,显示低(-)、中(+)、高(++)和非常高(+++)DR5rev:mRFP信号强度(量化的详细描述,请参阅附加文件1:图S2)。误差条表示标准误差(n = 3次重复,至少有50个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;表示p值。
细胞分裂素稳态的间接可视化
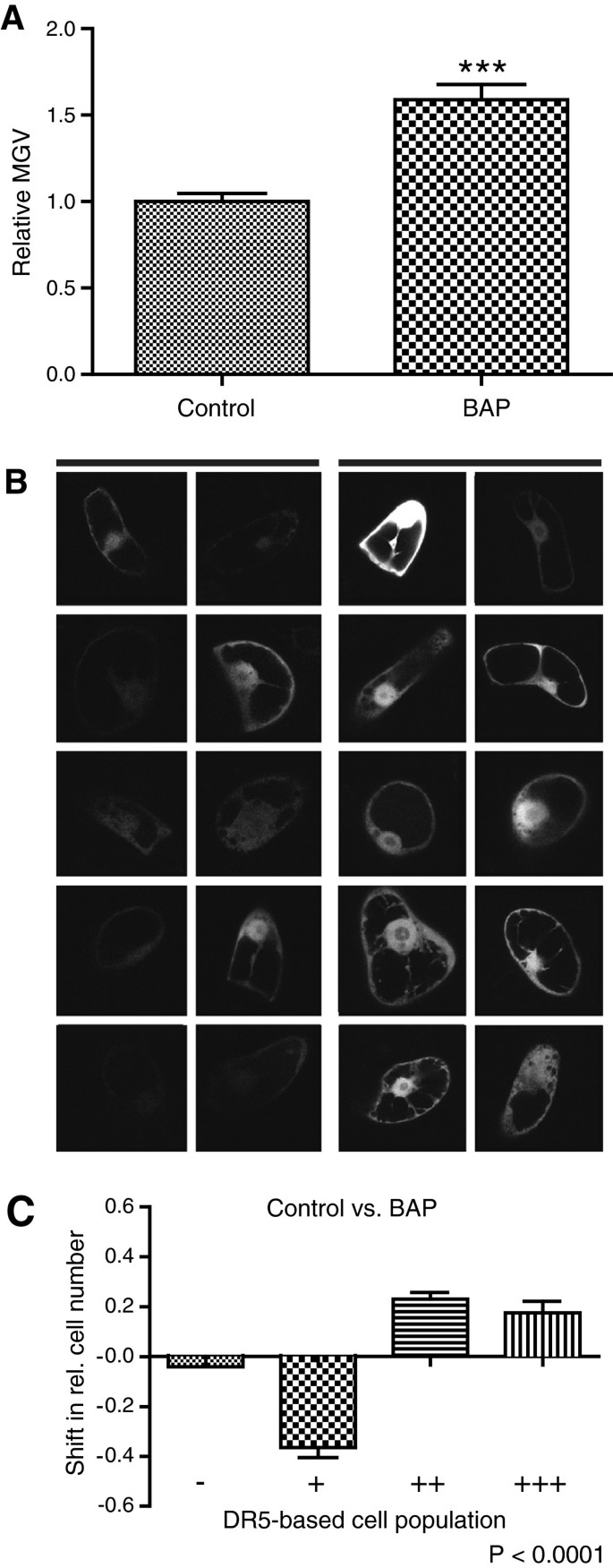
由于基于单细胞的系统能够间接监测载体驱动的细胞生长素稳态,我们测试了该方法是否可以类似地用于其他激素途径。合成的细胞分裂素响应启动子双组分输出传感器(TCS):GFP在烟草BY-2细胞中瞬时表达,用于细胞分裂素信号的间接可视化[48].TCS:GFP瞬时转化细胞的分布特征与之前观察到的DR5rev:mRFP相似。类似地,我们测量了转化细胞群的平均MGV,并进一步将TCS:GFP信号强度非常强、强、中、低的亚群中的细胞进行了分类(图6a - c)。TCS:GFP活性在6-苄基氨基嘌呤(BAP)处理的转化子中更高,BAP是一种天然的芳香细胞分裂素[1],比在标准培养基中生长的含量高(图6一个和6B),提示应用细胞分裂素后,BY-2细胞的细胞分裂素信号通路增强。
外源性6-的作用benzylaminopurine(BAP)细胞分裂素信号。与标准培养培养基(对照)相比,BAP处理(10 μM BAP富集培养基)导致TCS:GFP信号通路增加。(一个)图为TCS:GFP转化BY-cells的相对平均平均灰度值(MGV)。误差条表示标准误差(n = 60)。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(B代表性图片显示10个未处理(左)和BAP处理(右)的转化细胞的TCS:GFP信号强度。(C)该图描述了两个样品之间转换细胞的相对数量的变化,显示低(-),中(+),高(++)和非常高(+++)TCS:GFP信号强度(量化的详细描述,请参阅附加文件1:图S2)。误差条表示标准误差(n = 3次重复,至少有50个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;的P-value表示。
这些结果表明,我们的单细胞系统最终可以扩展到其他应用,如细胞分裂素信号的间接可视化。
讨论与结论
植物生长素在植物生长发育的许多方面起着关键作用。细胞生长素含量受局部生长素代谢(生物合成、偶联/解凝或氧化)和生长素转运促进因子的严格控制[5,28,49- - - - - -52].尽管这些因素之间复杂的相互作用仍有待阐明,但很明显,各种转运蛋白对细胞生长素稳态有显著影响[7,9,17,21,47,53].此外,新的注释基因组的稳定释放增加了假定的生长素携带者的数量,并使其分子进化的研究成为可能。生长素载体鉴定的科学进展强调了对评估载体驱动的细胞生长素稳态的合适方法的日益增长的需求。
在这里,我们提出了一个单细胞为基础的系统,使我们能够监测核生长素信号在两个感兴趣的样本之间的定性差异。由于这种简单的方法,载体驱动的生长素稳态及其对生长素运输抑制剂的敏感性可以被可视化。瞬态方法(可能与自动化成像系统结合使用)实现了中高通量的工作流程,可用于化学基因组或获得和失去功能的筛查。DR5rev:mRFP信号强度可以通过测量平均灰色值轻松估计。DR5信号的比例成像和一个本构性(生长素独立)标记物可以进一步提高该方法的灵敏度。此外,所谓的新型生长素信号传感器(基于Aux/ iaa)的使用被称为DII-VENUS [54]可能有助于提高系统的时间分辨率,因为DII不是基于基因调控,而是基于生长素依赖的蛋白质降解。对于高通量工作流程,自动化,如qRT-PCR或基于荧光素酶的检测,可能是最有益的。
各种瞬时表达方法,如金颗粒轰击、微注射、聚乙二醇(PEG)介导的DNA摄取和原生质体电穿孔[55- - - - - -58已经成功地用于瞬时转化植物细胞。原生质体的瞬时转化已被证明在高通量工作流程中是高效的,而植物细胞的颗粒轰击可能更适合于研究生长素载体活性,因为它不会影响生长素载体运输和功能所需的细胞壁完整性[59- - - - - -61].因此,本研究利用BY-2细胞的粒子轰击作为瞬时转化系统,建立了单细胞监测细胞生长素稳态的系统。
作为概念的证明,我们研究了突出的PIN生长素外排载体,并可视化了它们在细胞生长素信号通路中的作用。在稳定转化的BY-2细胞系中,我们证明了外源性生长素细胞积累的pin依赖性减少与(dr5为基础)核生长素信号的减少相关。利用单细胞系统,我们揭示了PIN2、PIN5和PILS5对生长素转运抑制剂NPA的不同敏感性。在我们的实验条件下,NPA阻断了PIN2在质膜上的作用,但没有减弱PIN5和PILS5在内质网上的作用,说明生长素在质膜和内质网上的转运机制可能部分不同。这些发现与NPA对生长素载体活性的作用可能仅限于质膜的假设一致[46].因此,NPA可用于区分细胞间和细胞内生长素转运。我们假设PIN2和PIN5对NPA的不同敏感性表明该系统适合于化学遗传方法。
除了PIN2、PIN5和PILS5的分析外,我们还证实了WAT1对细胞生长素信号的负向影响。WAT1定位于液泡体,并被建议调节细胞生长素稳态[47],可能是通过将一种尚未被鉴定的生长素化合物隔离到液泡中。WAT1如何影响生长素稳态尚不清楚,其机制有待深入研究。尽管如此,我们的系统可以间接地可视化WAT1活动,这可能有助于进一步描述其功能。
总之,我们建立了一个简单而有用的工具来可视化影响细胞生长素信号的载体活动。这种补充方法弥补了高度复杂的直接生长素运输试验和间接方法之间的差距,例如基于根毛的载体驱动细胞生长素稳态可视化[9,14,20.- - - - - -25].考虑到我们的方法的瞬态性质,它允许,例如,快速和系统的预筛选几个突变版本的生长素载体感兴趣。随后,可以在其他更详细的系统中深入分析感兴趣的候选对象。
这种基于单细胞的系统也可用于分析与生长素稳态有关的其他分子成分,如生长素信号或代谢的调节因子。此外,它最终可以通过不同的报告结构扩展到研究其他激素途径,例如细胞分裂素响应元件TCS:GFP [48].然而,与DR5生长素报告器相比,需要进一步深入表征TCS: BY-2细胞中的GFP活性,才能类似地使用该系统。
方法
植物材料和生长条件
烟草l .简历。亮黄2细胞系[62]在25°C黑暗条件下,在150转/分的轨道培养箱中,在液体培养基(3%蔗糖,4.3 g L-1Murashige和Skoog盐,100 mg L-1肌醇,1毫克L-1硫胺素0.2 mg L-12,4-二氯苯氧乙酸(2,4- d)和200 mg L-1KH2阿宝4, pH为5.8),每周传代培养(稀释50倍)。用于瞬态BY-2单元转换的结构已经在前面描述过:DR5rev:mRFP[37),XVE::PIN1:绿色荧光蛋白[38),GVGPIN7[21),35个年代:PIN2绿色荧光蛋白[63),35个年代:平快绿色荧光蛋白[14),35个年代:PILS5_D[17),35个年代:HDEL绿色荧光蛋白[64),35个年代:PIN1招标书[59),35个年代:VP16IAA17mImII[38),35个年代:WAT1:绿色荧光蛋白[47),35个年代:绿色荧光蛋白:绿色荧光蛋白[47),而TCS:绿色荧光蛋白[48].的表达PIN1绿色荧光蛋白在XVE:PIN1绿色荧光蛋白/DR5:mRFP1β-雌二醇(1 μM, 48 h)诱导基因PIN7在GVG:PIN7/DR5:mRFP在传代期开始时加入地塞米松(3 μM, 48 h)。溶剂DMSO(雌二醇)或H2对照组加O(地塞米松)。我们使用拟南芥哥伦比亚0型(Col-0)。幼苗垂直生长在一半Murashige和Skoog培养基上。植物在20-22°C的长日照条件下(光照16小时/暗8小时)生长。的拟南芥DR5rev:GFP线已在前面描述[30.].用1 μM油菜素内酯对7 d龄的幼苗在液体培养基中处理18h。
稳定转化BY-2细胞
An[的基本转换协议65]被使用。对于变换,采用BY-2行承载PIN1:绿色荧光蛋白雌二醇诱导转激活因子XVE (XVE- pin1:GFP) [38]或PIN7地塞米松诱导启动子下基因(系GVG-PIN7) [21]被使用。3天大的BY-2细胞与根癌土壤杆菌菌株GV2260携带DRrev5:mRFP构造。双转化系分别在含100 μg/mL卡那霉素、100 μg/mL湿霉素和100 μg/mL头孢噻肟的培养基中保存。
定量逆转录聚合酶链反应(qRT-PCR)对转基因基因表达的验证
用SpectrumTM Plant total RNA Kit (Sigma - Aldrich)从稳定转化的by -2细胞(地塞米松(3 μM, 24 h)诱导gmv - pin7表达)中提取烟草总RNA,用DNA-freeTM Kit (Ambion)中的DNAse处理。根据制造商的说明,使用M-MLV逆转录酶(H-) (Promega)生成cDNA。qPCR采用DyNAmoTM Flash SYBR®Green qPCR Kit (Finnzymes)进行。特异性引物:AtPIN7正向5”-GGGAAGAAGAGTCGGAGAG-3”,反向5”-AAGAGCCCAAATGAGACCAA-3”;Ta = 56°C。结果值表示为特定基因在诱导细胞中的相对表达量与该基因在非诱导细胞中的相对表达量之比。肌动蛋白作为内参基因。
生长素积累测量
使用放射性标记的生长素,根据[66],由[21].处理重复至少三次,平均值(±标准误差)表示为每百万细胞中特定生长素积累的pmol。在积累试验开始时3.H]NAA (20 Ci mmoL .-1;将American radiolabedchemicals, Inc., St Louis, MO, USA)(作为生长素外排载体的良好底物)添加到PIN1-GFP诱导的BY-2细胞系XVE-PIN1:GFP/DR5rev:mRFP(非诱导系用作对照)中,最终浓度为2nM3.H]乙酰天冬氨酸。
BY-2细胞的瞬时转化
根据先前所述程序调整[39,40用真空过滤法在滤纸上收集10毫升3天的细胞,并保存在用0.6%琼脂凝固的by -2培养基的平板上。细胞按照制造商的说明书(http://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_9075.pdf).将直径为1.6 μm的金颗粒6.25 μl(溶于50%甘油)中,加入2 μl质粒DNA(如无特殊标记,则为每个待转化物0.05 μg/μl),使金颗粒表面包裹DNA。在悬液中加入2.5 μl亚精胺(0.1 M原液)和6.25 μl氯化钙2(2.5 M原液)。为35个年代:PIN2绿色荧光蛋白,35个年代:平快绿色荧光蛋白,35个年代:HDEL:绿色荧光蛋白,35个年代:VP16IAA17mImII, 0.1 μg/μl进行转化。离心成粒,用70%和100%乙醇洗涤两次,然后用10 μl 100%乙醇重悬。细胞在1100 psi的压力下被轰击。转化后直接加入10 μM NPA、10 μM 6-苄基氨基嘌呤(BAP) (Duchefa)或1 μM油菜素内酯(BR) (Fuji Chemical Industries)富集的by -2培养基0.5 ml进行药理学处理。用滑膜密封,在25°C的黑暗环境中保存18小时。为了进行显微分析,将细胞从过滤器(用刮刀)轻轻转移到显微镜载玻片(在水中)上,随后用盖玻片覆盖。样品通过共聚焦显微镜进行分析。
显微镜
活细胞共聚焦显微镜使用蔡司710显微镜。检测到GFP(激发488 nm,发射峰509 nm)和mRFP1(激发561 nm,发射峰607 nm)的荧光信号。双标采用序贯扫描,避免通道间串扰。的DR5rev:mRFP通过定义每个成像细胞(中间切片)的平均灰度值(MGV)来评估表达。每次实验均根据对照细胞的DR5rev:mRFP信号定义共焦设置,并在各自实验期间保持不变。转化子基于两种蛋白的荧光进行鉴定,用40倍物镜成像,并根据相对MGV细分为四个簇(极低、低、中、高)(另见附加文件)1:图S2)。每个实验都进行了三次(独立的转化),对于每种条件,至少有60个转化细胞被成像。计算均数和标准误差,通过学生t检验(用于MGV分析)和方差分析(用于细分为聚类)获得统计学显著性(两个群体之间的独立性)。
缩写
- 2:
-
明亮Yellow-2
- 销:
-
Pin-formed
- 呃:
-
内质网
- NPA:
-
1-naphthylphthalamic酸
- 而得利:
-
PIN-likes
- WAT1:
-
墙很薄
- 东盟地区论坛:
-
生长素反应因子
- 行动/空军基地:
-
运输抑制反应/生长素F-box蛋白
- 辅助/宽松:
-
抗生长素1/类生长素1
- GH3:
-
格雷琴·哈根3
- mRFP:
-
单体红色荧光蛋白
- 乙酰天冬氨酸:
-
1-Naphthylacetic酸
- MGV:
-
平均灰度值
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 塔塔:
-
Two-component-output-sensor
- 软面包卷:
-
6-benzylaminopurine
- 挂钩:
-
聚乙二醇。
参考文献
- 1.
Perrot-Rechenmann C:细胞对生长素的反应:分裂与扩张。中国生物医学工程学报,2010,2 (5):a001446-10.1101/ cshperspective .a001446。
- 2.
Gray WM, Kepinski S, Rouse D, Leyser O, Estelle M:生长素调节SCF(TIR1)依赖性AUX/IAA蛋白降解。自然科学学报,2001,29(4):344 - 344。10.1038 / 35104500。
- 3.
Dharmasiri N, Dharmasiri S, Estelle M: F-box蛋白TIR1是一种生长素受体。自然科学学报,2005,35(4):344 - 344。10.1038 / nature03543。
- 4.
Kepinski S, Leyser O:植物发育:生长素循环。动物学报,2005,15 (6):R208-R210。10.1016 / j.cub.2005.03.012。
- 5.
罗斯奎特M,巴贝兹E, Kleine-Vehn J:细胞生长素稳态:守门是管家。分子植物学报,2011,5(4):772-786。
- 6.
Zazimalova E, Murphy AS, Yang H, Hoyerova K, Hosek P:生长素转运蛋白为什么这么多?中国生物医学工程学报,2010,2 (3):a001552-10.1101/ cshperspective .a001552。
- 7.
Bennett MJ, Marchant A, Green HG, May ST, Ward SP, Millner PA, Walker AR, Schulz B, Feldmann KA:拟南芥AUX1基因:一种根系向地性的量测调控基因。科学通报,1996,29(4):344 - 344。10.1126 / science.273.5277.948。
- 8.
Luschnig C, Gaxiola RA, Grisafi P, Fink GR: EIR1,一种参与生长素转运的根特异性蛋白,是拟南芥向地性所必需的。基因开发,1998,12(14):2175-2187。10.1101 / gad.12.14.2175。
- 9.
Geisler M, Blakeslee JJ, Bouchard R, Lee OR, Vincenzetti V, Bandyopadhyay A, Titapiwatanakun B, Peer WA, Bailly A, Richards EL,等:拟南芥MDR/PGP转运体AtPGP1催化生长素的细胞外排。植物学报,2005,44(2):179-194。10.1111 / j.1365 - 313 x.2005.02519.x。
- 10.
杨晓明,王晓明,王晓明,等。植物生长素的时空分布及其对植物生长发育的影响。细胞生命科学,2006,63(24):2738-2754。
- 11.
Katekar GF, Geissler AE:生长素运输抑制剂:IV:提出的一类生长素运输抑制剂的共同作用模式的证据:植物促肽。中国植物学报,2000,26(6):344 - 344。10.1104 / pp.66.6.1190。
- 12.
Rubery PH:载体介导的生长素转运。植物学报,2004,18(3):344 - 344。10.1007 / BF00388387。
- 13.
藤田T,坂口H, Hiwatashi Y, Wagstaff SJ, Ito M, Deguchi H, Sato T, Hasebe M:苔藓植物芽的趋同进化:缺乏生长素的极性运输。生物技术学报,2008,10(2):176-186。10.1111 / j.1525 - 142 x.2008.00225.x。
- 14.
Mravec J, Skupa P, Bailly A, Hoyerova K, Krecek P, Bielach A, Petrasek J, Zhang J, Gaykova V, Stierhof YD,等:植物激素生长素的亚细胞稳态由er定位PIN5转运体介导。自然科学进展,2009,39(4):344 - 344。10.1038 / nature08066。
- 15.
Bosco CD, Dovzhenko A, Liu X, Woerner N, Rensch T, Eismann M, Eimer S, Hegermann J, Paponov IA, Ruperti B,等:内质网定位PIN8是花粉特异性生长素载体,参与细胞内生长素稳态。植物学报,2012,31(5):366 - 366。10.1111 / j.1365 - 313 x.2012.05037.x。
- 16.
丁z,王波,Moreno I, Duplakova N, Simon S, Carraro N, Reemmer J, Pencik A, Chen X, Tejos R,等:er定位生长素转运蛋白PIN8调控拟南芥生长素稳态和雄配子体发育。环境科学学报,2012,3:941-
- 17.
王斌,朱军,李艳,王斌,王斌,等:植物生长素载体家族对植物细胞内生长素稳态调控的研究。自然科学进展,2012,34(6):344 - 344。10.1038 / nature11001。
- 18.
杨晓东,杨晓明,杨晓明,Petrášek J:植物长生素载体的结构多样性及其对植物生长的影响。前厂交通运输,2012,10.3389/fpls.2012.00227。
- 19.
张志刚,张志刚。植物生长素区系的研究进展。中国植物学报,2012,10.1016/j.pbi.2012.10.005。
- 20.
黄志强,李志强,李志强,等。植物生长素在烟草细胞中表达的研究进展。植物学报,2000,21(4):588 -588。10.1007 / s004250050047。
- 21.
Petrasek J, Mravec J, Bouchard R, Blakeslee JJ, Abas M, Seifertova D, Wisniewska J, Tadele Z, Kubes M, Covanova M,等:PIN蛋白在细胞生长素外排中的限制作用。科学通报,2006,31(4):344 - 344。10.1126 / science.1123542。
- 22.
杨艳,刘志刚,刘志刚,刘志刚,杨艳,刘志刚,陈志刚,陈志刚:植物生长素的高亲和性转运。动物学报,2006,16(11):1123-1127。10.1016 / j.cub.2006.04.029。
- 23.
杨华,Murphy AS:拟南芥ABCB、AUX 1和PIN生长素转运蛋白在蓬节糖菌中的功能表达与鉴定。植物学报,2009,39(1):379 - 379。10.1111 / j.1365 - 313 x.2009.03856.x。
- 24.
李士华,赵洪涛:拟南芥根毛细胞和烟草细胞中PINOID对生长素外排有正向调控作用。植物细胞学报,2006,18(7):1604-1616。10.1105 / tpc.105.035972。
- 25.
姜古丽,李士华,赵敏,李璐,刘海华,赵海东:拟南芥根毛细胞中pin -形成蛋白的差异生长素转运活性。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.110.156505。
- 26.
Jones AR, Kramer EM, Knox K, Swarup R, Bennett MJ, Lazarus CM, Leyser HM, Grierson CS:生长素通过非毛细胞运输维持根毛发育。细胞生物学杂志,2009,11(1):78-84。10.1038 / ncb1815。
- 27.
Ulmasov T, Murfett J, Hagen G, Guilfoyle TJ: Aux/IAA蛋白抑制含有天然和高活性合成生长素反应元件的报告基因的表达。植物细胞学报,1997,9(11):1963-1971。
- 28.
Casimiro I, Marchant A, Bhalerao RP, Beeckman T, Dhooge S, Swarup R, Graham N, Inze D, Sandberg G, Casero PJ,等:生长素转运促进拟南芥侧根启动。植物学报,2001,13(4):843-852。
- 29.
黄志刚,张志刚,张志刚,张志刚。植物生长素对植物器官形成的影响。光子学报,2003,15(5):591-602。10.1016 / s0092 - 8674(03) 00924 - 3。
- 30.
Friml J, Vieten A, Sauer M, Weijers D, Schwarz H, Hamann T, Offringa R, Jurgens G:拟南芥外源生长素梯度的建立自然科学学报,2003,26(6):344 - 344。10.1038 / nature02085。
- 31.
Dubrovsky JG, Sauer M, Napsucialy-Mendivil S, Ivanchenko MG, Friml J, Shishkova S, Celenza J, Benkova E:生长素作为局部形态发生的触发器来指定侧根创始人细胞。自然科学进展,2008,26(3):379 - 379。10.1073 / pnas.0712307105。
- 32.
Petersson SV, Johansson AI, Kowalczyk M, Makoveychuk A, Wang JY, Moritz T, Grebe M, Benfey PN, Sandberg G, Ljung K: IAA分布和合成的高分辨率细胞特异性分析显示拟南芥根尖生长素梯度和最大值植物细胞学报,2009,21(6):1659-1668。10.1105 / tpc.109.066480。
- 33.
苏瑞芬K,吉林T,李吉仁SJ,李荣凯,Robles P, galvana - ampudia CS, Offringa R, Friml J, Yanofsky MF, Ostergaard L:拟南芥种子传播过程中生长素最低水平的调控。自然科学进展,2009,39(1):1 - 4。10.1038 / nature07875。
- 34.
Nakamura A, Higuchi K, Goda H, Fujiwara MT, Sawa S, Koshiba T, Shimada Y, Yoshida S:油菜素内酯诱导拟南芥合成生长素反应元件IAA5, IAA19和DR5,暗示油菜素内酯和生长素信号的交叉点。植物科学进展,2003,26(4):344 - 344。10.1104 / pp.103.030031。
- 35.
李志刚,李志刚,李志刚。拟南芥雌芽形态发生过程中生长素和ETTIN的表达。发展,2000,127(18):3877-3888。
- 36.
杨晓东,杨晓东,杨晓东,杨晓东。玉米分枝途径中腋生分生组织命运的控制。发展,2010,137(17):2849-2856。10.1242 / dev.051748。
- 37.
Marin E, Jouannet V, Herz A, Lokerse AS, Weijers D, Vaucheret H, Nussaume L, Crespi MD, Maizel A: miR390,拟南芥TAS3 tasiRNAs及其生长素响应因子靶点定义了一个定量调节侧根生长的自动调节网络。植物细胞学报,2010,22(4):1104-1117。10.1105 / tpc.109.072553。
- 38.
Lankova M, Smith RS, Pesek B, Kubes M, Zazimalova E, Petrasek J, Hoyerova K:生长素流入抑制剂1-NOA, 2-NOA和CHPAA干扰烟草细胞的膜动力学。实验学报,2010,61(13):3589-3598。10.1093 / jxb / erq172。
- 39.
Sanford JC, Klein TM, Wolf ED, Allen N:利用粒子轰击过程将物质输送到细胞和组织中。UPST。1987, 5(1): 27-37。10.1080 / 02726358708904533。
- 40.
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。烟草细胞粒子轰击技术的研究进展。美国国家科学研究院。1988, 85(22): 8502- 8502。10.1073 / pnas.85.22.8502。
- 41.
黄志刚,李志刚,李志刚:植物生长素应答因子域在植物生长素应答转录中的作用。植物学报,2003,15(2):533-543。10.1105 / tpc.008417。
- 42.
李永强,李志强,李志强,等。植物向性过程中生长素响应启动子的诱导。植物生理学报,2004,18(3):344 - 344。
- 43.
许志强,李志强,李志强,李志强,李志强,李志强:拟南芥中n -1-萘基酞酸结合质膜相关氨基肽酶的鉴定、纯化及分子克隆。植物营养学报,2002,26(3):357 - 357。10.1104 / pp.010519。
- 44.
陈晓明,王晓明,王晓明,王晓明,等。植物质膜再循环通路与细胞极性的关系。中国生物医学工程学报,2006,29(4):344 - 344。
- 45.
李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚。植物生长素外排载体PIN2的研究进展。科学通报,2008,29(6):489 - 497。10.1073 / pnas.0808073105。
- 46.
Cox DN, Muday GK: NPA结合活性在质膜外周,与细胞骨架相关。植物学报,1994,6(12):1941-1953。
- 47.
Ranocha P, Denance N, Vanholme R, Freydier A, Martinez Y, Hoffmann L, Kohler L, Pouzet C, Renou JP, Sundberg B,等:Walls are thin 1 (WAT1)是拟南芥中Medicago truncatula NODULIN21的同源物,是纤维中次生壁形成所需的一种膜胞体定位蛋白。植物学报,2010,30(3):469-483。10.1111 / j.1365 - 313 x.2010.04256.x。
- 48.
杨晓明,张晓明,张晓明,等。细胞分裂素和生长素在早期胚胎发育中的作用。自然科学学报,2008,38(4):344 - 344。10.1038 / nature06943。
- 49.
Blakeslee JJ, Peer WA, Murphy AS:生长素转运。植物学报,2005,8(5):494-500。10.1016 / j.pbi.2005.07.014。
- 50.
刘志刚,陈志刚,陈志刚,陈志刚,陈志刚。拟南芥根系生长素合成的研究进展。植物细胞学报,2005,17(4):1090-1104。10.1105 / tpc.104.029272。
- 51.
Woodward AW, Bartel B:生长素:调控,作用和相互作用。安·博特(伦敦)。中国农业科学,2005,29(5):553 - 553。10.1093 / aob / mci083。
- 52.
王志刚,王志刚。植物细胞动态极性靶向的发育可塑性研究。环境科学学报,2010,29(16):2700-2714。10.1038 / emboj.2010.181。
- 53.
Krouk G, Lacombe B, Bielach A, perine - walker F, Malinska K, Mounier E, Hoyerova K, Tillard P, Leon S, Ljung K,等:NRT1.1硝酸盐调控植物生长素转运的机制研究细胞工程学报,2010,18(6):927-937。10.1016 / j.devcel.2010.05.008。
- 54.
Brunoud G, Wells DM, Oliva M, Larrieu A, Mirabet V, Burrow AH, Beeckman T, Kepinski S, Traas J, Bennett MJ,等:一种新型的高时空分辨率生长素响应和分布传感器。自然科学进展,2012,29(3):344 - 344。10.1038 / nature10791。
- 55.
Schnorf M, Neuhaus- url G, Galli A, Iida S, Potrykus I, Neuhaus G:植物细胞微注射转化的改进方法:分子和遗传分析。转基因研究,1991,1(1):23-30。10.1007 / BF02512993。
- 56.
竹内勇,多森M,基恩NT:植物改造:基于流动氦的简单粒子轰击装置。植物分子生物学,1992,18(4):835-839。10.1007 / BF00020031。
- 57.
Datta K, Datta SK:通过peg介导的DNA摄取转化水稻原生质体。方法分子生物学杂志,1999,111:335-347。
- 58.
Niemes S, Langhans M, Viotti C, Scheuring D, San Wan Yan M, Jiang L, Hillmer S, Robinson DG, Pimpl P: Retromer回收跨高尔基网络中的液泡分选受体。植物学报,2010,29(3):344 - 344。10.1111 / j.1365 - 313 x.2009.04034.x。
- 59.
Robert S, Kleine-Vehn J, Barbez E, Sauer M, Paciorek T, Baster P, Vanneste S, Zhang J, Simon S, Covanova M,等:ABP1介导生长素抑制拟南芥格网蛋白依赖的内吞作用。生物技术学报,2010,43(1):1- 11。10.1016 / j.cell.2010.09.027。
- 60.
王志刚,王志刚,王志刚,王志刚,王志刚。生长素信号通路与细胞内生长素信号通路的关系。生物化学学报,2010,6:447-
- 61.
Feraru E, Feraru MI, Kleine-Vehn J, Martiniere A, Mouille G, Vanneste S, Vernhettes S, runion J, Friml J:拟南芥细胞壁对PIN极性的维持。动物学报,2011,21(4):338-343。10.1016 / j.cub.2011.01.036。
- 62.
Nagata T, Nemoto Y, Hasezawa S:烟草BY-2细胞系作为高等植物细胞生物学中的“HeLa”细胞。中国生物医学杂志,1997,33(3):344 - 344。
- 63.
Abas L, Benjamins R, Malenica N, Paciorek T, Wisniewska J, Moulinier-Anzola JC, Sieberer T, Friml J, Luschnig C:拟南芥生长素外排促进因子PIN2的胞内转运和蛋白水解参与根向地性。细胞生物学杂志,2006,8(3):249-256。10.1038 / ncb1369。
- 64.
Langhans M, Marcote MJ, Pimpl P, virgli - lopez G, Robinson DG, Aniento F:植物细胞中p24蛋白的体内转运和定位。交通学报,2008,9(5):770-785。10.1111 / j.1600-0854.2008.00719.x。
- 65.
An G:烟草细胞的高效转化。中国农业科学,2004,27(4):457 - 457。10.1104 / pp.79.2.568。
- 66.
戴巴雷AMP, Imhoff V, Guern J:烟草细胞对2,4-二氯苯氧乙酸、萘-1-乙酸和吲哚-3-乙酸吸收和积累的控制机制比较。植物学报,1996,29(3):344 - 344。
确认
我们感谢T.J. Guilfoyle, C. Luschnig, D. Goffner, J. Sheen和P. Pimpl分享出版材料,并感谢M. De Cock在准备手稿方面的帮助。这项工作得到了维也纳科技基金(WWTF) (J.K.-V。),该机构为创新科技(IWT)和全宗voor Wetenschappelijk Onderzoek (FWO)(格兰特博士前的交通和旅游E.B.),奥德修斯项目的研究Foundation-Flanders (J.F)授予机构的捷克共和国,项目CZ.1.07/2.3.00/20.0043 CZ.1.05/1.1.00/02.0068(参考),P305/11/2476 (J.P.)和P305/11/0797 (E.Z.)和巴登-符腾堡州的土地,Heidelberg大学的Chica und Heinz Schaller基金会和蜂窝网络卓越集群(到A.M.)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
我们保证与任何金融机构就手稿中讨论的数据和材料不存在利益冲突。
作者的贡献
EB和JKV构思了该项目,EB进行了大部分实验,ML和MP进行了生长素积累测定,并对稳定转化的BY-2细胞系进行了成像。AM提供了DR5rev:mRFP结构。EB、ML、MP、EZ、JP、AM、JF、JKV对结果进行了讨论,EB、JKV撰写了稿件。所有作者均已阅读并批准最终稿。
电子辅助材料
Barbez等补充信息。表S1。
附加文件1:共变换效率。测量了在几种浓度比下转换的两种结构的共转换效率。根据质粒1的存在鉴定转化子,并计算携带两种质粒的细胞百分比。图S1:PIN1-GFP与DR5rev:mRFP信号强度的相关性。(A)图表描述相对PIN7地塞米松诱导表达水平GVG-PIN7定量rt - pcr分析非诱导细胞(n = 3)。(B)雌二醇诱导的BY-2细胞表现出个体差异PIN1-绿色荧光蛋白表达式。PIN1-GFP的细胞强度与DR5rev:mRFP信号强度呈负相关。强烈PIN1-绿色荧光蛋白与表达较弱的细胞相比,表达细胞显示DR5rev:mRFP信号强度明显降低(绿色箭头)PIN1-绿色荧光蛋白表达式(红色箭头)。(C)散点图描述PIN1-GFP的单细胞平均灰度值(MGV)及其对应的DR5rev:mRFP荧光强度(n = 178)。图S2。DR5rev:mRFP信号强度量化。DR5rev:mRFP信号强度用灰度表示,用Image j测量每个变换后的细胞的平均灰度值(MGV),根据对照样本的平均MGV计算每个细胞的相对MGV。个别相对MGV描绘在图片中。每个样品的转化细胞群根据相对MGV细分为4类。相对MGV低于0.5(= 2)的细胞被评分为低(-)-1),相对MGV在0.5(= 2)之间的中等(+)-1)和1 (= 20),高(++)相对MGV在1(= 2)之间0)和2 (= 21)和非常高(+++),平均灰值高于2 (= 2)1).该评估可视化了DR5rev:RFP信号强度在转化细胞群中的可变性。在使用的共聚焦设置,大多数可视化细胞聚集在类别中和强。图S3。油菜素内酯对细胞生长素稳态的影响。(一)DR5rev:绿色荧光蛋白油菜素内酯(1 μM;18小时)治疗和未经治疗拟南芥幼苗。图中为DR5rev:GFP强度的相对平均平均灰度值(MGV)。误差条表示标准误差(n > 20)。(B)代表图片显示DR5rev:未处理(左)和油菜素内酯处理(右)幼苗的GFP信号强度。颜色编码(黑到白)描述(低到高)DR5牧师:GFP信号强度。(C)该图为大气的相对平均MGVDR5rev:mRFP改变了细胞。误差条表示标准误差(n > 50)。应用1 μM富含油菜素内酯的培养基对DR5rev:mRFP的平均相对MGV无显著影响。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(D)代表性图片显示10个转化对照(左)和油菜素内酯处理(右)细胞的DR5rev:mRFP信号强度。(E)图描述了两个样本之间DR5rev:mRFP信号强度分别为低(-)、中(+)、高(++)和非常高(+++)的转化细胞相对数量的变化。有关量化的详细描述,请参阅附加文件1:图S2油菜素内酯(1μM富含油菜素内酯的培养基)处理后,细胞相对数量发生显著变化,表现出低、中、高和极高的DR5rev:mRFP信号强度,表明油菜素内酯影响转化细胞群中相对MGV的可变性。误差条表示标准误差(n = 3次重复,至少有50个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;表示P值。图S4。PILS5对NPA敏感。在NPA存在时,PILS5_D的表达降低了DR5rev:mRFP信号强度。(A)图表示DR5rev:mRFP信号强度的相对平均平均灰度值(MGV)。误差条表示标准误差(n = 60)。采用非配对学生t检验(* P < 0.05, ** P < 0.01, *** P < 0.0001)评价差异有统计学意义。(B)图描述了两个样本之间显示低(-)、中(+)、高(++)和非常高(+++)DR5rev:mRFP信号强度的转换细胞的相对数量的变化(关于量化的详细描述,请参阅附加文件1:图S2)。误差条表示标准误差(n = 3次重复,至少有60个计数单元格)。采用方差分析(ANOVA)检验分析差异是否有统计学意义;表示p值。(pdf5102kb) (pdf5mb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
巴贝斯,E, Laňková, M, Pařezová, M。et al。基于单细胞的系统监测载体驱动的细胞生长素稳态。BMC植物生物学13,20(2013)。https://doi.org/10.1186/1471-2229-13-20
收到了:
接受:
发表:
关键字
- 生长素内稳态
- DR5
- 生长素载体
- 生长素运输