摘要
背景
浮萍,即Lemnoideae科的成员,是最小的水生开花植物之一。它们的高生长速度,水生习性和适宜的生物修复使其成为生物质生产的强有力的候选人。浮萍作为生物乙醇生产原料的潜力已被研究过;然而,它们以脂肪酸(FA)和油的形式积累减少碳的能力却鲜为人知。
结果
分析了30种浮萍的FA分布,评价了浮藻科的自然多样性。总脂肪酸含量在干重的4.6%至14.2%之间变化,而三酰甘油(TAG)含量在干重的0.02%至0.15%之间变化。三种FA, 16:0(棕榈酸),18:2Δ9,12(亚油酸,或LN)和18:3Δ9,12,15 (α-亚麻酸,或ALA)构成浮萍总FA的80%以上。七个浮萍属和两个Wolffiela物种还积累了含有Δ6-double键的多不饱和FA,即GLA和SDA。相对于总FA, TAG在饱和FA中富集,在多不饱和FA中缺乏,只有5种浮萍属物种在它们的TAG中累积Δ6-FA。在重组的DNA序列中鉴定出一个已知的Δ6-desaturase指定的lgde,与前端的Δ6-FA和Δ8-spingolipid去饱和酶家族同源浮萍属gibba.合成的LgDes基因在烟草benthamiana导致GLA和SDA的累积,确认它指定了一个Δ6-desaturase。
结论
在被调查的30种Lemnoideae中,FA的总积累变化是3倍。9种含有Δ6前端去饱和酶合成的GLA和SDA,但FA的组成在其他方面是相似的。TAG的累积可达总干重的0.15%,与陆地植物叶片中的含量相当。多不饱和脂肪酸在TAG中代表性不足,其中Δ6-FA GLA和SDA仅在其中5个TAG中被发现浮萍属产生它们的物种。当存在时,相对于总FA库中GLA的丰度,SDA增加,SDA减少。
背景
浮萍是已知最小的水生开花植物[1].这些单子叶植物家族属于柠檬科,包括五个属:浮萍属,Spirodela,Wolffia,Wolffiela而且Landoltia,包括超过38种分布在全球各地的不同物种[2].浮萍不同属的形态差异很大,从属成员相对复杂的结构不等Spirodela到在这个属中发现的极其简化的结构Wolffia.
自20世纪60年代以来,浮萍一直被用于研究[3.但是基因和分子技术在其他模型系统中发展得更快。由于对可再生生物质的高需求,人们对浮萍重新产生了兴趣。许多种类的浮萍繁殖速度很快,最快可达48小时浮萍属aequinoctialis而且Wolffia microscopica[1],而某些种类的浮萍有能力在废水中生长[4].最近的研究集中在浮萍产生淀粉和蛋白质的能力上,Spirodela polyrhiza当在猪的废水中生长时,已被证明积累高达20%干重的淀粉[5].这些特性使浮萍成为生物量生产的理想候选者。浮萍属gibba也被设计用于生产单克隆抗体[6].
淀粉和油都是光合作用固定碳的汇,但油的能量密度是淀粉的2倍多,被高度还原。植物油有广泛的用途,包括工业原料[7生物燃料和膳食补充剂。植物油通常从种子中获取,但最近的研究表明,油脂可以在营养组织中成功积累[8- - - - - -12].尽管关于浮萍的脂质组成和积累的资料很少,但其短暂的加倍时间、将多余的光合作用产物储存为淀粉的巨大能力以及在废水中生长的能力,使其成为筛选潜在营养油脂生产的有前途的候选者。
为了探索利用浮萍采油的可能性,我们对该科的30个不同物种进行了FA和TAG含量的调查。本研究还检测了浮萍的FA组成,以确定积累特定FA的浮萍品系,这些品系作为工业原料或膳食补充剂具有潜在的重要性。调查显示,9种浮萍以γ-亚麻酸(GLA)或硬脂酸(SDA)的形式积累Δ6-containing FA。虽然这些脂肪酸很少在高等植物中发现,但它们存在于琉璃苣中[13),而Echium[14].Δ6-containing FA是由通常称为“前端”的去饱和酶合成的,因为它们在FA的羧基和一个已有的双键之间引入双键[15,而不是像大多数去饱和酶那样在现有的双键和端甲基之间。前端去饱和酶在c端与电子供体细胞色素b融合时发生5并包含在所有去饱和酶中发现的三部组氨酸基序[16],只不过第三盒中的第一个组氨酸被谷氨酰胺取代[15].Δ6去饱和酶序列与一类无处不在的Δ8鞘脂长链基(LCB)去饱和酶聚集在一起[17阻止它们仅根据序列来指定任何一个类的功能。详细研究浮萍属gibba该酶同时包含GLA和SDA,结果鉴定出了LgDes,它是Δ6/Δ8去饱和酶家族的成员。LgDes是一种Δ6的去饱和酶烟草benthamiana.
方法
植物材料和生长条件
浮萍系来自罗格斯大学浮萍种群合作社(http://www.ruduckweed.org),在含1.6 g/L Schenk and Hildebrandt基础盐混合物(Sigma)和0.5%葡萄糖(pH 5.7)的SH培养基中培养。在T-75培养瓶中培养100 ml培养基,22°C,连续荧光(100 μE m)-2年代-1).
生物质成分分析
浮萍是通过过滤去除多余的介质来收获的。总干重、脂质和代谢物含量的测定如前所述[18].简单地说,将浮萍组织均质于3ml甲醇/水(4:3,v/v)中,使用Omni组织研磨机(Omni International, Merietta, GA),然后加入3.4 mL CHCl3.建立双相溶剂体系(CHCl3./甲醇/小时2O, 8:4:3, v/v/v, [19])。用室温下3000xg离心分离相。脂质干重组分(CHCl3.相)、游离代谢物(甲醇/水相)和细胞球(不溶性物质)。
标记提取
采用薄层色谱法(TLC)从总脂提取物中分离TAG。大约25%的总脂质提取物与拟南芥种子油(TAG)标准一起被标记在硅胶板上。然后用正己烷:乙醚:乙酸(80:20:1,v/v/v)显影。显影后,脂质在碘蒸气中孵育可见。通过与正品标准的比较来确定TAG的迁移性,并通过从TLC板上刮取二氧化硅来收集含有TAG的硅带。
FA和TAG分析
如前所述,利用三氯化硼甲醇进行衍生化,FA被转化为脂肪酸甲酯(FAMEs) [20.,21],加入100 μg十七烷酸作为内标。FAMEs与2-氨基-2-甲基-1-丙醇在190°C的氮气气氛下孵育16小时,生成4,4-二甲基唑啉(DMOX)衍生物[21].使用标准协议生成吡咯烷酮加合物[22].为了便于定量,在每个样品中加入100 μg十七烷酸作为内标,通过对每个GC-MS峰相对于内标的面积进行积分来确定TAG中FA的丰度。采用配备安捷伦J&W DB 23毛细管柱(30 m × 0.25 mm × 0.25 mm)和5973型质量选择检测器的惠普6890气相色谱仪进行FA和TAG谱分析。每个样品的分析使用250°C的注入温度和一个程序,在该程序中,烤箱加热80-170°C,以20°C/min, 170-210°C,以5°C/min。数值以平均百分比±标准差表示,n = 3或更多。
烟草瞬时表达系统
烟草benthamiana植株在16/8小时昼夜循环条件下生长约6周,生长速率约为160 μmol m-2年代-1在22°C的温度下瞬态表达式协议基于Schütze方法[23].在入渗前一天,给植株浇水,为了减少样品的变异,去掉上部和下部的叶片,留下3片刚刚完全展开的叶片(直径约为10-12厘米)用于入渗。这一过程使每片叶子在接种后的阶段暴露在充分的光照下。一个单一的蜂群农杆菌属含有在35S启动子控制下含有目标去饱和酶基因的二元质粒[24]在30℃下,5毫升含有适当抗生素的LB培养基中培养过夜。在4000 ×g离心10分钟收集细胞,并在新鲜制备的AS培养基(10 mM MES-KOH, pH 5.6, 10 mM MgCl)中重悬2, 150 μM乙酰丁香酮)至外径6000.5毫升,孵育1.5小时。22°C。将该悬浮液用含有p19 RNA沉默抑制因子的同等细胞制剂稀释1:1 [25]并在22°C下进一步培养1.5小时,然后用1ml无针注射器压在叶片背面进行渗透。每片叶子进行大约8次离散浸润,处理浸润和对照浸润的位置随机分配。用圆珠笔标记浸润区域的周长和处理代码。植株在正常生长条件下返回生长室,浸润后4天取叶进行分析。
结果
总脂肪酸含量和组成
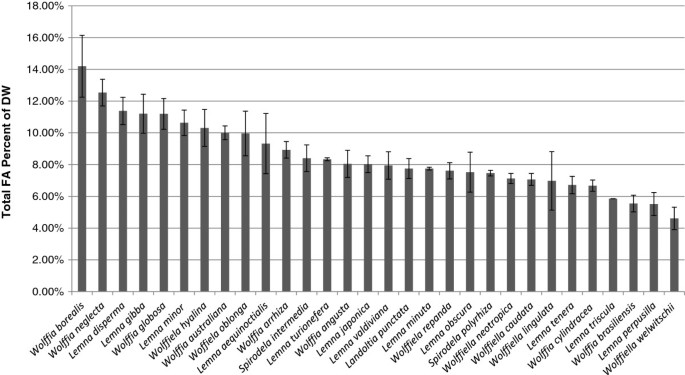
选取了30种浮萍,代表了浮藻科中自然多样性的最广泛范围。培养物来自罗格斯浮萍种群合作社,每个物种的来源见表1.培养物在半强度SH培养基上添加0.5%葡萄糖培养两周,同时收获0.1 - 0.7克新鲜叶片用于脂质分析。为了便于统计分析,30个物种中的每一个都培养了3个独立的培养体。提取的油脂转化为FA甲酯(FAMEs),用毛细管气相色谱-质谱联用(GC-MS)分离得到不同FA种类的组成。每种鱼的脂质含量占干重的百分比如图所示1.FA的含量范围为4.6%Wolffiela welwischii为14.2%Wolffia北欧化工30个物种的中位数为8.0%。50%的物种在6.9%到10.1%之间。单个物种的标准差通常<平均值的15%,脂质含量范围内的差异非常显著(学生t检验P <0.001)。
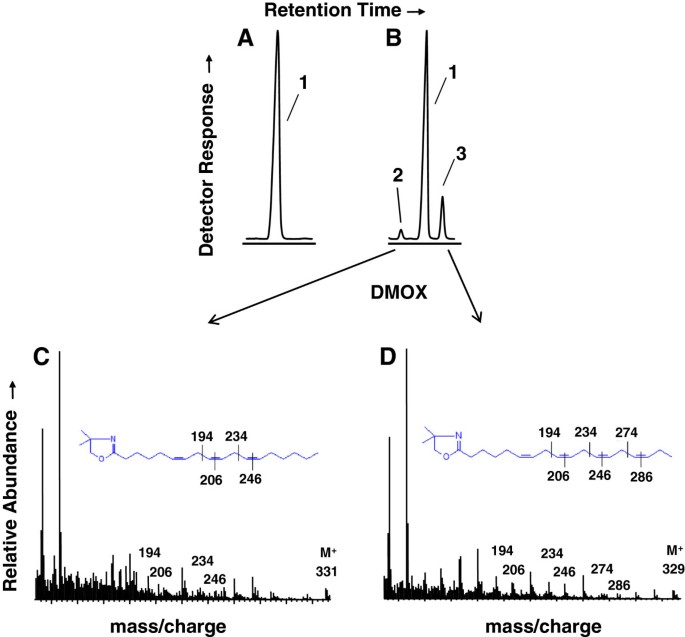
利用DMOX进一步衍生了fame,使其能够根据质谱分析的碎片模式诊断分配FA中的双键位置。三种FA, 16:0, 18:2和18:3 (Δ9,12,15,或ALA)构成了所有物种中发现的约80%的FA(表2).16:0在17.2%之间Wolffiella hyalina年的36.3%Wolffiella lingulata,中位数为24.4%;18:2的范围为4.8%Wolffiella neotropica年的25.5%Wolffiella北欧化工中位数为17.5%;ALA为34.2%Wolffiella北欧化工年的64%Spirodella polyrhiza中位数为47.7%。除了陆生植物中常见的FA外,在一个种亚群中还发现了两种不同寻常的FA, M /z 331和M /z 329离子,分别对应于18:3和18:4种浮萍属gibba但在其他情况下则不然,例如,Spirodella polyrhiza(图2).对18:3新物种的DMOX衍生物进行质谱分析,根据Δ6 (m / z152、167及180)、Δ9 (m / z194、206)和Δ12 (m / z234,246)双键(图2C). 18:4 DMOX衍生物产生的离子对应于Δ6,9,12双键,如上文所述的GLA,加上具有Δ15双键特征的离子(m / z274和286),确定其为SDA (18:4Δ6,9,12,15,十八烯酸)(图2D) 6例检出GLA和SDA浮萍属(L. distrima, L. gibba, L. japonica, L. obscura, L. triscula, L. valdiviana)和一个Wolffia(w . australiana)的物种;一个额外的浮萍属(l . valdiviana)种仅含GLA和aWolffia(w .茶树菇)种仅含SDA。GLA含量最高,为4.5%浮萍属粳稻;SDA含量最高,为10.1%Wolffia austrialiana其中,GLA + SDA的含量也最高(11.8%)。
GLA和SDA的鉴别浮萍属gibba.FA 4,4-二甲基恶唑啉(DMOX)衍生物的部分气相色谱迹Spirodela polyrhiza(面板一个),浮萍属gibba(面板B).标记为1的峰对应ALA、2、GLA和3、SDA。与GLA的DMOX衍生物对应的质谱C)和SDA(小组)D)所示。根据W.W. Christie (http://lipidlibrary.aocs.org/ms/masspec.html).
的识别ΔLemna gibba的6-去饱和酶
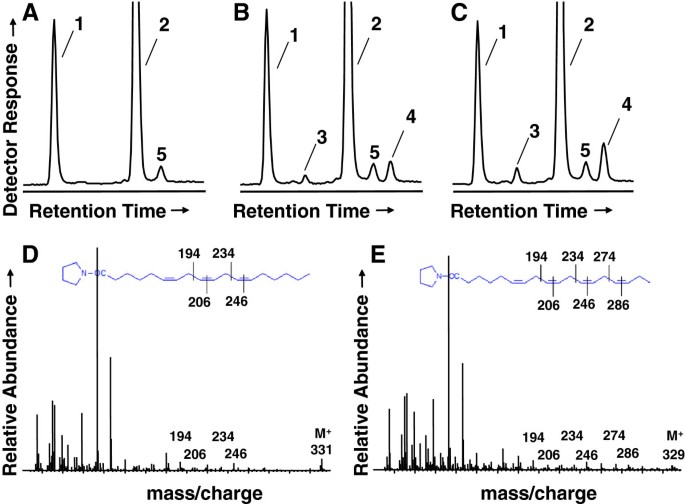
我们推测,Lemnoideae中的Δ6-desaturation可能是前端去饱和酶作用的结果[15与高等陆地植物相似。我们通过执行TBLASTN查询来开始我们的调查新创汇编成绩单数据库浮萍属gibbaG3 DWC131(未发表的,http://www.lemna.org的氨基酸序列Borago officinalisΔ6-desaturase, Boofd6 [13],负责从LA合成GLA和从ALA合成SDA。搜索返回了我们指定的LgDes候选序列(Genbank登录:KF638283),该序列具有62%的氨基酸同一性Borago officinalisΔ6-desaturase(表3.).对lgde与GenBank的互反检索发现了许多前端去饱和酶同源物,它们被注释为Δ6-FA去饱和酶或Δ8-sphingolipid长链基(LCB)去饱和酶。我们缩小了搜索范围,只包括功能表达实验支持注释的基因。这产生了5个Δ6-FA去饱和酶和6个Δ8-LCB去饱和酶(见图)3.).lgde与这些序列的多重序列比对揭示了强同源块,包括膜去饱和酶特征的三个组氨酸簇周围的区域[16].为了区分LgDes编码的是Δ6-FA去饱和酶还是Δ8-LCB去饱和酶,我们对LgDes和11个实验定义的序列进行了两两比较3.).LgDes最接近的同源物是烟草Δ8-LCB去饱和酶(70%)[17]然后是Δ6-FA desaturases fromEchinum gentianoides(65%)和酷栗初步(63%)拟南芥Δ8-LCB desaturase [26]和琉璃苣Δ6-FA去饱和酶[13(两者的比例均为62%)。这些关系可以可视化为一个系统发育树(图4),令人惊讶的是,Δ6-FA去饱和酶或Δ8-LCB去饱和酶并没有聚集在不同的分支中。因为LgDes不属于Δ6-FA或Δ8-LCB去饱和酶的一个离散分支,我们通过异源表达和表型分析来评估LgDes的功能。为了达到这一目的,LgDes和琉璃苣Δ6-FA去饱和酶被克隆到二元植物表达载体中,用于农杆菌介导的瞬时表达烟草benthamiana叶子(27].一个由空矢量组成的对照被用作阴性对照。接种4 d后提取叶片FA,质谱分析。如图所示5在叶片样品中检测到A-C,洗脱峰的迁移率符合GLA和SDA标准Borago officinalisΔ6-desaturase和LgDes,但阴性对照质粒没有。与GLA和SDA吡咯烷醚衍生物相对应的质谱证实了这些FA的身份(图5, D和E)。总之,这些数据最终确定LgDes作为Δ6-FA去饱和酶,但目前的分析不能排除它也可以进行Δ8-LCB鞘脂去饱和的正式可能性。在我们的实验条件下,lgde的转化效率约为琉璃苣去饱和酶BoD6的一半(表4).lgde将大约4%的LA转化为GLA, 3%的ALA转化为SDA。
lgde与经实验验证的同源物的序列比较。对齐使用CLUSTALW2 [28和BOXSHADE 3.21。(http://www.ch.embnet.org/software/BOX_form.html).在给定位置上6个或6个以上序列相同的残基以黑底白字显示,6个或6个以上相似的残基以灰底白字显示。序列:LgDes (KF638283,本研究),Δ6去饱和酶序列:Borago officinalis(BoD6 AAC49700) (13];Echinum gentianoides(EgD6 AAL23580) (14],樱草属植物farinosa(PfD6 AAP23034) (29],酷栗初步(RnD6 ADA60230) (30.],樱草属植物vialii(PvD6 AAP23036) (29].Δ8序列:拟南芥(AtD8a NP_191717;AtD8b NP_182144) (26],烟草(NtD8 ABO31111) (17],向日葵(HaD8 CAA60621) (31],樱草属植物farinosa(PfD8, AAP23033, PvD8, AAP23035) [29].膜结合去饱和酶常见的三个组氨酸盒用红色下划线标出。一致的细胞色素b5序列用蓝色下划线标出,由CPDL识别的lgde的L210对应的氨基酸位置用红色垂直箭头标出。
具有实验验证同源物的lgde的系统发育树。Clustalw2系统发生树输出输入到Phylodendron树绘图工具(http://iubio.bio.indiana.edu/treeapp/treeprint-form.html),通过邻接距离分析构建树。线长表示节点之间的相对距离。序列和基因标识符如图所示3..颜色编码:LgDes,红色,Δ6-FA去饱和酶绿色和Δ8-LCB鞘脂去饱和酶,蓝色。
LgDes的表达导致GLA和SDA的积累n benthamiana叶子。fa -吡咯烷醚衍生物的部分气相色谱迹烟草benthamiana包含空矢量控制(面板一个),乐金显示器(面板B)、琉璃苣Δ6-desaturase(面板C).峰标1,对应LA, 2, ALA, 3, GLA, 4, SDA, 5, 20:0。与GLA的吡咯烷醚衍生物对应的质谱(PanelD)和SDA(小组)E)由面板B所示的lgde表达式推导而来,分别显示了峰3和峰4。根据W.W. Christie (http://lipidlibrary.aocs.org/ms/masspec.html).
三酰甘油的含量和组成
采用薄层色谱法(TLC)与拟南芥TAG标准进行共迁移鉴定。采集TAG对应的TLC板区域,提取FA转化为相应的FAMEs,用GC/MS进行分离。每个物种的TAG含量(表5)的范围为0.02%Spirodela polyrhiza年的0.15%Wolffiella lingulata中位数为0.06%。TAG的FA组成与总FA相似,超过80%的FA由16:0、18:0、18:2和18:3 (ALA)组成。然而,总FA中含有28%的饱和脂肪酸(16:0 + 18:0)和64%的多不饱和脂肪酸(18:2和18:3 ALA),而TAG中含有57%的饱和脂肪酸和只有33%的多不饱和脂肪酸。因此,相对于总FA(40%),饱和,16:0和18:0都在TAG中富集vs.25%和17%vs.分别为3%),18:2基本不变(15%)vs。与总FA相比,TAG中的ALA显著降低(18%)vs。48%)。
而9种浮萍堆积Δ6-containing FA,只有5种浮萍属物种(长臂猿,长臂猿,暗箱猿,三叶猿,绿蕨)在TAG中累积它们。在三个物种中(L. japonica, L. triscula, L. turionefera), TAG中累积的GLA水平显著高于总FA水平约50%(学生t检验,p < 0.05),而TAG中SDA显著低于总FA水平约50%(学生t检验,p < 0.05)。九种浮萍中只有两种(L. japonica, L. turionefera)在总FA和TAG中都包含GLA和SDA(表5).
讨论
本研究是迄今为止对浮萍的FA和TAG组成和含量进行的最全面的调查,选取了30个物种代表浮藻科在形态和地理起源方面的多样性范围。
FA含量在3倍范围内;Wolffia北欧化工干重最高,为14.2%Wolffiella welwitschii在4.6%。总脂肪酸分布变化不大,其中ALA和棕榈酸占60%。所有被调查的物种在其TAG中具有相似的FA组成,其中50%的FA是由棕榈酸和ALA组成的。在22个被调查物种的TAG中硬脂酸占FA的10%。
叶片总游离脂肪酸的组成和TAG游离脂肪酸的组成大致相同,但总游离脂肪酸的组成不同于TAG。TAG中饱和FA的水平约为总FA池的两倍,ALA为补偿而降低;具体来说,硬脂酸在22种浮萍中占总FA的7%以下,但占TAG的10-34%。含有Δ6-double键的FA SDA遵循同样的模式,它的TAG水平比总FA池低51%,而GLA,像饱和FAs一样,是TAG在这三种结合的首选底物浮萍属物种粳稻,triscula而且turionefera,其水平在TAG中相对于总FA池增加了50%。TAG中饱和FA和GLA相对于总FA池的增加表明这三种浮萍含有偏好饱和FA和GLA的酰基转移酶。另一种解释是,每个浮萍物种都有几种酰基转移酶,它们对饱和(和GLA)和多不饱和FA底物具有不同的选择性,这些底物在不同的浮萍物种中表达的水平不同。这些结果提供的信息可能有助于识别含有特定FA成分的TAG的浮萍物种。
浮萍的叶子含油量远低于世界上主要的油料作物大豆、油菜籽、棉籽和花生的种子。Wolffiella lingulata籽粒含油量最高,占总干质量的0.14%,比大豆籽粒含油量低200倍[32比葵花籽低400倍[33].这种巨大的差异主要是由于本研究所收获的浮萍含有营养组织,更合适的比较方法是与其他营养组织进行比较。例如,拟南芥叶片含有约0.06%的干质量作为TAG [8],海棠叶中约含有0.15%的TAG和l . serriola叶子含有约0.5%的TAG [34].因此,Wolffiella lingulata的TAG含量为0.15%,属于陆地营养组织的范围。
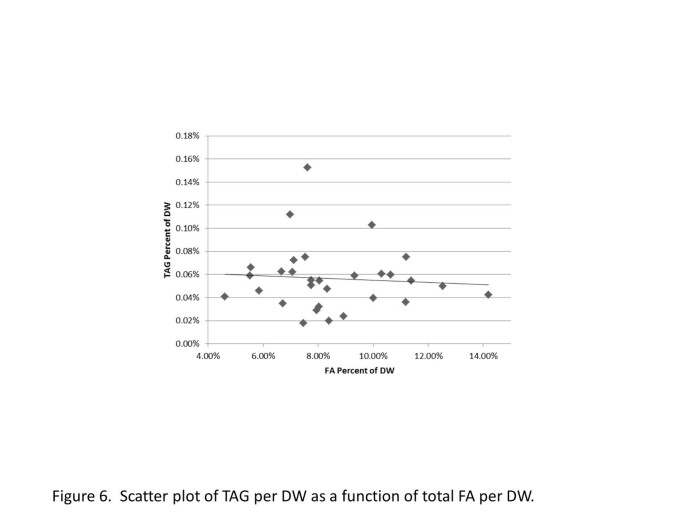
在30种浮萍中,总FA含量变化超过3倍,TAG含量变化约7倍,这促使我们思考TAG积累和总FA积累水平之间是否存在关系。TAG/总FA比值的显著变化约为14倍Wolffia austrialiana比例最低,只有0.2%Wolffiella lingulata比例最高,为2.7%。然而,Wolffiella lingulata可以被认为是一个异常值,因为它的比例几乎是排名第二的物种的两倍,浮萍属perpussila在1.4%。如果省略离群值,则其范围接近7倍,即与FA和TAG总含量的范围相似。这一观察结果促使我们思考TAG含量是否依赖于总FA水平,TAG含量占总FA的比例非常小(<0.8%)。因此,我们制作了30种浮萍的TAG含量与总FA含量的散点图(图1)6).TAG积累与总FA积累水平无显著相关性(R2< 0.1)。事实上,最高和最低的TAG含量存在于累积约占总FA的7.5%的物种中,即接近总FA含量的中位数8%,而含有最低和最高总FA含量的物种都只累积0.04%的TAG。与FA总量相比,在TAG中积累的FA的比例非常低(<0.8%),这表明浮萍组织中TAG的组装是有限的,增加酰基转移酶和油苷、卡红苷等油体结构蛋白的表达可能是增加TAG积累的有吸引力的靶点[11,35].当TAG开始大量消耗总FA库时,可以通过增加FA生物合成速率、转录因子如wrinkle 1 (wr1)的异位表达和抑制淀粉生物合成来进一步增强TAG的积累[10].FAS的增加也可以通过过表达其他转录因子来实现,如LEC2和FUS3,这些转录因子可以促进FA的生物合成[36],或通过增加FA生物合成第一步乙酰辅酶a羧化酶活性的策略[37].
脂质组成在所有被调查的浮萍中是相对均匀的,除了在9种浮萍中存在Δ6-FA。GLA和SDA是罕见的,只在少数高等植物中发现[38],包括琉璃苣[13),Echium[14].我们的发现是浮萍属gibbaΔ6去饱和酶LgDes与烟草具有较强的同源性Δ8-shingolipid去饱和酶[17]与琉璃苣Δ6去饱和酶相比,后者被用作同源探针来识别lgde,支持了Δ6-FA去饱和酶和Δ8-LCB鞘脂去饱和酶密切相关的观察,并可能在进化过程中彼此进化了许多次[15].在这方面,有趣的是,在酵母中使用密切相关的Δ6-FA和Δ8-LCB去饱和酶的表达实验表明,它们具有不重叠的功能[39].酵母中这两种底物的可用性表明,作为FA或LCB的酰基链的环境并不影响这些酶的区域选择性,就像对ADS酶家族一样,在ADS酶家族中,头部基团的性质决定了Δ7或Δ9双键是引入到16:0 FA底物上[40].确定缺乏可检测到的Δ6-FA的浮萍物种是否也缺乏Δ6-desaturase基因,或者它是否存在但在我们的生长条件下没有表达出来,这将是很有趣的。传统的南方或北方印迹法在这种情况下并不适用,因为Δ6-FA和Δ8-LCB去饱和酶基因序列之间的序列相似性通常很高(图3.而且4和[15])。因此,我们搜索了一个Δ6-FA-containing物种未发表的基因组浮萍属gibba,以及Δ6-FA-lacking物种,Spirodela polyrhiza与lgde同源的序列。在每个基因组中都发现了一个假定的去饱和酶,它们之间的同源性高于lgde,表明它们编码Δ8-LCB去饱和酶。因此,我们的搜索未能提供证据Spirodela polyrhizaΔ6-FA去饱和酶与lgde密切同源。
为了试图确定可能有助于解释Δ6-FA和6个Δ8-LCB去饱和酶之间酶特异性差异的位置,我们进行了保守性差异定位器(CPDL)分析[41]使用每一类的六种功能性酶(附加文件1: 6个D6和6个D8去饱和酶的CPDL分析)。许多氨基酸位置被确定为潜在的特异性决定残基,然而,只有一个位置(在氨基酸210处)显示出Δ6-FA和Δ8-LCB类去饱和酶之间一致的性质差异(见图)3.,垂直红色箭头)。LgDes中的中性氨基酸Leu210和其他5个Δ6去饱和酶中的Tyr所占据的位置被所有6个Δ8去饱和酶序列中的带电His残基所占据。210位氨基酸的性质以及位于氨基酸80和350之间的其他因子决定了Δ6 FA或Δ8 LCB活性,这一假设与现有琉苣嵌合体数据一致[39].
结论
对30种浮萍的调查显示,总FA含量在4.6% ~ 14.2%之间变化约3倍;然而,在被调查的30种浮萍中,FA组成的变化率惊人地低,其中棕榈质、LN和ALA三种FA占浮萍总FA的80%以上。然而,在7例中发现了Δ6-FA GLA和/或SDA浮萍属和两个Wolffiela物种。LgDes,一种去饱和酶,与前端去饱和酶Δ6-FA和Δ8-spingolipid家族同源,包括细胞色素b5-去饱和酶融合,从浮萍属gibba经表达证实为Δ6-FA去饱和酶烟草benthamiana.在浮萍中,以牺牲多不饱和FA为代价而在饱和FA中富集的TAG可累积到总FA的0.15%,即与陆地植物叶片中的水平相当。Δ6-FA出现在TAG中只有5个浮萍属相对于它们在总FA池中的丰度,其中GLA增加,SDA减少。
参考文献
浮萍科植物的生物系统研究。卷2。柠檬科植物:形态学、核心学、生态学、地理分布、命名和描述。瑞士Zürich: Eidgenössische Technische Hochschule;1986.
Les DH,等:浮萍科(Lemnaceae)的系统发育和系统分类。系统学报,2002,27(2):221-240。
光周期-光期黑暗对临界夜长的影响。科学通报,2003,29(3):369。
浮萍去除猪泻湖污水中的营养物。科学通报,2000,43(2):263-269。
徐建林,等:高淀粉浮萍的生产及其转化为生物乙醇。中国生物工程学报,2011,29(2):369 - 371。
Woodard SL,等:评价从转基因Lemna中提取的单克隆抗体和用于纯化工艺开发的酚类提取。生物技术与工程学报,2009,32(3):569 -571。
卡尔森·阿斯等人:用新鲜石油取代化石油——用什么来取代?中国生物医学工程学报,2011,29(4):369 - 369。
Slocombe SP,等:通过脂肪酸分解和脂质合成途径的修饰来指导叶片中的油脂积累。植物生态学报,2009,29(4):394 - 394。
James CN,等:拟南芥cg -58同源体的破坏在植物中产生chanarin - dorfman样脂滴积累。中国生物医学工程学报,2010,29(4):369 - 369。
Sanjaya等:转基因拟南芥中通过将碳从淀粉转化为油的生物合成来增加营养组织的能量密度。植物生态学报,2011,9(8):874-883。
Vanhercke T,等:wr1和DGAT1共表达对植物三酰甘油生物合成的协同作用。中国科学(d辑:自然科学版)。
糖依赖性1脂肪酶限制了拟南芥营养组织中三酰甘油的积累。植物生理学报,2013,29(3):369 - 369。
含有n端细胞色素b5结构域的琉璃苣去饱和酶cDNA的表达导致转基因烟草中高水平的δ 6-去饱和脂肪酸的积累。中国科学:地球科学,1998,21(3):369 - 369。
Garcia-Maroto F等:两种鸢尾属植物δ 6-去饱和酶的克隆和分子表征:在酵母和烟草中异源表达GLA。油脂学报,2002,37(4):417-426。
细胞色素b(5)融合去饱和酶在多不饱和脂肪酸合成中的作用。前列腺素-白质必需脂肪酸的研究进展。中国生物医学工程学报,2003,38(2):359 - 361。
Shanklin J, Whittle E, Fox BG: 8个组氨酸残基在膜相关铁酶硬脂酰辅酶a去饱和酶中是催化必需的,并且在烷烃羟化酶和二甲苯单加氧酶中是保守的。生物化学,1994,33(43):12787-12794。
Garcia-Maroto F等:烟草中与Delta(6)-酰基去饱和酶密切相关的Delta(8)-鞘脂去饱和酶的克隆和分子特征。植物生理学报,2004,24(3):371 - 371。
杨志明,杨文德,杨文明:两种拟南芥种子贮存脂质合成严重受损突变体的代谢通量表型分析。植物生理学报,2009,29(4):369 - 369。
Folch J, Lees M, Sloane Stanley GH:一种从动物组织中分离和纯化总脂质的简单方法。中国生物医学工程学报,2004,25(3):397 - 397。
Klopfenstein W:用三卤硼-甲醇试剂甲基化不饱和酸。中华医学杂志,1997,12(6):773-776。
脂质分析:脂质的分离、分离、鉴定和结构分析第3版。布里奇沃特,英国:油压机;2003.
Andersson BA, Holman RT:用质谱法测定单不饱和脂肪酸中双键位置的吡啶烷醚。油脂学报,1994,9(3):185-190。
Schutze K, Harter K, Chaban C:双分子荧光互补(BiFC)用于研究活植物细胞中蛋白质-蛋白质相互作用。方法分子生物学杂志2009,479:189-202。
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:β -葡糖苷酸酶作为一种敏感和多功能的高等植物基因融合标记。中国科学(d辑:自然科学版)。
汤姆斯病毒p19蛋白介导的RNA沉默抑制的分子机制。中华医学杂志,2004,23(4):876-884。
陈明,Markham JE, Cahoon EB:拟南芥鞘脂δ 8不饱和对糖基神经酰胺生物合成和低温性能的影响。植物生态学报,2012,29(5):769-781。
Wood CC等:一种基于树叶的检测方法,使用可互换设计原则快速组装多步重组途径。植物生态学报,2009,7(9):914-924。
Larkin MA等人:Clustal W和Clustal X 2.0版本。生物信息学,2007,23(21):2947-2948。
报春花脂肪酸δ(6)-去饱和酶的n-3偏好底物的鉴定。中国科学(d辑:自然科学版)。
宋丽丽,等:黑肋菌delta6 -去饱和酶基因的鉴定与功能分析。中国机械工程学报,2010,61(6):1827-1838。
高等植物中Delta(8)-鞘脂去饱和酶的进一步表征。生物化学学报,2000,28(6):638-641。
Clemente TE, Cahoon EB:大豆油:功能和总含量修饰的遗传方法。植物生理学报,2009,29(3):369 - 369。
Kuznetsov DI, Grishina NL:一些富油向日葵和芝麻种子的脂肪酸组成。中华医学杂志,1988,27(1):72-78。
林世力,Oliver DJ:三酰甘油在叶子中的作用。植物生态学报,2008,29(3):378 - 378。
Winichayakul S等:三酰甘油的体内包装提高了拟南芥叶片的生物量和能量密度。植物生理学报,2013,32(2):369 - 369。
种子油生产的生理和发育调控。脂质学报,2010,49(3):235-249。
王晓燕,王晓燕,王晓燕,等。甘蓝型油菜18 - 1酰基载体蛋白对可塑性乙酰辅酶a羧化酶的反馈调控。中国生物医学工程学报,2012,29(5):557 - 557。
Gunstone FD:伽马亚麻酸的发生和物理化学性质。脂质学报,1992,31(2):145-161。
Libisch B等:delta6脂肪酸和delta8鞘脂去饱和酶嵌合体。生物化学与工程学报,2000,29(3):369 - 369。
Heilmann I等:通过交替亚细胞靶标切换去饱和酶特异性。中国生物工程学报,2004,29(4):366 - 366。
Mayer KM, McCorkle SR, Shanklin J:使用保守性质差异定位器将酶序列与功能连接起来,以识别和注释可能控制特定功能的位置。中国生物医学工程学报,2005,26(6):381。
确认
这项工作得到了美国能源部基础能源科学办公室(JS和JS)和DOE EERE对JS, JS, YY, EE, RM和HS的支持。我们感谢F. W. studer博士和xiaohong Yu博士对手稿的批判性阅读,以及Sean McCorkle博士的技术支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有经济或其他竞争利益。
作者的贡献
JS构思并提供了研究的初步设计。YY JC, HS和EE进行研究;EE和RM创建了浮萍属gibba转录序列和组装。所有作者都对数据分析和稿件准备做出了贡献。所有作者已阅读并认可最终稿。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原始作品的名称正确。创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
颜颖,Candreva, J, Shi H。et al。30种浮萍总脂肪酸和三酰甘油的组成和含量的调查及产γ-亚麻酸和硬脂硬脂酸的海鞘Δ6-desaturase的克隆。BMC植物杂志13,201(2013)。https://doi.org/10.1186/1471-2229-13-201
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-201
关键字
- Desaturase
- 脂肪酸
- 三酰甘油
- Lemnoideae
- 浮萍
- 浮萍属
- Wolffiela
- 可再生原料
- 生物燃料