抽象的
背景
最近,菲律宾好氧稻田产量的逐渐下降与三个密切相关的因素有关腐霉属SPP。,P. Arrhenomanes,P. Graminicola.和P. Unitatum..为了了解它们对水稻幼苗的不同毒力,我们进行了比较调查P. Arrhenomanes,P. Graminicola.和P. Unitatum.通过组织病理学分析、表型、DNA定量和基因表达研究,研究寄主定殖、寄主反应和碳利用概况。
结果
最致命物种的隔离物,P. Arrhenomanes,迅速在水稻幼苗外部和内部根系组织(包括木质部)定植,可能阻断水分运输,引起严重的发育不良、萎蔫和幼苗死亡。较低的毒性测试P. Graminicola.和P. Unitatum.分离似乎反映在较慢的定植过程,有限的入侵血管中柱和较少的系统扩散,其中细胞壁强化似乎发挥作用。随着菌丝的入侵,活性氧(ROS)和酚类化合物的生成逐渐增加,其中活性氧和酚类化合物的生成最为强烈P. Arrhenomanes在接种时被延迟或弱得多P. Unitatum.隔离。坏死标记OsJamyb似乎由毒性最强的菌株诱导的更快更强。尽管孤立P. Unitatum.是营养上最广泛,毒性最强的吗腐霉属该菌株对d -氨基酸、l-苏氨酸和羟- l-脯氨酸等氨基酸的广泛利用表明其对寄主的生理适应性较强。后两种化合物在植物防御和它们的使用P. Arrhenomanes因此可能是其毒性策略的一部分。
结论
本研究表明,水稻的不同毒力是致病的P. arrhenomanes, P. graminicola和P. Unitatum.分离株与根系定殖能力、诱导的根系反应强度和利用定殖生态位氨基酸的能力有关。因此,本文对卵菌对水稻根系侵染的研究有重要的认识,有助于进一步解开土传病原菌的毒力策略。
背景
腐霉属物种是无处不在的土传卵菌,在许多植物物种上从机会主义到高毒性病原体排列。它们主要侵染植物幼体组织,造成出苗前后的衰减或降低存活幼苗的活力和生长。此外,它们还感染成熟植物的根,导致严重的坏死和发育不良[1].几种重要的禾秆作物,包括玉米、小麦、水稻、甘蔗、大麦、高粱和草坪草都已被提到受到影响腐霉属攻击[2].最近,P. Arrhenomanes,P. Graminicola.和P. Unitatum.与菲律宾有氧稻田的逐步产量下降有关[3.].这些密切相关腐霉属spp。表现出有氧水稻幼苗的不同程度的毒力,其中P. Arrhenomanes其中毒性最大的一种是否会在水稻出苗前后产生强烈的抑制作用,使秧苗发育不良P. Graminicola.毒性较小,而且P. Unitatum.是不管的体内.
很少有组织病理学研究监测了感染过程腐霉属单子叶植物的根。我们最近调查了P. Graminicola.水稻幼苗根[4]并揭示了这种病原体通过渗透菌丝迅速侵入了水稻rhizodermis,之后它在内部组织中产生了致密的细胞内网络,最终引发坏死。modjehi等。(1991)[5]研究了小麦根的感染P. Arrhenomanes在这项研究中,Oomycete似乎通过抗缩醛结构穿透小麦根。该病原体还细胞内侵入了根皮层,并且在较小程度上侵入了斯特勒,最终导致严重的皮质细胞塌陷和小麦根的强烈褐变。此外,之间的相互作用P. Arrhenomanes玉米已经分析了[6,并证明了这一点P. Arrhenomanes在玉米根定殖过程中产生了两种不同类型的菌丝。据我们所知,研究水稻根与P. Arrhenomanes或P. Unitatum.目前缺乏。此外,具有高度弱毒性的比较组织病理学分析腐霉属spp。从未被执行过的单极管根部。
因此,我们探讨了一个隔离的稻米殖民化过程P. Arrhenomanes,P. Graminicola.和P. Unitatum.从菲律宾患病的好氧稻田中获取的在体外侵染试验可以准确地评价水稻根和茎的发育腐霉属利用接种、组织学和分子技术来阐明这三种病毒感染过程的定性和定量差异腐霉属孤立.使用类似的技术,水稻的根对腐霉属随着时间的推移进行了调查。此外,还进行了表型研究,以揭示三种卵菌的营养需求,并确定与更高毒力相关的碳利用模式。我们的研究发现水稻侵染的根系定植能力和营养状况存在明显差异P. arrhenomanes, P. graminicola和P. Unitatum.隔离。
结果
米幼苗的宏观症状腐霉属感染
米幼苗(CV.Nipponbare)在Gamborg B5(GB5)琼脂平板上培养,以研究效果P. ArrhenomanesPt 60,P. Graminicola.PB912 132和P. Unitatum.pt52对根、茎发育的影响。宏观的评价腐霉属- 植物米幼苗通过了米组织的强烈定植P. Arrhenomanes孤立(图1).在接种后2天(DPI)后,水稻种子和根表面均覆盖着空中菌丝体。当感染进入时,菌丝体主要集中在水稻种子附近。同样,致密的白色菌丝体出现在种子上P. Unitatum.p52接种培养物2 dpi。然而,在这种情况下,表面的殖民化不那么明显。菌丝的P. Graminicola.PB912 132在水稻种子附近的培养基上生长良好,但水稻幼苗表面没有大量定殖。当营养素从培养基中消除时,我们仍然观察到水稻种子附近受刺激的菌丝生长(数据未显示)。这种生长刺激可能是由于种子渗出所致。当腐霉属单独培养分离物在种子渗出物中,确实观察了增加的亚腿生长(附加档案1:图S1)。
评价这一点在体外10 dpi的培养揭示了水稻幼苗非常容易受到影响P. ArrhenomanesPt 60和P. Graminicola.PB912 132感染(图1, 桌子1).最具毒性的孤立P. ArrhenomanesPt 60抑制冠根和侧根形成。此外,与非接种控制相比,原发性根长度明显减少63%(P≤0.05)。在初生根的上部可见典型的棕色坏死。当对茎生进行监测时,明显的发育迟缓(相对于对照有61%)(P≤0.05)。此外,所有接种的水稻幼苗中的72%表现出透明的枯萎症状,可见为秆和/或叶子的变黄或褐变。高毒力水平P. ArrhenomanesPT 60也导致显着的幼苗死亡为28%(P≤0.05),即茎部病害严重程度评分为5分的植株比例。
与…相反P. Arrhenomanes隔离,P. Graminicola.PB912 132在水稻幼苗中从未受损冠根和侧根形成。尽管如此,所有根类型都经济高度发育气,并表现出整体透明的棕色变色。主要根长度明显较短(P ≤ 0.05), with lengths representing 52% of those of the non-inoculated control. Opposing the strong wilting symptoms onP. ArrhenomanesPt 60接种的米幼苗,射击显着更健康(P≤0.05),全部存活P. Graminicola.PB912 132接种。此外,芽增长减少了36%,这显着较低(P ≤ 0.05) than the stunting evoked by the most virulent isolate. The impact ofP. Unitatum.与其他菌株相比,pt52对水稻幼苗发育的影响较小(图)1, 桌子1).除了缩减冠根伸长率和初级,冠和侧根上的坏死斑,没有观察到明显的疾病症状。最大的根长度P. Unitatum.PT 52接种幼苗代表了对照治疗的99%。此外,射击急剧仅为7%,出现不显着(P < 0.05). Most shoots were categorized in the lowest disease score, exhibiting only few symptoms of wilting. Disease severity indices were still significantly distinct from the control treatment (P≤0.05)表示P. Unitatum.是弱毒性在体外.
组织学研究腐霉属水稻根系侵染过程
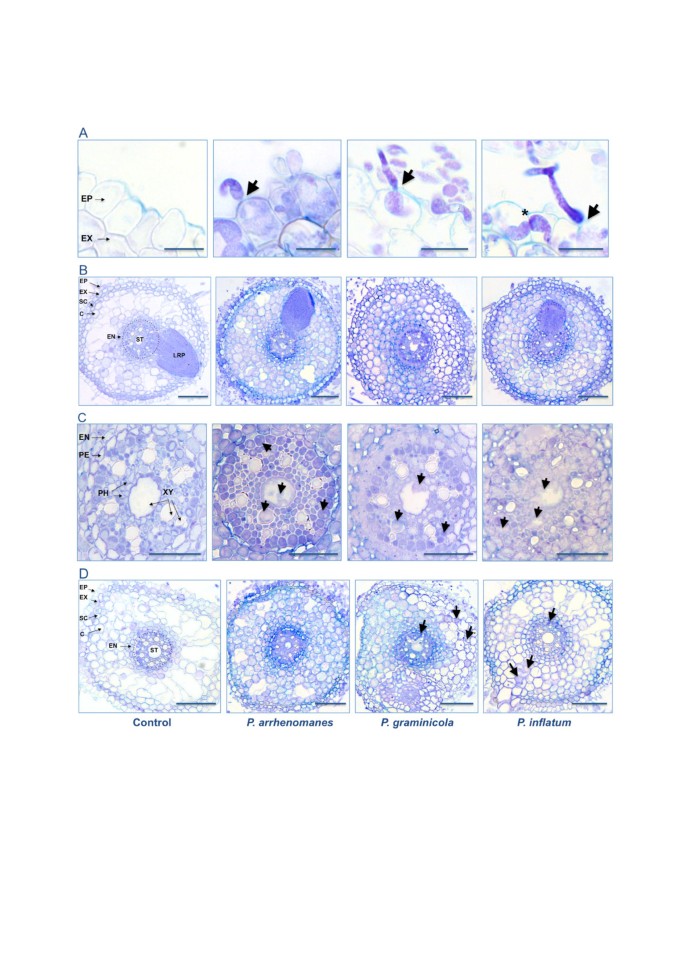
考察殖民的过程P. ArrhenomanesPt 60,P. Graminicola.PB912 132和P. Unitatum.在水稻根内,我们用明亮的视野显微镜观察台盼蓝染色的插根。这三个腐霉属分离株通过直接穿透表皮细胞侵入初生根(图2肿胀的菌丝而不是特化的附着体被用作穿透工具。后立即腐霉属侵入后,菌丝分化成不规则膨胀的结构,向细胞内的邻近细胞壁进发。就在细胞壁交叉之前,菌丝急剧收缩(图)2一种)。在进一步的蔓延期间可能采用了相同的策略腐霉属菌丝在皮质和血管组织中。
组织学研究腐霉属水稻根系侵染过程。一个,直接透过水稻根茎P. arrhenomanes, P. graminicola和P. Unitatum..箭头指示hyhal穿透部位。球茎状腐霉属菌丝在细胞壁通过(*)之前,细胞内成长并严重限制。B,水稻内部根组织的定殖P. arrhenomanes, P. graminicola和P. Unitatum.在27 hpi的主要根根部受感染的(上)部分。C,镶嵌的殖民化P. arrhenomanes, P. graminicola和P. Unitatum.在27 HPI的最严重感染的原发性部位。箭头表示韧皮植物和木糖中的菌丝。D,接种后2天的内部根组织的定植P. Arrhenomanes,P. Graminicola.和P. Unitatum.在主要根的中间部分。P. Graminicola.和P. Unitatum.菌丝在皮质和血管组织(箭头)中的浓度较小。对照图片中的缩写指定表皮(EP),epodermis(ex),硬化症(c),endodermis(en),腹侧(pe),stele(st),韧皮(pH),Xylem(xy)和侧根原始(LRP)。截面(5 μm)腐霉属- 用锥虫蓝染色的根组织。在B =100μm的尺度条中,在C =50μm,在d =100μm中。
但是,隔离的P. Arrhenomanes,P. Graminicola.和P. Unitatum.在内部组织的殖民地区的程度上不同。在最严重的主要根部(占1.5厘米)的最严重的部分中,三个腐霉属在27 hpi范围内,分离株在皮质、内皮层和中柱上强烈定植(图2对中柱更详细的观察揭示了当时存在于韧皮部和木质部中的大量菌丝(图)2C)。关于主要根部中间部分的组织学研究产生了类似的结果P. ArrhenomanesPT 60定植过程,同时P. Graminicola.PB912 132在皮层和维管组织中菌丝较少(图)2d)。此外,后一种病原体在大多数检查的横截面中没有侵入木质细胞。在P. Unitatum.接种PT 52的根样品中,菌丝密集网的出现频率较低P. ArrhenomanesPt 60和P. Graminicola.PB912 132接种的根样本。另外,根碑精的定植通常限于外部电池层。
量化的腐霉属DNA在水稻根
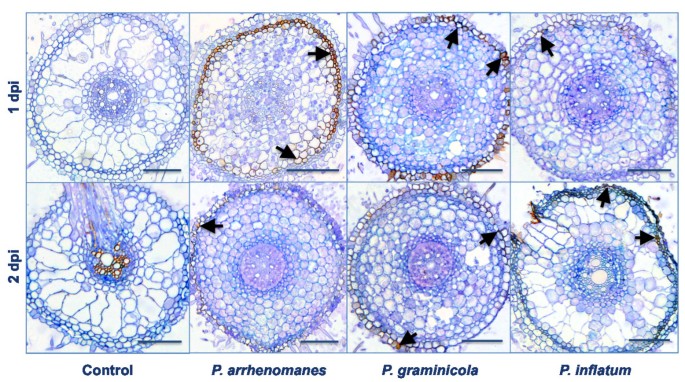
已经说明了定性和定量技术的组合允许更准确的时间过程监测植物根部的微生物感染过程[7].因此,采用基于dna的定量方法,进一步调查水稻幼苗根系定植情况P. ArrhenomanesPT 60, p . graminicolaPB912 132和P. Unitatum.Pt 52.非表面灭菌根样品上的定量实时PCR(QPCR)所示P. ArrhenomanesPt 60快速且大规模地殖民整个稻肉系统(表2A).在第一次实验中(Exp 1),测试对象的DNA数量P. Arrhenomanes分离物在1 dpi的总DNA提取物中的8.42%分别为高达49.2%和59%(2和3dpi)。数量P. Graminicola.PB912 132的DNA含量要低得多,并且随着时间的推移保持了大致相同的水平(即5-6%)。的浓度P. Unitatum.水稻幼苗根上和根内的pt52 DNA在1 dpi时增加到26.4%,在2 dpi时增加到15.8%。
第二个实验(Exp 2)产生了类似的增加趋势的定殖过程P. Arrhenomanes隔离。在P. Graminicola.PB912 132-和P. Unitatum.接种PT 52的根,在3 dpi下测定的DNA浓度一致(分别为5%和19.6%),但在第1天,与第1次试验相比,DNA浓度分别较高和较低。
表面灭菌的根样本上的QPCR使能量化腐霉属水稻根系内的DNA。再一次,集中P. Arrhenomanesp60dna明显随时间升高(见表)2B),在20 hpi时为0.13%,在28 hpi时为0.84%,在73 hpi时为4.77% (Exp 1)P. Graminicola.水稻幼苗根系内的PB912 132 DNA在20 HPI的幼苗根系中得多。尽管如此,通过73 HPI,DNA数量P. Arrhenomanes和P. Graminicola.隔离达到了相同的数量。的份额P. Unitatum.在感染过程的前20小时期间,Pt 52 DNA在总DNA提取物中非常低。从28 HPI开始,DNA量略微升高至约0.1%,但仍远低于其他物种的0.1%。尽管我们的第二实验中的感染水平较低,但我们可以观察三个类似的殖民化趋势腐霉属隔离。综上所述,这些数据表明P. Arrhenomanes分离物是稻根表面和内组织的更好且更快的殖民大学家而不是筛选的P. Graminicola.和P. Unitatum.隔离。此外,他们证明了弱毒物种的隔离P. Unitatum.主要寄生在水稻根表面,而分离株P. Graminicola.其表面传播效率较低。
米根回应腐霉属仕达屋优先计划
活性氧(ROS)
过氧化氢的积累(H.2O2)腐霉属用明场显微镜和使用3,3'-二氨基苯并(DAB)的内源性过氧化物酶依赖性染色程序可视化。使用3,3'-二氨基苯胺(DAB)。
当分析初级根部的最重侵染(上)部分时,我们检测到在外部电池层中的红褐色DAB沉淀(图3.黑色的箭头)。在1 dpi,h2O2生产出现最强P. Arrhenomanespt60接种幼苗根部,在厚壁组织和部分皮层细胞中积累。当dpi为2dpi时,DAB沉淀变得不明显。在P. Graminicola.接种PB912 132的幼苗,DAB集中于根的表皮和外皮层2O2生产也减少了2 DPI。相反,在前24小时期间,DAB沉淀物几乎没有明显。P. Unitatum.Pt 52米互动。2 dpi,h2O2表皮表皮,exodermis和幼苗硬化的生产略有增加,但随着这种分离物接种而似乎少量的稻食似乎减少。DAB积累未发生在控制根部,除血管组织和腓肠肌外。
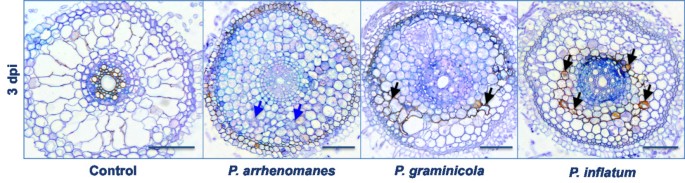
当检查原代根源的中间部分时,我们还观察到外层皮层中的DAB积累P. Unitatum.PT 52,P. Graminicola.Pb912 132接种在3 dpi的幼苗(图4黑色的箭头)。在这两种情况下,根皮层部分菌丝增殖受到阻碍,定植速度减慢。在P. Arrhenomanespt60接种的幼苗,皮层细胞似乎在感染的这个阶段崩溃(图4蓝色箭头)。
酚类化合物
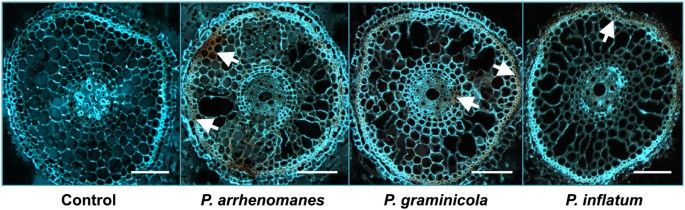
酚类化合物在腐霉属接种水稻幼苗的根被钙荧光白m2r染色的根茎紫外激发后显示为橘黄色的自荧光。
从2 dpi上看到自发荧光(图5,白色箭头)并且是最强的P. ArrhenomanesPt 60接种的米幼苗根,其中它从外根皮质和硬化的部分发射。在P. Graminicola.PB912 132接种根茎后,酚类化合物主要存在于厚壁组织中,维管组织很少发出荧光。同样,我们在厚壁组织中检测到自身荧光P. Unitatum.Pt 52接种的稻食,但再一次,宿主对这种隔离物响应最弱。在对照根中未检测到自发荧光。
坏死标志物和JA响应基因osjamyb的表达
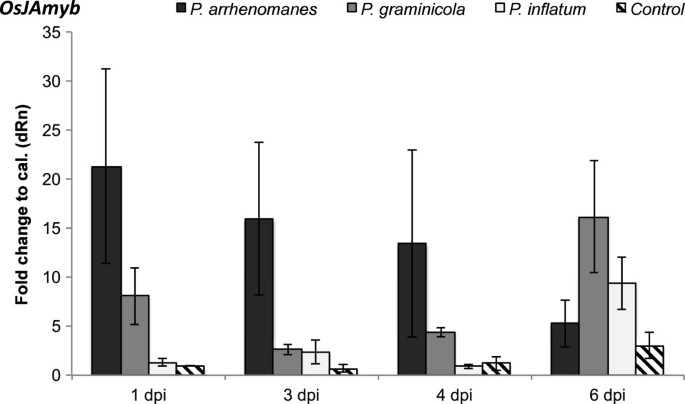
比较两组的诱导坏死程度P. ArrhenomanesPt 60-,P. Graminicola.PB912 132-和P. Unitatum.Pt 52接种根系,表达OsJAmyb采用qPCR分析。这种JA-和病原体诱导的MYB转录因子已被鉴定为坏死标志物,主要在细胞死亡前的植物组织中表达[8].我们的基因表达分析显示腐霉属分离诱导水稻幼苗根部的坏死(图6).P. Arrhenomanespt60在1、3和4 dpi分别诱导21.3倍、16倍和13.4倍时,表现出强烈的坏死触发OsJAmyb转录是测量。到6 dpi时,转录下降到5.3倍,接近对照的表达水平。在P. Graminicola.PB912 132接种根组织后,诱导率较低OsJAmyb在感染的第一天。通过6 dpi,坏死标记的表达强度高达16.2倍,似乎超过了水平P. ArrhenomanesPt 60接种根。在接种后的第一天勉强触发坏死P. Unitatum.隔离。只有在6 dpi,mRNA水平强烈升高(9.4倍)。
P. Arrhenomanes和P. Graminicola的分离株营养不良比P. Inflatum的多功能
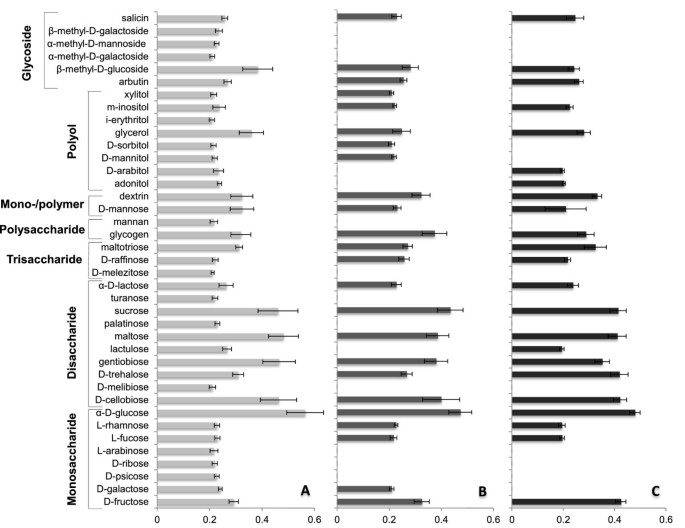
一个人的成长,每个人P. Arrhenomanes,P. Graminicola.和P. Unitatum.利用表型对不同碳源进行了评价。这项分析揭示了……的能力P. Unitatum.分离PT 52以使用广泛的碳水化合物,氨基酸,羧酸和衍生物(图7和8).
的P. Unitatum.分离用80%的所有单体,二,三糖,糖单体/聚合物,糖苷和补充到微孔板的多元醇,而这仅为49%和47%P. ArrhenomanesPt 60和P. Graminicola.分别为PB912 132(图7;额外的文件2:表S1,附加文件3.:表S2)。后者不代谢半乳糖和甘露糖苷,而所有的糖苷都能促进甘露糖的生长P. Unitatum.此外,仅使用56%和44%的测试多元醇P. ArrhenomanesPt 60和P. Graminicola.分别为PB912 132,而这是89%的情况P. Unitatum.Pt 52.看到测试的隔离物有趣P. Arrhenomanes和P. Graminicola.在甘油和m-intositol旁边的不同多元醇增长。与这一点相比P. Unitatum.分离物,它们在使用几种糖类中的使用时也效率较低,特别是单糖。然而,在预先填充二糖蔗糖,麦芽糖,龙胆糖和D-纤维糖的孔中测量整体最高吸光度值(OD <0.35),以及单糖α-D-葡萄糖。井中的浊度接种P. Unitatum.与其他物种相比,PT52对于这些化合物来说是最高的,这些化合物对碳水化合物的更好增长。此外,这P. Graminicola.和P. Arrhenomanes分离物在D-果糖(单糖)和D-海藻糖(二糖)和糖原(多糖)上增长了最佳。P. ArrhenomanesPt 60和P. Unitatum.PT 52分享了使用D-半乳糖的能力,而分离物P. Unitatum.和P. Graminicola,但不是P. Arrhenomanes,能够使用乳果糖。
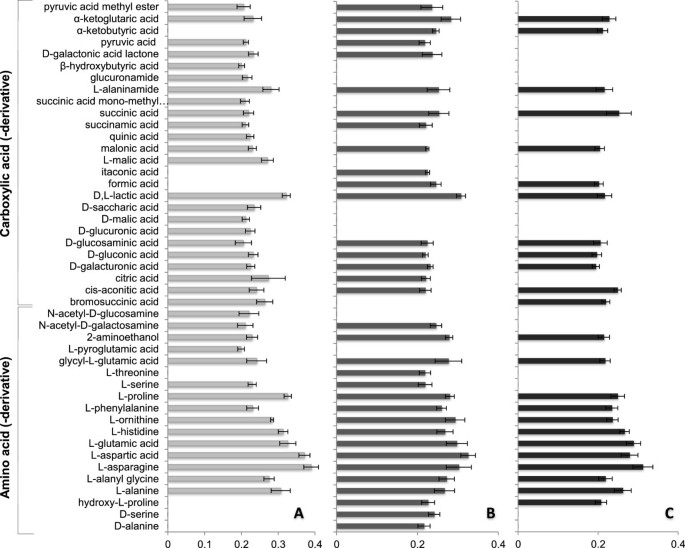
探索三者的增长腐霉属对氨基酸,羧酸及其衍生物的分离,很明显P. Unitatum.PT 52,P. Arrhenomanespt60可分别使用这些化合物的68%和61%,而pt60仅为43%P. Graminicola.PB912 132(图8;额外的文件2:表S1,附加文件3.:表S2)。筛选的孤立P. Unitatum.表现出最宽的羧酸曲线,并且是可以利用奎酸,D,L-苹果酸,D-糖酸,D-葡糖醛酸和β-羟基丁酸的唯一分离物。然而,它无法代谢两种特定的羧酸,即甲酸和α-酮丁酸,其可怕地显示刺激更毒性的分离物的生长。除了这些调查结果,P. ArrhenomanesPt 60在使用衣康酸的能力中出现独特,而没有羧酸或衍生物似乎是特异性的P. Graminicola.PB912 132(表3.).我们还发现了一些羧酸可以促进P. Arrhenomanes和P. Unitatum.孤立或者P. Graminicola.和P. Unitatum.孤立(表3.).
所有测试的氨基酸图谱腐霉属分离株包括L-丙氨酸,L-丙氨酸 - 甘氨酸,L-天冬酰胺,L-天冬氨酸,L-谷氨酸,L-组氨酸,L-鸟氨酸,L-苯丙氨酸和L-脯氨酸。然而,L-苏氨酸,D-丝氨酸和D-丙氨酸被专门用于P. ArrhenomanesPT60,因此,它在三个中表现出最广泛的氨基酸谱腐霉属隔离(图8).P. Unitatum.PT 52,P. Arrhenomanespt60均能利用l -丝氨酸P. Graminicola.PB912 132无法。有趣的是,羟基-1-脯氨酸的使用似乎对更毒性的特异性腐霉属l -亮氨酸(L-leucine)均无生长3.:表S2)。
这三个腐霉属菌株对某些其他碳源的反应也不同(附加文件2:表S1)。核苷胸苷,尿苷和杀虫素,引发了生长P. ArrhenomanesPT 60,P. Unitatum.pt52似乎是唯一能在腐胺上生长的菌株。
讨论
在这项研究中,一个隔离每个P. Arrhenomanes,P. Graminicola.和P. Unitatum.从患病的好氧稻田[3.选择了详细在体外分析它们的宿主感染过程和随后的疾病发展。在体外接受水稻幼苗根源显示P. Arrhenomanes结果表明,该菌株的毒副作用明显强于该菌株P. Graminicola.和P. Unitatum..该病原体抑制了冠和横向根部发育,诱导严重枯萎,引起了稻块芽的强烈振缩,而疾病症状P. Graminicola.孤立的孤立不那么明显P. Unitatum.孤立仅对水稻幼苗发展产生了微小的影响。
组织病理学研究表明这三个腐霉属该菌株利用渗透菌丝侵染水稻幼苗根系。一旦进入根部组织,腐霉属菌丝不规则膨胀,主要生长在细胞内。通过收缩的菌丝进行细胞壁的交叉,菌丝可能通过胞间连丝迁移,从而避免了可见的细胞壁损伤。一致的发现被提出腐霉属其他单子叶植物根系感染[5,6,9].但是,在这些情况下,专门的映异性结构代替简单的菌丝在这些情况下使无根状渗透[5].病原体侵入后,我们发现P. Arrhenomanes,P. Graminicola.和P. Unitatum.分离物通过悬垂的腋生大规模寄生稻米组织,导致在27hpi内完全填充皮质和内胚层细胞。相当,在感染时注意到密集的悬垂网络拟南芥小植物p . irregulare[10].
与它们不同的毒性同时,我们展示了三种腐霉属分离株在系统组织定植的程度上有所不同。的隔离P. Arrhenomanes快速殖民,整个主要根根,从主要感染部位有效地传播到其他部分。
此外,菌丝大量侵入木质部,可能阻碍了水分向茎部的输送,这在一定程度上解释了接种该菌株后水稻幼苗严重萎蔫和频繁死亡的原因。这种寄生特征在真正的血管病原体中很常见,比如Fusarium oxysporum和轮枝菌属其中,菌丝侵入植物根中柱之前,内皮层被覆盖[11].的情况下腐霉属然而,菌丝阻断木质部感染的报道并不多见。血管中柱的广泛侵犯仅被描述p . irregulare拟南芥[10],p . tracheiphilum生菜(12],P. sylvaticum.和p . dissotocum草莓(13),P. Ultimum.在黄瓜[14].在后一种情况下,木质部导管也被试图限制菌丝扩散的植物防御相关tyloses的产生所阻断。
系统性的传播P. Unitatum.在较小程度上,还有P. Graminicola.孤立,在水稻幼苗根系的皮质和石碑中,比P. Arrhenomanes隔离。尤其在木质部导管中,木质部导管的寄生率较低P. Graminicola.孤立,而生长P. Unitatum.分离株通常局限于少数韧皮部细胞,这可能是接种这些病原菌后较低程度的萎蔫和发育不良的原因。我们的qPCR分析证实P. Arrhenomanes菌株对水稻幼苗根系的定殖效果最好,其次是菌株P. Graminicola.和P. Unitatum.,后者几乎不在内部组织中蔓延。这样的阳性相关性腐霉属并不总是预期根殖民化能力和毒力。与我们的结果相比,Modjehi等人。(1991)[5]的研究表明,在小麦根中P. Arrhenomanes菌丝在内皮层受阻。在本研究中,中柱在原感染部位的距离上保持不受影响,直到细胞死亡。此外,殖民的过程P. Arrhenomanes在这种宿主中比在水稻根中进展得更慢。其他对比的发现被描述为腐霉属f组番茄根系相互作用。腐霉属组F是一种次要病原体,可能导致产量损失,而不会产生可见的根症状[15].在番茄根中,它能够在2-3 dpi内定植所有细胞类型,包括木质素。然而,已经发现大多数垃圾杂志出现为空鬼细胞。
生物防治剂和促进生长的物种也有类似的发现P. oligandrum在与番茄根的互动中[16].
不断的侵略腐霉属水稻幼苗根系菌丝产生活性氧(ROS)和酚类化合物,最终引起细胞死亡。ROS是短寿命分子,与植物细胞中的蛋白质、DNA、脂类和碳水化合物相互作用,从而引起组织损伤和细胞死亡[17].植物产生清道夫来抗氧化保护。然而,一些生物和非生物因素可能会破坏ROS和清除剂之间的平衡,从而引发氧化爆发[18].例如,病原体病原体可以在杀灭宿主组织期间触发ROS的细胞内产生。另一方面,ROS-生产也可能是植物防御反应的一部分对生物营养和Hemi-Biotophic病原体的一部分[17].在目前的研究中,生产过氧化氢(H.2O2)的外细胞层腐霉属- 为1 dpi的毒性物种更强烈地植物米;Oliver等人。(2009)[19还注意到ROS生产p . irregulare和P. debaryanum.但在这些情况下,ROS积累在腐霉属- 预设区域,它之前的细胞死亡。这三个腐霉属菌株以1 dpi侵入水稻幼苗根中柱,而DAB则集中在离感染前沿较远的位置2O2积累可能与过晚以防止感染的免疫反应有关。这些可能包括细胞壁修改事件,以来腐霉属SPP。和其他oomycetes一样,直接穿透他们的主持人[19]和过氧化氢参与细胞壁聚合物的过氧化物酶催化交联[20.].但是,它也可能是h2O2积累在腐霉属- 在营养耗尽时形成细胞死亡的稻源是指细胞死亡[21].也已经描述了这种尾随坏死p . irregulare-Arabidopsis互动[10].组织学分析P. Arrhenomanes- 植物稻培养揭示了3 dpi根皮层中的细胞塌陷,证实了坏死的发生。
细胞崩溃由P. Arrhenomanes小麦幼苗的感染以前被认为与毒素或酶的产生有关[5].毒素或大量的细胞壁降解酶可能不涉及腐霉属因为病原体的入侵与广泛的组织损伤并不相关,而且在此之前也没有细胞死亡。在根组织中接种P. Unitatum.和P. Graminicola.孤立,我们还检测到3 dpi的皮质相关的ROS生产,减慢了腐霉属殖民化过程,表明细胞壁强化发生,稻根与稻块之间的相互作用P. Unitatum.或P. Graminicola.可能比with更不相容P. Arrhenomanes.
在ROS之外,酚类化合物在植物的反应中满足了生物和非生物应激的重大作用[22].腐霉属有人提到过感染会引起酚类物质的积累[16,19],可以在设防事件期间掺入细胞壁中,或者可以在细胞死亡期间释放[19].在紫外线照射下,这些酚的积累在显微镜下可见为自身荧光[22]或宏观地作为根褐色[23].在本文中,我们检测到类似的根褐变腐霉属- 植物米培养。当研究内部根组织时,我们注意到初级根皮层中最强的自发荧光接种P. Arrhenomanes而自体荧光主要在接种时从厚壁组织发出P. Graminicola.在接种时在外部组织中分离出并且在外部组织中弱可见P. Unitatum.隔离。综上所述,这些结果表明水稻幼苗对高毒力的反应可能比弱毒力的反应更多和/或更快腐霉属物种。
升高的表达水平的坏死标记OsJAmyb在腐霉属-接种水稻根为诱导的坏死提供了分子支持,伴随H的连续积累2O2和酚类化合物。不同时期的转录水平分析表明,感染P. Arrhenomanes该分离物可能引起了更高程度的坏死,证实了水稻幼苗对这种病原体的较高易感性[8],而在接种时,坏死的诱导可能被延迟或减弱P. Unitatum.隔离。
这种茉莉酸(JA) - 响应基因的激活也意味着JA反应的作用腐霉属大米的互动。许多文献报道了茉莉酸酯(jasmonates, JAs)的防御诱导作用腐霉属双子叶植物的相互作用[10,19,24].然而,在水稻中,水杨酸(SA)和赤霉酸(GA)途径已被鉴定为根防御的调节因子腐霉属spp。4].后一项研究也揭示了P. Graminicola.在水稻幼苗根系中劫持芸苔类固醇(BR)机械,因此否定了GA-和SA依赖性免疫应答。这似乎与Ga-抑制细长水稻1(SLR1)的间接稳定相平行,即水稻Della蛋白。有趣的是,杨等人最近的一篇论文。(2012)[25]报道了水稻JA与GA的拮抗作用,并阐述了JA对della的稳定作用。基于这些发现,我们提出了一个可能的模型腐霉属侵染直接或间接激活水稻JA通路,使SLR1稳定,根系更加敏感。JA的类似负作用仅在Fusarium oxysporum-Arabidopsis相互作用,病原体劫持Coi介导的JA信号传导促进疾病发展[26].需要更多的研究来验证这一假设并揭示了JA的作用腐霉属大米pathosystem。
由于水稻侵染的毒力和根系定殖能力腐霉属spp。似乎是积极的,我们比较了营养概况P. Arrhenomanes,P. Graminicola.和P. Unitatum.分离物以阐明高毒性物质是否可以在生理学上更适合于其定植利基或可以使用特定的营养作为防御策略。看到高度毒性的营养型材很有意思P. Arrhenomanes和适度的毒性P. Graminicola.分离株与弱毒株相当相似,但明显不同P. Unitatum.隔离。碳利用模式提出P. Unitatum.是营养最丰富的物种植物病原性与非病原性的比较分析也得出了类似的结论假单胞菌物种,其中致病物种表现出降低的营养多功能性[27.].
特别是碳水化合物的利用情况P. Unitatum.分离的范围比P. Arrhenomanes和P. Graminicola.隔离。然而,三个腐霉属分离株在蔗糖、麦芽糖、龙胆二糖、d -纤维二糖和α- d -葡萄糖上生长良好,P. Arrhenomanes和P. Graminicola.分离菌株对贮藏糖原、d -海藻糖和d -果糖的增殖能力强。这些碳水化合物是前面提到的生长刺激物p . aphanidermatum[28.],p . myriotylum,p . dissotocum,P. Arrhenomanes[29.),P. oligandrum[30.],并与其他碳水化合物一起代表水稻无条土沉积的最大部分[31.].此外,P. Unitatum.和P. Arrhenomanes分离物能够在D-半乳糖上生长,米根大量渗出[32.].因此,我们特别假设P. Unitatum.和P. Arrhenomanes并在较小程度上P. Graminicola.可能在生理上适应利用水稻根际可能存在的碳水化合物。这也可以解释水稻组织表面更强的定殖P. Arrhenomanes和P. Unitatum.隔离在我们在体外分析。
测试了P. Unitatum.分离物也表现出最广泛的羧酸利用模式。已知苹果酸,柠檬酸和甲酸存在于水稻植物的Phloem Sap中[33.因为我们的数据说明了这一点P. Unitatum.,P. Arrhenomanes和/或P. Graminicola.分离株可以在这些碳源上生长,它们可以作为水稻根石柱内的营养来源。细胞内对这些营养物质的吸收可能是通过类似吸器的结构进行的p . irregulare拟南芥[10].
与…相反假单胞菌研究植物致病物种表明在其主要感染部位使用六种最丰富的氨基酸中的研究[27.,我们注意到其中毒性最强的腐霉属分离物表现出最广泛的氨基酸利用模式。全部腐霉属分离菌株能够在一组一致的9种氨基酸上生长,这些氨基酸已被证明具有吸引力腐霉属延长(34.,刺激游动孢子的包膜过程[34.和/或促进各种腐霉属spp。28.- - - - - -30.].
其中,尤其是组氨酸、脯氨酸和丙氨酸是水稻幼苗在播种后的第一个星期分泌的[32.,天冬酰胺和谷氨酸存在于水稻韧皮部[35.].因此,这些碳源可能在植物的外部和内部根定殖过程中被利用P. arrhenomanes, P. graminicola和/或P. Unitatum.孤立在我们的在体外实验。很有趣的是氨基酸的分布P. Arrhenomanes分离物还含有d -丝氨酸和d -丙氨酸。到目前为止,没有腐霉属已被证明在氨基酸的d -对映体上生长。因为水稻种子含有大量的d -丝氨酸[36.[水稻组织中存在D-丙氨酸肽[37.,这一特殊的特征可能有助于水稻种子和幼苗根的大规模殖民化P. Arrhenomanes隔离。
氨基酸的选择性利用并不总是营养偏好。它还可能代表一种毒力策略,通过该毒力策略通过哪种毒力策略试图降低与防御相关的化合物[38.].羟- l-脯氨酸和l-苏氨酸是富含羟脯氨酸的糖蛋白(也称为伸展蛋白)的组成部分,存在于单子叶细胞壁中[39.]并且在功能上涉及细胞壁延伸和过氧化物酶介导的细胞壁设防[39.].经筛选的P. Arrhenomanes和P. Graminicola.似乎仅在氨基酸和羟基-L-脯氨酸上生长,这可能表明P. Arrhenomanes具有较强的潜力,可以阻断稻米组织中的细胞壁强化。然而,我们的组织病理学研究没有证据证据抑制细胞墙壁设防事件腐霉属- - - - - -米幼苗感染,但它们的发生可能被延迟。除此之外,L-苏氨酸代表水稻验素SAP中的主要游离氨基酸[35.],并可能在植物与专性生物营养卵菌的相互作用中发挥抑制生长的作用[40].这可能有可能P. Arrhenomanes试图从宿主组织中去除l -苏氨酸以提高其适应度,但这一假设需要进一步研究。
在我们的苯甲醚中,我们还指出了这三个腐霉属分离物使用与防御相关的氨基酸L-脯氨酸[41.,42.].此外,P. Unitatum.孤立似乎在Putrescine,一种与压力相关的多胺上生长。由于最弱的毒性分离物可以在两种碳源上生长,因此它们从环境中的去除可能没有确定水稻病原的侵袭性水平腐霉属spp。
结论
程度腐霉属spp。可以在氨基酸上喂养,并侵入米皮质和胸骨细胞似乎与强度有关腐霉属导致水稻幼苗发育不良和萎蔫症状。我们的数据显示,它的毒性很强腐霉属可能是通过抑制细胞壁强化事件,从水稻组织中去除防御相关的化合物,并在水稻种子中含有大量的d -氨基酸上生长。血管中柱的快速侵袭可能对水稻侵毒的毒性水平至关重要腐霉属SPP。,因为稻胚层和血管组织在成熟期间变余/徘徊[43.].这可以解释为什么米幼苗获得一定程度腐霉属- 在种植后八天内的影响[44.].有趣的是,赤霉素已经被发现介导单子叶植物根的木质化[45.].由于Ga诱导腐霉属- 在水稻幼苗中,这可能会揭示为什么病原腐霉属试图通过诱导水稻幼苗根系的拮抗br途径来抑制GA途径[4].通过这种方式,它们可以平衡或延缓水稻幼苗根系的细胞壁强化作用,即对卵菌最重要的防御反应。
方法
腐霉属孤立
在这项研究中,我们选择了一个隔离P. Arrhenomanes,P. Graminicola.和P. Unitatum.研究与之间的相互作用腐霉属和大米(表4).这些菌株在不同的环境下表现出不同的毒力水平在体外条件(3.].分离菌株在22 ml马铃薯葡萄糖琼脂(PDA;Difco实验室),28°C的黑暗。
植物材料和感染试验
水稻品种Nipponbare(o.苜蓿亚种粳稻)被选中为在体外监测引起的疾病症状P. Arrhenomanes,P. Graminicola.和P. Unitatum.在水稻的根和芽上。种子也同样容易受到腐霉属作为有氧水稻CV。'apo',原始主机。在萌发之前,通过在70%EtOH(1分钟)和2%NoOCl(15分钟)中搅拌消毒种子。在无菌脱矿质水中的三次连续冲洗后,在无菌过滤纸上印迹,表面灭菌的种子在填充50ml Gamborg B5(GB5)中的平方培养皿(120×120mm)上铺板46.].将板在28℃下在黑暗中孵育三天。随后,选择具有相等初级根长度(1.5cm)的幼苗,将6个幼苗在新的GB5平板上移植2cm。从三天历史的边缘取出三种菌丝塞(直径5毫米)P. arrhenomanes, P. graminicola或P. Unitatum.菌落放置在幼苗根部1-2、3-4、5-6之间。方形培养皿部分被铝箔覆盖,以遮挡根部光线,然后在生长室中垂直放置(60°C角度),12小时(28°C) /夜(26°C)循环培养。每个处理设3个重复。
对于疾病评估,在接种后10天(DPI)(n = 18)测量最大根和芽长度。基于疾病严重程度的疾病评估稻芽的疾病症状(图9) (n = 3):得分0,健康芽;评分1分,茎长≥对照的50%,秆绿色,少量黄色或棕色斑点叶片;评分2,茎长≥对照的34%,秆微黄,叶呈黄色或棕色斑点;得分3,茎长小于对照的34%,秆微黄,叶片呈黄色或棕色斑点;得分4,茎长<对照34%,秆黄,叶黄或棕;评分5分,茎长<对照的34%,秆和叶呈褐色,干燥。这种规模使我们计算每个生物的疾病严重程度指数(DSI)复制(例如培养皿)使用以下方程:(((#×得分0)+(#×得分1)+得分(#×2)+(#×得分3)+(4 #×分数)+(# 5)×分数)/((总#)×得分5)))×100(#。苗)。大多数数据不是正态分布,在SPSS 21 (SPSS Inc.)中采用Kruskal-Wallis和Mann-Whitney非参数检验进行统计分析(α = 0.05,P≤α)。通常分布的数据通过单向ANOVA和DUNCHAN后HOC测试分析(α= 0.05,P≤α)。
根样本的显微镜分析
在不同时间分析了根部感染过程P. arrhenomanes, P. graminicola和P. Unitatum.接种使用明场和渗流荧光显微镜。在该实验中,GB5-培养板含有四个米幼苗,在每个新出现胚源的右侧置于0.5cm距离下的米幼苗。显示出呈浅表亚腿生长和坏死的主要根源的部分腐霉属接种水稻幼苗。根样本的±0.5 cm固定在含有4%多聚甲醛和1%戊二醛的50 mM磷酸钠缓冲液(pH 7.2)中,随后在乙toh分级系列中脱水,并用Technovit 7100溶液渗透。
根系样品经渗透后最终包埋在塑料中1cm2- 填充Technovit 7100 Histo-Embedding Medium(Heraeus Kulzer,Wehrheim,Germany)的立方体。使用Leica RM2265电动旋转线机(Leica Microsystems,Nussloch,德国)用于生产5μm横截面。对于在不同时间点的每种治疗中,至少两种不同幼苗的三到四个根样品完全切开。这导致每个样品中的50个切屑,在十个微观载玻片上随机化。为每个染色程序选择至少两个载玻片。腐霉属菌丝被孵化彩色部分的0.1% (w / v)台盼蓝10% (v / v)醋酸5分钟。酚类化合物的积累被染色可视化荧光增白剂28 0.1% (Calcofluor白色M2R) 1分钟。彩色部分都是彻底冲洗,干燥和中立的安装介质(DPX,安装Klinipath、比利时)。过氧化氢的积累(H.2O2),一种植物防御和诱导坏死的标记物,通过用3,3 ' -二氨基联苯胺(DAB)对新鲜根样品进行染色证实。每个处理在不同时间点从至少两株不同的幼苗中采集3到4个根样本。采样后,立即用0.1%的3,3 ' -二氨基联苯胺(DAB)溶液(pH 4.4)真空渗透,在黑暗中连续3步5分钟。在额外4分钟的孵育步骤后,去除残留的染色剂,按照上述方法固定、切片和安装样品。经dab染色的标本也用台盼蓝染色腐霉属菌丝。使用奥林巴斯ColorView III相机和氙气光源的奥林巴斯BX51显微镜获取数字图像。选择DAPI窄带荧光立方体(BP330-385 NM / DM400 / BA420)用于用荧光染色分析。用奥林巴斯分析单元^ F软件(Olympus Soft Magaging Solutions,Münster,德国)和ImageJ 1.44P处理图像。
定量检测腐霉属根样本中的spp
对多拷贝的内部转录间隔物(其)的引物 - 核糖瘤DNA(RDNA)的重组特异性P. ArrhenomanesPt 60,P. Graminicola.PB912 132和P. Unitatum.采用Primer-BLAST (NCBI)和OligoAnalyzer 2.1构建PT 52。web-software (IDT, Coralville, IA5).引物的物种特异性用三个纯DNA进行双重检查腐霉属水稻根DNA (cv.;Nipponbare)。通过热循环仪(Flexcycler, Analytikjena)上的梯度PCR评估最佳退火温度,并使用Sybr Green master mix (Fermentas)在Mx3005P实时PCR检测系统(Stratagene)上进行引物滴定。设定最佳反应条件后,实时PCR运行标准曲线(10 ng - 1 pg),以监测引物对的扩增效率和准确性。如果曲线显示为R2 ≥ 0.985, slopes between −3.1 à −3.6 and efficiencies between 90-110%, primers were accepted.
腐霉属在两种单独的实验中,在不同时间点收集在不同时间点的稻根(参见“植物材料和感染试验”)。在每个实验中,在每个时间点(n = 2)处理来自两个复制板的样品。将样品立即在液氮中冷冻或在1%NaOCl中冷冻表面灭菌1分钟并彻底洗涤。接下来,用DNEasy植物迷你试剂盒(QIAGEN)从细碎的根中提取DNA。用ND-1000分光光度计(NanoDrop)测定提取的DNA的质量和浓度。如果需要,施用乙醇沉淀以浓缩DNA样品。将提取的DNA(2.5μl1ng/μl)加入到96孔板中,填充有12.5μl等分试样的SYBR绿母混合物(FERMENS),其补充有2.5μl的每个引物储备溶液(表2)、0.05 μl ROX溶液和4.95 μl无核酸酶水。每个DNA样品用Mx3005P real-time PCR检测系统(Stratagene)进行重复分析,采用以下热profile:在95°C初始变性10 min,在95°C初始变性15 s,在63°C初始变性30 s,在72°C初始变性15 s, 40个循环。为了验证扩增子的特异性,我们使用了默认熔化曲线分析(Stratagene)。最后,将循环阈值(Ct)值(n = 4)应用到标准曲线的方程中,量化定量腐霉属采集的根样本中的DNA。
基因表达分析腐霉属- 割草稻根
在不同时间从GB5培养板收集稻根腐霉属接种(见“植物材料和感染试验”)。在每个试验中,每个处理在每个时间点汇集来自两个重复平板的根样本(n = 3)。样品在液氮中冷冻,粉碎,然后使用光谱植物总RNA试剂盒(Sigma-Aldrich)提取总RNA。立即进行Turbo Dnase处理(Ambion),用ND-1000分光光度计(NanoDrop)测定提取的RNA的质量和浓度。然后,利用Multiscribe逆转录酶和随机引物(Applied Biosystems)从总RNA (10 ng/μl)中合成互补DNA (cDNA)。将该cDNA (2.5 μl, 10 ng/μl)添加到96孔板中,填充12.5 μl Sybr Green主混合(Fermentas),每个引物原液添加2.5 μl(见表)3.)、0.05 μl ROX溶液和4.95 μl无核酸酶水。在下列条件下用MX3005P实时PCR检测系统(Stratagene)重复分析每个样品:在95℃下初始变性步骤10分钟,40个循环为95°C,30秒,59°C和15 s在72°C。在PCR之后,产生默认的熔化曲线(Stratagene)以测试扩增子特异性。每个样品中的植物RNA的数量归一化osactin1.(LOC_Os03g50890)作为内部引用6).CT值相对表达于1dPI的非接种对照,并计算三个实验(n = 3)的平均折叠变化。
Phenoarrays
纯的碳利用模式P. arrhenomanes, P. graminicola和P. Unitatum.文化研究在体外使用SF-N2和SF-P2微板(Biolog Inc.),基于Chun et al.(2003)的协议[30.].在这些微板中,每个孔都含有特定碳源的营养基,包括几种碳水化合物、氨基酸和羧酸。腐霉属在28℃的黑暗中,在50ml马铃薯葡萄糖肉汤(PDB; Difco实验室)中培养菌株。11天后,用无菌筛布(1mm网)过滤液体培养物,并将保留的菌丝垫用无菌脱矿质水洗涤。随后将收获的菌丝体混合在无菌的1mM磷酸钾缓冲液(pH = 7)中,再次筛分(1mm网格)。使用Multican EX分光光度计(Thermo Labsystems),在595nm中以三份测定悬浮液的光学密度。接下来,通过在无菌磷酸盐缓冲液中稀释,将OD调节至0.100±0.006,并填充了三个SF-N2和三个SF-P2微孔板,每种菌丝悬浮液的100μl等分试样。将控制板填充有100μl的无菌磷酸盐缓冲液。在28℃的孵育步骤中,在黑暗的碳源利用模式中P. ArrhenomanesPt 60,P. Graminicola.PB912 132和P. Unitatum.Pt 52通过595nm的浊度测量评估。实验由三块复制板组成,并及时重复以验证重现性。这为每种处理产生至少六个OD值(n≥6)。在SPSS 21(SPSS Inc.)中使用Kruskal-Wallis进行统计分析数据(α= 0.05,P≤α)。当浊度显着超过初始OD(= 0.1)时,腐霉属spp。被认为使用根据碳源进行增长。
参考
- 1.
Martin Fn,Loper Je:土壤传播植物疾病腐霉属SPP:生态,流行病学和生物控制前景。CRIT Rev Plant Sci。1999,18:111-181。10.1016 / s0735-2689(99)00389-5。
- 2.
van der Plaats-Niterink AJ:属的专论腐霉属.在真菌学研究。荷兰巴恩:中央统计局;1981年,200 - 239。
- 3.
Van buten E, Banaay CGB, Vera Cruz C, Höfte腐霉属在菲律宾的好氧水稻种植中与产量下降有关的物种。植物病理学杂志。2013,62:139-153。10.1111 / j.1365-3059.2012.02607.x。
- 4。
De Vleesschauwer D,Van Buyten E,Satoh K,Bandion J,Mauleon R,Choi IR,Vera-Cruz C,Kikuchi S,HöfteM:芸苔类药物拮抗吉布林素和水杨酸水杨酸介导的根免疫。植物理性。2012,158:1833-1846。10.1104 / pp.112.193672。
- 5。
Mojdehi H,Singleton LL,Richardson Pe:小麦幼苗根系的组织病理学感染Pythium Arrhenomanes.J植物疗法。1991,132:75-83。10.1111 / J.1439-0434.1991.TB00095.x。
- 6。
Napi-Acedo G,Exconde或:玉米根的渗透和感染Pythium Arrhenomanes.中国农业科学(英文版)。
- 7。
Macia-Vicente JG,Jansson H,Lopez-Llorca LV:评估植物改进的真菌根系定子。植物信号行业。2009,4:445-457。10.4161 / PSB.4.5.8393。
- 8。
Lee MW,齐米,杨Y:一种新型茉莉酸 - 诱导水稻MYB基因与真菌感染和宿主细胞死亡。Mol植物微生物相互作用。2001,14:527-535。10.1094 / mpmi.2001.14.4.527。
- 9。
McKeen WE:增长腐霉属graminicola在大麦根。植物学报1977,55:44-47。10.1139 / b77 - 010。
- 10.
ABA是影响拟南芥ja -生物合成和防御激活的病原菌的一个重要信号。acta botanica sinica(云南植物研究),2007,19(4):457 - 461。10.1105 / tpc.106.048041。
- 11.
Okubara Pa,Paulitz TC:对真菌病原体的根防御反应:分子视角。植物土壤。2005,274:215-226。10.1007 / s11104-004-7328-9。
- 12.
马塔病:一种由一新种引起的莴苣病害腐霉属.植物病理学杂志。1965,4:48-53。
- 13。
nemec s:组织病理学腐霉属被感染的草莓根。acta botanica sinica(云南植物学报),2012,30(5):591 - 596。10.1139 / b72 - 135。
- 14。
ChérifM,Benhamou N,Bélangerrr:Chycumber植物中真菌发育和宿主反应的超微结构和细胞化学研究腐霉属最后.Physiol Mol Plant P. 1991,39:353-375。10.1016 / 0885-5765(91)90017-c。
- 15.
王志强,王志强,王志强,等。无症状感染的超微结构和细胞化学研究腐霉属植物病理学杂志,1998,19(4):534 - 542。10.1094 / PHYTO.1998.88.3.234。
- 16。
王志强,王志强,王志强,等:生物防治对番茄根系定植的影响。腐霉属oligandrum.植物营养与肥料学报。2005,43(1):1-11。10.1016 / j.plaphy.2004.10.005。
- 17。
Heller J,Tudzynski P:植物疗法真菌的无功氧气物种:信号,发展和疾病。Annu Rev phytopathol。2011,49:369-390。10.1146 / annurev-phyto-072910-095355。
- 18。
活性氧:代谢、氧化应激和信号转导。植物生态学报,2004,33(5):591 - 598。10.1146 / annurev.arplant.55.031903.141701。
- 19。
Oliver JP,Castro A,Gaggero C,Cascon T,Schmelz Ea,Castresana C,Ponce deLéoni:腐霉属感染激活苔藓植物保守的防御反应。植物学报。2009,32(4):569-579。10.1007 / s00425 - 009 - 0969 - 4。
- 20。
细胞壁结构蛋白的氧化交联在植物抗病中的作用。acta botanica sinica(云南植物研究),1994,6:1703-1712。
- 21。
Able AJ:活性氧在大麦对坏死营养病原体反应中的作用。acta physica sinica, 2003,22(4): 427 - 434。10.1007 / s00709 - 002 - 0064 - 1。
- 22.
Hutzler P, Fischbach R, Heller W, Jungblut TP, Reuber S, Schmitz R, Veit M, Weissenböck G, Schnitzler J:共聚焦激光扫描显微镜对植物酚类化合物的组织定位。中国生物医学工程学报,1998,19(4):553 - 565。
- 23.
Owen-Going TN, Beninger CW, Sutton JC, Hall JC:酚类化合物在植物和营养液中的积累Pythium aphanidermatum..植物病理学杂志。2008,30:214-225。10.1080 / 07060661.2008.10540537。
- 24.
Staswick PE, Yuen GY, Lehman CC:拟南芥茉莉酸信号突变体对土壤真菌敏感茄子urgulare..工厂J. 1998,15:747-754。10.1046 / J.1365-313x.1998.00265.x。
- 25.
杨东,姚建平,梅超,童星,曾玲,李强,肖玲,孙涛,李军,邓旭,李春明,杨勇,何志,何淑英:植物茉莉酸盐通过干扰赤霉素信号级联调控防御。美国国家科学院学报。2012年,doi: 10.1073 / pnas.1201616109
- 26.
Thatcher LF, Manners JM, Kazan K:Fusarium oxysporum利用coi1介导的茉莉酸信号促进拟南芥疾病的发展。植物学报,2009,58:927-939。10.1111 / j.1365 - 313 x.2009.03831.x。
- 27.
Rico A,Preston Gm:假单胞菌含油pv。番茄DC3000利用组成质和质外体诱导的营养同化途径分解番茄质外体中丰富的营养物质。植物营养与肥料学报,2008,21(4):429 - 434。10.1094 / mpmi - 21 - 2 - 0269。
- 28.
哈利勒,阿萨尼乌斯BW:碳源的利用腐霉属、疫霉属、镰刀菌素通过Biolog微孔板测定。微生物学报,2009,3:9-14。10.2174 / 1874285800903010009。
- 29.
陈永强,施耐德,钟一:碳源利用的测定芽孢杆菌和腐霉属通过Biolog Microplate测定物种。微生物学杂志。2003,41:252-258。
- 30。
McQuilken MP,Whipps JM,Cooke RC:影响生物量和卵球体生产生物控制剂的营养和环境因素腐霉属oligandrum.生物工程学报,1992,14:106-111。10.1016 / 0141 - 0229 (92) 90166 - l。
- 31。
Suzuki K,Okazaki K,Tawaraya K,Osaki M,Shinano T:气相色谱 - 质谱相关的全球分析在无障碍条件下渗出水稻根部。土壤SCI植物NUTR。2009年,55:505-513。10.1111 / J.1747-0765.2009.00390.x。
- 32.
Bacilio-jiménezm,aguilar-flores s,Ventura-zapata e,Pérez-campos E,Bouquelet s,Zenteno E:从米中渗出的根部化学表征(奥雅萨苜蓿)及其对内生细菌的趋化响应的影响。植物土壤。2003,249:271-277。10.1023 /答:1022888900465。
- 33.
水稻韧皮部中的硝酸盐和其他阴离子。植物营养与肥料学报。
- 34.
DONALDSON SP,DEACON JW:氨基酸和糖对Zoospore Taxis的影响,封入和囊肿萌发Pythium aphanidermatum.(Edson) Fitzp。,P. Catenulatum.马修斯和p . dissotocumDrechs。新植绿醇,1993,132:289-295。
- 35.
陈志强,陈志强。水稻韧皮部汁液中氨基酸和氨基酸的含量。植物营养与肥料学报。2002,23(4):427 - 434。
- 36.
Gogami Y,ITO K,Kamitani Y,Matsushima Y,Oikawa T:D型丝氨酸的发生和水稻丝氨酸的表征。植物化学。2009,70:380-387。10.1016 / J.Phytochem.2009.01.003。
- 37。
MANABE H:在野生稻植物中含有D-丙氨酸的二肽的形成。植物化学。1992,31:527-529。10.1016 / 0031-9422(92)90031-k。
- 38。
陈志强,陈志强,陈志强,等。谷氨酸代谢在植物抗病中的作用。植物营养与肥料学报,2013,26(4):489 - 494。10.1094 / mpmi - 07 - 12 - 0176 - cr。
- 39。
一个水稻富苏氨酸和羟脯氨酸糖蛋白的表位在细胞壁和疏水质膜糖蛋白中很常见。植物学报。1995,196:510-522。
- 40。
Stuttmann J,Hubberten HM,Rietz S,Kaur J,Muskett P,Guerois R,Bednarek P,Hoefgen R,Hoefgen R,Parker JE:拟南芥氨基酸代谢导致与适应的病原体不相容Hyaloperonospora拟南芥.acta botanica sinica, 2011, 32(5): 593 - 598。10.1105 / tpc.111.087684。
- 41。
胁迫诱导植物脯氨酸积累的代谢意义。植物生长学报,1997,21:79-102。10.1023 /: 1005703923347。
- 42。
Cassab GI:植物细胞壁蛋白。植物营养与肥料学报,1998,19(4):491 - 498。10.1146 / annurev.arplant.49.1.281。
- 43。
Clark LH,哈里斯WH:观察水稻根系解剖学(奥雅萨苜蓿L.)。我是J机器人。1981,68:154-161。10.2307 / 2442846。
- 44。
作者简介:陈志伟,男,博士腐霉属水稻幼苗种类及株龄和水深对病害发展的影响。植物病理学杂志。1998,88:1255-1261。10.1094 / PHYTO.1998.88.12.1255。
- 45。
陈志强,王志强,王志强,等。外源赤霉素对烟草光合作用的影响[j]。植物营养与肥料学报。2004,29(4):429 - 434。10.1104 / pp.103.036988。
- 46.
Gamborg ol,Miller Ra,Ojima K:大豆根细胞悬浮培养物的营养要求。Exp Cell Res。1968年,50:151-158。10.1016 / 0014-4827(68)90403-5。
确认
本研究支持的专业化奖学金来自佛兰德研究所科技创新促进在佛兰德斯(IWT-Vlaanderen),由根特大学的特殊研究基金会(双边格兰特和果阿01 gb3013)和研究基金会弗兰德斯(G.0833.12 FWO-Vlaanderen项目)。作者感谢黄建瑞博士在校对方面的帮助。
作者信息
隶属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
vbe进行了实验,解释了数据,起草并编辑了稿件。HM协调数据和起草的解释,批判性地修订了手稿并获得了最终批准的出版物。这位作者都读到并批准了最终手稿。
电子补充材料
12870_2013_1408_moesm1_esm.pdf.
附加文件1:图S1:水稻种子渗出的刺激效果腐霉属增长。水稻种子(2.5克)cv。CO-39 (o.苜蓿亚种indic),也同样容易受到影响腐霉属cvs。Apo和Nipponbare表面消毒,洗涤并在28°C下20ml无菌脱盐水中孵育。种子渗出液在自吸24小时后收集成水溶液。将三毫升等量的水(−)或渗出液(+)加入到三个六孔复制板中,然后用一个4天前的PDA插头接种P. arrhenomanes, P. graminicola或P. Unitatum.文化。将板在28℃温育并在17小时后筛选。当菌落直径和/或密度的清晰刺激是可见的腐霉属spp。在种子渗出物中生长。图片是三个复制板的代表性。(PDF 5 MB)
12870 _2013_1408_moesm2_esm.doc
附加文件2:表S1:刺激的碳源腐霉属在表型中生长。根据SPSS 21中的Kruskal-Wallis非参数检验,数据代表了24 hpi时OD值与初始OD值(= 0.1)显著差异的碳源(α = 0.05,P≤α)。括号之间的值表示标准错误。(Doc 166 KB)
12870 _2013_1408_moesm3_esm.doc
附加文件3:表S2:不刺激生长的碳源腐霉属phenoarray。spss21的Kruskal-Wallis非参数检验结果显示,24 hpi时,所列碳源的OD值与初始OD值(= 0.1)无显著差异(α = 0.05,P≤α)。(医生33 KB)
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
范·比腾,E., Höfte, M。腐霉属来自水稻根的物种在毒性、寄主定植和营养状况上有所不同。BMC植物BIOL.13,203(2013)。https://doi.org/10.1186/1471-2229-13-203
收到了:
接受:
发表:
关键字
- 腐霉属
- 栽培稻L
- Root-oomycete交互
- 组织病理学
- 茉莉酸(JA)
- 苯array.
- 氨基酸