摘要
背景
必需的含硫氨基酸蛋氨酸在植物代谢和人体营养中起着至关重要的作用。在本研究中,我们旨在阐明在蛋氨酸生物合成途径中的第一个承诺酶-半胱硫氨酸γ-合成酶(CGS)对烟草种子蛋氨酸积累的调节作用。我们还研究了这种操作对种子代谢的影响。
结果
在豆科蛋白B4种子特异性启动子调控下,拟南芥两种CGS (AtCGS)表达均为反馈敏感型F -AtCGS (LF种子)和反馈不敏感T-AtCGS (LT种子)。出乎意料的是,在两组转基因种子中,蛋氨酸的可溶性含量显著降低。氨基酸分析和饲养试验表明,虽然蛋氨酸水平降低,但其合成通量增加。结果表明,蛋白质结合的蛋氨酸水平在LT种子中显著提高了60%,而在蛋氨酸含量受到严格调控的LF种子中没有观察到这种情况。这种增加伴随着其他蛋白质结合氨基酸含量的增加,导致种子中蛋白质含量达到27%,尽管这在统计上不显著。此外,还原糖(代表淀粉)的水平略有但显著降低,而油的水平则不显著降低。为了评估种子中T-AtCGS的高表达水平对其他初级代谢物的影响,使用GC-MS进行了代谢分析。这表明,与野生型种子相比,LT中8种标记代谢物(主要是糖及其氧化衍生物)显著增加,而其他12种代谢物水平显著降低,从而显著改变了种子的初级代谢。
结论
T-AtCGS的表达导致总Met水平升高,总氨基酸含量升高,20种注释代谢物水平发生显著变化。高水平的氧化代谢物,两种与应激相关的氨基酸,脯氨酸和丝氨酸,以及低水平的谷胱甘肽表明,在LT种子发育过程中发生了氧化应激。本研究提供了种子中CGS活性增加的代谢后果及其如何影响种子营养品质的信息。
背景
作为必需的含硫氨基酸,蛋氨酸(Met)的含量限制了作物的营养品质。Met也是植物的基本代谢物,因为除了作为蛋白质成分和在mRNA翻译起始中起核心作用外,它也是通过其第一代谢物合成必需代谢物的前体。年代腺苷基Met (SAM)。由于蛋氨酸在营养和代谢方面的重要性,人们进行了研究,以评估调节其在营养组织中的合成和积累的因素(由[1- - - - - -3.])。然而,只有有限的研究揭示了其在种子中的合成和积累的调节因素(由[4,5])。
生化和遗传证据表明Met是合成的新创在种子中通过天冬氨酸家族途径(图21),因为它发生在树叶中。胱氨酸γ-合成酶(cystathionine γ-synthase, CGS)是Met生物合成途径的第一个承诺酶,它通过结合碳-氨基骨架(来自天冬氨酸)和硫基(来自半胱氨酸)来调节该途径[3.,6)(图1).然而,在拟南芥和小麦等几种植物中进行的其他研究表明,在营养组织中合成的Met被转化为年代-甲基Met (SMM),然后从这些组织运送到发育中的种子。在种子中,SMM通过同型半胱氨酸的活性转化回Met年代-甲基转移酶[7,8)(图1).
虽然关于SMM和天冬氨酸途径在种子Met合成中的作用的争论仍在进行中,但最近的两项研究报道,拟南芥CGS (AtCGS)的反馈不敏感突变形式在豆科种子中的种子特异性表达[9,10会导致Met水平升高。这些实验表明,CGS在豆科植物种子Met合成中起着重要的控制作用。然而,CGS(在天冬氨酸家族通路中)和HMT(在SMM通路中)在其他植物种子中的作用还需要进一步的研究。
在本研究中,我们旨在揭示CGS在烟草Met合成中的作用(红花烟草)属于茄科的种子。本研究选择烟草植物,是因为我们之前曾将其作为模式植物研究拟南芥CGS (AtCGS)对烟草营养组织Met积累的调节作用[11- - - - - -14]。两种形式的AtCGS在烟草植物中过表达:全长AtCGS (F-AtCGS)对高水平的Met/SAM具有反馈敏感性[15];截短的AtCGS (T-AtCGS)对Met/SAM反馈不敏感[11]。与野生型(WT)相比,过表达F-AtCGS的植物可溶性Met含量显著增加了约两倍,而过表达T-AtCGS的植物Met含量增加了2.5倍,但与表达F-AtCGS的植物相比,蛋白质结合的Met含量显著增加(约两倍)[11,12]。选择烟草植物作为研究对象,还因为它们的蒴果形态使我们能够将Met或其他代谢物应用于发育中的蒴果,以评估对发育中的种子中氨基酸和初级代谢物的影响[16]。
在本研究中,我们的目的是(i)阐明CGS在烟草种子Met合成中的作用;(ii)研究AtCGS对种子Met合成的反馈抑制作用;(iii)研究CGS活性增强对这些种子代谢的影响。
蛋氨酸含量增加对代谢的影响尚未得到研究,只有少数研究探讨了其他氨基酸水平增加与种子代谢之间的关系[17,18]。发育中的种子是研究发育控制的代谢调节的一个极好的系统,因为在种子发育过程中,脂肪酸、糖和氨基酸大量合成,这些合成转化为它们的储存形式:蛋白质、淀粉和油[19]。结果表明,高表达T-AtCGS导致总Met含量升高,并影响20种注释代谢物的水平。结果提示,表达这种形式CGS的转基因种子可能发生氧化应激。
结果与讨论
烟草内源CGS受高水平Met的调控
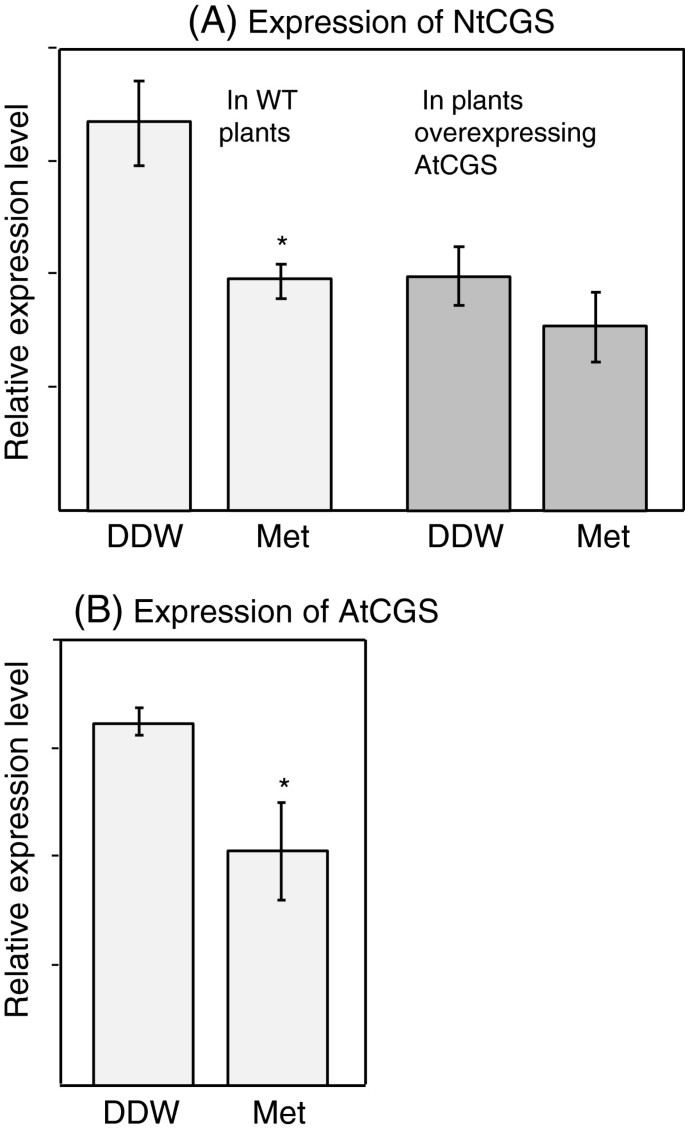
在这项研究中,我们在烟草种子中表达了AtCGS的反馈敏感形式(F-AtCGS)和对Met不敏感的突变形式(T-AtCGS)。为了区分这两种形式的AtCGS的影响,重要的是要知道内源性烟草CGS (NtCGS)是否被高含量的Met下调,类似于AtCGS [15]。为确定NtCGS的表达水平,以21日龄的烟草幼苗分别饲喂5 mM Met和双蒸馏水(DDW)作为对照,采用实时荧光定量PCR (qRT-PCR)检测NtCGS的表达水平。结果(图2A,左图)表明NtCGS的水平对高水平的Met(如AtCGS和番茄CGS)很敏感[20.,21],但不像土豆[22与烟草和番茄一起属于茄科。
很可能是由于Met在植物代谢中的主要作用,我们预计与拟南芥相似[38], NtCGS会在烟草植株的所有组织中表达。因此,我们认为,如果在表达AtCGS的转基因种子中发现较高水平的Met,这将是AtCGS活性较高而内源NtCGS活性较低的结果。
表达AtCGS的种子不积累较高水平的可溶性Met
为了评估CGS表达是否为烟草种子Met合成的限速因子,研究了两种形式的AtCGS (F-AtCGS;T-AtCGS)在种子特异性启动子Legumin B4的控制下表达[23],分别生产LF和LT植物(附加文件1:图S1)。采用免疫印迹法对各品系30株卡那霉素抗性植株的种子进行筛选,测定两种AtCGS的表达水平(附加文件)1:图S2)。每一株系中表达量最高的两株植物进行自花授粉,得到纯合子植株。来自T的种子3.用线条作进一步分析。
然后在转基因纯合子系和WT植株的种子中测定可溶性Met的水平。出乎意料的是,两组转基因种子中的Met水平并没有超过WT种子的水平,甚至显著降低(图2)3.;额外的文件2:表1)。这些结果与过度表达这两种AtCGS形式的烟草植株的报道不同,后者在其叶片中显示出明显更高的Met水平[11,12]。此外,这些结果也不同于从表达AtCGS反馈不敏感形式的大豆和红豆种子中获得的结果,后者表现出明显更高的可溶性Met水平(比相应的WT种子高2至6倍)[9,10]。
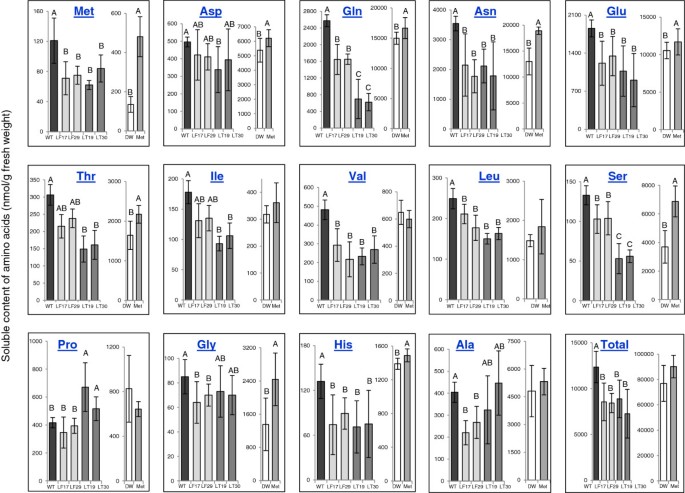
野生型(WT)和纯合子转基因烟草种子中可溶性氨基酸的含量拟南芥CGS:全长AtCGS (LF)和截断形式的AtCGS (LT),其水平与WT中发现的显著改变。每个品系分析两个转基因事件(LF17;LF29和LT19;LT30)。每个氨基酸盒的左面板描述了WT和转基因种子中该氨基酸的水平,而每个盒子的右面板描述了在WT发育胶囊的容器上进行的饲养实验结果,以5毫米Met或DDW作为对照。用气相色谱-质谱分析氨基酸的含量,并将其归一化为去甲亮氨酸,以每克鲜重种子的nmol计算。所提供的数据是取自三个不同植物的每条线的四个样本的平均值±标准差。统计上的显著变化(P<0.05,使用双向方差分析),只有当值有统计学差异时,才用不同的字母来识别。
观察到Met在转基因株系的种子中积累不超过WT水平,可能是Met分解代谢酶升高的结果。据报道,烟草种子发育过程中表达赖氨酸合成关键酶的分解代谢酶的表达增加[j]。24]。与野生种子相比,这些种子在发育过程中具有显著更高的赖氨酸含量;然而,这会在种子发育后期触发赖氨酸分解代谢酶的表达,最终在干种子中赖氨酸水平不会增加[24]。我们预计,如果这一现象也发生在表达两种AtCGS形式的转基因种子中,那么在种子发育过程中Met的水平将比WT种子高。为了验证这一点,在种子发育的8个阶段测量了Met的水平。结果表明,转基因种子中可溶性Met的水平与WT种子在所有发育阶段的水平相似(见LT种子,附加文件)1:图S3)。这表明,在种子发育过程中,WT和转基因种子发生了类似的过程,并且在干燥转基因种子中发现的低Met水平显然与Met分解代谢酶的速率升高无关。然而,在未来,当基因序列编码Met的两个主要分解代谢酶,SAM合成酶和Met γ-裂解酶(图2)1),那么在转基因株系的种子发育过程中,它们的表达水平和/或活性是否会增加,将是值得研究的。此外,当AtCGS在种子中的表达水平升高时,可以研究Met衍生的Young循环和甲基循环在这些种子中的作用,从而更好地了解这些途径。
转基因种子在种子发育过程中Met合成增强的证据
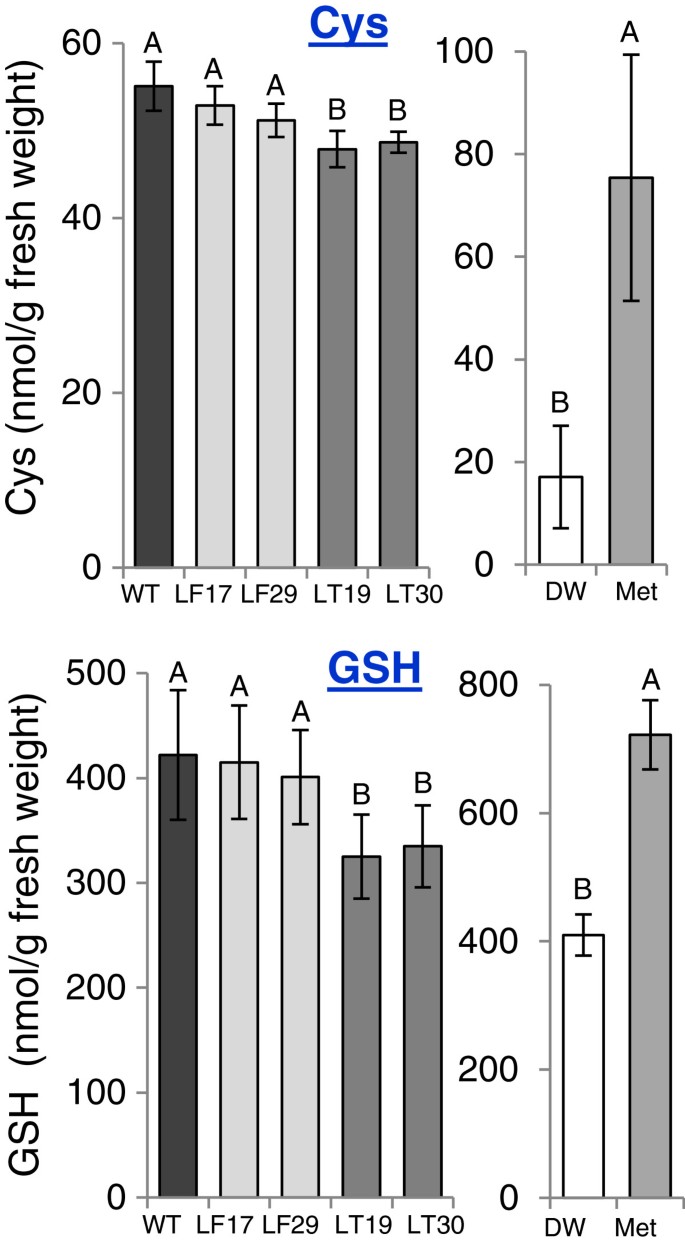
Met的合成与其他氨基酸(如那些属于天冬氨酸家族途径的氨基酸)有关1).由于可溶性Met在转基因种子中的减少是意料之外的,我们测量了其他氨基酸的水平,以确定随着AtCGS表达水平的增加而发生的变化。分析结果表明,除Met外,谷氨酰胺、谷氨酸、天冬酰胺、丝氨酸、缬氨酸、亮氨酸和组氨酸等7种氨基酸的含量均显著降低。转基因LT种子中苏氨酸和异亮氨酸水平显著降低,而转基因LF种子中丙氨酸和甘氨酸水平显著降低。与WT种子相比,LT种子的脯氨酸水平显著增加(图2)3.;额外的文件2:表1)。从这些改变的氨基酸中,有8种可以被认为是与met相关的氨基酸(图2)1).谷氨酰胺和谷氨酸作为天冬氨酸的前体,将其碳-氨基酸骨架捐献给Met合成。当蛋氨酸的含量以及另外两种属于天冬氨酸家族的氨基酸赖氨酸和苏氨酸的含量降低时,这些氨基酸的水平往往会降低(图2)1),增加[12,24,25]。苏氨酸与Met争夺它们共同的前体O-phosphohomoserine(图1),而若干植物的苏氨酸水平在蛋氨酸水平上升后亦有所下降[1]。支链氨基酸亮氨酸、异亮氨酸和缬氨酸与蛋氨酸有关,因为这些氨基酸的碳/氨基骨架是由苏氨酸和蛋氨酸的分解代谢产生的[26- - - - - -28]。事实上,当转基因烟草和拟南芥植物的叶片中发现高水平的Met时,它们的水平显著增加[12,29]。丝氨酸是合成半胱氨酸的碳/氨基骨架的前体,半胱氨酸是合成蛋氨酸的硫供体。据报道,当对半胱氨酸和蛋氨酸的需求增加时,丝氨酸含量会下降[30.- - - - - -32]。丝氨酸水平的下降表明半胱氨酸水平也下降了。因此,采用高效液相色谱法测定半胱氨酸水平。结果表明,LT种子中半胱氨酸水平显著降低(p < 0.05),而LF种子中半胱氨酸水平降低不显著(图5)4).由于半胱氨酸也被用作合成谷胱甘肽(GSH)的前体,而谷胱甘肽的水平受半胱氨酸(例如,[33- - - - - -35]),同时测定GSH水平。与半胱氨酸类似,谷胱甘肽水平在LF中变化不显著,而在LT中与WT相比显著降低(图2)4),降价22%。
LT种子中11种氨基酸(包括半胱氨酸)的低水平表明,尽管我们没有检测到可溶性Met含量的增加,但转基因种子中合成Met的通量增强,导致Met前体和竞争对手含量减少。
为了验证这一假设,并评估LT种子中水平降低的11种氨基酸是否确实与蛋氨酸的合成和代谢有关,研究人员在WT植物发育中的蒴果的花托中喂食了蛋氨酸。预计由于NtCGS表达水平的降低,饲喂蛋氨酸将减少蛋氨酸合成的通量(图2)2A).如果发生这种情况,我们预计谷氨酸前体(如天冬氨酸、谷氨酰胺和半胱氨酸)或谷氨酸竞争对手(苏氨酸)在种子中的水平会升高。为了验证这一假设,在开花后16-17天,正在发育的蒴果的花托被喂食0.5 ml的5毫米Met,或用DDW作为对照。在这个发育阶段,蛋白质在种子中积累,氨基酸在种子中合成[16]。24小时后,从这些胶囊中收集种子并分析游离氨基酸的水平。从饲料胶囊中获得的种子中获得的可溶性氨基酸(nmol/g鲜重)的值明显高于从干燥种子中获得的值(比较图中左右面板中每种氨基酸的值)3.).这显然是因为在种子发育的那个阶段,大多数氨基酸还没有被整合到种子储存蛋白中。
结果表明,添加Met的荚膜种子中Met含量显著增加(3.5倍)(图2)3.;额外的文件2表S2),表明Met可以从花托运输到种子。谷氨酸、谷氨酸、谷氨酰胺、丝氨酸(蛋氨酸前体)、苏氨酸(蛋氨酸竞争对手)、甘氨酸和组氨酸的水平在饲喂蛋氨酸的种子中显著升高(图2)3.;额外的文件2表2)。同型半胱氨酸和同型丝氨酸是Met生物合成途径的中间代谢产物(图2)1),也显著增加(附加文件2(表S2),表明在这些条件下,蛋氨酸合成的最后一种酶——蛋氨酸合成酶(Met synthase)和同型丝氨酸激酶(homesine kinase)的活性调节着蛋氨酸的合成。除了这些与Met相关的氨基酸外,与Met一起属于天冬氨酸家族的赖氨酸水平也显著升高,色氨酸水平显著降低(图2)3.;额外的文件2表2)。高效液相色谱法测定的半胱氨酸水平表明,蛋氨酸饲喂组的半胱氨酸水平显著高于DDW饲喂组(提高了4.4倍)。这些种子中谷胱甘肽的含量也显著增加,升高了1.7倍(图2)4).这些结果,以及图中所示的结果4研究表明,T-AtCGS的高表达增加了半胱氨酸在LT种子中用于蛋氨酸合成的通量,而牺牲了半胱氨酸及其三肽GSH。
LT和met种子中半胱氨酸和谷胱甘肽含量的变化是出乎意料的。因此,为了进一步了解这些变化,我们研究了LT种子中T-AtCGS的高表达如何影响GSH合成中两个基因的转录本表达水平。我们还测定了半胱氨酸生物合成途径的关键酶腺苷-5′-磷酸硫酸还原酶的转录水平[36,37]。这些转录本的表达水平在WT和LT种子之间都没有改变1:图S4)。这些结果表明,GSH含量的变化较少受半胱氨酸和GSH生物合成途径相关基因的转录水平控制,而更多地受半胱氨酸对GSH和/或Met生物合成途径的通量控制。然而,需要进一步的研究来确定其他因素和酶的作用,以及O-乙酰丝氨酸,调节半胱氨酸合成的关键代谢物[36]。
综上所述,饲喂实验获得的数据表明,饲喂蛋氨酸导致蛋氨酸合成通量的减少,导致蛋氨酸前体及其竞争对手水平的升高。这些结果支持了这样的假设,即尽管转基因种子中的Met水平相对较低,但在种子发育过程中Met合成的通量增强。这在对Met/SAM反馈敏感的LT种子中比在LF种子中更为明显[15]。然而,需要进一步的研究来直接监测导致Met合成的代谢通量以及T-AtCGS表达对这种通量的影响。结果还表明,在烟草种子中,T-AtCGS的高表达水平与12种氨基酸和GSH的水平有关。
LT种子在其蛋白质中含有较高水平的总Met
上述结果表明,LT种子中有较高的Met合成通量。由于附加文件中描述的结果1图S3表明Met在LT种子中转化为其他代谢物的速率与WT种子相同,我们假设在LT种子中,Met主要用于合成储存蛋白。对这一假设的支持来自于以下观察:通过Met分解代谢产生的三种支链氨基酸的可溶性水平[26,27]在LT种子中没有显著增加,甚至显著减少(图2)3.;额外的文件2:表1)。
为了验证LT种子中Met被用于合成种子贮藏蛋白的假设,我们测量了WT、LF和LT干种子中蛋白质水解后的氨基酸水平。与WT相比,两种LF系种子中总Met含量没有显著变化,甚至略有降低(表1)1).一种可能的解释是,由于SAM对AtCGS转录物水平的反馈抑制调节,LF种子中的Met含量不能进一步增加[15]。此外,由于与WT相比,LF种子中可溶性Met的水平显著降低(图2)3.),这也意味着AtCGS(转基因种子中CGS的主要形式)对反馈抑制的敏感性高于NtCGS,从而降低了Met的积累能力。为了进一步验证这一假设,我们在过表达AtCGS的WT和转基因幼苗中检测了NtCGS的表达水平[11]。正如我们观察到的,NtCGS的表达水平对高水平的Met非常敏感(图2)2A,左图),与WT相比,在过表达F-AtCGS的幼苗中,其水平较低(因为在这些植物中,与WT相比,它们具有更高的Met水平)2A).接下来,我们还分析了高Met含量对AtCGS和NtCGS表达水平的影响。结果(图2A、B)表明,与DDW相比,NtCGS的表达量降低了33%,AtCGS的表达量降低了52%。这表明与NtCGS相比,AtCGS对高水平Met引起的反馈抑制更敏感。由于AtCGS对Met的敏感性在拟南芥的整个组织中是相似的[38,我们预计NtCGS也是如此。如果情况确实如此,则会出现图5所示的结果2可以解释在LF转基因种子中Met水平降低的原因。然而,需要进一步的研究来验证这一假设,并揭示为什么在LF转基因种子中,另外九种可溶性氨基酸(丙氨酸、缬氨酸、亮氨酸、谷氨酰胺、天冬酰胺、谷氨酸、丝氨酸、甘氨酸和组氨酸)的含量显著降低(图2)3.).
与LF不同,表达AtCGS反馈不敏感形式的LT种子(T-AtCGS)的总Met水平显著高于WT种子,比WT种子增加了46%至60%(表1)1).基于LT的结果,我们认为烟草WT种子中可溶性Met的水平限制了可并入蛋白质的Met含量。其他几项研究也作出了类似的假设,表明转基因大豆种子中可溶性半胱氨酸、赖氨酸、色氨酸或蛋氨酸的含量较高[10,39- - - - - -41]和稻子中的色氨酸[42导致种子蛋白质中这些氨基酸的增加。然而,高可溶性氨基酸融入蛋白质的能力似乎在不同的种子之间有所不同。可溶性蛋氨酸水平显著提高(约6倍)导致自贡东豆品种大豆种子总蛋氨酸水平显著提高(约2倍)[10]。然而,当使用大豆品种“Misuzudaizu”和“Bert”时,据报道,尽管它们的可溶性Met含量显著提高(2倍),但总Met水平没有显著改变[9]。同样,烟草种子中的可溶性苏氨酸含量高(16倍)[24]和羽扇豆种子的高半胱氨酸含量(26倍)[43]不会改变转基因种子中的总苏氨酸或半胱氨酸[43,44]。
LT种子的总氨基酸和蛋白质含量较高
LT种子中除了总Met水平显著升高外,天冬氨酸、谷氨酸和两种与胁迫相关的氨基酸脯氨酸和丝氨酸的总水平也显著升高(表1)1).此外,LT种子中大多数其他氨基酸的水平也有所提高,但不显著。结果,LT种子总氨基酸含量显著提高了18-21%(表2)1).这种升高可以解释为什么总可溶性氨基酸水平显著下降(图2)3.;额外的文件2:表1)。在表达AtCGS反馈不敏感形式的两种转基因大豆种子中也发现了类似的总氨基酸含量升高的趋势,其中总氨基酸含量分别增加了55%和76% [10]。然而,这并不是其他氨基酸的普遍现象,因为转基因大豆种子中总色氨酸含量较高,拟南芥种子中赖氨酸含量较高,但并没有显示总氨基酸水平的增加[40,45]。这表明Met水平是烟草种子蛋白质合成的一个限制因素,当Met合成增强时,大多数其他可溶性氨基酸能够融入蛋白质中。然而,需要进一步的研究来确定这种表型背后的机制,并确定其他尚未研究的氨基酸含量的升高是否也会导致同样的现象。
蛋白质结合氨基酸含量的增加表明LT种子具有较高的蛋白质含量。为了测试这种可能性,从每条线10毫克的种子组中测量了四种种子样品中水溶性蛋白质的含量。结果表明,LT种子蛋白质含量(2.22±0.36 μg/ l)高于WT(1.74±0.39 μl),提高了27%,差异无统计学意义(p < 0.05)。
高表达T-AtCGS对种子初级代谢产物的影响
T-AtCGS的表达导致总Met水平升高(表2)1)和12种可溶性氨基酸水平的改变(附加文件)2:表1)。为了评估更高的Met合成通量是否与初级代谢物水平的额外变化有关,我们使用已建立的气相色谱-质谱(GC-MS)进行了代谢谱分析[46- - - - - -48]。尽管在种子发育过程中,种子代谢发生了显著的变化,但在种子发育过程中,当异源基因表达时,对种子代谢谱的变化知之甚少[qh]17,18]。因此,我们有兴趣研究Met代谢的扰动是否会影响种子内的个体代谢物。
GC-MS分析显示102个峰具有显著更高的信噪比值。为了确定尽可能多的峰的化学性质,使用了标准。此外,将所有峰的光谱与市售的电子质谱库、NIST和WILEY进行了比较。在WT和转基因种子中检测到52种带注释的特异性化合物(附加文件)3.(表S4),其中一些出现在不止一个保留时间。
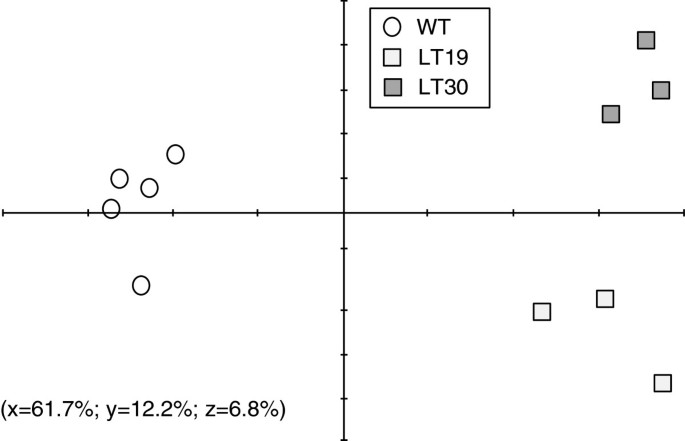
通过主成分分析(PCA)分析种子代谢物浓度变化趋势时,WT和LT基因型表现出明显的差异,表明遗传操作对LT种子初级代谢的影响相对较强(图2)5).这些结果与报道的具有较高赖氨酸水平的拟南芥种子不同,后者与WT的差异不大[17]。PCA分析使我们能够确定对WT和LT基因型之间差异有显著贡献的代谢物和峰。因此,这些代谢物和峰值也通过双向方差分析进行了评估。
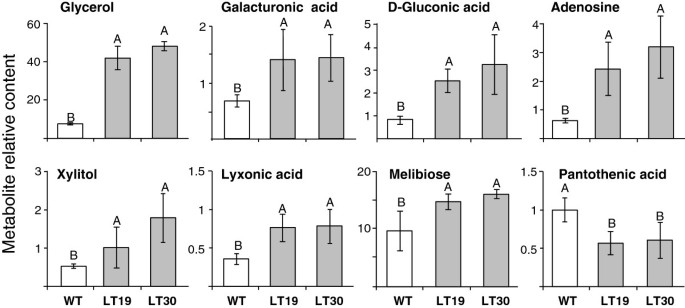
在标注的52种代谢物中,与WT种子相比,LT中甘油、葡萄糖酸、半乳糖醛酸、木糖醇、lyxonic酸、美利二糖和腺苷等7种代谢物水平显著升高,而泛酸水平显著降低(图2)6).此外,4个峰(17、31、72、73;额外的文件3.(表S4), LT种子显著减少,而另外两个种子(90、93)显著增加。根据文献,没有一个标注的代谢物与Met相关。大多数在肝移植中升高的化合物是糖或它们的氧化衍生物。葡萄糖酸是葡萄糖的氧化形式,半乳糖醛酸是果胶的主要成分,是半乳糖的氧化形式。木糖醇和羟酸(也称为木糖石)分别由木糖通过氢化或轻度氧化产生。氧化代谢物的含量越高,可溶性脯氨酸的含量也越高(图2)3.;额外的文件2:表S1)和总丝氨酸水平,它们是应激诱导的氨基酸[49,50],表明氧化应激发生在LT种子发育过程中。
除了这些糖及其衍生物,腺苷(一种嘌呤核苷)的水平也增加了。已知腺苷在植物中引起许多生理反应[51,52],是合成主要蛋氨酸代谢物SAM所必需的。嘌呤的合成需要叶酸,叶酸也是合成甲基四氢叶酸所必需的,甲基四氢叶酸是Met合成酶的底物,是Met合成的最后一种酶。然而,这是一种假定的联系,需要进一步的研究来揭示Met和腺苷之间的联系。
当这些代谢物的含量增加时,泛酸(维生素B5)在LT种子中减少。泛酸是辅酶A的前体,由天冬氨酸合成[53], Met的碳/氨基给体。因此,LT种子中可溶性天冬氨酸水平降低(附加文件)2(表S1)可能会减少用于合成泛酸的天冬氨酸。蛋氨酸和泛酸之间的另一个假定联系是它们的合成都需要依赖叶酸的酶[54]。因此,当蛋氨酸(以及腺苷)水平增加时,可用于合成泛酸的叶酸就会减少。然而,需要进一步的研究来澄清这些关系。
为了更好地了解这些代谢物与Met代谢之间的关系,使用GC-MS扫描方法对WT种子进行了分析。这使我们能够检测到喂养24小时后代谢产物水平的变化。结果表明:添加蛋氨酸显著提高了木糖醇和糖二糖含量(分别为32%和27%);腺苷水平增加了15%,但在统计学上不显著。与DDW饲喂的种子相比,其他化合物的含量没有显著变化。最有可能的是,短时间的高Met暴露不足以显著改变这些代谢物的含量。然而,这一分析加强了木糖醇和糖二糖与烟草种子中AtCGS高表达水平和Met高表达水平之间存在联系的假设。
LT种子中脂质和总还原糖的水平
LT种子中甘油含量的显著增加可能会影响脂质含量,因为甘油是三酰基甘油的前体,可能在调节种子中油脂含量方面发挥作用[55,56]。此外,这些种子中较高水平的蛋白质也可能影响脂质和淀粉的水平,正如先前报道的大豆种子[57]。我们用索氏法测定了油的含量。结果表明,LT种子含油量略高于WT,但差异无统计学意义(分别为40.71%±2.46和36.75%±2.29)。
由于LT种子中蛋白质总氨基酸水平有所增加,油脂水平略有下降,因此我们还测量了碳水化合物水解后的总还原糖水平,即淀粉含量。LT种子的还原糖含量略低于WT种子,分别为10.65±0.31 mg / g和11.84±0.13 mg / g。这表明蛋白质含量的提高是以淀粉积累为代价的。总还原糖的减少也可能与以下观察结果有关:除了氨基酸外,在LT种子中代谢产物水平显著改变的大多数是糖及其衍生物(图2)6).一个假定的联系是葡萄糖的碳骨架被修饰成其他糖,留下更少的葡萄糖可被纳入淀粉。
LT种子的发芽率略有降低
LT种子细胞成分和关键代谢物(包括20种注释的初级代谢物(包括氨基酸))、总蛋白、脂质和还原糖含量的变化程度可能影响种子的表型和发芽率。因此,我们比较了WT和LT种子的形态表型,发现没有显著差异。100粒LT种子的平均重量较WT种子下降(LT种子为87.5±0.64 mg, WT种子为93.6±1.19 mg),但差异无统计学意义。吸胀后5天,LT种子的发芽率低于WT(附加文件)1:图S5),然而,4天后,WT和LT幼苗的生长无法区分。据报道,赖氨酸水平升高的大豆和拟南芥种子发芽率下降[41,45],然而,大豆中苏氨酸含量的增加[58]或Met [10没有受到影响。因此,不同的种子以不同的方式对高通量或高水平的可溶性氨基酸作出反应。总的来说,目前的研究结果表明,烟草种子的发芽率相对耐受Met合成增加时发生的扰动,导致20种注释代谢物的谱以及总还原糖和蛋白质的水平发生显著变化。
结论
基于上述结果,我们对AtCGS表达后烟草种子中发生的变化提出以下解释:与AtCGS在LF种子中的反馈敏感形式不同,LT种子中Met/SAM反馈不敏感形式的AtCGS的高表达水平导致Met合成通量显著增加。这导致蛋氨酸合成显著增加,导致作为蛋氨酸前体的氨基酸含量减少。蛋氨酸合成的增加提高了蛋白质合成速率,在种子成熟过程中可以利用其他可溶性氨基酸整合到贮藏蛋白中。结果,总氨基酸含量增加(表1)1),以及总水溶性蛋白质的数量(约27%)。这表明CGS在烟草种子中的Met合成中发挥作用,正如在豆类种子中发现的那样[9,10,59]。然而,需要进一步的研究来评估是否也可以在种子发育的后期阶段由SMM合成Met,正如所建议的那样Medicago truncatula[60]。
除了评估AtCGS在种子Met合成中的作用外,我们还旨在破译这种操作如何与种子中的其他初级代谢物交叉相互作用。结果表明,与WT种子相比,LT中20种带注释的初级代谢物(包括氨基酸)的水平发生了改变。其中12种代谢物水平降低,8种代谢物水平升高。结果还表明,与赖氨酸代谢不同,Met代谢对初级代谢物的影响相对较大,因为高赖氨酸含量只影响与TCA循环相关的四种代谢物[17]。一般来说,大多数游离氨基酸的水平在LT中降低,而糖及其衍生物的水平则升高。氧化糖的增加和总脯氨酸和丝氨酸水平的提高,这两种氨基酸的水平在氧化应激期间会增加[49,50],表明LT种子遭受氧化应激。氧化应激可能与谷胱甘肽(一种主要抗氧化化合物)含量低有关[61],在LT种子中。然而,在种子发育过程中,高水平的T-AtCGS、低水平的GSH和氧化应激之间的关系还有待进一步的研究。
本研究提供了关于提高种子中CGS is表达水平的代谢后果的信息。此外,由于LT种子的总可溶性蛋白水平提高了27%,总脂质含量降低了约4%(尽管不显著),代表淀粉含量的总还原糖含量显著降低了4.6%,我们也定义T-AtCGS的高表达水平影响了种子的营养品质。
方法
以种子特异性方式表达不同形式AtCGS的转基因植株的产生
二元结构按照Song等人的描述制备。[10]和附加文件1:图S1烟草植物(烟草cv Samsun NN)用前面描述的这些结构进行转换[11]。将植株置于生长室内,光照/黑暗循环16/8小时,温度23-27℃。杂合成熟T0采用免疫印迹法对各转基因系30株卡那霉素抗性植株种子进行蛋白表达水平筛选[11]。从每组中选择表达水平最高的两株进行进一步研究。这些植物通过自花授粉获得纯合子植株。
种子氨基酸的提取、衍生化及分析
从每个转基因系和野生型系收集的至少15粒蒴果中收集种子。从20毫克干种子中提取游离氨基酸。为了测定总氨基酸,包括蛋白质结合氨基酸,按所述取干种子10mg [30.]。对于酸水解,使用Carousel 12 +反应站(Radleys, UK)。采用GC-MS的单离子法(SIM)检测氨基酸,如前所述[30.]。对于半胱氨酸和谷胱甘肽的测定,用研钵和杵研磨干种子(50 mg),然后用HPLC提取和分析,如前所述[33]。
GC-MS仪器及初级代谢物的数据分析
对于初级代谢物分析,按照描述的方法制备游离氨基酸样品[30.和7 μl保留时间标准混合物(0.2 mg/ml正十二烷、正十五烷、正十一烷、正十二烷和正八烷,吡啶);此外,在三甲基硅化之前,加入4.6 μl去甲亮氨酸和利比醇的保留时间标准混合物(2 mg/ml)。
样品在GC- ms系统(Agilent 7890A系列GC系统与Agilent 5975c质量选择检测器耦合)上运行,该系统上安装了Gerstel®多用途进样器(MPS2)。该分析方法基于Roessner et al. (2001) [46]。载气为氦气,流速为1 mL / min,以无分裂方式注入1 μL,入口温度为230℃,压力为8.805 psi。GC采用30 m RXI-5-Sil质谱毛细管柱,内径0.25 mm,膜厚0.25 μm (Restek, USA)。分析在以下温度程序下进行:在70°C的等温加热5分钟,然后是5°C min1烤箱温度梯度至310°C,最后在310°C下加热3分钟。在注入下一个样品之前,系统在70℃下温度平衡6分钟。在2扫描秒内记录质谱1扫描范围50至600米/z。
将标准物质(大部分由魏茨曼研究所Asaph Aharoni提供)溶于50%甲醇(1mg /ml)中。取5 μl体积的标准溶液真空干燥,用40 μl 20 mg/ml盐酸甲氧胺吡啶和100 μl n -甲基- n -(三甲基硅基)三氟乙酰胺(MSTFA)衍生化。采集的数据使用Agilent GC/MSD Productivity ChemStation软件获取。所有高于基线阈值的峰根据保留时间进行量化和分组,区域归一化为去甲亮氨酸和利比醇。通过与标准进行比较,并与市售的NIST和WILEY电子质谱库进行比较,确定了物质。
Met在胶囊研制中的应用
在WT开花后16-17天,将无菌DDW中5 mM Met的半ml注射到发育蒴果的花托中。在这个阶段,种子的颜色由白色变成浅棕色。24小时后,收获胶囊并保存在冰上。将种子从蒴果中分离出来,用冻干机干燥,在- 70°C保存直至使用。以注射DDW胶囊为对照。
烟草幼苗RNA提取及表达分析
提取RNA时,植株在Nitsch琼脂培养皿[Nitsch培养基(DUCHEFA), pH调至5.8,KOH为0.9% (w/v),含2%蔗糖]中生长,光照/暗循环(16 h/8 h)。21日龄的烟草幼苗分别饲喂5 mM Met或DDW作为对照。6 h后,将植株在液氮中冷冻,作为5个生物重复的30株幼苗池,保存至- 80°C使用。对于qRT-PCR,提取RNA并合成cDNA,如前所述[10]。qRT-PCR分析中使用的引物在附加文件中进行了总结2:表S3。为了使样本间的差异归一化,我们以PP2A转录水平作为内源对照[62]。给出的值是三个生物重复的平均值。
转基因LT和WT种子发芽率测定
将种子在12°C的水中放置一夜,轻轻摇晃,然后用沾有水的Watmann纸转移到培养皿中。将板置于标准植物生长室中,温度25°C,光照16/8小时,持续10天。
种子中总蛋白、脂质和还原糖的测定
总蛋白的测定,将10 mg种子研磨在120 μl pH = 7.8的25 mM磷酸钠缓冲液中,用蛋白酶抑制剂鸡尾酒(Sigma, P9599)。两次离心循环(14000 rpm, 4°C, 20分钟)后,用Bradford试剂(Bio-Rad Hercules, california)测定总蛋白。以牛血清白蛋白为标准品。
如前所述,使用索氏法测定脂质[10]。碳水化合物和淀粉水解后,用Sumner法量热测定还原糖[63]。150毫克种子按上述方法干燥和研磨。取80 ml HCl 1n, 70℃提取2 h,冷却后pH校正为7.5,加水校正体积为100 ml。然后将0.1 ml和0.2 ml的样品分别与1.9 ml和1.8 ml的水混合,并加入2ml的Sumner试剂。还原糖在550 nm处检测。
统计和网络分析
本研究所得数据采用jmp8软件进行统计学分析。在这个软件中,我们使用了方差分析和学生t检验程序,如文中所述。P值<0.05认为有统计学意义。
对于代谢谱分析所需的统计分析,使用TMEV软件包对代谢物谱分析获得的数据集进行主成分分析和双向方差分析[64],使用默认的加权协方差估计函数。在分析之前,数据被对数转换并归一化为每个代谢物的整个样本集的中位数。为了检验特定时间点之间的统计学显著性,使用Microsoft Excel中合并的算法进行t检验。我们将相关显著性阈值固定在Spearman相关系数的水平上。
作者的信息
RA是以色列Tel Hai大学和Migal研究所的副教授。在过去的几年里,她主要研究植物中Met的代谢。YH博士和IM是她研究团队的成员。IG是硕士学位。学生。
缩写
- 满足:
-
甲硫氨酸
- 山姆:
-
年代-adenosyl蛋氨酸
- 社交媒体:
-
年代甲基蛋氨酸
- 研究生院理事会:
-
胱硫醚γ合酶
- AtCGS:
-
研究生院理事会拟南芥
- WT:
-
野生型
- 谷胱甘肽:
-
谷胱甘肽
- 存在:
-
实时定量PCR
- 气相:
-
气相色谱-质谱法
- DDW:
-
双倍蒸馏水。
参考文献
- 1.
高等植物营养组织中蛋氨酸含量调节因素的研究进展。氨基酸,2010,39(4):917-931。10.1007 / s00726 - 010 - 0482 - x。
- 2.
李建军,李建军,李建军,等。植物蛋氨酸合成调控的研究进展。[J] .生物医学工程学报,2004,35(4):444 - 444。10.1093 / jxb / erh139。
- 3.
李建军,李建军,李建军,等。蛋氨酸在植物体内的合成和代谢特征。美国国家科学促进会。中国生物医学工程学报,2009,35(3):559 - 561。10.1073 / pnas.95.13.7805。
- 4.
Amir R, Han T, Ma F:通过提高蛋氨酸含量的生物工程方法提高种子的营养价值。动物学报,2012,29(9):915-924。10.1007 / s11032 - 011 - 9690 - 7。
- 5.
加利利G,阿米尔R:强化植物必需氨基酸赖氨酸和蛋氨酸以提高营养品质。植物学报,2013,31(2):521 - 522。10.1111 / pbi.12025。
- 6.
王晓明,王晓明,王晓明,等。蛋氨酸生物合成的研究进展。植物科学进展,2003,8(6):259-262。10.1016 / s1360 - 1385(03) 00107 - 9。
- 7.
Bourgis F, Roje S, Nuccio ML, Fisher DB, Tarczynski MC, Li C, Herschbach C, Rennenberg H, Pimenta MJ, Shen TL,等:S-甲基蛋氨酸在韧皮部硫转运中起重要作用,并由一种新型甲基转移酶合成。植物学报,1999,11(8):1485-1498。
- 8.
李M,黄涛,Toro-Ramos T, Fraga M, Last RL, Jander G:降低拟南芥蛋氨酸生物合成酶HMT2活性,提高种子蛋氨酸含量。植物学报,2008,35(2):391 - 391。10.1111 / j.1365 - 313 x.2008.03419.x。
- 9.
Hanafy MS, Rahman SM, Nakamoto Y, Fujiwara T, Naito S, Wakasa K, Ishimoto M:拟南芥半胱甘氨酸γ -合酶突变形式对大豆和小豆蛋氨酸代谢的差异响应。植物生理学报,2013,31(3):368 - 368。10.1016 / j.jplph.2012.10.018。
- 10.
宋松,侯伟,Godo I,吴超,于勇,Matityahu I, Hacham Y,孙松,韩涛,Amir R:表达反馈不敏感半胱甘氨酸γ-合成酶的大豆种子蛋氨酸含量较高。实验学报,2013,64(7):1917-1926。10.1093 / jxb / ert053。
- 11.
Hacham Y, Avraham T, Amir R:拟南芥半胱甘氨酸γ -合成酶n端区域在蛋氨酸代谢中起重要调控作用。植物生理学报,2009,32(2):454-462。10.1104 / pp.010819。
- 12.
Hacham Y, Matityahu I, Schuster G, Amir R:烟草叶片中天冬氨酸激酶和半胱甘氨酸-合成酶突变形式的过度表达导致蛋氨酸和苏氨酸的高积累。植物学报,2008,35(2):369 - 369。10.1111 / j.1365 - 313 x.2008.03415.x。
- 13.
Hacham Y, Schuster G, Amir R:拟南芥半胱甘氨酸γ -合成酶n端区域的体内内部缺失导致对蛋氨酸不敏感的CGS表达。植物学报,2006,45(6):955-967。10.1111 / j.1365 - 313 x.2006.02661.x。
- 14.
Hacham Y, Song L, Schuster G, Amir R:赖氨酸通过调节s -腺苷甲硫氨酸合成酶的表达来提高蛋氨酸含量。植物学报,2007,31(5):851 -861。10.1111 / j.1365 - 313 x.2007.03184.x。
- 15.
Chiba Y, Sakurai R, Yoshino M, Ominato K, Ishikawa M, Onouchi H, Naito S: S-腺苷- l-蛋氨酸在拟南芥半胱甘氨酸γ -合成酶基因转录后自动调节中的作用。美国国家科学促进会。中国生物医学工程学报,2003,31(6):1025 -1023。10.1073 / pnas.1831512100。
- 16.
黄晓明,黄晓明,黄晓明,等。烟叶种子赖氨酸分解代谢的钙蛋白磷酸化机制。植物细胞,1995,7(11):1963-1970。
- 17.
朱晓霞,李建军,李建军,李建军,拟南芥种子发育过程中赖氨酸代谢机制的研究进展。植物生理学报,2009,31(4):558 - 572。10.1104 / pp.109.145631。
- 18.
黄晓明,李晓明,李晓明,李晓明,黄晓明,黄晓明,谷氨酸- γ -氨基丁酸转化对拟南芥种子碳氮平衡和储存储量的影响。植物生理学报,2011,31(3):1026-1042。10.1104 / pp.111.179986。
- 19.
王晓明,王晓明,王晓明,等。豆科植物种子储备积累的研究进展。中国生物医学工程学报,2008,31(10):755-762。10.1016 / j.crvi.2008.07.017。
- 20.
Chiba Y, Ishikawa M, Kijima F, Tyson RH, Kim J, Yamamoto A, Nambara E, Leustek T, Wallsgrove RM, Naito S:拟南芥半胱甘氨酸γ -合成酶mRNA稳定性的自调节证据。科学,1999,28(5):1371-1374。10.1126 / science.286.5443.1371。
- 21.
李建军,李建军,李建军,等。半胱硫氨酸- γ合酶在番茄成熟过程中对乙烯产生的调控作用。植物化学学报,2006,31(1):357 - 357。
- 22.
王晓明,王晓明,王晓明,等。基因工程马铃薯半胱硫氨酸γ -合成酶的功能分析。植物生理学报,2003,31(4):1843-1854。10.1104 / pp.102.015933。
- 23.
Baumlein H, Nagy I, Villarroel R, Inze D, Wobus U:种子蛋白基因启动子的顺式分析:legumin box中保守的RY重复CATGCATG对legumin基因的组织特异性表达至关重要。植物学报,2002,22(2):393 - 393。
- 24.
Karchi H, Shaul O, Galili G:烟草种子发育过程中赖氨酸合成和分解代谢的协调调节。美国国家科学促进会。中国生物医学工程学报,1994,18(7):559 - 561。10.1073 / pnas.91.7.2577。
- 25.
Zeh M, Casazza AP, Kreft O, Roessner U, Bieberich K, Willmitzer L, Hoefgen R, Hesse H:苏氨酸合成酶反义抑制对转基因马铃薯中蛋氨酸含量的影响。植物生理学报,2001,27(3):792-802。10.1104 / pp.010438。
- 26.
Joshi V, Jander G:拟南芥蛋氨酸γ -裂解酶受异亮氨酸生物合成需要调控,但对苏氨酸脱氨酶起从属作用。植物生理学报,2009,31(1):367-378。10.1104 / pp.109.138651。
- 27.
杨建军,杨建军,李建军,张建军。植物苏氨酸、蛋氨酸和异亮氨酸代谢的相互依赖性:非生物胁迫下植物苏氨酸、蛋氨酸和异亮氨酸的积累和转录调控。氨基酸,2010,39(4):933-947。10.1007 / s00726 - 010 - 0505 - 7。
- 28.
Rebeille F, Jabrin S, Bligny R, Loizeau K, Gambonnet B, Van Wilder V, Douce R, Ravanel S:拟南芥细胞的甲硫氨酸分解代谢是由γ -裂解过程启动的,并导致S-甲基半胱氨酸和异亮氨酸的合成。美国国家科学促进会。中国生物医学工程学报,2006,32(4):387 - 398。10.1073 / pnas.0606195103。
- 29.
Kusano M, Fukushima A, Redestig H, Kobayashi M, Otsuki H, Onouchi H, Naito S, Hirai M, Saito K:拟南芥基因型依赖性蛋氨酸积累的比较代谢组学图。氨基酸,2010,39(4):1013-1021。10.1007 / s00726 - 010 - 0562 - y。
- 30.
Golan A, Matitiyho I, Avraham T, Badani H, Galili S, Amir R:可溶性蛋氨酸促进转基因苜蓿植株中15kda玉米蛋白(一种富含蛋氨酸的储存蛋白)的积累,而在转基因烟草植株中没有。实验学报,2005,56(4):2443-2452。10.1093 / jxb / eri237。
- 31.
Nikiforova V, Kempa S, Zeh M, Maimann S, Kreft O, Casazza AP, Riedel K, Tauberger E, Hoefgen R, Hesse H:马铃薯半胱氨酸和蛋氨酸的生物合成工程。氨基酸,2002,22(3):259-278。10.1007 / s007260200013。
- 32.
Stiller I, Dancs G, Hesse H, Hoefgen R, Banfalvi Z:提高马铃薯块茎营养价值:通过无标记转化提高马铃薯品种白女士的半胱氨酸和谷胱甘肽含量。中国生物医学工程学报,2007,32(2):335-343。10.1016 / j.jbiotec.2006.10.015。
- 33.
mattyahu I, Kachan L, Bar Ilan I, Amir R:酿酒酵母me25基因的转基因烟草表现出半胱氨酸和谷胱甘肽水平的提高和对氧化应激的耐受性增强。氨基酸,2006,30(2):185-194。10.1007 / s00726 - 005 - 0250 - 5。
- 34.
王晓明,王晓明,王晓明,王晓明。烟草半胱氨酸合成酶的基因表达及其对含硫环境污染物的耐受性。植物生理学报,2009,26(3):973-980。10.1104 / pp.126.3.973。
- 35.
王晓华,王晓华,王晓华,等。植物半胱氨酸合成酶蛋白复合物的结构、生化和调控特性分析。植物生理学报,2006,32(3):557 - 557。10.1016 / j.jplph.2005.11.013。
- 36.
M ., M .:硫氨基酸:半胱氨酸和蛋氨酸的合成。生物质化学工程,2009,35(3):344 - 344。10.1007 / s11120 - 005 - 8810 - 9。
- 37.
周建军,李建军,李建军,等。植物对硫酸盐的吸收与同化。植物学报,2010,31(2):314-325。10.1093 / mp / ssq001。
- 38.
李建军,李建军,李建军,李建军,李建军。拟南芥可溶性蛋氨酸和s -甲基蛋氨酸合成酶的高表达。植物生理学报,2002,28(1):394 - 394。10.1104 / pp.101801。
- 39.
金淑娟,陈文杰,李建军,李建军,李建军,李建军,李建军。大豆种子中半胱氨酸和Bowman-Birk蛋白酶抑制剂表达的研究进展。植物学报,2012,35(1):13-23。10.1007 / s00425 - 011 - 1487 - 8。
- 40.
北田,Nakamoto Y, Takahashi M, Kitamura K, Wakasa K, Ishimoto M:色氨酸生物合成失调和贮藏蛋白缺乏对大豆种子氨基酸组成的影响。植物学报,2010,29(1):87-95。10.1007 / s00299 - 009 - 0800 - 5。
- 41.
李春华,李春华,李春华,黄春华,等。油菜籽粒赖氨酸基因的克隆与分析。生物技术学报,1995,13(6):577-582。10.1038 / nbt0695 - 577。
- 42.
Wakasa K, Hasegawa H, Nemoto H, Matsuda F, Miyazawa H, Tozawa Y, Morino K, Komatsu A, Yamada T, Terakawa T,等:转基因水稻种子高水平色氨酸积累及其对农艺性状和种子代谢产物谱的影响。实验学报,2006,57(12):3069-3078。10.1093 / jxb / erl068。
- 43.
table L, Wirtz M, Molvig L, Droux M, Hell R:丝氨酸乙酰转移酶的过表达导致豆科种子中o -乙酰丝氨酸和游离半胱氨酸的大量增加。实验学报,2010,61(3):721-733。10.1093 / jxb / erp338。
- 44.
王晓明,王晓明,王晓明,等。一种细菌脱敏的天冬氨酸激酶在转基因烟草种子中的特异性表达及对苏氨酸和蛋氨酸的影响。植物学报,1993,3:721-727。10.1111 / j.1365 - 313 x.1993.00721.x。
- 45.
Zhu X, Galili G:拟南芥种子中赖氨酸合成的增加加上其分解代谢的敲除协同提高赖氨酸含量,并对其他氨基酸的代谢进行转调控。植物细胞,2003,15(4):845-853。10.1105 / tpc.009647。
- 46.
罗思纳,卢德曼,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。植物细胞,2001,13(1):11-29。
- 47.
李建军,李建军,李建军,等。植物氨基酸代谢过程中芳香族氨基酸网络和asp家族的转录调控与系统相互作用。氨基酸,2010,39(4):1023-1028。10.1007 / s00726 - 010 - 0566 - 7。
- 48.
王晓明,王晓明,王晓明,王晓明,等。拟南芥种子发育和萌发与代谢开关的关系。植物生理学报,2006,32(3):839-854。10.1104 / pp.106.086694。
- 49.
李建军,李建军,李建军,李建军,等。植物体内脯氨酸的研究进展。植物信号行为,2012,7(11):1456-1466。10.4161 / psb.21949。
- 50.
Nikiforova VJ, Kopka J, Tolstikov V, Fiehn O, Hopkins L, Hawkesford MJ, Hesse H, Hoefgen R:拟南芥代谢组学分析对硫缺乏的响应。植物生理学报,2009,38(1):394 - 398。10.1104 / pp.104.053793。
- 51.
李建军,李建军,李建军,等。植物腺嘌呤核苷酸转运的研究进展。植物科学进展,2011,16(9):507-515。10.1016 / j.tplants.2011.04.001。
- 52.
李志强,王志强,王志强,等。L(+)-腺苷在番茄、黄瓜和玉米叶片上的快速诱导效应。植物生理学报,1993,31(1):449 - 456。
- 53.
赵建军,杨建军,杨建军,杨建军,杨建军。植物体内泛酸盐(维生素B(5))含量的研究进展。植物生理学报,2008,35(4):493- 493。
- 54.
Mehrshahi P, Gonzalez-Jorge S, Akhtar TA, Ward JL, santoyoo - castelazo A, Marcus SE, Lara-Nunez A, Ravanel S, Hawkins ND, Beale MH,等:叶酸多谷氨酰化在植物代谢和发育中的功能分析。植物学报,2010,32(2):379 - 379。10.1111 / j.1365 - 313 x.2010.04336.x。
- 55.
黄海涛,黄海涛,黄海涛,等。大豆胚中甘油三酯合成的酰基通量分析。植物生理学报,2009,31(1):555 - 572。10.1104 / pp.109.137737。
- 56.
Vigeolas H, Waldeck P, Zank T, Geigenberger P:在种子特异性启动子控制下酵母甘油-3-磷酸脱氢酶的过表达提高油菜籽(Brassica napus L.)的含油量。植物学报,2007,35(3):431-441。10.1111 / j.1467-7652.2007.00252.x。
- 57.
Hernandez-Sebastia C, Marsolais F, Saravitz C, Israel D, Dewey RE, Huber SC:天冬酰胺在控制低蛋白和高蛋白大豆种子贮藏产物积累中的可能作用。[J] .中国生物医学工程学报,2005,35(4):551 - 563。10.1093 / jxb / eri191。
- 58.
祁强,黄娟,Crowley J, Ruschke J, Goldman BS, Wen L L, Rapp d . bovieni Xenorhabdus bovienii大豆种子中苏氨酸不敏感型天冬氨酸激酶的生化特性和特异性表达。植物学报,2011,9(2):193-204。10.1111 / j.1467-7652.2010.00545.x。
- 59.
table LM, Droux M:发育中的罗苹子叶硫同化对种子中有机硫储量的积累有重要贡献。植物生理学报,2009,26(1):379 - 379。10.1104 / pp.126.1.176。
- 60.
张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。分子生物学与工程学报,2007,35(6):555 - 557。10.1074 / mcp.M700171-MCP200。
- 61.
notor G, Mhamdi A, Chaouch S, Han Y, Neukermans J, Marquez-Garcia B, Queval G, Foyer CH:植物谷胱甘肽的综合综述。植物细胞环境,2012,35(2):454-484。10.1111 / j.1365-3040.2011.02400.x。
- 62.
赵建军,刘建军,刘建军,等。拟南芥转录调控内参基因的克隆与鉴定。植物生理学报,2005,39(1):5-17。10.1104 / pp.105.063743。
- 63.
用二硝基水杨酸测定糖尿病尿中的糖。中国生物医学工程学报,2009,32(2):387 - 398。
- 64.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M,等:TM4:一个免费的、开源的微阵列数据管理和分析系统。生物工程学报,2003,34(2):374-378。
致谢
我们要感谢Ulrich Wobus, Gatersleben Germany,他慷慨地提供了Legumin B4启动子,Asaph Aharoni提供了用于GC-MS分析的化合物库,Gidi Baum对手稿的批判性阅读。我们非常感谢以色列科学院的Rachel Galon教授,他推动和鼓励了这项研究。这项工作得到了以色列科学基金会(ISF资助231-09)的支持,部分研究资助号为。IS-4248-09 R来自BARD, Yad Hanadiv基金会(通过以色列科学院)和UJIA,英国基金会。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
IM设计并构建了转基因种子的二元结构,进行了转基因种子的表达水平分析,与IG一起进行了氨基酸含量分析和饲养实验;YH对烟草植物进行分子遗传学研究,并进行统计分析;RA设计和协调研究并撰写稿件。所有作者都阅读并批准了最终的手稿。
Ifat Matityahu、Itamar Godo对这项工作也作出了同样的贡献。
电子补充资料
图S2
图S1:(a)拟南芥胱硫氨酸γ-合成酶(AtCGS)蛋白的示意图,以及本研究中使用的结构体。: T的样品1免疫印迹法筛选转基因种子LF和LT种子。图S3: WT和转基因LT种子发育过程中可溶性Met的水平。图S4: LT和WT种子中半胱氨酸和谷胱甘肽生物合成代表性基因的实时荧光定量PCR分析。图S5: LT种子的发芽率。(doc 307kb)
表S2
附加文件2:表S1: WT和LF、lt纯合转基因烟草种子中可溶性氨基酸含量。在发育蒴果的花托中,分别用双蒸馏水(DDW)或DDW中加入5 mM蛋氨酸后,WT烟草种子中可溶性氨基酸含量。表S3:本研究中使用的引物列表。(docx 21kb)
12870 _2013_1410_moesm3_esm.xls
附加文件3:表S4。:The entire data set of the relative contents of metabolites in WT, LF and LT seeds. (XLS 360 KB)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是原创作品要有适当的署名。创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
马蒂亚胡,我,戈多,我,哈查姆,Y。et al。表达反馈不敏感的半胱硫氨酸γ合酶的烟草种子表现出蛋氨酸含量升高和初级代谢谱改变。BMC Plant Biol13日,206(2013)。https://doi.org/10.1186/1471-2229-13-206
收到了:
接受:
发表:
关键字
- 氨基酸
- 胱硫醚γ合酶
- 发芽
- Methinonine
- 新陈代谢
- 种子
- 贮藏蛋白质