摘要
背景
的拟南芥基因组编码全长噬菌体T7 gp4蛋白的同源物,该蛋白也与真核生物Twinkle蛋白同源。虽然噬菌体蛋白同时具有DNA启动酶和DNA解旋酶活性,但在动物细胞中,Twinkle定位于线粒体,由于DNA启动酶域的序列变化,它仅具有DNA解旋酶活性。然而,拟南芥和其他植物的Twinkle同源体保留了噬菌体蛋白两个功能域的序列同源性。的拟南芥闪烁同源基因已被其他研究证明是双重靶向线粒体和叶绿体。
结果
以确定的功能活性拟南芥蛋白质我们获得了全长的基因拟南芥蛋白质并在细菌中表达。纯化后的蛋白同时具有DNA启动酶和DNA解旋酶活性。Western blot和qRT-PCR分析表明拟南芥基因在幼叶和茎尖组织中表达最丰富,如果该蛋白在细胞器DNA复制中起作用,这是预期的。这种表达与同一组织中细胞器定位DNA聚合酶的表达密切相关。通过系统发育分析,来自其他植物物种的同源物具有密切的相似性。
结论
本文给出的结果表明拟南芥噬菌体T7 gp4/Twinkle同源体同时具有DNA启动酶和DNA解旋酶活性,可能为细胞器DNA复制提供这些功能。
背景
DNA复制涉及到几种酶和蛋白质的协调活动。这些酶有助于双链DNA的解开、分离和复制,以产生新的相同的DNA副本[1].DNA解旋酶沿着核酸的一条链单向易位,以促进复制启动。解旋酶利用ATP水解将DNA双螺旋分离成单独的链[2,3.].DNA引物酶催化短RNA寡核苷酸的形成,作为开始DNA合成的引物[4].DNA聚合酶使用引物,并通过添加与模板链匹配的核苷酸来延伸核苷酸链的3'端[1].
单个基因通常负责编码每种复制酶的活性。然而,噬菌体T7基因4蛋白(T7 gp4)和来自T3、P4和其他噬菌体的类似蛋白[4]编码一种具有DNA解旋酶和DNA启动酶结构域的单一蛋白质。T7噬菌体具有两种形式的gp4蛋白,这两种蛋白都是噬菌体基因组复制所必需的。较长的一种有两个锌基序,同时具有DNA启动酶和解旋酶活性,而较短的一种只保留DNA解旋酶活性[5].
大多数真核生物都有T7 gp4蛋白的同源物,被命名为Twinkle (T7 gp4样蛋白,线粒体内核样定位)。该蛋白与噬菌体T7 gp4引物解旋酶蛋白具有密切的序列相似性[6,7].Twinkle是一种位于线粒体DNA复制叉上的六聚体DNA解旋酶,它可以解开双链DNA的部分[8,9].在高等真核生物中,Twinkle同源体缺乏DNA启动酶活性,但被认为在真核生物中具有这种活性疟原虫物种(6,10),拟南芥及其他植物[11,12].该蛋白被认为在线粒体DNA (mtDNA)复制中起关键作用,因为它定位在线粒体核和基质中。在玉米中,Twinkle也被发现与叶绿体类核有关[13],这表明这种蛋白质可能在线粒体和叶绿体中都起作用。
闪烁基因突变导致人类线粒体相关疾病[6,14]和老鼠[15,16].在人类中,该基因的编码区突变与常染色体显性进展性外眼肌麻痹(adPEO)有关,并且通常与多个mtDNA缺失有关,提示其在mtDNA复制中发挥作用[6].在小鼠中,通过RNAi降低Twinkle表达导致mtDNA拷贝数迅速下降[6,17]而该蛋白的过度表达导致肌肉和心脏组织中mtDNA拷贝数的增加[15,18].
当比较来自多种真核生物物种的Twinkle同源体的氨基酸序列时,已经观察到该蛋白质的DNA解旋酶域的保守Walker基序具有高度同源性,这在两篇综述论文中得到了总结[4,5].在一些模式生物中,与T7 gp4蛋白的n端相比,Twinkle的启动酶结构域存在重大差异[19].在人类的Twinkle中,(无功能的)引物酶结构域位于蛋白的n端,与噬菌体T7 gp4以及细菌和噬菌体中的dnaglike引物相同[4,11].但与T7 gp4不同的是,人类Twinkle的n端结构域缺乏T7 gp4中引物合成所需的几个基序,因此预测Twinkle n端区域在人类和后生动物中通常是不活跃的[5].T7 gp4蛋白含有β片结构和半胱氨酸残基,形成两个锌指[7]在Motif 1。T7 gp4引物酶结构域的n端包含锌指基序,但在大多数后生动物物种中,Twinkle缺乏引物聚合时DNA和氨基酸结合所必需的锌结合结构域[5].此外,人类的Twinkle不包含锌指基序的保守半胱氨酸残基,这对DNA结合和引物酶活性至关重要[20.].引物酶域中的锌指基序合成pppAC寡核苷酸引物,对序列5上序列特异性引物合成的初始步骤至关重要”-GTC-3”[21].闪烁蛋白来自拟南芥含有保守序列元素,预计具有DNA启动酶和DNA解旋酶活性。
的拟南芥基因组包含两个噬菌体T7 gp4蛋白的同源物。第一个(At1g30680)与DNA启动酶和DNA解旋酶结构域的保守基序同源[5].该编码序列预测了一个约80 kDa的蛋白,它比全长63,000 kDa的T7 gp4蛋白大,但与在真核生物中报道的Twinkle同源物的大小相似。第二个拟南芥同源物被截断,共享n端引物酶结构域,但完全缺乏c端解旋酶结构域,预测大小为~38 kDa (At1g30660)。本文将截断的基因命名为引物酶同源基因,而全长基因命名为闪烁同源基因。
我们在这里展示拟南芥T7 gp4同源物同时具有DNA启动酶和DNA解旋酶活性,这在高等真核生物中尚属首次报道。该蛋白的基因在快速生长的植物组织中高度表达,并与细胞器DNA聚合酶基因表达相关。
结果
表达拟南芥蛋白质大肠杆菌以及DNA启动酶活性的演示
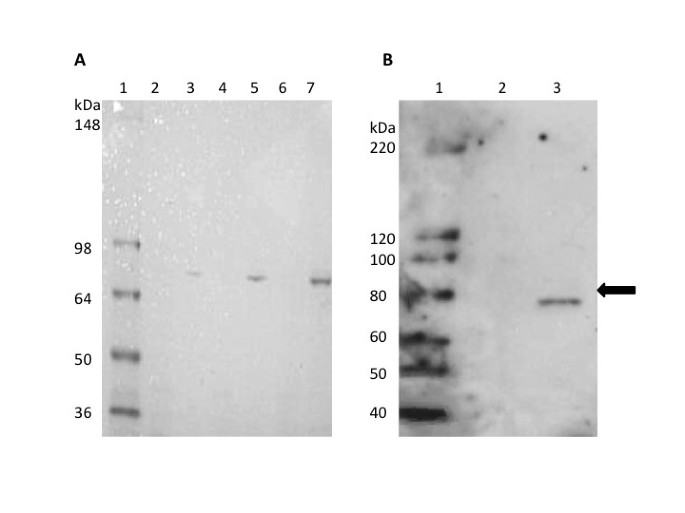
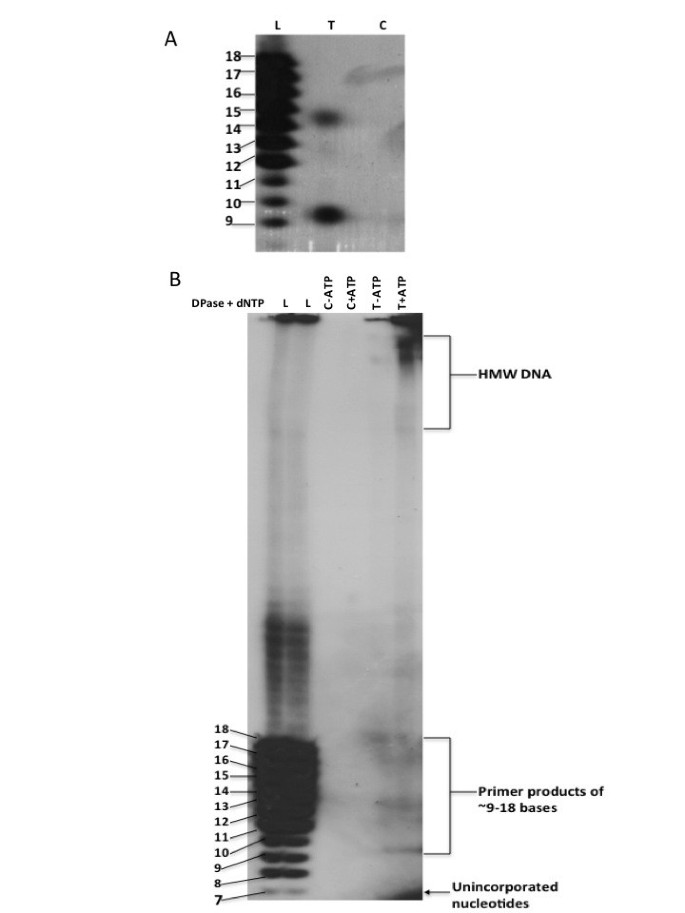
的全长cDNA拟南芥将Twinkle基因克隆到细菌表达载体中,制备蛋白进行酶活性测定。经凝胶染色,纯化的蛋白显示出一个大小适当的主要条带(图1A).其作为表达蛋白的身份是通过western blot分析确认的,该抗体使用一种合成肽从拟南芥蛋白质序列1B).重组蛋白产物比Twinkle同源物的全长编码区更小(~74 kDa),因为它缺乏n端细胞器靶向序列。纯化后的蛋白被用于制备在体外DNA启动酶活性测定。对反应产物的凝胶分析表明,该蛋白能够从单链DNA模板中产生约9-18个碱基的RNA引物(图2).9和14个碱基的引物强度均较强(特写如图)2A),并且在大小上与其他DNA启动物报告的产物相似[22].引物能够被DNA聚合酶扩增成高分子量DNA(图2B),这是DNA引物酶的基本属性,为DNA复制产生引物。引物条带在对照通道中缺失(来自细菌的蛋白质与缺乏引物的空载体)拟南芥基因),表明该活性不是由于细菌DNA启动酶污染纯化的重组蛋白。这为其功能提供了明确的证据拟南芥闪烁同系物作为一种活性DNA启动酶,在高等真核生物中首次报道。
重组蛋白的纯化。面板一个显示了考马斯蓝染色凝胶,从左到右,增加了纯化重组蛋白(3,5,7通道)和对照蛋白(2,4,6通道)的数量。Lane 1,蛋白质分子量标记(Invitrogen SeeBlue 2标记)。2、3道,0.195 ng;4、5车道,0.39 ng;6、7道,0.585 ng。面板B显示纯化蛋白的western blot结果拟南芥闪烁同系物。巷1含有分子量标记(Invitrogen Magic markers)。Lane 2,控制蛋白;Lane 3, 0.5 ng纯化重组蛋白。右边的箭头表示全长80 kDa拟南芥基因产品。重组蛋白略小(~74 kDa),因为它缺乏n端定位序列。
DNA解旋酶活性拟南芥闪烁同源蛋白
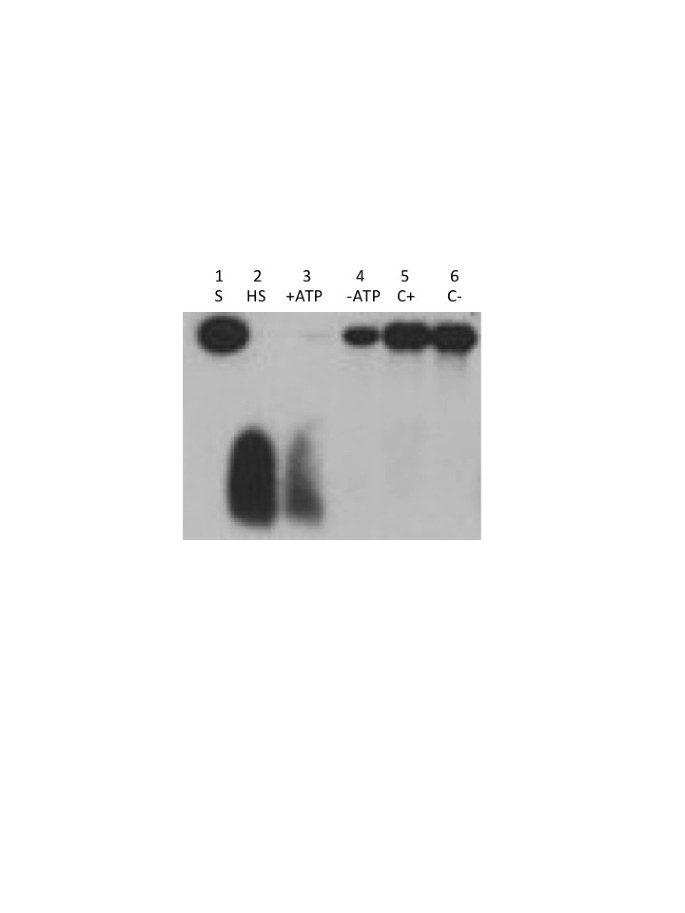
对纯化后的重组蛋白进行DNA解旋酶活性测定。结果表明,该蛋白确实具有预测的atp依赖性DNA解旋酶活性(图3.).对照蛋白制剂(没有插入物的载体)在ATP存在或不存在的情况下都缺乏DNA解旋酶活性(图3.该活性与我们之前在大豆线粒体提取物中检测到的DNA解开活性相似[23].生物化学分析结果表明拟南芥Twinkle同源物同时具有DNA启动酶和解旋酶活性,与噬菌体T7 gp4蛋白相似。
Western blot分析拟南芥闪烁同源表达
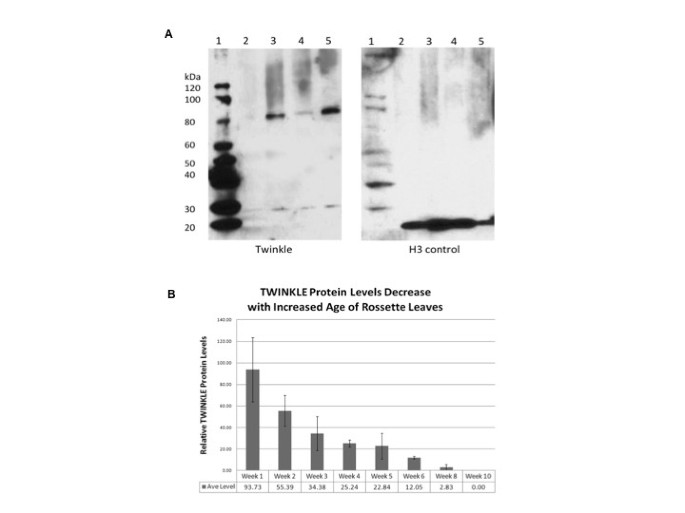
Western blot分析不同组织中Twinkle蛋白的表达水平拟南芥该蛋白在分生组织和年轻叶片组织中含量最高,而在成熟叶片中几乎检测不到4A).每隔一周收集植物的总莲座叶组织,并从每个样本中回收总蛋白进行western blot分析。结果显示,在生长的1-3周内,闪烁蛋白的水平相对较高,随后水平迅速下降,直到5周后几乎检测不到该蛋白(图2)4B).这些结果与不同组织报道的结果一致(图4A). Western blot分析表明,在分离的线粒体和叶绿体中存在Twinkle拟南芥(数据未显示)。
分析拟南芥qRT-PCR检测闪烁同源基因在不同组织中的表达
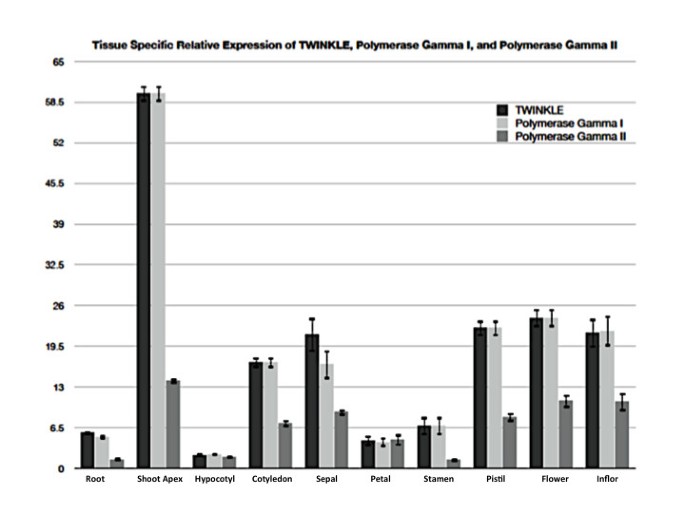
对不同组织的cDNA进行了定量逆转录酶PCR分析拟南芥闪烁基因在茎尖表达量最高(图5),如果闪烁蛋白在快速生长的组织中发挥细胞器DNA复制的作用。在其他发育中的组织中,尤其是子叶和花的不同部分,包括萼片、雌蕊和花序,Twinkle的表达水平也相对较高5).有趣的是,Twinkle的表达水平与DNA Pol γ I的表达水平非常相似(图5),是一种双靶点DNA聚合酶,在植物细胞器DNA复制和修复中发挥作用[24].在具有高闪烁表达的同一组织中,DNA Pol γ II的表达也通常最高(图5).Twinkle与细胞器定位DNA聚合酶表达水平相似[25提示闪烁可能在细胞器DNA复制中发挥作用。
闪烁DNA和蛋白质序列分析
两个独立的研究小组报告了来自各种真核生物物种的Twinkle同源体氨基酸序列的比较,并表明在c端DNA解旋酶结构域的保守Walker基序中有高度的同源性拟南芥蛋白质(4,5].人类,果蝇而且秀丽隐杆线虫闪烁同源物具有DNA解旋酶活性,但缺乏DNA启动酶活性[4,5].仔细检查植物蛋白和动物蛋白中编码蛋白n端引物酶结构域的氨基酸序列,可以发现一些明显的关键差异。Motif 1中由半胱氨酸残基形成的两个锌指存在于T7 gp4蛋白中[7]和大多数真核生物的同源体,但在后生动物(包括人类)中不存在形成锌指的四种半胱氨酸[4,5].对Twinkle同源物与T7 gp4蛋白的氨基酸序列比对分析表明,只有T7 gp4蛋白与Twinkle同源物的氨基酸序列一致拟南芥和其他植物的同源体与T7 gp4蛋白共享所有高度保守的元素[5].在人类蛋白质的启动酶区域内的其他保守基序中观察到其他重要差异,果蝇而且秀丽隐杆线虫,而一些低等真核生物的序列与T7 gp4蛋白共享保守元件[5].特别是,在Motif 1中,人类同源物缺乏锌指结构域,而人类的和果蝇序列缺乏Motif IV和Motif V中高度保守的残基。
的拟南芥Twinkle蛋白含有保守的序列元件,预计同时具有DNA启动酶和DNA解旋酶活性[4].虽然先前对这些蛋白质的氨基酸序列的分析在后生动物蛋白质的启动酶域区域的一些保守位点上发现了关键差异,包括缺乏形成锌指所需的半胱氨酸残基[4,5],我们想知道这些变化是否是由于序列中的微小突变。然而,DNA序列分析表明,人类和人类的同源物氨基酸序列存在差异果蝇不是由于单个碱基的改变,而是由于DNA序列中更显著的改变(图6).的碱基序列差异拟南芥与T7 gp4蛋白相比,闪烁引物酶结构域主要出现在密码子的第三位,不改变氨基酸序列。
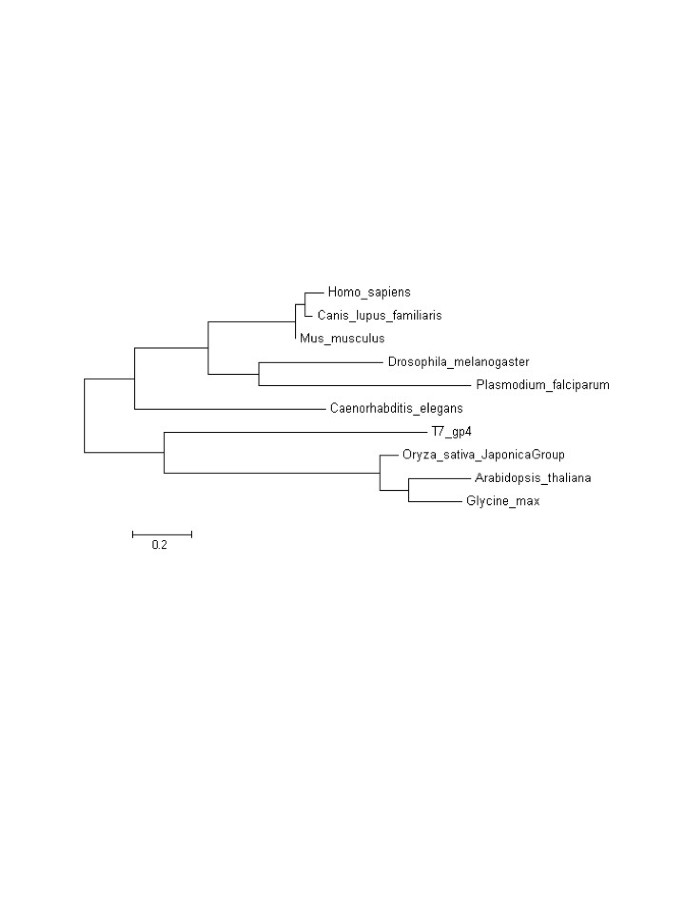
对几种植物和其他物种的Twinkle同源氨基酸序列进行了系统发育分析拟南芥和植物同源物紧密聚集,最类似于噬菌体T7 gp4蛋白(图7).通过对Twinkle同系物分类样本的最大似然系统发育分析,证明了Twinkle蛋白之间的关系。这表明,来自人类和其他动物的Twinkle同源物与T7 gp4蛋白的关系最为遥远,支持了从直接DNA和氨基酸序列比对中观察到的结果。
讨论
Twinkle已被证明是真核细胞线粒体中可复制的DNA解旋酶,在动物细胞中,这种基因表达的突变是致命的[6,14,15,26].Twinkle是噬菌体T7 gp4蛋白的同源物,具有DNA引物酶和DNA解旋酶活性,并含有高度特征的TOPRIM结构域,该结构域在DNA引物、拓扑异构酶和OLD家族核酸酶中保守[4].然而,到目前为止,还没有来自更高真核生物的Twinkle同源物被证明具有DNA启动酶活性。Shutt和Gray分析了几个真核生物物种的Twinkle同源物序列,并提出除了作为DNA解旋酶外,Twinkle还可以作为除后生动物以外的大多数真核生物的线粒体DNA启动酶[5].据我们所知,我们目前的报告是第一次表明在一个植物物种中有Twinkle同系体(拟南芥)同时具有DNA启动酶和DNA解旋酶活性。除了已经提到的截断的引物同源物(At1g30660;但没有关于这种蛋白质是否有功能的信息)没有其他细菌或噬菌体型DNA引物酶同源物被发现拟南芥基因组序列。
序列分析解释了为什么植物同源物具有这两种活性,而动物同源物缺乏DNA引物酶活性(图6).人类Twinkle中启动酶活性的缺失可能是由于缺乏由蛋白n端附近的4个半胱氨酸残基形成的锌指基序,以及蛋白启动酶域保守序列上的其他氨基酸序列差异,这些差异已被证明是负责启动酶活性的(图)6) [4].序列变异也发生在其他后生动物物种中,虽然有些有锌指,但它们在其他保守的基序上有差异。的拟南芥相比之下,同源保留了所有保守的母题[4].系统发育分析进一步支持了这些发现,表明植物Twinkle同源体与T7 gp4蛋白的亲缘关系最密切,而动物同源体的亲缘关系则相当遥远。这些结果表明,双功能的T7 gp4同源体在高等植物中可能是保守的。
的拟南芥Twinkle蛋白可能同时在线粒体和叶绿体中起作用,因为该蛋白已被证明对这两种细胞器具有双重靶向作用[27,28].这些报告是基于对若干核编码的预测n端目标序列的分析拟南芥蛋白质与GFP编码区融合。然而,已有研究表明,融合蛋白的靶向性可能受到n端序列与GFP序列上下文的影响[28,29].最近一份关于玉米质体蛋白质组的报告显示,在叶绿体类核中存在Twinkle [13].
线粒体基因组的大小差异很大,从脊椎动物和无脊椎动物的约16.5 kbp,到酵母的70-100 kbp和植物的200-2000 kbp。动物mtDNA的复制已被详细地描述,在原始模型中,双链DNA的每条链在不同的时间复制,最初的复制由线粒体RNA聚合酶合成的短转录本启动[30.].第二链只有当它通过第一链的进展成为单链时才能复制,允许形成特征结构以促进该链的复制起始。在酵母和植物中,mtDNA复制似乎更为复杂,可能涉及一种依赖重组的复制机制[23,31- - - - - -34].在这种情况下,如果入侵链为DNA合成提供启动功能,DNA启动可能就不需要了。然而,即使在通过重组机制复制的噬菌体系统中,在DNA复制的某些阶段,在滞后链上的引物合成仍然需要DNA引物酶[4].
在一些动物和原生生物细胞中已经报道了一种独特的mtDNA启动酶活性,在人类细胞中也报道了mtDNA启动酶活性,但尚未发现具有这种活性的独特人类蛋白质。有人认为动物细胞中的DNA引物酶与mtDNA (γ)聚合酶密切相关,因此很难单独分离[35].据报道,锥虫mtDNA引物酶为70 kDa [36],而在酵母中,一种67 kDa的mtDNA引物酶已被鉴定[37],它们的大小都接近T7 gp4和Twinkle。我们对动物mtDNA复制的理解由于来自单一复制起点的链耦合双向复制的报道而变得复杂,这种复制本质上应该需要DNA引物酶来为滞后链合成引物[30.,38,39].目前尚不清楚在具有高度紧密线粒体基因组的物种(包括人类)中是否存在或需要一个单独的mtDNA启动酶[40].最近有研究表明在体外,人线粒体RNA聚合酶负责启动滞后链mtDNA的合成。小动物线粒体基因组复制的启动可能是由线粒体RNA聚合酶合成的短转录本提供的[40,41].
从豌豆叶绿体中纯化并鉴定了一种DNA启动酶[42],由该制剂合成的引物在尺寸上与由纯化物合成的引物相似拟南芥闪烁同系物。豌豆酶比豌豆酶大(~90 kDa)拟南芥闪烁同源,但未鉴定DNA解旋酶活性。CtDNA复制涉及多个复制起点和双向DNA合成[42,43],这需要DNA启动酶活性来合成滞后链。
细胞器DNA复制在植物中似乎不同(与动物相比),植物具有非常大而复杂的线粒体基因组,可能需要多个位点的滞后链DNA合成。重组介导复制的作用[33,34可能会减少对引物合成的引物的需求,用于细胞器DNA复制,因为入侵的DNA链可以提供3”结束DNA合成。然而,即使在这种情况下,植物也可能需要细胞器DNA启动酶。噬菌体T4通过多种机制复制,包括依赖重组的复制,并需要DNA引物酶。我观察到拟南芥Twinkle蛋白在茎尖和包括嫩叶在内的其他发育组织中表达水平最高,这为Twinkle同源体在植物细胞器DNA复制中的作用提供了强有力的支持,这与其在其他物种中的作用相似[4,5].
人类闪烁基因的突变已被证明会导致mtDNA拷贝数和疾病的急剧减少[17].研究发现,在培养的人类细胞中,rnai介导的Twinkle表达的减少导致mtDNA拷贝数的快速下降,而在小鼠组织中,Twinkle的过表达与mtDNA拷贝数的增加有关[15,26].在每一种情况下,这种效应都与蛋白质的DNA解旋酶活性有关。我们展示了这个单一的蛋白质拟南芥在体外具有DNA启动酶和DNA解旋酶活性,与噬菌体T7 gp4蛋白活性相同。
结论
的拟南芥噬菌体T7 gp4蛋白的同源物已被证明具有与噬菌体蛋白相似的DNA启动酶和DNA解旋酶活性。它在活跃生长的组织中表达水平最高,这表明它可能在细胞器DNA复制中发挥作用。在植物中发现了两种DNA聚合酶,据报道它们都是线粒体和叶绿体的双重靶点[28,44].很可能拟南芥噬菌体T7 gp4同源体与这两种DNA聚合酶一起完成细胞器DNA复制。即使mtDNA通过依赖重组的机制进行复制[23,33,34], DNA启动可能是后链DNA复制所必需的。这拟南芥蛋白质也可能在控制植物mtDNA(也可能是ctDNA)拷贝数中发挥作用,如在动物中观察到的[5,17],但这一确定将需要额外的实验,这将是我们实验室未来工作的主题。
方法
身份证明拟南芥闪烁同系物
一个完整的《闪烁》同源词在拟南芥基因组(At1g30680,蛋白分子量80401.9 Da)。在第一个基因附近也存在第二个截断的同源物(At1g30660,分子量为37,806.9 Da),但仅包含蛋白质的引物酶结构域,并在连接子区域附近结束[45]连接启动酶和解旋酶结构域。本研究只检测了全长基因(At1g30680)。
重组表达拟南芥闪烁同系物
At1g30680的全长cDNA来自日本Riken公司。该基因的全长编码区预测了709个氨基酸的多肽,并且MitoProt程序[46]预测了该蛋白DNA引物酶结构域中锌指等保守元素之前的氨基酸91之后的裂解位点。我们在pEXP5-NT/TOPO表达载体(Invitrogen)中构建了整个基因保守编码区,但缺少n端91个氨基酸的DNA序列。构念随后转化为大肠杆菌BL21株(Invitrogen)。总共500ml的LB被用来培养细菌。在达到过量之后6000.4 ~ 0.6时,在培养基中加入IPTG至终浓度0.5 mM诱导目标蛋白的表达。细胞在30°C下生长4小时,并通过离心收集。在相同的条件下,一个含有缺乏该基因插入的空载体的对照菌株被培养。用ProBond镍螯合树脂(Invitrogen)在相同条件下纯化重组蛋白和对照样品。使用本地条件,并按照手册中的描述进行纯化。用凝胶电泳和western blot分析蛋白纯度。
DNA启动酶活性测定
重组蛋白的DNA引物酶活性采用先前发表的方法检测[42]以单链M13 DNA为模板。为了消除重组蛋白部分中存在细菌DNA引物酶的可能性,加入了对照细菌部分。单链M13 DNA与0.5 ng probond纯化的重组蛋白或对照蛋白片段在含α的rntp存在下孵育32P-ATP (MP生物医学)。反应产物在20%变性聚丙烯酰胺凝胶(1X TBE中尿素含量为6%)中分离。End-labeled益生元(dT)12 - 18用作尺寸标记。电泳后,凝胶干燥并暴露在x射线胶片上。
DNA解旋酶活性测定
按照Song [47].的substrate was prepared by annealing (heating for 5 min to 65°C in 40 mM Tris–HCl, pH 7.8, 50 mM NaCl and slowly cooling to room temperature for 20–30 min) single-stranded M13 circular DNA with a complementary oligonucleotide (5”GTAAAACGACGGCCAGT 3”)标记在5”结束使用T4多核苷酸激酶(New England Biolabs)和γ32P-ATP (MP生物医学)。底物与0.5 ng重组蛋白在反应缓冲液(10 mM Tris-HCl, pH 8.0, 8 mM MgCl)中孵育2, 1 mM二硫苏糖醇,5 mM ATP, 1 ng32p标记解旋酶底物)30min后,加入EDTA至2mm终止反应,反应产物通过天然TBE 6%聚丙烯酰胺凝胶电泳分离。同样的细菌蛋白对照也包括在内。然后将凝胶干燥并暴露在x射线胶片上。
Western blot分析Twinkle同源基因在不同组织中的表达
从动物的不同组织中制备蛋白质片段拟南芥在液氮中研磨,并悬浮在1X sds加载缓冲液中。将蛋白质加热到95°C 5分钟,并在8-20% SDS-PAGE凝胶中电泳分离。将蛋白质转移到PVDF膜上,在5%脱脂牛奶中阻断后,将膜与在兔体内培养的抗体(Sigma-Genosys公司)孵育,该抗体针对来自Twinkle蛋白独特区域的合成肽(KASRIVIATDGDGPG)。这个序列在完整长度和截断长度上都是共享的拟南芥基因(At1g30680和At1g30660)将肽抗原序列与整个抗原序列进行比较拟南芥蛋白质组,以确保它不与任何其他蛋白质共享同源除了闪烁同源(NCBI-Blast)。对组蛋白H3蛋白进行对照印迹,以使信号强度正常化。使用Pierce Supersignal Western化学发光试剂盒检测结合抗体,然后暴露于x射线胶片。
为了进行时间过程分析,从拟南芥从1周龄开始,每隔一周种植一次。组织在液氮中快速冷冻,并在-80°C保存。用1X SDS-loading缓冲液从50 mg粉碎和均质组织中提取总蛋白[48].样品定量(BioRad RC DC蛋白检测试剂盒),SDS-PAGE电泳前归一化。如上所述,进行西方印迹试验。蛋白质水平通过Un-Scan-It软件(Silk Scientific, Orem, Utah)从三个独立的western blot中测量的平均像素强度来确定。
qRT-PCR基因表达分析
使用PureLink RNA Mini Kit (Invitrogen)从幼体中分离RNA拟南芥幼苗。对于非常小的组织,用了200多株幼苗来获得足够的样本。茎尖组织作为幼芽的最尖端,包括茎尖分生组织。RNA定量,加入1 μg,用SuperScriptIII (Invitrogen)进行逆转录反应。这些反应的cdna用100 μl无菌水稀释,并按照制造商(Roche)的描述添加到qPCR反应中。qPCR反应由1X SYBR Green PCR Master Mix (Roche)组成,每个引物50 nM。引子拟南芥闪烁基因有5个”-TCCCCAGAGTCCCAACTCCTGTTGA-3”和5”-TCCCTGTTCCGCCAATTTACGCC-3”;DNA聚合酶γ 1 (At3g20540)为5”-CCTGAATACCGTTCACGTGCCCA-3”和5”-AGCCGCACTTCCCTGAACAGGA-3”, DNA聚合酶γ 2 (At1g50840)为5”——TTCCGGCGTCAAAGTCACGTGC-3”和5”-TGCACTTCCCTGGACTGGAGTGT-3”.在95°C孵育5分钟后,在LightCycler 480系统(Roche)中进行45个循环(95°C 10秒,58°C 10秒,72°C 20秒)。使用ΔΔCt方法计算基因表达的折叠变化[49],以Tub 4微管蛋白基因(At5g44340)为内控。
系统发育分析
从Gen Bank下载了Twinkle同源基因的蛋白质序列,其登录号如下:智人(NP_068602.2),秀丽隐杆线虫(F46G11.1),黑腹果蝇(NP_609318.1),恶性疟原虫(NP_702000.1), T7 gp4 (P03692.1),亩骶(AAL27647.1),犬类狼疮(XP_543974.1),拟南芥(ACI49800.1),大豆(XP_003546288.1),栽培稻Japonica组(BAD46002.1)。多序列比对使用MUSCLE [50],采用基于JTT矩阵模型的最大似然法推断其进化史[51].给出log似然值最高的树(−3556.6701)。启发式搜索的初始树如下所示。当共有位点数< 100或小于总位点数的四分之一时,采用最大简约法;另外采用带有MCL距离矩阵的BIONJ方法。树是按比例绘制的,分支长度以每个站点的替换数来衡量。该分析涉及10个氨基酸编码序列。采用标准遗传密码表对编码数据进行翻译。所有场地覆盖率低于95%的职位都被淘汰。也就是说,在任何位置都允许小于5%的对齐间隙、缺失数据和不明确的碱基。 There were a total of 199 positions in the final dataset. Evolutionary analyses were conducted in MEGA 5 [50].
缩写
- 存在:
-
定量逆转录酶PCR
- mtDNA:
-
线粒体DNA
- ctDNA:
-
叶绿体DNA
- 闪烁:
-
T7 gp4样蛋白与线粒体内核样定位。
参考文献
科恩伯格A,贝克T: DNA复制,第2卷。纽约,纽约州:W.H.弗里曼公司;1991.
Lionnet T, Spiering MM, Benkovic SJ, Bensimon D, Croquette V:噬菌体T4 gp41解旋酶的实时观察揭示了一种解旋机制。美国国家科学研究院。2007, 40(5): 379 - 379。10.1073 / pnas.0709793104。
杜谷K,彭华,马丽娟KJ:大肠杆菌引物酶与DnaB解旋酶在复制叉功能相互作用的结构域的鉴定。中国生物医学工程学报,1994,26(6):469 - 482。
Ilyina TV, Gorbalenya AE, Koonin EV:细菌和噬菌体启动酶-解旋酶系统的组织和进化。中华生物医学杂志,1992,34(4):351-357。10.1007 / BF00160243。
shutter TE, Gray MW: Twinkle,线粒体复制DNA解旋酶,广泛存在于真核生物辐射中,也可能是大多数真核生物的线粒体DNA启动酶。中华生物医学杂志,2006,62(5):588-599。10.1007 / s00239 - 005 - 0162 - 8。
Spelbrink JN, Li FY, Tiranti V, Nikali K, Yuan QP, Tariq M, Wanrooij S, Garrido N, Comi G, Morandi L, Santoro L, Toscano A, Fabrizi GM, Somer H, Croxen R, Beeson D, Poulton J, Suomalainen A, Jacobs HT, Zeviani M, Larsson C:人类线粒体DNA缺失与编码Twinkle基因突变相关,Twinkle是一种定位于线粒体的噬菌体T7基因4样蛋白。植物学报,2001,28(3):223。10.1038/90058。
Bernstein JA, Richardson CC:噬菌体T7基因4蛋白的7-kDa区域是启动酶所必需的,而不是解旋酶活性所必需的。美国国家科学研究院。1988, 85(2): 396-400。10.1073 / pnas.85.2.396。
王志强,王志强,王志强:六聚体解旋酶的结构与功能研究生态学报,2000,29(1):457 - 457。10.1146 / annurev.biochem.69.1.651。
Korhonen JA, Gaspari M, Falkenberg M: TWINKLE具有5' -> 3' DNA解旋酶活性,特异性受线粒体单链DNA结合蛋白刺激。中国生物医学工程学报,2003,27(4):457 - 457。10.1074 / jbc.M306981200。
肖文芳,孙晓明,杨森,王晓明,王晓明,王晓明,王晓明,王晓明。恶性疟原虫DNA复制酶复合体的研究进展。中国生物医学工程学报,2005,26(2):344 - 344。10.1016 / j.molbiopara.2005.02.002。
Leipe DD, Aravind L, Grishin NV, Koonin EV:细菌复制解旋酶DnaB由RecA复制进化而来。Gen res 2000, 10(1): 5-16。
Emanuelsson O, Nielsen H, von Heijne G: ChloroP,一种基于神经网络的预测叶绿体转运肽及其切割位点的方法。生物工程学报,1999,8(5):978-984。10.1110 / ps.8.5.978。
Majeran W, Friso G, Asakura Y, Qu X, Huang M, Ponnala L, Watkins KP, Barkan A, van Wijk KJ:玉米叶片质体和叶绿体发育中的核类蛋白组:核类功能的新概念框架。植物生理学报,2012,29(1):357 - 357。10.1104 / pp.111.188474。
Wanrooij S, Luoma P, van Goethem G, van Broeckhoven C, Suomalainen A, Spelbrink JN:闪烁和POLG缺陷增强mtDNA控制区突变的年龄依赖性积累。中国生物医学工程学报,2004,32(10):3053-3064。10.1093 / nar / gkh634。
Tyynismaa H, Sembongi H, Bokori-Brown M, Granycome C, Ashley N, Poulton J, Jalanko A, Spelbrink JN, Holt IJ, Suomalainen A: Twinkle解旋酶对mtDNA维持和调节mtDNA拷贝数至关重要。人类分子化学,2004,13(24):3219-3227。10.1093 /物流/ ddh342。
Tyynismaa H, Mjosund KP, Wanrooij S, Lappalainen I, Ylikallio E, Jalanko A, Spelbrink JN, Paetau A, Suomalainen A:突变线粒体解旋酶Twinkle导致小鼠多重mtDNA缺失和迟发性线粒体疾病。美国国家科学研究院。2005, 32(3): 357 - 357。10.1073 / pnas.0505551102。
Sarzi E, Goffart S, Serre V, Chretien D, Slama A, Munnich A, Spelbrink JN, Rotig A:闪光解旋酶(PEO1)基因突变导致线粒体DNA缺失。神经神经学报,2007,32(6):579-587。10.1002 / ana.21207。
Inoue T, Ide T, Tyynismaa H, Yoshida M, Ando M, Tanaka A, Todaka K, Kang D, Suomalainen A, Sunagawa K:线粒体DNA解旋酶的过表达,Twinkle,改善小鼠心脏重构和衰竭。流通决议,2008,118 (18):S314-S315。
Kusakabe T, Richardson CC:噬菌体T7的基因4 DNA引物酶在引物酶识别位点介导核糖寡核苷酸的还原和延伸。中国生物医学工程学报,1997,27(4):344 - 344。10.1074 / jbc.272.19.12446。
Kusakabe T, Richardson CC:锌基序在DNA启动子序列识别中的作用。中国生物医学工程学报,1996,27(3):379 - 379。10.1074 / jbc.271.32.19563。
Kusakabe T, Hine AV, Hyberts SG, Richardson CC:噬菌体T7启动酶Cys4锌指在序列特异性单链DNA识别中的应用。美国国家科学研究院。1999, 36(8): 497 - 497。10.1073 / pnas.96.8.4295。
Laquel P, Litvak S, Castroviejo M:小麦DNA引物酶(RNA引物体外合成,光化学交联结构研究,DNA聚合酶对引物酶活性的调节)。中国农业科学,2004,27(4):457 - 457。
王晓燕,王晓燕,王晓燕,王晓燕,王晓燕,王晓燕。大豆线粒体DNA重组活性的研究。中华分子生物学杂志,2006,356(2):288-299。10.1016 / j.jmb.2005.11.070。
拟南芥亲本JS, Lepage E, Brisson N:两种poly - like细胞器DNA聚合酶的分化作用。植物生理学报,2011,26(1):344 - 344。10.1104 / pp.111.173849。
卡普JD,尼尔森BL:拟南芥细胞器DNA聚合酶IB突变体显示mtDNA水平降低,线粒体面积密度降低。《植物物理学》2012,出版,10.1111/ pll .12009
小鼠线粒体DNA缺陷模型及其与人类疾病的相关性。生态环境学报,2009,10(2):137-143。10.1038 / embor.2008.242。
Carrie C, Kühn K, Murcha MW, Duncan O, Small ID, O 'Toole N, Whelan J:拟南芥双靶向蛋白的研究进展。植物学报,2009,27(6):344 - 344。10.1111 / j.1365 - 313 x.2008.03745.x。
Christensen A, Lyznik A, Mohammed S, Elowsky CG, Elo A, Yule R, Mackenzie SA:拟南芥双结构域双靶向细胞器蛋白前序列可以使用非aug起始密码子。植物学报,2005,17:2805-2816。10.1105 / tpc.105.035287。
Mackenzie SA:植物细胞器蛋白靶向:一个仍在建设中的交通计划。细胞生物学进展,2005,15:548-554。10.1016 / j.tcb.2005.08.007。
克莱顿D:线粒体DNA复制:我们所知道的。中国生物医学工程学报,2003,29(4):344 - 344。
张志刚,张志刚,张志刚,张志刚。芸苔属植物线粒体DNA重组研究。中国植物科学,2009,17(6):629-635。10.1016 / j.plantsci.2009.08.002。
Backert S, Nielsen BL, Borner T:环的奥秘:高等植物线粒体基因组的结构和复制。植物科学进展,1997,2(12):477-483。10.1016 / s1360 - 1385(97) 01148 - 5。
Backert S, Borner T:高等植物线粒体中DNA复制和重组的噬菌体t4样中间体Chenopodium专辑(L.).当前Gen. 2000,37: 304-314。10.1007 / s002940050532。
Oldenburg DJ, Bendich AJ:来自地苔Marchantia polymorpha的线粒体DNA:圆形排列的线性分子,从头到尾的串联体,和一个5'蛋白质。中华分子生物学杂志,2001,31(3):549-562。10.1006 / jmbi.2001.4783。
王涛,克莱顿·达:人类线粒体DNA启动酶的分离与表征。中国生物医学工程学报,1998,26(4):528 - 528。
李志刚,李志刚:线粒体DNA启动酶对细胞生长和动体DNA复制有重要作用锥虫属brucei.中国生物医学工程学报,2010,30:1319-1328。10.1128 / MCB.01231-09。
Murthy V, Pasupathy K:线粒体DNA启动酶的特征酿酒酵母.生物工程学报,1994,19:1-8。10.1007 / BF02703462。
王志刚,王志刚,王志刚:哺乳动物线粒体DNA前链和后链合成的研究进展。光子学报,2000,20(5):515-524。10.1016 / s0092 - 8674(00) 80688 - 1。
Bogenhagen DF, Clayton DA:结束语:线粒体DNA复制泡沫尚未破裂。生物科学进展,2003,28(8):404-405。10.1016 / s0968 - 0004(03) 00165 - 8。
王丽娟,王丽娟,王丽娟,王丽娟,王丽娟。人线粒体RNA聚合酶诱导延迟链DNA合成的研究进展。美国国家科学研究院。2008, 35(4): 344 - 344。10.1073 / pnas.0805399105。
Fuste JM, Wanrooij S, Jemt E, Granycome CE, Cluett TJ, Shi Y, Atanassova N, Holt IJ, Gustafsson CM, Falkenberg M:线粒体RNA聚合酶是激活轻链DNA复制起源的必要条件。Mol Cell, 2010, 37(1): 67-78。10.1016 / j.molcel.2009.12.021。
孙丽娟,李志刚,李志刚:豌豆叶绿体DNA启动酶的研究进展。植物化学学报,1997,16:1019-1034。10.1007 / BF00016074。
Tuteja N, Phan TN, Tewari KK:豌豆叶绿体DNA解旋酶的纯化和鉴定,该酶在3 '到5 '方向易位。中国生物医学工程学报,1996,23(1):344 - 344。10.1111 / j.1432-1033.1996.0054q.x。
小野Y, Sakai A, Takechi K, Takio S, Takusagawa M, Takano H: NtPolI-like1和NtPolI-like2,从BY-2培养的烟草细胞中分离出来的细菌DNA聚合酶I同源物,编码DNA聚合酶,参与质体和线粒体的DNA复制。中国生物医学工程学报,2007,29(4):489 - 497。10.1093 /卡式肺囊虫肺炎/ pcm140。
Guo S, Tabor S, Richardson CC:噬菌体T7基因4蛋白解旋酶和启动酶结构域之间的连接子区域对六聚体的形成至关重要。中国生物医学工程学报,1999,27(4):339 - 339。10.1074 / jbc.274.42.30303。
Claros MG: MitoProt,用于研究线粒体蛋白质的Macintosh应用程序。中国生物工程学报,2004,19(4):441-447。
宋D:植物线粒体中的同源链交换和DNA解旋酶活性。学校:杨百翰大学;2005.
Weigel D, Glazebook J:拟南芥:实验室手册。美国纽约冷泉港:冷泉港实验室出版社;2002.
Livak K, Schmittgen T:使用实时定量PCR和2-(−δ δ C(T)方法分析相关基因表达数据。方法,2001,25:402-408。10.1006 / meth.2001.1262。
田村K,彼得森D,彼得森N, Stecher G, Nei M,库马尔S: MEGA5:分子进化遗传学分析的最大似然。Mol Biol Evol:进化距离和最大简约法2011.
李文杰,李志强,李志强,等。蛋白质序列突变数据矩阵的快速生成。应用科学学报,2002,26(3):379 - 379。
确认
我们感谢Elisabeth Haws, Tatiana Alarcon, Cynthia Perry和Kali Tibbitts对一些实验的帮助。这项研究得到了美国国立卫生研究院和杨百翰大学指导环境资助计划的部分资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
JDA进行了组织特异性western blot和系统发育分析,并帮助撰写了手稿。BL帮助构思了该项目,构建了重组蛋白,并对其进行了纯化,并进行了一些初步分析。JDC进行qRT-PCR和western blot时间过程分析。TH进行DNA和氨基酸序列分析。BLN帮助构思了这个项目,进行了引物酶和解旋酶分析,并与JDA一起撰写了手稿。所有作者都阅读并批准了手稿。
Joann Diray-Arce和Liu Bin对这项工作做出了同样的贡献。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
迪雷-阿尔斯,刘博,刘博,乔建平et al。的拟南芥At1g30680基因编码与噬菌体T7 gp4蛋白的同源物,该蛋白同时具有DNA启动酶和DNA解旋酶活性。BMC植物生物学13日,36(2013)。https://doi.org/10.1186/1471-2229-13-36
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-36
关键字
- DNA引物酶
- DNA解旋酶
- 噬菌体T7 gp4
- 闪烁
- 细胞器DNA复制