摘要
背景
植物器官的脱离发生在脱落带(AZs)。在植物生长过程中,AZ形成,但在细胞感知到促进分离的信号并开始分离之前不会进一步发展。一旦感知到信号,立即启动分离;如果没有信号,则不诱导脱落,器官仍然附着在植物上。然而,在脱落前AZ中保持对脱落信号响应能力的基因很少受到关注。最近,我们发现番茄(茄属植物lycopersicum转录因子盲目的(提单),杯状(吐唾沫),侧抑制器(Ls)和一个西红柿WUSCHEL同系物(LeWUS)在脱落前组织、花梗AZs中特异表达。为了提高我们对脱落的理解,我们在这里分析了番茄花梗在脱落前阶段的全基因组基因表达。
结果
我们检测了三个番茄花梗区域,即AZ和两侧近端- (Prox)和远端- (Dis)区域的转录组,鉴定出89个基因在AZ中比Prox和Dis更优先表达。这些基因包括几个调节顶端或腋生芽分生组织活性的转录因子。此外,与生长素活性相关的基因以Prox-Dis区域特异性的方式受到调节,表明生长素在花梗中存在梯度。一个影响花过渡的MADS-box基因优先在Prox区表达,而其他用于花器官鉴定的MADS-box基因则优先在Dis区表达,这表明形态相似的Prox区和Dis区具有不同的身份。我们还分析了已知调控因子的表达;在花期花梗,提单,吐唾沫,Ls和LeWUS在AZ区维管细胞中表达。然而,在发出分离信号后,提单被上调了,但是吐唾沫,Ls和LeWUS被下调了,这意味着什么提单可能是分离的正调节因子,但其他可能是负调节因子。
结论
本研究揭示了番茄花梗在开花时的区域特异性基因表达,并确定了可能决定脱落前花梗生理特性的因素。本研究发现的区域特异性转录调控因子和生长素活性基因可能在没有信号的情况下阻止花脱落或建立响应脱落信号的能力。
背景
植物可以脱离老化的叶子、未受精的花朵、患病或受损的器官和成熟的果实或成熟的种子。这些脱落过程使植物能够循环利用营养物质以持续生长,发育适当的器官,在疾病中存活,并促进繁殖[1,2].脱落发生在预定的位置,称为脱落带(AZs)。AZ含有一组缺乏大液泡的小细胞,这表明这些细胞可能处于未分化状态[3.].由于脱落对作物产量和品质有重大影响,因此控制脱落一直是一个重要的农业问题。例如,在驯化稻米等谷物的过程中,人类选择了种子碎裂较少的种质(栽培稻)、玉米(玉米)和小麦(小麦) [4- - - - - -6].同样,在番茄(茄属植物lycopersicum),具有抑制花梗发育的突变的“无节”品种已被广泛用于机械收获,因为在没有花梗的情况下,茎和萼片仍留在植物上,允许在没有绿色组织的情况下收获果实。
分离可分为四个主要步骤[7[a]:(1) AZ发育,(2)获取响应脱落促进信号的能力,(3)激活脱落,(4)通过AZ主体侧保护层的分化来封闭断裂。番茄果实/花花梗中AZ的发育已经被广泛研究,并确定了影响花梗AZ发育的几个突变。例如,无接缝的(j),jointless2(j2)突变完全抑制AZ分化和侧抑制器(ls)突变部分损害AZ发育[1,8- - - - - -10].的j和ls基因座分别编码一个MADS-box转录因子和一个GRAS家族转录因子[11,12].的j2位点仍有待鉴定,但预计其编码一种c端结构域(CTD)磷酸酶样蛋白[13].最近,我们发现MADS-box转录因子MACROCALYX (MC)被认为是萼片大小的调节因子[14],也通过与基因编码的MADS-box蛋白相互作用调控番茄花梗AZ的发育j轨迹(10].
在其他系统中,对参与AZ结构发育的基因的研究(step1)发现了几个调节AZ形成的基因。在拟南芥中,MADS-box转录因子基因SEEDSTICK(STK)和bHLH转录因子基因HECATE3(HEC3)调节种子AZs的形成[15,16),而BLADE-ON-PETIOLE1(BOP1),BOP2编码BTB/POZ结构域和含有npr1样蛋白的锚蛋白重复序列,调控花器官AZs的形成[17].在水稻中,种子破碎所需的花梗AZ的形成是由qSH1这是1号染色体上一个主要的种子碎裂数量性状位点,编码一个bell型同源盒转录因子SH4该基因是4号染色体主要的种子破碎数量性状位点,编码含有MYB3 dna结合域的蛋白。水稻花梗AZ的形成也受粉碎ABORTION1(SHAT1)编码AP2家族转录因子SHATTERING1同系物(OsSH1)编码YAB家族转录因子CTD磷酸酶样蛋白(OsCPL1) [6,18- - - - - -21].
对步骤3和步骤4的研究,即脱落的激活和保护层的分化,也揭示了脱落所需的几个因素。例如,植物激素生长素和乙烯刺激促进脱落的信号并以拮抗的方式调节脱落的发生;生长素抑制脱落,乙烯促进脱落[1,2,22].细胞壁降解和修饰酶在AZ分离层中被激活[23- - - - - -26].此外,转录因子、受体样激酶、信号肽、染色质重塑因子和膜转运蛋白也参与了脱落的激活[24].此外,全基因组转录组分析显示,多种植物激素信号、细胞壁降解和防御相关蛋白的基因在脱落过程中上调[27- - - - - -29].
尽管许多研究已经考察了分离的其他步骤,但驱动第二步的机制,即对分离信号作出反应的能力的获得,仍然是一个谜。在脱落发生之前,AZ具有响应脱落启动信号的能力,但AZ细胞没有启动脱落。例如,番茄花梗AZs在花期接收到促离信号之前,一直处于空转状态。一旦信号被提供,AZ细胞立即开始脱落,但如果花成功授粉,那么AZ细胞保持小,随着AZ结构变厚以支持生长的果实而分裂。第二阶段的细胞看起来是静止的和不活跃的,但我们最近发现番茄花梗的AZs表现出明显的基因表达模式;花花梗AZs特异性表达盲目的(提单),杯状(吐唾沫),Ls还有一个西红柿WUSCHEL同系物(LeWUS),而这种表达在缺乏az的突变体的花梗中不存在[10].这些转录因子基因在花梗AZs中的功能尚不清楚,但已知这些基因在茎尖或腋窝分生组织中起关键作用[10,12,30.- - - - - -32].它们的az特异性表达表明,这些转录因子可能在脱落前阶段起作用,可能阻止花脱落或建立响应脱落信号的能力。
为了确定其他可能参与番茄花梗脱落的基因,我们进行了转录组分析,比较了AZs中两个花梗区域的表达谱,在花侧(远端区域;Dis)和在花序侧(近端区域;Prox,图1A).检查这些花梗区域的特定表达特性提供了对每个花梗区域的特性和脱落前状态下细胞活性的见解。此外,我们进一步表征了四种先前鉴定的转录因子,检查了详细的表达模式刘易斯,比尔,GOB和Ls在开花期。我们的研究结果表明,这四个基因在诱导脱落时表现出显著的表达变化,表明这些基因在脱落的发生中起着关键作用。
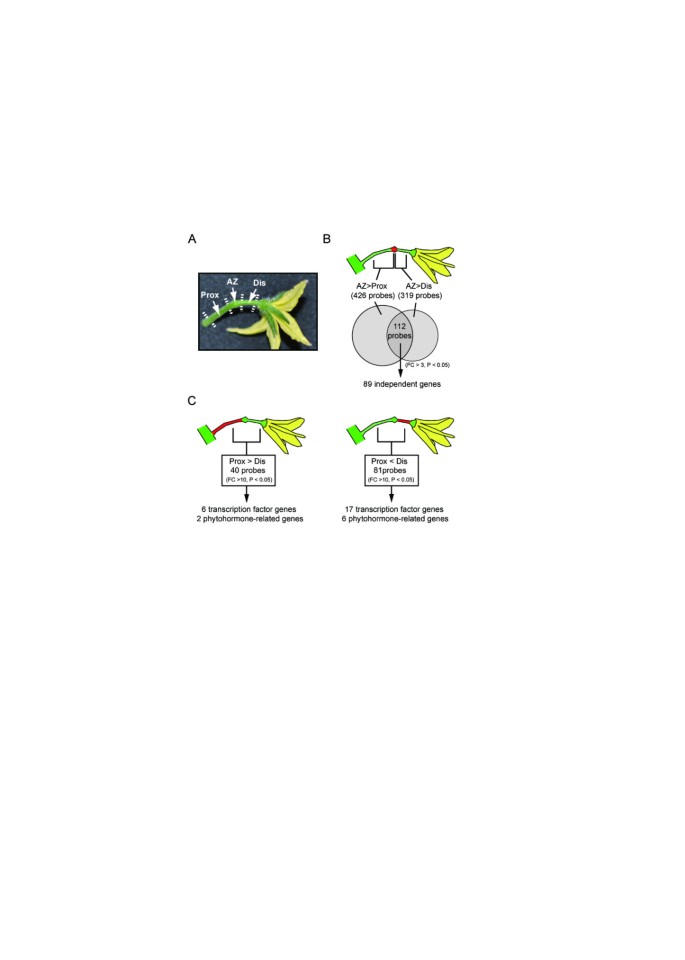
表达芯片分析筛选番茄不同花梗区差异表达基因。(一个)本研究中使用的花梗区域。番茄脱落带(AZs)形成于花梗的中间区域,具有关节状结构,在关节状结构中形成脱落沟。花梗区和花序主干之间的区域称为近端区(Prox),花梗区和花之间的区域称为远端区(Dis)。从5 - 20个花梗中提取每个区域的RNA。(B)用3个独立制备的样品进行微阵列分析,比较AZ与Prox或Dis在花期的表达情况。维恩图中的两个圆圈表示来自AZ的信号高于来自Prox或Dis的信号的探针数量,本研究对重叠的112个探针进行了进一步研究。通过合并编码相同基因的探针的结果,我们发现89个独立的基因在AZ中上调。C)筛选Prox和Dis之间转录因子和植物激素相关基因的差异表达示意图。通过芯片分析比较Prox和Dis的表达谱,并从两个区域之间表达模式有显著差异的基因中选择转录因子或植物激素相关基因。
结果
比较转录组分析显示,番茄花梗AZ基因在花期表达上调
番茄花的AZ细胞在花原基发育早期就已被识别;在花期,在AZ中观察到6至8层细胞,花梗已获得响应脱落促进信号的能力[27,33,34].为了鉴定在开花时在番茄花梗AZ中优先表达的基因,我们使用Agilent番茄44K寡核苷酸DNA微阵列进行转录组分析,比较AZ与非AZ花梗区域、Dis和Prox(图2)1A)。在三个独立制备的样品和探针上进行微阵列实验,结果显示至少有3倍的变化(p信号强度<0.05)。结果发现,426个探针在AZ中的信号强度高于Prox, 319个探针在AZ中的信号强度高于Dis(附加文件)1和2).共有112个探针显示AZ内的信号强度高于Prox和Dis(图1)1B)。在112条探针的EST序列中,105条ESTs代表了82个国际番茄注释组(ITAG2)预测的基因,但其余7条ESTs尚未分配给任何预测基因(表2)1).我们将这82个预测基因和7个未分配ESTs作为独立基因,进一步检测这89个基因的功能。为了验证微阵列检测结果,我们从89个基因中任意选择了10个基因,并通过反转录PCR (RT-PCR)分析了10个基因的表达(附加文件)3.).三个花梗区域内的表达特异性与芯片结果一致。
根据拟南芥同源物的注释,我们推断了89个基因在拟南芥中优先表达的功能。从这89个基因的推测功能中,我们发现了6个主要的功能群:转录因子(13个基因)、植物激素代谢、信号和应答(6个基因)、细胞壁降解或修饰(5个基因)、防御功能(8个基因)、脂质代谢(6个基因)和转运蛋白/通道蛋白(6个基因)(表1)1).
我们还发现了AZ中表达量低于Prox和Dis的基因,选择了AZ表达量低于Prox和Dis三分之一的基因(p<0.05)。该组仅包含4个est,分别是BF114405、TA41413_4081、AK248036和AK324977(附加文件)4).AK324977编码一种推测的生长素反应蛋白的同源物,而其他基因与任何已知基因没有序列相似性。结果不足以评估AZ细胞的具体特征,因此我们没有进一步分析这四个细胞。
转录因子基因在AZ中特异性上调
我们以前报道过花梗AZ细胞在花期表达转录因子基因Bl, GOB, Ls和LeWUS它们已被确定为顶端或腋窝分生组织发育的调节因子。除了这4个基因外,我们还发现了9个在花梗AZs中优先表达的转录因子基因(表1)1).鉴定的9个基因属于7个转录因子家族:1个KNOX家族基因(番茄结3[TKn3]),一个BELL家族基因(钟状同源结构域蛋白[曲差]),锌指同源结构域(ZF-HD)家族基因(CK715116), OVATE家族基因(卵圆形的)、3个乙烯反应转录因子(ERF)家族基因(SlERF52,SlERF56和SlERF68)、AT-hook家族基因(AK330067)和类似homeodomain的超家族基因(BE431711)(表3)1).卵圆形的,SlERF52和CK715116在an中表达MC和无接缝的在番茄花梗上的依赖方式,类似于Bl, GOB, Ls和LeWUS[10].先前的研究表明,本文描述的几个转录因子家族在器官脱落中发挥作用。例如,KNOX家族转录因子首次被发现调节茎部分生组织的同一性[35],也被证明参与了花器官的脱落过程[36,37].还有BELL家族基因qSH1调控水稻落粒过程中脱落带的形成[19].在AZs中发现的一些转录因子家族参与植物激素代谢和信号通路。例如,CK715116编码蛋白与拟南芥ZF-HD家族基因序列相似同源框PROTEIN33,在脱落酸(ABA)反应途径中起作用[38].AT-hook家族控制花序形成、衰老和赤霉素(GA)代谢[39- - - - - -41].ERF家族的成员最初被确定为乙烯信号的调节剂,但现在已知对非生物和生物应激作出反应并调节脂质代谢和发育[42- - - - - -45].OVATE家族蛋白已被确定为细胞伸长和番茄的调节因子卵圆形的调节水果形状[46,47].
植物激素相关基因在AZ中特异性上调
由于在花梗脱落前阶段,生长素阻止了花梗脱落,我们预计与生长素活性相关的基因将主要在花梗中表达METHYLESTERASE1(MES1),光中的矮人(DFL1)/生长素诱导格雷琴·哈根3.6(GH3.6)分别显示AZ中的转录物水平高于Prox和Dis(表2)1).MES1与吲哚-3-乙酸(IAA)的储存形式转化为活性形式有关DFL1编码一种IAA酰胺合成酶,该合成酶从活性形式产生一种储存形式的IAA [48- - - - - -50].此外,一些与多种植物激素相关的通路相关的基因在水杨浆组织中的表达高于在非水杨浆组织中的表达;这些基因包括茉莉酸(JA)代谢(AF461042)、油菜素类固醇代谢和生物合成(矮和AB223041)和GA信令调节(AI779761)。
细胞壁降解和重塑基因在AZ中特异性上调
我们的转录组分析表明,细胞壁降解和重塑因子的一些基因在AZ中的表达水平高于非AZ组织。这些基因包括聚半乳糖醛酸酶(PG)、过氧化物酶和扩张蛋白。PG是一种水解细胞壁果胶的酶,已被证明可以促进多种植物器官的脱落[51,52]和PG基因在番茄花梗脱落开始时被强烈上调[27]和柑橘(柑橘克莱门蒂娜)树叶[29].在番茄花梗中,PG的表达严格限于脱落开始后的AZ [53].膨胀蛋白是一种细胞壁重塑蛋白,据报道可以调节接骨木小叶的脱落。Sambucus黑质)和拟南芥的花梗[25,26].烟草脱皮过程中过氧化物酶的基因表达或酶活性(烟草)花梗及柑橘叶[29,54].虽然PG、扩张蛋白和过氧化物酶基因在稻壳中优先表达,但在脱落前阶段这些基因的表达水平远低于脱落开始后的表达水平(图2)2B) (25,27].因此,这些蛋白在脱落前和脱落过程中可能具有不同的功能。在脱落前阶段,这些基因可能通过重塑细胞壁成分参与AZ组织维持或AZ增厚。也有可能是开花期PG活性过低,对细胞没有显著影响,因为其表达水平远低于脱落激活期(图2)2B)。
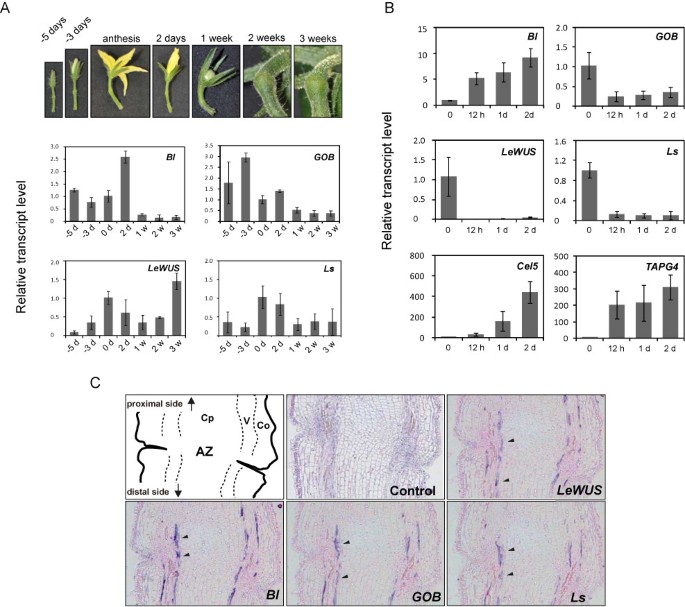
的表达提单,吐唾沫,LeWUS和Ls在番茄花梗。(一个)的表达提单,吐唾沫,LeWUS和Ls在花梗发育期间。采用qRT-PCR检测花前5天和3天、花时和花后2天至3周花梗基因的表达情况。每个基因转录本的水平显示为与开花时收获的样品相比的倍数变化值。(B)的表达提单,吐唾沫,LeWUS和Ls是对分离刺激的反应。取花后0小时、12小时、1天、2天分别采集花梗az。的表达式提单,吐唾沫,LeWUS和LsqRT-PCR检测。误差条表示生物三倍体的标准偏差。在去花后1天,大约10%的花梗发生了脓肿,在去花后2天,这一比例增加到36%8).同时检查附着和离体的花梗。作为阳性对照,进行表达分析Cel5和TAPG4,在去花后表达上调[27].每个基因的转录本水平显示为与0小时样品相比的倍数变化值。误差条表示生物三倍体的标准偏差。(C)的表达提单,吐唾沫,Ls,LeWUS花梗AZ在花期。将dig标记的反义探针杂交到花梗AZ的连续切片上。这些基因的转录本,用箭头表示,是在维管束内的几行细胞中发现的。左上角是AZ的示意图。对照部分用苏木精和伊红染色液染色。阿兹;Co .脱落带;皮层,V;维管束和Cp;中央薄壁组织。
防御相关基因和脂质代谢基因在AZ中特异性上调
几个pathogenesis-related(公关)基因据报道在器官脱落的部位表达[1].的公关基因有望在分离过程中发挥防御作用,以防止潜在的病原体感染[1].许多公关基因也在未受胁迫的组织中表达,如杨叶和烟草花,可能是为了发育或抵抗机会致病菌入侵的基础防御活动[55,56].转录组分析还发现,防御相关基因的同源物编码基本几丁质酶(TA36496_4081、BW687719和BI209334)、PR4 (AW037799)、基本PR1 (AK324158)、渗透蛋白(TA36568_4081和pr p23)和一个主要乳胶蛋白- - - - - -like蛋白(AK326776)在AZs花期优先表达。
脂质可以作为额外的防御病原体感染或在脱落时脱水。一项解剖学研究表明,在花梗AZs的缝隙中充满了脂质化合物,如角质[57],我们之前的研究表明,在非az形成植物的花梗中,许多脂质代谢基因被下调(反义-)MC转基因植物和无接缝的突变体)与野生型植物比较[10].因此,我们发现6个与脂质代谢相关的同源物在AZ中优先表达;这些基因编码一个脂质结合蛋白(BW688588)、一个gdsl基序脂肪酶/水解酶(BI928574)、一个脂肪酸去饱和酶(柑橘外皮类病毒诱导[cevi19])、蛋白酶抑制剂/种子储存/脂质转移蛋白(AI777049)、富含甘氨酸的蛋白/油蛋白(GO374663)和类patatin蛋白(AW030712)(表1)1).
Prox和Dis基因的差异表达
先前的研究表明,在脱落发生后,Prox和Dis组织显示出不同的脱落相关基因表达模式,如PG,β1,4-glucanase(纤维素),核糖核酸酶开花期[51,58,59].在这项研究中,我们分析了两种组织在开花期和脱落前阶段的表达模式差异。通过使用fold-change bbbb3 (p<0.05)作为截断,我们发现629个探针在Prox中的信号强度高于Dis(图1)1C、附加文件5), 392个探针在Dis中高于Prox(图2)1C、附加文件6).随后,在这些基因中,我们重点研究了转录因子和植物激素相关基因。通过使用更严格的标准,折纸变化bbbb10 (p<0.05),作为截断点,我们鉴定出6个转录因子基因和2个植物激素相关基因在Prox中优先表达(表1)2),以及在Dis中优先表达的17个转录因子基因和6个植物激素相关基因(表2)3.).我们还使用RT-PCR验证了11个任意选择基因的芯片分析结果,发现RT-PCR结果与芯片数据一致(附加文件)7).
Prox和Dis转录因子基因的差异表达
在Dis中优先表达的基因中,我们发现了5个MADS-box基因(BI203609,MADS-box 5[TDR5或TM5],TM29,MADS-box蛋白[SlMBP21),而番茄APETALA3[TAP3]),它们是同源的AGAMOUS-LIKE6(AGL6),SEPALATA1(SEP1),SEPALATA3(SEP3)或AP3拟南芥花器官同一性的调控因子(表2)3.).一个APETALA2(AP2)同系物SlAP2a)也在拟南芥中优先表达的基因中发现AP2编码一种属于AP2家族的转录因子并调节花器官的身份[60];番茄同源物SlAP2a已被证明是果实成熟过程中乙烯生物合成的负调节因子[61].最近,一种大米AP2同源物已被证明可调节种子碎裂的AZ发育[18].相比之下,在Prox中优先表达的转录因子基因中,我们发现了拟南芥的同源基因constans过表达抑制因子(SOC1),该基因编码一种MADS-box蛋白,调节花分生组织的特性(SlMBP14;表格2) [62,63].
一些与生长素调控信号通路相关的转录因子基因在Prox和Dis中表达存在差异,如生长素反应因子(ARF)家族基因(TA50096_4081)在Prox中优先表达,而在Dis中优先表达的基因包括编码生长素/吲哚-3-乙酸(AUX/IAA)家族(AK319758)、NAC家族(TC202847)和MYB家族(BG126724)成员的同源基因。ARF家族蛋白参与生长素信号的调节[64和拟南芥ARF1,ARF2是多余的,以促进花器官脱落[65].AK319758编码拟南芥IAA29的同源物,参与生长素介导的下胚轴伸长[66].BG126724是aMYB77调节生长素信号的同源物[67].TC202847与母,参与生长素介导的侧根形成[68].
一个YAB家族基因AI782101在Prox和另一个中优先表达YAB同源物(AK328263)在Dis中优先表达。YAB家族蛋白在拟南芥侧壁器官发育过程中作为调节因子建立背轴细胞命运[j]。69].最近,一位YAB同系物的基因SH1它的同源基因被鉴定为调节谷物物种的种子碎裂,包括高粱、水稻和玉米[20.].
Prox和Dis中具有不同表达模式的植物激素相关基因
与Prox相比,Dis中表达水平较高的基因包括几个调节植物激素活性的基因同源物(表1)3.).例如,BW692346编码GH3.1的同源物,GH3.1介导生长素偶联[48];BP875651和AK247718编码HOOKLESS1 (HLS1)的同源物,后者在拟南芥下胚轴的细胞分化伸长中作为乙烯、生长素和光信号通路的整合者[qh]70].SlACO5编码一种催化乙烯生物合成的1-氨基-环丙烷-1-羧酸氧化酶(ACO), BG130984和TA49618_4081是其同源物细胞分裂素OXIDASE3它编码一种细胞分裂素氧化酶,可以降解细胞分裂素。我们还发现了两个植物激素相关基因在Prox中优先表达,脂肪氧合酶的(LOXA),根系(RSI-1)(表2).LOXA编码9-LOX途径的一种脂肪加氧酶,并被认为在氧化脂类的生物合成中起作用[71].9-LOX通路的产物在防御反应中与JAs具有相似的生物学功能[72,73].RSI-1是气体”(GA-stimulated拟南芥)基因家族,其中包括参与细胞和器官伸长的调节因子[74];RSI-1已被确定为侧根发育的调节因子[75]
的时空表达Bl, GOB, Ls和LeWUS响应一个分离信号
我们之前展示过提单,吐唾沫,Ls和LeWUS在花梗AZs的调控下优先表达MC和无接缝的.在这里,我们对它们的表达模式进行了更详细的分析。首先,我们用定量RT-PCR分析了它们在花梗发育过程中的表达,从花前5天到花后3周(图2)2A)大量的提单花前5 d开始表达,花后2 d表达量达到最大值,果实生长期表达量明显下降。的最高表达吐唾沫在花前3天检测到,随后表达量逐渐下降。的表达LeWUS和Ls在花期达到顶峰,然后逐渐下降,与吐唾沫。与其他三个基因不同的是LeWUS在果实生长期再次增加,在花后3周达到最高表达量。接下来,我们研究了花脱落信号对这四个基因转录水平的影响(图2)2B).花梗脱落AZ是通过将花从花梗上移除来刺激的。经过这种处理,10%和36%的花梗分别在1天和2天后发生脓肿(附加文件)8).取花后,表情吐唾沫,Ls和LeWUS在花梗处,12小时内立即凋谢,但是提单治疗后表达量增加5倍以上。随后,为了鉴定转录这4个转录因子基因的细胞,我们对花期的AZ区域进行了检测原位杂化。制备了AZ区域的连续切片,并与反义探针杂交提单,吐唾沫,Ls和LeWUS。如图所示2C, mrna提单,吐唾沫,Ls和LeWUS在相同的细胞中检测;这些细胞在皮层和中央薄壁之间的维管组织内排列成几行。当用传感探针作为阴性对照进行杂交时,我们没有检测到特定的杂交信号(附加文件)9).的模式提单,吐唾沫,Ls和LeWUS是相似的吗TAPG4(附加文件9),据报道,在番茄花梗AZ组织内的维管细胞周围可以检测到其表达[53].
讨论
花梗AZs的几个调控途径可能与茎尖分生组织(sam)的调控有共同之处。
我们对花梗基因表达的分析显示,与其他花梗组织、Prox区和Dis区相比,AZ区有不同的表达模式。我们之前的研究表明,调控茎分生组织维持和侧枝发育的转录因子,LeWUS,提单,吐唾沫和Ls,在花梗AZs中表达[10].除了这四个基因外,我们还鉴定了几个同源的转录因子基因,这些基因被鉴定为调节分生组织的活性。Tkn3和曲差,两者在AZ中均上调,分别编码拟南芥KNOX和BELL家族转录因子的同源物,形成SAM功能所需的异源二聚体[76].此外,我们的分析还揭示了AZ特异性的上调卵圆形的,其同系物与KNOX-BELL异源二聚体复合物结合并调节该复合物的活性[77].此外,在SAM中发现的另一种转录途径也可能在花梗中被激活。拟南芥YAB表达于叶片背面结构域的基因,通过活性的分生组织促进干细胞的活性侧抑制器(拉斯维加斯),表达于叶器官原基与SAM中心区的交界处[78,79].我们的分析发现拉斯维加斯同系物Ls表示为AZ和YAB同源物在AZ外的Prox区和Dis区表达(表2)1、表2和表3.),表明二者的空间表达模式具有相似性拉斯维加斯和YAB在花梗和茎尖之间的家族基因。这一证据支持了我们的建议,即AZs中的转录调控与SAMs中的调控是共享的。如果是这样,那么这种共同的调节是如何作用于这些不同的组织的?它调节了哪些细胞活动?对花梗AZs的观察表明,AZs内排列着细胞质密集的小细胞[34,80]而这些细胞被认为维持在未分化状态[3.].因此,一个合理的解释是,在花梗AZs和SAMs中共同的调控系统可能有助于维持两种组织中的小的、未分化的细胞。这一假设得到以下事实的支持本人和诺克斯,其同源物在花梗AZs中上调,是调节未分化分生组织细胞维持的关键基因[81- - - - - -83].此外,最近的一项研究表明,KNOX家族基因通过调节AZ细胞的大小和增殖来决定花器官脱落的时间[36].此外,花梗AZs可以发育不定芽,尽管这种情况很少见[10],也支持了花梗AZs含有与SAM细胞相似特征的细胞的可能性。
的参与LeWUS,提单,吐唾沫和Ls在能力的调节,以响应脱落促进信号
在此我们分析了LeWUS,提单,吐唾沫和Ls揭示这些az特异性基因在脱落过程中的功能。分离启动刺激显著改变了这4个基因的表达模式;转录水平LeWUS,吐唾沫和Ls显著下降提单大幅上调(图2B)。这种变化与正常组织发育中发生的表达模式变化有显著不同(图2)2A).因此,这四种转录因子基因可能参与了脱落发生的调控。表情模式表明提单可能是分离的正调节因子,而其他三个可能是负调节因子。在正常组织发育过程中,这四个基因的表达高峰出现在开花前后的几天内(图2)2A).发育阶段似乎是决定器官是脱落还是过渡到生长期的关键。因此,组织可能需要高水平表达阳性和阴性调节因子来立即对任何一种命运作出反应。当组织发生脓肿时,阳性调节因子上调,阴性调节因子下调。或者,如果组织要过渡到生长期,可能不需要这两种调节因子的高水平表达,这可能是因为果实中脱落抑制剂生长素的稳定供应抑制了脱落。
反应的不同提单其他3个基因的AZ特异性表达是意料之外的,因为所有这些基因的AZ特异性表达同时受到MC和JOINTLESS的调控[10],之前的一项研究提出腋窝分生组织调节剂(递交),杯状子叶(中联科利),拉斯维加斯,是拟南芥的同源物提单,吐唾沫和Ls,是在腋窝分生组织中组成转录级联的积极调节因子[84].一个相反的假设递交和拉斯维加斯是两个独立转录途径的元件,也被提出[85].的表达式提单,LeWUS,吐唾沫和Ls在AZ中,可能受到双重机制的调控,其中一个共同的调控因子可能在开花开始前诱导这四个基因,一旦提供脱落信号,不同的转录调控因子可能上调提单或者下调其他三个基因。
的表达式性质LeWUS和吐唾沫这可能解释了花梗AZ细胞在脱落过程中的生理变化.对番茄花梗AZ的组织学分析表明,在脱落前保持小的分离带细胞在脱落开始后扩大。86].有人提出,在分离开始时AZ细胞的扩大会产生一种力,使分离区破裂[36,87].如上所述,本人在sam中维持细胞未分化状态的功能;中联科利的同系物吐唾沫,也可使细胞大小保持较小[83,88].因此,的表达减少吐唾沫和LeWUS由脱落信号引起的细胞分离带增大可导致脱落发生。在这四个基因中,只有LeWUS在花后3周表达增加。因为分离带细胞增加,直到成熟的青果期[80,增加活动LeWUS可能需要维持细胞的生理机能。
如图所示2C,LeWUS,提单,吐唾沫和Ls均在花梗维管细胞中表达,而在分离区的小细胞中不表达。在地对空导弹,本人调节干细胞活性,并在干细胞下面的细胞中表达,而不是在干细胞本身中表达[83].递交,中联科利和拉斯维加斯的同系物提单,吐唾沫和Ls,分别在SAM和叶原基之间的边界区域表达[84,85,89].如果花梗AZs中的分离带细胞具有与上述SAMs相似的特性,则LeWUS,提单,吐唾沫和Ls分离带外的细胞与SAMs中的观察结果一致。这四个基因可能通过类似于SAM活性调控的非细胞自主机制调控AZs中分离带细胞的活性本人或拉斯维加斯[78,90].虽然这4个基因在花梗AZs中的功能尚不清楚,但我们的表达分析表明,这4个基因对脱落发生的反应有重要贡献。进一步的研究将为这些转录因子在调控脱落中的功能提供关键的见解。
生长素梯度可能在花梗中形成并影响基因表达
一些证据表明,生长素和乙烯是调控脱落发生的关键因素,生长素在维持花或果实与植物的附着方面起着重要作用。1,22].结果表明,与生长素信号通路和生长素稳态相关的基因在AZ、Prox和Dis三个花梗区表达模式存在明显差异,IAA酰胺合成酶DFL1/GH3.6 (AK319847)和GH3.1 (BW692346)的同源基因分别在AZ和Dis中优先表达,而在Prox区优先表达的基因中未发现同源基因。IAA酰胺合成酶基因在生长素丰富的组织中被诱导,基因产物灭活IAA以控制生长素的稳态[91],表明花期Dis区和AZ区生长素浓度高于Prox区。同时,在AZ中优先表达的基因包括MES1基因的同源基因(AK328818),该基因可以将IAA的无活性形式IAA-甲酯(MeIAA)转化为活性形式IAA [49].这些结果表明,花期活性IAA水平可能以一种复杂的方式微调。这些相反的反应,即IAA的激活和失活,可能发生在AZ内不同的细胞群中,以维持其脱落前的状态。我们还发现了一个同源物IAA29,一种生长素诱导转录因子基因[66],在Dis区优先表达的基因中(AK319758;表格3.).的表达式IAA29同源性在Dis区最高,向Prox (Additional)区逐渐降低10).此外,一些可能在生长素信号传导中起作用的基因,如同源物MYB77(BG126724)和母(TC202847),在Dis中比在Prox中有更丰富的转录本(表3.).这些结果也支持了在花梗组织中形成生长素梯度的可能性。相反,生长素反应因子的转录水平ARF9同源性在Prox中显著升高(表1)2和附加文件10).一般来说,arf的转录因子活性受转录后调控;AUX/IAA蛋白偶联可抑制ARF活性,当细胞内生长素水平升高时,ARF被激活,生长素的增加诱导偶联AUX/IAAs的降解[92].虽然目前还不清楚成绩单的水平是否ARF9Prox的同源基因受生长素浓度的调控,Prox的高表达表明Prox区域对生长素的响应可能不同于AZ和Dis区域。这些对生长素的不同反应可能反映了每个组织中不同的基因表达模式。因为生长素水平决定了花梗脱落的发生时间[27],本研究中发现的生长素信号基因,特别是在AZ区和Dis区表达的生长素信号基因,可能参与了防止脱落的发生。
MADS盒子蛋白可能是决定花梗区域身份的关键因素
我们的研究结果表明,尽管它们的外观相似,但开花花梗的Prox和Dis区域具有不同的表达谱。特别是,Dis区域的特点是与花器官发育相关的基因,如同源物的特异性表达AP2(SlAP2a)和MADS盒子基因AGL6(BI203609),AP3(TAP3), SEP1(TM29和SlMBP21),SEP3(TDR5),表明Dis在基因表达水平上具有类似花器官的特性(表2)3.).相比之下,Prox区细胞特异性表达的同源SOC1(SlMBP14),它编码另一种MADS盒蛋白,调节从营养生长到生殖生长的转变[62,63].决定不同细胞命运的转录因子基因的区域特异性表达表明Prox和Dis组织具有不同的发育特性。
我们之前的研究表明,MADS盒子基因MC和无接缝的,在整个花梗组织中表达,调节花梗AZ的发育,并诱导AZ特异性表达LeWUS,提单,吐唾沫和Ls[10].这些观察结果表明,MADS盒转录因子可能在很大程度上有助于确定花梗区域的身份。在每个花梗区域表达的MADS box蛋白可能形成区域特异性蛋白复合物,并确定每个区域的身份,类似于花器官鉴定中提出的四重奏模型[93].
结论
为了揭示番茄花梗在脱落前状态下的转录特性,我们分析了三个花梗区域Prox、AZ和Dis的基因表达谱。基因表达数据表明,AZ与非AZ组织(Prox和Dis),以及Prox和Dis之间存在显著差异,特别是与生长素活性相关的基因在花梗区域表现出不同的表达模式。提示生长素浓度梯度可能在整个花梗区域形成,这种生长素梯度可能是影响花梗组织中不同表达模式的关键因素之一。这些生长素相关基因可能在脱落时间的调控中起关键作用。不同组的转录因子也以区域特异性的方式表达,其中不同区域存在不同类型的MADS-box转录因子基因。例如,Dis区细胞表达花器官发育所需的MADS-box基因,而Prox区细胞表达另一种调节开花的MADS-box基因。几种类型的MADS-box蛋白复合物可能在各自的花梗区域形成,专门调节基因表达,类似于花的四重奏模型。与茎尖或腋芽分生组织功能相关的转录因子基因在水杨浆中优先表达,表明茎尖分生组织细胞和水杨浆细胞可能具有共同的分生组织功能。最后进行了详细的基因表达分析提单,采空区,Ls和LeWUS表明这些AZ特异性转录因子基因可能是响应脱落线索的关键因素,尽管这四个基因之间的调控途径可能不同;提单可能是分离的正调节因子,其他三个可能是负调节因子。
综上所述,本研究确定了多个差异表达因子,这些因子可能在番茄花梗脱落前AZs特性的建立和维持中起重要作用,并为脱落前响应的转录调控提供了新的思路。特别是,对AZs和SAMs中共同表达的基因进行比较研究,可能为研究脱落的调控提供新的视角。此外,花梗区域特异性的MADS盒转录因子可能是决定花梗组织身份的调控因子的有吸引力的候选者。
方法
微阵列实验和数据分析
对番茄(茄属植物lycopersicum)的简历。艾尔莎·克雷格生长在25°C、16 h日长的生长室内的土壤中。每个花梗区域都用锋利的剃须刀片小心地剪掉并进行分析。为了进行杂交,我们使用了安捷伦番茄基因表达芯片44K (Agilent Technologies, Santa Clara CA, USA),其中包含从三个不同数据库中保存的EST序列设计的探针,基因库(GB数据库),TIGR (TA数据库)和番茄基因索引(TC和NP数据库)。杂交和信号检测基本上按照前面的描述进行[10].使用genesspring软件版本10.0 (Agilent Technologies),通过每块芯片归一化方法将信号强度归一化到第75个百分位数。如果信号是非均匀的离群值,或者信号是总体离群值,则从离群值探针中删除数据。来自三个独立准备样本的数据通过log的单样本t检验进行评估2-使用MeV v4.6.2软件转换每个探头的信号比,默认设置使用选项“基于t分布的p值和“只是Alpha(没有修正)“(94].为了标注用于微阵列探针的番茄ESTs序列,我们使用BLASTX对拟南芥信息资源蛋白数据库(TAIR9)进行了检索,期望值阈值为0.01。在国际茄科基因组学计划(SOL)基因组学网络网站(http://solgenomics.net/).完整的微阵列数据集已存入Gene Expression Omnibus,登录号为GSE39519 [NCBI GEO]。
RT-PCR和定量RT-PCR分析
RT-PCR实验用PrimeScript第一链cDNA合成试剂盒(Takara Bio Inc., Otsu Shiga, Japan)合成第一链cDNA。RT-PCR使用ExTaq聚合酶(Takara Bio Inc.)按照制造商的说明进行。采用7300 Real-Time PCR系统(Applied Biosystems, Foster City, CA, USA)和THUNDERBIRD SYBR qPCR MIX (TOYOBO, Osaka, Japan)进行定量PCR扩增。每个基因表达的相对定量使用2——ΔΔCT方法(95].的沙子(SGN-U316474)基因作为内参[96].用于PCR的寡核苷酸在附加文件中列出11.
原位杂交
花梗用福尔马林/乙酸/醇(FAA)固定,石蜡包埋,切片厚度为4 μm。探针杂交按照前面描述的方法进行[97].用NBT/BCIP显色。对照切片采用苏木精和伊红染色。每个切片用Kernechtrot染色反染,并用CC/Mount (Sigma-Aldrich)裱片。为了生产dig标记的RNA探针,cDNA片段被pcr扩增(寡核苷酸列在附加文件中)11)克隆到pSPT19 (Roche);用T7 RNA聚合酶合成dig标记的RNA。
参考文献
Roberts JA, Elliott KA, Gonzalez-Carranza ZH:细胞分离、分裂和其他分离过程。植物学报,2002,35(3):591 - 598。10.1146 / annurev.arplant.53.092701.180236。
《金融时报》:分离。加州伯克利:加州大学出版社;1982.
van Nocker S:分离带的发展。科学通报,2009,35(1):1 - 5。
Doebley J:玉米进化的遗传学。宗教学报,2004,38:37-59。10.1146 / annurev.genet.38.072902.092425。
Tanno K, Willcox G:野生小麦的驯化速度有多快?科学,2006,311(5769):1886-1886。10.1126 / science.1124635。
李超,周安,桑涛:水稻减少破碎驯化的研究。科学,2006,311(5769):1936-1939。10.1126 / science.1123604。
Patterson SE:摆脱束缚。拟南芥的脱落和开裂。植物生理学报,2009,26(2):494- 498。10.1104 / pp.126.2.494。
巴特勒·L:番茄的遗传性状。2无接缝的花梗。[J] .中华医学杂志,1996,27(1):25-26。
Rick CM:加拉帕戈斯群岛番茄属植物遗传与系统研究。[J] .中国生物医学工程学报,2003,31(3):687-696。10.2307 / 2438834。
Nakano T, Kimbara J, Fujisawa M, Kitagawa M, Ihashi N, Maeda H, Kasumi T, Ito Y: MACROCALYX和JOINTLESS相互作用对番茄果实脱落区发育的转录调控。植物生理学报,2012,31(1):459 - 459。10.1104 / pp.111.183731。
自然科学学报,2000,40(6):910-913。10.1038 / 35022611。
Schumacher K, Schmitt T, Rossberg M, Schmitz C,有K:番茄VHIID蛋白家族新成员的侧抑制基因编码。美国国家科学促进会。中国生物医学工程学报,2009,32(1):391 - 391。10.1073 / pnas.96.1.290。
Budiman MA, Chang SB, Lee S, Yang tji, Zhang HB, de Jong H, Wing RA:基于高分辨率遗传和物理定位的番茄12号染色体着丝区无节2基因定位。理论与应用,2004,18(2):190-196。10.1007 / s00122 - 003 - 1429 - 3。
Vrebalov J, Ruezinsky D, Padmanabhan V, White R, Medrano D, Drake R, Schuch W, Giovannoni J:番茄成熟抑制因子(rin)位点mad -box基因的克隆。科学通报,2002,29(6):343-346。10.1126 / science.1068181。
Ogawa M, Kay P, Wilson S, Swain SM:拟南芥分裂带多半乳糖醛酸酶1 (ADPG1)、ADPG2和QUARTET2是拟南芥生殖发育中细胞分离所需的多半乳糖醛酸酶。植物学报,2009,21(1):216-233。10.1105 / tpc.108.063768。
Pinyopich A, Ditta GS, Savidge B, Liljegren SJ, Baumann E, Wisman E, Yanofsky MF:心皮和胚珠发育过程中MADS-box基因的冗余性分析。自然科学,2003,24(6):85-88。10.1038 / nature01741。
Mckim SM, Stenvik GE, Butenko MA, Kristiansen W, Cho SK, Hepworth SR, Aalen RB, Haughn GW:叶片上叶柄基因在拟南芥脱落区形成中的作用。生态学报,2008,35(8):1537-1546。10.1242 / dev.012807。
周勇,陆东,李超,罗军,朱丰峰,朱军,上官勇,王铮,桑涛,周波:APETALA2转录因子对水稻种子碎裂的遗传控制[J]。植物细胞学报,2012,24(3):1034-1048。10.1105 / tpc.111.094383。
小西,井泽涛,林世英,叶bana K, Fukuta Y, Sasaki T, Yano M:水稻驯化过程中籽粒脱落的SNP。科学通报,2006,31(5):1392-1396。10.1126 / science.1126410。
林志伟,李小荣,香农林明,叶春成,王明林,白海燕,彭忠,李小荣,Trick HN, Clemente TE:谷物碎裂1基因的平行驯化。植物学报,2012,44(6):720-724。10.1038 / ng.2281。
季海,金世荣,金玉华,金海,尹美梅,金立德,Cha YS, Yun DW, Ahn BO, Lee MC:水稻CTD磷酸酶样基因OsCPL1的失活对水稻脱落层发育和籽粒破碎的影响。植物学报,2010,61(1):96-106。10.1111 / j.1365 - 313 x.2009.04039.x。
刘建军,刘建军,刘建军,等。中国生物医学工程学报,2001,31(2):323-339。10.1046 / j.0028 - 646 x.2001.00194.x。
杨建军,张建军,张建军,张建军,张建军。番茄内切-1,4-葡聚糖酶基因的克隆分析。细胞1在花脱落中的作用。植物学报,1998,13(3):303-310。10.1046 / j.1365 - 313 x.1998.00025.x。
李国荣,李国荣,李国荣,等:器官分离。植物细胞分离与粘附,植物学刊。第25卷。编辑:罗伯茨JA,冈萨雷斯-卡兰萨ZH。牛津,英国:布莱克威尔出版;2007.
张建军,张建军,张建军,等。乙烯诱导黑松叶脱落过程中扩张蛋白活性及基因表达的变化。[J] .中国生物医学工程学报,2015,35(4):817-823。10.1093 / jxb / eri076。
赵海涛,张志强,张志强,等。拟南芥叶片生长和花梗脱落与扩张素表达的关系。美国国家科学促进会。中国生物医学工程学报,2009,31(6):993 - 998。10.1073 / pnas.160276997。
Meir S, sophia - hadas S, Sundaresan S, Selvaraj KSV, Burd S, Ophir R, Kochanek B, Reid MS, Jiang CZ, Lers A:生长素枯竭对番茄花脱落区相关转录组的微芯片分析。植物生理学报,2010,34(4):299 - 296。10.1104 / pp.110.160697。
引用本文:蔡清平,Lashbrook CC .:花蕊脱落区转录组分析揭示了过表达拟南芥锌指蛋白2的花器官保留增强。植物生理学报,2009,35(3):559 - 561。10.1104 / pp.107.110908。
李建军,李建军,李建军,等。乙烯诱导柑橘叶片脱落差异基因的表达。实验学报,2008,59(10):2717-2733。10.1093 / jxb / ern138。
Reinhardt D, Frenz M, Mandel T, Kuhlemeier C:显微外科和激光消融对番茄茎尖分生组织区域和层间相互作用的分析。发展,2003,130(17):4073-4083。10.1242 / dev.00596。
张晓明,张晓明,张晓明,张晓明,张晓明,张晓明,张晓明,张晓明,张晓明,等。nac结构域转录因子GOBLET在番茄复叶中表达的研究进展。生态学报,2009,36(5):823-832。10.1242 / dev.031625。
Schmitz G, Tillmann E, Carriero F, Fiore C, Cellini F,有K:番茄盲基因编码MYB转录因子控制外侧分生组织的形成。美国国家科学促进会。中国生物工程学报,2002,19(2):1064-1069。10.1073 / pnas.022516199。
张建军,张建军,张建军,等。乙烯促进番茄花脱落的研究进展。植物学报,2004,26(2):559 - 563。10.1007 / BF00392864。
Tabuchi T:两个番茄品种花梗脱落带发育的比较。植物生态学报,1999,38(5):993-999。10.2503 / jjshs.68.993。
Kerstetter RA, LaudenciaChingcuanco D, Smith LG, Hake S:玉米同源盒基因knottted1的功能缺失突变在茎部分生组织维持中存在缺陷。发展,1997,24(16):3045-3054。
石丽娟,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。拟南芥花脱落信号通路的研究进展。植物学报,2011,23(7):2553-2567。10.1105 / tpc.111.084608。
王晓青,徐文辉,马丽丽,付志明,邓小文,李建勇,王永华:拟南芥脱落带发育对KNAT1/BP的要求。植物遗传学报,2006,32(1):1 - 6。10.1111 / j.1744-7909.2005.00085.x-i1。
王丽,华大平,何建军,段勇,陈志强,洪晓华,龚志强:生长素反应因子2 (ARF2)及其调控的同源结构域基因HB33介导拟南芥脱落酸应答。植物科学通报,2011,7 (7):e1002172。10.1371 / journal.pgen.1002172。
Gallavotti A, Malcomber S, Gaines C, Stanfield S, Whipple C, Kellogg E, Schmidt RJ:玉米穗形成所需的AT-hook蛋白。植物细胞,2011,23(5):1756-1771。10.1105 / tpc.111.084590。
林宝波,金燕,布雷泽,顾建军,吴洪华,Ryu JS, Park DH, Beynon J, Tabrett A, Buchanan-Wollaston V:一种染色质结构控制AT-hook蛋白的过表达延长了植物叶片寿命和采后贮藏期。植物学报,2007,32(6):1145 - 1145。10.1111 / j.1365 - 313 x.2007.03317.x。
Matsushita, Furumoto T, Ishida S, Takahashi Y: AT-hook蛋白AGF1编码GA3 -氧化酶的AtGA3ox1负反馈是必需的。植物生理学报,2007,43(3):1152-1162。10.1104 / pp.106.093542。
Komatsu M, Chujo A, Nagato Y, Shimamoto K, Kyozuka J:卷曲的穗部是水稻小穗防止腋生分生组织形成和确定花分生组织特性的必要条件。科学通报,2009,35(6):391 - 391。10.1242 / dev.00564。
李春华,李春华,李春华,等。AP2/ERF转录因子对植物抗病途径的调控。植物学报,2004,7(4):465-471。10.1016 / j.pbi.2004.04.007。
张志刚,张志刚,张志刚,等。低温胁迫下植物对水分胁迫信号通路的影响。植物学报,2000,33(3):217-223。
黄晓明,王晓明,王晓明,等。拟南芥表皮蜡质积累转录激活因子WIN1的克隆及表达。美国国家科学促进会。中国生物医学工程学报,2009,31(3):457 - 457。10.1073 / pnas.0305574101。
王松,常宇,郭军,陈建国:拟南芥卵形家族蛋白1是一种抑制细胞伸长的转录抑制因子。植物学报,2007,35(5):858-872。10.1111 / j.1365 - 313 x.2007.03096.x。
刘太平,Van Eck J,丛斌,Tanksley SD:一类新的梨形番茄果实调控基因。美国国家科学促进会。中国生物医学工程学报,2009,29(3):349 - 349。10.1073 / pnas.162485999。
Staswick PE, Serban B, Rowe M, Tiryaki I, Maldonado MT, Maldonado MC, Suza W:拟南芥氨基酸与吲哚-3-乙酸偶联酶家族的表征。植物细胞,2005,17(2):616-627。10.1105 / tpc.104.026690。
杨燕,徐瑞,马志杰,Vlot AC, Klessig DF, Pichersky E:拟南芥AtMES酯酶家族的几种酯酶可水解和活化甲基吲哚-3-乙酸酯。植物生理学报,2008,37(3):1034-1045。10.1104 / pp.108.118224。
杨晓东,杨晓东。生长素:调控、作用和相互作用。中国生物医学工程学报,2009,35(5):557 - 557。10.1093 / aob / mci083。
Kalaitzis P, Solomos T, Tucker ML:三种不同的多半乳糖醛酸酶在番茄叶片和花脱落中表达,每种酶具有不同的时间表达模式。植物生理学报,2009,35(3):394 - 394。
姜朝忠,陆峰,王志刚,Meir S, Reid MS .:多聚半乳糖醛酸酶基因的沉默对番茄叶柄脱落的抑制作用。实验学报,2008,59(4):973-979。10.1093 / jxb / ern023。
洪绍平,李建平,李建平,等。番茄多半乳糖醛酸酶的基因启动子分析。植物生理学报,2009,31(3):869-881。10.1104 / pp.123.3.869。
杨建军,杨建军,杨建军,等。烟草组织中过氧化物酶的研究进展[j]。乙烯诱导脱落过程中过氧化物酶活性的时间过程研究。植物生理学报,2004,26(2):394 - 394。10.1104 / pp.54.2.192。
杨树几丁质酶基因启动子在转基因烟草中的应用。植物学报,1994,25(5):799-815。10.1007 / BF00028875。
罗丹,奥里,弗鲁尔,等:烟草花发育调控的发病相关蛋白。植物学报,2009,31(9):881-887。
李建军,张建军,张建军,等。分离带的精细结构[j]。烟草和番茄花在花期花梗的脱落区。植物学报,1997,17(4):398 - 398。10.1007 / BF00389317。
李春华,李春华,李春华,等。β -1,4-葡聚糖酶内切基因在果实成熟和开花过程中的表达。植物细胞,1994,6(10):1485-1493。
Bar-Dror T, Dermastia M, Kladnik A, Znidaric MT, Novak MP, Meir S, Burd S, philosopho - hadas S, Ori N, songo L:番茄脱落过程中细胞程序性死亡的不对称性。植物学报,2011,23(11):4146-4163。10.1105 / tpc.111.092494。
Jofuku KD, Denboer BGW, Vanmontagu M, Okamuro JK:同源基因Apetala2对拟南芥花和种子发育的调控。植物细胞,1994,6(9):1211-1225。
Chung m, Vrebalov J, Alba R, Lee J, McQuinn R, Chung JD, Klein P, Giovannoni J:番茄(Solanum lycopersicum) APETALA2/ERF基因SlAP2a是果实成熟的负调控因子。植物学报,2010,36(6):936-947。10.1111 / j.1365 - 313 x.2010.04384.x。
李军,李军。开花途径整合子SOC1的调控及功能。实验学报,2010,61(9):2247-2254。10.1093 / jxb / erq098。
李建军,李建军,李建军,李建军,李建军。拟南芥开花时间基因对分生组织的影响。植物学报,2008,40(12):1489-1492。10.1038 / ng.253。
李建军,张建军,张建军,等。生长素反应因子对基因转录的抑制作用。美国国家科学促进会。中国生物医学工程学报,2009,35(10):544 - 549。10.1073 / pnas.96.10.5844。
王晓明,杨建军,张建军,张建军,张建军。植物生长素反应因子1和2对拟南芥衰老和花器官脱落的调控作用。发展,2005,32(20):4563-4574。10.1242 / dev.02012。
Kunihiro A, Yamashino T, Nakamichi N, Niwa Y, Nakanishi H, Mizuno T:拟南芥光合色素相互作用因子4和5 (PIF4和PIF5)激活同源体ATHB2和生长素诱导的IAA29基因的光周期调控机制植物生理学报,2011,52(8):1315-1329。10.1093 /卡式肺囊虫肺炎/ pcr076。
Shin R, Burch AY, Huppert KA, Tiwari SB, Murphy AS, Guilfoyle TJ, Schachtman DP:拟南芥转录因子MYB77调控生长素信号转导。植物细胞,2007,19(8):2440-2453。10.1105 / tpc.107.050963。
谢强,Frugis G, Colgan D, chunh:拟南芥NAC1在TIR1下游转导生长素信号促进侧根发育。基因工程学报,2000,14(3):344 - 344。10.1101 / gad.852200。
Siegfried KR, Eshed Y, Baum SF, Otsuga D, Drews GN, Bowman JL: YABBY基因家族成员决定拟南芥的下轴细胞命运。发展,1999,26(18):417 -4128。
李海,Johnson P, Stepanova A, Alonso JM, Ecker JR .:拟南芥细胞生长差异信号通路的趋同。开发单元,2004,7(2):193-204。10.1016 / j.devcel.2004.07.002。
李建军,张建军,张建军,张建军,张建军。亚油酸9-脂氧合酶的研究进展。中国生物医学工程学报,2008,43(11):979-987。10.1007 / s11745 - 008 - 3230 - 1。
辣椒9-脂氧合酶基因CaLOX1在微生物病原体防御和细胞死亡反应中的作用。植物生理学报,2010,32(2):948-967。10.1104 / pp.109.147827。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,等。9-脂氧合酶和α -双加氧酶-氧化脂素途径对机体防御的调控作用。植物化学,2012,5(4):914-928。10.1093 / mp / ssr105。
Roxrud I, Lid SE, Fletcher JC, Schmidt ED, Opsahl-Sorteberg HG:拟南芥GASA小多肽家族14个成员之一的GASA4调控开花和种子发育。植物生理学报,2007,48(3):471-483。10.1093 /卡式肺囊虫肺炎/ pcm016。
Taylor BH, Scheuring CF:一个侧根起始的分子标记——Rsi-1基因在番茄(lycopersicon-esculentum mill)侧根原基早期被激活。中国生物医学工程学报,2004,24(2):444 - 444。
Rutjens B, Bao DP, van Eck-Stouten E, Brand M, Smeekens S, Proveniers M:拟南芥茎尖分生组织功能需要3个bel1样同源结构域蛋白的联合活性。植物学报,2009,31(4):641-654。10.1111 / j.1365 - 313 x.2009.03809.x。
王晓明,王晓明,王晓明,等。KNOX基因对植物生长发育的调控作用。发展,2010,37(19):3153-3165。10.1242 / dev.030049。
黄晓明,王晓明,王晓明,等。拟南芥茎尖分生组织中YABBY基因的表达及其调控机制。植物细胞,2008,20(5):1217-1230。10.1105 / tpc.107.057877。
巴顿MK: 20年过去了:茎尖分生组织的内部运作,一个发育的发电机。中国生物医学工程学报,2010,31(1):95-113。10.1016 / j.ydbio.2009.11.029。
田田一,田田一。番茄花梗次生细胞分裂区在不同果实生育期的形成。[J] .植物生态学报,2002,26(2):559 - 561。10.2503 / jjshs.69.156。
Lenhard M, Jurgens G, Laux T: WUSCHEL和SHOOTMERISTEMLESS基因在拟南芥茎部分生组织调控中发挥互补作用。发展,2002,129(13):3195-3206。
Long JA, Moan EI, Medford JI, Barton MK:拟南芥STM基因编码的KNOTTED类同源结构域蛋白。自然科学学报,1996,37(6):366 - 369。10.1038 / 379066 a0。
Mayer KF, Schoof H, Haecker A, Lenhard M, Jurgens G, Laux T: WUSCHEL在拟南芥茎分生组织干细胞命运调控中的作用。细胞生物学杂志,1998,35(6):805-815。10.1016 / s0092 - 8674(00) 81703 - 1。
Raman S, Greb T, Peaucelle A, Blein T, Laufs P,有K: miR164、杯形子叶基因和侧抑制子基因对拟南芥腋生分生组织形成的相互作用。植物学报,2008,35(1):559 - 561。10.1111 / j.1365 - 313 x.2008.03483.x。
王晓明,王晓明,王晓明,等。拟南芥中R2R3 Myb基因的克隆与表达。植物细胞,2006,18(3):586-597。10.1105 / tpc.105.038745。
李春华,李春华,李春华。花期番茄花梗脱落过程的解剖学研究。植物生态学报,2001,70(1):63-65。10.2503 / jjshs.70.63。
李建军,李建军。细胞扩张在急性胰腺炎患者胰腺炎发病中的作用。中国生物医学工程学报,2011,30(5):745-756。
王晓明,王晓明,王晓明,等。拟南芥分生后叶根发育的调控机制。发展,2007,34(6):1045-1050。10.1242 / dev.02774。
Greb T, Clarenz O, Schafer E, Muller D, Herrero R, Schmitz G, K:拟南芥腋窝分生组织形成的保守调控机制。基因工程学报,2003,17(9):1175-1187。10.1101 / gad.260703。
王晓明,王晓明,王晓明,等。拟南芥茎尖中WUSCHEL蛋白的表达及其调控机制。遗传学报,2011,25(19):2025-2030。10.1101 / gad.17258511。
陆生植物生长素偶联物及其在植物发育和进化中的作用。实验学报,2011,62(6):1757-1773。10.1093 / jxb / erq412。
张建军,张建军,张建军。生长素反应因子。植物学报,2007,10(5):453-460。10.1016 / j.pbi.2007.08.014。
王志强,王志强。植物生物学研究——花的四分之一。自然科学学报,2001,39(6):469-471。10.1038 / 35054172。
Saeed AI, Bhagabati NK, Braisted JC, Liang W, Sharov V, Howe EA, Li J, Thiagarajan M, White JA, Quackenbush J: TM4微阵列软件套件。方法酶学杂志,2006,11:134-193。
Livak KJ, Schmittgen TD:利用实时定量PCR和2(T)(−Delta Delta C)方法分析相对基因表达数据。方法,2001,25(4):402-408。10.1006 / meth.2001.1262。
李建军,李建军,李建军,等。番茄发育过程中内控基因的实时荧光定量pcr研究。植物生态学报,2008,28(1):131。10.1186 / 1471-2229-8-131。
Kikawada T, Saito A, Kanamori Y, Nakahara Y, Iwata KI, Tanaka D, Watanabe M, Okuda T:海藻糖转运蛋白1,一种方便的高容量海藻糖转运蛋白,允许外源海藻糖进入细胞。美国国家科学促进会。中国生物医学工程学报,2009,31(6):559 - 561。10.1073 / pnas.0702538104。
致谢
作者感谢Akemi Koma女士提供的技术援助。本研究得到了“生物产业创新基础与应用研究促进计划”(BRAIN)的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
TN和YI设计了研究;TN进行研究并分析数据;MF有助于微阵列数据分析;YS参与了样品的制备;TN和YI写了这篇论文。所有作者都阅读并批准了最终稿。
电子补充资料
12870 _2012_1241_moesm3_esm.pdf
附加文件3:通过RT-PCR检测芯片数据,验证在芯片检测中表现出AZ优先表达的基因。通过微阵列和RT-PCR检测,比较了花梗区域AZ、Prox和Dis 10个基因的转录水平。两种方法得到的结果对所有检测基因均具有良好的一致性。作为RT-PCR检测的内部对照(Ctrl),沙子(SGN-U316474) [96].(pdf 670kb)
12870 _2012_1241_moesm7_esm.pdf
附加文件7:用RT-PCR验证Prox和Dis基因差异表达的微阵列数据。通过芯片检测和RT-PCR检测,比较了花梗区AZ、Prox和Dis 11个基因的转录水平。两种方法得到的结果对所有检测基因均具有良好的一致性。作为RT-PCR检测的内部对照(Ctrl),沙子(SGN-U316474) [96].(pdf 781kb)
12870 _2012_1241_moesm8_esm.pdf
附加文件8:取花后花梗脱落的频率。取花梗上的花诱导脱落,计数脱落花梗数。共使用206个花梗进行分析。(pdf 163kb)
12870 _2012_1241_moesm9_esm.pdf
附加文件9:的表达提单,吐唾沫,Ls, LeWUS和TAPG4在开花时番茄花梗的AZ内。将花梗开花时AZ的组织切片与digg标记的反义探针杂交提单,吐唾沫,Ls LeWUS和TAPG4,在管状维管细胞中检测到杂交信号,但在检测其感觉探针时未检测到特异性信号。每个基因的信号用箭头表示。(pdf 3mb)
12870 _2012_1241_moesm10_esm.pdf
附加文件10:TA50096_4081的表达模式ARF9同源物)和AK319758 (anIAA29同源物)在番茄花花梗。AK319758转录本水平在Dis最高,向Prox逐渐降低;TA50096_4081在Prox中的表达量明显高于Dis。通过微阵列检测表达信号强度,误差条表示该检测的生物三次重复的标准偏差。(pdf 143kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
中野,T.,藤泽,M.,岛,Y.。et al。番茄脱落前花梗的表达谱提供了对脱落区特性的深入了解,包括对脱落信号的响应能力。BMC Plant Biol13,40(2013)。https://doi.org/10.1186/1471-2229-13-40
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-40
关键字
- 番茄(茄属植物lycopersicum)
- 离层区
- 花花梗
- 生长素
- 拍摄分生组织
- 对失踪信号作出反应的能力
- 转录因子
- MADS-box基因