摘要
背景
香蕉栽培品种大多来源于野生二倍体亚种之间的杂交穆萨acuminata(基因组)和m . balbisiana(B基因组),它们表现出不同程度的倍性和基因组结构。“巴西农业研究公司”的原址穆萨集合包含超过220个资料,其中只有少数已遗传特征。有关现代栽培品种和野生近缘种之间的遗传关系和多样性的知识将有助于保护和育种策略。我们的目标是基于内部转录间隔区(ITS)多态性和流式细胞术测定所有材料的倍性来确定基因组结构,并基于结构软件使用简单序列重复(SSR)位点作为共显性标记来研究收集的群体结构,这在以前没有进行过穆萨.
结果
在流式细胞术分析的221份材料中,212份(95.9%)证实或建立了正确的倍性,而ITS区域的消化证实了209份(94.6%)的基因组结构。基于SSR二进制数据的邻居连接聚类分析可以检测出两个主要的群体,基本上由B基因组的存在与否来区分,而亚群体则根据基因组组成和商业分类来形成。利用贝叶斯方法对SSR的共显性特性进行了群体结构分析,共检测出21个亚群体。大多数亚群体符合聚类分析。
结论
流式细胞仪、ITS和SSR的数据支持了A和B基因组发生同源重组的假设,导致每个亲本基因组的套数或部分存在差异。在香蕉的进化过程中,这些现象在很大程度上被忽视了,因为“单步驯化”假说长期占据主导地位。这些发现将对未来的育种方法产生影响。结构分析使最近通过育种程序开发的四倍体杂交种和一些三倍体的祖先得以有效检测。然而,对于主要的商业亚群,结构似乎在二倍体群体中检测祖先的效率较低,可能是由于采样限制。通过推断亲本间的隶属关系来纠正遗传结构的影响,为利用关联作图进行标记辅助选择提供了可能。
背景
种植的香蕉及大蕉(穆萨)原产于东南亚及西太平洋[1,2].从原点的中心,穆萨sp在古代被引入非洲,并被欧洲探险家带到美洲和世界其他地方[3.,4].目前,香蕉和大蕉(以下统称香蕉)作为许多国家重要的主食和商品,广泛种植于热带和亚热带地区[5].
绝大多数香蕉品种是由野生二倍体种子亚种之间的自然杂交而来m . acuminataColla (A基因组)和m . balbisianaColla (B基因组)[6].大多数现代栽培品种含有不同倍性水平的基因组组合,如二倍体(AA;BB;或AB;2n= 2x= 22);三倍体(AAA级;艺术展;或ABB;2n= 3x= 33);四倍体(AAAA;AAAB;AABB;或ABBB;2n= 4x= 44) [6].目前还不清楚野生香蕉是如何被驯化的,但有可能是随着果肉质量的增加和种子的缺乏,不育性的积累和单性性的获得,然后是人类的选择,产生了现代的主要不育品种[7- - - - - -10].
数量有限非原位世界各地的保育馆藏(http://www.crop-diversity.org/banana/),与重要品种相关的育种项目甚至更少。其中一个罕见的例子是位于巴西巴伊亚州克鲁兹达斯阿尔马斯(12°39′59”S;39°06“00”W)。这非原位该收藏包括220多份个人资料,是由已故的肯尼思·谢博德博士于1981年开始努力的结果,他利用他在国际组织中的重要个人网络和信誉获得和介绍穆萨来自不同国家的物种种质[11].尽管保存了广泛的遗传资源,但育种计划中只使用了少数资源,这可能是因为缺乏特征和遗传特性。
对种质的倍性和基因组组成的精确测定对于确定杂交方案非常有意义,因为这两个基因组(A和B)的组合决定了农学属性(例如,产量;对生物因素的抗性),以及由此产生的杂交植物的果实风味和品质[12- - - - - -14].此外,估计各种野生和栽培品种之间的遗传多样性和遗传关系将有助于开发新的育种方法和协助长期保护战略。
测定倍性穆萨染色体计数[15],估计气孔大小和密度,或测量花粉颗粒大小[16],而对于基因组组成(基因组A和/或B)的表征,传统上使用一组15个标准形态描述符[6].但这些常规方法精度不高,对环境影响大,繁琐耗时,不适合大规模应用。流式细胞术是一种快速的方法,能够检测DNA含量的微小变化,并有效地确定倍性水平穆萨spp。17- - - - - -19].以确定基因组的组成穆萨基于Nwakanma等人开发的rDNA区域的PCR-RFLP标记[20.]似乎有效[21],但结果在估计遗传多样性的能力方面是有限的。另一方面,简单序列重复(SSR)位点与基因组特异性等位基因[22,23]提供了识别基因组组成和估计遗传多样性的可能性非原位保护收藏。
尽管微卫星(SSR)位点具有多等位基因和高信息性的特性,但其等位基因信息在研究中仍然存在穆萨由于在具有不同倍性水平的杂合基因型之间难以建立等位关系,通常被转换为二进制数据[9,21,22,24- - - - - -29]和多体遗传[29].利用软件Structure [30.- - - - - -32]可能为建立不同品系之间的等位基因关系提供了新的视角,从而推断栽培品种和野生品系之间的祖先m . acuminata亚种。基因结构的测定非原位种群对于确定遗传关系很重要[11,33]及建立核心馆藏[34].此外,Structure的使用将允许在关联映射模型中采用的联接之间估计成员矩阵[35来纠正导致错误关联(假阳性)的基因结构。关联映射是一种特别适合的方法穆萨Spp,因为非亲缘关系的个体可以在一个群体中取样,例如非原位种质资源集或优良品种集[36- - - - - -38],不需要发展隔离种群,限制在穆萨由于不育,不相容[39],由于染色体畸变和不可活基因等位基因的分离,杂交种生存能力低[40,41].
因此,本研究的目标是(i)特征的加入非原位通过流式细胞仪和PCR-RFLP对巴西保存藏品的倍性和基因组结构进行分析;(ii)利用在结构上实现的贝叶斯模型,通过探索SSR位点的共显性性质来建立遗传关系。
方法
植物材料
共有224项入选穆萨包括野生材料和栽培材料,倍性和基因组构成明显不同(表1;额外的文件1:表S1)。唯一可用的护照信息是遗传的起源,有一个假定的基因组结构。香蕉品系分类为子类群成员(如“Pome”;“丝”;和“卡文迪什”)之前是由育种家进行的。其他信息,如亚种或亚群,从穆萨种质资源信息系统(http://www.crop-diversity.org/banana/) [42].
流式细胞术分析
为了确定倍性,除了等量的内标外,每个样品中大约20至30毫克的新鲜年轻健康叶片组织Pisum一[43],用刀片在含有适当缓冲液的培养皿中切碎[44来溶解细胞并将细胞核释放到悬浮液中。核悬浮液经50 μm滤网过滤,用25 μL / 1 mg mL染色-1取碘化丙啶,再加入5 μL RNase溶液(100 μg mL-1).每个增加代表的样本来自三个个体,每个个体有一片叶子。对于每个样本,使用FACSCalibur流式细胞仪(Becton Dickinson & Co.;使用CellQuest (Becton Dickinson)软件获得了含有细胞核计数和荧光值的直方图。DNA含量的统计数据采用WinMDI 2.8 (http://facs.scripps.edu/software.html).DNA含量以pg (2C)为表达单位p .一标准为2C = 9.09 pg。
PCR-RFLP内部转录间隔区(ITS)的扩增
利用引物扩增核糖体基因ITS1-5.8S-ITS2区域ITS1而且ITS4[45]用于PCR-RFLP方法[20.].扩增反应(最终体积为25 μL和25 ng基因组DNA)和循环条件与[20.],底漆浓度除外(每个底漆0.2 μM)。每个反应取5 μL进行电泳扩增。剩余20 μL用2u消化RsaI (Fermentas),加入2.5 μL 1X Tango缓冲液,在37℃下孵育3 h,在0.5X TBE (90 mM Tris;90mm硼酸;2.5 mM EDTA, pH 8.3)在4v cm下运行2小时-1.
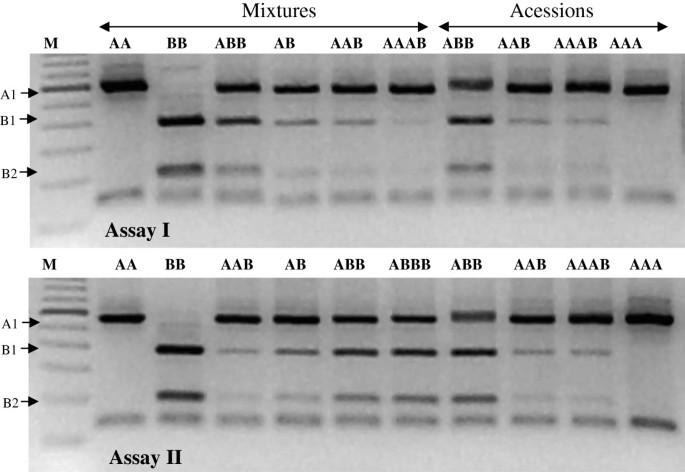
为了区分不同剂量的基因组混合物,片段和条带强度的谱图最初是由来自DNA样本的顺序混合物建立的m . acuminata(AA;《加尔各答》(Calcutta 4))和m . balbisiana(BB;' Butuhan ')基因组,以获得各种人工基因组组合。在第一个实验中,等量的AA和BB DNA按以下摩尔比例组合:1AA:2BB;1 aa: 1 bb;2 aa: 1 bb;和3AA:1BB分别模拟ABB、AB、AAB和AAAB。第二种方法为2AA:1BB;1 aa: 1 bb;1 aa: 2 bb;制备1AA:3BB,分别模拟AAB、AB、ABB和ABBB基因型。 Accessions 20 (ABB); 53 (AAB); 84 (AAAB); and 142 (AA) with known genomic constitutions (Additional file1:表S1)作为两种试验的阳性对照(图1)1).
放大后ITS区域的限制谱(阴性图)。验证A和/或B基因组剂量之间的竞争,用于rDNA区域的扩增和消化穆萨.分析我: aa (1aa: 0bb);BB (0 aa: 1 BB);ABB (1 aa: 2 bb);AB (aa: 1 bb);艺术展(2节aa: 1 bb);AAAB (3 aa: 1 bb);ABB,艺术展;AAAB;AA。试验二世: aa (1aa: 0bb);BB (0 aa: 1 BB);艺术展(2节aa: 1 bb);AB (aa: 1 bb);ABB (1 aa: 2 bb);ABBB (1 aa: 3 bb);ABB;艺术展;AAAB;AA。 M: 100 bp ladder.
SSR位点分析
共检测了21个SSR位点(附加文件1:表S2),包括来自' Ma '系列的两个基因座[46];《AGMI》系列中的三部[47];四个' Mb '位点从m . balbisiana[48];8从m . acuminata商品品种“欧罗”(AA) (毛) [23];四个新位点,其中两个来自“Ouro”()和另外两个来自m . acuminata《加尔各答4》(MaC-CEN).扩增反应含25 ng DNA;1.5 mM MgCl2;每个dNTPs 100 μM;每个底漆0.2 μM, 1.2 UTaq聚合酶放入1x PCR缓冲液(Fermentas)中,最终体积为10 μL。使用触地循环进行放大[23].在自动DNA分析仪中分析这些基因座,并对每个基因座分别进行扩增反应,每个基因座都有一个前向引物,其中包含三个附加尾序列中的一个[49]相当于浓度为0.02 μM的荧光底漆。每个个体三种荧光中的每一种扩增反应各取1 μL,与12 μL Hi-Di甲酰胺(应用生物系统公司)和0.5 μL ROX-500标准尺寸(35-500 bp)(应用生物系统公司)混合,原始浓度为8 nM。然后将该混合物在94ºC下变性5分钟,并在注射前冷藏。样本装入ABI PRISM 310遗传分析仪,并使用GeneScan和基因型仪(应用生物系统公司)分析结果。
SSR数据的统计分析
对于所有的加入(2x;3.x;和图4x),各SSR位点的多态性信息含量(PIC)为图片我f = 2我(1 - f)我),在那里我是信息的吗我th标记;f我是扩增等位基因的频率(条带的存在)和(1 - f我)为零等位基因的频率[50].PIC表示为各位点的平均值。标记指数(MI)估计为mi = picxEMR,在那里EMR是由总片段数(Na)和多态频带的比例(β=多态带数/总带数)[51].为了比较二倍体,使用PowerMarker v3.25估计PIC和平均杂合度(Ho) [52].
采用两种方法对各种质间的遗传结构和多样性进行了研究。在第一种情况下,多态性被视为二进制数据(存在或不存在)。然后使用Jaccard指数(使用Genes[)软件将二进制数据用于获得不相似矩阵。53].利用矩阵进行基于Neighbor-joining的聚类分析[54]使用Mega 4.0 [55].为了确定亲本间的遗传结构,采用了基于标记的共显性性质的第二种方法,使用使用structure 2.3.2软件实现的贝叶斯方法,假设每个个体的基因组的某些部分来自k个群体,以其等位基因频率为特征[31,56].输入文件根据多重倍体进行准备[32的适应性。由于四倍体的等位基因分布与三倍体相似,大多数位点的等位基因分布在1 ~ 3个之间,所有的四倍体均被标准化为三倍体。对于具有两个以上等位基因的二倍体和具有三个以上等位基因的三倍体,从分析中删除等位基因过多的位点,认为缺失。对于只显示两个等位基因的三倍体和四倍体,有必要认为一个等位基因是重复的。生成了两个可供选择的矩阵:一个是根据碱基对考虑最小的等位基因,另一个是根据碱基对考虑最大的等位基因,在矩阵中进行复制。这样,一个等位基因a的三倍体1一个2(一个1<一个2)被认为是A1一个1一个2或者一个1一个2一个2,创建两个文件进行分析(分别为analysis I和analysis II)。确定总体数量(k)后,隶属度(矩阵问)采用Jing等提出的Pearson相关对结构分析ⅰ和结构分析ⅱ进行比较。[57].因此,矩阵之间的高相关值表明这些方法之间具有相似的遗传结构。
现代香蕉品种的起源涉及种内杂交和种间杂交,采用混合模型和等位基因频率相关。每个k使用150000次磨合,然后使用70000次蒙特卡洛马尔可夫链,从2到30不等,每个k运行10次。根据可能性的最高对数值(LnP(k))并使用Evanno等人开发的方法来选择可能的总体数量。[58].
结果
用流式细胞仪测定倍性
用流式细胞仪分析每一株的叶片样本,以确定倍性,并在pg中估计2C值(表2)1).77份二倍体材料(AA;BB;而且Rhodochlamys)呈现出2C = 2的平均值x= 1.26 pg,从1.22到1.30 pg不等。艺术展;或ABB)的平均温度为2C = 3x= 1.93 pg,差异在1.86 ~ 1.99 pg之间,而23份四倍体(AAAA或AAAB)的平均含量为2C = 4x= 2.45 pg,范围为2.28至2.56 pg(表1).总体平均水平m . acuminata基因组(A)和m . balbisiana(B)估计为2C = 1.25 pg。样品间总变异系数为3.31%,范围为1.23 ~ 4.56%。
在224份评估资料中,221份来自section穆萨3个来自分部Rhodochlamys。从穆萨节(表1;额外的文件1:表S1)中,有3个品种(204、205和215)首次定义了倍性,另有5个品种(54、80、123、201和202)的倍性水平与护照信息不一致。对于4个种质(56、102、206和218),流式细胞仪无法测定倍性,而5个种质(10、11、21、117和183)表现出混倍性(表2)1).
奇怪的是,流式细胞术分类为二倍体的201 (' Pitogo ')和204 (' Marmelo '),通过ITS PCR-RFLP显示了典型的ABB谱(比较7号和8号车道,上图)2).在聚类和结构分析中,这两个样本都被归为ABB3.而且4下文)。
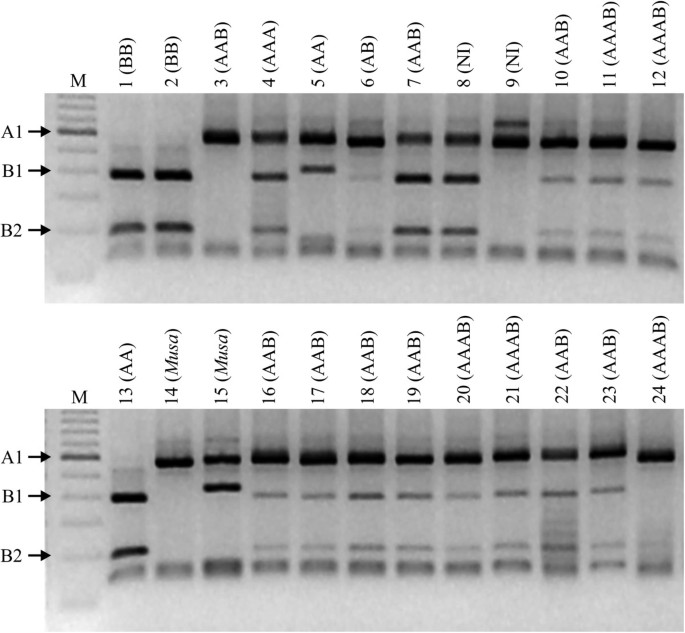
扩增ITS区域的限制谱穆萨具有不同基因组组成的资源。ITS1-5.8S-ITS2区消化后扩增产物Rsa一、选录一:《布土汉》;2: BB 'Panama ';第3集:“Figue Rose Naine”;4:“Tugoomomboo”;5:“但是”;6:“PachaNadan”;7:“Njok Kon”;8:“Marmelo”;9: ' Lareina BT100 ';10:“PisangCeylan”; 11:‘PV42-114’; 12:‘PV03-76’; 13: ‘Diplóide Bélgica’; 14:穆萨laterita;15:“Musa Royal”(毛蕨x毛蕨);16: ' Prata Ponta Aparada ';17:“Chifre Vaca ';18:“Pulut”;19:“Pratao”;20:“Pacovan肯”;21:“Garantida”;22:“Kelat”;23:“Java IAC”;24小时:“热带BRS”。 Genomic composition determined by morphology is between parentheses. NI no information on genome composition; (穆萨):从Rhodochlamys;M: 100 bp的梯子标记。箭头指向A基因组的530 bp片段(A1);350和180 bp特异性B基因组(B1和B2)。
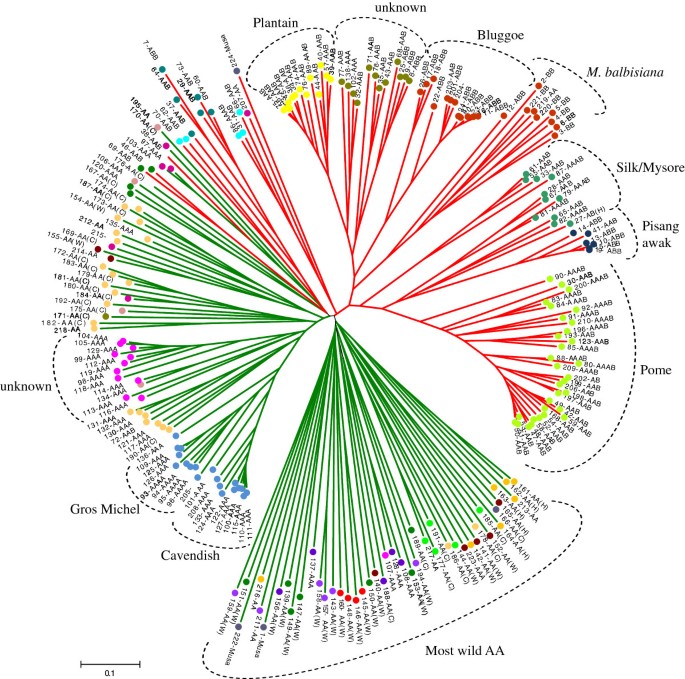
对224个种质资源的亲缘关系进行了图谱分析让其它基于Jaccard不相似指数的Neighbor-joining聚类方法,获得了‘Embrapa Mandioca Fruticultura’中心16个SSR位点的保护资料。包括基于护照数据的基因组组成。全圆颜色与图有关6.含有A基因组的获取m . acuminata显示在绿色分支线,B基因组来自m . balbisina在红色的分支线上。
基于ITS-PCR-RFLP的基因组结构表征
评估Nwakanma等人提出的方法是否。[20.]将能够区分基因组结构和倍性,初步分析是使用来自m . acuminata(《加尔各答4》)和m . balbisiana(' Butuhan ')基因组,以获得各种人工组合的基因组,模仿自然的基因组。在第一个试验中,基因组剂量的增加显示出BB更强烈的b特异性条带(350和180 bp),其次是ABB、AB、AAB和AAAB(图1;BB、ABB和AB的基因组组成可能有明显的区别,但AAB和AAAB之间没有明显的区别。同样,参考基因组' Prata Anã '之间没有明显差异(53;AAB)和《BRS Platina》(84;检测到AAAB)(图1).在第二次试验中,B基因组剂量的增加不允许ABB和ABBB之间的区分(图1;实验II),但在条带强度模式上均与AAB和AB不同。因此,该模拟结果表明,在倍性水平已经确定的情况下,有可能进行基因组结构鉴别。
从所有224份资料中扩增ITS区域,得到约700 bp的片段,并揭示了预期的片段,特征是基因组a和/或B的存在Rsa我(图2).在评估的224个品系中,有3个品系(204、205和215)的基因组结构得到了定义,而13个品系(5.8%)的基因组结构与现有的基于先前发表的或由形态描述符表征的信息所定义的基因组结构不一致,包括品系7、10、11、28、68、72、79、102、195、201、202、203和2191).但在这13份样本中,只有4份(28,79,102和195)似乎真正证明了PCR-RFLP建立的基因组结构不一致。《选集》28o。2》;AAB)和79 (' BRS Tropical ';AAAB)在消化后未表现出b特异性的350 bp片段,而102 (' Tugoomomboo ';AAA)表现出典型的ABB消化模式,195号(' Madu ';AA)在b特异性片段大小上有轻微偏差。通过SSR基因分型的聚类分析,28、79、102和195个种质的基因组结构分别为AAB、AAAB、AAB和AA。
为穆萨以。为代表的二倍体观赏种m . basjoo(加入1;表格1)和杂交种“皇家”(224),后者由该剖面的两个物种杂交而来Rhodochlamys(m .这种xm . velutina) [59],比350 bp处的碎片略大m . balbisiana530 bp从m . acuminata观察碎片。为m . laterita(222);部分Rhodochlamys),只是典型的m . acuminata检测到530 bp片段(图2;表格1).
SSR和遗传多样性分析
在21个检测位点中,只有5个(MaOCEN09;mb1 - 69;mb1 - 134;mb1 - 139;而且AGMI24-25而16个SSR位点从224份材料中成功扩增了182个等位基因,平均每个位点11.5个等位基因,范围在7 ~ 15个之间(附加文件)1:表S2)。通过估计多态性信息含量(PIC)和标记指数(MI)来评价各位点的鉴别能力。为了估计PIC,将微卫星数据转换为二进制格式(存在或不存在波段),因此最大PIC可为0.5。16个位点的平均PIC为0.20,每个位点从0.16到0.30不等,表明所分析的位点具有很大的鉴别能力(附加文件)1:表S2)。MI [51,60]的范围为1.57MaOCEN03到3.24MaC-CEN04平均为2.28。以均值2.28为参考,7个基因座(Ma1-17;AGMI 93/94;MaOCEN01;MaOCEN10;MaOCEN14;MaOCEN19;而且MaC-CEN04)揭示了香蕉的多样性(附加文件)1:表S2)。
总体而言,无论倍性如何,2个等位基因的优势(35.2 ~ 55.8%),1个等位基因的优势(14.1% ~ 60.7%)次之;3人(3.5 - 32.8%);只有一小部分具有4个等位基因(0.3 - 15.6%)2).BB组和ABB组显示单等位基因的比例最大(分别为60.7%和41.9%),其次是野生(41.3%)和栽培AA二倍体(39.7%)。少量二倍体材料在栽培AA(4.2%)、BB(4.1%)和野生AA(3.5%)中均有3个等位基因。3个等位基因的亲本以三倍体(AAB为18.3%,AAA为24.3%)和四倍体(AAAB为28.2%,AAAA为32.8%)为主。4个等位基因的材料很少,大部分为四倍体杂交种AAAA,占15.6%,AAAB占3.0%(表2)2).
研究了栽培AA和BB种质中20个最常见等位基因与其他基因组群和倍性群的关系。总的来说,在培养的AA中,频率最高的等位基因随A基因组剂量的增加而增加(m . acuminata)在高倍性基因组组(图5A).同样,BB中最常见的等位基因随着B基因组剂量的减少成比例减少(m . balbisiana)(图5B)。
栽培二倍体的平均杂合度(62.4%)高于野生二倍体(56.4%)。平均杂合度最低,为37.4%m . balbisiana(附加文件1:图S1),而m . acuminatassp。microcarpa而且m . acuminatassp。burmannica / burmannicoides显示最大的平均杂合度(分别为74%和71.9%)。以BB品种和BB品种的PIC值最低m . acuminatassp。banksii分别为34.2%和36.6%。
集合的聚类分析
基于Neighbor-joining的聚类分析基本上允许检测两个主要的聚类(图3.).第一个集群包含至少一个B基因组副本的接入,而第二个集群包含那些只包含A基因组的接入(图3.),除AAB 38、46和69位点与基因组A位点一起分配外(表21).通过结构分析得到相似的分组(图4).在这两个主聚类中,根据基因组组成和倍性水平的不同,形成了不同的亚聚类。在主要的A或AB类群中,主类群通常证实了子类群的分类,如“Pome”和派生杂种;“车前草”;“丝”;“香蕉awak ';“Bluggoe”;“卡文迪许”;以及“Gros Michel”(图3.).没有事先分类的数据被分配到主要的子组中,允许新的分类,而两个子集群(在图中以“未知”命名)3.)需要进一步调查,以确定适当的亚群分类。一些SSR档案没有差异,可能代表重复的资料(图3.),包括第45和63个来自“Plantain”子群的词条;《Pisang awak》(ABB)中的第15和第19;11和16,20,21和24来自“Bluggoe”(ABB)。
人口结构分析
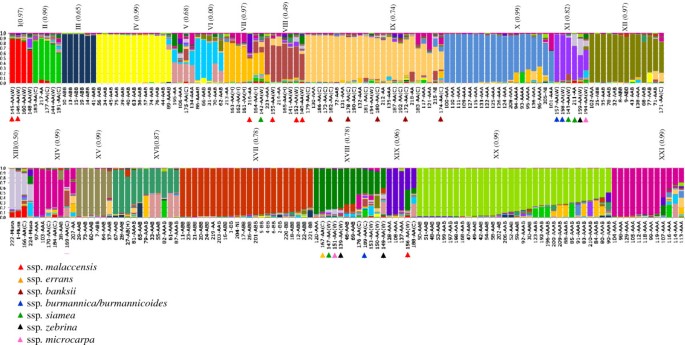
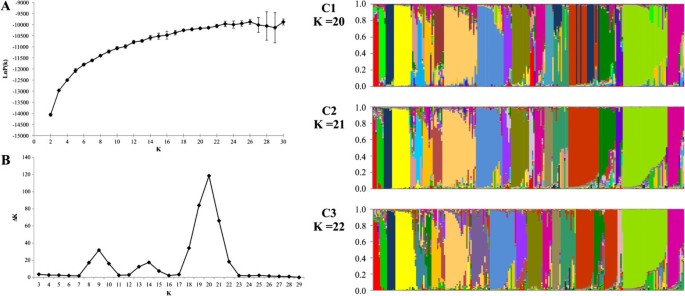
利用SSR标记的共显性性质,利用贝叶斯方法分析了群体结构。测试的亚种群数量(k)在2到30之间6A).为了估计亚种群的大致数量,使用似然对数的最大估计值LnP(K)。然而,对于评估的资源,LnP(K)的值并没有达到一个明确的平台,而是随着测试K之间的方差而继续增加(图6A).在这种情况下,亚种群数量(k)预计在16和23之间(图6A).当k = 20、21或22时,所形成的主要群体没有太大的变化(图6;面板C1, C2和C3)。计算二阶似然变化的方法(Δk)在这些情况下比之前的方法更敏感地检测出亚种群的数量[58].采用这种方法,Δk在k = 21时达到峰值(图6B)。
测试的两种备选矩阵(分析I和分析II)在基因型分配和隶属度值(问).皮尔逊相关系数(r对于大多数组(r = 0.65至0.99),两种不同的替代方法之间的差异是高且显著的(p≤0.01),表明替代矩阵生成的共同祖先之间存在良好的调整(未显示),除了组VI,两种分析之间没有显示任何对应关系(图4).因此,仅使用分析一(见方法)的结果进行讨论。
由结构(图46个含有三倍体或四倍体(III、IV、VI、XV、XX和XXI);另外10种含有二倍体和三倍体的混合物x:3x/ 4x)各组比例:V (2:2);八世(6:1);第九(十七7);第十二(1:12);十四(4:3);十六世(1:10);第十七章(13);十八(9:3);XIX (1:3);和X (12x: 14 3x: 4x).
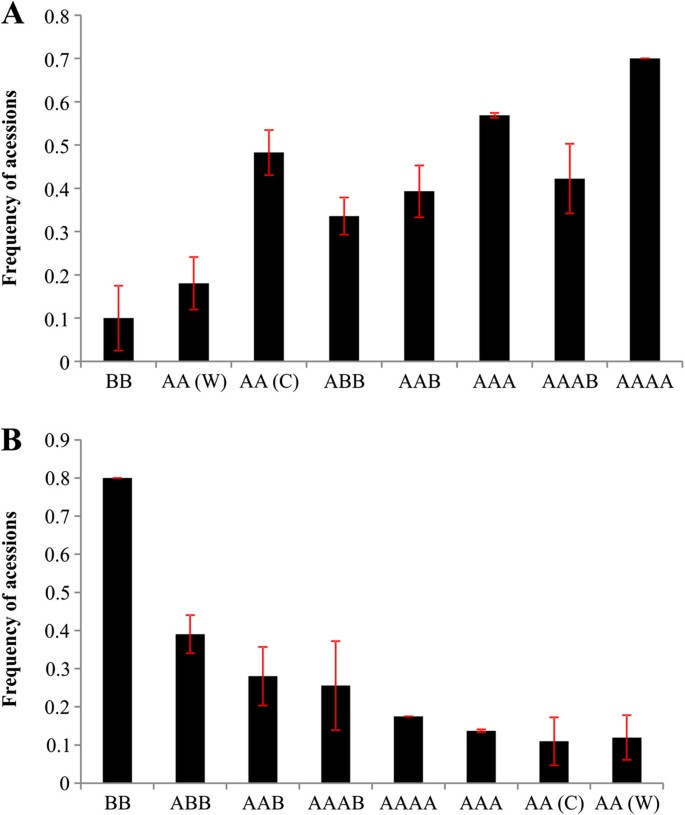
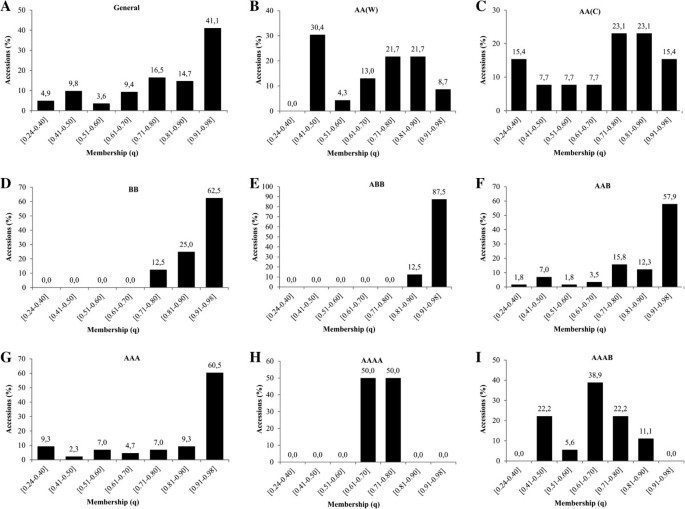
成员值(问)在0.24 ~ 0.60(41个)之间变化;58个品种为0.61 ~ 0.80;0.81 ~ 0.90 33个;且92个样本均大于0.907A).较高隶属度的最大加入频率(0.90 <问≤0.98)均来自ABB基因组群;BB级和AAA级占87.5%;62.5%;和60.5%(图7E;D;G),另一方面,隶属度最小值(问野生二倍体[AA(W)]、栽培二倍体[AA(C)]和AAAB的变异率分别为30.4%、23.2%和22.2%(图2)7B;C;I)主要香蕉栽培亚群(AAA、AAB、ABB)的种质资源总体上表现出较高的隶属度(图4),但加入外加剂(问≤0.90),如第XII组(' Saba '亚组)为43、71、68、77和138;XVI组的第28、33、55、61、65和67号(' Silk ' / ' Mysore '子组);X组为101、136和208(“卡文迪什”/“大米歇尔”亚组);第30、52、59、193和206组在XX组(“Pome”子组);XXI组为107、113、114、116。其他添加外加剂的三倍体均分布在V组;六世;七世;第九;十二世; XIV; XV; XVII; and XIX (Figure4).
从本质上讲,Structure生成的三倍体/四倍体群体与香蕉主要亚群的聚类分析显示的集群相同,例如“Pisang awak”(第三组;数字3.而且4);《大蕉》(第四组);“卡文迪什”和“大米歇尔”(X组);《Bluggoe》(第十七组);“Pome”(组XX),以及组XV, XII和XXI与非分类的接入(图3.而且4).
对于结构分析的二倍体,全部8个m . balbisiana样本和12个ABB样本(80%)被放置在亚群体XVII中(图4).的m . acuminata亚种(附加文件1表S1)分布在不同的集群中:ssp。malaccensis第一组有两名成员;一个在VII;三个在八;还有一个在XIX;ssp。说说第十八组加一人;ssp。banksiiIX组5人;spp。burmannica / burmannicoides还有一次是在十八;ssp。siamea有一人在第七章继承;还有一次是在十八;ssp。zebrina第十一次加入;十八岁有两个;和ssp。microcarpa第十一次加入;第十七节有两个(图4).
二倍体是高度异质的(混合),它们的祖先仍然局限于其他二倍体群体,除了161、162、183和195,它们的祖先是AAA三倍体的XXI组,BB ' IAC '(221)的祖先是' Pisang awak ' (ABB)亚群的III组(图)4).
讨论
倍性和基因组结构的特征
采用流式细胞仪测定224份种质的基因组大小(2C含量)和倍性水平。221部分穆萨只有5个(2.3%)的结果与护照数据相冲突。用形态学表征估计倍性与流式细胞术估计倍性之间有类似的差异已被报道[61,62].以前,人们认为核DNA含量可以很好地预测基因组结构[63],因为BB基因组被认为比AA基因组平均小12% [64].然而,在我们的研究中,基因组A或B的估计大小在不同的倍体和基因组组之间没有差异,因此,仅通过流式细胞仪估计C值无法区分基因组结构。个体A和B基因组大小的微小差异可能会影响基因组结构的预测价值;在三倍体或四倍体中不同基因组染色体组数的变化,包括非整倍体的出现[65];他人的参与穆萨基因组,如S或T基因组的存在(从m . schizocarpa或m . textilis,分别)在某些品种[65];或重组导致基因组大小缺乏可加性,导致A或B基因组比例不同[66,67].
长期以来,人们一直在寻求利用分子标记来确定基因组结构,并尝试使用RAPD [68]或SSR [23,28,47,69,70],但在确定基因组剂量方面精度有限。当我们使用标准品种评估ITS PCR-RFLP方法时,除了Nwakanma等人报道的最小片段(50 bp)外,可以识别所有预期的消化片段。[20.],而这并不是由在网上消化(未显示)。模拟不同的A和B基因组组成和剂量,表明能够区分大多数基因组组合(BB, AAB, ABB和AB);但是AAB不能与AAAB区分,ABB不能与ABBB区分,可能是由于放大竞争。为了成功地采用这种方法,关于倍性的知识是必不可少的[20.].当ITS PCR-RFLP方法应用于整个种质时,如先前报道的,大多数种质的基因组组成与可用的形态学分类一致[21].我们的数据表明,在大多数情况下,使用形态学描述符确定倍性和基因组结构仍然被认为是可靠和有用的,只有少数例外。
值得注意的是,我们的研究发现,少数品种表现出了意想不到的行为,例如“Yangambi no。2’ (28) and ‘BRS Tropical’ (79), recognized as AAB and AAAB, respectively, but they exhibited typical AAA and AAAA digestion profiles. These changes in the restriction profiles for ‘Yangambi nº 2’ and ‘BRS Tropical’ (a tetraploid hybrid from ‘Yangambi nº 2’) might have derived from a variant of the B genome rDNA-locus. Other unusual alleles were identified. For example, ‘Tugoomomboo’ (102), considered as AAA, exhibited an ABB PCR-RFLP profile, but it was classified as AAB by clustering analysis, suggesting the occurrence of the B genome allele for the ITS regions in one of the A genomes. The diploid AA ‘Madu’ (195) was indicated to be AB, with a slight change in the restriction fragment size for the B genome. This alteration in size was derived from a change in theRsaI限制位点,后来通过测序确认(未显示)。这一加入也显示出来自AAB和AAAB的VI组和AAA/AA/AAB的XVIII组的祖先(图4).这样的结果可能与A和B基因组发生重组有关[5,66,67].
中观察到ITS序列的不完全一致进化穆萨具有原始亲本等位基因优势的杂交种可能源于没有有性繁殖[71].但是,通过rDNA ITS和ETS区域的序列分析,观察到意想不到的基因型,这表明A和B之间或之间发生了重组m . acuminata亚种基因组[5,20.,71].在三倍体杂交种(AAB和ABB)和一个异体四倍体(AABB)的减数分裂中,已经实际观察到A和B染色体之间的同源配对和重组,并且似乎以某种频率出现[66,70].
因此,尽管基因组大小之间的差异很小m . acuminata而且m . balbisiana我们认识到,在减数分裂过程中染色体重组和多价配对的发生,导致基因组分离的不平衡,可能会在不同的资源之间产生基因组大小的连续体,重叠差异并削弱区分基因组结构的能力,正如我们的结果和其他人的结果所证实的[61,62].同样,我们对ITS序列的PCR RFLP结果表明,在两个杂交种(AAB和AAAB)中存在B等位基因缺失的重组,或者在ABB和AA的A基因组中存在B基因组等位基因。通常观察到的不完全协同进化的例外可能与有性生殖的发生有关,减数分裂提供了同源染色体配对产生重组染色体的可能性。
遗传多样性和聚类分析
使用了16个SSR位点,揭示了182个等位基因,平均11.5个,而Christelová等[29]对70份二倍体和38份三倍体材料分别检测到平均15.4和14个等位基因。在每个倍性水平内,BB基因组组只具有一个等位基因(纯合子)的比例更高[7],表明遗传变异性较低[72]或在评估的访问中出现大量的空等位基因。相反,在栽培AA种质中,结构杂合度[9,73]可能证明了较大的平均杂合度(62.4%)以及有限的育性[7,9,73,74],与野生二倍体相比(平均56.4%)(补充文件1:图S1)。先前的研究表明,基于SSR标记,栽培AA和野生二倍体的杂合度分别为61%和53% [26],利用RFLP标记对栽培AA和野生AA分别进行61%和53%的检测[7].
在我们的研究中,三倍体中产生一个和两个等位基因的比例很高(超过75%)。香蕉三倍体品种被认为起源于非还原2n配子(恢复第一或第二部分)和减少n配子。当涉及两个不同的基因组时,非还原配子的形成往往更高,例如在亚种之间的AB或AA杂交的情况下m . acuminata,如栽培的二倍体[8,9].在三倍体的情况下,它们最有可能是由杂合子二倍体个体之间的杂交产生的,例如具有非减少配子的培养二倍体(2)n)及另一名人士(n)携带着与父母另一方相似的等位基因。这一假设得到以下发现的支持:在培养的AA二倍体中发现的最常见的等位基因在三倍体和四倍体中观察到的频率增加,含有增加剂量的m . acuminata基因组(图5A).在栽培三倍体和四倍体中存在驯化性状,如孤雌性、不育性和制浆量,证明了与栽培二倍体的相关性[9].此外,奥尔蒂斯[75]研究了非减少配子的发生,并观察到所有产生2 .n配子也可以通过父壳壳产生果实。许多栽培的三倍体呈现出与栽培的二倍体相同的线粒体和叶绿体模式[2].的m . acuminataspp。banksii而且m·a。spp。说说亚种以栽培二倍体为特征,参与了几乎所有栽培二倍体、三倍体和孤雌品种的发育[2,9,10]。
尽管AA(C)在一些加入中有参与的趋势,但只有34% (ABB);39%(艺术展);57% (AAA);42% (AAAB);70% (AAAA)的材料含有此类等位基因。这一事实加强了之前PCR-RFLP的观察,即栽培香蕉的起源可能涉及重组事件(种间和种内)和种间回交以及人类干预。因此,一个品种不能携带来自特定基因组a或B的全部等位基因补体[66].另一方面,8个BB种质中存在的40%的等位基因在ABB上没有被检测到,这很可能是因为ABB在形成过程中存在更大的BB多样性。76]也证实了种间杂交种(如ABB)的B基因组比BB的多样性更大,这表明B基因组的代表性不足m . balbisinana在这些杂交种中,B基因组的亲代供体的多样性或灭绝。我们的研究也发现了这些差异(附加文件1:图S2),但与BB相比,ABB表现得更为均匀(问> 0.91,分别占62.5%和87.5%)7而且4).
通过将SSR基因分型转换为二进制数据并使用它来估计基因型之间的差异,分析显示了广泛的遗传变异性穆萨(附加文件1:表S2)。SSR位点可以根据基因组结构将资源分离为两个主要的集群(一个集群至少有一个B基因组副本,第二个集群仅具有A基因组副本)。一般来说,进一步的细分证实了香蕉的分类(' Pome ', ' Plantain ', ' Cavendish ', ' Gros Michel ', ' Bluggoe ', ' Silk '和' Pisang awak ')。多样性最多的是AA二倍体,多样性较低的是商业利益的亚群,如“Pome”、“Plantain”、“Cavendish”、“Gros Michel”和“Bluggoe”,这证实了先前的研究[21,22,28,29,70,77- - - - - -79].香蕉亚群的特征是具有相似农艺和果实品质性状的基因型[22],它们被认为起源于一个共同的祖先,这意味着,在这些亚群的进化中,一个单一的减数分裂事件和完全缺乏性阶段[78],这证明了基因差异很小。然而,在无性繁殖维持的田间观察到较大的形态差异[78- - - - - -80].表观遗传调控可能有助于阐明与遗传差异无关的亚群内的表型差异[66,76].
基于SSR的聚类分析除了在重复种质的鉴定、倍性水平的定义和种质的基因组构成方面的贡献外,还使我们能够根据自然三倍体种质在表型图中的分配来推断其属于哪个亚群。这是一个关键方面,因为它使我们能够分离具有相似农艺属性的品系。这些信息可以用于育种计划,以开发杂种,这需要一定的农艺或定性的亚群的必要条件。然而,有两个集群(被识别为“未知”;数字3.)需要进一步研究,以作出适当的分类。
群体结构与亲缘关系
据我们所知,这是第一个探索SSR标记共显性性质的工作穆萨利用结构贝叶斯模型对具有不同倍性水平的种质资源进行分析。建立现代栽培品种、本地品种及其野生近缘种的基因组关系及其演化,对于确定人类干预对驯化过程的影响,了解野生物种多样性的地理维度和驯化过程具有重要意义[11].许多物种经历了漫长而复杂的驯化和繁殖时期,基因流动有限,预计存在复杂的种群结构[81,82].
在此,我们建议根据Evanno等提出的方法将224个种质资源划分为21个亚种群(组)。[58].考虑到具有不同基因组结构(AA、BB、ABB、AAB、AAA、AAAA和AAAB)和来自不同基因组群的不同亚群(“Pome”、“Plantain”、“Cavendish”、“Gros Michel”等)的亲本进行分析,类群数量的增加是意料之中的。总的来说,即使考虑到一些等位基因缺失,在以SSRs为优势标记(不排除等位基因)生成的表型图中,结构分组对于大多数形成的群体(特别是三倍体和四倍体)是一致的。两组数据之间的一致性表明,适应并不危及结构分析中使用的等位基因信息,该结构分析还包括每个群体的祖先关系。
有新出现的证据表明,栽培香蕉的进化过程可能不是简单地由杂交、选择和无性繁殖(“单步驯化”)派生出来的,但在某些情况下,减数分裂、重组和受精可能最终发生[5,66,71].在我们的研究中,由隶属度值(q≤90%)给出的混合群体祖先的证据在野生和栽培二倍体中得到了验证,这与育种项目中观察到的四倍体杂交种相似。对于三倍体种质,有证据表明存在外加剂(12.5%的ABB种质;AAA的39.5%;和42.1%的AAB),其祖先大多在两个或多个群体(每个群体的祖先最少),这表明多个起源和/或重组的发生比预期的更频繁。然而,从“Plantain”(V组)、“Cavendish”和“Gros Michel”(X组)和“Pome”(XX组)中提取的样本是高度同质的,只有少数例外。
子组“Pome”(AAB;XX集团;数字4)包含了巴西最多的栽培品种,Embrapa的育种计划主要集中于从部分可育的栽培母本(AAB)之间的杂交衍生出四倍体,产生非减少配子(2n),与雄性二倍体花粉供体(AA),具有新的理想性状,如抗病。在“Pome”亚群(XX)中,从5个推断为混合物的三倍体中,只有59个和193个分别显示出与XVI和II组的明确祖先关系。奇怪的是,据报道,' FHIA-02 '(91)是一个AAAA杂交品种,它是' Williams '和二倍体' SH3393 '的杂交,具有' Cavendish '亚群的特征[83],但在这里它只显示了22%的基因组为“卡文迪什”,这表明它是“Pome”(表1;数字3.而且4).其他二倍体亲本可能没有出现在本研究中的FHIA杂交种,其祖先在X组(' Cavendish ' / ' Gros Michel ')、XVI组(' Silk ' / ' Mysore ')和XIX组(图4).
在聚类分析中,' Cavendish '和' Gros Michel '被分为两个紧密的亚组(图3.);然而,根据结构(图4),这些亚群的代表性遗传出现在同一组中,很可能是因为它们拥有共同的等位基因[2,8].使用RFLP也观察到类似的结果[8]、微卫星[22],以及DArT标记[84],而根据PCR-RFLP显示的细胞器基因组具有相同的细胞型[85].希波吕特等人。[76)提出,从“卡文迪什”和“大米歇尔”亚群中获取的信息来源于一个共同的2n配子捐赠者,很可能是两个不同但基因相近的人,n捐助者。Raboin等人。[8)提出了“Sa”和“KhaiNai On”作为可能的加词n' Gros Michel '子群配子供体。在我们的研究中,两个名称相同的二倍体(173和186)被分配到IX组,但只有X组(' Cavendish ' / ' Gros Michel ')的第136号(' Amritsagar ')具有祖先性(问~ 18%),这支持了“卡文迪什”亚群和“大米歇尔”亚群的二倍体起源。此外,二倍体“Lareina BT100”(205)被归入X组,可能是一个潜在的2n“卡文迪什”和“大米歇尔”的配子捐赠者。因此,来自IX组和“Lareina BT100”的二倍体可能是“卡文迪什”和“大米歇尔”的亲本,可用于杂交程序或染色体操作(加倍),以获得/重新合成“大米歇尔”/“卡文迪什”杂种。
值得注意的是,一些AAB和AAA三倍体材料显示了其他群体的血统,其中包含其他具有相似基因组结构的材料。我们知道,一些杂交种表现出不同程度的剩余生育能力,它们的进化可能包括有性繁殖的阶段,正如回交假说所提出的那样[66].
我们的结果表明,在巴西(“Pome”)和牙买加(“Gros Michel”)育种项目中,最近开发的具有明确谱系的四倍体杂交种和一些三倍体品种的祖先检测中,结构是有效的。然而,这种方法在检测大多数原始三倍体的祖先时似乎效率较低,这些原始三倍体构成了主要的商业亚群(' Pisang awak ';“格罗斯米歇尔”;“卡文迪许”;“梨果”;“车前草”)。这种没有发现祖先的现象可以用一系列假设来解释。
一种可能是主要商业亚群的潜在亲本二倍体在该群体中代表性不足,例如本研究评估的FHIA最近开发的一些四倍体杂交种的二倍体群体中缺乏祖先(图)4).其次,这些三倍体品种自起源以来经历了漫长而不确定的进化时期,可能导致了位点的变化/突变,这可能导致亲本之一的等位基因完全消除或修饰。最近发现的四倍体杂种的祖先检测能力是支持这一假设的重要证据。异源多倍体化过程可导致逆转录转座子的激活;亲本染色体的消除和重排[86,87], DNA序列丢失,显然来自最大的亲代基因组[66,88]和来自高度重复序列区域[89].这类事件可能在年发生过m . acuminata,拥有较大的基因组[62,63]和更多的重复序列m . balbisiana[90].第三,所使用的位点数量有限也是商业种质祖先鉴定缺乏准确性的一个原因,因为大量的位点将增加在栽培的三倍体和祖先的二倍体之间的一组保守多态位点中发现相同等位基因的机会。例如,其他研究人员没有发现“卡文迪什”亚组之间的差异[22],但此子群的加入之间的差异已在这里和Christelová等人确定。[29],最有可能的原因是每个位点所识别的等位基因数量更大。
二倍体与AAB之间的关系可能受到结构组织不同的同源染色体之间可能发生重组的影响,从而导致异体多倍体发生较大的遗传变化[88].A和B基因组之间的重组可能发生,并且在三倍体杂交种中很常见,而这可能导致相对于亲本种的基因组传递不平衡[66,67],证明了AAB基因组的变异、A和B性状的形态表达以及无致瘾性,因为杂交种可能携带不同的重组A和B染色体(如。一个B和B一个) [66].因此,所有这些单独或结合发生的过程,尤指在m . acuminata亚种可以阻碍大多数三倍体遗传的祖先推断。
对于二倍体,聚类分析形成的群体表现出与三倍体和四倍体不同的行为。在结构方法中,使用表征每个群体的等位基因频率,根据似然概率来定义群体[30.],使得该方法在评估个体群体时更加可靠。在我们的研究中,我们对不同亚种的有限数量的资源进行了分析(ssp的7个资源)。malaccensis第I、VII、VIII、XIX组;ssp。说说在十八;五ssp。banksii第IX组;三个sspburmannica / burmannicoides在第十一、十八;四个ssp。siamea在第七、十一、十八;两个ssp。microcarpa在第十一、十八;三个ssp。zebrina此外,这些AA二倍体中有一些可以互交,亚种的分类仅基于时间和空间的隔离,一些种质可能具有亚种间起源[2].
尽管每个亚种的数量有限,但先前研究的推论得到了支持。例如,5个ssp的分组。banksii(IX组)已报道栽培二倍体的种质[2,84]与其他亚种有明显区别[84].穆萨acuminatassp。banksii原产于巴布亚新几内亚和印度尼西亚北部岛屿,地理上与其他亚种隔离,是一种优先的自交配[2].该亚种的平均杂合度较低(55.8%),PIC值较低(36.6%)。这些纯合位点banksiiGrapin等人也报道了培养的二倍体。[73].与其他亚种相比,banksii呈现较高的隶属度值(图4).
4).这两组都含有少量的ssp。burmannica / burmannicoides;ssp。siamea;ssp。microcarpa和ssp。zebrina,证实了基于DArT得到的分组[84],以及ssp之间更紧密的关系。说说和ssp。microcarpa[73].然而,基于PCR-RFLP,这些亚种表现出不同的细胞类型[85].已报道将不同的亚种组合成同一类群[2,9,84].这种行为可能与内部存在的广泛可变性有关m . acuminata[91]或在亚种中存在许多罕见的等位基因[73可能会掩盖遗传关系。此外,标记和分析方法的差异,以及不同的注册名称[76],而某些品种是否属于已确定的亚种仍有疑问[2使研究之间的直接比较变得困难。
结论
的非原位“Embrapa Mandioca Fruticultura”中心的藏品是一种重要的来源穆萨属遗传资源。根据农艺性状进行了性状鉴定,并对黑叶斑病和黄叶斑病进行了抗病筛选,镰刀菌素现已确定了它们的倍性、基因组结构和遗传多样性。这项研究代表了定义遗传关系的初步努力穆萨使用在结构中实现的贝叶斯统计,同时探索微卫星的共主导性质,这是以前没有在结构中执行的穆萨.
DNA含量被认为是一个很好的预测基因组构成穆萨但我们的结果证实,这些微小的差异可能由于同源重组的发生而重叠,来自每个亲本基因组的组数或部分的差异,包括非整倍体。同样,ITS rDNA意外等位基因的检测证实了A和B基因组之间或之间发生重组的假设m . acuminata亚种的基因组。在香蕉品种的进化过程中,由于“单步驯化”假说长期占据主导地位,这些现象的出现在很大程度上被忽视了,这些发现将对未来的育种方法产生影响。
结构分析使最近通过育种程序开发的四倍体杂交种和一些三倍体品种的祖先得以有效检测。然而,对于主要的商业亚群,Structure在二倍体群体中检测祖先的效率较低,可能是由于二倍体在集合中代表性不足;评估的分析位点数量有限;或亚群进化过程中的等位基因变化,尤其是异源多倍体。
通过结构建立祖先和遗传关系,可以鉴定IX组和' Lareina BT100 '的二倍体,它们可能与不育'卡文迪什'和'大米歇尔'的亲本有关,这可以用于杂交程序或染色体操作(加倍),以获得/重新合成'大米歇尔' / '卡文迪什'杂交种。使用贝叶斯分析推断存取的隶属度的可能性为其在标记辅助选择中的使用提供了可能性,通过结合结构的影响(隶属度矩阵;问matriz),以控制假阳性(I型错误)[35,92].
随着的完成穆萨基因组测序[93],加上新一代测序技术的发展,提高基因组信息的精度将有助于更好地定义栽培香蕉及其二倍体亲本之间的关系。对来自不同亚种的大量二倍体材料进行评价,可以更好地确定二倍体和三倍体品种之间的关系,因此,可以使用这种方法来协助育种计划制定新的策略。
参考文献
- 1.
西蒙兹西北:香蕉的进化。伦敦:Longmans Green;1962.
- 2.
Carreel F, Leon DG, Lagoda P, Lanaud C, Jenny C, Horry JP, Montcel TH:确定母系和父系穆萨通过叶绿体和线粒体DNA RFLP分析。基因组学报,2002,45(4):679-692。10.1139 / g02 - 033。
- 3.
De Langhe E, Vrydaghs L, Maret P, Perrier X, Denham T:《香蕉为什么重要:香蕉驯化史简介》。应用生态学报,2009,27(1):379 - 379。
- 4.
Valmayor RV:分类和表征穆萨新奇的,米.alinsanaya而且m . acuminatassp。说说.信息科学,2001,10(2):35-39。
- 5.
Boonruangrod R, Fluch S, Burg K:利用5’ets rDNA序列信息鉴定现代杂交香蕉品种的起源。生物育种,2009,24(1):24-77。
- 6.
Simmonds NW, Shepherd K:栽培香蕉的分类和起源。植物生态学报,2004,27(3):344 - 344。10.1111 / j.1095-8339.1955.tb00015.x。
- 7.
Carreel F, Faure S, Gonzalez De Leon D, Lagoda PJL, Perrier X, Bakry F, Tezenas Du Montcel H, Lanaud C, Horry JP:评价la diversité二倍体香蕉的遗传学之家(穆萨spp)。生态学报,1994,26(1):125-136。10.1186 / 1297 - 9686 - 26 - s1 - s125。
- 8.
Raboin LM、Carreel F、Noyer JL、Baurens FC、Horry JP、Bakry F、Du Montcel HT、Ganry J、Lanaud C、Lagoda PJL:三倍体出口香蕉品种二倍体祖先的分子鉴定n恢复配子捐赠者和n配子捐赠者。生物育种,2005,16(4):333-341。10.1007 / s11032 - 005 - 2452 - 7。
- 9.
Perrier X, Bakry F, Carreel F, Jenny C, Horry JP, Lebot V, Hippolyte I:结合生物学方法揭示可食用香蕉的进化。应用生态学报,2009,7(1):199-216。
- 10.
Perrier X, Langhe E, Donohue M, Lentfer C, Vrydaghs L, Bakry F, Carreel F, Hippolyte I, Horry J-P, Jenny C, Lebot V, Risterucci A-M, Tomekpe K, Doutrelepont H, Ball T, Manwaring J, Maret P, Denham T:香蕉的多学科视角(穆萨spp)驯化。《美国国家科学院学报》上。2011, 5: 1-8。
- 11.
INIBAP。基因改良:唯一可持续的解决方案-向我们的同事致敬。INIBAP 2001年度报告。蒙彼利埃;2002: 34-37。http://www.musalit.org/pdf/IN030400_en.pdf.
- 12.
Robinson JC:香蕉和大蕉。英国:CAB International;1996.
- 13.
王晓玲,蒋提,Roux N,郝刚,葛晓军:野生香蕉的遗传多样性(穆萨balbisianacora)的AFLP标记显示。作物学报,2007,54(5):1125-1132。10.1007 / s10722 - 006 - 9004 - 9。
- 14.
何建平,王晓明,王晓明,等:水稻数量性状遗传的倍性与性别效应穆萨物种。作物学报,2009,3(6):367-373。
- 15.
荠菜K:荠菜属的细胞遗传学。蒙彼利埃:INIBAP;1999.
- 16.
杨晓明,王晓明,王晓明,等:植物物候学与植物产量的结合。生态学报,2004,27(3):344 - 344。10.1023 /: 1018638120145。
- 17.
doleel J, Lysak MA, Van den Houwe I, dolezelova HM, Roux N:流式细胞仪快速测定Musa种倍性。信息学报,1997,6(1):6-9。
- 18.
杜丽娟,李丽娟,李丽娟,李丽娟,李丽娟:利用流式细胞仪和分子细胞遗传学技术分析猕猴桃基因组。中国生物医学工程学报,1999,8(1):3-4。
- 19.
张晓明,张晓明,张晓明,等。大豆倍性与基因组组成的关系穆萨国际热带农业研究所(IITA)的种质资源。生物技术学报,2006,5(13):1224-1232。
- 20.
Nwakanma DC, Pillay M, Okoli BE:核糖体DNA内部转录间隔子(ITS)的PCR-RFLP为A和B基因组提供了标记穆萨刘志军。理论与应用。2003,30(3):344 - 344。10.1007 / s00122 - 003 - 1402 - 1。
- 21.
宁斯鹏,徐力斌,陆勇,黄伯忠,葛晓军:水稻基因组组成与遗传多样性穆萨利用PCR-RFLP和SSR标记对来自中国的种质资源进行了鉴定。科学通报,2007,44(4):379 - 379。10.1016 / j.scienta.2007.07.002。
- 22.
Creste S, Tulmann Neto A, Silva SO, Figueira A:香蕉品种的遗传特征(穆萨spp.),使用微卫星标记。自然科学进展,2003,29(3):344 - 344。10.1023 /: 1025047421843。
- 23.
Creste S, Benatti TR, Orsi MR, Risterucci AM, Figueira A:一个商业品种微卫星位点的分离和特征穆萨渐尖.分子生物学通报,2006,6(2):303-306。10.1111 / j.1471-8286.2005.01209.x。
- 24.
Crouch JH, Crouch HK, Tenkouano A, Ortiz R:基于vntr的2倍和4倍全同胞多样性分析穆萨混合动力车。电子生物技术,1999,2(3):130-1139。
- 25.
乌德,皮莱,李文华,李文华,等穆萨acuminata阿胶,穆萨balbisianacola和它们的一些自然杂交品种使用AFLP标记。应用物理学报,2002,44(8):1246-1252。10.1007 / s00122 - 002 - 0914 - 4。
- 26.
Creste S, Tulmann Neto A, Vencovsky R, Silva SO, Figueira A:植物遗传多样性穆萨利用微卫星标记估计巴西香蕉育种项目的二倍体和三倍体。作物学报,2004,51(7):723-733。
- 27.
Jesus ON, Câmara TR, Ferreira CF, Silva SO, Pestana KN, Soares TL: Diferenciação molecular de ares菁英香蕉。中国农业生态学报,2006,41(12):1739-1748。10.1590 / s0100 - 204 x2006001200008。
- 28.
阿莫林EP, Reis RV, Santos-Serejo JA,阿莫林VBO, Silva SO: Variabilidade genética estimada entre diplóides de banana por meio de marcadores microssatélites。中国农业生态学报,2008,43(8):1045-1052。10.1590 / s0100 - 204 x2008000800014。
- 29.
Christelová P, Valárik M, Hřibová E, den HouweI V, Channelière S, Roux N, doleel J:一种高效基因分型平台穆萨使用微卫星标记。植物学报,2011,1:1-14。
- 30.
Pritchard JK, Stephens M, Rosenberg NA, Donnelly P:结构化群体的关联映射。中国科学(d辑),2000,26(1):1 - 8。10.1086/302959。
- 31.
李志强,李志强,李志强,等。基于多位点基因型数据的种群结构推断。遗传学报,2000,37(3):344 - 344。
- 32.
Pritchard JK, Wen W:结构软件文档,2.3版。芝加哥:芝加哥大学人类遗传学系;2011.http://pritch.bsd.uchicago.edu/structure.html.
- 33.
Stajner N, Satovic Z, Cerenak A, Javornik B:啤酒花的遗传结构与分化忽花布L.),由微卫星推断。生态学报,2008,29(3):344 - 344。10.1007 / s10681 - 007 - 9429 - z。
- 34.
东TL, Heerwaarden J, Jansen J, Hintum TJL, Eeuwijk FA:传统的分子标记数据分级聚类方法是否适用于种质资源遗传结构的测定?应用理论与实践,2011,29(1):1 - 5。10.1007 / s00122 - 011 - 1576 - x。
- 35.
Yu J, Pressoir G, Briggs WH, Bi IV, Yamasaki M, Doebley JF, McMullen MD, Gaut BS, Nielsen DM, Holland JB, Kresovich S, Buckler ES:一种用于关联映射的统一混合模型方法,该方法考虑了多个级别的相关性。王志强,2005,30(3):344 - 344。
- 36.
Kraakman ATW, Martinez F, Mussiraliev B, Van Eeuwijk FA, Niks RE:现代春大麦品种形态、抗性和其他农艺相关性状的连锁不平衡映射。生物育种,2006,17:41-58。10.1007 / s11032 - 005 - 1119 - 8。
- 37.
克拉克曼·阿文,范丹·伯格PMMM, Stam P, Van Eeuwijk FA:现代春大麦品种产量与产量稳定性的连锁不平衡映射。中国生物医学工程学报,2004,29(3):344 - 344。
- 38.
Malosetti M, Van der Linden CG, Vosman B, Van Eeuwijk FA:利用谱系信息进行关联映射的混合模型方法5种在土豆。中国生物医学工程学报,2007,27(3):349 - 349。10.1534 / genetics.105.054932。
- 39.
席尔瓦SO,马托斯AP,阿尔维斯EJ: Melhoramento genético de香蕉。Pesquisa Agropecuária Brasileira. 1998, 33(5): 693-703。
- 40.
Fauré SJL Noyer J-PHorry F, Bakry C, Gonzàlez-de-León D, Lanaud:基于分子标记的二倍体香蕉连锁图谱(穆萨acuminata).应用理论,1998,37(4):517-526。10.1007 / BF00215098。
- 41.
Heslop-Harrison JS, Schwarzacher T:香蕉的驯化,基因组学和未来。学报学报,2007,100(5):1073-1084。10.1093 / aob / mcm191。
- 42.
- 43.
王志强,王志强,王志强,等。流式细胞仪检测植物细胞核DNA含量的研究。光子学报,2007,30(2):344 - 344。10.1038 / nprot.2007.310。
- 44.
流式细胞术在植物基因组研究中的应用。应用物理学报,1997,38(3):285-302。
- 45.
White TJ, Bruns T, Lee S, Taylor J:真菌核糖体RNA基因的扩增和直接测序。PCR方案:方法和应用指南。Volume1。编辑:Innis MA, Gelfand DH, Sninsky JJ, White TJ。纽约:学术出版社;1990.315 - 322。1.
- 46.
王晓明,王晓明,王晓明,王晓明,等。微卫星DNA标记的分离穆萨.中国生物医学工程学报,1994,3(1):3-4。
- 47.
Lagoda PJL, Noyer JL, Dambier D, Baurens FC, Grapin A, Lanaud C: Musaceae的序列标记微卫星位点(STMS)标记。分子生物学,1998,7(5):657-666。
- 48.
刘志强,刘志强,王志强,王志强,等。植物微卫星标记的分离与表征穆萨balbisiana.分子生物学通报,2005,5(2):327-330。10.1111 / j.1471-8286.2005.00916.x。
- 49.
任务A, Grattapaglia D:利用多尾引物4色荧光检测植物微卫星基因分型。生物化学学报,2006,1(5):72-78。
- 50.
Roldan-Ruiz I, Dendauw JE, Van Bockstaele E, Depicker A, Loose M:黑麦草AFLP标记显示高多态性率(Loliumspp)。生物化学学报,2000,6:125-126。10.1023 /: 1009680614564。
- 51.
Varshney RK, Chabane K, Hendre PS, Aggarwal RK, Graner A: EST-SSR、EST-SNP和AFLP标记在野生、栽培和优质大麦遗传多样性评价和遗传资源保护中的比较研究。植物科学学报,2007,43(3):344 - 344。10.1016 / j.plantsci.2007.08.010。
- 52.
刘凯,缪斯SV: Powermarker:遗传标记数据集成分析环境。生物信息学,2005,21(9):2128-2129。10.1093 /生物信息学/ bti282。
- 53.
Cruz CD: Programas GENES-versão Windows 2005.6.1。Vicosa: UFV;2001.
- 54.
齐青,倪明:邻接法:一种重建系统发生树的新方法。分子生物学杂志,1987,4(4):406-425。
- 55.
田村K, Dudley J, Nei M, Kumar S, MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。分子生物学杂志,2007,24:1596-1599。10.1093 / molbev / msm092。
- 56.
王晓明,王晓明,王晓明,等:基于多位点基因型数据的群体结构分析。中国生物医学工程学报,2003,34(4):357 - 357。
- 57.
Jing R, Vershinin A, Grzebyta J, Shaw P, Smýkal P, Marshall D, Ambrose MJ, Noel Ellis TH, Flavell AJ:菜豆遗传多样性与进化(Pisum)采用高通量逆转录转座子插入多态性(RBIP)标记分析研究。中国生物医学工程学报,2010,30(4):344。10.1186 / 1471-2148-10-44。
- 58.
李文杰,李志强,李志强。基于软件结构的个体聚类数量检测方法研究。分子生态学报,2005,14(8):2611-2620。10.1111 / j.1365 - 294 x.2005.02553.x。
- 59.
Santos-Serejo JA, Souza EH, Souza FVD, Soares TL, Silva SO: Caracterização morfológica de bananeiras装饰菜。裁判法院,2007,19(4):326-332。
- 60.
Baraket G, Chatti K, Saddoud O, Abdelkarim AB, Mars M, Trifi M, Hannachi AS: SSR和AFLP标记在无花果遗传多样性和保存评价中的比较,无花果L.突尼斯的遗传资源。植物分子生物学学报,2011,29:171-184。10.1007 / s11105 - 010 - 0217 - x。
- 61.
doleel J, Valárik M, Vrána J, Lysák MA, Hibová E, Bartos J, Gasmanová N, Doleželová M, Safár J, Simková H:香蕉分子细胞遗传学与细胞技术(穆萨spp)。香蕉改良:细胞分子生物学和诱导突变,卷1。编辑:Jain SM, Swennen R. Leuven:科学出版社;2001: 229 - 244。
- 62.
香蕉倍性研究(穆萨通过流式细胞术从卢旺达rubona的国家香蕉种质资源收集中分离得到。中华临床科学杂志,2006,72(2):302-305。10.1016 / j.sajb.2005.10.004。
- 63.
Lysák MA, Doleželová M, Horry JP, Swennen R, doleel J:流式细胞术分析木薯核DNA含量。应用理论,1999,98(8):1344-1350。10.1007 / s001220051201。
- 64.
杜丽娟,Doleželová M, Novák FJ:流式细胞法测定二倍体香蕉核DNA含量(穆萨acuminata而且m . balbisiana).生物工程学报,1994,3:351-357。
- 65.
D 'Hont A, Paget-Goya A, Escoute J, Carreel F:栽培香蕉种间基因组结构,穆萨spp.由基因组DNA揭示原位杂化。应用理论,2000,100(2):177-183。10.1007 / s001220050024。
- 66.
De Langhe E, Hřibová E, Carpentier S, doleel J, Swennen R:回交对杂交可食用香蕉的起源有贡献吗?学报学报,2010,36(4):344 - 344。10.1093 / aob / mcq187。
- 67.
Jeridi M, Bakry F, Escoute J, Fondi E, Carreel F, Ferchichi A, D 'Hont A, Rodier-Goud M:利用基因组原位杂交技术发现Musa属植物A、B基因组同源染色体配对。学报学报,2011,38(4):344 - 344。10.1093 / aob / mcr207。
- 68.
Pillay M, Nwakanma DC, Tenkouano A: A和B基因组序列RAPD标记的鉴定穆萨中国生物医学工程学报,2000,43(5):763-767。
- 69.
Crouch HK, Crouch JH, Jarret RL, Cregan PB, Ortiz R: Musa单倍体和二倍体配子微卫星位点的分离。作物科学,1998,38(1):211-217。10.2135 / cropsci1998.0011183X003800010035x。
- 70.
Retnoningsih R, Megia R, Hartana A:印度尼西亚香蕉品种间遗传关系的微卫星标记。中国园艺学报,2011,37(3):344 - 344。
- 71.
Hřibová E, Cizkova J, Christelova P, Taudien S, de Langhe E, doleel J:蘑菇科ITS1-5.8S-ITS2序列的结构、多样性及其在分子系统发育中的应用。PlosOne。2011, 6 (3): e17863。
- 72.
Swangpol S, Volkaert H, Sotto RC, Seelanant:选择非编码叶绿体DNA序列在种间杂交种谱系评估中的应用。生物化学与分子生物学杂志,2007,40(4):577-587。10.5483 / BMBRep.2007.40.4.577。
- 73.
Grapin A, Noyer JL, Carreel F, Dambier D, Baurens FC, Lanaud C, Lagoda PJL:二倍体穆萨acuminata序列标记微卫星位点的遗传多样性分析。电泳,1998,19(8-9):1374-1380。
- 74.
Dessauw D: Étude des facteurs de la sterilité du bananier (穆萨等关系细胞分类学中心m . acuminanta等m . balbisiana阿胶。果树学报,1988,43:539- 539。
- 75.
奥尔蒂斯R: 2的发生和继承n花粉穆萨.王志强,2001,30(4):344 - 344。10.1006 / anbo.1996.0367。
- 76.
希波吕特I,珍妮C,加德斯L,巴克里F,里瓦兰R,波米斯V,库布里P,托梅克佩K,里斯特鲁奇AM,鲁克斯N,鲁阿尔M,阿尔诺E,科列斯尼科娃-艾伦M,佩里耶X:食用基础特征穆萨SSR标记的等位分布显示为三倍体。植物科学进展,2012,29(3):344 - 344。10.1093 / aob / mcs010。
- 77.
Oriero CE, Odunola OA, Loco Y, Ingelbrecht I: b基因组来源的简单序列重复(SSR)标记分析穆萨中国生物工程学报,2006,5(2):126-128。
- 78.
Noyer JL, Causse S, Tomekpe K, Bouet A, Baurens FC:利用SSR、AFLP和MSAP标记评价大蕉多样性的新图像。中国生物医学工程学报,2005,29(1):344 - 344。10.1007 / s10709 - 004 - 7319 - z。
- 79.
克劳奇HK,克劳奇JH, Madsen S, Vuylsteke DR, Ortiz R:大蕉地方品种表型和基因型多样性的比较分析(穆萨spp. AAB组)。应用理论,2000,101(7):1056-1065。10.1007 / s001220051580。
- 80.
奥尔蒂斯R:形态变异穆萨种质。作物学报,1997,44(5):393-404。10.1023 /: 1008606411971。
- 81.
Sharbel TF, Haubold B, Mitchell-Olds T:基于距离的遗传隔离拟南芥:生物地理学和冰川后的欧洲殖民。分子生物学学报,2000,9:2109-2118。10.1046 / j.1365 - 294 x.2000.01122.x。
- 82.
王晓明,王志刚,王志刚:植物连锁不平衡结构的研究进展。植物科学学报,2003,24(3):357- 357。
- 83.
Cruz FS, Gueco LS, Damasco OP, Huelgas VC, Banasihan IG, Lladones RV, Van Den Bergh I: Molina AB:菲律宾引种和本地香蕉品种目录:植物育种研究所示范试验结果。拉古纳:菲律宾大学Los Baños, IPB-UPLB,国际生物多样性和DA-BAR;2007.
- 84.
Risterucci AM, Hippolyte I, Perrier X, Xia L, Caig V, Evers M, Huttner E, Kilian A, Glaszmann JC:用于高通量DNA分析的多样性阵列技术的开发和评估穆萨.应用理论,2009,19(6):1093-1103。10.1007 / s00122 - 009 - 1111 - 5。
- 85.
潘文杰,李文杰,李文杰,李文杰,等。黄曲霉细胞质基因库的鉴定穆萨acuminata阿胶,穆萨balbisianacola及其杂种的叶绿体和线粒体单倍型。应用理论,2008,118(1):43-55。10.1007 / s00122 - 008 - 0875 - 3。
- 86.
Gernand D, Rutten T, Pickering R, Houben A:染色体消除大麦芽xh . bulbosum有丝分裂和间期的杂交包括微核形成和渐进性异染色质化。中国生物医学工程学报,2006,26(2):344 - 344。
- 87.
Sanei M, Pickering R, Kumke K, Nasuda S, Houben A:大麦种间杂交种中,着丝粒组蛋白H3 (CENH3)的缺失先于单亲本染色体消除。《美国国家科学院学报》上。2011, 38(4): 457 - 457。
- 88.
Jeridi M, Perrier X, Rodier-Goud M, Ferchichi A, D'Hont A, Bakry F:同种异体四倍体(AABB)二组体和多体混合遗传的细胞遗传学证据穆萨基因型。学报学报,2012,110(8):1593-1606。10.1093 / aob / mcs220。
- 89.
Renny-Byfield S, Chester M, Kovarik A, Le Comber SC, Grandbastien M-A, Deloger M, Nichols RA, Macas J, Novák P, Chase MW, Leitch AR:下一代测序揭示了异体四倍体的基因组缩小烟草,主要是通过消除来自父亲的重复dna。分子生物学杂志,2011,28:2843-2854。10.1093 / molbev / msr112。
- 90.
Hribová E, Dolezelová M, Town CD, Macas J, doleel J:香蕉基因组高重复部分的分离与表征。中国生物医学工程学报,2007,29(4):344 - 344。
- 91.
李志刚,李志刚,李志刚,李志刚。基于rflp的植物进化研究穆萨巴布亚新几内亚的物种。应用理论与实践,2002,26(5):579-584。
- 92.
Simko I:栽培莴苣的种群结构及其对关联映射的影响。地球科学进展,2008,29(3):344 - 344。
- 93.
霍特A:香蕉穆萨acuminata)基因组和单子叶植物的进化。自然科学进展,2012,29(4):344 - 344。10.1038 / nature11241。
致谢
本工作由FAPESP(2008/03470-0)和CNPq资助。非常感谢路易斯·爱德华多·丰塞卡提供的技术援助。作者(ONJ, SSO, EP, AF)非常感谢CNPq和GGS为FAPESP(2010/01398-0)提供的奖学金。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
ONJ, SOS和AF构思了该研究,这是ONJ的博士项目。SOS, EPA和CFF维护和提供来自原址穆萨收集资料,并参与资料的解释。ONJ和GGS进行了分子分析。JMCS进行流式细胞术分析。ONJ和AF在CFF的帮助下讨论了结果并撰写了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
表S2。
附加文件1:表S1:穆萨来自非原位巴西“Embrapa Mandioca Fruticultura”中心(Cruz das Almas, Brazil)的原始来源和来自形态表征的倍性和基因组组成信息或来自原产地的信息(护照数据)。表S2。位点用于特征的描述原址穆萨样本来自“Embrapa Mandioca Fruticultura”中心,包含用于荧光标记的尾巴,标记有观察到的等位基因数量(Na)、多态性信息含量(PIC)、标记指数(MI)。下划线区域是指用于标记荧光FAM、HEX或NED产品的尾部。图S1。平均观测异质性(Ho)和所有微卫星位点的多态性信息含量(PIC)。C:培养;W:野外。图S2。直方图表示所有种质(一般种质)和主要基因组群对种质之间的不相似(x轴)比例(y轴)。(docx220 kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
德耶稣,O.N,席尔瓦,S.d.O.e,阿莫林,E.P.et al。遗传多样性和群体结构穆萨登记入册的非原位保护。BMC植物生物学13日,41(2013)。https://doi.org/10.1186/1471-2229-13-41
收到了:
接受:
发表:
关键字
- 关联映射
- 香蕉
- 进化
- 流式细胞术
- 内部转录间隔
- 微卫星
- 简单序列重复
- 结构