- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
富亮氨酸重复结构域的同二聚化和配体结合gydF4y2BaRHG1 / RFS2gydF4y2Ba对两种大豆病原菌的潜在抗性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba13gydF4y2Ba、物品编号:gydF4y2Ba43gydF4y2Ba(gydF4y2Ba2013gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
GmRLK18-1编码的蛋白(gydF4y2BaGlyma_18_02680gydF4y2Ba在18号染色体上)是一种在大豆(Glycine max L. Merr.)中编码的受体样激酶(RLK)。gydF4y2BaRhg1 / Rfs2gydF4y2Ba轨迹。这个基因座是对大豆囊肿线虫(SCN)产生抗性的基础。gydF4y2Ba异皮线虫属甘氨酸gydF4y2Ba(1)猝死综合征(SDS)及其致病因素gydF4y2Ba镰刀菌素virguliformegydF4y2Ba(青木)。以前富含亮氨酸重复序列(LRR)结构域在gydF4y2Ba大肠杆菌gydF4y2Ba。gydF4y2Ba
结果gydF4y2Ba
这里的目的是评估lrr的能力;homo-dimerize;结合较大的蛋白质;并与小肽结合。Western分析表明同源二聚体可以在从根中提取蛋白质后形成。从残基131-485中纯化的LRR结构域形成了单体和同型二聚体的混合物gydF4y2Ba在体外gydF4y2Ba。交联实验gydF4y2Ba在体外gydF4y2BaH274N区域与第二同型二聚体亚基上高度保守的半胱氨酸残基C196接近(<11.1 A)。在植物和线虫分泌物中发现的肽的结合常数为20 ~ 142 nM。当根被50 pM的肽处理时,观察到对植物表型的影响,包括萎蔫,茎弯曲和对SCN感染的抗性。远西分析和质谱分析表明,蛋氨酸合成酶和亲环蛋白与LRR结构域紧密结合。来自GmRLK08-1的第二个LRR (Glyma_08_g11350)没有表现出这些强相互作用。gydF4y2Ba
结论gydF4y2Ba
GmRLK18-1蛋白的LRR结构域形成单体和同型二聚体。LRR结构域与4种不同的CLE肽、一个亲环蛋白和一个蛋氨酸合成酶紧密结合。先前有报道称,CLE肽GmTGIF、GmCLE34、GmCLE3和HgCLE参与根生长抑制,但在这里GmTGIF和HgCLE被证明可以改变茎的形态和对SCN的抗性。从同源和几个模型之一gydF4y2Ba从头开始gydF4y2Ba通过交联部分验证了建模。RLK等位型中存在的3个氨基酸替换,A87V、Q115K和H274N,预计会改变结构域的稳定性和功能。因此,GmRLK18-1的LRR结构域可能是大豆根系发育和抗病的基础,并为开发可能促进减少SCN损失的新变体和配体提供了一条途径。gydF4y2Ba
背景gydF4y2Ba
植物利用细胞表面和细胞质受体对来自病原体的各种信号作出反应[gydF4y2Ba1gydF4y2Ba]。受体蛋白激酶(RPKs)是两大基因家族中的一个,涉及导致病原体抗性的识别事件的基础[gydF4y2Ba2gydF4y2Ba]。大豆中最具破坏性的两种病原体gydF4y2Ba大豆gydF4y2Bal .稳定gydF4y2Ba。gydF4y2Ba)为大豆囊肿线虫(SCN;gydF4y2Ba异皮线虫属甘氨酸gydF4y2BaI.)和猝死综合征(SDS)剂gydF4y2Ba镰刀菌素virguliformegydF4y2Ba(青木)[gydF4y2Ba3.gydF4y2Ba]。囊线虫种群的复杂遗传、植物的部分抗性和温度敏感性使得控制线虫成为一项艰巨的任务[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。植物对病原体的防御被证明涉及到RLK蛋白的活性[gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2Ba8gydF4y2Ba从北京传入的。两个位点,gydF4y2BaRhg4gydF4y2Ba8号染色体(连锁组(Lg) A2)和gydF4y2BaRhg1 / Rfs2gydF4y2Ba在18号染色体(Lg G)上,含有编码受体样激酶(RLK)蛋白的基因,这些蛋白属于与抗性相关的RPK基因家族。GmRLK08-1 (Glyma_08_11350)在附近gydF4y2BaRhg4gydF4y2BaGmRLK18-1 (Glyma_18_02680)在其中gydF4y2BaRhg1 / Rfs2gydF4y2Ba(gydF4y2Ba5gydF4y2Ba,gydF4y2Ba8gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba]。翻译的蛋白都是细胞外富含亮氨酸重复序列(LRR)的RLKs。许多其他基因可以改变SCN反应。然而,只有GmRLK18-1被证明是转基因植物对这两种病原体产生抗性的基础[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]gydF4y2Ba
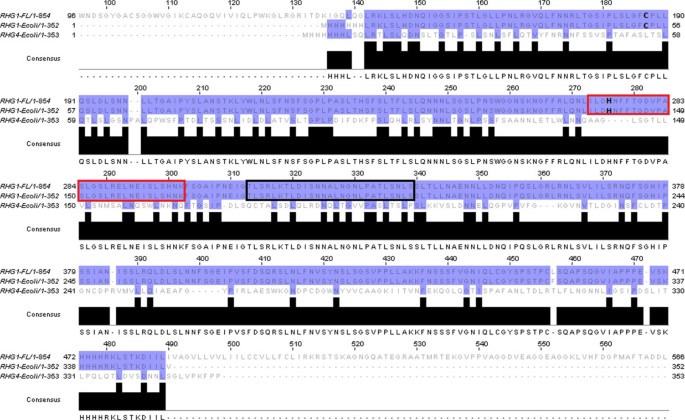
大量研究表明RLKs的LRR结构域参与了效应物识别和蛋白-蛋白相互作用[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba11gydF4y2Ba- - - - - -gydF4y2Ba19gydF4y2Ba]。RLKs的胞内激酶结构域经常参与磷酸化介导的信号转导。GmRLK18-1蛋白显示出不同功能的分离结构域,这是植物和动物RLKs的特征。预计细胞外结构域参与二聚化/识别,细胞内结构域参与信号转导。预测GmRLK18-1蛋白是一个855个氨基酸的多肽,编码一个n端信号肽(氨基酸1-61)、10个细胞外富含亮氨酸的重复序列(氨基酸141-471)、一个单通跨膜结构域(氨基酸485-507)和一个细胞内丝氨酸/苏氨酸激酶结构域(氨基酸510-855;5).gydF4y2Ba
在gydF4y2BaRhg1 / Rfs2,gydF4y2Ba抗性表型与GmRLK18-1等位型1完全相关[gydF4y2Ba5gydF4y2Ba]而转基因植物中的等位基因提供了部分抗性[gydF4y2Ba8gydF4y2Ba]。氨基酸(A87V, Q115K和H274N)的变化足以区分具有I型抗性(北京基抗性)和其他4个同种异型的植物。迄今为止还没有研究试图分析这些氨基酸变化对整体蛋白质结构的作用,因此对SCN和SDS抗性的分子基础仍未探索。gydF4y2Ba
最近的一项研究[gydF4y2Ba6gydF4y2Ba揭示了GmRLK18-1 LRR结构域的二级结构成分。螺旋和薄片的内容与α - β结构褶皱一致。利用圆二色光谱法(CD)分析了LRR结构域内的非结构化元素。由于一些LRR蛋白固有的重折叠问题,尚未进行同种异型比较。在许多情况下,可以通过与已知结构的同源物进行比较来预测蛋白质结构[gydF4y2Ba20.gydF4y2Ba- - - - - -gydF4y2Ba23gydF4y2Ba]。表达的GmRLK18-1 lrr结构域残基141-435gydF4y2Ba大肠杆菌gydF4y2Ba(gydF4y2Ba6gydF4y2Ba]根据一级序列相似性和长度判断的最接近的同源物,包括已知的结构;1ogq_a (PGIP) [gydF4y2Ba16gydF4y2Ba], 3rgx (BRI1) [gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba], 1xcd_a (decorin) [gydF4y2Ba21gydF4y2Ba], 106s (e -钙粘蛋白)[gydF4y2Ba15gydF4y2Ba];1ozn_a (NOGO受体,配体结合域)[gydF4y2Ba22gydF4y2Ba];2bnh(猪核糖核酸酶抑制剂;PRI) (gydF4y2Ba23gydF4y2Ba]。gydF4y2Ba
忽略LRR结构域的长度,多半乳糖醛酸酶抑制蛋白来自gydF4y2Ba菜豆gydF4y2Ba(PGIP) [gydF4y2Ba16gydF4y2Ba]是GmRLK18-1最接近的同源基因,具有已知的结构,具有27%的相同度和44%的相似度(gydF4y2Bahttp://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=indexgydF4y2Ba)。接下来是BRI1受体[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],在LRR区域有27%相同,42%相似(残基141-435)。PRI蛋白[gydF4y2Ba23gydF4y2Ba]与GmRLK18-1-LRR有20%的同源性和36%的相似性,长度相似,已知形成同源二聚体gydF4y2Ba在活的有机体内gydF4y2Ba。在研究较多的植物RLK-R蛋白中,GmRLK18-1的LRR与水稻XA21受体激酶LRR最为相似(39%)[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。XA21是一种RLK,其胞外结构域控制种族特异性病原体识别,以响应已知的激发子。病原体配体与XA21 lrr结构域的结合可能导致细胞内激酶的二聚化和活化。在参与发育控制的基因中,GmRLK18-1 LRR结构域与异源二聚化的拟南芥CLAVATA1和CLAVATA2相似度为43% [gydF4y2Ba25gydF4y2Ba]。GmRLK18-1 LRR结构域与大豆NARK1相似45% [gydF4y2Ba26gydF4y2Ba]。这后3种蛋白已被证明结合CLE肽作为其活性的一部分。在线虫的分泌物中有一种CLE肽,可以被RLKs感知gydF4y2BaCLAVATA2gydF4y2Ba和gydF4y2BaCORYNEgydF4y2Ba家庭(gydF4y2Ba25gydF4y2Ba提出了GmRLK18-1可能结合CLE肽的可能性。CLE肽的结合常数(Kd)在17.4 ~ 2000 nM之间。gydF4y2Ba
先前一个RPK蛋白的三维模型[gydF4y2Ba27gydF4y2Ba]是预测的,但模拟的RPK蛋白不是RLK。同样,预测了和RLK的模型,但蛋白质在共生而不是防御中起作用[gydF4y2Ba26gydF4y2Ba]。本文基于GmRLK18-1蛋白胞外LRR结构域(残基141-471)的同源性建模,报道了参与耐药性的RLK蛋白的LRR结构域模型。GmRLK18-1-LRR的建模基于PRI (2BNH) [gydF4y2Ba23gydF4y2Ba]。推测了氨基酸取代对蛋白质稳定性的影响;进行了折叠结构和类分析;并对二级结构进行了分析gydF4y2Ba在体外gydF4y2Ba和gydF4y2Ba在网上gydF4y2Ba来预测GmRLK18-1是否可能同二聚gydF4y2Ba在活的有机体内gydF4y2Ba。用交联蛋白对模型进行测试gydF4y2Ba在体外gydF4y2Ba。用短cle样肽测定配体结合。gydF4y2Ba
结果gydF4y2Ba
蛋白质序列分析gydF4y2Ba
GmRLK18-1-LRR结构域显示出分散的基序,但具有规律的重复模式(图2)gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba2gydF4y2Ba]。相反,激酶结构域包含预期的保守基序,因此似乎经历了纯化选择。这两个结构域的同义和非同义取代率也不同(图2)gydF4y2Ba1gydF4y2Ba)。RLK的九个已知等位基因中有八个gydF4y2Barhg1gydF4y2Ba轨迹(gydF4y2Ba5gydF4y2Ba]使用CLUSTAL-W对齐,并确定同义和非同义替换率。lrr结构域的非同义置换与同义置换的比例约为1:1,而在激酶结构域,大多数核苷酸置换不转化为氨基酸变化,比例超过3:1。这些比率表明纯化选择消除了激酶结构域的突变体,但没有消除LRR结构域的突变体。每个核苷酸变化的氨基酸序列变异的相对缺乏可能与激酶结构域在信号功能中的作用有关。适当的信息转导对氨基酸取代施加了严格的限制。相反,lrr结构域可能会积累中性突变,改善当前功能或导致新的自适应识别能力。gydF4y2Ba
表达的GmRLK18-1蛋白和LRR结构域序列gydF4y2Ba大肠杆菌gydF4y2Ba。gydF4y2Ba整个RLK蛋白理论pI为8.42,分子量为92,388.98 Da。B.表达的LRR域片段gydF4y2Ba大肠杆菌gydF4y2Ba。方框是用来产生特定抗体的肽。黑体中是通过交联标记的半胱氨酸残基和组氨酸残基在抗性和易感植物中的多态性。红框表示同型二聚体形成时与半胱氨酸接触的胰蛋白酶片段;注意它含有组氨酸残基。该蛋白预测pI为9.54,分子量为38404.55 Da。GmRLK08-1的LRR结构域氨基酸序列接近gydF4y2BaRhg4gydF4y2Ba这是用gydF4y2Ba大肠杆菌gydF4y2Ba用于配体结合试验。蛋白质预测pI为5.2,分子量为38,086.11 Da。LRR结构域与GmRLK18-1相似度为45%。gydF4y2Ba
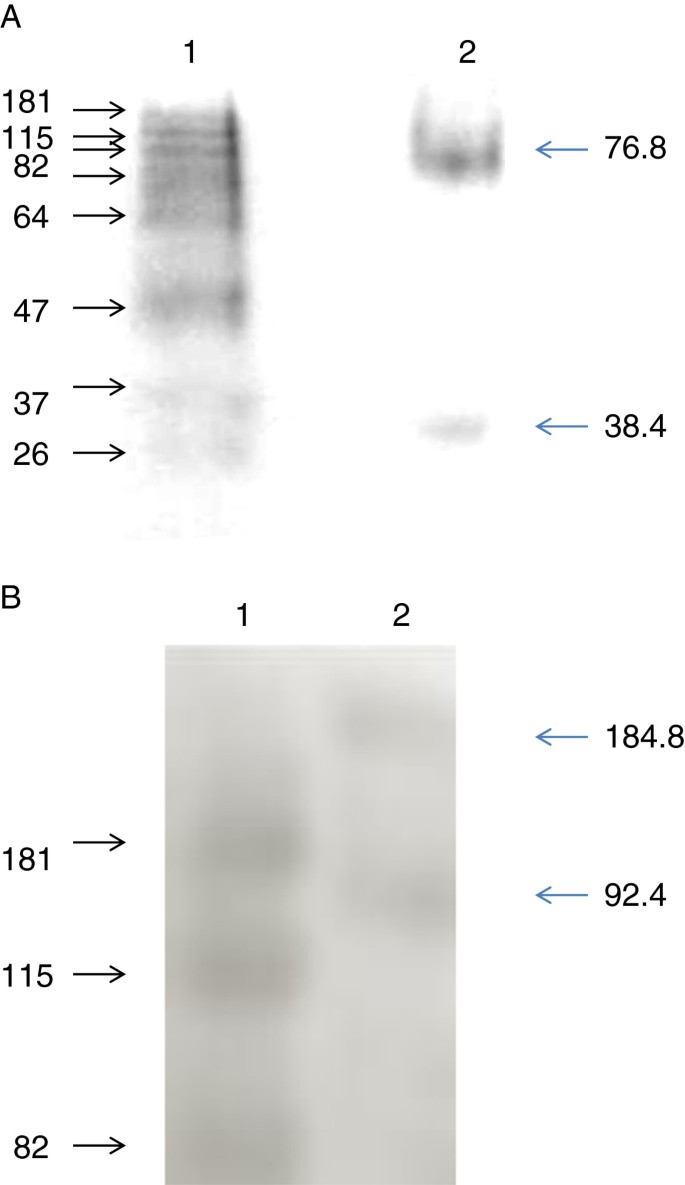
GmRLK18-1同源二聚体检测,而GmRLK08-1未检测gydF4y2Ba
GmRLK18-1和GmRLK08-1的LRR结构域在gydF4y2Ba大肠杆菌gydF4y2Ba用同样的方法。原生page凝胶一致显示GmRLK18-1存在38.4 Kd和76.8Kd的2个条带(图2)gydF4y2Ba2gydF4y2BaA),但GmRLK08-1只有38.1 Kd的单条带(数据未显示)。76.8 Kd条带经SDS-PAGE洗脱后电泳,经变性后表观大小减半至38.4 Kd。从植物根部提取的蛋白质,经过非变性PAGE和Western转移,似乎也能够维持同型二聚体和/或与另一种质量和电荷相似的蛋白质形成异型二聚体(图1)gydF4y2Ba2gydF4y2BaB).相对于球形标记蛋白,预测的92.4 Kd的单体带电泳速度比预期的慢,预测的同源二聚体184.8 Kd带也是如此。蛋白质的非变性电泳提供了基于大小和电荷密度的大小的不准确估计。在这种情况下,非常低丰度的RLK是从膜结合部分溶解后重新折叠的蛋白质。可能暴露的跨膜结构域或其他非结构化元素降低了蛋白质迁移的速度。gydF4y2Ba
GmRLK18-1 lrr结构域二聚化的证据。gydF4y2Ba面板(gydF4y2Ba一个gydF4y2Ba) 12% (w/v)未变性的PAGE;一号车道基准gydF4y2BaTMgydF4y2Ba染色蛋白阶梯;通道2,纯化的GmRLK18-1-LRR。重组后的GmRLK18-1-LRR既存在单体,也存在同二聚体。在SDS PAGE上加载,在简化条件下显示只有单个条带[gydF4y2Ba6gydF4y2Ba]。面板(gydF4y2BaBgydF4y2Ba);12% (w/v)未变性PAGE;一号车道基准gydF4y2BaTMgydF4y2Ba染色蛋白阶梯;车道2,抗GmRLK18-1抗体检测的GmRLK18-1蛋白。从根中分离出蛋白质,重新折叠的GmRLK18-1在正确的位置上存在单体和复合物,为同型二聚体。gydF4y2Ba
GmRLK18-1而非GmRLK08-1同源二聚体之间的交联gydF4y2Ba
通过与MTBS交联,发现在11a内gydF4y2BaogydF4y2Ba从C57到相邻的氨基酸,观察到两组离子信号,它们可能都被分配到同型二聚体的同一区域。这两个生物素化的胰蛋白酶消化衍生的肽是由交联产生的,从残基136开始,以残基169结束(高丰度信号,质量3791.97,1个缺失裂解),从残基131开始,以残基169结束(低丰度信号,质量4413.27,2个缺失裂解)。这意味着LRR中的C57或整个蛋白中的C215与含有H274N多态性(LRR片段中的H133N)的区域相邻(>11A)。因此,预计单体相互覆盖,但被79-112个残基抵消。值得注意的是,C215将接近预测的两个本质非结构化区域之一。同样值得注意的是,在这个结构中,15个带负电荷的残基(D + E)中的10个预计与22个带正电荷的残基(R + K)中的10个配对,这导致了由LRR结构域形成的同型二聚体的pIgydF4y2Ba大肠杆菌gydF4y2Ba接近中性(数据未显示),而不是为单体测量的pI 9 [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。相比之下,与Gm08-RLK1或无蛋白对照没有交联gydF4y2Ba
GmRLK18-1包含本质上非结构化的元素gydF4y2Ba
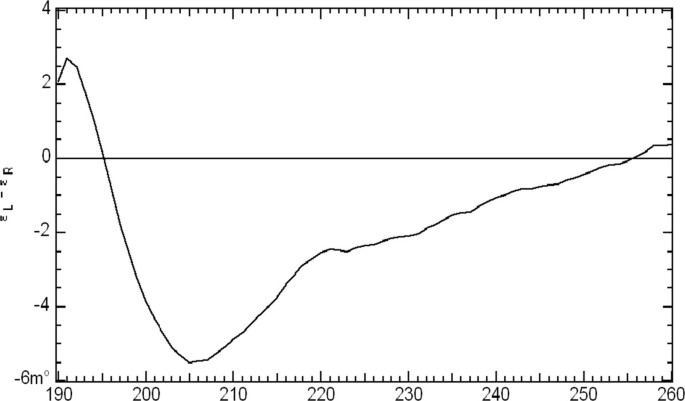
从LRR结构域对被折叠的蛋白进行圆二色光谱分析,以确保表达的蛋白被充分地重新折叠。事实上,光谱显示大多数蛋白质折叠良好,但在LRR结构域内具有中断和非结构化区域的光谱特征(图5)gydF4y2Ba3.gydF4y2Ba) [gydF4y2Ba29gydF4y2Ba]。CD显示混合的二级结构含量(40%螺旋,30%链和匝)。有趣的是,21%的LRR蛋白被预测为无序或非结构化[gydF4y2Ba6gydF4y2Ba]。非结构化区域介入,将LRR域分裂为两部分。中间区域可能是维持LRR溶解度困难的基础gydF4y2Ba在体外gydF4y2Ba改变非变性凝胶电泳过程中的迁移模式。gydF4y2Ba
CLE肽配体结合LRR结构域gydF4y2Ba
用一组5个一致的基序肽来测量两个LRR结构域蛋白GmRLK18-1和GmRLK08-1的结合亲和力(表1)gydF4y2Ba1gydF4y2Ba)在大豆根部表达的CLE基因家族中发现[gydF4y2Ba30.gydF4y2Ba]。此外,对线虫分泌物中发现的一个CLE结构域进行了检测。作为对照,用于提高抗rlk18抗体的肽在同一实验中进行了测试。它含有GmRLK18-1类蛋白特有的LRR重复序列。在8个GmCLE肽中有6个独立的基序,其中3个基序存在于植物分泌组的短肽(12个残基)或长肽(28-32个残基)中。GmRLK18-1-LRR对短肽(14-45 nM)的亲和力最高,对长肽的结合强度低2-3倍。肽GmCLE34 (14 nM)和T (20 nM)结合最强烈,其次是CLV3及其线虫同源物N (29-30 nM)。这些结合常数在生理范围内,表明LRR结构域可以结合多种肽配体。每个配体都被找到了gydF4y2Ba在活的有机体内gydF4y2Ba作为改变植物发育的信号级联的一部分[gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。相比之下,与发育控制相关的肽集,参与控制结节共生的肽GmRIC1和GmNIC1 (2,2l和30)被GmRLK18-1衍生的LRR肽弱结合。gydF4y2Ba
GmRLK08-1 LRR结构域(来自RLK蛋白)位于gydF4y2BaRhg4gydF4y2Ba)对大多数CLE肽的亲和力较低(50-338 nM)。然而,GmCLE34的长、短版本和GmCLV3的短版本结合的亲和力最高(50-52 nM),表明它们是GmRLK08-1整合的配体信号之一。线虫肽HgCLV3结合较弱(78 nM)。这一结果与GmRLK08-1蛋白不是基因编码的抗性反应的唯一元件的结论一致gydF4y2BaRhg4gydF4y2Ba轨迹(gydF4y2Ba9gydF4y2Ba]。与GmRLK18-1一样,GmRLK08-1 LRR结构域蛋白与共生关系相关的GmRIC和GmNIC结合非常弱。与GmRLK18-1不同,GmRLK08-1蛋白与GmTDIF结合较弱。因此,lrr表现出不同的肽配体特异性,反映了它们不同的序列和结构。gydF4y2Ba
LRR结构域二聚化的Kd可以通过含有一个LRR基序的肽L来估计。该区域二聚化的表观Kd值为36 nM,表明整个结构域的同型二聚化常数小于36 nM。gydF4y2Ba在体外gydF4y2Ba从根中提取的蛋白质和从根中溶解的LRR结构域肽gydF4y2Ba大肠杆菌gydF4y2Ba有证据表明,大约一半的蛋白质以单体形式存在,大约一半的蛋白质以同型二聚体形式存在gydF4y2Ba2gydF4y2Ba)。这种平衡在很大的蛋白质和盐浓度范围内都能维持。今后,观察配体结合是否能改变这种平衡将是一个有趣的问题。gydF4y2Ba
远西分析中LRR的全蛋白配体结合gydF4y2Ba
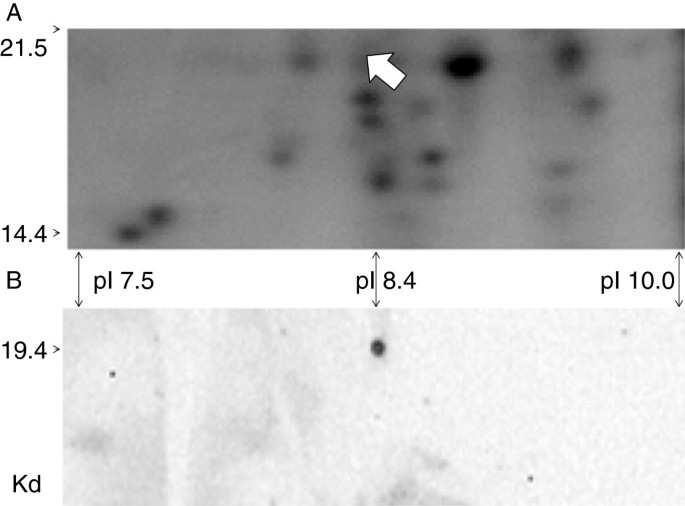
Far Western对2d凝胶上分离的总根蛋白的分析显示,在10代和42代与SCN的相互作用中,检测到一个单独的相互作用伙伴(图2)gydF4y2Ba4gydF4y2Ba)。在第10天(24小时),摄食部位刚刚发育,耐药性反应已经开始。该阶段唯一与LRR紧密结合的蛋白是一个亲环蛋白,与gi 17981611 (gb AAL51087.1)的2个区域有24%相同的肽匹配,Score为284,期望值为1egydF4y2Ba-75年gydF4y2Ba。该亲环蛋白长182个氨基酸,与DNA衍生氨基酸序列预测的19,392 d和pI 8.38一致(图2)gydF4y2Ba4gydF4y2Ba)。接种SCN后,蛋白斑点的丰度也未发生变化;gydF4y2Baf . virguliformegydF4y2Ba在这里或在早期的研究中接种或植物基因型[gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
用GmRLK18-1的LRR结构域对24dap (10 dai)大豆根蛋白进行了远西分析。gydF4y2Ba面板(gydF4y2Ba一个gydF4y2Ba):所示为2D凝胶的一部分(14.4-21.5 KDa;7.5-10.0 pI),从34-23(抗性)SCN接种总根蛋白,用银染色显示斑点。面板(gydF4y2BaBgydF4y2Ba):转移到膜上的蛋白质,用纯化的GmRLK18-1 LRR结构域和6X his-RHG1进行探测。Anti-His-HRP作为二次探针。从重复凝胶中切除鉴定出的单点(箭头),通过Q-TOF (MS-MS)分析,鉴定出一个亲环蛋白是GmRLK18-1 LRR结构域的相互作用伙伴。gydF4y2Ba
到28代(42 dap)时,包囊成熟(易感系)或大部分死亡(抗性系)。与LRR结构域结合最强烈的蛋白是大豆分泌的蛋氨酸合成酶。蛋氨酸合成酶蛋白(gi: 33325957)在84.2 KDa和pI 5.93处是最强的相互作用伙伴(图3)gydF4y2Ba5gydF4y2Ba)。接种SCN后,蛋白斑点的丰度也未发生变化;gydF4y2Baf . virguliformegydF4y2Ba此处或10代接种或植株基因型[gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
用GmRLK18-1的LRR结构域对大豆根蛋白42 dap (28 dai)进行了远西分析。gydF4y2Ba面板(gydF4y2Ba一个gydF4y2Ba):所示为全2D凝胶(6.5-116.0 KDa;3.0-10.0 pI),从34-23(抗性)SCN接种总根蛋白,用银染色显示斑点。面板(gydF4y2BaBgydF4y2Ba):转移到膜上的蛋白质,用纯化的GmRLK18-1 LRR结构域和6X his-RHG1进行探测。Anti-His-HRP作为二次探针。从重复凝胶中切除鉴定到的单点(箭头),通过Q-TOF (MS-MS)分析,鉴定出84.2 KDa和pI 5.93的甲硫氨酸合酶(GI: 33325957)是GmRLK18-1 LRR结构域的相互作用伙伴。另外3种蛋白质的丰度更高,因此不太可能是特定的相互作用。gydF4y2Ba
在两个时间点(10或42 dai)均未检测到含有CLE基序的蛋白。大豆中CLV3样蛋白的大小范围为3329 - 15332 d, pI为5.4-11.9,但活性肽配体要小得多(12-30个氨基酸),并不丰富,因此不会出现在2D凝胶上。gydF4y2Ba
讨论gydF4y2Ba
这里显示的是与GmRLK18-1的LRR相互作用的蛋白质的结构和丰度[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。此外,同型二聚体亚基之间的距离用已建立的技术进行了映射和测量[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]。这些实验数据将与模型[gydF4y2Ba34gydF4y2Ba- - - - - -gydF4y2Ba42gydF4y2Ba]基于本讨论中的同构。gydF4y2Ba
结构与功能gydF4y2Ba
GmRLK18-1的LRR结构域倾向于同二聚化或配体结合。在其内部检测到非结构化区域。超过30%的人类蛋白质内部有非结构化区域[gydF4y2Ba42gydF4y2Ba]。非结构化蛋白通过增强与许多靶标的低亲和力瞬时相互作用(缺乏结构允许简并),提供了比球状/固定蛋白更有利的优势[gydF4y2Ba43gydF4y2Ba]。这可能是相互作用的伙伴或病原体效应物的结合决定了RHG LRR结构域的结构。细胞周期调控、转录调控和细胞信号传导中的许多例子都涉及非结构化蛋白质。包括BRI1 [gydF4y2Ba29gydF4y2Ba,gydF4y2Ba31gydF4y2Ba锌指,参与肿瘤发展的ACTR辅助因子和参与细胞周期控制的P53 [gydF4y2Ba44gydF4y2Ba]。与结构蛋白不同,大多数非结构蛋白对其伴侣的亲和力较低[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba45gydF4y2Ba- - - - - -gydF4y2Ba47gydF4y2Ba]。这可能为需要对外部或内部刺激做出快速反应的细胞提供可塑性。gydF4y2Ba
肽配体结合与表型效应gydF4y2Ba
cle样蛋白衍生的共识肽是植物基因组中发现的一组定义的肽,涉及短距离和长距离信号传导[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba48gydF4y2Ba- - - - - -gydF4y2Ba51gydF4y2Ba]。在CLE肽中发现的16个共识基序中,有5个在根中表达(表1),GmRLK18-1也是如此。GmRLK18-1 LRR结构域对GmCLV3和N有很强的结合常数,被认为参与分生组织分化[gydF4y2Ba25gydF4y2Ba]。在SCN发病过程中,一个新的分生组织被启动,将一个气管元件带到摄食部位附近,N可能介导了这一过程,并被抗性蛋白GmRLK18-1检测到。T是气管元件分化抑制因子(GmTDIF),可能在防御过程中抑制取食部位诱导的发育过程。GmCLE34肽在血管前组织中产生[gydF4y2Ba48gydF4y2Ba]。被认为与共生有关的CLE结构域[gydF4y2Ba26gydF4y2Ba]并没有紧密结合,这表明它们不是生理相关的配体,尽管线虫寄生确实会减少结瘤[gydF4y2Ba8gydF4y2Ba]。gydF4y2Ba
为了确定CLE肽结合是否会对植物产生影响,我们用12株植物进行了根浸试验。将被hg0型(分离物JB3)侵染的SCN易感植株放置于10天,取0.5g根样。然后将根浸在50 pM浓度的CLE肽TGIF或HgCLE水中,并返回侵染土壤。在接触CLE肽的植株中观察到立即枯萎,而在水对照中则没有gydF4y2Ba1gydF4y2Ba:图S1)。X5 (A-D组)植株的萎蔫和茎秆弯曲比Westag 97 (E-H组)植株严重。在CLE肽浸泡1小时内,茎部观察到弯曲(图B和F),并保持弯曲,尽管在X5植株中有S弯曲补偿,直到28代收获根(图D)。在CLE肽处理后18天收获根,并计算囊肿数量(表D)gydF4y2Ba2gydF4y2Ba)。经CLE肽处理的植株中,SCN雌虫数量明显减少,表明产生了抗性反应。gydF4y2Ba
蛋白质配体结合gydF4y2Ba
检测到亲环蛋白(图2)gydF4y2Ba4gydF4y2Ba)是大豆基因组中编码的30个基因之一,表明它是一个特定的RHG1/RFS2互作伙伴。亲环蛋白在发病机制中的作用与[gydF4y2Ba51gydF4y2Ba]。亲环蛋白的作用包括小分子结合和受体相互作用[gydF4y2Ba52gydF4y2Ba]。亲环蛋白可能通过肽基脯氨酸顺式反式异构酶活性引起lrr结构域的结构变化(将在未来的实验中尝试核磁共振证实)。gydF4y2Ba
在感染过程后期(28天)的第二次远西分析中,使用老根(42天)检测到s -腺苷- l-蛋氨酸合成酶(图2)gydF4y2Ba5gydF4y2Ba)。在植物真菌发病过程中,蛋氨酸合成酶的丰度增加,并在分泌组中发现[gydF4y2Ba53gydF4y2Ba]。蛋氨酸合酶作为甲基单位供应的提供者,在防御中具有明确的作用。最近的实验表明,在二倍体小麦(gydF4y2Ba小麦属植物monococcumgydF4y2Ba)被真菌感染gydF4y2BaBlumaria茎gydF4y2Baf . sp。gydF4y2BatriticigydF4y2Ba有12种蛋白质参与了生物合成途径的快速合成,并为木质素的生物合成提供了甲基单位[gydF4y2Ba54gydF4y2Ba]。蛋氨酸合成酶是在表皮感染早期被高度诱导的基因之一。该表达与宿主细胞壁的形成有关,表明甲基单位的合成途径被转录激活,这种激活是为了宿主的防御反应。细胞壁附着形成于SCN耐药反应的后期gydF4y2Bag·马克斯gydF4y2Ba(gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba]。甲基化的另一个可能作用是LRR中的精氨酸可能在病原体反应期间被甲基化。另外,它可能通过改变乙烯产生的位置和数量而间接地与发病过程中的发育控制有关[gydF4y2Ba52gydF4y2Ba]。gydF4y2Ba
GmRLK18-1模型gydF4y2Ba
为了了解GmRLK18-1的结构功能细节,构建了三维结构模型。所生成的模型采用了同源性和gydF4y2Ba从头开始gydF4y2Ba预测。由于最合适的三级结构同源性与GmRLK18-1的同源性较低,模型的建立困难。因此gydF4y2Ba从头开始gydF4y2Ba在最后的结构预测中使用建模。革命制度党(gydF4y2Ba23gydF4y2Ba,gydF4y2Ba39gydF4y2Ba]作为模板结构(2bnh),模板结构来自3D陪审团服务器生成的顶部命中。PRI是一个450残基的富含亮氨酸的重复蛋白,分子量为49 kDa。这种蛋白质与某些核糖核酸酶相互作用并形成紧密的复合物。结构预测基于基于判别评分函数选择近原生构象的算法。首先利用GmRLK18-1(氨基酸52-440)的氨基端结构域(包含LRR结构基序)在4-6 Å RMSD处生成模型。在SCOP数据库中,LRR域(包括植物和所有LRR)被划分为3个超级科;(1) pri样(由β - α重复组成的规则结构);(2)类l域(不正则);(3)外臂动力蛋白轻链样和pgip样(β - β - α超螺旋)。预测GmRLK18-1同时具有pri样和pgip样。 Several knowledge-based scoring functions have been developed with varying degrees of success [40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。这些函数通常从包含实验确定结构的数据库中编译统计信息,并使用这些统计信息来测试给定构象与原生构象相似的概率。两个超家族之间的中间结构蛋白质常常使程序混淆。gydF4y2Ba
模型验证gydF4y2Ba
对GmRLK18-1的LRR结构域进行ProcheckTM分析表明,大多数立体化学参数都在分辨率为2.3的结构的可接受值范围内Å(另见文件)gydF4y2Ba2gydF4y2Ba:表1)。由于无法为GmRLK18-1的预测结构赋予分辨率值,因此这些值仅供比较。模型的Ramachandran图显示,大约71%的残基在最有利的区域,26%的残基在允许的区域。少于1%(3)的残基在Ramachandran图的不允许区域(附加文件)gydF4y2Ba3.gydF4y2Ba:图S2,附加文件gydF4y2Ba4gydF4y2Ba表2)。gydF4y2Ba
PRI晶体结构的PROCHECK分析(附加文件)gydF4y2Ba3.gydF4y2Ba(图S3)显示,大约80%的残基位于最有利区域,20%位于额外有利区域。因此,在GmRLK18-1模型生成过程中,模板中约10%的最有利残基丢失。gydF4y2Ba
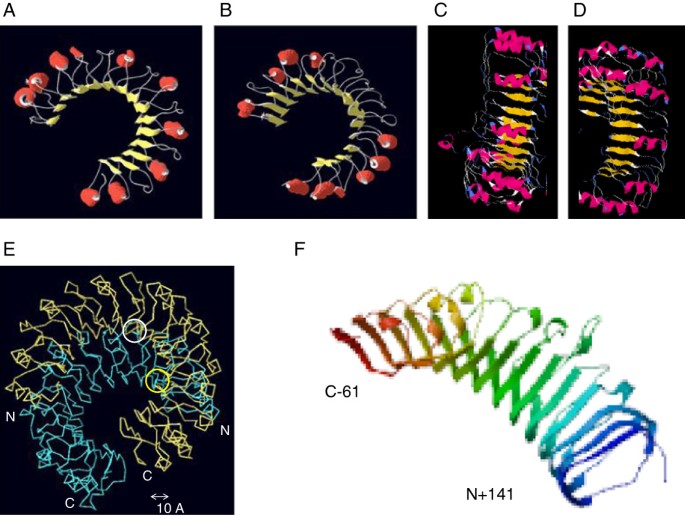
模型显示GmRLK18-1的LRR结构域(图1gydF4y2Ba6gydF4y2Ba)采用马蹄形结构,类似于PRI的晶体结构,不同于单体BRI1的螺线管结构[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]。在模板和模型蛋白质中,长ß片与蛋白质内环上的螺旋平行。在GmRLK18-1中,螺旋和薄片通过环连接在一起。此外,N和C端螺旋较长,短螺旋在重复序列中均匀分布(图2)gydF4y2Ba6gydF4y2Ba)。gydF4y2Ba
预测了GmRLK18-1 LRR单体的结构。gydF4y2Ba面板(gydF4y2Ba模拟gydF4y2Ba) β片区域显示为黄色,螺旋区域显示为红色。建模结果表明,GmRLK18-1的lrr值为gydF4y2BaRhg1 / Rfs2gydF4y2Ba(面板gydF4y2Ba一个gydF4y2Ba)和GmRLK8-1 atgydF4y2BaRhg4gydF4y2Ba采用马蹄形结构。在GmRLK18-1中,N和C端螺旋较长,较短的螺旋在重复序列中均匀分布。在蛋白质中还可以看到4个不形成螺旋的口袋,非结构化区域是最近的两个C端。在GmRLK18-1预测中,N和C端螺旋较长,且在重复序列中较短的螺旋间距均匀,而在GmRLK8-1预测中,螺旋间距不均匀,仅存在于N或C端。面板gydF4y2BaCgydF4y2Ba从凹面和面板上可以看到预测的GmRLK18-1结构gydF4y2BaDgydF4y2Ba在看凸面。面板(gydF4y2BaEgydF4y2Ba) GmRLK18-1基于RI模板建模为晶体同型二聚体。同源二聚体界面由反平行的β片连接在一起,这些β片包含来自每个单体链的许多残基。链被约90个残基抵消。白色圈为交联检测到的来自配对同型二聚体链小于11a的半胱氨酸,黄色圈为不在二聚体界面附近的半胱氨酸。(gydF4y2BaEgydF4y2Ba) SWISS-PROT预测的结构[gydF4y2Ba49gydF4y2Ba]中只表达了GmRLK18-1的141-435个氨基酸的LRR结构域gydF4y2Ba大肠杆菌gydF4y2Ba。n端缺乏信号肽。C端比跨膜结构域的起点短61个氨基酸(−61个)。gydF4y2Ba
已知LRR结构域缺乏基序守恒[gydF4y2Ba2gydF4y2Ba表明参与病原体识别的lrr更需要适应不断变化的病原体种群。一些结构元素主要是螺旋结构,存在于模板PRI结构中[gydF4y2Ba39gydF4y2Ba]在GmRLK18-1-LRR蛋白中缺失(图2)gydF4y2Ba6gydF4y2Ba)。令人惊讶的是,螺线管蛋白中螺旋接触的损失似乎是在奇数螺旋旋转处(螺旋数5,7,9,11和13)。gydF4y2Ba
GmRLK18-1 LRR建模为晶体同型二聚体gydF4y2Ba
GmRLK18-1的原生PAGE显示一个单体和一个同聚二聚体带(图2)gydF4y2Ba2gydF4y2Ba一个和gydF4y2Ba2gydF4y2BaB)。因此,GmRLK18-1-LRR蛋白被建模为晶体同型二聚体(图2)gydF4y2Ba6gydF4y2Ba)。该模型要么基于decorin模板中的晶体二聚体[gydF4y2Ba21gydF4y2Ba]或氨基肽酶或与血管生成素复合物的RI二聚体(1a4y) [gydF4y2Ba23gydF4y2Ba]。基于RI二聚体建立的模型与MTBS交联的实验证据一致,如图所示gydF4y2Ba6gydF4y2Ba。基于decorin和氨基肽酶的模型与实验数据不一致,被拒绝。简单地说,从C57的两个生物素化的,胰蛋白酶消化衍生的交联中,来自同型二聚体的一个区域的两个肽产生了交联。这意味着LRR中的C57或整个蛋白中的C215与含有H274N多态性(LRR片段中的H133N)的区域相邻(<11A)。因此,预计单体相互覆盖,但被79-112个残基抵消。值得注意的是,C215将接近预测的两个本质非结构化区域之一。同样值得注意的是,在这个结构中,15个带负电荷的残基(D + E)中的10个预计将与22个带正电荷的残基(R + K)中的10个配对。这将导致由LRR结构域形成的同型二聚体的pI表达gydF4y2Ba大肠杆菌gydF4y2Ba近乎中立。使用DIABLA测定系统在非变性pI测量中检测到中性蛋白(数据未显示)[gydF4y2Ba28gydF4y2Ba]而不是为单体测量的pI 9(图2)gydF4y2Ba2gydF4y2Ba) [gydF4y2Ba8gydF4y2Ba]。gydF4y2Ba
XA21是GmRLK18-1-LRR最接近的同源物之一,被认为是通过同质二聚体形成起作用[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。其他与发育有关的lrr也有同二聚化的报道。例如,gydF4y2Ba在活的有机体内gydF4y2Ba的研究gydF4y2Ba拟南芥gydF4y2Ba体细胞胚胎发生受体激酶(SERK)显示出SERK同源二聚体,而CLV1 LRR结构域与CLV2 LRR结构域异二聚体(25)。gydF4y2Ba
为了评价突变体结构的稳定性,利用RAPDF计算了伪能量。RAPDF评分表明,所有3个突变都可能影响二聚体蛋白的稳定性gydF4y2Ba5gydF4y2Ba(表S3),虽然这3个残基在表达的LRR片段中不存在gydF4y2Ba大肠杆菌gydF4y2Ba。gydF4y2Ba
GmRLK18-1的单倍型和等位型分析gydF4y2Ba
先前,等位基因1(基于Forrest的抗性)和对SCN (Hg 0型或3型)的抗性之间的完美关联在三个分离群体和不相关pi的关联研究中被证明[gydF4y2Ba5gydF4y2Ba]。最近,先前易感的转基因GmRLK18-1等位基因的植物被发现对SCN和SDS都有抗性[gydF4y2Ba8gydF4y2Ba]。基于预测的GmRLK18-1单倍型的多序列比对,发现了LRR中的一个数量性状核苷酸gydF4y2Barhg1gydF4y2Ba推断,在Q115和H274的背景下,A87改为V87,而不是K115和N274(附加文件gydF4y2Ba6gydF4y2Ba:图S3)。与此密切相关的拷贝数变异也可能导致抗性[8]。gydF4y2Ba
使用Fold X算法分析非同义点突变对RLK胞外结构域蛋白单体稳定性的影响(gydF4y2Bahttp://fold-x.embl-heidelberg.degydF4y2Ba) [gydF4y2Ba46gydF4y2Ba]。这三种突变可以区分耐药和易感gydF4y2Barhg1gydF4y2Ba在等位基因中,第87个氨基酸上的A到V取代预测对折叠自由能的影响最为显著(附加文件)gydF4y2Ba7gydF4y2Ba:表S4)。115位的Q变K和274位的H变N对蛋白质的稳定性有相反的影响。然而,与具有确定结构的蛋白质相比,预测的绝对折叠自由能值通常并不准确。因此,绝对值意义不大,仅用3个突变体与野生型结构的自由能差值进行相对比较。GmRLK18-1-LRR中的功能重要残基也使用最近开发的算法与结构残基区分开来[gydF4y2Ba47gydF4y2Ba]。对GmRLK18-1 LRR蛋白中的每个残基进行分析,基于(a)基于多序列蛋白比对的序列保守评分和(b)自然存在的残基与该位置潜在最优残基之间的自由能差。分析表明,87号丙氨酸残基是北京品种除天然残基外的最佳残基。这两个结果都表明丙氨酸87可能参与了提供蛋白质稳定性的过程。其余2个氨基酸的取代可能对蛋白质二聚体的稳定性有影响。gydF4y2Ba
结论gydF4y2Ba
本文报道了一个参与植物病虫害抗性的RLK蛋白的LRR结构域的功能分析和结构预测。进行了结构预测并进行了验证。结果表明,GmRLK18-1分离的LRR与线虫和植物分泌物中发现的肽具有高亲和力。可能会出现一个问题,即孤立的LRRs是否与整个RLKs和RPKs的行为方式相同。然而,LRR先前已被CD证明可形成活性结构[gydF4y2Ba27gydF4y2Ba]。在3种不同的实验中检测到同源二聚化(2)gydF4y2Ba在体外gydF4y2Ba)和通过肽结合试验估计的贪婪度。更大的蛋白质也被证明与LRR结构域结合,包括亲环蛋白、蛋氨酸合成酶和与RLK单体质量和电荷相同的蛋白质。因此,分离的LRR的行为方式与RLK相似。LRR结构域很大,似乎与不同的配体结合。RLK可能会将这些信号整合成一个单一的适当反应。gydF4y2Ba
RLK的预测结构与模板PRI或单体BRI1在许多方面进行了对比。首先,预测模型缺少PRI和BRI1中存在的一些连续α螺旋区。这可能解释了圆二色光谱测定的非结构化内容。其次,预测N端螺旋重复序列较长,而内部螺旋区域均匀分布在整个蛋白质中。在大多数其他方面,该模型与PRI模板非常相似。未来的预测可能基于类似长度的植物RLK同型二聚体,如果有任何结构可用,或者如果GmRLK18-1同型二聚体可以结晶。在没有这种情况下,这里采用的预测可以通过进一步的交联实验用于广泛的结构改进。gydF4y2Ba
预测并验证了候选GmRLK18-1蛋白的一些重要特征。c端A87V、Q115K和H274N的三种多态性可能影响蛋白质的稳定性。区分北京等位型(抗性)的H274N的数量性状核苷酸可能具有结构或功能上的意义。氨基酸多态性H274N可能在单体和同型二聚体的稳定性中起重要作用。未来的实验将涉及该氨基酸的突变,并将其与GmRLK18-1的稳定性和/或结合所有植物及其许多病原体中发现的CLE样肽基序的功能相关联[gydF4y2Ba30.gydF4y2Ba]。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
来源于等基因系“EF34-3”和“EF34-33”、“X5”和“X5”的品种“Essex”和“Forrest”,转基因Gm18-1 RLK (X5::RLK),在26℃的生长室中生长,如前所述[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
视交叉上核接种gydF4y2Ba
大豆种植在5 l桶中,每个桶随机分成20个球果。每个桶里装着1:1比例的砂土混合物。这些容器被放置在SIUC温室中26°C的水浴中。生长条件为光照周期14h,空中白天温度30°C,夜间温度22°C。感染为Hg 0型SCN人群(JB3)。每株14日龄苗接种2000个卵。将接种过的大豆植株从球果上移除;在10天(24dap)和0.5 g根样品冷冻或在28天(42dap)和根冷冻后计数囊肿数。实验重复进行。一些实验使用生长室进行SCN和根生长的测定。 The conditions varied from the greenhouse as follows. The whole chamber was set at 26°C. The humidity was maintained at approximately 40-50% judged by indicator cards.
GmRLK18-1和GmRLK08-1 LRR域的表达gydF4y2Ba大肠杆菌gydF4y2Ba
GmRLK18-1-LRR在pET30a中得到表达和纯化gydF4y2Ba大肠杆菌gydF4y2Ba如前所述[gydF4y2Ba6gydF4y2Ba]。RHG4-LRR在pET28a中通过相同的方法克隆和表达。简而言之,141-435的LRR残数(图1)gydF4y2Ba1gydF4y2Ba)表示为gydF4y2Ba大肠杆菌gydF4y2Ba采用包涵体沉淀和萃取缓冲液洗涤分离LRR蛋白。将纯包涵体部分溶解于2M尿素和10% (w/v)甘油中。折叠蛋白被这种低浓度的尿素选择性溶解。用Ni-NTA琼脂糖固定化金属离子亲和层析(IMAC)进一步纯化蛋白质。蛋白质在- 20或- 80℃保存直至使用。gydF4y2Ba
圆二色光谱和非结构区测定gydF4y2Ba
纯化后的GmRLK18-1的CD光谱按照先前的报道进行[gydF4y2Ba6gydF4y2Ba]。简单地说,用0.5M尿素、5mM还原谷胱甘肽、2mM氧化谷胱甘肽和2.0M精氨酸透析去除尿素蛋白。透析前对1.0M精氨酸,谷胱甘肽对进行透析,pH为6.0,缓冲磷酸钠。蛋白质必须在48小时内使用,以避免尿素释放后的沉淀。gydF4y2Ba
在25°C下,在0.2-0.3mg /ml的蛋白质浓度下,在0.5mm径长的石英比色皿中测量CD光谱。使用Aviv 62-DS光谱仪(Lakewood, NJ)分析天然蛋白、部分折叠蛋白和未折叠蛋白。在190 ~ 250nm波长范围内记录蛋白质远紫外光谱,平均时间为1s,在远紫外波长范围内平均扫描3次。使用称为CDTOOL的集成软件包处理CD数据。二级结构含量通过CDSSTR在dichroweb服务器(gydF4y2Bahttp://dichroweb.cryst.bbk.ac.uk/html/home.shtmlgydF4y2Ba)。的PrelinkgydF4y2BaTMgydF4y2Ba预测算法[gydF4y2Ba29gydF4y2Ba]用于探测LRR域潜在的非结构化区域。gydF4y2Ba
原生页面检测单体和二聚体gydF4y2Ba
采用大豆根蛋白提取物对GmRLK18-1进行12% (w/v)的天然PAGE [gydF4y2Ba31gydF4y2Ba]或gydF4y2Ba大肠杆菌gydF4y2Ba(gydF4y2Ba6gydF4y2Ba]。在原生PAGE上观察到的条带推断为GmRLK18-1 LRR结构域单体和来自gydF4y2Ba大肠杆菌gydF4y2Ba筛选了。洗脱液在非变性和变性条件下再次电泳,在12% (w/v)的SDS PAGE上使用既定的方案[gydF4y2Ba6gydF4y2Ba]。蛋白pi在[gydF4y2Ba8gydF4y2Ba]及[gydF4y2Ba28gydF4y2Ba]。gydF4y2Ba
用MAB试剂修饰LRR结构域gydF4y2Ba
采用Sephadex G-25粒径隔离柱层析法从溶解后的LRR中去除2M尿素。首先用平衡缓冲液(21mM Tris-Cl pH 8.0, 1mM EDTA, 0.01% (v/v) NP-40, 5% (v/v)甘油和200mM NaCl)以1g/10ml树脂/平衡缓冲液的比例对树脂进行平衡,并将树脂装入1ml BD™注射器管中,在1000下旋转5分钟gydF4y2BaggydF4y2Ba和4°C。随后,将蛋白涂于填充柱上,在1000℃下再次离心5分钟gydF4y2BaggydF4y2Ba和4°C。过量10倍的2-[N2-(4-叠氮基-2,3,5,6-四氟苯甲酰)- n6 -(6-生物胺己基)- l -赖氨酸基]乙基甲基乙硫磺酸盐,(MAB;采用Pierce Biotechnology, Rockford, IL)试剂溶解在二甲基甲酰胺中,在室温下黑暗修饰15 μg (3.5 pM)的LRR 1hr。gydF4y2Ba32gydF4y2Ba]。在这一步骤中,MAB与LRR N端的游离半胱氨酸结合。之后,多余的试剂通过Sephadex™G-50隔离柱层析从反应中除去。gydF4y2Ba
UV交联和标签转移程序gydF4y2Ba
在12.5 μl条件下,用30mM NaOH-HEPES [pH 7.8]、60mM NaCl、5mM MgCl,使MAB修饰的LRR结构域蛋白(3.5 pM)在30℃下平衡30分钟,使其与同型二聚体自由结合和/或分离gydF4y2Ba2gydF4y2Ba5% (v/v)甘油和0.1mg/ml BSA。紫外线照射(Spectroline BIO-VISION紫外/白光透光器,310 nm, 2.65 mW/cmgydF4y2Ba2gydF4y2Ba(距离为8 cm) 2 min,使生物素标签共价连接到最近的残基(< 11.1 a) [gydF4y2Ba33gydF4y2Ba]。将生物素标签通过添加DTT至终浓度为100mM的方法转移到残基上,以打破与半胱氨酸的二硫键。gydF4y2Ba
质谱分析用蛋白质的制备和生物素化肽的富集gydF4y2Ba
最初,用胰蛋白酶(溶解在1mM盐酸中)酶解LRR结构域,酶与底物的比例为1:5,在25mM碳酸氢铵中37°C下酶解3小时。然后用蛋白酶抑制剂PMSF(超过胰蛋白酶的20倍摩尔量)停止反应,然后通过单体亲素柱(生物素化蛋白的结合能力约为1.2mg/ml),该柱已经用阻断缓冲液(4mM d-生物素溶解在1x PBS中)阻断,并用12柱体积的洗脱缓冲液(0.4% (v/v)三氟乙酸和40% (v/v)乙腈)洗涤。用5柱体积的洗脱缓冲液(200 μl)从柱中洗脱生物素化肽。样品被送到SIUC的质谱设备进行多肽片段大小估计,以进行MALDI分析。简单地说,将1μl胰蛋白酶化蛋白滴入1μl MALDI基质(5 mg/ml α -氰基-4-羟基肉桂酸在50% (v/v)乙腈中)中,在不锈钢板上干燥。使用Bruker Daltonics Microflex™(Billerica, MA)飞行时间质谱仪对样品进行分析,脉冲氮激光设置为337nm,重复频率为20 kHz,所产生的离子在正离子模式下被观察到,作为1 - 1万m/z范围内500个独立质谱的总和。gydF4y2Ba
西部和远西部分析与LRR域探针gydF4y2Ba
对Essex和Forrest的总植物蛋白进行SDS-PAGE分析,然后采用之前描述的方法进行Western杂交[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],并作以下修改。对于Western杂交,使用了一种定制抗体,该抗体针对RHG1的LRR结构域的肽CTL SRL KTL DIS NNA LNG NLP ATL SNL S (Alpha Diagnostics, San Antonio, Texas)。二抗采用抗兔IgG HRP (GE healthcare, Milwaukee, Wisconsin)。gydF4y2Ba
对于Far-Westerns, LRR结构域被用作从1或2维凝胶转移的过滤器的探针。作为二级探针,anti-his抗体结合HRP(1-10,000稀释;使用Invitrogen, Carlsbad CA)。人工挑选斑点和条带,用胰蛋白酶消化其中的蛋白质,采用直接输注MS/MS方法进行鉴定。gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
配体结合试验gydF4y2Ba
为gydF4y2Ba在体外gydF4y2Ba实验用荧光素-5-异硫氰酸酯(FITC)在室温下以10:1的摩尔比标记潜在的肽配体60分钟(G-Biosciences, St . Louis, MO)。标记的肽在10% (v/v)甘油中于- 20℃保存至使用。在配体结合实验中,将肽在20 mM磷酸盐缓冲液(pH6.9)中稀释至50nM/ml,在比色皿中使用发光光谱仪扫描500-600 nm的偏振发光量,激发能为494 nm,检测波长为520 nm。激发狭缝设置为4 nm,发射狭缝设置为4 nm,扫描速度为100 nm/min。配体在试管中加入超过(50 nM)的配体。多肽以5 nM的等分加入,以荧光单位测量极化的增加。从极化单元中减去与非cle和非lrr肽的基线结合。用3种不同的蛋白制剂重复实验3次。解离常数(Kds)由双倒数Scatchard图计算[gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
在足底gydF4y2Ba试验采用栽培品种X5和Westag 97各12株,在两个独立的实验中进行根浸试验,时间超过一个月[gydF4y2Ba55gydF4y2Ba]。将被hg0型(分离物JB3)侵染的SCN易感植株放置于10天,取0.5g根样。然后将根浸在50 pM浓度的CLE肽TGIF或HgCLE水中,并返回侵染土壤。分别于治疗后2分钟、5分钟和18天拍照。gydF4y2Ba
GmRLK18-1的生物信息学分析gydF4y2Ba
GmRLK18-1的核苷酸序列,编码的RLKgydF4y2Barhg1gydF4y2Ba位点,被翻译成它的多肽序列gydF4y2Bain-silicogydF4y2Ba使用EXPASY翻译工具(gydF4y2Bahttp://www.expasy.ch/tools/dna.htmlgydF4y2Ba)。GmRLK18-1的完整序列(855个氨基酸)进行结构域结构分析(smart. embll -heidelberg.de)。lrr结构域(氨基酸52 ~氨基酸440)用于模型生成。在(supfam.mrc-lmb.cam.ac.uk/SUPERFAMILY)上找到的Apache服务器被用来预测蛋白质的超家族、折叠和类别。采用基于web的算法SNAP (gydF4y2Bahttp://www.hiv.lanl.gov/content/sequence/SNAP/SNAP.htmlgydF4y2Ba)。gydF4y2Ba
结构的比较和同源建模gydF4y2Ba
GmRLK18-1结构的第一个模型是使用RAMP软件套件程序(gydF4y2Bahttp://compbio.washington.edugydF4y2Ba;gydF4y2Bahttp://protinfo.compbio.washington.edugydF4y2Ba)。GmRLK18-1的初始模板和相应的序列比对选择自3D-Jury服务器(gydF4y2Bahttp://BioInfo.PLgydF4y2Ba)。通过检查GmRLK18-1-LRR蛋白的一致序列和所有模板序列(附加文件)确定最佳模板gydF4y2Ba8gydF4y2Ba:图S4)。最后,对这些对齐进行手动调整,以获得lrr域的最佳对齐。采用PRI (PDB入口2BNH)的晶体结构作为模板结构对GmRLK18-1进行建模。gydF4y2Ba
初始模型采用最小摄动方法构建[gydF4y2Ba34gydF4y2Ba]。采用图论团寻方法构造了可变侧链和主链,该方法探索了各侧链和主链的各种可能构象,并利用全原子评分函数找到了最优组合。这些方法已在上文[gydF4y2Ba34gydF4y2Ba- - - - - -gydF4y2Ba37gydF4y2Ba]。简单地说,基于每个单独的比对,通过复制靶蛋白和模板蛋白中相同的主链(不包括任何插入/环)和残基侧链的原子坐标来生成初始模型。使用SCWRL3程序构建了侧链类型不同的残基模型。考虑到靶区与模板结构的不同,主链区域(环)产生了一系列可能的构象。这些模型包括潜在的插入和删除。采用基于14个离散扭角状态的穷举抽样技术进行主链抽样。改进gydF4y2Ba从头开始gydF4y2Ba采样方案也被纳入循环采样技术[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]。使用ENCAD对所有模型进行细化,并使用残差全原子条件概率判别函数(RAPDF)选出最佳模型。gydF4y2Ba
根据核糖核酸酶抑制剂-血管生成素复合物(1a4y)的同型二聚体构象的相对位置,使用XtalView软件包生成GmRLK18-1的同型二聚体构象。使用SCWRL3生成GmRLK18-1同种异体(A87V、Q115K和H274N)的结构。为了评估结构的稳定性,用RAPDF计算了结构的伪能量。gydF4y2Ba
结构模型验证与分析gydF4y2Ba在网上gydF4y2Ba
蛋白质结构验证检查,主要是蛋白质结构的立体化学质量,使用PROCHECK (gydF4y2Bahttp://www.ebi.ac.uk/thornton-srv/software/PROCHECK/gydF4y2Ba)。采用PROCHECK算法进行主链、侧链参数分析和Ramachandran图分析。利用两个预测服务器进一步分析了SCN I型抗性异体与易感异体之间3个氨基酸变化的功能和结构重要性(gydF4y2Bahttp://robetta.bakerlab.org/gydF4y2Ba;gydF4y2Bahttp://fold-x.embl-heidelberg.degydF4y2Ba)。gydF4y2Ba
缩写gydF4y2Ba
- 远程雷达:gydF4y2Ba
-
亮氨酸丰富重复gydF4y2Ba
- RLK:gydF4y2Ba
-
受体样激酶gydF4y2Ba
- 继续教育:gydF4y2Ba
-
克拉瓦塔像引出器。gydF4y2Ba
参考文献gydF4y2Ba
Jones JDG, Dangl JL:植物免疫系统。自然科学,2006,44(4):323-329。gydF4y2Ba
杨建军,杨建军,李建军,等。植物受体样丝氨酸苏氨酸激酶在植物防御信号转导中的作用。植物学报,2008,21(2):557 - 557。gydF4y2Ba
Wrather JA, Koenning SR, Anderson TR:病害对美国和安大略省大豆产量的影响(1999 - 2002)。植物健康计划,2003,10.1094/PHP-2003-0325-01-RV。gydF4y2Ba
[j]张建军,张建军,张建军,等。温度对动物种族测定的影响。gydF4y2Ba异皮线虫属甘氨酸gydF4y2Ba。中国生物医学工程学报,2009,32(2):349-355。gydF4y2Ba
Ruben E, Aziz J, Afzal J, Njiti VN, Triwitayakorn K, Iqbal MJ, Yaegashi S, Arelli PR, Town CD, Ishihara H, Meksem K, Lightfoot DA:“Peking”基因分析gydF4y2Barhg1gydF4y2Ba基因座:大豆抗囊线虫的候选基因。中国生物医学工程学报,2006,32(2):393 - 393。gydF4y2Ba
大豆抗病蛋白GmRLK18-1-LRR结构域的表达、纯化和重组gydF4y2Ba大肠杆菌gydF4y2Ba包含体:为功能分析做准备。中国生物医学工程学报,2007,35(3):346-355。gydF4y2Ba
李建军,李建军,李建军,李建军,等gydF4y2BaRhg1 / Rfs2gydF4y2Ba基因座:一个影响根系发育、线虫抗性重组抑制的模型。理论与应用,2012,24(4):1027-1039。gydF4y2Ba
Srour A, Afzal AJ, Saini N, Blahut-Beatty L, Hemmati N, Simmonds DH, El Shemy H, Town CD, Lightfoot DA SH:受体样激酶的转基因研究gydF4y2BaRhg1 / Rfs2gydF4y2Ba基因座对大豆囊线虫猝死综合征产生多效性抗性。中国生物医学工程学报,2012,13(3):493 - 493。gydF4y2Ba
刘霞,刘森,Jamai A, Bendahmane A, Lightfoot DA, Mitchum MG, Meksem K:大豆对包囊线虫的抗性是独立的gydF4y2BaRhg4gydF4y2Ba位点LRR RLK基因。功能集成基因组,2012,10.1007/s10142-011-0225-4。gydF4y2Ba
Cook DE, Lee TG, Guo xin, Melito S, Wang K, Bayless AM, Wang J, Hughes TJ, Willis DK, Clemente TE, Diers BW, Jiang J, Hudson ME, Bent AF: rg1介导大豆线虫抗性的多基因拷贝数变异。科学通报,2012,38(3):1106 - 1109。gydF4y2Ba
王国良,阮德林,宋文伟,Sideris S,陈丽丽,皮莱,张思平,张志,Fauquet C, Gaut BS, Whalen MC, Ronald PC:gydF4y2BaXa21DgydF4y2Ba编码一个具有丰富亮氨酸重复结构域的受体样分子,决定种族特异性识别是否受适应性进化的影响。植物学报,1998,10:765-779。gydF4y2Ba
王晓明,王晓明,王晓明,等。鞭毛蛋白感知在先天性免疫中的应用。植物科学,2002,7:251-256。gydF4y2Ba
王晓明,王晓明,王晓明,等。油菜自交不亲和基因的研究进展。科学,2001,29(3):1824-1826。gydF4y2Ba
叶夫多基莫夫AG,安德森DE, Routzahn KM, Waugh DS:不同寻常的分子结构gydF4y2Ba鼠疫杆菌gydF4y2Ba细胞毒素YopM:具有最短重复单元的富含亮氨酸的重复蛋白。中国生物医学工程杂志,2001,31(2):444 - 444。gydF4y2Ba
Schubert WD, Urbanke C, Ziehm T, Beier V, Machner MP, Domann E, Wehland T, Chakraborty T, Heinz DW:一种主要入侵蛋白内毒素的结构gydF4y2Ba单核细胞增多性李斯特氏菌gydF4y2Ba与人类受体e -钙粘蛋白结合。细胞。2002,11:825-836。gydF4y2Ba
Di Matteo A, Federici L, Mattei B, Salvi G, Johnson K, Savino C, De Lorenzo G, Tsernoglou D, Cervone F:多半乳糖醛酸酶抑制蛋白(PGIP)的晶体结构,一种富含亮氨酸的重复蛋白。美国国家科学促进会。[j] .中国科学:地球科学。gydF4y2Ba
陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。实验学报,2006,35(5):559- 569。gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,等。甾体激素受体激酶BRI1的表达及其调控机制。自然科学,2011,(4):467-471。gydF4y2Ba
佘军,韩忠,金涛,王军,程伟,常军,石森,王军,杨敏,王志强,柴军:bri对油菜素内酯感知的结构研究[J]。自然科学,2011,41(4):472-476。gydF4y2Ba
洪洪华,王志强,王志强,等。proteinfo:蛋白质结构预测。中国生物医学工程学报,2003,31(3):396 - 396。gydF4y2Ba
Scott PG, McEwan PA, Dodd CM, Bergmann EM, Bishop PN, Bella J:装饰素二聚体蛋白核心的晶体结构,典型的小亮氨酸重复蛋白多糖。美国国家科学促进会。[j] .中国科学:地球科学。gydF4y2Ba
何晓玲,王坤,何志刚,何志刚,王凯,何志刚,何志刚,garcikc: Nogo受体外域结构与髓磷脂抑制的关系。神经学报,2003,38:177-185。gydF4y2Ba
王志刚,王志刚,王志刚,王志刚。晶体结构的研究gydF4y2Ba副球菌denitrificansgydF4y2Ba芳香氨基酸氨基转移酶:通过氢键网络重排构建的底物识别位点。中国生物医学工程杂志,2002,28(4):559 - 561。gydF4y2Ba
Han SW, Lee SW, Ronald PC: Ax21的分泌、修饰和调控。中华微生物学杂志,2011,14:62-67。gydF4y2Ba
Replogle A, Wang J, Bleckmann A, Hussey RS, Baum TJ, Sawa S, Davis EL, Wang X, Simon R, Mitchum MG:拟南芥线虫CLE信号通路中CLAVATA2和CORYNE的表达。植物科学学报,2011,35(5):444 - 444。gydF4y2Ba
黄春华,黄春华,黄春华,等。接种和硝酸盐诱导的大豆CLE肽控制nark依赖的根瘤形成。MPMI。2011, 24: 606-618。gydF4y2Ba
Basak J, Bahadur RP:一种编码抗性蛋白的抗病基因同源物三维结构的理论模型gydF4y2Ba豇豆属曼戈gydF4y2Ba。生物质化学工程学报,2006,24(4):391 - 391。gydF4y2Ba
张建军,张建军,张建军,等。一种新型的蛋白靶点筛选方法。中国生物医学工程学报,2008,31(4):444 - 444。gydF4y2Ba
Coeytaux K, Poupon A:基于氨基酸组成的蛋白质序列未折叠片段预测。生物信息学2005,21:1891 - 1900。李建军,李建军,李建军,等。植物富含亮氨酸重复序列(LRR)的蛋白质中断插入。《生物分子》,2012,出版中。gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,王晓明,等:细胞凋亡信号肽家族的生物信息学分析。植物学报,2008,8(1):1 - 4。gydF4y2Ba
Afzal AJ, Natarajan A, Saini N, Iqbal MJ, Geisler MA, El Shemy H, Mungur R, Willmitzer L, Lightfoot DA:线虫抗性等位基因的研究gydF4y2Barhg1gydF4y2Ba基因座改变大豆根系的蛋白质组和代谢组。植物生理学报,2009,32(1):444 - 444。gydF4y2Ba
Goil A:绘制ISW2复合物与核小体之间的结合相互作用。女士论文。美国:卡本代尔,156。gydF4y2Ba
张建军,张建军,张建军,等。同源双功能蛋白交联试剂长度的定量评价。中国生物医学工程学报,2001,32(1):393 - 394。gydF4y2Ba
夏勇,黄恩义,李维特M, Samudrala R:gydF4y2Ba从头开始gydF4y2Ba用分层方法构建蛋白质三级结构。中国生物医学工程学报,2009,30(3):391 - 391。gydF4y2Ba
Samudrala R,夏宇,黄娥,levitm:gydF4y2Ba从头开始gydF4y2Ba结合层次分析法的蛋白质结构预测。结构函数学报,1999,(7):194-198。gydF4y2Ba
Samudrala R, Levitt M: 40个盲蛋白结构预测的综合分析。生物医学工程学报,2002,22(3):391 - 391。gydF4y2Ba
陈国强,陈国强,陈国强,等gydF4y2Ba从头开始gydF4y2Ba蛋白质结构预测。蛋白质学报,1995,23(3):431- 445。gydF4y2Ba
刘涛,Samudrala R .:实验分辨率对基于知识的蛋白质结构选择区分功能性能的影响。生物工程学报,2006,19(1):431-437。gydF4y2Ba
张建军,张建军,张建军,等。核糖核酸酶抑制蛋白的研究进展[J] .中国生物医学工程学报,1997,26(4):343 - 346。gydF4y2Ba
王志强,王志强,王志强,等。基于残基三元组的蛋白质结构预测方法。蛋白质工程学报,2006,19(1):187-93。gydF4y2Ba
McDermott JE, Corrigan A, Peterson E, Oehmen C, Niemann G, Cambronne ED, Sharp D, Adkins JN, Samudrala R, Heffron F:革兰氏阴性菌III型和IV型分泌效应物的计算预测。感染免疫,2011,79:23-32。gydF4y2Ba
Demarest SJ, Martinez-Yamout M, Chung J,陈红伟,徐伟,Dyson HJ, Evans RM, Wright PE: p160核受体共激活剂对CBP/p300的相互协同折叠。自然科学,2002,15(4):549-553。gydF4y2Ba
李建军,李建军,李建军,李建军,等。蛋白质结构与功能研究进展。生物工程学报,2008,18(3):756-764。gydF4y2Ba
鲍曼,李建军,李建军,等。p27(Kip1)活化与非活化Cdk2相互作用的热力学表征:内在非结构蛋白的热力学链。生物工程学报,2006,32(4):559 - 559。gydF4y2Ba
Mészáros B, Simon I, Dosztányi Z:无序蛋白中蛋白质结合区域的预测。计算机工程学报,2009,35(5):391 - 391。10.1371 / journal.pcbi.1000376。gydF4y2Ba
李建军,李建军,李建军,等。蛋白质复合物稳定性的预测:一项超过1000个突变的研究。中国生物医学工程学报,2002,32(3):369-387。gydF4y2Ba
程刚,钱斌,Samudrala R, Baker D:基于计算设计的蛋白质家族进化结构功能约束的蛋白质功能位点预测。中国生物医学工程学报,2005,33(3):561 - 567。gydF4y2Ba
Djordjevic MA, Oakes M, Wong CE, Singh M, Bhalla P, Kusumawati L, Imin N:边界序列gydF4y2BaMedicago truncatulagydF4y2BaCLE36是由紫花苜蓿和大豆细胞外液中常见的内源性蛋白酶特异性切割的。实验学报,2011,32(2):449 - 459。gydF4y2Ba
李建军,李建军,李建军,等。基于gis的蛋白质同源性建模方法研究。生物信息学,2006,22(2):195-201。gydF4y2Ba
福田,东山,等。植物多肽功能的研究进展。植物生理学报,2011,52(1):1-4。gydF4y2Ba
杨建军,李建军,李建军,等。植物致病性细菌效应蛋白的研究进展。科学通报,2005,32(3):548- 555。gydF4y2Ba
王志强,王志强,王志强,等。植物生理学报,2008,35(4):839-844。gydF4y2Ba
Schenk PM, Kazan K, Wilson I, Anderson JP, Richmond T, Somerville SC,等:基因芯片分析揭示的拟南芥植物防御反应。美国国家科学促进会。[j] .中国科学:地球科学。gydF4y2Ba
杨建军,张建军,张建军,等。小麦抗白粉病基因表达分析及基因沉默研究进展。中国生物医学工程学报,2009,35(6):591 - 591。gydF4y2Ba
Lightfoot DA:抗枯萎病根腐病、包囊线虫和大豆猝死综合征的抗性基因和蛋白及其应用方法。2012,专利申请61/ 432226。最终申请日期为2012年1月13日。gydF4y2Ba
致谢gydF4y2Ba
本项目由美国国家科学基金会资助,基金号:0487654。本材料中表达的任何观点、发现、结论或建议都是作者的观点,并不一定反映美国国家科学基金会的观点。我们感谢Mary Kinsel博士在质谱方面的协助和Shehzad Khan博士在荧光各向异性方面的协助。gydF4y2Ba
Afzal和Srour是联合第一作者。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
作者的贡献gydF4y2Ba
DAL构思了这项研究和所有的分析。AS和JA进行了远西部战役。RS和JY进行了同源建模。SV开发了GmRLK08-1表达载体。DAL和SK进行CLE结合试验。AG进行交联实验。DAL进行了根浸试验。DAL起草了手稿。AS和JA提供了关键的审查,解释结果和反馈。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
电子补充资料gydF4y2Ba
12870 _2012_1261_moesm1_esm.pdfgydF4y2Ba
附加文件1:图S1:外源处理对X5和Westag 97根系CLE肽的影响根浸试验。被hg0型(分离物JB3)侵染的SCN易感植株放置10天(24天),取0.5g根样。然后将根浸泡在50 pM浓度的CLE肽TGIF或HgCLE中,并返回侵染土壤。在X5 (panel)中萎蔫和茎弯更为严重gydF4y2BaBgydF4y2Ba-gydF4y2BaDgydF4y2Bawestag97(面板)植物gydF4y2BaFgydF4y2Ba-gydF4y2BaHgydF4y2Ba)植物。面板A和E是在存放之前。面板gydF4y2BaBgydF4y2Ba和gydF4y2BaFgydF4y2Ba浸渍后2分钟再灌封。面板gydF4y2BaCgydF4y2Ba和gydF4y2BaGgydF4y2Ba治疗后15分钟。面板gydF4y2BaDgydF4y2Ba和gydF4y2BaGgydF4y2Ba在根收获28天(42天)。经水处理的植株上有大量的囊肿,但在HgCLE或GmTDIF浸泡的5株植株上各有10±6个囊肿(表2)。gydF4y2Ba
12870 _2012_1261_moesm2_esm.docgydF4y2Ba
附加文件2:表S1:模型GmRLK18-1 LRR结构主链参数PROCHECK分析。以2.3 Å分辨率显示了建模的GmRLK18-1-LRR和典型蛋白质的立体化学参数,如允许区域残基百分比、欧米加角标准差、氢键标准差和模型的整体质量。(doc 68kb)gydF4y2Ba
12870 _2012_1261_moesm3_esm.pdfgydF4y2Ba
附加文件3:图S2:基于猪核糖核酸酶抑制剂模板的GmRLK18-1同源模型结构的Ramachandran图。每个氨基酸残基用一个黑点表示。红色表示最有利的残留位置,黄色表示额外允许残留位置,米色表示慷慨允许残留位置,白色表示不允许残留位置。(pdf 47kb)gydF4y2Ba
12870 _2012_1261_moesm4_esm.docgydF4y2Ba
附加文件4:表S2:从PROCHECK计算的GmRLK18-1的Ramachandran图统计。模型蛋白中大约71%的氨基酸残基位于Ramachandran图的允许区域。另外26%的氨基酸残基位于额外的允许区域,而在Ramachandran图中,有2.4%的氨基酸落在慷慨允许区域。不到1%的残留物(3)在不允许的区域。(doc 67kb)gydF4y2Ba
12870 _2012_1261_moesm5_esm.docgydF4y2Ba
附加文件5:表S3: 3个LRR突变体和野生型GmRLK18-1-LRR的RAPDF评分。RAPDF评分表明,这些突变可能会影响同型二聚体蛋白的稳定性,尽管这些残基与同型二聚体界面没有直接关系。(doc 39kb)gydF4y2Ba
12870 _2012_1261_moesm6_esm.pdfgydF4y2Ba
附加文件6:图S3: 7个GmRLK18-1同种异体的序列多样性。87位丙氨酸仅存在于“Peking”序列中。两个额外的变化Q到K在位置115和H到N在位置274不是唯一的电阻类型i (PDF 7kb)gydF4y2Ba
12870 _2012_1261_moesm7_esm.docgydF4y2Ba
附加文件7:表S4:通过Fold X算法计算的三个非同义替换对蛋白质稳定性的影响(http://fold-x.embl-heidelberg.de)。给出了计算得到的折叠自由能和野生型蛋白(北京等位基因)与突变蛋白之间的自由能变化。H到N和Q到K的变化增加了折叠的自由能,而丙氨酸到缬氨酸的变化导致自由能的显著降低。(DOC 45kb) (DOC 46kb)gydF4y2Ba
12870 _2012_1261_moesm8_esm.pptxgydF4y2Ba
附加文件8:图S4:与RHG1序列高度同源的LRR蛋白的三维结构。面板(gydF4y2Ba一个gydF4y2Ba)为BRI1 (pdb id: 3RGX)的晶体结构。油菜素类固醇识别是通过Brassinosteroid - insensitive 1 (BRI1)的LRR结构域介导的。BR1I以单体形式存在。蛋白质以螺旋螺线管结构存在。(gydF4y2BabgydF4y2Ba聚半乳糖醛酸酶抑制蛋白(PGIP)的晶体结构。PGIP蛋白(PDB id: 1ogq)是一种与真菌内聚半乳糖醛酸酶相互作用的细胞壁蛋白。(gydF4y2BacgydF4y2Ba)猪核糖核酸酶抑制剂(PRI)的x射线结构。PRI的富亮氨酸重复序列(PDB id: 2BNH)与核糖核酸酶形成紧密复合物,从而调节RNA水平。PRI采用马蹄形结构,LRR基序由重复β环螺旋单元组成。(pptx 354kb)gydF4y2Ba
作者提交的原始图片文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Afzal, a.j., Srour, A, Goil, A。gydF4y2Baet al。gydF4y2Ba富亮氨酸重复结构域的同二聚化和配体结合gydF4y2BaRHG1 / RFS2gydF4y2Ba对两种大豆病原菌的潜在抗性。gydF4y2BaBMC Plant BiolgydF4y2Ba13日,gydF4y2Ba43(2013)。https://doi.org/10.1186/1471-2229-13-43gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-13-43gydF4y2Ba
关键字gydF4y2Ba
- 受体gydF4y2Ba
- 富亮氨酸重复gydF4y2Ba
- 配位体gydF4y2Ba
- 肽gydF4y2Ba
- 交联gydF4y2Ba
- 预测gydF4y2Ba