- 研究文章
- 开放访问
- 发布:
转录因子RAP2.6的过表达增强了合胞体的胼胝质沉积,增强了对甜菜包囊线虫的抗性heterodera schachtii.在拟南芥根系中
BMC植物生物学体积13文章编号:47.(2013)
摘要
背景
囊肿线虫作为第二阶段青少年侵入其宿主植物的根源,诱导一个同义性,这是他们的生命中的营养素来源。甜菜囊肿线虫诱导的异胞体分析heterodera schachtii.在拟南芥根中的研究表明合胞体中的基因表达不同于根的表达,有数千个基因上调或下调。在这些下调的基因中,有许多是防御相关蛋白的编码基因。乙烯反应转录因子RAP2.6的编码基因。拟南芥基因组包含122个ERF转录因子基因,这些基因参与了多种发育和胁迫反应。
结果
的表达RAP2.6采用RT-PCR和启动子系::GUS进行研究。在正常生长条件下,该基因主要在根和茎中表达。它是由两但从一个早期的时间点,在一个傻瓜中下调。对基因的过度表达增强了对抗的抵抗力h . schachtii这是由于在这些植物上生长的线虫数量较少,合胞体和雌性线虫较小。T-DNA突变体有减少RAP2.6转录水平但这并未进一步提高对抗的易感性h . schachtii.无论是过表达谱还是突变体都没有影响P. inringae..RAP2.6过表达导致ja应答基因在感染后早期时间点表达升高h . schachtii.在过表达系上发育的合胞体显示胼胝质沉积增强。
结论
我们的结果表明h . schachtii感染伴随着下调RAP2.6.Nematodes似乎有可能使用效果,以积极下调这种和其他与防御相关基因的表达,以避免宿主植物的抵抗反应。RAP2.6过表达线的增强效应似乎是由于在Syncytia的增强胼沉积,这可能会干扰营养物质进入Syncytia。
背景
线虫是多细胞无节软体蠕虫,属于线虫门。它们在自然界中无处不在,从海洋的沉积物到高山和各种气候条件下都能找到[1].植物寄生线虫是专性的生物营养寄生虫,通常攻击许多植物的根。它们有广泛的宿主范围,可以直接或作为病毒载体破坏作物,从而对作物产量产生不利影响。据估计,每年由植物寄生线虫造成的全球农作物损失高达1570亿美元[2].
几种经济上重要的物种是不同作物植物和家庭内囊肿和根结线虫的病原体heteroderidae.是最重要的。它们是植物根的专性内寄生虫,作为第二阶段的幼体(J2幼虫)进入,并建立专门的进食结构[3.那4.].根结线虫属有诱导由几个巨细胞组成的喂养结构[5.].包囊线虫属的包囊线虫异皮线虫属和Globodera从卵孵化成J2幼虫,并通过不断击打寄生植物的根伸长区周围的茎管刺穿寄生植物的根。进入根后,它们在细胞内穿过根皮层,找到维管柱。当线虫到达维管束时,它们开始一种被称为合胞体的特殊取食部位[6.].合胞体起源于单个根细胞(ISC,初始合胞细胞),该细胞通过局部细胞壁溶解合并多达几百个相邻细胞而扩大。已有研究表明,植物编码的细胞壁修饰和降解酶,如膨胀蛋白、果胶酶和纤维素酶参与了这一过程[7.-11].该Syncytium成为当量通过随后的久坐寿命阶段发展的Nematodes的食物来源[12那13].成年雄性包囊线虫再次移动,离开进食地点与雌性交配,而雌性仍然附着在合胞体上。雌囊线虫交配后继续进食,但卵发育完成后死亡,在其增大的体内留下数百个卵。雌性的外层随后变硬,形成一个囊肿,保护卵,直到具有传染性的J2在有利的条件下孵化[3.].
维管柱内ISC的合胞体的建立很可能是通过线虫的分泌和植物基因的协调表达而开始的[9.-11那14那15].最近,我们对感染后5天和15天的合胞体进行了转录组分析h . schachtii在拟南芥根茎中,共21,138个基因中有34.2%的基因与未感染的对照根切片相比存在差异表达[16].其中18.4%(3893)表达上调,15.8%(3338)表达下调。上调的基因包括例如那些编码扩张蛋白、纤维素酶和果胶酸裂解酶的基因[9.-11],参与细胞壁降解和肌醇加氧酶基因编码[17].另一方面,线虫感染后受到强烈抑制的基因与植物的防御反应有关[16].一种强烈下调的基团,其组成,所述基因编码用于过氧化物酶,其中100种差异表达基因具有最强的表达降低,14是过氧化物酶[16].
与对照根段相比,合胞体中另一个基因显著下调RAP2.6基因(16].该蛋白家族的成员包含APETALA2 (AP2)结构域,在拟南芥中首次被定义为一个由12个基因编码的家族。APETALA2被发现参与了拟南芥花和种子发育的控制,并编码了一个假定的转录因子,该转录因子由一个被称为AP2域的新DNA结合基序区分[18].相关蛋白质最初鉴定为转录调节剂,其在乙烯信号传导下起作用[19].所有这些和其他蛋白质现在都包含在AP2/ERF超家族中,该家族在拟南芥中有147个成员[20.].其中最大的一组包括乙烯反应因子(ERFs),共有122个成员。这一组包含了最初描述的不同亚组的RAP2蛋白。
这RAP2.6基因已被报道对各种生物和非生物胁迫作出反应,表明其在调控这些胁迫中的作用。RAP2.6被发现参与了拟南芥对脱落酸(ABA)、伤害、茉莉酸(JA)、盐、冷和渗透胁迫的响应[21.-24.].的激活RAP2.6的III型分泌物的毒性和无毒菌株两据报道依赖于Coi1被[25.].同样,Rap2.6被确定为一个Coi1- 依赖JA-Invucible转录因子[26.].使用一个RAP2.6 :: LUC报告基因,发现RAP2.6由毒性细菌诱导P. inringae.光伏番茄而非非适应的细菌P. inringae.光伏phaseolicola[27.].众所周知P. inringae.利用coronatin诱导宿主植物的JA通路抑制水杨酸(SA)依赖的抗性[28.].RAP2.6在24小时后也得到了高度上调,以回应钻石黑蛾[29.].所有这些报告都表明RAP2.6基因参与JA响应。实际上,该基因是在JA-Invucible ERF转录因子的筛选中发现的14个AP2 / ERF基因中[30.],其中也包括ORA59 [31.].自从RAP2.6是合胞体中下调幅度最大的基因之一[16我们更详细地研究了该基因。我们推断出该基因可能是下调的h . schachtii避免植物抵抗反应。因此,我们已经过过表达了RAP2.6基因可能导致更高的抗性h . schachtii.
结果
ERF基因家族在合胞体中的表达
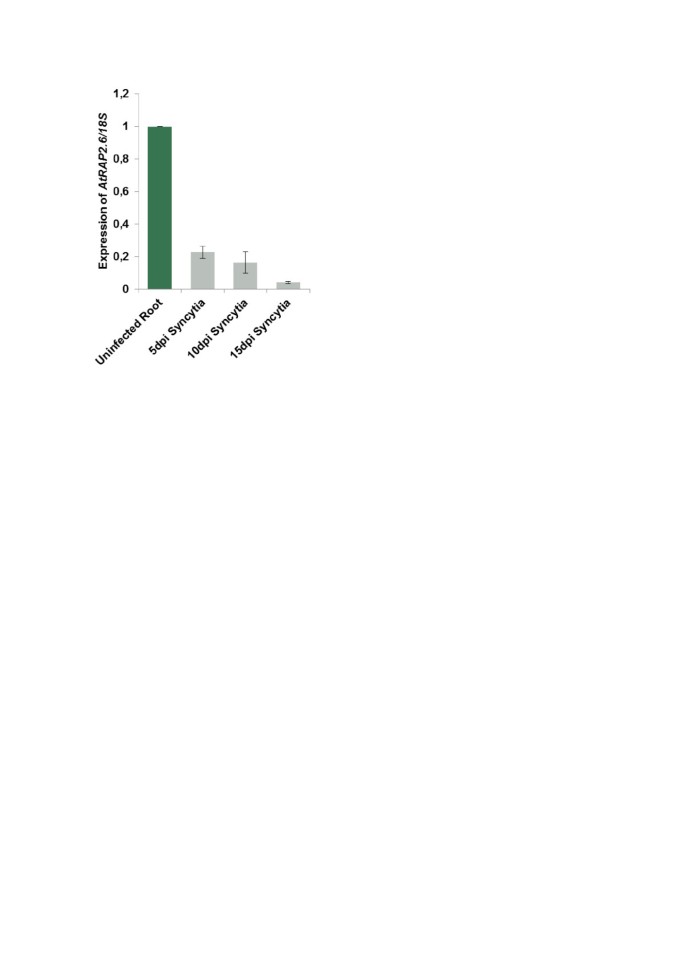
我们最近进行了对Syncytia引起的转录组分析h . schachtii在拟南芥根部[16].该分析数据被用于专门分析合胞体中ERF基因的表达。ERF家族有122个成员,其中105个被列入拟南芥基因芯片。我们的分析(表1和额外的文件1)表明,与对照根部相比,这些基因中只有7个在合胞上进行显着上调,而32显示出显着的下调(假发现率<5%)。比较15 dpi Syncytia与5 dpi Syncytia显示,与5 dpi Syncytia相比,15 dpi Syncytia的7个基因显着高得多(附加文件2).显示在Syncytia中最强的下调的基因是At5g25810(TNY),AT1G78080(RAP2.4),At2g20880那AT3G50260(CEJ1或亲爱的[32.]) 和At1g43160(RAP2.6),这是这个家庭中最抑制的基因。因为有几个报告发现它涉及植物阻力,并且GeneChip数据显示最强的下调RAP2.6(合胞体中表达量为0.91,对照根切片表达量为9.97),利用GUS和qRT-PCR技术对该基因在合胞体中的表达进行了详细研究。
启动子:: GUS和QRT-PCR分析RAP2.6表达合胞体
表达RAP2.6采用qRT-PCR方法,分别在5、10和15 dpi处切除合胞体。为了与genchip的结果进行比较,使用了与该研究相同的对照根段[16].RAP2.6与所有时间点的控制相比,在一个同义词中高度下调(图 1),从而验证在Syncytia中也表现出强烈抑制该基因的GeneChip数据。
进一步研究的表达RAP2.6合胞体中为胎膜早破RAP2.6::GUS融合在pMAA-Red中构建[33.并用来转化拟南芥。将具有代表性的纯合子启动子系::GUS在无菌条件下感染第二阶段的幼体,并在感染后的不同时间点染色检测GUS活性,即1,3,5,10,12和15dpi与未感染的根一起(图)2).在Nematode感染部位附近看到GUS表达在1 dpi附近,但在ISC中消失了。在3和5 dpi下,在大多数喂养位点被切断,但在围绕合身菌的细胞中仍然可见GUS染色。在10,12和15dpi,Gus表达既不在Syncytia中发现,也没有在Syncytia周围的细胞中发现。另一方面,在促进者的未感受的根部中发现了高度强烈的表达RAP2.6:: 20-D古植物中的GUS植物(对应于5 dpi),然后将其局限于25-和30 d型叶(对应于10和15dpi)的较小根部和侧面。启动子RAP2.6GUS分析也证实了genchip的数据。
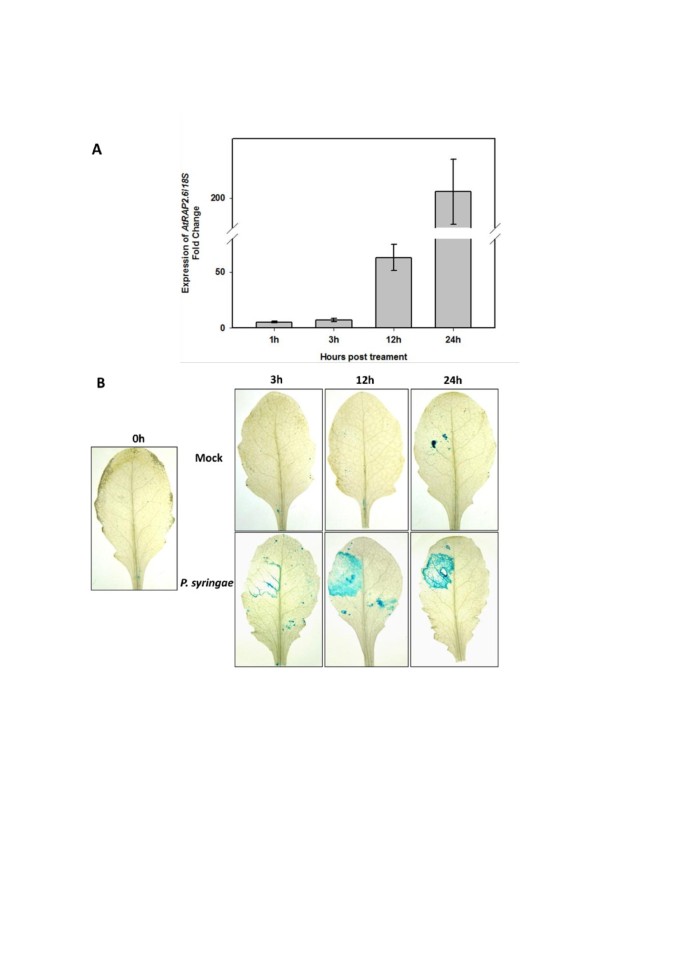
一个舞会RAP2.6以前也有报道过GUS株系,但是,作者仅展示了幼苗、花朵和七叶树的图片[24.].因此,我们在这里包含了对我们的线的发展分析(图)3.).1日龄幼苗的子叶和根部有GUS染色,根尖没有。在5 d龄幼苗中,在根中发现了启动子活性,而在根尖和下胚轴中没有。子叶未见GUS染色。在14天的树苗中也发现了类似的结果,但较老的根没有染色。在较老的莲座叶片中没有发现染色,除了一些叶片上有很小的非常弱的斑块(也比较图)4.).开花后,主叶脉有染色。茎生叶也有叶脉染色和弱斑染。我们还检测到茎部,特别是脉管部的GUS染色。在花中,GUS仅在心皮中表达,在幼角果中主要在毛层中表达,而在老角果中仅在部分瓣叶中表达。RT-PCR证实GUS表达(图)5.)发现了最强的RAP2.6根和茎中的表达。渗透后的GUS表达P. inringae.光伏番茄DC3000(图 5.)亦证实有关[25.那27.),RAP2.6是诱发的P. inringae..
的过表达系和突变体RAP2.6
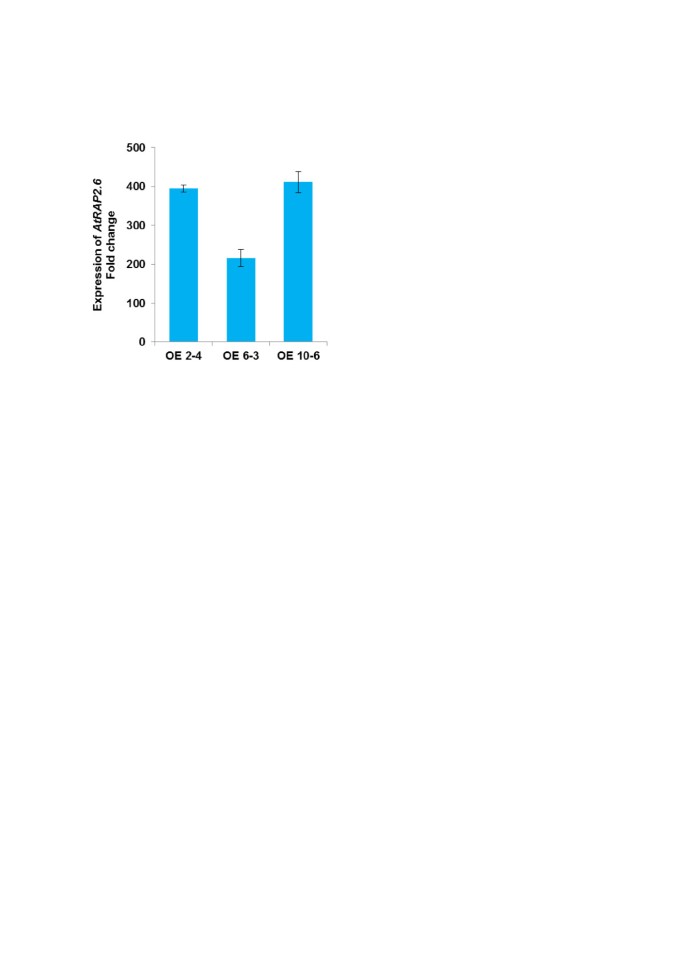
几份报告表明RAP2.6参与抵抗反应[25.那27.那29.那30.].这表明线虫可能下调表达RAP2.6以避免植物的抗性反应。因此,我们使用载体pMAA-Red构建了过表达系。纯合子系的选择首先根据不同株系种子的DsRed荧光程度进行目测,如前所述[33.].显示出强荧光的三条线纯合,然后用QRT-PCR进行,与野生型使用18S作为内部对照(图 6.).与野生型(Col)相比,14 d龄过表达品系幼苗的转录水平显著提高。如以前所报道的[24.], RAP2.6过表达导致开花早,但在我们的研究中,幼苗的表型与野生型没有区别(数据未显示)。
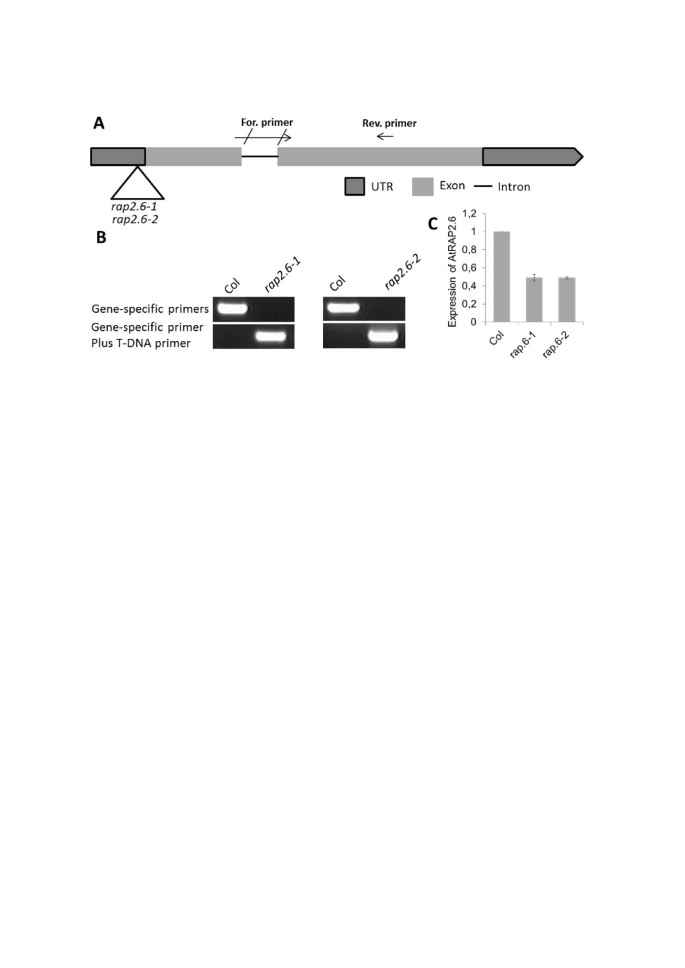
为了RAP2.6有1个突变体(GK-053G11)和若干个T3种子系。T-DNA的插入位于5´未翻译的前导区(图)7.A).两个T3株系的T-DNA插入通过PCR得到证实(图)7.B)如材料和方法中所述。通过qRT-PCR检测纯合品系的转录水平RAP2.6幼苗下调约50%(图 7.C).下降调节RAP2.6在这些突变体中,突变体植株开花晚,但幼苗的表型与野生型幼苗没有差异(数据未显示)。
过度的RAP2.6没有影响两
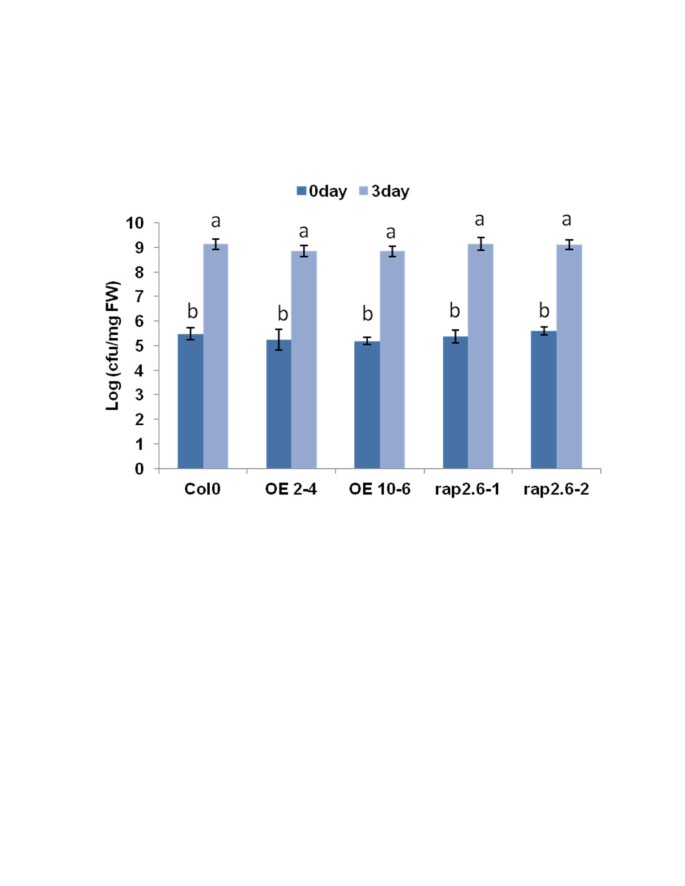
作为RAP2.6被毒性和非毒性菌株高度激活P. inringae.[25.那27.[我们通过分析PROMRAP2.6 :: GUS线(图 5.)我们还测试过过表达或突变体的效果RAP2.6关于致病菌株P. inringae.光伏番茄DC3000。既不夸张也不夸张RAP2.6对生长有影响吗P. inringae.光伏番茄DC3000与野生型植物相比(图 8.).这表明了RAP2.6没有参与抵抗或易感性P. inringae.光伏番茄DC3000。
过度的RAP2.6导致对线虫的抵抗力
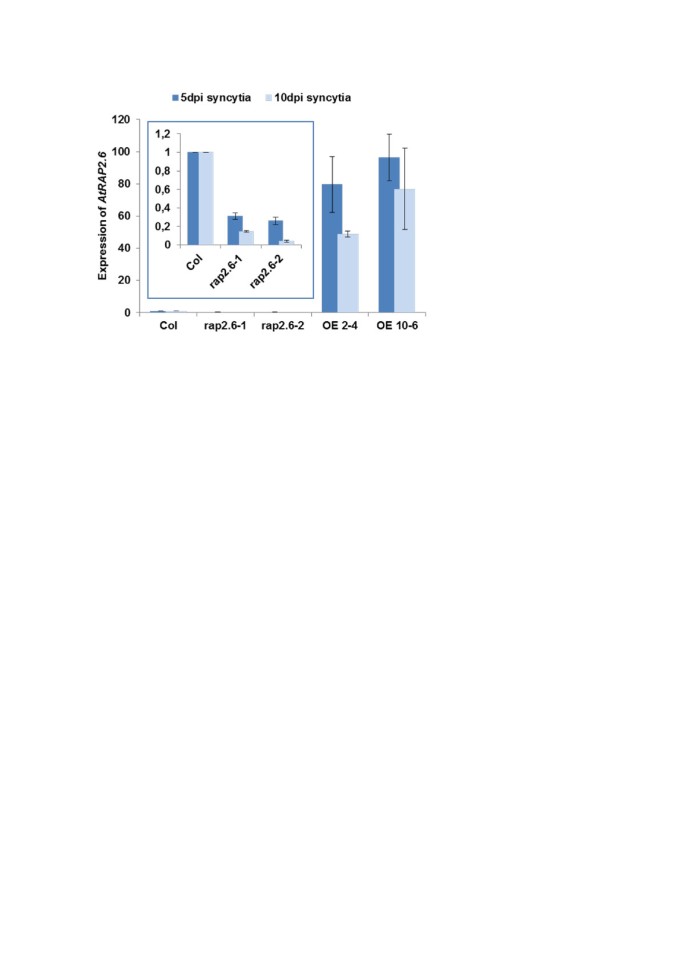
由于在幼苗中的表达可能与合胞体中的表达不同,我们测定了其表达水平RAP2.6突变系和过表达系的合胞体(图9.).与野生型相比,突变株合胞体中5和10 dpi的表达明显降低,而过表达株的表达明显升高。一般情况下,10dpi合胞体表达较低。
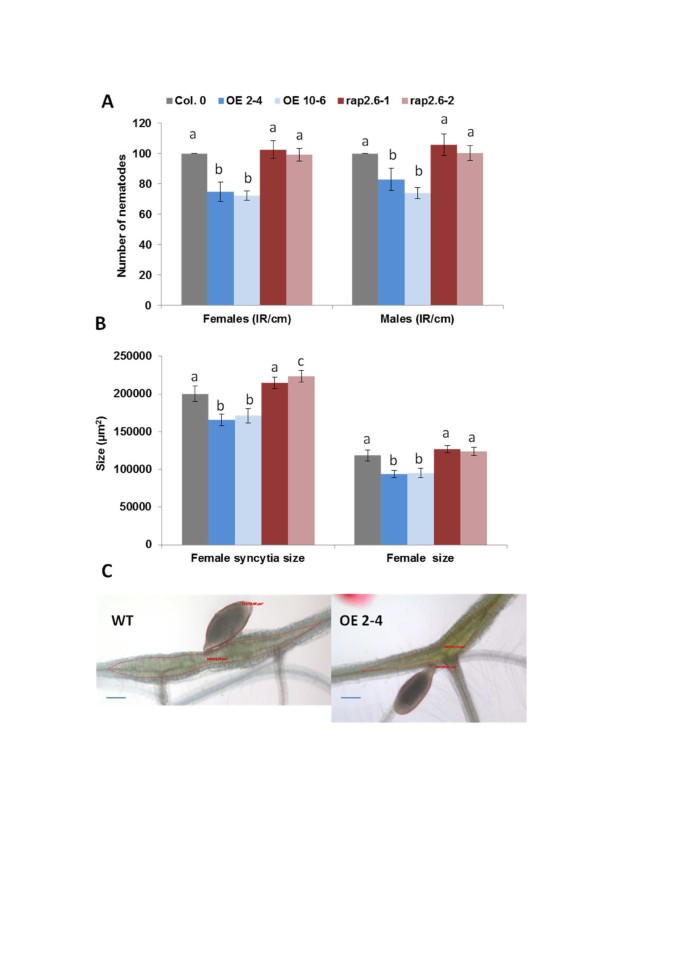
我们用两个过表达系和两个突变系进行了线虫侵染试验,并将结果与野生型植物进行了比较(图)10).与野生型相比,两种过表达系所支持的雌线虫和雄线虫数量均显著降低。过表达系还导致雌性线虫合胞体发育受损,且雌性线虫比野生型线虫小。而T-DNA插入突变体在雌雄线虫数量和雌线虫大小上与野生型均无显著差异。只有与雌性线虫相关的合胞体的大小受该突变的影响,且显著增大rap2.6-2.
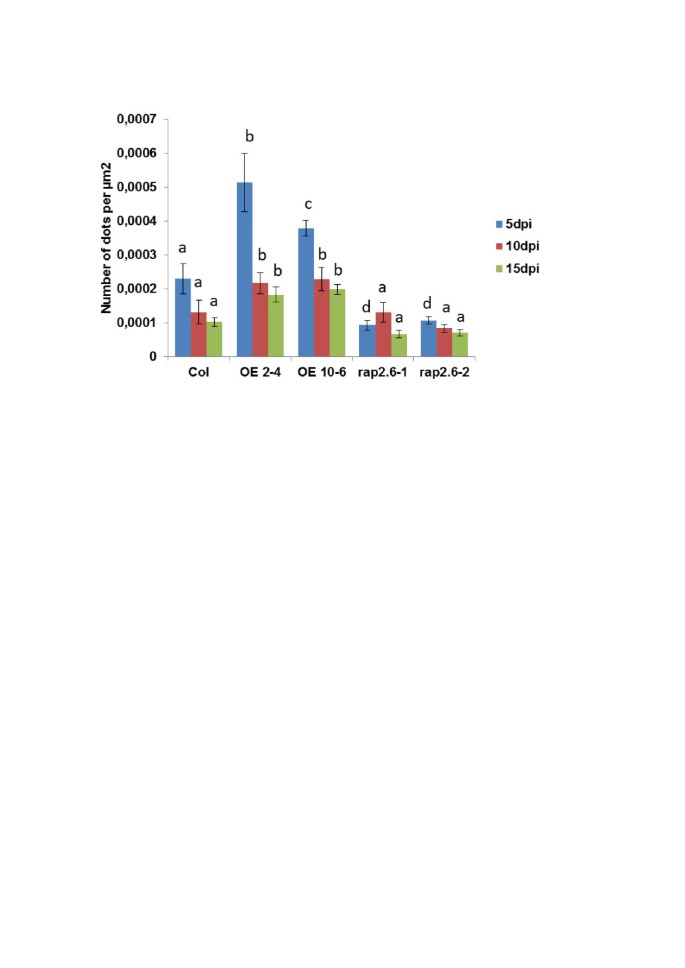
线虫电阻测试。过表达系和敲除突变体的抗性RAP2.6与野生型植物相比h . schachtii.一种:野生型为100%时,每厘米根长的雄性和雌性线虫数量按15 dpi计算。通过三个独立的重复确定统计学意义。值为平均值±SE, n = 15。条形为标准差,不同字母表示差异显著(P < 0.05;方差分析和LSD)。B.:14 dpi的女性同义性和女性线虫的大小。从三个独立的重复(总= 30)中随机选择十个同义性,并确定了同义性和相关的雌性线虫的大小。采用方差分析(P < 0.05)和LSD对数据进行显著性差异分析。数值为平均值±SE。C:野生型Col和过表达系OE - 4的合胞体和线虫的代表性照片。比例尺(蓝色)= 100 μm。
过表达系的线虫抗性可能受到SA和JA途径的调控
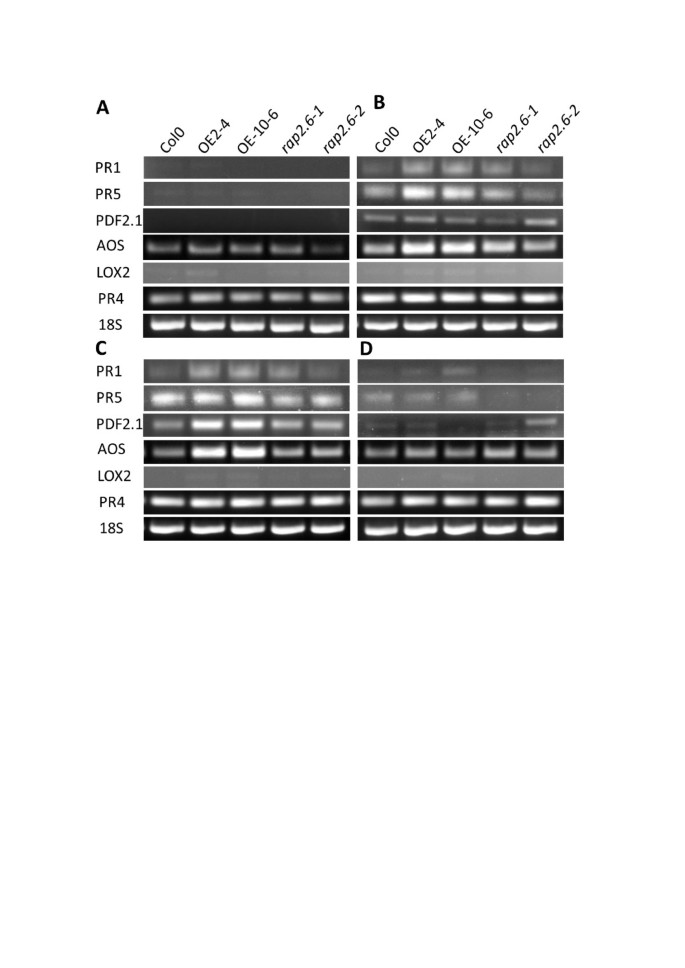
通过2次独立实验,将过表达株和突变株的根以及野生型Col感染J2幼虫。从未感染的根、1 dpi根、2 dpi根以及5 dpi合胞体中分离出RNA。乙烯(ET)诱导的标记基因表达(PR4),sa(PR1和PR5), JA / ET (Pdf2.1a)和JA (先进的和LOX2),通过RT-PCR检测(图11).未侵染的野生型与过表达系和突变体在未侵染的根中表达量相近先进的和PR4没有表达PR1那PR5那Pdf2.1a,LOX2(图11一种)。但是,SA诱导基因PR1和PR5与野生型(Col)和突变体相比,过表达系在1 dpi水平上受到轻微的诱导,这表明植物的初始反应可能受到SA的调控(图11B).同样,ja诱导基因先进的在过表达系中,1 dpi的表达明显高于PR1和PR5.另一方面,Pdf2.1a那LOX2和PR4在过度表达线或突变体中显示不高,与野生型相比(图 11b)。在2 dpi,大多数基因显示出与1 dpi中相同的表达除外Pdf2.1a这在过表达线中被诱导(图11C)。在5 dpi Syncytia中,所有测试基因的表达类似于过表达线和突变线的野生型(图 11D).与未感染的对照相比,线虫感染导致植物早期反应,表现为上调PR1那PR5那pdf1.2a那先进的,PR4.
在RAP2.6过表达系中,胼胝质沉积增强
我们进行了5,10和15 dpi Sypcytia的核糖染色,其显示过表达线在所有时间点与突变体和野生型植物相比累积了更多的核糖。代表图片如图所示 12.在过表达品系的喂养部位,胼胝质沉积更明显,数量也更多。点数的量化证实了肉眼观察的结果(图)13).与野生型相比,在所有时间点,喂养位点上的卷绕点数在喂过表达线的数量显着较高,而突变线的沉积物数量明显较低。
讨论
ERF基因优先在Syncytia中下调
在拟南芥基因芯片中包含的105个ERF基因中,有32个在合胞体中表达显著下调h . schachtii在拟南芥根中,只有7种显着上调。除了RAP2.6包括下调的基因RAP2.4(也命名风),涉及伤口反应[34.),AT3G50260(亲爱的),一种细胞死亡和PR-基因表达的正调节剂[32.].另一个下调的基因是ORA59[31.],参与JA调节的抗性反应。此外,据报道,转录因子ERF5,ERF6和某种程度较为侧面涉及拟南芥的甲壳素诱导的抗性反应[35.].ERF5和ERF6基因在合胞体中均显著下调。由此可见,ERF下调的基因包括那些对抗性相关基因表达非常重要的转录因子,支持这一观察h . schachtii下调合胞体的抗性反应。
一个值得注意的例外RAP2.3.,在根和合胞体中表达量非常高,在合胞体中表达量高于根。然而,已有研究表明,RAP2.3在酵母中起着抑制细胞死亡的作用[36.因此,它在一个Syncytia的上调将是支持Syncytia的发展的重要性。Rap2.3不是这项工作的重点,但研究其对合身发展的作用细节可能很有意思。
的表达RAP2.6
这项工作的出发点是观察到RAP2.6基因在同义性中强烈下调,如同血糖的转录组分析所确定的[16].我们已经通过QRT-PCR从受感染的根部切出并通过分析舞会来证实了这一下调RAP2.6:: GUS线。表达RAP2.6已经在以前研究过。根据Genevestigator [37.)(附加文件3.该基因特别在原生质体和根中表达。根中表达最强的是成熟区。通过qRT-PCR在花序特别是莲座叶和幼苗中发现了表达[24.].这些作者还产生了启动子::GUS融合,在7-d龄幼苗的根、花瓣、心皮和未成熟角果的瓣中显示了表达。我们的启动子::GUS系证实了该基因在幼苗和心皮中表达,但在花瓣中未发现表达,在角果瓣中表达较弱。产生这些差异的原因尚不清楚,可能与启动子片段或所使用的特定GUS株系有关。然而,我们所有的结果,包括诱导后的GUS分析P. inringae.pv番茄DC3000感染后GUS基因表达分析h . schachtii与先前的观察结果一致[16那25.那27.和qRT-PCR结果。
转录的反应RAP2.6对不同的刺激/压力
感应的RAP2.6被JA和SA证实[23.-25.].类似地,已经报道了响应于ABA和各种非生物应力的激活,例如盐,热,干旱和渗透胁迫,[23.那24.].除了这些压力,似乎RAP2.6由于我们的GUS分析后,伤害也是伤害的诱导P. inringae.PV番茄DC3000渗透,其中在24 HPI的模拟渗透时观察到一些GUS染色。
的作用RAP2.6线虫发展
包囊线虫操纵各种植物基因的表达,从而导致合胞体作为其唯一的营养来源的发展[38.].防御相关基因优先下调[16那17这可能是通过线虫产生的效应体的活性并注入合胞体来实现的。最近的几份报告支持这一假设。假定的表达h·甘氨酸拟南芥效应HG30C02增加了易感性h . schachtii可能通过干扰植物pr-prote [39.那40].此外,最近的研究表明Globodera rostochiensis产生一种效应体(SPRYSEC-19),能够抑制植物的防御反应[41.].有理由假设线虫产生各种各样的效应子(抑制子),这些效应子参与下调合胞体中的防御相关基因[42.].在Syncytia的这种下调基因中[16]例如WRKY33.([43.[, Ali等,手稿准备中)和RAP2.6.RAP2.6属于大家庭的乙烯响应因子。其中许多是对乙烯或JA刺激的转录因子。另一个例子是例如ORA59[31.],在合胞体中也下调[16].
过度的RAP2.6导致更高的抵抗力h . schachtii,支持下调的考虑RAP2.6合胞体对相容性很重要。本文的突变RAP2.6除了对合身尺寸的小效果外,没有显示出在我们的抵抗测定中的效果。的情况下P. inringae.,细菌仍然能够诱导ja依赖的途径,从而抑制SA途径,从而导致相容相互作用。的情况下h . schachtii,下调RAP2.6被线虫感染明显足以完全阻断下游的抗性反应,因此突变体没有进一步增强易感性。
对JA-、SA-和et -响应基因的分析表明,线虫可能在侵染初期诱导了植物的初始反应,从而诱导了SA-、JA-和et -依赖的植物抗性反应。这种反应在过表达系中升高,其中ja诱导基因的增强最强。这些结果表明,抗病性增强h . schachtii可能是依赖于ja的反应机制的结果。在拟南芥根中诱导PR基因后h . schachtii以前曾报告感染个案[40].已经提示囊肿线虫抑制其饲料部位依赖性抗性[44.].JA途径在水稻对根结线虫的抗性中起重要作用[45.,但目前尚不清楚感染拟南芥的拟南芥根中是否存在依赖于ja的信号h . schachtii除了包括依赖于JA-Signaling的防御相关基因,在Syncytia中下调[16].目前我们还不确定RAP2.6过表达系抗性增强是ja依赖的防御基因表达的结果,还是胼胝质沉积增强的结果(或两者都是)。但是,考虑到ja依赖的防御基因的诱导只是在非常早的时间点才被发现,所以很有可能胼胝质沉积的增强是过表达系抗性的主要原因。
胼胝质沉积被认为是植物对入侵病原体的抗性反应[46.].这种反应也越来越多地用于量化对细菌PAMPs(病原体关联分子模式)的反应,如鞭毛蛋白(见47.].胼胝质沉积也是植物对入侵线虫的最早反应之一[48.那49.].植物根细胞膜外沉积的胼胝质的降解对线虫的发育很重要[50.].然而,关于胼胝质在植物抗线虫中的作用尚不清楚,尽管可以想象胼胝质可能被用来堵塞合胞体和韧皮部细胞之间的胞间连丝[51.].例如,我们知道,抗性水稻对褐飞虱的取食反应是用胼胝质堵住筛板[52.].
结论
我们的研究结果表明,RAP2.6的过度表达导致了在Syncytia中增强了胼ins沉积物。调用在一个合胞增殖症Mata的沉积会使营养素导入同义性,并且可以抑制线虫的发展,因为这些依赖于通过同义性提供的营养素。因此,进一步探讨胼e对囊肿对囊肿的抵抗的作用更有趣。
方法
植物栽培
拟南芥(生态型哥伦比亚)在25°C长日照条件下(16 h光照/ 8 h黑暗)生长在生长室的土壤中。为了在无菌条件下生长,种子表面用10% (w/v)次氯酸钠消毒7分钟,然后用无菌水冲洗3次。种子被放置在培养皿中(9厘米),培养皿中添加了2%的蔗糖[53.]或含有3%蔗糖的MS培养基[54.].
推进剂的生产:: GUS和过度表达线
启动子区域1333 BP上游的起始密码子RAP2.6基因(At1g43160以50 ng哥伦比亚拟南芥基因组DNA为模板,采用PCR (Phusion high fidelity DNA Polymerase from Thermo Scientific)扩增。用于扩增启动子区域的引物对分别为promrap2.6 forrecori和promRAP2.6revNcoI(附加文件)4.).引物包括EcoRI和NcoI的限制性位点,用于随后克隆到双载体pMAA-Red中[33.].该质粒患者植物选择的DSRED基因。它还含有花椰菜马赛克病毒(CAMV)和TMV Omega元素的双重增强35s启动子,作为融合给GUS记者的翻译增强剂。在克隆过程中,35S启动子被启动子片段交换RAP2.6.用于施工过表达线的cDNA克隆RAP2.6(日本、日本、http://www.riken.go.jp)用作模板。使用Plusion聚合酶与RAP2.6 ForBSPHI和RAP2.6REVBAMHI引物的PCR扩增cDNA(附加文件4.).该引物包括以下克隆到二元载体pmaa-red中的BSPHI和BamHI限制性位点,这次替代GUS基因。
推出启动子:: GUS和过度表达构建体根癌土壤杆菌通过花卉DIP方法进行拟南芥植物的GV3101 [55.].在配备有DSRED荧光过滤器(AXIOSOVERT 200M; Zeiss AG,德国)的逆显微镜下选择荧光变化的种子并将土壤放在下一代。根据所述视觉观察选择纯合线,如[33.].
突变筛选
从Rap2.6的单一敲除突变体的两个独立线从拟南芥股票中心获得(GK_053G11.01,带有库存号N301757rap2.6-1和GK_053G11.02,库存号为N301758rap2.6-2) (数字 6.).这些是父母线GK-053G11的个体T3种子线。每条线的不同偏析植物的DNA被隔离[56.]和PCR分析(Gk-Lb引物和用于筛选单突变体的引物对见附加文件4.)用于鉴定纯合的敲除。
线虫感染分析
h . schachtii囊肿取自体外用芥菜(Sinapsis阿尔巴Cv炭化剂)生长在0.2浓度knop培养基上的根源,其补充有2%蔗糖[53.].将囊肿浸泡在3mm ZnCl中2作为无菌条件下J2幼虫孵化的刺激。然后将J2幼虫在无菌水中洗涤三次,并在接种前重悬于0.5%(W / V)凝胶(Duchefa,Haarlem,荷兰)。12岁拟合拟南芥根在无菌条件下接种,每株植物约50-60岁。在14 dpi下,使用逆显微镜(Axiovert 200m; Zeiss Ag,Germany),拍摄雌性Syncytia和雌性线虫的图片(纵向光学部分)。使用AxioVision Kontour工具(Zeiss AG,德国)概述了Syncytia和女性,该区域由软件确定。之后,每厘米根长度的雄性和雌性的数量在15 dpi计算。根据[57.通过比较生长在琼脂平板上的根与不同种类根生长的图片。采用单因素方差分析(P < 0.05)对线虫数量、线虫大小和合胞体进行分析。当f统计量大于f临界时,采用最小显著性检验(LSD)。
格斯分析
采用X-gluc (Biomol, Hamburg, Germany)染色,在0.1 M磷酸钠缓冲液pH 7.0, 0.1% Triton-X 100, 0.5 mM K中进行GUS活性的组织化学检测3.[Fe (CN)6., 0.5 mM K4.[Fe (CN)6.]和10mm Na2EDTA。对于Syncytia的GUS染色,PROMRAP2.6 :: GUS植物在37℃下将受感染的根(如上所述的感染)与X-Gluc过夜一起温育。在1,3,5,7,10和15 dpi中检查染色。染色的Syncytia和未感染的根在逆显微镜下拍摄(Axiovert 200m; Zeiss,Hallbergmoos,德国),具有集成相机(Axiocam MRC5; Zeiss)。
RNA孤立
植物样品立即在液氮中冷冻。根据制造商的说明,使用Nucleospin®RNA植物试剂盒(Genxpress)分离出总RNA,包括DNase消化。然而,该DNase治疗没有完全消化样品中存在的DNA。对于一些实验,因此使用Ambion®DNA-FLUE TM DNase治疗和去除试剂(Invitrogen)消化了剩余的DNA。使用Nanodrop(来自Peqlab的Nanodrop TM 2000c)量化RNA。分离的RNA立即在-80℃下储存。
逆转录酶(RT-PCR)和实时定量PCR (qRT-PCR)
使用在制造商的指示之后使用RT-PCR主混合物(USB)进行RT-PCR。对于CDNA合成载体III逆转录酶(Invitrogen)和随机引物(Oligo(DN)6)根据制造商使用指令。在ABI棱镜7300序列检测器(Applied Biosystems)上进行QRT-PCR。每种QRT-PCR样品含有12.5μl铂Sybr绿色QPCR Supermix,具有UDG和ROX(Invitrogen),2mM MgCl2,0.5μL前向和反向引物(10μm),2μLcDNA和水,制备25μl总反应体积。用于用于的底漆对RAP2.6RAP2.6qRTfor和RAP2.6qRTrev是附加文件中给出的吗4..没有cDNA模板的对照反应排除了假阳性。解离运行,以确保没有形成引物二聚体。18S基因作为内参。使用SDS v2.0序列检测软件(Applied BioSystems)计算结果。相对表达式由(1 + E)计算-ΔΔct方法(58.].
调用染色的染色
如上所述进行野生型,过表达线和敲除突变体的线虫感染。在5,10和15dpi和15dpi的同义中染色,如Millet等人所述核对沉积。[47.经过一些修改。将合胞体在3:1乙醇:醋酸溶液中固定4小时。2小时后更换固定剂,彻底固定并清除组织,以便更好地检测胼胝质。合胞体在30%乙醇中再水合3 h,水过夜。3次水洗后,用10% NaOH处理幼苗,37℃放置1小时,使组织透明。四次水洗后,在室温150 mM K中培养合胞体2HPO.4.,pH9.5和0.01%苯胺蓝(Sigma-Aldrich)2小时。立即使用逆显微镜(Axiovert 200m; Zeiss,Hallbergmoos,德国)立即观察到召唤紫外线(Axiocam MRC5; Zeiss)(激发,390nm;排放,460nm)。胼舌沉积为单位面积量化。为此,测量了个性胞苷的区域,并且计算了该区域内的点。
两感染试验
根据Tornero和Dangl进行感染测定[59.用致病性菌株做了一些修改两PV番茄DC3000。在接种之前大约24小时,为了获得细菌的草坪,将细菌接种物分布在新鲜的王的B介质板上,并在28℃下孵育24小时。然后,15毫升10 mm mgcl2加入到板上以刮擦细菌草坪并重新悬浮在猎鹰管中。在4000rpm离心10分钟后获得细菌颗粒,并在10mM MgCl中再次重悬了2.将细菌悬浮液稀释至OD6000.05,10 mm mgcl2加silwet至终浓度200 μl/L。然后将装有拟南芥植株(15 d龄幼苗)的花盆倒过来,浸入细菌悬浮液并旋转10秒。感染后,用一个透明的盖子盖住植株并移回生长室。
接种1小时后,对每个调查品系,将感染苗(仅地上部分)约50-100 mg转移到预称重的1.5 ml试管中,试管中含有200 μl 10 mM氯化镁2和200μl/ l silwet。将管子(250rpm)在2升Erlenmeyer中摇动(250rpm),在28℃下持续1小时。之后,将来自每根管的20μl加入到含有180μl10mMMgCl的96孔板中2(没有Silwet)。通过使用多通道移液管,制备从细菌悬浮液中的连续10倍稀释液,从新鲜的King'sb培养基板上发现并在28℃下孵育24小时。计数菌落的数量以确定每单位新重量的菌落形成单位(CFU)。CFU数据(日志10)为0 dpi和3 dpi,采用Tornero和Dangl给出的CFU方程[59.].
将promRAP2.6::GUS株系在短日条件下的土壤上生长,5周后用MgCl浸渍模拟莲座叶片2或渗透P. inringae。在0、3、12和24小时用X-Gluc染色,37℃下染色8小时。
微阵列数据的统计分析
来自Szakasits等人的Affymetrix Cel文件。[16使用Bioconductor Suite的包装进行分析(http://www.bioconductor.org).有关详细信息,请参阅szakasits等。[16].对于统计测试,使用诸如Siddique等人所述的经验贝叶斯方法进行了个体基因差异。[17]并且在线方法(附加文件5.).测试仅限于122个ERF组基因的105个基因的子集,这些基因可以在GeneChip上探测,其中包括之前定义的组[20.并包含了最初描述的RAP2蛋白不同的亚群。这大大提高了测试过程的统计能力,因为它减少了大量重复测试的必要校正。
参考文献
- 1.
Blaxter ML, De Ley P, Garey JR, Liu LX, Scheldeman P, Vierstraete A, Vanfleteren JR, Mackey LY, Dorris M, Frisse LM:线虫门的分子进化框架。自然。1998,392(6671):71-75。10.1038/32160。
- 2。
adagnone, Gouzy J, Aury JM, castagnone, Danchin EGJ, Deleury E, Perfus-Barbeoch L, Anthouard V, Artiguenave F, Blok VC:后生植物寄生线虫Meloidogyne incognita的基因组序列。生物技术。2008,26(8):909-915。10.1038 / nbt.1482。
- 3.
Hussey Rs,Grundler FM:植物的Nematode寄生。自由生活和植物寄生线虫的生理学和生物化学。卷。第一个版本。编辑:Perry RN,Wright DJ。CAB INTERINATIONY:CAB INTERINATIONY;1998年:213-243。
- 4.
Wyss U,Zunke U:关于寄主根系中的第二阶段青少年的行为的观察。Revue deNématologie。1986,9(2):153-165。
- 5。
Jones MGK,Payne HL:Nematode诱导的巨型细胞形成的早期阶段,在偶尔Balsamina的根源中。J Nematol。1978,10(1):70-84。
- 6。
宿主细胞对内寄生线虫攻击的反应:巨细胞和合胞体的结构和功能。引用本文10.1111 / j.1744-7348.1981.tb05122.x。
- 7。
作者简介:王志刚,男,硕士研究生,主要研究方向为拟南芥(Arabidopsis thaliana),植物寄生性线虫(Heterodera schachtii)。acta physica sinica, 2010, 32(1): 1 - 4。
- 8.
拟南芥和拟南芥的寄主-寄主相互作用模型。线虫。1992,38(4):488-493。
- 9.
王小华,王小华,王小华,等。β -1,4-葡聚糖酶在植物-线虫互作中的表达。植物学报。2001,13(10):2241-2255。
- 10.
Wieczorek K, Golecki B, Gerdes L, Heinen P, Szakasits D, Durachko DM, Cosgrove DJ, Kreil DP, Puzio PS, Bohlmann H: Expansins参与了线虫诱导的拟南芥根合胞体的形成。植物学报,2006,48(1):98-112。10.1111 / j.1365 - 313 x.2006.02856.x。
- 11.
Wieczorek K, Hofmann J, Blochl A, Szakasits D, Bohlmann H, Grundler FMW:拟南芥1,4- β -葡聚糖内酯酶参与了沙克异虫诱导的根合胞体的形成。植物学报,2008,53(2):336-351。
- 12.
ENDO B:veridodera甘氨酸易感和耐大豆根部感染的初始反应超微结构。Revue de Nematologie。1991,14(1):73-94。
- 13。
Grundler FMW,Sobczak M,Lange S:植物 - 寄生线虫杂交甘露糖胺侵袭和喂养网站诱导过程中拟南芥的防御反应。Physiol Mol Plant P. 1997,50(6):419-429。10.1006 / PMPP.1997.0100。
- 14。
利用线虫对寄生蜂寄生的影响。中国寄生虫学杂志。2004,20(3):134-141。10.1016 / j.pt.2004.01.005。
- 15.
戴维斯·埃尔,丘陵米格:线虫,豆类精致寄生虫。植物理性。2005,137(4):1182-1188。10.1104 / pp.104.054973。
- 16。
Szakasits D, Heinen P, Wieczorek K, Hofmann J, Wagner F, Kreil DP, Sykacek P, Grundler FM, Bohlmann H:拟南芥包囊线虫异源线虫(Heterodera schachtii)诱导合胞体转录组。植物学报,2009,57(5):771-784。10.1111 / j.1365 - 313 x.2008.03727.x。
- 17。
Siddique S,Endres S,Atkins JM,Szakasits D,Wieczorek K,Hofmann J,Blaukopf C,Urwin Pe,Tenhaken R,Grundler FMW:Myo-inositol氧气酶基因参与拟南芥Schachtii诱导的Syncytia的发育。新植物。2009,184(2):457-472。10.1111 / J.1469-8137.2009.02981.x。
- 18.
Okamuro JK,Caster B,Villarroel R,Van Montagu M,Jofuku KD:Apetala2的AP2域在拟南芥中定义了大量的DNA结合蛋白质。P Natl Acad Sci USA。1997,94(13):7076-7081。10.1073 / pnas.94.13.7076。
- 19.
OHME-TAKAGI M,Shinshi H:乙烯 - 诱导的DNA结合蛋白与乙烯响应元件相互作用。植物细胞。1995,7(2):173-182。
- 20。
中国水稻和拟南芥ERF基因家族的基因组分析。植物营养与肥料学报。2006,14(2):441 - 442。10.1104 / pp.105.073783。
- 21。
Chen WQ, Provart NJ, Glazebrook J, Katagiri F, Chang HS, Eulgem T, Mauch F, Luan S, Zou GZ, Whitham SA:拟南芥转录因子基因的表达谱矩阵表明它们在响应环境胁迫中的作用。植物学报。2002,14(3):559-574。10.1105 / tpc.010410。
- 22。
Fowler, Thomashow MF:拟南芥转录组分析表明,在冷适应过程中,除了CBF冷响应途径外,还有多个调节途径被激活。植物学报。2002,14(8):1675-1690。10.1105 / tpc.003483。
- 23。
关键词:拟南芥,AP2/ERF转录因子,ABA,盐胁迫,渗透胁迫基因工程学报。2010,42(1):1-12。
- 24.
Krishnaswamy S,Verma S,Rahman MH,Kav NNV:拟南芥中四种Apetala2-Family基因的功能表征(Rap2.6,Rap2.6L,DREB19和DREB26)。植物mol biol。2011,75(1-2):107-127。
- 25.
他P,Chintamanani S,Chen Zy,Zhu Lh,Kunkel BN,Alfano Jr,唐Xy,Zhou Jm:Pseudomonas Syringae III型反应器和冠状素的拟南芥COI1依赖途径的激活。工厂J. 2004,37(4):589-602。10.1111 / J.1365-313x.2003.01986.x。
- 26.
王铮,曹国根,王小龙,苗静,刘新涛,陈志林,曲丽娟,谷海平:拟南芥中coi1依赖性转录因子基因的鉴定与表达。植物学报,2008,27(1):125-135。
- 27.
陈华,潘军,赵旭,周军,蔡锐:基于报告子的拟南芥非寄主抗性突变体筛选。科学通报,2008,53(7):1027-1034。10.1007 / s11434 - 008 - 0144 - 5。
- 28.
布鲁克斯DM, Bender CL, Kunkel BN:丁香假单胞菌冠状毒素通过克服水杨酸依赖的防御增强拟南芥的毒力。植物营养与肥料学报。2005,6(6):629-639。10.1111 / j.1364-3703.2005.00311.x。
- 29.
Ehlting J,Chowrira SG,Mattheus N,Aeschliman DS,Araimura G,Bohlmann J:拟南芥的比较转录组分析钻石射击飞蛾(Plutella Xylostella)幼虫抑制应激反应,次生代谢和信号传导的签名。BMC基因组学。2008,9:154.101186 / 1471-2164-9-154。
- 30.
李志刚,李志刚。拟南芥ap2结构域转录因子的研究进展。西北农林科技大学学报(自然科学版),2005
- 31.
Pre M,Atallah M,Champion A,De Vos M,Pieterscm,Memelink J:AP2 / ERF域转录因子ORA59将茉莉酸和乙烯信号集成在植物防御中。植物理性。2008,147(3):1347-1357。10.1104 / pp.108.117523。
- 32.
Tsutsui T, Kato W, Asada Y, Sako K, Sato T, Sonoda Y, Kidokoro S, Yamaguchi-Shinozaki K, Tamaoki M, Arakawa K: DEAR1, DREB蛋白的转录抑制因子,介导拟南芥的植物防御和冰冻胁迫反应。植物学报,2009,122(6):633-643。10.1007 / s10265 - 009 - 0252 - 6。
- 33.
pMAA-Red:一种用于转基因拟南芥种子期快速视觉筛选的新型ppzp衍生载体。生物技术学报。2012,12(1):37。10.1186 / 1472-6750-12-37。
- 34.
Iwase A, Mitsuda N, Koyama T, Hiratsu K, Kojima M, Arai T, Inoue Y, Seki M, Sakakibara H, Sugimoto K: AP2/ERF转录因子WIND1控制拟南芥细胞脱分化。生物医学进展,2011,21(6):508-514。10.1016 / j.cub.2011.02.020。
- 35.
Son GH, Wan JR, Kim HJ, Nguyen XC, Chung WS, Hong JC, Stacey G:乙烯响应元件结合因子5 (ERF5)参与几丁质诱导的先天免疫应答。植物生态学报,2012,25(1):48-60。10.1094 / mpmi - 06 - 11 - 0165。
- 36.
Ogawa T,Pan L,Kawai-yamada M,Yu LH,Yamamura S,Koyama T,Kitajima S,Ohme-Takagi M,Sato F,Uchimiya H:拟南芥乙烯响应元素结合蛋白赋予Bax和非生物抗性的功能分析应激诱导的植物细胞死亡。植物理性。2005,138(3):1436-1445。10.1104 / pp.105.063586。
- 37。
Zimmermann P,Henrsch-Hoffmann M,Hennig L,Gruissem W:Genevistigator,Arabidopsis MicroArray数据库和分析工具箱。植物理性。2004,136(1):2621-2632。10.1104 / pp.104.046367。
- 38。
植物线虫对植物生长发育的影响。植物生态学报。2011,14(4):415-421。10.1016 / j.pbi.2011.03.012。
- 39。
Hamamouch N,Li C,Hewezi T,Baum TJ,Mitchum Mg,Hussey Rs,Vodkin Lo,Davis El:与植物Beta-1,3-内切葡聚糖酶的新型30c02囊肿线虫效应蛋白的相互作用可能抑制宿主促进寄生。J Exp Bot。2012,63(10):3683-3695。10.1093 / JXB / ERS058。
- 40。
李春华,李春华,李春华:拟南芥致病相关基因在线虫侵染过程中的表达。植物学报。2011,12(4):355-364。10.1111 / j.1364-3703.2010.00675.x。
- 41。
Slootweg EJ, Rehman S, Finkers-Tomczak A, Tytgat TO, van Gelderen K, Lozano-Torres JL, Roosien J, Pomp R, van Schaik C: Globodera rostochiensis的效应体sprysec19抑制cc - nb - lrr介导的植物抗病性。植物营养与肥料学报。2012,29(2):429 - 434。10.1104 / pp.112.200188。
- 42。
Hewezi T,Baum T:通过囊肿和根结线虫效应的操纵植物细胞。Mol植物微生物相互作用。2013,26(1):9-16。10.1094 / mpmi-05-12-0106-Fi。
- 43。
WRKY33是拟南芥灰霉病感染激素和代谢反应的关键转录调控因子。植物营养与肥料学报。2012,32(1):1 - 8。10.1104 / pp.111.192641。
- 44。
Wubben MJE, Jin J, Baum TJ:水杨酸(salicylic acid, SA)抑制拟南芥包囊线虫寄生,并诱导非耦合SA独立致病相关基因在根中表达。植物营养与肥料学报。2008,21(4):424-432。10.1094 / mpmi - 21 - 4 - 0424。
- 45。
王志强,王志强,王志强,等。水稻根结线虫的系统防御机制研究进展[j]。植物营养与肥料学报。2011,32(1):1 - 8。10.1104 / pp.111.177576。
- 46。
LUNA E,Vistor V,Robert J,Flors V,Mauch-Mani B,Ton J:胼sencosition:多方面的植物防御反应。莫尔植物微生物。2011,24(2):183-193。10.1094 / mpmi-07-10-0149。
- 47。
Millet Ya,Danna Ch,Clay Nk,Songnuan W,Simon Md,Werck-Reichhart D,Ausubel FM:通过微生物相关分子图案在拟南芥根系中激活先天免疫应答。植物细胞。2010年,22(3):973-990。10.1105 / TPC.109.069658。
- 48.
关键词:环线虫,根皮层细胞,胼胝质,免疫细胞化学定位acta physica sinica, 2010, 31(1): 1- 5。
- 49.
Grunder FMW,Sobczak M,Golinowski W:在植物 - 寄生线虫veridodera schachtii感染后拟南芥根细胞中的墙壁开口。EUR J植物途径。1998,104(6):545-551。10.1023 /答:1008692022279。
- 50.
基于胞间连丝的胼胝质沉积在线虫取食部位中的作用。植物营养与肥料学报,2010,23(5):549-557。10.1094 / mpmi - 23 - 5 - 0549。
- 51.
HOTH S,Stadler R,Sauer N,Hammes UZ:线虫诱导的饲养场的差分血管化。P Natl Acad Sci USA。2008,105(34):12617-12622。10.1073 / pnas.0803835105。
- 52.
陈郝PY,刘残雪,王YY, RZ,唐米,Du B,朱会,他G: Herbivore-induced胼胝质沉积在大米的筛盘:宿主抗性的一个重要机制。植物营养与肥料学报。2008,29(4):441 - 446。10.1104 / pp.107.111484。
- 53.
Sijmons PC,Grundler FMW,Vonmende N,Burrows Pr,Wyss U:Arabidopsis-Thaliana作为植物寄生线虫的新模型主机。植物J.1991,1(2):245-254。10.1111 / J.1365-313x.1991.00245.x。
- 54.
EPPLE P,APEL K,BOHLMANN H:拟南芥 - 噻吩氏素基因通过与发病机制相关蛋白不同的信号转导途径诱导。植物理性。1995,109(3):813-820。10.1104 / pp.109.3.813。
- 55.
Logemann E,Birkenbihl RP,Ulker B,Somssich IE:一种改进的制备农杆菌细胞,简化了拟南芥转化方案。植物方法。2006,2:16 .101186 / 1746-4811-2-16。
- 56.
Edwards K,Johnstone C,Thompson C:一种简单而快速地制备PCR分析的植物基因组DNA的方法。核酸RES。1991,19(6):1349 .1093 / NAR / 19.6.1349。
- 57.
JürgensenK:Untersuchungen Zum Assimilat-und Wassertransfer在Der Interaktion Zwischen Arabidopsis Thangalaa Underidera Schachtii。论文,Agrar-undernährungswissenschaftlichefakultät。基尔:克里斯蒂安 - 阿尔布雷克大学;2001年。
- 58.
Livak KJ,Schmittgen Td:使用实时定量PCR和2( - Delta Delta C)方法分析相对基因表达数据。方法。2001,25(4):402-408。10.1006 / meth.2001.1262。
- 59.
关键词:拟南芥,拟南芥,植物病原细菌,生长植物学报,2001,28(4):475-481。
确认
我们赞赏SabineDaxböck-Horvath和Martina Niese的优秀技术援助。该研究得到了奥地利科学基金(FWF)的补助金P16296-B06和P20471-B11。Muhammad Amjad Ali和Amjad Abbas得到了巴基斯坦高等教育委员会(HEC)的支持。DPK感谢维也纳科技基金(WWTF),Baxter AG,奥地利理工学院(AIT)和奥地利生物制药科技中心(ACBT)的支持。
作者信息
隶属关系
相应的作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
MAA进行了大部分的实验,并帮助撰写了手稿。AA的假单胞菌实验。DK进行了生物信息学分析。HB构思并参与了本研究的设计和协调,参与了实验分析和手稿的撰写。所有作者阅读并批准了最终的手稿。
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
阿里,m.a.,阿巴斯,A.克雷尔,D.P.等等。转录因子RAP2.6的过表达增强了合胞体的胼胝质沉积,增强了对甜菜包囊线虫的抗性heterodera schachtii.在拟南芥根。BMC植物BIOL.13,47(2013)。https://doi.org/10.1186/1471-2229-13-47
收到了:
公认:
发表:
关键词
- 水杨酸
- 茉莉酸
- 囊肿线虫
- 拟南芥根
- 过度表达线