- 研究文章
- 开放访问
- 发表:
CbCTB2是一种o -甲基转移酶,是植物毒素cercosporin生物合成和甜菜侵染的关键酶Cercospora beticola.
BMC植物生物学体积13., 文章编号:50.(2013)
抽象的
背景
Cercospora叶斑病,由真菌引起的Cercospora beticola.,是甜菜最具破坏性的叶面疾病(甜菜属)全世界。甘霉菌素是一种轻型诱导毒素,对于甜菜叶片的叶片组织和典型叶斑的发育至关重要。
结果
在这项研究中,我们表明O-甲基转移酶基因CTB2对于森孢菌素的生产和致病性至关重要C. Beticola.孤立.我们建立了一个转型系统C. Beticola.原生质体,中断CTB2,并转化δctb2菌株以及具有DSRED报告基因的野生型菌株。δ.ctb2菌株失去了它们的色素沉着和毒素测量表明δctb2菌株在森孢菌素生产中有缺陷。用野生型和δ感染甜菜ctb2DSRED菌株表明,植物感染缺失菌株严重受损。组织学分析显示CTB2- 剪发的孤立不能通过野生型气孔进入叶片组织。
结论
在一起,这些观察结果表明,森孢菌素在甜菜感染中具有双重功能:除了在组织坏死中的众所周知的作用外,糖甜菜感染的早期阶段需要毒素。
背景
Cercospora beticola.ascomycete,是糖甜菜的经济上最重要的叶酸病原体(甜菜属).典型的症状C. Beticola.侵染包括从叶的正面延伸到叶的背面的棕色叶斑;从春天到夏天,随着疾病的发展,斑点的数量增加,最后合并到整个叶子变成棕色和萎缩。叶斑病在经济上是至关重要的,因为叶片的破坏限制了光合作用和降低产量[1].
C. Beticola.通过Macroconidia,无性孢子繁殖,在田野上涂上植物碎片,并在春天通过风和雨水蔓延2].C. Beticola.是一种具有生物营养和坏死营养阶段的半生物营养真菌。接种后约3-4天,真菌通过开放的气孔进入寄主[3.];渗透后,真菌菌丝在细胞间生长并以无症状的方式殖民化叶实质组织[4.那5.].最终的病症,病症的特征在于形成坏死病变,导致叶斑是这种疾病的典型标志。与其他叶片病原体不同,这些病原体从针脚病变坏死并向外扩展,所产生的病变C. Beticola.包括在直径多毫米的区域内细胞几乎同时塌陷。坏死组织成为分生孢子和孢子发育的部位。虽然病变在最初组织塌陷后会扩大,但叶表面坏死面积的增加主要是由于病变数量的增加。田间条件下一个孢子形成周期约为12天[1].
这尾孢属家庭有许多成员有不同的主持人,包括烟草,大豆,咖啡,大米,玉米和花生[6.].尾孢属菌种产生蜡孢素,这是一种光激活毒素,暴露在光照下会产生活性氧。菌素的生物合成途径C. Nicotianae.已经被证明包括八个基因,CTB1-CTB8.CTB1,聚酮合成酶,凝结和脱羧剂前体丙二酰基和乙酰辅酶组成聚酮。然后催化分子的Claisen缩合和环闭合。下一步是所执行的氧化和水化反应CTB3,O-甲基转移酶和依赖于依赖的单氧化酶,CTB5,一种FAD / FMN依赖性氧化还原酶,CTB6,依赖于NADPH-依赖氧化还原酶,和CTB7,另一个FAD / FMN依赖性氧化还原酶。随后的甲基化步骤进行CTB2,也是o -甲基转移酶CTB3.由此产生的聚酮乙烯二聚,然后通过CTB4是一位主要的促进者超家族运输车。该出口机制导致自身免疫C. Beticola.对抗自己的毒素。菌素的表达受锌指转录因子的调控CTB8.
以前的研究表明,个人失败CTB1那CTB2那CTB3, 或者CTB8导致整个基因簇的转录抑制,并防止孢子蛋白产生C. Nicotianae.[7.那8.].目前的研究旨在确定森孢菌素是否生产C. Beticola.可以通过单一的敲除突变减少,并鉴定野生型和毒素缺乏菌株的感染行为的差异。
结果
扰乱CTB2在真菌孤立的Ahlburg和Ferrara
使用来自的同源序列设计引物C. Nicotianae.(登录号码DQ991505)。CTB2PCR扩增费拉拉分离株;测序结果显示CBCTB2.基因与编码区相同91.6%CnCTB2基因。的氨基酸序列CBCTB2.96%的蛋白质是相同的吗C. Nicotianae。
基因在两个分离的C. Beticola.,费拉拉和哈尔堡。转型导致44个法拉拉和23例Ahlburg转化体。对于两种分离物,选择两个独立的转化体,被破坏CTB2基因(图1).在法拉拉孤立,CTB2基因中断(δctb2)随后被称为Fδ.CTB2-1和Fδ.CTB2-2因此,在Ahlburg孤立一种δ.CTB2-1和一种δ.CTB2-2.选择来自每种野生类型的异位转化体,称为FEC(Ferrara)和AEC(Ahlburg)。
扰乱CTB2基因C. Beticola.隔离Ahlburg和Ferrara。一种800 bp 5'和3.'碎片CTB2用底漆对1/2和3/4分开扩增,通过重叠区域与潮霉素盒融合,并用嵌套引物扩增(包括不是我和APA在克隆到pGEMT之前。B.南方用潮霉素探测器的南方爆发的例子,从左到右,野生型法拉拉(无乐队),法拉拉异位,费拉拉ctb2基因中断菌株2-1和2 - 2,野生型Ahlburg,Ahlburgctb2破坏应变2-1,Ahlburg异位,Ahlburgctb2破坏应变2 - 2(宽度为3.7 kb,黑色箭头)。采用Dig VII标记物(Roche)作为DNA大小阶梯。C使用CTB2内引物的确认PCR位于整体基因座(INTF和INT)附近,从左到右,野生型Ahlburg(带0.3 kB的带),费拉拉CBT2.破坏应变2-1,Ahlburg破坏菌株2-1(乐队在2 kB)Fδ.CTB2-2和一种δ.CTB2-2产生与相应破坏剂的PCR带(数据未显示)。
Ahlburg野生型菌株和缺失突变体一种δ.CTB2-1选用DsRed进行转化,每个菌株都有20个以上的DsRed荧光转化子。通过转化获得DsRed报告菌株C. Beticola.用pii99dsred [9.],用x线性化何我。CBT2.用DsRed转化的缺失突变体呈粉红色,因为在白色菌丝中可以看到红色蛋白。一株表达DsRed的野生型菌株(wt Ahlburg- r)一种δ.CTB2-1表达DSRED(一种δ.CTB2-1-R.),以作进一步分析。转化体的生长率和分生率未发生变化。
δ.ctb2转化子在色素沉着和毒素产生中减少
基因破坏菌株失去了特征暗色素沉着,出现了白色,而异位和野生型菌落是灰色的。其他性能,如结合和生长速率保持不变(数据未显示)。
Ahlburg分离株毒素含量高于费拉拉分离株(图)2),这可以解释为什么Ahlburg是更毒性的孤立。δ.ctb2来自Ahlburg和Ferrara分离物的菌株没有产生醋孢菌素,而异位法格拉的毒素含量与野生型分离物相同(图2).Ahlburg异位转化体产生了类似的Cercosporin作为野生型(未显示的数据)。
什么时候在体外- 用PDA板水溶液处理培养的糖甜菜,在野生型提取物中浸入一天后浸渍的植物,而用水控制或δ处理植物ctb2提取物保持健康和绿色(图3.).将这些实验重复三次,每根板提取物处理五种植物。因此,来自基因破坏菌株的培养提取物缺乏损害植物组织所需的关键组分。
CTB2对致病性很重要C. Beticola.
用阿尔堡和费拉拉野生型感染3个月大的甜菜及相应的干扰物一种δ.CTB2-1和一种δ.CTB2-2也Fδ.CTB2-1和Fδ.CTB2-2菌株表明δctb2两种分离株的菌株在叶子上没有病变,并且整个植物在感染后三周出现健康。由每个野生类型的两个破坏剂引起的症状难以区分(数据未显示)。Ahlburg和Ferrara的野生型菌株感染植物并引起病变。Ahlburg的分离物被证明是高度侵略性的,导致严重的叶斑病损伤与较低的毒性法拉拉分离物相比,导致轻微病变(图4.).由法拉拉和Ahlburg的异位转化体引起的症状与相应的野生型菌株的症状无法区分,表明这一点CTB2对致病性至关重要C. Beticola.(数字4.).
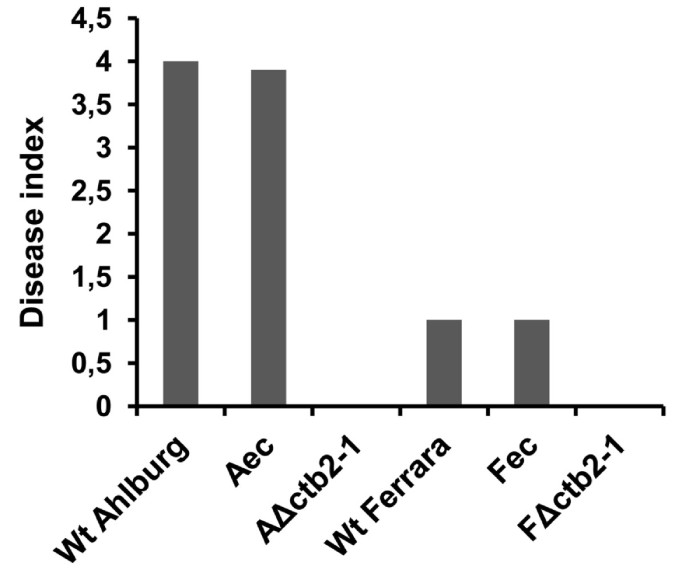
通过评估患病叶片表面的百分比进行疾病评级[10.].感染后21天的疾病表明,感染了基因破坏菌株的植物是无症状的,而感染的植物感染Ahlburg野生型菌株的疾病指数为4,而Ferrara野生型和异位型菌株的疾病指数为1(图5.).
偶而在一些感染了Ahlburg Δ的叶片上观察到单个病变ctb2接种后24天菌株。两种不同的接种技术的应用表明罕见病变的外观取决于接种物的质量。一种粗糙的菌丝菌丝体,如描述的[11.]有利于病变的出现。然而,如材料和方法部分中所述,通过过滤和筛分制备细孢子悬浮液,仅在24天后的非常少的坏死斑点。
δ.ctb2对寄主叶的渗透是否受损
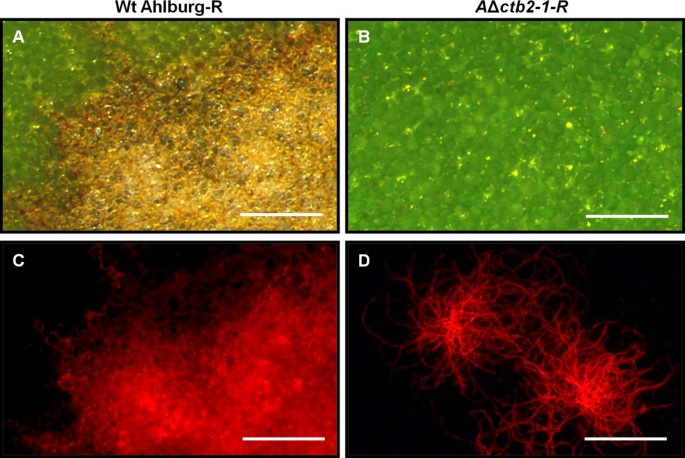
进行组织学分析以评估Ahlburg野生型和Ahlburgδ的感染过程CTB2-1在细胞水平的应变。在Ahlburg野生型和Ahlburg干扰物中DsRed荧光报告基因的组成性表达促进了真菌菌丝的显微镜检测。C. Beticola.通过荧光显微镜监测的感染在被DSRED野生型菌株引起的坏死斑点中显示出强烈的DSRED荧光(图6.a,c)。δ.CTB2-1DSRED菌株不会引起叶斑,荧光限制在叶面上的菌丝(图6.B, D)。
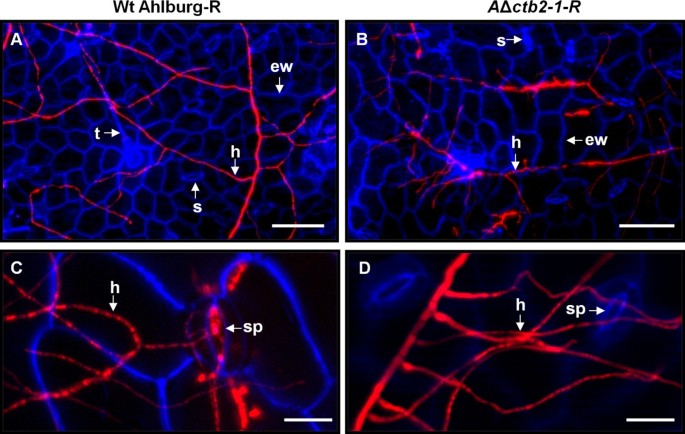
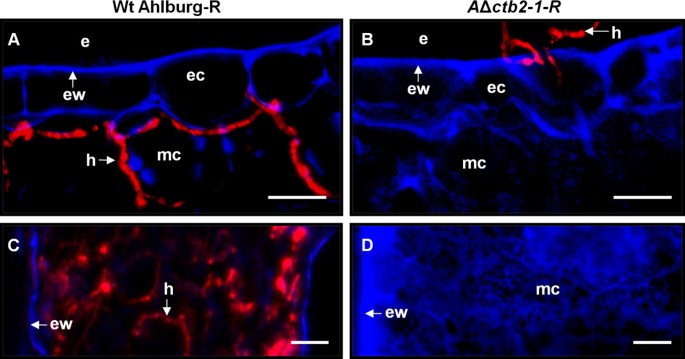
Adaxial和Beaxial叶片表面的荧光显微镜显示出Ahlburg野生型的萌发和悬垂扩散(图7.a)和基因破坏菌株(图7.B).野生型菌株在侵染后4天开始通过气孔侵染(图4)7.c)虽然基因破坏菌株没有渗透宿主组织(图7.D)。感染阶段的叶片的横截面显示,野生型从渗透部位进展(图8.a)并且在感染后14天开始造成坏死。基因破坏应变在表皮层停止(图8.b)。野生型在感染后21天左右涂抹在叶片内(图8.c),当大的坏死病变在表面上可见时。基因破坏菌株已经停止在此时生长,并且未能在叶片内蔓延(图8.D)。
Ahlburg野生型Dsred和Ahlburg侵犯甜菜叶子ctb2破坏应变2-1-安全域。一种接种后21天叶片横切面荧光显微镜显示Ahlburg野生型DsRed菌丝侵入叶肉细胞。B.与基因破坏菌株接种后21天的叶横截面未显示出侵袭骨膜形层。菌丝并不紧密地附着在表面上并容易脱臼。C和D.接种后21 d为侵染高峰,野生型叶片侵染症状明显。C横截面通过叶片感染野生型的叶斑病病变。许多菌丝殖民整理组织。植物细胞壁的蓝色自发荧光的丧失表明宿主组织的降解。D.基因破坏菌株侵染植株叶片的横切面显示植株细胞壁的蓝色荧光增强,但菌丝没有生长。规模的酒吧:一种和B.=100μm,C和D.=20μm。缩写:E细胞外空间,EC表皮细胞,EW表皮细胞壁,H悬鼠,MC叶片细胞。
讨论
尽管育种和杀菌剂介导的植物保护进展,但了解之间的分子相互作用C. Beticola.和甜菜刚刚开始。以前的研究C. Nicotianae.表明,涉及毒素生物合成的几种基因的破坏残疾酸孢菌素产生并使真菌是非血糖的[12.].在目前的研究中,我们表明O-甲基转移酶基因CTB2对于森孢菌素生物合成和真菌毒力至关重要C. beticola。敲门突变体(图1)未能产生菌素(图2)在温室生长的糖甜菜植物上是不管的在体外.突变菌株失去了特征的深色色素沉着。
δ的灰色色素沉着的损失ctb2菌株表明,对菌素途径的干扰可能影响真菌色素的形成。菌丝色素如黑色素或双卡维林和镰孢红素镰刀菌素fujikuroi[13.那14.通过类似于Cercosporin生物合成基因簇的聚酮合成酶基因簇合成。分析δ.ctb2突变体c . nicotianea透露还表明了成绩单CnCTB1、CnCTB3 CnCTB4和CnCTB8完全下调是什么时候CnCTB2中断(7.].除了Cercosporin生物合成中的参与旁,CBCTB2反馈抑制靶向的CBCTB2蛋白或蛋白质可参与其他真菌颜料的生物合成。除了森孢菌素生物合成的重要作用,淘汰o-甲基转移酶基因CTB2因此可能有多效性的影响C. Beticola..对于δ还描述了真菌菌丝体的变色CTB1和δ.ctb3突变体C. Nicotianae.并且通过缺血的寒霉菌素的缺失解释[15.].
Weiland等人[16.进行了定点淘汰实验CBCTB1.在C. Beticola.,参与菌素生物合成的聚酮合酶。两个分析Δctb1突变体没有产生醋孢菌素,但突变体能够造成比野生型更小且较少的病变。我们观察到δctb2菌株也很少引起坏死斑点,但这种斑点的频率受接种物质量的影响。感染技术越符合自然感染条件;坏死的数量越低。
植物致病性真菌必须克服细胞壁以进入宿主植物,因此制定了非常有效和复杂的机制,以违反该障碍。真菌渗透模式取决于他们的生活方式;C. Beticola.已被证明在没有特异性感染结构的情况下进入宿主叶,通过气孔侵入口腔,然后进行细胞间生长[4.].
我们通过荧光显微镜对报告菌株的观察显示,Ahlburg Δctb2菌株无法穿透宿主组织并造成感染。虽然突变株在表面发芽良好,生长数天,在某些情况下能够定位气孔,但在叶片内无法生长或引起疾病症状,这表明在侵染早期,cercosporin是组织定植所必需的C. Beticola..Cercosporin参与在早期感染阶段C. Beticola.是意外的。早期的研究表明,纯化的森孢菌素导致甜菜叶上的坏死斑点,其尺寸和超微结构组合物相似,对病变引起的病变C. Beticola.[5.那17.].因此,假设Cercosporin的主要贡献是引起许多植物孢子菌疾病的广泛枯萎症状。通过气孔和定植渗透后,膜损伤的毒素应允许细胞分解和营养素泄漏进行真菌生长和孢子素[6.].
失败的CTB2- 缩进和殖民化叶组织的菌株提高了关于醋孢菌素在感染的生物营养阶段的作用的问题。超过17.000多甜菜CDNA的转录组分析表明,早期到中期的防御反应转录激活C. Beticola.在多基因抗性或易感基因型中抑制感染[1].C. Beticola.显然开发了一种抑制由病原体相关分子模式(PAMP)引发的免疫力的策略。在...的情况下C. Beticola.- 已详细描述 - 抑制甜菜相互作用,抑制苯丙氨酸 - 铵裂解酶和肉桂酸酯-4-羟基化酶[11.].抑制苯丙氨酸氨解酶基因的表达C. Beticola.在感染早期产生植物激素脱落酸[18.].
有趣的是,推测尾蚴素可能参与了植物防御反应的抑制。作为这个模型的前提条件,毒素必须在感染的早期就存在,并且容易被植物细胞获取。由于菌素的生物合成是由光调节的[19.,则可以假设萌发的孢子和生长的菌丝C. Beticola.已经在表皮表面上产生毒素。此外,Cercosporin是一种脂质可溶性分子,可快速渗透到宿主细胞膜中[6.]并且可以与受体或转运蛋白如受体或转运物等膜嵌入分子相互作用。然而,需要额外的实验表明森孢菌素在抑制植物防御机制中的直接作用。
结论
我们扰乱了这一点CBCTB2.用于编码O-甲基转移酶的基因,从而消除了毒素的产生。所得突变体不仅不能产生毒素,而且未能感染甜菜叶。森孢菌素缺乏突变体在叶子表面上生长,但无法入侵和殖民甜菜叶。以前,假设森孢菌素在初始渗透和殖民化后参与组织损伤。在这里,我们表明Cercosporin也在病原体的初始生物营养期中起作用。最近的结果表明Cercospora beticola.压制植物防御途径的转录激活。我们假设Cercosporin对于抑制这些防御反应是重要的,这些防御反应是由病原体相关的分子模式引发的。因此,森孢菌素使病原体能够成功地感染其宿主植物。
方法
引物和质粒
扩增杂交霉素盒所需引物YGF(5'-GTTGGCGACCTCGTATTGG)和HyR (3'-cttaccacctgctcatcacct)。引物CTB2-1F(5'-cgctagattaggtgtgtgtgtgga),ctb2-2r(5'-agatgccgaccgaacaagagctgtccccc.GCAATCTTTTTCTTCCTGCT),CTB2-3F(5'-caatgctacatcacccacctcgctcccccCGTTTCAAGTCCAAGATCTG),CTB2-4R(5'-cttttcgtccctcgtatctc),ctb2-5f(5'-aacctccttgcgtattc)和ctb2-6r(5'-ATGTTTCCGAGTTCTTGATGTG)CTB2删除(下划线的杂霉素重叠序列)。最后,引物CTB2-INT-F(5'-AGCATAGGAAGAAAGATTGC)和CTB2-int-R (5'-CAGATCTTGGACTTGGAAACG)作为对照引物CTB2基因。使用来自的同源序列设计引物C. Nicotianae.(登录号码DQ991505)。本研究中使用的质粒是PGEMT(Promega,Mannheim,德国),用于PCR片段的Ta克隆,PII90DRED [9.]和pgemthyg(德国汉堡大学Le Thi Thu Giang)。
真菌和细菌菌株
大肠杆菌菌株XL1-Blue(Stratagene,La Jolla,CA,USA)用于分子克隆。这C. Beticola.孤立的艾尔堡和法拉拉被德国艾因贝克·埃班堡(Einbeck)提供。众所周知,Ahlburg是更具毒性的分离物(未发表的结果)。
媒体
C. Beticola.在完全液体培养基中培养[20.]用于DNA提取,并在完整的介质琼脂平板上进行维护。分别在具有50μg/ ml潮霉素B(Duchefa,荷兰)和100μg/ ml遗传蛋白(Invitrogen,Germany)的选择性压力下生长转化体。在环境光下在马铃薯葡萄糖琼脂(PH 5.6)上进行毒素生产。用200mg / ml氨苄青霉素(Sigma Aldrich,Munich,Manich,德国),在Luria-Bertani液体培养基或Luria-Bertani板上培养细菌。MS媒介在体外甜菜的培养方法如下所述[21.].
融合PCR.
CTB2通过使用融合PCR的双同源重组破坏,产生由1219bp 3组成的构建体'部分基因,耐潮霉素盒,796-bp 5'基因的一部分(图1一种)。Hygromycin Cassette从pgemthyg释放SmaI,用CTB2- 1f、CTB2- 2r、CTB2- 3f、CTB2- 4r引物从基因组DNA中扩增CTB2的5´-和3´-部分。融合PCR中,将上片段、潮霉素盒和下片段等数量融合,用CTB2-nestF和CTB2-nestR引物扩增3.7 kb片段。最终的PCR产物被克隆到pGEMT中并释放不是我和APA我。
真菌转化
如前所述制备原生质体[22.[含有聚乙二醇介导的转化,如前所述进行[23.].如前所述制备缓冲液[24.].用50μg/ ml进行抗生素潮霉素B(Duchefa,Harlem,荷兰)。使用遗传素(Duchefa,Harlem,荷兰)选择以100μg/ ml的终浓度进行耐旋转霉素抗性转化体的变形。
南方斑点
用野生型和基因破坏菌株的基因组DNA过夜消化过夜BspHI(新英格兰Biolabs,法兰克福,德国)。在80-100V的0.8%琼脂糖凝胶上分离消化的DNA。通过毛细血管印迹转移到杂交NX膜(Amersham Biosciences,UK)中转移到杂志中,然后用Digoxygenin标记的(Roche,Mannheim,德国)DNA潮霉素探针。根据制造商的手册(Roche),遵循检测和可视化程序。
毒素提取
用Chung描述用5N KOH萃取Cercosporin [25.].用pH 5.6的PDA制备板,均匀接种C. Beticola.分生孢子,在日光和室温条件下维持两周。将琼脂切成小方块,在玻璃烧杯中浸泡一夜。用家用小筛子筛去琼脂块。ΔCTB2在从PDA平板中培养两周的PDA平板中,测量Ahlburg和Ferrara的菌株以及野生型菌株和异位转化体在环境光中培养两周。从三个独立提取重复每次测量三次。从Planta GmbH获得5mm Cercosporin标准。在480nm处,在光谱仪(UltOPC 3000,Pharmacia Biotech)中测量吸光度,并且从分子量为534.51g / mol(sigma)中计算森孢菌素含量。为了在植物上进行测试,用水直接从PDA板中萃取CercoSporin,其工作以及用KOH提取。将植物浸入含有约750μm的植物孢菌素(分离Ahlburg)和320μm(分离法拉拉)的板萃取物中。
植物接种
甜菜甜菜植物在18℃下在生长室中生长,用16小时的光。为了生产用于植物接种的分类,PDA平板(pH5.6)与菌丝体捣碎在受损搅拌器中,并在白天孵育两周。为每种植物接种大致有一个板被感染。然后小心地用无菌水和刮刀仔细地刮掉表面。将刮擦的材料通过小家用筛,一层麦芽糖,200μmWilson筛过滤,完全取出所有琼脂采集。然后在福克斯 - 罗森特血细胞计数表中计数分类。通过彻底地施加50毫升2.0 * 10的Conidia悬浮液,接种了12周龄甜菜植物4.Conidia / ml与喷雾瓶上的轴向和轴向叶片表面。使用50mL一种植物的叶子被充分覆盖。每种真菌菌株接种二十五株植物。植物覆盖有箔的帐篷10天并暴露于18小时的光(2.0 * 104.勒克斯,400-600 nm = 4.0-6.0 * 103.K)在24°C的温度下,晚上18°C。
用于测试种植植物的毒素在体外, 1周在体外- 培养植物被浸入无细胞的平板提取物或水控制中。
显微镜
与野生型和Δctb2用MZ FL III显微镜(Leica Microsystems,Heerbrugg,Switzerland)研究表达DSRED的菌株和菌株。显微镜配有Leica 1.0×目镜和Leica DFC 500荧光相机。为了在白光条件下可视化植物坏,使用了外部卤素灯KL 1500电子(Schott,Mainz,德国)的光线。用Leica DSRED激发过滤器在546/12nm处检测DSRED荧光,并且在560nm处的长通滤光器。Las Leica软件(版本2.7.1)用于图像采集和游行。
用Zeiss Axio Imager.Z1显微镜进行高分辨率荧光显微镜,配备Zeiss Abotome和Axiocammrm CCD摄像头。紫外线(紫外线)灯留100盏灯作为光源。DSRED在538至562nm的范围内激发,并在570至640nm范围内检测到。在335至383nm的范围内激发植物胎面,并在420至470nm处检测其蓝色自发荧光。通过Zeiss AxioVision软件(版本4.8.1)完成图像处理,包括独立检测到的DSRED和植物自发荧光以及Z叠层的最大强度投影(MIP)的产生。所有呈现的图像都是相应z堆栈的MIPS。
疾病评级
疾病评级是根据一种将叶斑病的数量与疾病严重程度联系起来的方法进行的[10.].单叶根据以下疾病指数评定:没有坏死区域(叶斑)= 0,坏死区域<1%= 1,坏死区域2-5%= 2,坏死区域6-10%= 3,坏死区域11-20%= 4,坏死区域21-40%= 5,坏死区域41-60%= 6,坏死区域61-80%= 7,坏死区域81-100%= 8,叶死= 9。
参考文献
- 1。
Weltmeier F,MäserA,Menze A,Hennig S,Schad M,Breuer F,Schulz B,Holtschulte B,Nehls R,Stahl DJ:甜菜基因型中的转录性概况揭示了防御反应的时间和强度Cercospora beticola.感染。Mol植物微生物相互作用。2011,24(7):758-772。10.1094 / mpmi-08-10-0189。
- 2。
Weiland J,Koch G:甜菜叶斑病(Cercospora beticola.SACC。)。莫尔植物途径。2004,5(3):157-166。10.1111 / J.1364-3703.2004.00218.X。
- 3。
甜菜白叶枯霉气孔的向性。植物病理学杂志。1977,67:358-362。
- 4.
FEINDT F,Mendgen K,Heitefuss R:Feinstuktur UnterschiedLicher Zellwandreaktionen IM BlattParenchynAnfälligerund抵抗者吕根(甜菜属L.)Nach Infektion DurchCercospora beticola.Sacc。植物病理学杂志,1998,101:248-264。10.1111 / j.1439-0434.1981.tb03346.x。
- 5。
Steinkamp MP,Martin SS,Hoefert LL,Ruppel例如:由此产生的病变超微结构Cercospora beticola.叶子的甜菜属.植物生理学。1979,15(1):13-16。10.1016 / 0048 - 4059(79) 90035 - 3。IN13-IN19, 17-26
- 6。
涂抹ME, Ehrenshaft M:光活化尾孢属毒素森孢菌素:对植物疾病和基本生物学的贡献。Annu Rev phytopathol。2000,38:461-490。10.1146 / annurev.phyto.38.1.461。
- 7。
Chen HQ,Lee Mh,Daub Me,Chung Kr:植物孢菌素生物合成基因集群的分子分析Cercospora Nicotianae..mol microbiol。2007,64(3):755-770。10.1111 / J.1365-2958.2007.05689.x。
- 8。
Herrero S,Amnuaykanjanasin A,Daub M:在植物疗法真菌中鉴别鉴别的基因Cercospora Nicotianae.在抗痘菌毒素菌株和敏感菌株之间。微生物微生物学杂志。2007,34(4):436 - 437。10.1111 / j.1574-6968.2007.00903.x。
- 9。
Namiki F,Matsunaga M,Okuda M,Inoue I,Nishi K,Fujita Y,Tsuge T:精氨酸生物合成基因的突变导致降低致病性Fusarium oxysporum f。sp melonis..植物营养与肥料学报,2001,14(4):580-584。10.1094 / MPMI.2001.14.4.580。
- 10。
罗西V,巴蒂拉尼P:强度的评估尾孢属甜菜疾病。植物病理学。1989,124(1-4):63-66。
- 11.
关键词:甜菜,苯丙氨酸裂解酶,真菌病原,抑制Cercospora beticola.是在基因的核心启动子处介导的。植物mol biol。2004,55(6):835-852。
- 12.
Chen HQ,Lee Mh,Chung Kr:编码植物孢子毒素毒素在真菌中的毒素毒素毒素的推定氧化酶所需的三种基因的功能表征Cercospora Nicotianae..一般微生物学会。2007,153:2781-2790。
- 13。
Wiemann P, Willmann A, Straeten M, Kleigrewe K, Beyer M, Humpf H-U, Tudzynski B:红色素bikaverin的生物合成镰刀菌素fujikuroi:基因及其功能和调控。微生物学报,2009,32(4):341 - 346。10.1111 / j.1365-2958.2009.06695.x。
- 14。
Studt L, Wiemann P, Kleigrewe K, Humpf H-U, Tudzynski B:镰刀菌素的生物合成与色素沉着有关镰刀菌素fujikuroi杠杆。申请环境微生物。2012,78(12):4468-4480。10.1128 / aem.00823-12。
- 15.
chquer M, Dekkers KL, Chen H-Q, Cao L, Ueng PP, Daub ME, Chung K-R:编码真菌聚酮合酶的CTB1基因对菌素的生物合成和真菌毒力是必需的Cercospora Nicotianae..Mol植物微生物相互作用。2005,18(5):468-476。10.1094 / mpmi-18-0468。
- 16。
Weiland JJ,Chung Kr,Suttle JC:Cercosporin在毒力中的作用尾孢属。植物主持人。糖孢子叶甜菜和相关物种的植物孢菌。编辑:Lartey RT,Weiland JJ,Panella L,Crous PW,Windels Ce。圣保罗,美国:美国植物病理学会;2010年。
- 17。
研究结果表明:黄芩叶片病变的超微结构甜菜属由森孢菌素,来自毒素Cercospora beticola..植物病理学。1981,71(12):1272-1281。
- 18。
Schmidt K,Pflugmacher M,Klages S,Maser A,Mock A,Stahl DJ:在真菌感染部位的激素脱离酸(ABA)的积累Cercospora beticola.支持ABA在甜菜中作为植物防御阻遏物的作用。acta botanica sinica(云南植物学报),2008,29(5):641 - 643。10.1111 / j.1364-3703.2008.00491.x。
- 19。
Ehrenshaft M,Upchurch RG:Cercospora Kikuchii的轻增强CDNA分离。申请环境微生物。1991,57:2671-2676。
- 20。
哈里斯S:发芽中的形态发生Fusarium Graminearum.Macroconidia。体力学。2005,97(4):880-887。10.3852 / mycologia.97.4.880。
- 21。
Lindsey K,Gallois P:Sugarbeet的转型(甜菜属) 经过农杆菌肿瘤术.实验植物学。1990,41(5):529-536。10.1093 / jxb / 41.5.529。
- 22。
Jenczmionka NJ,Maier FJ,LöschAP,Schäferw:交配,共分析和致病性Fusarium Graminearum.,小麦头部枯萎病的主要因果剂,由地图激酶调节gpmk1.Curr Genet。2003,43(2):87-95。
- 23。
Proctor R,Hohn TM,McCormick SP:降低了毒力吉伯拉扎伊由Trichothecene毒素生物合成基因破坏引起的。Mol植物微生物相互作用。1995,8(4):593-601。10.1094 / mpmi-8-0593。
- 24。
Chung Kr,Ehrenshaft M,Daub Me:植物孢菌素抗性蛋白质的功能表达和细胞定位与GFP融合Cercospora Nicotianae..Curr Genet。2002,41(3):159-167。10.1007 / S00294-002-0289-8。
- 25。
Chung Kr:钙/钙调素信号传导在Cercosporin毒素生物合成中的参与Cercospora Nicotianae..申请环境微生物。2003,69(2):1187-1196。10.1128 / AEM.69.2.1187-1196.2003。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
CS进行了分子遗传学研究和分析测定以及起草稿件。MJB参与组织学和显微镜,以及起草手稿。CK进行了真菌转化。JB,DS和WS协调了实验工作,参与了数据的分析和解释以及起草和修改了手稿。所有作者阅读并认可的终稿。
作者的原始提交的图像文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Staerkel,C.,Boenisch,M.J.,Kröger,C.et al。CbCTB2是一种o -甲基转移酶,是植物毒素cercosporin生物合成和甜菜侵染的关键酶Cercospora beticola..BMC植物BIOL.13,50(2013)。https://doi.org/10.1186/1471-2229-13-50
已收到:
公认:
发表:
关键字
- 甜菜
- 野生型应变
- 叶子点
- 坏死地区
- 土豆葡萄糖琼脂板材