摘要
背景
哺乳动物BLM解旋酶参与DNA复制、DNA修复和同源重组(HR)。这些DNA交易与细胞分裂密切相关,对维持基因组的稳定很重要。然而,与哺乳动物不同,高等植物的细胞分裂主要局限于分生组织,因此在分生组织中基因组的维持是至关重要的。对应的BLM在拟南芥(AtRecQ4A)已被确认,其在HR和DNA损伤反应中的作用已被证实。然而,的功能AtRecQ4A在分生组织复制期间的应激还没有很好地阐明。
结果
我们分离了BLM对应的基因OsRecQl4用逆向遗传学的方法分析了其功能。Osrecql4与野生型(WT)相比,突变体植株表现出对DNA损伤剂的超敏感,HR发生频率增加。我们通过对DNA聚合酶的抑制作用,进一步分析了s期进展抑制剂蚜虫素(aphidicolin)对根分生组织基因组稳定性的影响osrecql4突变株和相应的WT株。结果表明:a)彗星试验显示突变体植株的DNA双链断裂(dsb), b) TUNEL试验显示突变体植株根分生组织的DNA断裂增强,c)重组报告显示突变体愈伤组织的HR频率增强,d)根尖的氟化丙啶(PI)染色显示突变体植株分生组织细胞死亡发生率增加。
结论
这些结果表明,蚜虫素敏感的表型osrecql4突变的部分原因是诱导dsb和细胞死亡,而OsRecQl4在水稻分生组织中扮演着重要的看守者角色,在DNA复制胁迫期间保持基因组的稳定。
背景
DNA损伤被认为不仅是由外源性基因毒性应激(如紫外线和电离辐射)诱导的,而且还由内在内源性应激(如DNA复制错误和与细胞代谢相关的氧化应激)诱导的。与动物不同,植物无法逃脱外源基因毒性胁迫。此外,在植物中,DNA复制位点主要局限于分生组织,种系的分化不是预先确定的;因此,植物需要一个高效而灵活的基因组维持系统。然而,对于在DNA复制压力下维持基因组稳定性的机制知之甚少。
RecQ解旋酶是atp依赖性解旋酶家族成员,在真核细胞DNA修复过程中维持基因组稳定发挥重要作用[1,2], DNA复制[3.,4],端粒维持[5],以及同源重组(HR)过程[6,7].酵母只有一个RecQ基因,Sgs1但哺乳动物和植物有多个RecQ基因,人类有5个,拟南芥有7个[8].有趣的是,RecQ蛋白在人类中有重叠和不同的作用[6,9].例如,在BLM,WRN而且HsRecQ4分别见于Bloom综合征、Werner综合征和rothmundd - thomson综合征[10- - - - - -12].患有这些综合征的患者表现出基因组不稳定,易患癌症,他们的细胞对dna破坏剂高度敏感。在DNA复制和端粒维持过程中,BLM的作用与WRN的作用重叠。然而,BLM在DSB修复的初始步骤中促进外切酶1介导的DNA切除,而其他RecQ解旋酶不促进这一步骤[13,14].引人注目的是,患有BLM缺陷显示姐妹染色单体交换(SCE)频率增强[15],表明BLM在DNA复制过程中抑制了HR。此外,BLM与复制蛋白A (RPA)和拓扑异构酶III相互作用[16,17].最近发现BLM在从DNA复制停滞中恢复中起着作用[18,19].因此,BLM很可能是一种多功能蛋白,参与了哺乳动物基因组维持的多个方面。鉴于已知HR和DNA复制之间的关联,迄今为止许多研究都集中在DNA复制的维持上[20.- - - - - -22].
两个BLM同源染色体,AtRecQ4A而且AtRecQ4B,已被隔离在拟南芥并利用突变植物分析其功能[23,24].atrecq4A与野生型(WT)相比,突变体在正常生长条件下表现出更高的HR频率和对DNA损伤剂的超敏感性。相比之下,atrecq4B与WT植物相比,突变体具有较低的HR频率,并且不表现出对dna损伤剂的敏感性,尽管这两个recq4具有高度的一致性[24].最近,有报道称AtRecQ4A在高效的合成依赖链退火(SDSA)中是必需的,但在单链退火(SSA)中作用有限[25].我们前期对OsRecQl4的研究表明,过表达OsRecQl4促进了水稻hr介导的DSB修复的切除过程[26].然而,blm相关蛋白在植物中的功能还没有得到很好的分析,特别是在植物分生组织中DNA复制过程中它们潜在的“看守”作用的背景下。
在单子叶模式植物水稻中发现了7个recq样基因。然而,水稻中的这7个基因与拟南芥中的7个基因并不对应。有趣的是,单一BLM对应基因,OsRecQl4,已在水稻基因组中被预测[8,27].虽然从植物基因组稳定性的进化角度来看,拟南芥中两个功能不同的blm样基因的存在是有趣的,但单个blm样基因的存在BLM水稻的BLM对应基因似乎有利于BLM对应基因的功能分析。之前的几份报告拟南芥已显示的效果BLMHR上的同源基因;我们询问这种功能是否与DNA复制过程中基因组稳定性的维持有关。
除了具有优势的分析BLM如上所述,水稻是一种理想的模式植物,用于评估DNA复制位点(即分生组织)中涉及基因组稳定性的基因的功能。此外,s相主要集中在水稻根分生组织区域[28].这是因为,在水稻中,伴随DNA复制停止而来的基因毒性胁迫从未诱导核内重复[29],这是一种逃避DNA损伤的途径之一拟南芥[30.].
在这里,我们报道克隆OsRecQl4并从DNA复制位点的DNA稳定性方面描述敲除植物的表型。我们的研究结果表明,OsRecQl4通过抑制HR在维持基因组稳定性方面发挥着重要作用,至少在根尖分生组织(RAM)中发挥着重要作用。
结果
隔离OsRecQl4水稻cDNA
Hartung和Puchta报道了水稻基因组中AtRecQ4A样序列的存在[8],他们鉴定出含有1164个氨基酸的蛋白CAE03209 (GenBank ID)为OsRecQ4A。我们根据含有CAE3209编码序列的基因组序列Os04g0433800设计特异性引物,通过RT-PCR和RACE方法克隆了相应的全长cDNA。我们的cDNA序列编码1174个氨基酸,与GRAMENE数据库中预测的Loc_Os04g35420.1序列相同[http://www.gramene.org/].我们将序列命名为OsRecQl4栽培稻像RecQ蛋白4。
OsRecQl4由25个外显子和24个内含子组成,编码含有1174个氨基酸的蛋白质,包括DEXDc(死亡样解旋酶结构域,包括ATP−Mg)++和HELICs(解旋酶超家族c端,包括ATP,核苷酸结合位点)解旋酶结构域,以及一个RQC (RecQ c端)和一个HRDC(双霍利德结溶解所需)结构域[6)(图1A).结果与水稻基因组注释计划的预测一致[http://rice.plantbiology.msu.edu/cgi-bin/ORF_infopage.cgi?orf=LOC_Os04g35420.1].由于DEXDc结构域在BLM和AtRecQ4A中是保守的,Hartung和Puchta预测的缺乏DEXDc结构域的OsRecQ4A (CAE3209)似乎是无功能的(附加文件)1:图S1及S2)。
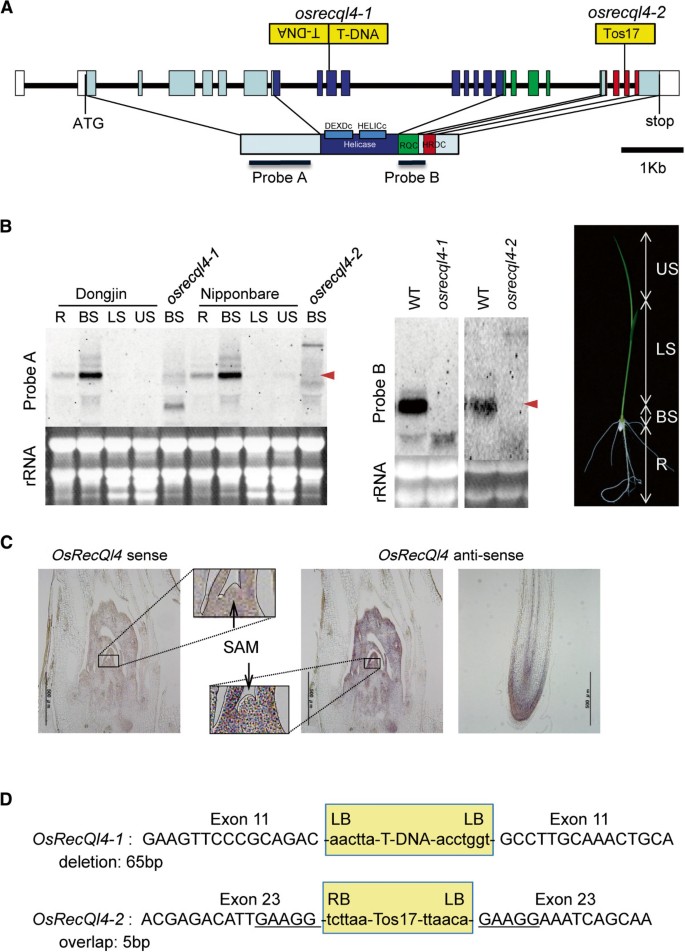
OsRecQl4基因的鉴定及敲除系的分子分析。(一个) T-DNA(来自POSTECH)插入位点osrecql4-1, Tos17 (from NIAS)插入位点在osrecql4-2。OsRecQl4具有保守的解旋酶结构域(包括DEXDc和HELICc结构域)、RecQ c端(RQC)和HRDC结构域。探针A (n端附近,994 bp)和探针B (RQC域的一部分,433 bp)用于northern blot分析。上图所示的T-DNA线在11号外显子上进行了头对头的插入。Tos17系在23号外显子中有一个插入。(B) Northern blot分析。OsRecQl4mRNA在东晋和日本竹芽基部表达较强,在根中表达较弱。在野生型(WT)植物中,探针A和探针B均能检测到mRNA的表达osrecql4-1或osrecql4-2。红色箭头表示的mRNAOsRecQl4。T-DNA的遗传背景(osrecql4-1)为东晋,Tos17 (osrecql4-27天大的野生型(分离野生型)和突变型(纯合子)幼苗。R,根;BS,芽的基础;LS,下枝;美国,上射。(C)原位杂交分析。OsRecQl4反义探针在茎尖分生组织(shoot apical meristem, SAM)和根尖分生组织(root apical meristem, RAM)周围均有较强的杂交信号。OsRecQl4主要在分生组织中表达。(D)osrecql4-1而且osrecql4-2插入站点。osrecql4-1在11号外显子的插入区有65 bp的基因组缺失。osrecql4-2在23号外显子的插入区有5个bp的基因组重叠。
拟南芥AtRecQ4A和AtRecQ4B被报道为功能不同的同源蛋白。由于AtRecQ4A和OsRecQl4的氨基酸序列非常相似,与AtRecQ4B蛋白的氨基酸序列略有不同,我们推测AtRecQ4B蛋白获得或失去了不同功能所需的特定基序。我们使用SALAD数据库比较了OsRecQl4、AtRecQ4A和AtRecQ4B蛋白的几个基序[http://salad.dna.affrc.go.jp/salad/en/]并发现,在解旋酶结构域的c端附近,只有在AtRecQ4B中检测到CMKMGYNC序列;在解旋酶结构域的n端,一个DKESQKSQFLSSTATRI序列在OsRecQl4和AtRecQ4A之间保守,而在AtRecQ4B中不保守(数据未显示)。这些主题还需要进一步的研究。尝试表达AtRecQ4A或AtRecQ4B蛋白可能也很有趣osrecql4突变体的背景。
系统发育分析显示,分离的OsRecQl4在氨基酸水平上与AtRecQ4A(51.5%)和AtRecQ4B(51.0%)最为相似(附加文件)1:图S3A)。OsRecQl4跨外显子8 - 16编码的氨基酸序列与AtRecQ4A跨外显子9 - 17编码的氨基酸序列具有特别高的同源性(数据未显示)。正如预期的那样,通过BLASTZ比对分析,OsRecQl4比AtRecQ4B更像AtRecQ4A [31](附加文件1图S3B)。
的表达OsRecQl4在分生组织
的表达OsRecQl4对粳稻品种东锦和日本光7日龄幼苗进行northern blot分析。使用探针A(图1A),芽根基部信号较强(BS,定义见图)1B)包括茎尖分生组织(SAM),在根(R)中观察到微弱的信号,在下(LS)或上(US)茎中未检测到信号(图1B)。
此外,SAM和ram的特异性表达OsRecQl4由原位杂交(图1C).有趣的是,Saotome等报道了水稻中其他RecQ家族基因的分生组织特异性表达。[27],他分析了其他四个RecQ成员-OsRecQ1,OsRecQ2,OsRecQsim而且OsRecQ886——大米。我们的结果得到了RiceXpro数据库分析的进一步支持。http://ricexpro.dna.affrc.go.jp/] -从水稻植株所有生长阶段的组织或器官的微阵列分析中获得的基因表达谱库[32].OsRecQl4在RAM中高度表达(附加文件1:图S4)。这些结果表明OsRecQl4局限于分生组织。
为了阐明OsRecQl4的生物学作用,我们描述了OsRecQl4的T-DNA和Tos17逆转录转座子插入系,即osrecql4-1(3A-03503 from POSTECH)osrecql4-2(NC2763 from NIAS)分别来自Nipponbare背景。通过PCR和随后的测序确定插入位点的序列。将两个头对头连接的t - dna插入外显子11,基因组缺失65 bp。Tos17系插入外显子23处,重叠5 bp(图1A和D)。
OsRecQl4在osrecql4-1而且osrecql4-2采用northern blot检测突变体。在本实验中,7日龄WT和osrecql4对突变体进行分析。探针A位于n端附近,探针B位于c端附近,包括部分RQC域(图1A).探针A和B在野生型植物中检测到约3.5 kb的转录本,而在野生型植物中未检测到osrecql4-1或osrecql4-2(图1B).在正常情况下,生长osrecql4-1而且osrecql4-2与野生型植物相当。此外,这些突变植株具有可育性,拟南芥中也有报道atrecq4A突变体(23].
OsRecQl4参与DSB修复和s期阻滞恢复
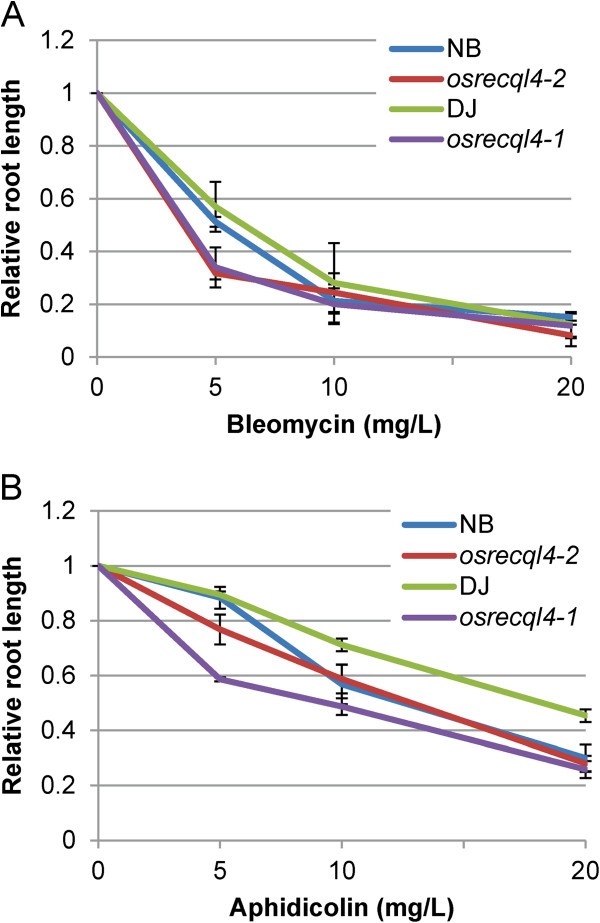
为了评估对DNA损伤的敏感性,种子来自osrecql4用0 ~ 20mg /L浓度的博莱霉素处理突变体和WT突变体。发芽后5天,测量总根长。当osrecql4-1或osrecql4-2在5 mg/L博莱霉素处理下,突变体的根长比WT植株短,表明OsRecQl4可能参与DNA单链断裂(SSBs)和/或DSBs的修复(图2A)。同样,我们评估了OsRecQl4在抑制DNA聚合酶引起的s期阻滞恢复过程中的作用。DNA复制可被aphidicolin -一种DNA聚合酶α抑制剂所阻止[33].在5 mg/L的蚜虫素处理下,观察到根系生长减慢(图2B).用2.5 mM羟基脲处理得到了类似的结果(数据未显示)。OsRecQl4基因在根中的表达增加与蚜虫素有关,而与博莱霉素无关1:图S5)。
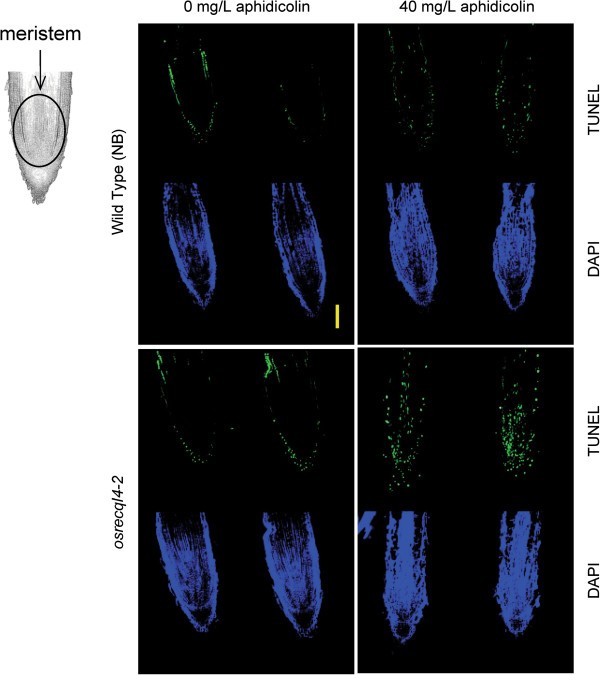
从北方印迹分析的结果来看,两者osrecql4-1(T-DNA线)和osrecql4-2(Tos17系)突变体表达自无功能蛋白OsRecQl4探针b未检测到转录本。此外,两个突变体对博莱霉素和蚜虫素均表现出超敏感(图2).此外,我们发现在蚜虫素治疗后细胞死亡增加,不仅在osrecql4-2(图3.),也在osrecql4-1(附加文件1:图S7)。
自osrecql4-1该突变体在其T-DNA区有一个GUS表达盒,我们无法用GUS - us重组底物系统评估同源重组频率。因此,我们主要使用osrecql4-2我们实验的变种系。
从DNA复制停滞中恢复失败会诱发dsb
在人类中,BLM参与了DNA复制中断的恢复过程,该过程可以由SSBs或DNA加合物诱导,由被阻止的复制叉的解开引起。此外,观察到SCE的增加blm突变细胞被解释为由于缺乏BLM解旋酶活性而增强的dsb [4].因此,我们调查了是否敏感性的增加osrecql4突变体对蚜虫素的治疗是由于从DNA复制停滞恢复的缺陷osrecql4细胞就像blm突变细胞和检测到增加的dsbosrecql4植物。
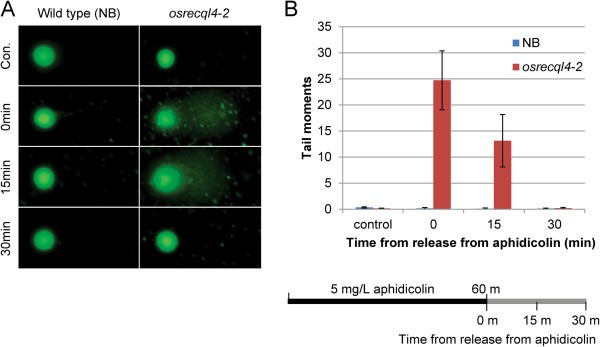
我们使用彗星试验研究了蚜虫素处理后dsb的诱导。Nipponbare (NB) 6周龄鳞片愈伤组织osrecql4-2用5 mg/L蚜虫素处理60 min;然后在去除蚜虫素后观察细胞。彗星尾巴osrecql4-2与未加蚜虫素处理的对照NB无差异。在蚜虫素处理后,彗星尾显示在osrecql4-2去除蚜虫素后立即培养细胞,去除蚜虫素后保持15分钟。相比之下,即使在蚜虫素处理后,对照组NB细胞也没有检测到彗星尾(图4).这些结果表明,在OsRecQl4缺失的情况下,蚜虫素触发的DNA复制阻滞导致DSB诱导。尽管这些DSB可能最终被包括HR在内的内在DNA修复系统修复,但细胞周期进程将因DSB修复所需的时间而延迟。
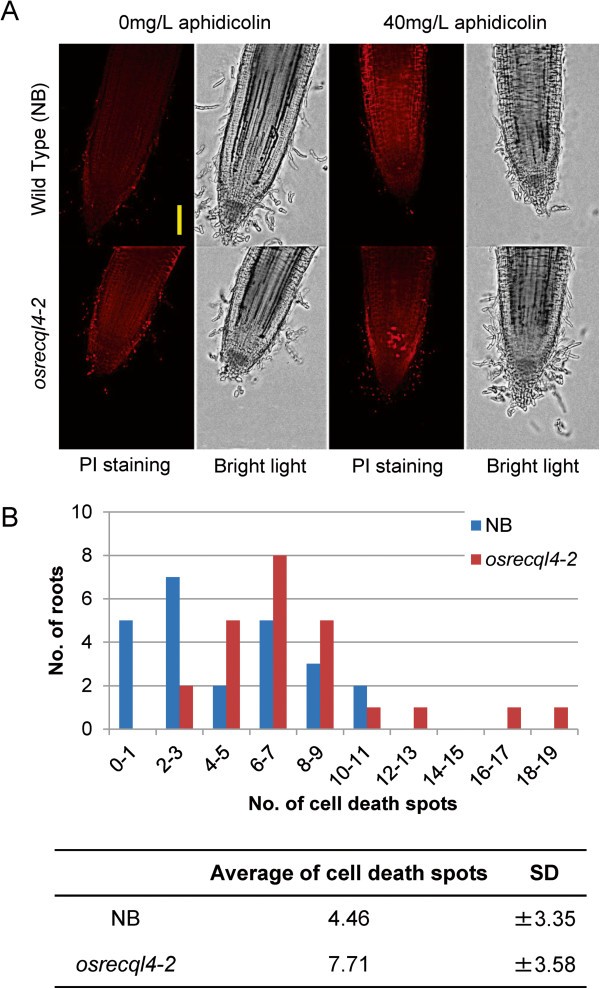
接下来,我们用TUNEL(末端脱氧核苷酸转移酶dUTP镍端标记)观察了根尖DNA损伤的发生osrecql4-2蚜虫素处理后的突变体。该方法通过标记核酸的3末端来检测组织中的dsb, ssb和刻痕[34,35].在分生组织和表皮细胞中观察到DNA损伤信号(图5).前者的信号与细胞分裂有关,而后者似乎是由根生长过程中的物理应激引起的。物理胁迫诱导的TUNEL信号已在根冠和根毛中观察到[36].在根分生组织中观察到DNA损伤信号osrecql4-2用40 mg/L aphidicolin处理野生型植株,在野生型植株中没有效果5).这些结果表明,增强的DNA复制阻滞引起了小鼠RAM中的DNA损伤osrecql4-2突变体。
DNA复制阻滞引发dsb累积诱发HR
诱导的dsb可以通过内在DNA修复系统进行修复;如果修复不当,可能会导致细胞死亡。由于HR是细胞周期s期使用的DSB修复系统,当姐妹染色单体可用作DNA修复模板时,我们分析了在细胞周期s期观察到的诱导DSB是否osrecql4突变体可以增强HR。
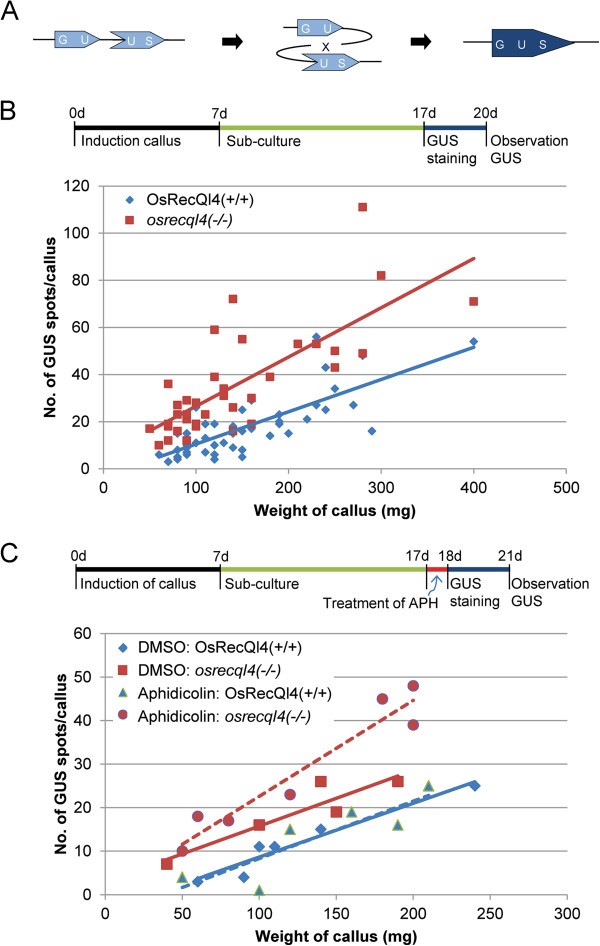
我们使用GUS重组报告器pGU.C.US [37]以监察osrecql4HR频率突变(图6A).两个重叠的GUS序列之间的重组事件可以产生一个有功能的GUS基因,在细胞中产生蓝色斑点,可以用5-溴-4-氯-3-吲哚基葡萄糖苷进行GUS组织化学染色。pGU.C.US转化为杂合子osrecql4-2行;通过Southern blot分析鉴定了具有单个重组报告基因拷贝的转基因系(附加文件)1:图S6),用于进一步研究。在pgu . c.s转基因水稻植株的T1代中监测了HR事件的发生频率osrecql4突变等位基因或WTOsRecQl4等位基因。我们评估了鳞片衍生愈伤组织中HR事件的频率。
增强的人力资源osrecql4-2突变体。(一个本实验中使用的GUS重组报告器(pGU.C.US)作了简要说明。两个重叠序列之间的重组产生功能GUS基因。(B)显微镜下每愈伤组织重量GUS蓝点数量的图示。的HR频率增加较多osrecql4-2对17日龄愈伤组织进行GUS组织化学染色。(C)Aphidicolin治疗可进一步提高HRosrecql4-2但在未加蚜虫素处理的WT中,HR频率无显著差异。用5 mg/L蚜虫素处理17 d愈伤组织24 h后,进行GUS染色。蓝色的钻石OsRecQl4 (+ / +);红色的方块OsRecQl4(−−);蓝色实线OsRecQl4(+/+) GUS位点的平均值;红色实线OsRecQl4(−/−)GUS斑点的平均值;蓝色三角形aphidicolin处理的OsRecQl4(+/+),红圈aphidicolin处理的OsRecQl4(−/−);蓝色虚线aphidicolin处理的OsRecQl4(+/+) GUS斑点的平均值;红色虚线aphidicolin处理的OsRecQl4(−/−)GUS斑点的平均值。
HR频率随愈伤组织重量的分布表明,在愈伤组织中HR频率较高osrecql4-2在WT中突变(图6B). HR频率在WT中没有变化,但在WT中进一步增加osrecql4-2在蚜虫素处理后突变(图6C)。
未修复的DNA复制阻滞会导致细胞死亡
对蚜虫素的敏感性增加osrecql4突变体表明,在这些突变体中检测到的dsb数量的增加可能会导致细胞周期进展延迟,或者dsb可能没有被HR充分修复。
我们通过摄取PI来揭示细胞死亡,PI渗透到垂死和死亡细胞的细胞膜[38].在aphidicolin (40mg /L)处理24小时后检测pi染色的根尖。我们使用Z-stack函数观察根尖(见方法部分的显微分析)。经蚜虫素处理后,我们检测到细胞中PI染色信号数量显著增加osrecql4-2突变体(7.71±3.58)比WT NB(4.46±3.35;Mann-Whitney P < 0.01U测试)(图3.).同样,我们观察到PI染色信号增加osrecql4-1WT Dongjin(0.20±0.14)比WT Dongjin(1.47±0.18)高1:图S7)。对于pi染色死亡细胞,蚜虫素的最佳显示浓度因生态型而异。我们还使用PI染色来观察其他类型的DNA损伤诱导物是否影响细胞死亡的诱导;然而,其他诱导剂均未导致WT和osrecql4(附加文件1:图S8A)。然而,高浓度或长时间的处理会导致根的异常形状并使其不透明(附加文件)1:图S8B)。这一结果表明osrecql4突变植株未能从DNA复制停滞中恢复,导致dsb数量增加,导致根分生组织细胞死亡。
讨论
在这里,我们通过敲除突变体分析了BLM同源物OsRecQl4在水稻DNA复制过程中的功能。使用彗星试验,我们证明了在蚜虫素处理的dsb的诱导osrecql4突变细胞。TUNEL分析表明,在RAM中引起了包括dsb在内的DNA损伤。使用GUS重组报告的HR检测表明,至少有一部分dsb可以被HR修复,这解释了为什么HR在osrecql4突变体。PI染色结果表明,未修复的dsb诱导了根分生组织的细胞死亡。在aphidicolin联合处理下,利用突变株进行comet、TUNEL和HR测定以及PI染色的联合结果清楚地表明,OsRecQl4在DNA复制中断恢复过程中发挥了重要作用,而BLM同源蛋白在这一过程中发挥了保守作用。在本研究中,我们重点研究了OsRecQl4在RAM中DNA复制期间的基因组维护中的作用。然而,OsRecQl4在SAM中也有表达(图1因此,我们认为OsRecQl4在SAM和RAM中都参与了DNA复制过程中基因组稳定性的维持。因此,增加的突变可以积累在osrecql4突变的植物在有丝分裂的细胞周期,这些突变应该遗传给后代。
的osrecql4-1(T-DNA系)只有少量的截断蛋白和osrecql4-2northern blot分析显示(Tos17系)蛋白较长(图1因此,我们得出结论,两者osrecql4-1和osrecql4-2突变体表达的OsRecQl4蛋白大小异常,在一致域RQC中存在缺陷。这两种突变体可能会产生不同的效果。然而,我们发现这两种突变体对DNA损伤剂超敏感,并在蚜虫素处理后增加细胞死亡。
在这项研究中,我们已经证明了DNA复制停滞会导致植物的超重组表型。浦和等人[39]报道了核糖体RNA基因(rDNA)之间的非转录间隔区(NTS),它含有rDNA的复制叉障[40,提高人力资源拟南芥。在大肠杆菌,有人推测,受损的DNA复制叉可能通过Holliday结的形成而重新启动,导致DNA通过Holliday结溶解而裂解,最终通过HR进行修复。然而,这种机制存在不适当重组的风险。因此,一个停滞的分叉(不导致DNA裂解)可能被DNA解旋酶处理以避免复制错误[41].
最近,Schuermann等人[42]报道了DNA聚合酶delta 1 (波尔δ1)拟南芥在停滞和崩溃的复制叉处表现出较高的HR频率。该报告也支持了我们的结论,即DNA复制胁迫诱导植物HR。然而,植物DNA复制胁迫与HR增强的分子机制尚不清楚。在这里,我们看到了累积的dsb, HR和细胞死亡之间的关系,并伴有分生组织部位的DNA复制停滞。
依赖rad51的修复HR包括断裂诱导复制(break-induced replication, BIR)、双霍利迪结(double-Holliday junction, dHJ)和SDSA。独立于rad51的SSA也能修复DSB [43].最近有报道,使用直接重复的GUS - us重组报告基因,主要通过SSA途径产生功能GUS基因,SDSA在DSB之后起次要作用[44].然而,在复制过程中,诱导的DSB并不是诱导两个自由端,而是诱导一个单端DSB,即DNA双链端(DSE)。DSE侵入其姊妹染色单体进行修复,通过BIR合成DNA [45,46].因此,尽管使用直接重复GU-US重组报告器将OsRecQl4和HR关联起来证明了HR效率的提高,但检测到的HR应该是依赖rad51的HR修复。将来,这可以通过Rad51的双突变体来证实。支持GU-US报告细胞选择性修复假说的进一步观点是组织(植物vs.愈伤组织)和诱导(I-南加州爱迪生公司I vs蚜虫素),这可能导致修复发生时细胞周期状态的不同流行率。
我们分析了的敏感性osrecql4蚜虫素和博莱霉素突变体。由于OsRecQl4的缺陷增强了水稻对后两种化合物的敏感性,OsRecQl4可能与DNA复制停滞恢复和DSB修复有关。另一方面,osrecql4不过,突变体生长正常,可育osrecql4突变体显示出异常大小的OsRecQl4蛋白,表明OsRecQl4可能不是必需的。在这方面,有报道称水稻中的RecQ家族基因成员OsRecQ1,OsRecQ2,OsRecQsim而且OsRecQ886-在分生组织中表达[27],表明RecQ解旋酶家族成员可能在维持增殖细胞基因组稳定方面发挥重叠作用。然而,纯合子blm小鼠生长迟缓[47].评估生长可能会很有趣osrecql4在紫外线升高的条件下突变,因为紫外线光产物诱导DNA复制停滞。
拟南芥虽然敏感atrecq4A在我们的研究中,我们观察到水稻对博莱霉素的敏感性增强osrecql4与WT植物相比的突变体。这可能是由于系统、组织和实验程序的差异。此外,我们观察到在根分生组织细胞死亡osrecql4突变体植物。这些差异可能是由于核内重复的发生拟南芥,因为DNA损伤的细胞可以进入内环,并从有丝分裂细胞周期中分离出来拟南芥。
我们的结果表明,OsRecQl4在SAM和RAM,即细胞分裂位点表达。此外,OsRecQl4的表达是由蚜虫素诱导的,而不是博莱霉素(附加文件)1:图S5)。这些结果表明,根据转录水平的不同,OsRecQl4在DNA复制的修复过程中比在dsb修复中发挥更重要的作用。BLM在停止的复制分叉处组装[4,6],这支持了DNA复制抑制诱导表达OsRecQl4的概念(附加文件1:图S5)。这些结果表明,从DNA复制停滞中恢复需要OsRecQl4。的osrecql4-2突变体未能从DNA复制停滞中恢复;这导致需要修复的dsb数量增加,可能由HR进行修复。
有趣的是,我们发现,在没有蚜虫素治疗的情况下,WT和osrecql4-2突变体产生了非常低水平的dsb(图4)从彗星实验判断。同样,DNA损伤osrecql4-2TUNEL分析的细胞分裂根区与野生型植物基本相当。然而,osrecql4-2在正常生长条件下,未施用蚜虫素的突变体植株发生HR的频率高于野生型植株。这表明,DSBs诱导的osrecql4-2在正常生长条件下,突变体可以被包括HR在内的DNA修复系统修复,因为HR在没有RecQ解旋酶的情况下可以缓慢进行[48].然而,蚜虫素处理诱导的过量dsb不能被内在DNA修复系统修复,因此通过comet和TUNEL试验检测到未修复的dsb。此外,未修复的dsb可能诱导细胞死亡osrecql4蚜虫素处理后的突变体。因此,OsRecQl4可能是将植物从基因毒性胁迫中拯救出来所必需的。
一般来说,RecQ解旋酶维持DNA的稳定性。RecQ解旋酶BLM不仅能促进DNA复制停滞的恢复,还能促进DSB修复初始阶段外切酶1介导的DNA切除[49].OsRecQl4也在促进水稻hr介导的DSB修复过程中发挥作用[26].OsRecQl4只在分生组织中表达;此外,其他recq样基因也在分生组织中表达[27].因此,我们预计7个RecQ解旋酶基因在水稻中有重叠和不同的作用。
结论
本文报道的结果表明,OsRecQl4在水稻DNA复制过程中具有维持基因组稳定的重要功能。由于BLM和SGS1通过解旋酶活性来恢复被阻止的复制叉,OsRecQl4可能在水稻基因组维持中具有相同的活性。特别是,在细胞分裂区DNA复制停止时,观察到增强的dsb和细胞死亡osrecql4突变体。由此,我们得出结论,在水稻分生组织中,从DNA复制停滞中恢复需要OsRecQl4。RecQ解旋酶在维持基因组稳定方面应该有部分重叠的作用,其中可能是主要作用于基因组稳定的专家。
方法
系统发育分析
我们检索了水稻全长cDNA数据库,NCBI [http://www.ncbi.nlm.nih.gov/]和GRAMENE [http://www.gramene.org/],利用BioEdit (version 7.0.5.3)和MEGA (version 3.1)程序对RecQ的水稻同源物进行鉴定。在大米中发现了7个RecQ同源体。系统发育分析基于内置CLUSTALW程序生成的氨基酸序列比对。
OsRecQl4 cDNA的合成及分离osrecql4突变体行
根据制造商提供的方案,使用RNeasy Plant Mini试剂盒(Qiagen)从7天大的幼苗中分离总RNA。使用ReverTra Ace (Toyobo, Japan),按照厂家说明书进行逆转录,总RNA来自水稻苗底。使用高保真耐热DNA聚合酶KOD-Plus (Toyobo, Japan)进行聚合酶链反应(PCR)和cDNA末端快速扩增(RACE)。5 ' -和3 ' - race使用GeneRacer试剂盒(Invitrogen, Carlsbad, CA),根据基因组DNA序列设计基因特异性引物。用于OsRecQl4编码区扩增的基因特异性引物为RecQl4_Start1 (gccatgataaagccaagagggtcaact),用于全长cDNA扩增的基因特异性引物为RecQl4_End1 (ACCCTAGGCTATTCTGGCGGACTG)、RecQl4-5'Race (GATCCGACCAGTTGACCCTTGGCTTT)和RecQl4-3'Race (ACGCGCTGCAAAGACACGTACAAGG)。PCR产物克隆到pCR2.1 TOPO载体(Invitrogen, San Diego, CA)进行DNA测序。
T-DNA标记系的种子osrecql4-1和Tos17插入线osrecql4-2为来自香港浦项科技大学(行号3A-03503) [50)和NIAS集合(行号为。NC2763),分别[51].从杂合子植株中获得的种子在土壤中培养,T-DNA和Tos17插入系的种子在温室中进一步繁殖。
T-DNA和Tos17的整合位点采用以下引物进行PCR检测:对于T-DNA插入,对应T-DNA左右边界的特异性组合:pGA2715-L1.5 (GGCCAGTGAATTCACTAGTGATTGC)、3A-03503-498 F (caatcctcgaaaggcaatctctat)、3A-03503-498R (ATTCGCGAGGCCATCTCTCT)和Tos17插入:Tos17_3880 (agtcgtgtgatttcttcaccaagg)、NC2763-F (TGCCTTGTACGTGTCTTTGC)、NC2763-R (AGCTTTGCAATGCCTTAGGA)以及相应基因内的基因组序列。PCR产物纯化并测序(图1一个)。
Northern blot分析
使用RNeasy Plant Mini Kit (Qiagen, Valencia, CA)从10天大的幼苗的茎尖制备总RNA。将总RNA (20 μg)装入1%琼脂糖凝胶中分离,转移到带正电荷的尼龙膜上(Roche, Mannheim, Germany)。探针A (OsRecQ4-proN_F, AACACAAAGGCCTAATCAGGAAGCA;OsRecQ4-proN_R, attcctggtgtaaatcggtgattattgg)或B (RecQl4_1F, GTCGAAAAAGATGTGACCAACATTGCTAG;RecQl4_1R, TCCCGTCCACTTGACTCTGTTGATTAG1A)采用PCR DIG探针合成试剂盒(Roche)制备,按照DIG应用手册(Roche)进行杂交。在50°C进行杂交,在50°C的高严格条件下进行洗涤。
用DNA损伤剂治疗
为了研究DNA损伤剂对水稻的影响,我们制备了10 mg/ml的顺铂(CDDP, cis- diamminedchloroplatinum [II];Wako Pure Chemical Industries,东京,日本),10mg /ml的博莱霉素(BLE;Wako Pure Chemical Industries), 10毫克/毫升的aphidicolin (APH;Wako Pure Chemical Industries), 10 mg/ml的诺可达唑(NOC;Wako Pure Chemical Industries),以及1mm的喜树碱(CPT;Wako纯化学工业)。
为分析DNA损伤剂对根系伸长的影响,将消毒后的种子播种在含有DNA损伤剂的MS固体培养基上,在30°C的生长室中连续光照下生长。播后5 d,用Image J软件(version 1.43)测量根长。
为了制备用于PI染色和TUNEL检测的植物材料,我们将在MS固体培养基上生长的5天大的水稻植株转移到含有不同浓度dna损伤剂的MS液体培养基上,然后在生长室中进一步培养24小时。为了进行彗星实验,将在N6D固体培养基上生长的4周愈伤组织转移到含有DNA损伤剂的N6D液体培养基上,然后在RT下继续培养1小时。
根尖PI染色
在离根尖约10mm处切取根尖,用5mg /L PI(溶解于无菌水中)在载玻片上染色20分钟。
TUNEL(末端脱氧核苷酸转移酶介导的dUTP划痕和标记)分析
根用4% (v/v)多聚甲醛固定在PBS (pH 7.4)中,在4℃下过夜。接下来,固定根在叔丁醇中脱水,并嵌入准质体中进行切片。将样品在分级乙醇系列中再水化以去除多聚甲醛,然后用蛋白酶K (20 μg/ml蛋白酶K在10 mM Tris-HCl中,pH 7.5)在37°C下处理30 min,然后用PBS洗涤三次。TUNEL反应在玻片上进行,使用荧光素原位细胞死亡检测试剂盒(Roche),按照制造商的说明进行。
彗星试验
用1%正常熔点琼脂糖预涂显微载玻片并彻底干燥。在含50 mM EDTA的200 μl PBS中用刀片切伤愈伤组织。取30 μl核悬浮液与等体积的1%低熔点琼脂糖液体在42℃下混合,涂抹在预先涂有1%正常熔点琼脂糖的载玻片上。含核琼脂糖凝固后,核在高盐溶液(2.5 M NaCl, 10 mM Tris-HCl pH 7.5, 100 mM EDTA)中在室温下裂解20分钟。在1×TBE的冰上平衡3 × 5分钟,然后在室温下在1×TBE缓冲液中电泳6分钟。为了清除核悬浮液中存在的淀粉颗粒凝胶,载玻片在1% Triton中保存10分钟,然后在70%乙醇和96%乙醇中脱水2× 5分钟并风干。干琼脂糖凝胶用1:10 000稀释的SYBR绿染色。染色后,在荧光显微镜下使用徕卡DM5000显微镜软件捕获载玻片,并使用CometScore™软件定量DNA损伤。
显微镜
pi染色的根尖图像由带Z-stack功能的Keyence (BZ-9000)显微镜捕获。Z-stack函数通过z轴移动物镜的焦点,捕获几张图像,从图像中只提取聚焦点,并将这些点合成为全焦图像(http://www.keyence.com/products/microscope/fluorescence/bz8000/bz8000_features_3.php).徕卡DM5000显微镜也用于图像捕捉。
水稻转化
农杆菌属-介导水稻转化(o .漂白亚麻纤维卷l .简历。Nipponbare)的执行如前所述[52,53].脱壳种子在N6D培养基上灭菌发芽1周。共同培养后农杆菌属携带pgus . c.us载体,用无菌水冲洗7次,12.5 mg/L美罗培南冲洗3次。将愈伤组织转移到含有合适抗生素的N6D培养基中,以选择转化细胞。将在选择培养基上生长旺盛的愈伤组织转移到含抗生素的再生培养基上。再生植株在无激素的MS培养基上进一步生长,然后种植在土壤中。
组织化学GUS染色
植物材料组织化学染色参照Jefferson [54].为方便染色缓冲液渗透,将植株切成约10mm的小段,将较大的愈伤组织切成几段。将这些植物材料用X-Gluc染色底物真空浸润3 × 10 min,然后在37℃下孵育3天。用70%乙醇漂白愈伤组织,计数GUS蓝点数量。
缩写
- 出生:
-
断路感应复制
- BS:
-
拍摄基地
- dHJ:
-
Double-Holliday结
- 双边带:
-
DNA双链断裂
- 内镜下动态慢动作影像:
-
双链结束
- 人力资源:
-
同源重组
- LS:
-
较低的射击
- 注:
-
Nipponbare
- nt:
-
Non-transcribed垫片
- PI:
-
Propidium碘化
- 波尔δ1:
-
DNA聚合酶1
- 接待员:
-
根
- 内存:
-
根顶端分生组织
- rDNA:
-
核糖体RNA基因
- 战:
-
复制蛋白A
- 山姆:
-
茎顶分生组织
- 南加州爱迪生公司:
-
姐妹染色单体交换
- SDSA:
-
依赖合成的链退火
- SSA:
-
长串退火
- 单边带:
-
长串打破
- 我们:
-
上拍摄。
参考文献
- 1.
玻尔VA:从RecQ时代崛起:人类RecQ解旋酶在基因组维持中的作用。生物化学,2008,33(12):609-620。10.1016 / j.tibs.2008.09.003。
- 2.
Singh DK, Ahn B, Bohr VA: RECQ解旋酶在重组DNA修复、基因组稳定性和衰老中的作用。生物老年学,2009,10(3):235-252。10.1007 / s10522 - 008 - 9205 - z。
- 3.
Bachrati CZ, Hickson ID: RecQ解旋酶:DNA复制叉的守护天使。中国生物医学工程学报,2008,27(3):344 - 344。10.1007 / s00412 - 007 - 0142 - 4。
- 4.
Wu L: BLM解旋酶在复制叉管理中的作用。DNA修复(Amst)。2007,6(7): 936-944。10.1016 / j.dnarep.2007.02.007。
- 5.
Singh DK, Ghosh AK: Croteau DL。玻尔VA: RecQ解旋酶在DNA双链断裂修复和端粒维持中的作用。Mutat Res;2011.
- 6.
Rezazadeh S: RecQ解旋酶;处于基因组复制、修复和重组的十字路口。Mol生物学报,2012,39(4):4527-4543。10.1007 / s11033 - 011 - 1243 - y。
- 7.
吴玲,Hickson ID: RecQ解旋酶和拓扑异构酶:调控遗传重组的保守复合体的组成部分。细胞与生命科学,2001,58(7):894-901。10.1007 / PL00000909。
- 8.
Hartung F, Puchta H:植物RecQ基因家族。植物营养学报,2006,26(3):357 - 357。10.1016 / j.jplph.2005.10.013。
- 9.
罗旭明,高希AK,玻尔VA:维尔纳综合征蛋白在基因组完整性保护中的作用。DNA修复(Amst)。2010, 9(3): 331-344。10.1016 / j.dnarep.2009.12.011。
- 10.
Ellis NA, Groden J, Ye TZ, Straughen J, Lennon DJ, Ciocci S, Proytcheva M, German J: Bloom综合征基因产物与RecQ解旋酶同源。光子学报,2004,31(4):359 - 366。10.1016 / 0092 - 8674(95) 90105 - 1。
- 11.
Gray MD, Shen JC, kamaths -Loeb AS, Blank A, Sopher BL, Martin GM, Oshima J, Loeb LA: Werner综合征蛋白是一种DNA解旋酶。植物学报,1997,17(1):100-103。10.1038 / ng0997 - 100。
- 12.
Kitao S, Shimamoto A, Goto M, Miller RW, Smithson WA, Lindor NM, Furuichi Y: RECQL4突变引起rothmundd - thomson综合征的一个子集。植物学报,1999,22(1):82-84。10.1038/8788。
- 13.
Nimonkar AV, Ozsoy AZ, Genschel J, Modrich P, Kowalczykowski SC:人外切酶1和BLM解旋酶相互作用,切除DNA并启动DNA修复。自然科学进展,2008,29(4):379 - 379。10.1073 / pnas.0809380105。
- 14.
Mimitou EP, Symington LS: Sae2, Exo1和Sgs1在DNA双链断裂过程中合作。自然科学学报,2008,38(4):344 - 344。10.1038 / nature07312。
- 15.
McDaniel LD, Schultz RA:布鲁姆综合征细胞升高的姐妹染色单体交换表型由人类15号染色体补充。中国科学:自然科学,2001,26(3):379 - 379。10.1073 / pnas.89.17.7968。
- 16.
Brosh RM, Li JL, Kenny MK, Karow JK, Cooper MP, Kureekattil RP, Hickson ID, Bohr VA:复制蛋白A与布鲁姆综合征蛋白相互作用并刺激其解旋酶活性。中国生物医学工程学报,2000,27(3):357 - 357。10.1074 / jbc.M001557200。
- 17.
Wu L, Davies SL, North PS, Goulaouic H, Riou JF, Turley H, Gatter KC, Hickson ID:布鲁姆综合征基因产物与拓扑异构酶III相互作用。中国生物医学工程学报,2000,27(3):344 - 344。10.1074 / jbc.275.13.9636。
- 18.
Davies SL, North PS, Dart A, Lakin ND, Hickson ID:布鲁姆综合征解旋酶的磷酸化及其在s期阻滞恢复中的作用。分子细胞生物学,2004,24(3):1279-1291。10.1128 / mcb.24.3.1279 - 1291.2004。
- 19.
Davies SL, North PS, Hickson ID: BLM在复制叉重启和复制应激后抑制起始发射中的作用。分子生物学,2007,14(7):677-679。10.1038 / nsmb1267。
- 20.
杨晓东,李志刚,李志刚,李志刚。布卢姆氏综合征中DNA复制中间体的异常分析。癌症研究,1990,50(11):3141-3145。
- 21.
Karow JK, Constantinou A, Li JL, West SC, Hickson ID: Bloom综合征基因产物促进节假日连接的分支迁移。自然科学进展,2000,29(3):357 - 357。10.1073 / pnas.100448097。
- 22.
桑蒂尼Y, Delacote F, Vares G, Petitot F, Lambert S, Averbeck D, Lopez BS:哺乳动物细胞复制抑制诱导同源重组的表征。环境科学学报,2001,20(14):3861-3870。10.1093 / emboj / 20.14.3861。
- 23.
Bagherieh-Najjar MB, de Vries OMH, Hille J, Dijkwel PP:拟南芥RecQl4A抑制同源重组并调节DNA损伤反应。植物学报,2005,43(6):789-798。10.1111 / j.1365 - 313 x.2005.02501.x。
- 24.
Hartung F, Suer S, Puchta H:两种密切相关的RecQ解旋酶在拟南芥同源重组和DNA修复中具有拮抗作用。中国科学:自然科学,2007,26(3):344 - 344。10.1073 / pnas.0705998104。
- 25.
Mannuss A, Dukowic-Schulze S, Suer S, Hartung F, Pacher M, Puchta H: RAD5A, RECQ4A和MUS81在拟南芥同源重组中具有特定功能,并定义了DNA修复的不同途径。植物细胞学报,2010,22(10):3318-3330。10.1105 / tpc.110.078568。
- 26.
Kwon YI, Abe K, Osakabe K, Endo M, Nishizawa-Yokoi A, Saika H, Shimada H, Toki S:水稻OsRecQl4和/或OsExo1过表达增强dsb诱导的同源重组。中国生物医学工程学报,2012,29(3):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcs155。
- 27.
saotoma, Kimura S, Mori Y, Uchiyama Y, Morohashi K, Sakaguchi K:水稻RecQ同源物的鉴定Nipponbare)。生物化学学报,2006,39(4):344 - 344。10.1016 / j.bbrc.2006.04.134。
- 28.
Kotogany E, Dudits D, Horvath GV, Ayaydin F:一种利用乙基脱氧尿苷检测植物细胞和组织s期细胞周期进展的快速和可靠的方法。植物学报,2010,6(1):5。10.1186 / 1746-4811-6-5。
- 29.
Endo M, Nakayama S, Umeda- hara C, Ohtsuki N, Saika H, Umeda M, Toki S: CDKB2参与水稻有丝分裂和DNA损伤应答。植物学报,2012,29(6):357 - 357。10.1111 / j.1365 - 313 x.2011.04847.x。
- 30.
Adachi S, Minamisawa K, Okushima Y, Inagaki S, Yoshiyama K, Kondou Y, Kaminuma E, Kawashima M, Toyoda T, Matsui M:拟南芥DNA双链断裂对核内复制的程序诱导。自然科学进展,2011,29(3):344 - 344。10.1073 / pnas.1103584108。
- 31.
Schwartz S, Kent WJ, Smit A, Zhang Z, Baertsch R, Hardison RC, Haussler D, Miller W: BLASTZ的人鼠对齐。基因组学报,2003,13(1):103-107。10.1101 / gr.809403。
- 32.
Sato Y, Antonio BA, Namiki N, Takehisa H, Minami H, Kamatsuki K, Sugimoto K, Shimizu Y, Hirochika H, Nagamura Y: RiceXPro:在自然田间条件下生长的粳稻基因表达监测平台。核酸研究,2011,39(数据库issue): 1141-1148。
- 33.
林志刚,李志刚,李志刚,李志刚。蚜虫素对真核生物DNA复制和细胞增殖的影响。中华药理学杂志,1984,12(2):143-148。10.1177 / 019262338401200205。
- 34.
Negoescu A, Lorimier P, Labat-Moleur F, Drouet C, Robert C, Guillermet C, Brambilla C, Brambilla E: TUNEL法原位凋亡细胞标记:细胞制备的改进和评价。组织化学与细胞化学杂志,1996,44(9):959-968。10.1177 / 44.9.8773561。
- 35.
王超,刘忠:拟南芥核糖核酸还原酶在细胞周期进程、DNA损伤修复和植物发育中起着重要作用。植物细胞学报,2006,18(2):350-365。10.1105 / tpc.105.037044。
- 36.
王志刚,王志刚,王志刚,等。仙人掌科植物初生根发育性细胞程序性死亡。学报学报,2005,29(4):379 - 379。10.3732 / ajb.92.9.1590。
- 37.
席伯特R, Puchta H:植物基因组中直接重复序列的同源重组对基因组双链断裂的有效修复。植物学报,2002,14(5):1121-1131。10.1105 / tpc.001727。
- 38.
杜尔尼特,哈瑟洛夫J:一种利用共聚焦显微镜识别活植物组织中非活细胞的简单方法。植物学报,2008,4(1):15。10.1186 / 1746-4811-4-15。
- 39.
Urawa H, Hidaka M, Ishiguro S, Okada K, Horiuchi T:拟南芥rDNA非转录间隔区引起的同源重组增强。中国生物医学工程学报,2001,26(4):546-555。10.1007 / s004380100547。
- 40.
Keil RL, Roeder GS:酿酒酵母核糖体DNA片段的顺式作用,重组刺激活性。中国生物医学工程学报,2004,39 (2 Pt 1): 377-386。
- 41.
McGlynn P, Lloyd RG:受损复制叉的重组修复和重新启动。中国生物医学工程学报,2002,3(11):859-870。10.1038 / nrm951。
- 42.
许尔曼D,李志刚,李志刚,李志强B:复制胁迫对拟南芥DNA聚合酶delta突变体的影响。植物细胞学报,2009,21(9):2700-2714。10.1105 / tpc.109.069682。
- 43.
Heyer WD, Ehmsen KT, Liu J:真核生物同源重组的调控。植物学报,2010,44:113-139。10.1146 / annurev -麝猫- 051710 - 150955。
- 44.
Roth N, Klimesch J, Dukowic-Schulze S, Pacher M, Mannuss A, Puchta H:植物体细胞同源双链断裂修复不同途径对重组因子的需求差异较大。植物学报,2012,32(5):379 - 379。10.1111 / j.1365 - 313 x.2012.05119.x。
- 45.
李志强,李志强,李志强,等。DNA双链断裂修复通路选择的调控。地球科学进展,2008,18(1):134-147。10.1038 / cr.2007.111。
- 46.
Allen C, Ashley AK, Hromas R, Nickoloff JA:复制应激恢复的道路上有更多的岔路口。分子细胞生物学杂志,2011,3(1):4-12。10.1093 / jmcb / mjq049。
- 47.
Chester N, Kuo F, Kozak C, O’hara CD, Leder P:小鼠布鲁姆综合征基因纯合子特异性凋亡、发育迟缓和胚胎致残性。基因开发,1998,12(21):3382-3393。10.1101 / gad.12.21.3382。
- 48.
朱智,钟文华,沈永勇,李晓霞,Ira G: sg1解旋酶和两种核酸酶Dna2和Exo1切断DNA双链断裂端。光子学报,2008,34(6):981-994。10.1016 / j.cell.2008.08.037。
- 49.
Bernstein KA, Gangloff S, Rothstein R: DNA修复中的RecQ DNA解旋酶。植物学报,2010,44:393-417。10.1146 / annurev -麝猫- 102209 - 163602。
- 50.
郑德华,韩俊杰,朴山,李海生,安凯,安庚:水稻T-DNA插入诱变活化标记的研究。植物科学进展,2002,26(4):344 - 344。10.1104 / pp.014357。
- 51.
Miyao A, Tanaka K, Murata K, Sawaki H, Takeda S, Abe K, Shinozuka Y, Onosato K, Hirochika H: Tos17逆转录转座子的靶位点特异性显示偏好在基因内插入,而非插入到基因组中逆转录转座子丰富的区域。植物细胞学报,2003,15(8):1771-1780。10.1105 / tpc.012559。
- 52.
Toki S:农杆菌介导水稻快速高效转化。植物分子生物学学报,1997,15(1):16-21。10.1007 / BF02772109。
- 53.
Toki S, Hara N, Ono K, Onodera H, Tagiri A, Oka S, Tanaka H:农杆菌早期侵染水稻茎叶组织,使水稻快速转化。植物学报,2006,47(6):969-976。10.1111 / j.1365 - 313 x.2006.02836.x。
- 54.
Jefferson RA, Kavanagh TA, Bevan MW: GUS融合:β -葡萄糖醛酸酶作为高等植物中敏感和多功能的基因融合标记。中国地质大学学报(自然科学版),2007,26(3):391 - 391。
致谢
感谢Puchta博士提供重组基板,感谢H. Rothnie对手稿进行英文编辑,感谢K. Amagai、A. Nagashii和F. Suzuki对实验的总体技术支持。N. Kishimoto协助PI染色的统计学分析。这项研究得到了日本教育、文化、体育、科学和技术部(MEXT)向Y.I. Kwon提供的奖学金的支持。
这项工作也得到了日本面向生物技术研究推进机构(BRAIN)向S. Toki提供的PROBRAIN(促进创新生物科学基础研究活动计划)资助;日本农林水产省的一笔赠款(农业创新基因组学,GMC-0001);日本文部科学省核基础研究战略推进计划(No. 210105, No. 23658012)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
YIK主导研究设计并开展部分实验工作,KA、ME参与研究设计,开展部分实验工作,并对实验流程提出建议;KO参与研究设计,提供启动子、终止子等结构;AT进行了部分原位杂交分析;NO、ANY和HS参与了研究设计,并进行了部分实验工作。ST是研究的总督导,参与研究设计,协助撰写稿件并获得资助。所有作者都阅读并批准了最终版本。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Kwon易建联。,一个be, K., Endo, M.et al。DNA复制停滞导致水稻OsRecQl4突变体分生组织中同源重组增强和细胞死亡。BMC植物生物学13日,62(2013)。https://doi.org/10.1186/1471-2229-13-62
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-62
关键字
- 大米
- RecQ解旋酶
- OsRecQl4
- DNA复制
- DNA双链断裂
- 同源重组
- 分生组织