摘要
背景
棉花遗传雄性不育(GMS)研究(gossypium hirsutum)在利用混合活力的情况下起着重要作用。然而,GMS的分子机制尚不清楚。虽然许多研究表明,微大RNA(miRNA)调节花和花药,无论是否存在不同的小RNA法规,尚不清楚。使用深度测序方法来研究本研究中棉花种植棉花种植症期间小RNA的全局表达和复杂性。
结果
三个小RNA文库由来自肥沃的野生型(WT)及其GMS突变棉的三种发展阶段的花药构成,导致近8000万次读数。三种WT文库中的miRNA和短干扰RNA的总数明显大于相应的三个突变库中的RNA。鉴定了十六个保守的miRNA家庭,其中四个中的四种在花药开发期间包含绝大多数表达的miRNA。此外,在GMS突变体及其重量的样品中,六个保守的miRNA家族在花药之间显着表达。
结论
本研究是第一个深度序列的小RNA人群G.Hirsutum.GMS突变体及其WT花药。我们的研究结果表明,棉质GMS突变体的小RNA规定脱节地与WT的那些不同。进一步的结果表明,不同表达的miRNA受调节的转录物,其明显涉及种植性地发展。鉴别棉GMS突变体和其WT之间不同的miRNA将有助于我们理解雄性不育的分子机制。
背景
棉花是世界上最重要的经济作物之一。雄性不育是一种简单有效的授粉控制系统,已广泛应用于杂交棉育种。在棉花育种中,主要采用细胞质雄性不育系(CMS)和遗传雄性不育系(GMS)两种雄性不育系进行杂交。这两个系统都具有母性(前)或核(后)遗传性状,使它们无法产生或释放功能性花粉,因此它们可以作为母性植物产生杂交种子。雄性不育的分子机制是当前植物科学研究的热点。
许多研究表明,CMS通常与线粒体基因组中发现的不寻常开放阅读框(ORFs)有关。例如,细胞毒肽ORF79在博罗-台中(BT)型细胞质雄性不育水稻(奥雅萨苜蓿)与Chinsurah Boro II细胞质引起CMS。ORF79蛋白由一个二聚体基因表达,ATP6.-orf79,它是在正常之外存在的ATP6.BT型线粒体基因组中的基因[1].核编码的育性恢复基因可以抑制cms诱导的ORFs,恢复雄性育性[2].GMS在基因和蛋白表达水平上也得到了广泛的研究,主要集中在蛋白编码基因上。到目前为止,关于雄性不育与蛋白质非编码基因关系的研究还很少。
作为一类非编码基因,小非编码RNA(NCRNA)在通过控制转录和转录后机制来调节真核细胞的分子机械方面发挥着重要作用[3.].这些过程包括染色质的形成和维持,对自私和寄生实体(如转座元件和病毒)的防御,以及天然蛋白质编码基因的表达[4,5].植物中的调控型ncRNA可分为两大类,即microrna (mirna)和短干扰rna (sirna)。虽然siRNAs结果主要来自外生来源,microrna是一类内源性小监管ncRNAs长度从20 - 24核苷酸(nt)负调节基因的表达在转录后水平通过完美的或近乎完美的互补与目标mrna解理或抑制翻译(6- - - - - -8].一些已知的miRNA位点在基因组中形成簇状,这些miRNA簇状可能是由基因复制产生的,给定簇状中的miRNA通常彼此相关[9- - - - - -11].
microrna是关键的转录后调控因子,控制真核生物的各种生物和代谢过程,其中许多是保守的,最近进化出了物种特异性多样性[12,13].mirna在植物生命周期的特定生物过程中也具有重要的调节功能,如控制组织分化和发育,从营养生长到生殖生长的阶段转换,以及对不同的生物和非生物胁迫的响应[14- - - - - -16].近年来已经确定了越来越多的新植物miRNA。迄今为止,拟南芥,大米和其他植物物种中的超过1,000 miRNA已经注释[17].然而,植物中mirna的数量显然没有达到饱和,因为在不同的物种中不断地发现新的mirna。陆地棉(G.Hirsutum.),只有54个mirna被报道。
花药是高度专业的器官,用于营养储存和生殖发展。他们的成熟和发育涉及转录和转录后水平的细致基因调节[18].在花药中,小的ncrna是开花植物体细胞二倍体阶段孢子体发育所必需的,被子植物雄性配子体中也存在小的RNA通路并发挥作用[19,20.].在拟南芥中,MiR167的过表达导致雄性不育[21].虽然没有直接证据表明miRNA是植物雄性不育的致病基因,但我们假设某些miRNA基因的差异表达参与了雄性不育的调控。
一个s the first step towards the understanding of their regulatory mechanisms and networks of target genes in male sterility in plants, expression of miRNAs between a cotton GMS mutant (‘Dong A’) and its fertile wild type (WT) was compared using a deep sequencing approach developed by Solexa (Illumina Inc) in the present study. The male sterility of the GMS mutant ‘Dong A’ is controlled by one pair of recessive genes [22],与野生型(WT)具有相同的遗传背景。是研究棉花花药发育和雄性不育的理想遗传材料。在本研究中,我们分析和比较了GMS‘Dong A’及其WT在雄性配子体发育的三个不同阶段的mirna的表达模式和关键小RNA通路,然后进行了综合生物信息学分析,以识别新的和候选mirna。此外,通过miRNA聚类分析miRNA的表达谱,该方法已被广泛应用于研究不同物种的miRNA表达水平[23- - - - - -25].通过进一步比较所选miRNA与其相应的靶基因之间的表达模式,我们已经更好地了解MiRNA在花药开发和典型遗传性雄性不育中的MiRNA的分子机制。
结果
棉雄性无菌突变体中的花药受损的表型分析
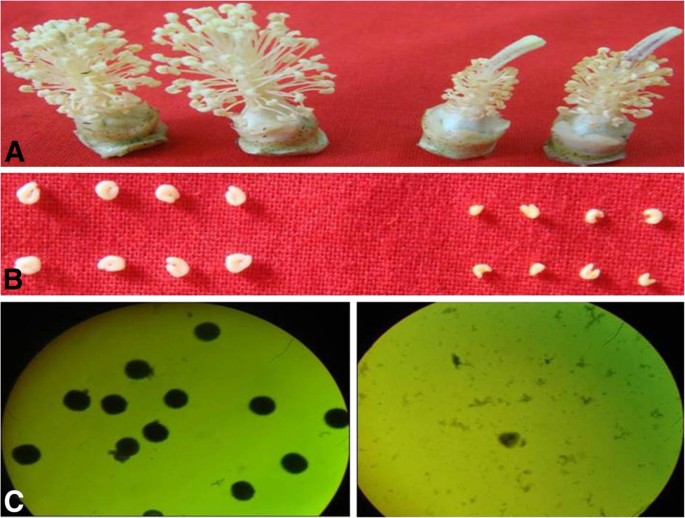
为了确定棉花GMS突变体的形态缺陷,我们将突变体的花药与其可育野生型(WT)进行了比较。在花后0天(DPA),突变体表现出异常的花表型,没有花粉粒,花药比WT小(图)1A和B)。WT和突变体的花粉粒用2% I染色2- 在开花期间检测淀粉活动。WT中有许多可行的花粉粒,而观察到的突变体中没有可行的花粉(图1因此,突变体是完全不育的。
棉花花药发育过程中小rna的分布
根据前人的研究,‘Dong A’GMS突变体的雄性不育高峰主要发生在花药单核小孢子阶段[26,选择早期花药发育阶段来识别可能参与导致雄性不育事件的mirna。本研究从减数分裂前期(WT: Mar-F-1;突变体:Mar-S-1)和四分体阶段(WT: Mar-F-2;突变体:Mar-S-2),伴单核小孢子阶段(WT: Mar-F-3;利用GMS‘Dong A’突变体及其可育野生型构建6个小RNA库(即来自两个基因型三个阶段的花药)。
来自六个库的数据集用于查询位于国家生物技术信息基因库中的NCRNA序列(http://www.ncbi.nlm.nih.gov/)和Rfam 9.1数据库(http://rfam.janelia.org/)将匹配非编码序列的小RNA分离,例如核糖体RNA(RRNA),转移RNA(TRNA),小核RNA(SNRNA)和小核核瘤RNA(SNORNA)。表中列出了这些片段的分布(<总读数的5%)1.
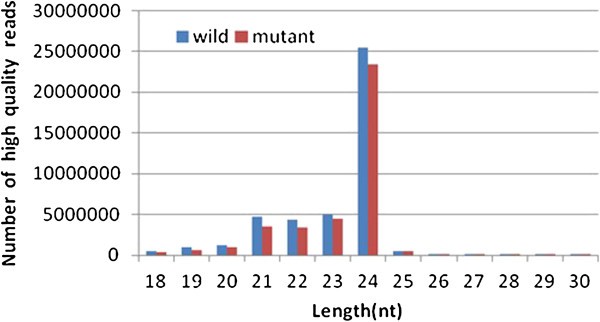
在这六个小RNA文库中获得了近8000万只具有18-30nt的长度的小RNA序列。WT和突变文库中的大多数小RNA是21-24 NT(图2),这是在骰子衍生产品的典型尺寸范围内,并与大多数以前报道的结果一致。其中24个nt小rna最为丰富。
WT和GMS突变体花药发育过程中小RNA表达的变化
三个WT库中miRNA和siRNA的总数大于三个相应的GMS突变库库(附加文件1).三个WT文库中独特mirna的数量与三个GMS突变文库中不同。此外,Mar-F-1库中独特miRNAs的数量是Mar-S-1库的两倍,且Mar-F-1库中独特sirna的数量也显著大于Mar-S-1库(附加文件)1).
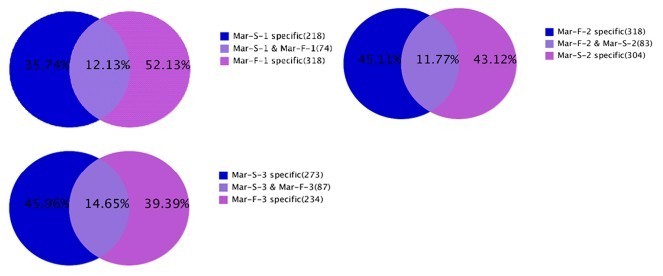
分析WT及其GMS突变体三种制育阶段的miRNA变化,我们发现MAR-S-1和MAR-F-1分别组成了独特MiRNA的35.74%和52.13%;MAR-S-2和MAR-F-2图书馆分别组成45.11%和43.12%;和Mar-S-3和Mar-F-3图书馆分别组成45.96%和39.39%。在相同的三种制育阶段,WT和其GMS突变体之间仅在WT及其GMS突变体之间共享12.13%,11.77%和14.65%(图3.).因此,在GMS突变体中发现的大多数独特的miRNA与相应阶段的WT白皮器中的那些不同。
上述结果表明,与可育野生型相比,‘Dong A’GMS突变体的花药发育过程中已经存在各种小RNA调控。这些不同的小RNA品种和不同的小RNA调控可能针对影响花药发育和雄性不育的不同基因。
棉花保守mirna的鉴定
将小RNA序列与已知的棉花miRNAs进行比对,分别发现了405,829和192,554对Mar-F-1和Mar-S-1文库的匹配。在Mar-F-2和Mar-S-2文库中,分别有496,607个和402,146个与WT和突变体匹配。在Mar-F-3和Mar-S-3文库中,WT和突变体分别有1,108,399和767,638个匹配项(附加文件2).
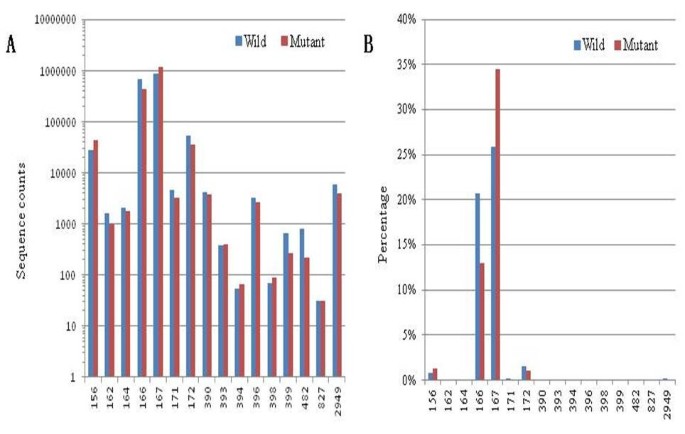
在6个小RNA库中鉴定出16个保守的棉花miRNA家族,包含3,373,236个个体候选miRNA reads,其中Gh-miR167和Gh-miR166家族数量最多,其次是Gh-miR172和Gh-miR156家族(图)4A).在所有保守的棉花miRNA reads中,Gh-miR167在WT和突变体库中占主导地位,分别占25.8%(在三个WT库中)和34.5%(在三个GMS突变体库中)4b)。接下来是GH-MIR166,分别占WT和突变库中的20.7%和12.9%。相比之下,一些其他miRNA家庭在花药中表现出非常低的表达丰度,读数非常较低。这些miRNA家族的各种丰富表明,MiRNA基因在花药开发期间差异转录。
通过对WT及其GMS突变体花药miRNA表达的分析发现,Gh-miR394、Gh-miR396、Gh-miR398、Gh-miR399和Gh-miR482在减数分裂阶段存在差异表达,其中3个(Gh-miR394、Gh-miR398和Gh-miR399)在四分体阶段也存在差异表达,其中2个(Gh-miR399)在四分体阶段存在差异表达,其中3个(Gh-miR394、Gh-miR398和Gh-miR399)在减数分裂阶段存在差异表达。Gh-miR398和Gh-miR482)以及Gh-miR827在单核小孢子期差异表达(附加文件)3.).因此,在所有三个阶段和GH-miR394,GH-miR399和GH-miR482中,GH-miR398在两个花药的发育阶段之间的差异表达,GM-MIR399和GH-MIR399和GH-MIR482各自差异地表达。
降级图书馆建设与保守miRNA目标的验证
在棉花中,保守的miRNA靶点以前主要是通过生物信息学预测确定的[27],只有少数保守的miRNA靶点被实验验证[28].在本研究中,为了鉴定miRNA靶点,我们从WT和GMS突变体的花药中构建了一个降解文库,并进行了测序,获得了2460万个原始reads。在去除低质量序列和适配器序列后,获得2440万个干净读取,98%的读取长度达到预期的20或21 nt(附加文件4)的正常长度分布峰在20 - 21 nt之间[29].在unique signatures中,获得了950万个长度为20和21 nt的不同reads, 568万个(59.8%)标记(被称为mapping reads)被完美地映射到棉花转录本组合数据库(DFCI-Cotton Gene Index, release 11.0)中的参考序列。占81.3%(95,966)。这些数据表明,降解文库具有高质量和良好的基因组覆盖率,可用于识别降解的mRNA靶点,这些靶点应该包含miRNA定向切割产生的序列谱。
通过序列比对,在GRODOME库中检测到145个独特的miRNA的总共896个不同的转录物(附加文件5).基于生物学过程的基因本体(GO)类别显示,这些miRNA-靶基因与32个生物过程有关(如附加文件所示6);五种最常见的术语是调节细胞过程,代谢过程,对刺激,大分子代谢过程和初级代谢过程的响应,表明这些miRNA在棉花花药开发期间基因规定的重要性。
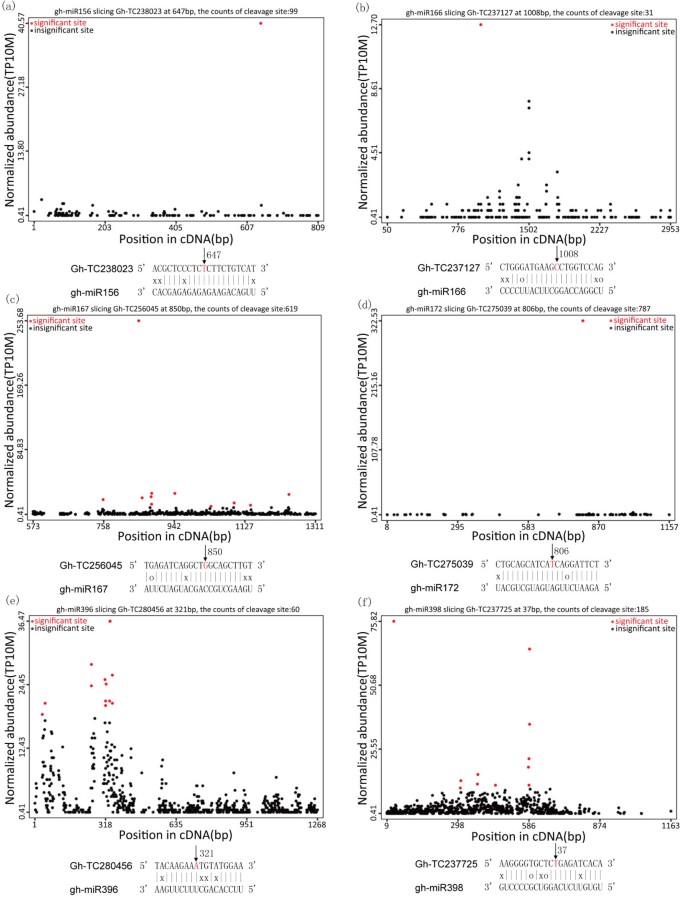
如上所示,通过降级分析捕获了许多保守的miRNA的目标,这提供了实验证据来支持以前的预测。降低组分析结果显示,GH-MIR156,GH-MIR166,GH-MIR167,GH-MIR172,GH-MIR396和GH-MIR398定向SBP-BOX的切割(TC238023,图5a)、III类HD-Zip样蛋白(TC237127,图5b)、生长素响应因子4 (TC256045,图5c)、AP2 (TC275039,图5d),Acc氧化酶3(TC280456,图5e)、Cu/Zn超氧化物歧化酶(TC237725,图5F)基因,分别是涉及激素信号、细胞模式和抗氧化代谢的关键基因。这些通过降解组测序确定的miRNA靶点以靶图(t图)的形式存在,靶图绘制了与转录本位置相关的标记丰度[30.].在每一个t图中,在Gh-miR156、Gh-miR166、Gh-miR167、Gh-miR172、Gh-miR396或Gh-miR398的预测切割位点上都发现了标签绝对数量的清晰峰值(附加文件)7),表明裂解位置与t图上的显著位点有对应关系。
通过TaqMan microRNA检测验证miRNA和靶蛋白表达
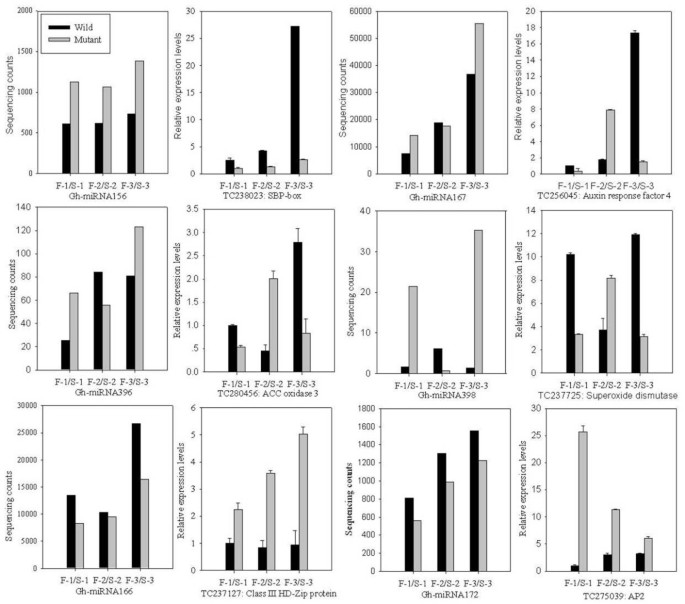
为了检测花药发育三个阶段的miRNA表达并验证测序结果,我们检测了Gh-miR156a、Gh-miR166a、Gh-miR167、Gh-miR172、Gh-miR396a和Gh-miR398,以验证这些miRNA在WT和GMS突变体花药中的表达是否存在显著差异(附加文件)8).miRNA表达模式与测序结果相似,说明小RNA测序结果可靠。
为了检验miRNA与其靶点是否存在相关性,我们比较了基于定量RT-PCR (qRT-PCR)检测到的miRNA靶点的表达模式(图)6).如果miRNA降解其靶mRNA转录本,其表达水平可能呈负相关。正如预期的那样,大多数miRNA的表达水平与相应mrna的表达水平呈负相关。在花药发育的三个阶段,Gh-miR156在GMS突变体中的表达水平相对高于WT,而其编码SBP-box的靶基因(TC238023)的表达与预期相反(图)6).出乎意料的是,与GMS突变体相比,该靶基因在WT花药单核期的表达比例较高,而在单核期Gh-miR156的表达水平相对较低(图)6).Gh-miR167与其编码生长素应答因子4(ARF4)的靶点(TC256045)以及Gh-miR398与其编码Cu/Zn超氧化物歧化酶的靶点(TC237725)在第1阶段和第3阶段的关系也有相似的趋势(图)6).与WT相比,GMS突变体化合物具有较高的两种miRNA的表达水平和在减数分裂和无核阶段的靶基因的降低表达。相反,TETRAD阶段的GMS突变分子在MIRNA的表达水平中具有相似(在GH-MIR167)或更低(在GH-MIR396和GH-MIR398)的表达水平,但相比,它们的靶基因具有显着更高的表达水平用wt(图6).与Gh-miR156类似,与WT相比,GMS突变体花药单核小孢子阶段Gh-miR167表达上调,而编码ARF4的靶基因(TC256045)表达较低(图)6).
反向趋势指出Gh-miR166及其目标基因编码之间的第三类HD-Zip Gh-miR172及其之间的蛋白质(TC237127)和目标基因编码AP2 (TC275039) GMS变异而WT。Gh-miR166的表达水平和Gh-miR172 GMS突变明显低于WT在3在花药发育的各个阶段,而它们的目标基因则相反6).需要指出的是,除Gh-miR166外,mirna与其靶基因的表达水平均存在负相关,但线性相关系数(r= 0.64 ~ 0.98)不具有统计学意义,部分原因是仅采集了3个花药发育阶段的样本。mirna与其靶基因表达水平的非线性关系也可能表明靶基因的表达还有其他调控机制。
新型候选miRNA的分析
鉴于普满棉花基因组的测序不完整,并且关于棉花小RNA群体的信息未知,准确地鉴定棉花中的非保守miRNA是一项艰巨的任务。在BLASTN搜索和发夹结构预测之后(参见材料和方法),110个占用独特G.Hirsutum.在6个小RNA库中检测到mirna(附加文件)9),包括33款在Mar-F-1图书馆,19个Mar-F-2图书馆,45位在Mar-F-3库中,在Mar-S-1图书馆中有6个,在Mar-s -2库和2在Mar-S-3库中(表2).这些新识别的miRNA所有符合miRNA注释的标准[31].
比较WT和GMS突变体花药中这些新mirna的表达,分别有43、22和56个新mirna在减数分裂、四分体和单核小孢子阶段有显著差异表达(附加文件)10).这些新mirna的靶基因的鉴定表明它们可能参与花药发育的各个方面。例如,新的miRNA Mar-F-1-m0031被鉴定为靶向基因编码运输抑制应答1 (TIR1, IAA的受体,附加文件11),可通过形成SCFTIR1复合物直接与生长素结合,是26S蛋白酶体Aux/IAA降解途径的关键蛋白[32].
讨论
小rna调控花药发育的许多方面。然而,目前尚无研究报道mirna与棉花雄性不育的关系。为了解导致棉花GMS突变体雄性不育的分子基础,本研究在‘Dong A’WT及其GMS突变体花药发育过程中构建了6个小RNA库。据我们所知,目前的研究代表了第一个这样的尝试。
共检测到数百万个18-30 nt的独特小RNA序列,其中110个是新的mirna,从而丰富了棉花已知的独特小RNA的数量。本研究共检测到16个保守的miRNA家族。许多典型mirna在苔藓、双子叶植物和单子叶植物中是保守的,有些在陆生植物中具有保守的功能[33].例如,棉花中成熟的规范GH-miR167与杨树和拟南芥中的成熟典型GH-miR167相同。这些保守的miRNA可能在棉花花药开发中发挥重要作用,因为它们的许多目标介导生物途径,例如养阴反应和细胞图案,基于先前的研究,在调节时间的发展中,如此:34].
Gh-miR167和Gh-miR166在‘Dong A’WT及其GMS突变体的花药发育过程中主要表达(图)4),表明对棉花花药发育具有重要的调控作用。本研究分别鉴定Gh-miR167和Gh-miR166靶向ARF4和III类HD-Zip样蛋白。与野生型相比,Gh-miR167在单核小孢子期表达水平较高,导致GMS突变体花药中ARF4下调10倍(图)6).ARF4的低得多的表达水平可能影响GMS突变体中的生长素响应途径,其与GMS突变体的无核微孔阶段中IAA的较低含量一致(附加文件12).在拟南芥中,miR166被认为针对编码III类hd - zip样蛋白的mrna,该蛋白在茎尖分生组织起始和叶子极性和模式形成中起关键作用[35,36].然而,与野生型相比,GMS突变体花药中Gh-miR166水平较低与雄性不育的关系目前尚不清楚,需要进一步研究。
miR156和miR172分别针对SQUAMOSA启动子结合蛋白转录因子(SBP-box)和APETALA2 (AP2),预测它们在花药发育中发挥重要作用[37,38].miR156直接抑制SBP-box转录因子的表达,SBP-box转录因子在整个植物界的幼体到成体转化中发挥重要作用[39].已经表明,MIR156通过SBP-BOX直接促进MIR172的转录,MIR172作用于MIR156的下游,以促进成年表皮标识[40].此外,MiR156调节的SBP-Box是一种直接上游活化剂的叶状,富有氟化物和Apetala1 [41].在本研究中,Gh-miR156和Gh-miR172在‘Dong A’WT及其GMS突变体中中度表达(图)4).与野生型相比,GMS突变体三个花药发育阶段的花药Gh-miR156表达量较高,其靶蛋白SBP-box表达量较低。相反,miR172的过度表达导致拟南芥和水稻的雄性不育[20.,38[我们检测到在三种制动阶段的GMS突变体中,检测到GH-miR172的较低水平的GH-miR172和其靶AP2的表达水平较高水平(图6).因此,miR156/miR172与GMS突变体雄性不育的关系可能是不同的,需要进一步研究。
Gh-miR396被鉴定为靶向ACC氧化酶3 (TC280456), ACC氧化酶3是乙烯生物合成过程中的关键分支点酶[42].在花药的发展中,乙烯对于雄性配子萌发和花药裂开是重要的[43,44]据报道,肥沃的男性配子体发育伴随着在花药组织中的乙烯生产峰的两个峰,并且成熟的花粉的特征在于高含量的乙烯[45].在目前的研究中,GH-MIR396在分裂阶段的“东A”WT及其GMS突变体中差异表达,并且在无核微孔阶段的GMS突变体中具有更高水平的表达。这与其靶基因Acc氧化酶3的相对较低水平的相对较低(图6).然而,GMS突变体的GM-MiR396及其靶基因的相反表达,导致乙烯合成显着降低的乙烯合成的显着降低。
Gh-miR398靶向编码Cu/Zn超氧化物歧化酶(Cu/Zn SOD)的mRNA (TC237725),在植物抗氧化代谢中起重要作用[46].在植物中,活性氧(ROS)在程序性细胞死亡(PCD)的诱导、信号传导和执行中的重要作用已经被揭示[47].ROS可以触发细胞色素的释放c,这是ros衍生的PCD特征,哺乳动物、植物和酵母线粒体共有[48].以往的研究表明,O2-2和H.2O2,活性氧清除酶活性显著降低与棉花细胞质雄性不育雄性细胞死亡相一致[49].Budar和Pelletier推出了棉雄性无菌系及其维护者之间的SOD基因表达的差异可能导致ROS代谢和雄性不育的不平衡[50].在本研究中,我们展示了不同潜在的miRNA途径,其可以调节WT及其GMS突变体中的酶活性。令人惊讶的是,与WT花药相比,GH-miRNA398在20倍上调,其靶基因Cu / Zn Sod在GMS突变分子的无核微孔阶段中表达得多。6).老年病的细胞色素c在GMS突变体花药的相应阶段中观察到三倍的突变体(附加文件13).Cu/Zn SOD活性降低,细胞色素表达水平升高c在GMS突变体花药中可能导致短暂的氧化爆发和显著的ROS积累。然而,需要更多的研究来了解导致GMS突变体男性不育的潜在机制。
结论
利用深度测序技术,鉴定了棉花花药发育三个阶段表达的多个mirna。mirna在GMS突变体和WT突变体中的表达差异表明,mirna与棉花花药发育和雄性不育有关。进一步研究这些差异表达的mirna及其在花药中的作用靶点,将有助于更好地了解棉花雄性不育的调控机制。
方法
植物材料和花药收集
旱棉(G.Hirsutum.在中国农业科学院棉花研究所试验场常规大田条件下,对‘东亚’(WT)植株和‘东亚’背景下的GMS突变体进行了试验。前期研究表明,当花蕾纵向长度分别达到5.0mm、6.5mm和9mm时,GMS突变体花粉母细胞进入减数分裂、四分体和单核期[51].根据此取样标准,结合显微镜检查,在清晨采集三个不同生长阶段的发育花药。取下的花药用液氮冷冻,保存在−80℃下进行分析。
小RNA测序和图书馆建设
根据制造商的说明,使用Pbiozol总RNA提取试剂(BiofLux)从花药中提取总RNA。然后用乙醇沉淀RNA,溶解在二甲基碳酸碳酸酯(DEPC)水中并储存在-80℃。检查蛋白质污染的所有RNA样品(a260/一种280和试剂污染(A260/一种230使用Nanodrop ND 1000分光光度计(Nanodrop, Wilmington, DE)。
从WT和GMS突变体花药中提取的样本进行量化和均等化,以便分析等量的RNA。提取的总RNA在变性的15%聚丙烯酰胺凝胶上分离。取18-30 nt大小的凝胶片段,小RNA片段用0.5 M NaCl在4℃下洗脱过夜,用乙醇沉淀。这些18-30 nt小rna被给予5”和3.”用T4 RNA连接酶连接的RNA适配器。随后通过超级脚本II逆转录酶(Invitrogen)随后转录到CDNA中并用聚合酶链反应扩增,使用引物退出在适配器的末端的引物进行扩增。纯化并回收扩增的cDNA产物。最后,使用SOLEXA测序技术对小RNA样本进行序列(BGI,深圳,中国)。
测序数据分析
使用BGI(深圳)的Illumina 1G基因组分析仪在BGI(深圳,中国)中生产的原始序列读数,并通过BGI小型RNA管道加工成清洁的全长读数。在此过程中,删除了所有低质量读取,例如用3读数”和5”适配器污染物,那些没有插入标签,和那些poly A序列。剩余的高质量序列被剪去其适配序列,大于30 nt或小于18 nt的序列被丢弃。所有高质量的序列,即使只有一个唯一的读取,都被认为是重要的,并用于进一步分析,序列保存在NCBI中,登录号为GSE43531。
进行Chi-Square测试以确定在前描述的方法后WT和GMS突变体小RNA文库之间的统计学意义[52].
鉴定小说麦芽糖
为了识别六个小RNA文库中的潜在新的miRNA,棉转录物组件(http://occams.dfci.harvard.edu/pub/bio/tgi/data/Gossypium)被选中绘制独特的小RNA序列。miRNA前体的发夹结构特征被用来预测可能的新miRNA。miRNA预测软件mireap也被用来预测基于二级结构、Dicer裂解位点和最小自由能(http://sourceforge.net/projects/mireap/).
通过降低测序鉴定miRNA及其目标
小rna与miRNA前体/成熟miRNA在miRBase中对齐(http://www.mirbase.org/index.shtml, 15.0版本)。采用以下标准来确定不同组织样本中miRNA家族的序列计数:(1)如果miRBase中有棉花miRNA信息,则将小rna与相应的棉花miRNA前体/成熟miRNA进行比对;(2)如果miRBase中没有棉花的miRNA信息,则将小rna与数据库中所有植物的miRNA前体/成熟miRNA进行比对。
大多数植物mirna通过精确地切割第10和第11个核苷酸(nt)来促进其mRNA靶点的降解”miRNA的末端。因此,3”靶mRNA的片段在其5处具有单磷酸盐”结束。这一重要属性已被用于验证miRNA靶点[53].在该研究中,为了在WT和GMS突变体中对MiRNA引导的基因调节进行筛查,如前所述构建适用于miRNA靶标鉴定的降低组文库[29].简单地说,从WT和GMS突变体花药中分别提取三个发育阶段的总rna,以等摩尔比混合作为一个样本。大约200 μg混合总RNA使用Oligotex mRNA mini kit (Qiagen)进行聚腺苷酸化。使用T4 RNA连接酶(Takara), 5”在裂解产物中加入RNA适配器,其具有自由的5”- 磷酸磷酸盐在3时”Termini。然后使用Oligotex mRNA mini试剂盒(qiagen)纯化连接的产物,用于逆转录,以通过上标II Rt(Invitrogen)使用寡聚DT引物产生第一链CDNA。使用Phusion Taq(NEB)将CDNA文库扩增6个循环(304℃,60℃,60℃,72℃,和72℃),用限制酶消化PCR产物居里夫人我(内)。然后用T4 DNA连接酶(NEB)将双链DNA适配器连接到酶切产物上。根据大小选择连接产物,运行10%聚丙烯酰胺凝胶,纯化最终PCR扩增(94℃30 s, 60℃20 s, 72℃20 s) 20个循环。PCR产物经凝胶纯化,利用Illumina HiSeq 2000进行高通量测序。
在序列分析之前除去低质量序列和适配器,并在NCBI中沉积清洁序列,并附有GSE43389的登录号。独特的序列签名与棉花基因指数中的棉转录物组件数据库对齐(第11.0份,http://occams.dfci.harvard.edu/pub/bio/tgi/data/Gossypium)使用SOAP软件(http://soap.genomics.org.cn/).CleaveLand用于基于降解序列检测潜在的剪切目标。如前所述,20和21 nt不同的reads经过CleaveLand管道用于小RNA靶点的鉴定[54].简单地说,20和21 nt不同的读取首先被规范化为“每百万读取”(RPM)。随后,将降解组reads映射到棉花注释cDNA (DFCI-Cotton Gene Index, release 11.0)中,并记录每个降解组reads的cDNA命中数。将目标文库中的原始丰度按公式归一化:归一化丰度(TP10M) =原始丰度/(总基因组匹配- (t/r/sn/snoRNA))*10,000,000。分数不超过4分且为5分的所有对齐”保留了与小RNA互补的第10和第11个核苷酸的降解序列末端。为了评估mirna靶向基因的潜在功能,基因本体论(GO)分类(http://www.geneontology.org/),根据上述方法对已鉴定的靶基因进行分配[55].
mirna的qRT-PCR
QRT-PCR反应在含有10μL的10μL的10μL的10μL的最终体积中进行,含有10μL20012×托管通用PCR主混合物,1μL20×Taqman MicroRNA测定引物和探针,7.67μL无核酸酶,与RT反应的1.33μL产物ABI 7500实时PCR系统(Applied Biosystems)。将反应在96孔板中在95℃下在95℃下孵育10分钟,然后在95℃下进行40个循环,持续15s和60℃。棉18s用于标准化基因特异性RT-PCR产品的量[56].
参考
- 1.
王振华,邹艳杰,李学勇:水稻Boro II细胞质雄性不育是由细胞毒肽引起的,并通过不同的mRNA沉默方式由两个相关的PPR基序基因恢复。acta botanica sinica, 2017, 36(4): 457 - 461。
- 2.
细胞质雄性不育和育性恢复的分子基础。植物科学进展。1998,3:175-180。
- 3.
voinnet o:植物microRNA的起源,生物发生和活性。细胞。2009,136:669-687。
- 4.
Carrington JC,Ambros V:MicroRNA在植物和动物发育中的作用。科学。2003,301:336-338。
- 5.
植物的RNA沉默。自然科学。2004,431:356-363。
- 6.
Filipowicz W,Jaskiewicz L,Kolb Fa,Pillai Rs:SiRNA和MiRNA的转录后基因沉默。CurrOgin struct Biol。2005,15:331-341。
- 7.
Rhoades MW, Reinhart BJ, Lim LP, Burge CB, Bartel B, Bartel DP:植物microRNA靶标的预测。细胞。2002,110:513-520。
- 8.
何丽,Hannon GJ:小rna在基因调控中的重要作用。作者简介:王志强,男,博士,2004年第5期。
- 9.
郭旭,桂颖,王勇,朱庆华,Helliwell C,樊丽:水稻进化过程中microRNA靶标序列的选择与突变。基因组学杂志。2008,9:1-10。
- 10。
李安,毛丽:植物microRNA基因家族的进化。Cell res2007, 17: 212-218。
- 11.
Maher C,Stein L,洁具D:通过复制事件演变MicroRNA家族。Genome Res。2006,16:510-519。
- 12.
陈曦:植物MicroRNA的生物发生和功能。FEBS Lett. 2005, 579: 5923-5931。
- 13.
Alvarez-Garcia I,Miska EA:MicroRNA在动物发育和人类疾病中的作用。发展。2005,132:4653-4662。
- 14.
microRNA在植物发育中的作用。植物生态学报,2005,8(1):38-44。
- 15.
Juarez Mt,Kui Js,Thomas J,Heller Ba,Timmermans MC:MicroRNA介导的卷叶镇压指定玉米叶极性。自然。2004,428:84-88。
- 16.
Hovav R,Udall Ja,Hovav E,Rapp R,鞭毛L,Wendel JF:大多数棉花基因在单纤维纤维中表达。Planta。2008,227:319-329。
- 17.
Griffiths-Jones S, Saini HK, Van Dongen S, Enright AJ: miRBase: microRNA基因组学工具。核酸学报2008,36(4):594 - 598。
- 18.
赵志强,王志强,王志强,等。microRNA和aptala2 -like靶基因对开花时间和花器官特性的调控。acta botanica sinica(云南植物学报),2003,27(5):457 - 461。
- 19.
Robert GD, Said H, David T, Hugh GD:小RNA通路在被子植物雄性配子体中存在并发挥作用。植物保护学报。2009,32(2):457 - 461。
- 20。
陈晓敏:拟南芥APETALA2转录抑制因子的翻译。科学进展。
- 21。
Ru P,Xu L,Ma H,Huang H:MicroRNA167增强表达诱导的植物生育缺陷。细胞res。2006,16:457-465。
- 22。
韩国伟,张冬梅,黄应祥,郭玉刚,史松松,李志刚,高德昆,冯国宝:棉花雄性不育隐性基因在杂交种生产中的应用(G.Hirsutum.).农业科学,1988,1:5-11。
- 23.
Thomson JM,Parker J,Perou CM,Hammond SM:用于分析MicroRNA基因表达的自定义微阵列平台。NAT方法。2004,1:47-53。
- 24.
Bentwich A,Avniel A,Karov Y,Aharonov R,Gilad S:鉴定数百个保守和非折衷的人体microRNA。NAT Genet。2005,37:766-770。
- 25.
梁雷克,李波,李益,棕褐色,李爵士,金yx,阮kc:基于标记RNA与量子点和纳米多元探针的微瘤表达分析的寡核苷酸微阵列。核酸RES。2005,33:17-23。
- 26.
盛志慈:棉花雄性不育研究论著。成都:四川科学技术出版社;1989.
- 27.
邱CX,谢佛,朱益,郭k,黄sq,nie l,杨zm:微润罗斯的计算鉴定及其在Gossypium hirsutum表达序列标签中的靶标。基因。2007,395:49-61。
- 28.
关键词:异源四倍体棉花,胚珠,纤维发育,miRNA, siRNA陆地棉L)。生物医学工程学报。2009,10:1-21。
- 29.
通过拟南芥测序测序鉴定的Addo-Quaye C,Eshoo Tw,Bartel DP,Axtell MJ:内源性siRNA和miRNA靶标识分。Curr Biol。2008,18:758-762。
- 30.
MA, Pillay M, Jeong DH, Hetawal A, Luo SJ, Janardhanan P, Kannan V, Rymarquis LA, Nobuta K, German R, Paoli ED, Lu C, Schroth G, Meyers BC, Green PJ: microrna靶向RNA对的整体鉴定。生物工程学报。2008,26:941-946。
- 31。
Meyers Bc,Axtell MJ,Bartel B,Bartel DP,Baulcombe D,Bowman JL,Cao XF,Carrington JC,Chen XM,Green PJ,Griffiths-Jones S,Jacobsen SE,Maltienssen Ra,Poethig Rs,Qi Yj,VAUCHERET H,Voinnet O,Watanabe Y,Weigel D,Zhu JK:植物MicroRNA的注释标准。植物细胞。2008,20:3186-3190。
- 32。
Kepinski S, Leyser O:拟南芥F-box蛋白TIR1是生长素受体。自然资源学报。2005,435:446-451。
- 33。
Axtell MJ, Snyder JA, Bartel DP:陆地植物不同小rna的共同功能。acta botanica sinica(云南植物研究中心),2007,19(4):427 - 434。
- 34。
关键词:拟南芥,ARF6, ARF8, microRNA167,雄性和雌性生殖发展。2006,133:421 -4218。
- 35.
陈志强,陈志强,陈志强:miR166g及其靶基因对拟南芥茎尖分生组织和侧枝器官形成的调控。发展。2005,132:3657-3668。
- 36.
Mallory AC, Reinhart BJ, Jones-Rhoades MW, Tang G, Zamore PD, Barton MK, Bartel DP: MicroRNA对PHABULOSA叶片发育的控制:与MicroRNA 5 '区配对的重要性。国家自然科学基金青年基金,2004。
- 37.
Wang JW, Czech B, Weigel D: mir156调控的SPL转录因子在拟南芥开花过程中的作用。细胞。2009,38:738-749。
- 38.
朱QH,Upadhyaya NM,Gubler F,Helliwell CA:MiR172的过表达导致稻米穗的损失和稻米花器官异常奥雅萨苜蓿).BMC植物生物。2009,9:1-13。
- 39.
Schwab R,Palatnik JF,Riester M,Schommer C,Schmid M,Weigel D:MicroRNA在植物转录组上的特定效果。DEV细胞。2005,8:517-527。
- 40。
吴G,公园我,Conway SR,王JW,Weige D,Poethig Rs:MiR156和MiR172的顺序动作调节拟南芥的发育时间。细胞。2009,138:750-759。
- 41。
Yamaguchi A,Wu MF,Yang L,Wu G,Poethig Rs,Wagner D:MicroRNA调节的SBP-Box转录因子SPL3是叶状,富有氟化物和Apetala1的直接上游活化剂。发育细胞。2009,17:268-278。
- 42。
乙烯:植物中的一种气体信号分子。细胞生物学杂志。2000,16:1-18。
- 43。
林志强,钟树生,Grierson D:乙烯研究进展。中国生物医学工程学报。2009,30(4):457 - 461。
- 44。
王玉华,王玉华,王玉华:矮牵牛花中两种乙烯受体的特性:pher1和pher2调控花药开裂的时间。中国生物医学工程学报。2007,31(4):531 - 534。
- 45。
Kovaleva LV,Dobrovolskaya A,Voronkov A,Rakitin V:乙烯参与了喇叭绦虫的男性配子瘤发育和萌发。J工厂增长调节。2011,30:64-73。
- 46。
Dugas DV,Bartel B:拟南芥蔗糖诱导MiR398压制了两个Cu / Zn超氧化物歧化酶。植物mol biol。2008,67:403-417。
- 47.
活性氧在植物细胞死亡中的作用。植物营养与肥料学报。2006,31(4):489 - 494。
- 48.
Lorrain S,Vailleau F,Balague C,Roby D:病变模拟突变体:用于破解细胞死亡和植物防御途径的键。趋势植物SCI。2003,8:263-271。
- 49.
江庞,张XQ,朱益,朱慧,谢璐,王XD:棉细胞质雄性不育中反应性氧物种的代谢及其恢复。植物细胞代表2007,26:1627-1634。
- 50.
Budar F,Pelletier G:植物中的雄性不育:发生,确定性,意义和使用。C R ACAD SCI III。2001,324:543-550。
- 51。
侯丽,肖艳华,李晓波,王文芳,罗晓燕,裴艳:“东A”棉花雄性不育系与可育系花药发育过程中的cDNA-AFLP差异显示。遗传学报,2002,29:359-363。
- 52。
数字基因表达谱的重要性。基因组Res. 1997,7: 986-995。
- 53。
关键词:拟南芥,拟南芥,miRNA,稻草人样mRNA自然科学学报,2003,23(4):453 - 456。
- 54。
Addo-Quaye C,Miller W,AXTELL MJ:Cleaveland:用于使用降级数据查找切割的小型RNA目标的管道。生物信息学。2009,25:130-131。
- 55。
杜Z,周X,凌Y,张Zh,Su Z:Agrigo:农业社区的GO分析工具包。核酸RES。2010,38:W64-W70。
- 56。
关键词:番茄,病毒感染,茎环实时RT-PCR,小分子rna基因。2009,437:14-21。
确认
感谢国家重点基础研究发展计划(No. 2010CB126006)和国家863计划(No. 2011AA10A102)对本课题的资助。
作者信息
隶属关系
相应的作者
附加信息
作者的贡献
MMW,SXY,SLF和JWY设计了实验。SLF进行了现场棉花植物栽培和花药收集。MZS构思了这项研究,参与了其设计,以及起草并修改了手稿。MMW编写了稿件草案和ZJF编辑并修改了手稿。MMW,HLW和WM执行了实验。所有作者阅读并认可的终稿。
电子辅料
12870_2012_1773_moesm3_esm.xlsx.
附加文件3:六个小RNA中显着差异表达的棉花保守miRNA的数量。(XLSX 16 KB)
12870 _2012_1773_moesm5_esm.xlsx
附加文件5:在降解库中检测到的独特mirna靶向的不同转录本的数量。(XLSX 46 KB)
12870_2012_1773_moesm6_esm.jpeg
附加文件6:在WT和GMS突变体花药中鉴定的miRNA靶基因的GO分析,代表发育的三个阶段。(JPEG 88 KB)
12870 _2012_1773_moesm8_esm.jpeg
附加文件8:将鉴定的棉花mirna的qRT-PCR结果与相应mirna的Solexa测序结果进行比较。(a), (c), (e) miRNAs Solexa测序结果;(b), (d), (f) mirna的qRT-PCR结果。F-1和S-1:野生和突变体花药减数分裂阶段;F-2和S-2:野生和突变体花药的四分体阶段;F-3和S-3:野生和突变花药的单核小孢子阶段。以18S作为对照,计算相对表达量(r.e.l)。(JPEG 229 KB)
12870 _2012_1773_moesm10_esm.xlsx
附加文件10:6个文库中显著差异表达的新型棉花miRNA的数量。(XLSX 23 KB)
使用降低测量测序的鉴定的新型miRNA(MAR-F-1-M0031)靶标靶图(T-PLOTO)。
附加文件11:每个签名的丰度作为其在文本中的位置的函数绘制。靶转录本上的红色斜体核苷酸”End表示在降级库中检测到的分裂位点。(JPEG 409 KB)
12870 _2012_1773_moesm12_esm.jpeg
附加文件12:利用高效液相色谱法测定WT和GMS突变体花药单核小孢子阶段IAA含量。F-3和S-3:单核小孢子期野生型和突变型花药。(JPEG 27 KB)
细胞色素的QRT-PCR结果
额外的文件13:c在WT和GMS突变体的花药中。(XLSX 15 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
魏敏,魏华,吴敏。et al。MiRNA在遗传性雄性无菌和野生型棉花种植过程中MiRNA的比较表达分析。BMC植物杂志13,66(2013)。https://doi.org/10.1186/1471-2229-13-66
已收到:
接受:
发表:
关键字
- 男性不育
- 细胞质雄性不育
- 花药开发
- 降级序列
- 基因雄性不育