摘要
背景
该基因编码PAD4.(植物抗毒素DEFICIENT4)需要在拟南芥几个基因的表达参与防御反应两pv。maculicola。AtPAD4(拟南芥PAD4)编码一种脂肪酶样蛋白,该蛋白在介导水杨酸信号传导中起调节作用。
结果
我们表达了编码的基因AtPAD4在复合植物的大豆根中测试能力AtPAD4防止植物寄生线虫发育。以大豆包囊线虫(SCN;异皮线虫属甘氨酸)和根结线虫(RKN;有隐姓埋名的女人).的表达AtPAD4接种后35 d,成年SCN雌株数量减少68%。同样,大豆的根表达AtPAD4当受到RKN的挑战时,显示出的胆汁减少了77%。
结论
我们的实验表明AtPAD4可用于经济上重要的作物大豆,以提供对两种不同属线虫的抗性测定。
背景
当植物对病原体的攻击作出反应时,诱导防御反应被激活[1].该基因对基因的防御反应是对病原体的植物抗性较强的形式。这种类型的电阻被接通时的植物具有的比电阻(R),该基因识别相应的病原体基因的产物,称为无毒性(avr的)基因。这种相互作用R- 那烯和an ..avr的-基因触发超敏反应(HR)和快速表达防御反应,导致细胞在感染24小时内程序性死亡[2].另一种类型的防御反应发生在被没有avr的-被植物识别的基因。在这种情况下,植物的反应比基因对基因的抗性反应更慢,这使得病原体得以繁殖。对毒性病原体的抗性可以通过一种称为系统性获得性抗性(SAR)的现象产生[3.],其过敏反应后发生。SAR减少由多种病原体产生的症状,但不是所有的病原体[4].水杨酸(Salicylic acid, SA)在基因间抗性和SAR中都起着重要的信号转导作用。通过构建表达细菌水杨酸羟化酶基因(nahG)将SA转化为邻苯二酚[5].在基因对基因的抗性或感染致病病原体时nahG植物不能表达致病机制相关的(PR)基因,它们对有毒和无毒病原体的易感性大大增强[5,6].
模型植物的突变体拟南芥已被用于研究sa依赖的植物防御反应的调控。某些防御信号的产生是由拟南芥PAD4(AtPAD4)基因。植物携带PAD4.突变显示SA水平降低,防御基因表达降低PR1,以及吲哚衍生物卡马毒素的合成减少后,感染了一种有毒的菌株两[7- - - - - -10.].相比之下,……的作用PAD4.为了防御桃蚜Myzus persicaeSulzer与SA和camalexin无关[10.,11.].报道称,PAD4.编码与甘油三脂酶和其他酯酶相似的核细胞质蛋白。在防御信号,PAD4.与…一起作用EDS1基因(疾病易感性增强1),它编码一种在细胞核和细胞质中也发现的结构相关的蛋白质[12.,13.].EDS1是PAD4蛋白积累所必需的[14.].EDS1还与另一种脂肪酶样蛋白SAG101(衰老相关基因101)相互作用,该蛋白在细胞核中积累[13.].植物细胞内EDS1-PAD4和EDS1-SAG101复合物的出现表明EDS1是PAD4和SAG101在防御信号传导中的适配器[13.].
虽然PAD4.已被广泛研究拟南芥在美国,人们对它在赋予线虫抗性方面的作用知之甚少,也不知道它是否AtPAD4可以在大豆等重要经济作物中发挥作用,提供对线虫的抗性。大豆包囊线虫(SCN;异皮线虫属甘氨酸)和根结线虫(RKN;Melidogyne Incognita.)是强制性的植物寄生虫,每年造成全球经济作物超过1000亿美元的产量损失[15.].这两种线虫建立自己的寄主植物内复杂的索饵场。一个t在fection, the pre-parasitic second stage juveniles (J2) penetrate the roots and migrate towards the vascular cylinder where they induce the growth of a multinuclear feeding site, termed a ‘syncytium’ produced by SCN and a ‘giant cell’ produced by RKN [16.].
在最佳条件下,SCN的生命周期可在30天左右完成,包括6个阶段:卵期、4个稚期和成虫期[17.].感染植物根的唯一阶段是J2,它是运动的,通常穿透宿主根并迁移到维管柱,同时分泌细胞壁降解酶[18.- - - - - -21.].一旦在那里,线虫通过它的茎管向宿主细胞注入蛋白质,诱导合胞体的形成[22.- - - - - -26.].合胞体形成过程中发生许多生理和形态变化:周围细胞壁部分溶解,细胞核扩大,细胞质内细胞器密度增加,内质网积聚[24.,27.,28.].合胞体的起始和形成是一个复杂的过程,需要由线虫食道腺体分泌物触发的未知宿主信号转导途径[18.,20.].在喂食点启动后,J2蜕皮至J3和J4阶段,最后发育成雌性或雄性成虫。雌性在进食的地方仍然是久坐不动的,而成熟的雄性则在根部活动以使雌性受精。雌性从合胞体中提取营养,以支持数百个卵子的生产,其中大部分留在雌性体内,而其他的则以胶状物质的形式排泄到土壤中。雌性死后,身体保持完整,并硬化成一个坚韧的皮质囊,称为囊肿。卵和幼虫可在包囊体内存活数年,直至在有利条件下受到刺激在土壤中孵化[18.,25.,26.].
RKN的生命周期从三周到几个月不等,取决于环境因素,如温度、湿度和合适宿主的可用性[29.].第二阶段的侵染幼体(J2)通过其茎管的穿透作用穿透寄主植物的根。一旦进入,线虫释放食管分泌物,诱导多核喂养细胞的形成。J2变得定居,进食,并经历三次蜕皮(J3, J4,成年)。偶尔,蠕虫状的雄性会发育并从根部迁移出去,而雌性则保持静止不动,在凝胶状基质中取食并产卵。胚胎发生始于卵子内部,而J2个体在首次脱壳后孵化[30.].
在这项工作中,我们证明了过度表达拟南芥基因AtPAD4在复合植物的转基因大豆根中,可以赋予SCN和RKN的抗性。
结果
农杆菌用红色荧光蛋白转化大豆根(RFP)
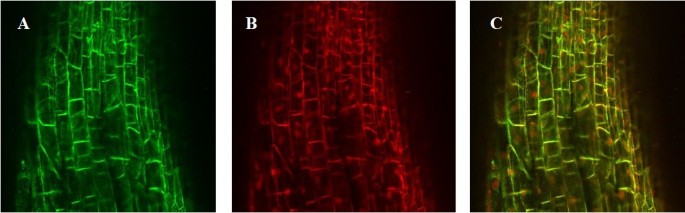
的rfp.基因被克隆到pRAP15载体中并在大豆根确认pRAP15矢量的过表达功能性表达(图1).通过在整个根中存在绿色荧光蛋白(eGFP)来鉴定转化的根(图)1一种)。强烈的红色荧光显示,玄参花叶病毒亚基因组转录(FMV)启动子成功地表达rfp.转化的大豆根中的基因。整个根部的强绿色荧光证明了的方式D启动子成功地驱动了egfp.基因(图1B).当图像重叠时,红色和绿色荧光被共定位(图1C).放大倍数为25倍。
农杆菌大豆根的转化AtPAD4
我们克隆了拟南芥PAD4(AtPAD4)基因进入PRAP15,用于复合植物的转基因大豆根中过表达。氨基酸序列AtPAD4(AT3G52430)中度保守,与大豆同源物Glyma08g00420.2最接近(图2).AtPAD4(AT3G52430.1)与GmPAD4 (Glyma08g00420.2)具有41.8%的氨基酸同源性。这两种蛋白质都含有一个脂肪酶3基序,该基序保存在许多蛋白质中。
100个豆豆植物受到根系转换的AtPAD4转基因植株中,55%的植株在种植28天后表现出转化的迹象。空pRAP15控制装置的转化效率为74%。将未转化的根部分修剪,再生长14天,将未转化的根全部切除,其余表现出强eGFP荧光的根接种RKN或SCN进行检测。
推测转基因植物的分子分析
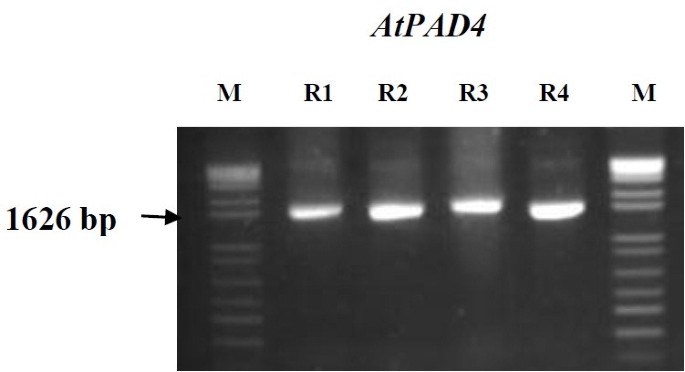
插入AtPAD4通过PCR检测转基因大豆植株中的基因片段(图)3.),使用基因特异性引物(表1).利用基因特异性引物扩增1626 bp的片段。对四种植物进行了测试,所有植物都显示含有转基因dna。未转化的对照根和空pRAP15转化的对照根均未检测到扩增。
qRT-PCR检测表达AtPAD4大豆根基因
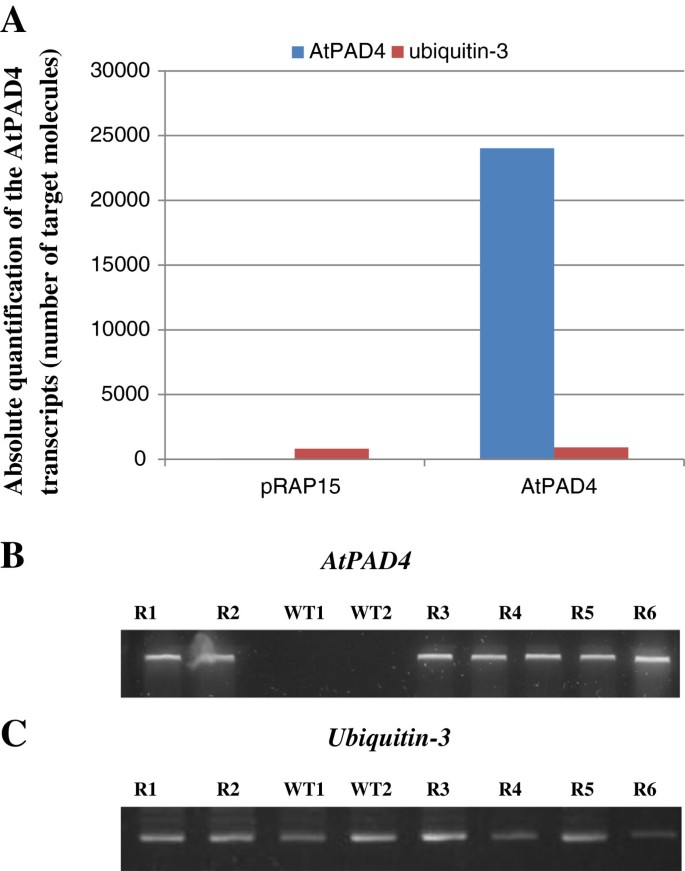
进一步分析表达eGFP的根的丰度AtPAD4使用基因特异性引物通过QRT-PCR基因转录物(表2).转录本的绝对定量(目标分子的数量)是使用s型方法计算的[31].AtPAD4过表达根的转录本丰富,而对照根没有检测到AtPAD4(图4A).抄本的数量AtPAD4在根中进行变换AtPAD4构建体被计算为24030个分子。虽然成绩单AtPAD4在含有空向量的控制根部没有可检测到的(图4b),在所有样品中,编码泛素-3的内政基因的转录物(图4C)。
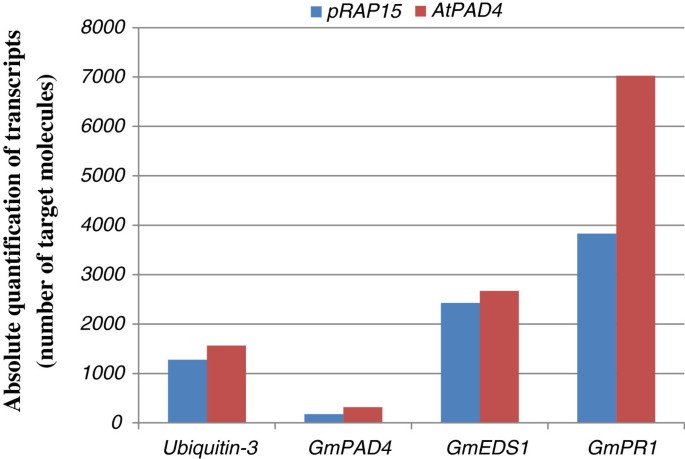
除了测量转录水平AtPAD4,我们还使用qRT-PCR来确定三个防御相关基因的转录本数量,GmPAD4;GmEDS1和GmPR1(图5).抄本的数量GmPAD4在根overexpressingAtPAD4几乎是对照根的两倍。在同一根中,转录本的数量GmEDS1在?之间没有显著变化AtPAD4 -过表达根和控制根。然而,抄本的数量GmPR1在AtPAD4 -过表达的根几乎是含有空载体的对照根的两倍。
的影响AtPAD4大豆根系抗性的过度表达
抗大豆孢囊线虫
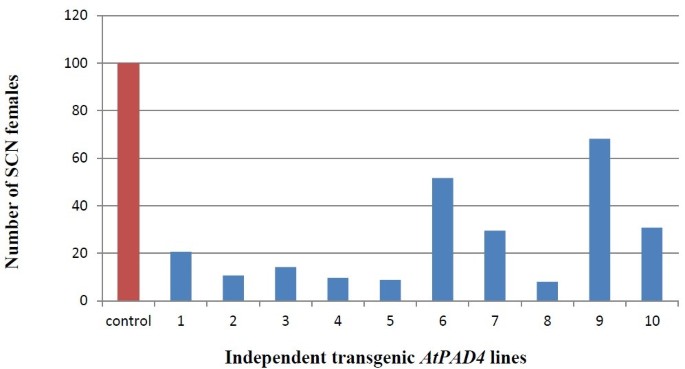
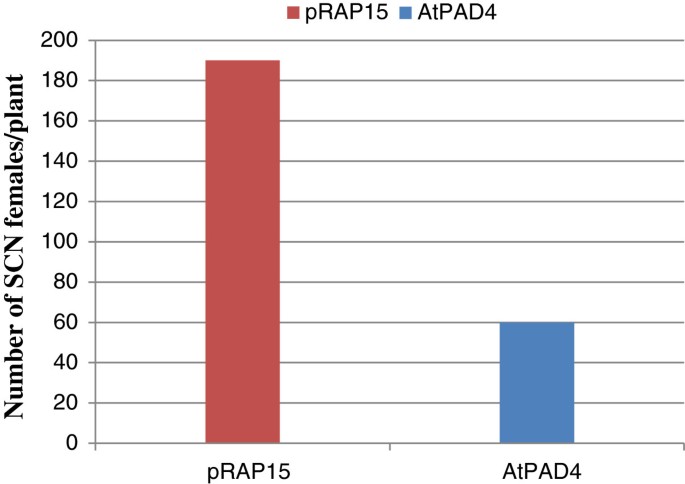
过度表达的效果AtPAD4本研究通过对敏感大豆品种‘Williams82’根系中SCN雌株数量的统计,研究了其对SCN雌株发育的影响AtPAD4 -接种后35天过度抑制和控制根(图)(图6).单株SCN雌株数平均减少68%AtPAD4-过表达根与pRAP15对照(图7).以每克根湿重的SCN雌株数表示,减少了76%AtPAD4-overexpressing植物。这些差异被认为有统计学意义(P<0.0001),说明AtPAD4在大豆根系中阻断了SCN雌性的发育(表3.).
抗根结线虫
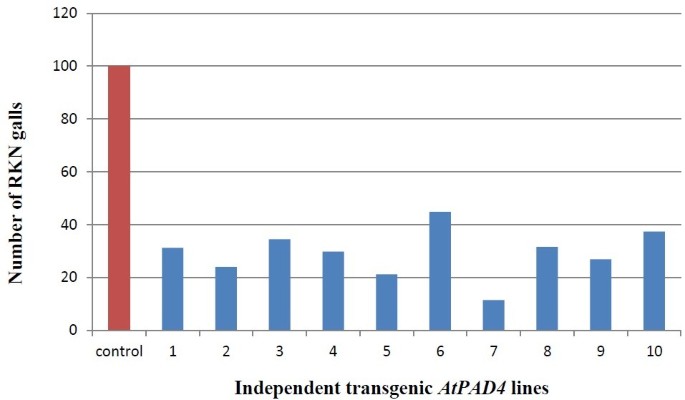
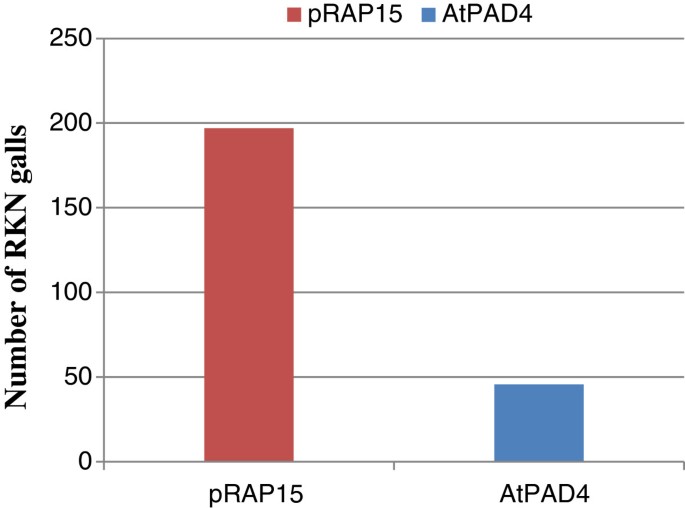
过度表达的效果AtPAD4用计数法测定了敏感大豆品种‘Williams82’根系中虫瘿的发育情况AtPAD4 -过表达和控制根35代(图8).在蓝光下,瘿很容易被识别为转化后的根上坚实的、厚绿色区域。每株RKN瘿瘤的平均数量比对照低77%AtPAD4与pRAP15对照相比(图5)9).当以每克根湿重的RKN瘿瘤数表示时,其减少率为72%AtPAD4-overexpressing植物。这些差异被认为是极其统计学意义(P <0.0001)并表明了AtPAD4基因中断的RKN发育(表4).
RKN瘿和根内RKN线虫的大小是通过使用激光捕捉显微镜的Leica Microsystem 5.0软件测量其剖面面积35 dai确定的。根中RKN瘿瘤的剖面面积与AtPAD4比控制根上的RKN胆量小86%(表5).类似地,RKN线虫的轮廓面积较小66%AtPAD4根。因此有许多不成熟的线虫AtPAD4根比对照根多。我们还观察到在AtPAD4根。
讨论
植物病原体相互作用
静止不动的内寄生线虫由大量的植物病原体组成,它们感染并寄生于寄主的根部。这些线虫和寄主之间的相互作用是高度复杂的,它们专性的根寄生特性已经被证明是这些病理系统的分子特征的一个障碍,包括有针对性地探索线虫寄生期间的植物防御反应。因此,与叶面细菌、病毒和真菌病原体相比,对于在亲和互作中哪些防御信号基因或途径对植物-寄生线虫有效的认识相当缺乏。
对害虫和病原体的有效植物防御涉及的认可和适当的防御激活。类似的底层机制有可能控制在所有的开花植物这一基本过程[32].因此,对植物防御相关基因的结构和功能进行分析拟南芥(l)Heynh,可以促进识别结构和功能同源性及其在其他植物物种抗病途径中的作用[1,8].
作物自然种群和育种种群对病虫害的抗性表现出定性和定量的表型变异。质性抗性有两种不同的表型,抗性和易感,遵循孟德尔遗传。正是这种单基因或抗性(R)基因介导的抗性,在植物病原识别和防御信号转导中得到了最彻底的研究[33- - - - - -36].与此相反,定量性的特征在于连续的表型变异范围从高敏感性的后代中的重组个体之间的高电阻。这种抗性是通过多于一个的基因控制,并且可以受到环境因素的强烈影响。耐SCN是由几个电阻控制(Rhg,抵抗异皮线虫属甘氨酸)基因37- - - - - -40,大豆品种可以对SCN表现出一系列的反应,包括高度敏感或耐药,这取决于用于检测的SCN群体和补体岚该品种的基因组中的基因。抗性基因似乎在群体中特定SCN或种族特异性方式工作,并最对电阻贡献只有一个小的,添加量[37,38].
拟南芥病原体相互作用
的遗传解剖拟南芥-病原互作揭示了植物防御和各种防御信号通路的重要见解。我们的知识R基因活化的防御,以及水杨酸(SA),茉莉酸(JA),和乙烯(ET)依赖性应答途径的调节剂已在过去的二十年[大大扩展33,41].分析答:芥突变体扰乱了SA介导的信号转导的各个方面,揭示了SA在亲和相互作用中是囊线虫寄生的抑制剂[42].不能合成或积累SA的突变体(sid2-1,pad4-1,nahG)表现出持续增加的对h . schachtii.SA预处理显著降低了野生型植物对线虫的敏感性,同时诱导了根和茎中PR-1基因的表达。综上所述,这些数据强烈表明,SA介导的信号通路在相容互作中限制线虫寄生起重要作用。[43结果表明,接种根结线虫前施用SA可缓解番茄根结线虫病;然而,由于实验中使用了高浓度的SA,因此SA的这种作用被认为是在自然界中杀线虫的。[10.,44)表明,PAD4.在拟南芥对抗病原体中调节卡拉内蛋白合成和SA合成和信号传导。
虽然,有关于防御响应的广泛研究拟南芥在这一工作中的真菌和细菌病原体(1-6),小拟南芥已直接转化为经济上重要的粮食作物,如大豆,特别是植物寄生线虫。的拟南芥脂肪酶样蛋白PHYTOALEXIN deficiency 4 (PAD4)被多项遗传学研究鉴定为植物抗强毒病原体免疫的必要成分,可促进防御信号激素水杨酸(SA)和植物alexin camalexin [8- - - - - -10.,33].我们的实验表明AtPAD4可用于经济上重要的作物大豆,以提供对两种不同属线虫的抗性测定。在拟南芥,的PAD4.由SA触发的防御响应的基因函数在下游[45].PAD4可以与EDS1结合,触发防御反应的各个方面,但EDS1也可以与SAG101相互作用,而不依赖于PAD4 [45].在我们的实验中,过度表达AtPAD4在大豆根系中转录本的水平没有很大的影响GmEDS1,但是通用PR1记录。PR1转录对SA水平的增加是敏感的,是SA的下游[46- - - - - -48].过度的表达AtPAD4在转基因拟南芥授予绿桃蚜抗性[49].这种阻力并不需要EDS1。我们的数据,延长的理解AtPAD4通过展示拟南芥基因可以在一种经济上重要的作物中过度表达,从而赋予对两种不同的线虫属的抗性。
结论
在这里,我们证明了过度表达AtPAD4的根g·马克斯对两种不同种类的线虫具有抗性。它降低了敏感大豆品种‘Williams82’中成熟雌SCN包囊的数量和RKN形成的虫瘿数量。此外,RKN瘿和线虫的大小AtPAD4-表达的根显著减少,卵块减少,证实了异位过表达AtPAD4在大豆根系中破坏了RKN的生命周期。本研究为阐明防御信号基因在这一主要作物数量抗病中的潜在作用提供了基础拟南芥基因可以使一种重要的大田作物对两属具有世界重要性的线虫产生抗性。
方法
线虫采购
视交叉上核(h·甘氨酸)雌性是从大豆(g·马克斯)接种后2-4个月的根。通过蔗糖浮选纯化雌性。然后轻轻地压碎以释放卵子。将卵灭菌0.5%的次氯酸钠溶液,然后用无菌水洗涤1.5分钟,并置于带有120ml无菌水的小塑料托盘和1.2ml无菌300mM ZnSO4·7H2O。将托盘放置在28°C和50-75rpm的加热振动器上,用于通气。2天后,将J2S与未孵化的卵子分离,并浓缩至最终优化浓度为1,000J2 mL-1.将两种毫升的J2接种物添加到每个根系中。RKN(m .隐姓埋名的女人)的女性,从辣椒的根(收获甜椒)品种PA136接种后2-4个月。鸡蛋用于大豆幼苗接种根(大豆,简历。Williams 82),用1% NaOCl溶液提取[44].将蛋悬液的浓度调整到1500蛋mL-1.每个根加入两毫升的接种物。然后将植株在温室中生长35天,进行SCN和RKN试验。用酸性品红染色法对具有代表性的感染根样本进行感染确认[50].
隔离PAD4.从同源拟南芥
cDNA第一链合成
提取总RNA拟南芥使用Rneasy Mini Kit(Qiagen,USA),并使用用寡核苷酸(Invitrogen,Carlsbad,Ca)的上标III第一链合成系统合成第一链cDNA,用寡核苷酸D(t)作为底漆。manufacturer’s instructions.
扩增和纯化AtPAD4互补脱氧核糖核酸
拟南芥的PAD4.基因(登录号NM_115103)从cDNA扩增从答:芥利用基因特异性引物(Table4)产生1626年的产品。我们将CACC序列添加到正向引物的5'末端,以使扩增子插入PENTR载体(Invitrogen)。使用E-GEL®电泳系统(Invitrogen)纯化PCR产物。
基因克隆
使用pENTR™定向TOPO克隆试剂盒(Invitrogen公司,Carlsbad, CA)进行克隆AtPAD4转化成pENTR克隆载体。由此产生的构念被转化为有能力的构念大肠杆菌使用One Shot Mach1™T1R化学活性细胞大肠杆菌(Invitrogen公司,卡尔斯巴德,加利福尼亚州),并且质粒使用QIAprep Spin Miniprep试剂盒(Qiagen公司,瓦伦西亚,CA)收集细胞。存在和方位AtPAD4使用3130XL基因分析仪(Applied Biosystems, Foster City, CA)对阳性样本进行DNA测序确认。AtPAD4从pENTR载体转移到植物过表达载体pRAP15(图1)使用Invitrogen公司的Gateway技术。pRAP15载体具有四环素抗性基因(TetR),用于细菌选择,该基因被工程设计到位于左右边界外的BstEII位点和增强的绿色荧光蛋白(egfp.gene [51]由rolD根启动子驱动[52,53]以作视觉筛选变形根[51].插入的AtPAD4该基因由figwort花叶病毒亚基因组转录本(FMV-sgt)启动子驱动[51,表现出强烈的构成性根表达。克隆反应由Gateway LR克隆酶™II酶Mix (Invitrogen,Carlsbad, CA)介导,并涉及交叉丙氨酸在pRAP15和丙氨酸l在pentr的网站,与AtPAD4更换致命的ccd用于细菌选择的B基因。利用菌落PCR方法确定其存在和/或方向AtPAD4和egfp.(1) FMV-F +PAD4.- r;(2)egfp.- f +egfp.-R(表4).
农杆菌转换
pRAP15克隆转移到competent根出杆菌根草杆菌[54]程序后K599。将平板在30℃下生长3天,并将菌落转移到含有5mg mL的5ml Tb液体介质的管中-1四环素,在37°C孵育过夜。如上所述,通过PCR证实了转化。
植物改造与挑战m .隐姓埋名的女人和h·甘氨酸
的文化答:rhizogenes用空pRAP15控件或pRAP15+转换rfp.和pRAP15 +AtPAD4基因在含5mg mL TB液体培养基中培养-1四环素在室温下以250转/分的转速在旋转振动筛上过夜。用5 mL培养液接种600 mL相同培养基,在相同条件下孵育。培养物在4℃,5000 rpm离心30分钟。将颗粒重悬在含3%蔗糖的Murashige and Skoog培养基(MS)中。一个大豆品种的一百株(g·马克斯简历。对SCN和RKN敏感的‘William 82’)在转化前每个试验培养9天。根被转化的复合植物答:rhizogenes是按照[51].简而言之,嫩枝是在土壤线处剪下,置于悬浮液中答:rhizogenes在MS培养基,真空渗入30分钟,然后在65rpm下在23℃温育过夜以种植在填充有50电池单位预润湿PROMIX。MS培养基接种在含有相同量的水,而不是转化的答:rhizogenes培养物用于模拟转化以产生非转化对照(NC)植株。孵育后,用清水冲洗茎干,放入烧杯中,在23℃下孵育约48小时0C在生长室中。幼苗被种植在温室中预湿润的Promix中。种植四周后,使用黑暗阅读点灯(Clare Chemical Research, Dolores, CO)对植物进行筛选,以识别转化的根系。
对于每个实验,在种植后28天选择33种具有最健康的根和最强的EGFP表达的植物,并且部分除去非转化的根。将植物在土壤中重新植入并在14天内生长另外14天,然后选择10种植物进行线虫测定,除去所有非转化根。根源受到2000年的挑战h·甘氨酸每株J2或3000m .隐姓埋名的女人鸡蛋/工厂。接种菌被移液管移入靠近植株茎部的土壤中约1英寸深的2个洞中。每次试验用10株植物。在植物接种(dai) 35天后,对成熟的SCN雌虫和RKN瘿虫进行计数。
根结线虫虫瘿计数和测量
接种RKN 35天后,将10株连根拔起。将根洗净,记录其新鲜重量。计数RKN瘿瘤。10个RKN瘿和10个根内RKN线虫的大小是通过将根切成1 ~ 2厘米的小块,用酸性品红染色确定的。50].将胆汁置于含有甘油下降的载玻片上。没有使用盖玻片。通过使用激光捕获显微镜Leica MicroSystem平台和软件5.0来限制每种胆和RKN的区域。所有样品都使用相同的倍率。
视交叉上核女性数量
从个体植物中收集成熟的SCN女性,在嵌套20-网眼筛子上。将〜30ml水的雌性收集到150ml烧杯中。在恒定真空下,将雌性倒入9厘米直径的滤纸(Schleicher和Schuell; Keene,NH)。计数是在解剖显微镜下完成的。RKN和SCN实验都被分析了t- 使用GraphPad软件(La Jolla,CA)。
验证植物过表达载体的有效性
通过使用它在大豆根中过表达红色荧光蛋白(RFP)来确认植物过表达载体PRAP15的功能。PRAP15 +rfp.利用引物,在美国马里兰州Beltsville大豆基因组与改良实验室USDA-ARS进行了克隆rfp.-F和rfp.-R(表1).该载体pRAP15包含figwort花叶病毒亚基因组转录(FMV-sgt)启动子,驱动串联倒置重复盒的表达。该启动子在整个过程中表现出强烈的、结构性的根表达h·甘氨酸感染。使用Zeiss 710激光扫描共聚焦显微镜(LSCM)和Zeiss Axio Observer™倒置显微镜(带有40x1.2 NA水浸计划复消色物镜)获得eGFP和RFP的根表达图像。用氩气激光器在488 nm处激发eGFP,用MBS 488/561/633滤光片在500 ~ 510 nm处监测发射。在561 nm处用二极管泵浦固体激光器激发RFP,在575 ~ 620 nm处用488/561/633滤波器检测发射。使用蔡司ZenTM 2009捕捉图像,使用Axiophot 4.6™和Photoshop 7.0™设计图形。
推测转基因植物的分子分析
从表现最强的最健康的转基因根中分离出来的基因组DNAegfp.使用DNeasy植物迷你试剂盒(Qiagen,美国)进行荧光和控制大豆植株。的存在AtPAD4用PCR方法验证了转基因根中基因的表达。
序列特异性引物(表1)被用来放大AtPAD4使用植物基因组DNA作为模板的DNA片段。从未转化的植物中提取的DNA用作阴性对照。此外,使用来自大豆泛素-3基因的大约132bp的引物,Genbank加入D28123的碎片用于确认所有样品中存在大豆DNA。PCR条件包括94℃的初始熔化温度2分钟,然后在30s,65℃下为35次,65℃,72℃,2分钟。然后在72°C时的最终延伸时间为10分钟。PCR混合物包括0.4μLTaq聚合酶(Invitrogen,卡尔斯巴德,CA,USA),50mM的MgCl 2和10毫摩尔dNTP。模板质粒DNA的浓度为1-10纳克微升-1.PCR扩增片段在0.8 g/ml琼脂糖凝胶上分离,在紫外光下观察。
实时定量反转录聚合酶链反应(qRT-PCR)测定其转录水平AtPAD4和植物根内的防御基因
RNA从三个单独的根(每个100 mg)中提取,用空pRAP15转化的根(作为对照)最强egfp.使用超清洁植物RNA分离试剂盒(MOBIO, Carlsbad, CA)表达和代表独立的转化事件。用DNase I处理RNA,去除基因组DNA。根据生产说明书,利用逆转录酶(Invitrogen, Carlsbad, CA)和oligo dT引物合成单链cDNA。所有引物都被设计成包含一个内含子的侧翼区域,以确保预期大小的产物是从cDNA扩增而不是从基因组DNA。引物(表2)被设计成特异于拟南芥的侧翼区域PAD4.(AtPAD4)并产生约150bp的PCR扩增片段。此外,大豆泛素-3基因,GenBank登录D28123用作实验的阳性RT-PCR对照,以确认所有样品中存在大豆RNA。和大豆基因(GmPAD4;GmEDS1)Phytozome加入Glyma06G16290.1;glyma06g19920.1和(GmPR1相关防御基因xm_003545723.1。
qRT-PCR的其他对照包括不含模板的反应和不含逆转录酶的反应。对3个生物重复进行qRT-PCR,每个反应重复3次。使用生产厂家提供的Stratagene Mx3000P Real-Time PCR系统(Stratagene, La Jolla, CA)测定基因的相对表达量。用SYBR Green测定反应过程中的DNA积累。使用Stratagene Mx3000P Real-Time PCR系统提供的软件计算Ct值(第一次明显检测到荧光增加的周期)。扩增产物的SYBR green解离曲线表明,每个反应只能产生一个产物。数据分析按照s型模型进行[31],以实现绝对量化。将PCR产物在0.8%琼脂糖凝胶上运行,并在UV光下可视化。
参考文献
- 1。
王志刚,王志刚:诱导植物防御机制与抗性基因功能。acta botanica sinica(云南植物学报). 1996,8(4):593 - 598。
- 2。
Baker B, Zambryski P, Staskawicz B, Dinesh-Kumar SP:植物-微生物相互作用的信号传导。中国科学:地球科学。10.1126 / science.276.5313.726。
- 3.
Crute I, Beynon J, Dangl J, Holub E, Mauch-Mani B, Slusarenko A, Staskawicz B, Ausubel FE, Meyerowitz M:微生物致病机理拟南芥.拟南芥。编辑:Meyerowitz EM, Somerville CR。冷泉港,纽约:冷泉港实验室出版社;1994: 705 - 747。
- 4.
Ryals JA, Neuenschwander UH, Wilits MG, Molina A, Steiner HY, hunt MD:系统性获得性抗性。植物学报。1998,8:1809-1819。
- 5.
Gaffney T, Friedrich L, Vernooij B, Negrotto D, Nye G, Uknes S, Ward E, Kessmann H, Ryals J:对水杨酸诱导系统获得性抗性的需求。中国科学:地球科学。10.1126 / science.261.5122.754。
- 6.
水杨酸在植物抗病中的重要作用。关键词:植物抗病,水杨酸,抗性科学通报。1994,32(4):457 - 457。10.1126 / science.266.5188.1247。
- 7.
BARTSCH男,Gobbato E,贝德纳雷克P,Debey S,舒尔茨JL,BautorĴ,帕克JE:在拟南芥中免疫和细胞死亡水杨酸acidindependent EDS1信令的稳压器。植物细胞。2006年,18:1038至1051年。10.1105 / tpc.105.039982。
- 8.
Glazebrok J,Zook M,Mert F,Kagan I,Rogers EE,Crute IR,Houlb EB,Hourmerschmidt R,Ausubel FM:拟南芥缺乏突变体揭示了PAD4编码了调节因子,四个垫基因有助于柔软的霉菌抗性.遗传学。1997年,146:381-392。
- 9.
Jirage D, Tootle TL, Reuber TL, Frost LN, Feys BJ, Parker JE, Ausubel FM, Glazebrook J:拟南芥PAD4编码一个对水杨酸信号转导很重要的类脂肪酶基因。美国国家科学院学报。美国。1999年,96:13583 - 13588。10.1073 / pnas.96.23.13583。
- 10.
Zhou N, Tootle TL, Tsui F, Klessig DF, Glazebrook J:PAD4.在水杨酸上游调控拟南芥的防御反应。acta botanica sinica(云南植物学报). 1998,10:1021-1030。
- 11.
Pegadaraju V, Knepper C, Reese JC, Shah J:拟南芥PAD4基因调控的叶片早衰与抵抗绿桃蚜虫的韧皮部相关。植物营养与肥料学报。2005,29(4):429 - 434。10.1104 / pp.105.070433。
- 12.
JE: EDS1是拟南芥R基因介导抗病的重要组成部分,与真核脂肪酶具有同源性。美国国家科学院学报。美国。1999年,96:3292 - 3297。10.1073 / pnas.96.6.3292。
- 13。
Feys BJ, Wiermer M, Bhat RA, Moisan LJ, Medina-Escobar N, Neu C, de Cruz-Cabral A, Parker JE:拟南芥衰老相关的Gene101稳定和信号在一个加强疾病susceptibility1植物先天免疫复合物。植物营养与肥料学报。2005,17(4):427 - 434。10.1105 / tpc.105.033910。
- 14.
Feys BJ, Moisan LJ, Newman MA, Parker JE:拟南芥抗病信号蛋白EDS1和PAD4的直接相互作用。国家自然科学基金重点项目,2001,20:5400-5411。10.1093 / emboj / 20.19.5400。
- 15.
DW:线虫学的世界视角:社会的角色。线虫学的远景。1987,7-14。
- 16.
Williamson Va,Gleason Ca:植物线虫交互。植物BIOL。2003,6:327-333。
- 17.
Wyss U:对寄生行为的观察h . schachtii贯穿其发展的内部根源。应用生态学报,1992,15:75-89。
- 18.
Williamson VM,Hussey Rs:Nematode发病机制和植物抗性。植物细胞。1996,8:1735-1745。
- 19.
王小红,杨艳,王小红。β - 1,4 -内切葡聚糖酶在植物体内的定位。植物营养与肥料学报,1999,12:64-67。10.1094 / MPMI.1999.12.1.64。
- 20.
利用线虫对寄生蜂寄生的影响。中国寄生虫学杂志,2004,20:134-141。10.1016 / j.pt.2004.01.005。
- 21.
王志强,王志强,王志强,等。植物根结线虫寄生基因的研究进展。土木工程学报。2007,28:17-43。
- 22.
宿主细胞对内寄生线虫攻击的反应:巨细胞和合胞体的结构和功能。作者简介:安安普·比尔。10.1111 / j.1744-7348.1981.tb05122.x。
- 23。
Endo BY:来自包囊线虫诱导的组织学和超微结构修饰:包囊线虫。编辑:Lambert F, Taylor CE。纽约:Plenum出版社;1986: 133 - 146。
- 24。
静止植物寄生线虫的摄食行为。Neth。植物病理学杂志,1992,98(增刊2):165-173。
- 25。
关键词:线虫,食饵点,基因表达在取消。大豆包囊线虫亚种形态的术语和鉴定[h·甘氨酸) 1997;编辑Epps JM, Riggs RD, Duclos LA, Fox JA, Bernard RL。中国农业科学,2003,21(4):434 - 434。
- 26.
植物与寄生性线虫的相互作用。植物病理学杂志。2003,41:245-270。10.1146 / annurev.phyto.41.052102.104023。
- 27.
1 .大豆抗大豆对H. glycines Ichinohe侵染早期反应的细胞学表达。基因组学。1996,39:986-998。10.1139 / g96 - 123。
- 28.
生物信息学:昆虫分泌的秘密:控制植物线虫寄生的基因。布拉兹。植物生理学报。2002,14:183-194。
- 29.
泰勒AL,震荡波JN:生物学,识别和根结线虫的控制[根结线虫。]。北卡罗来纳州罗利,美国:北卡罗莱纳州:州大学出版社的图形;1978年。
- 30.
Abad P,Gouzy J,Aury JM,Castagnone-Sereno P,Dancancon Egj,Deleury E,Perfus-Barbeoch L,Anthouand V,Artiguenave F,Blok VC,Caillaud MC,Coutinho PM,Dasilva C,De Luca F,Deau F,ESQUIBET M,Flutre T,Goldstone JV,Hamamouch N,Hewezi T,Jaillon O,Jubin C,Leonetti P,Magliano M,Maier Tr,Markov GV,McVeigh P,Pesole G,Poulain P,Robinson-Rechavi M:基因组序列美唑南植物 - 寄生线虫有隐姓埋名的女人.自然生物技术。2008,26(4):909-915。
- 31.
基于动力学的s型模型的聚合酶链反应及其在高容量绝对定量实时荧光定量PCR中的应用。生物技术。2008,8:47。10.1186 / 1472-6750-8-47。
- 32.
McDowell JM,Wofdenden BJ:植物疾病抗性基因:最近的见解和潜在应用。趋势生物技术。2003,21:178-183。10.1016 / s0167-7799(03)00053-2。
- 33.
控制防御反应表达的基因拟南芥.植物BIOL。2001,4:301-308。
- 34.
Feys BJ,帕克JE:信令在植物抗病途径的相互作用。趋势类型。2000,16:449-455。10.1016 / S0168-9525(00)02107-7。
- 35。
孙强:抗性基因复合体的进化与应用。植物病理学杂志。2001,39:285-312。10.1146 / annurev.phyto.39.1.285。
- 36。
来自致病相关蛋白和植物防御。植物的关系。Mycota V, Part A.编辑:Carroll GC, Tudzynski P. Verlag,柏林:施普林格;1997: 107 - 128。
- 37。
短句来源Concibido VC, Lange DA, Denny RL, Orf JH, Young ND:大豆包囊线虫抗性基因PI 90763和PI 88788的DNA标记配对。作物科学,1997,37:258-264。10.2135 / cropsci1997.0011183X003700010046x。
- 38.
大豆孢囊线虫抗性QTL定位研究。植物科学学报,2004,44(6):1171 -1131。10.2135 / cropsci2004.1121。
- 39.
马特森AL,威廉姆斯LF:第四基因用于向大豆胞囊线虫抗性的证据。农作物科学。1965年,5:477 10.2135 / cropsci1965.0011183X000500050032x。
- 40.
Rao-Arelli AP、Anad SC、Wrather JA:大豆对大豆包囊线虫3小种的抗性是由附加显性基因决定的。作物科学,1992,32:862-864。10.2135 / cropsci1992.0011183X003200040005x。
- 41.
格莱兹布鲁克记者:对比防御机制对活体营养和死体营养性病原体。Annu启Phytopathol。2005年,43:9.1-9.23。
- 42.
WUBBEN MJ,Jin J,Baum TJ:囊肿线虫寄生寄生拟南芥被水杨酸[SA]抑制,并在根中诱导非偶联SA独立致病相关基因表达。MPMI。2008年,21日:424 - 443。10.1094 / mpmi - 21 - 4 - 0424。
- 43.
研究了几种酚类化合物对根结线虫的杀线虫活性、根结生长和产量的影响辣椒frutescens简历。加州的奇迹。植物病虫害学报,1999,19(4):429 - 434。10.1111 / j.1439-0434.1990.tb04299.x。
- 44.
周N,Tootle TL,Tsui F,Klessig F,Glazebroka J:PAD4.在水杨酸上游调控拟南芥的防御反应。acta botanica sinica(云南植物学报). 1998,10:1021-1030。
- 45.
植物抗毒素缺陷4 (PAD4)在拟南芥免疫中的作用。叶绿醇。2011,191:107-119。10.1111 / j.1469-8137.2011.03675.x。
- 46.
秦晓峰,王志强,王志强,蔡志强:水杨酸通过花椰菜花叶病毒的早期转录激活1元素。植物学报。1994,6:863-874。
- 47。
一个水杨酸敏感突变体的特性研究(sai1)拟南芥在利用的该SA诱导表达的选择性筛选中鉴定tms2基因。植物与微生物的相互作用。1997,10:69-78。10.1094 / MPMI.1997.10.1.69。
- 48。
李志强,李志强,李志强:调控序列控制的功能分析PR-1基因表达拟南芥.植物学报1998,16:223-233。10.1046 / j.1365 - 313 x.1998.00288.x。
- 49。
Pegadaraju V, Louis J, Singh V, Reese J, Bautor J, Feys BJ, Cook G, Parker JE, Shah J:韧皮部对桃蚜的抗性是由拟南芥植物抗毒素缺陷4控制的,而没有其信号转导伴侣。植物学报,2007,52:332-341。10.1111 / j.1365 - 313 x.2007.03241.x。
- 50。
Byrd DW, Kirkpatrick T, Barker KR:一种用于清除和染色植物组织以检测线虫的改进技术。植物营养与肥料学报,1998,15(4):514 - 514。
- 51。
Haseloff J, Siemering KR, Prasher DC, Hodge S:去除隐性内含子和绿色荧光蛋白的亚细胞定位是转基因拟南芥的明亮标记所必需的。美国国家科学院学报。1997年,94:2122 - 2127。10.1073 / pnas.94.6.2122。
- 52.
白FF, Taylor BH, Huffman GA, Gordon MP, Nester EW:根际拟南芥根诱导质粒转移DNA区域的分子和遗传分析。中国微生物学杂志。
- 53.
Elmayan T, Tepfer M:烟草中rolD启动子、35S启动子和35S2启动子A域的器官特异性和强度的评价。中国生物医学工程学报,2003,21(4):457 - 461。10.1007 / BF01973757。
确认
作者感谢Susan Meyer,Ann Smigocki和Hua Lu对稿件的批判性阅读。DNA测序由Peter Van Berkum实验室,USDA-ARS大豆基因组学和改善实验室进行。联合大豆委员会第1292号的财政支持非常确认。提及本出版物中的商品名称或商业产品仅用于提供具体信息,并不意味着美国农业部的推荐或认可。的U.S. Department of Agriculture (USDA)prohibits discrimination in all its programs and activities on the basis of race, color, national origin, age, disability, and where applicable, sex, marital status, familial status, parental status, religion, sexual orientation, genetic information, political beliefs, reprisal, or because all or part of an individual’s income is derived from any public assistance program. (Not all prohibited bases apply to all programs). Persons with disabilities who require alternative means for communication of program information (Braille, large print, audiotape, etc.) should contact USDA’s TARGET Center at (202)720-2600 (voice and TDD). To file a complaint of discrimination, write to USDA, Director, Office of Civil Rights, 1400 Independence Avenue, S.W., Washington, D.C. 20250–9410, or call (8000795–3272 (voice)or (202)720-6382 (TDD). USDA is an equal opportunity provider and employer.
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
BM进行实验设计,设计过表达向量,帮助起草手稿,进行统计分析。RY进行了分子遗传学和线虫转化研究,进行了统计分析并起草了手稿。KK参与过表达载体的设计和构建。MM参与了线虫的研究。EB参与了统计分析,并帮助起草了稿件。GB进行了激光扫描共聚焦显微镜研究。所有作者阅读并批准了最终的手稿。
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
尤瑟夫,麦克唐纳,m.h.,布鲁尔,E.P.等等。异位表达AtPAD4提高大豆对大豆包囊和根结线虫的抗性。BMC植物杂志13,67(2013)。https://doi.org/10.1186/1471-2229-13-67
收到了:
接受:
发表:
关键词
- 拟南芥
- Phytoalexin-deficient4
- AtPAD4
- 大豆
- 线虫
- 水杨酸
- 植物防御