抽象的
背景
Arabinogalactan蛋白(AGPS)是细胞壁蛋白多糖,已被证明对花粉发育是重要的。拟南芥双重突变体为两种花粉特异性AGPS(AGP6 AGP11.)表现出花粉管生长减少和对萌发信号的反应减弱在活的有机体内.进行了微阵列实验AGP6 AGP11.研究花粉管生长环境中的遗传相互作用。设计了AGP6和AGP11的酵母双杂交试验。
结果
缺乏两种特异性AGPS在基因表达谱中诱导有意义的转变。实际上,大量基因显示出改变的表达水平,强化AGP6和AGP11参与复杂现象的情况。发现钙和信令相关基因的表达水平被改变,支持各种蛋白质在花粉管生长中的已知作用。虽然所提出的相互作用的精确性需要进一步调查,但AGP通过钙调蛋白和蛋白质降解通过钙调蛋白的信号传导级联的推定累积。还改变了应激的表达,以及信号传导的基因;由防御和花粉管生长中的信号通路之间的公认相似性可能导致的相关性。
酵母双杂交实验的结果进一步支持了这些信号通路,并揭示了假定的AGP6和AGP11相互作用者参与了通过胞吞作用、网格蛋白介导的内核体和多泡体的细胞膜组分的循环。
结论
这些数据表明,AGP6和AGP11参与了多个信号通路,特别是参与了拟南芥花粉发育过程中胞吞介导的质膜重塑等发育过程。这突出了核内体运输途径的重要性,这是迅速出现的基本调控壁生理学。
背景
当雄配子体从花药转移到柱头时,花粉-雌蕊相互作用就开始了。然后花粉粒开始水合并发芽,形成一个花粉管,花粉管通过心皮内部组织生长,将两个精子送到胚囊。花粉管通过雌蕊组织的细胞外基质伸长,通过基于肌动蛋白-肌球蛋白的顶端生长机制延伸,这一机制将满载新细胞壁物质的小泡运送到延伸的顶端,最终到达胚囊,进入助细胞。从根本上说,在这种以尖为中心的局部生长过程中,细胞质极化,将分泌事件导向尖。内部梯度和跨膜离子通量,特别是钙离子,是花粉管生长的另一个关键特征[1].
拟南芥花粉转录组分析显示,与孢子体组织相关的一个独特的基因子集表达[2- - - - - -6].此外,在从微孔到成熟三胞花粉晶粒的雄性配子体发育过程中发生基因表达模式的变化[7].最近,对花粉管进行了全基因组表达分析在体外发现了另一组基因在花粉管中表达而不在花粉中,这表明新创花粉管中mRNA的合成[5].的基因表达谱在体外和半在活的有机体内生长的拟南芥花粉管也有特征,并发现不同;这导致了一个特定的基因亚组的发现,该基因是由增强花粉管由雌蕊[6].
在可能参与从孢子体到配子体发育过程的基因或基因家族中,编码阿拉伯半乳聚糖蛋白(AGP)的基因或基因家族。agp是细胞壁蛋白多糖的一大家族,可在质膜、细胞壁、质外体间隙和分泌物中发现。从拟南芥中分离出来的抗洗涤剂膜中也发现了它们,这表明它们存在于脂筏中[8].AGPS的关键区别特征是:(1)碳水化合物,通常支链II raira armino-3,6-半乳糖,O与忧郁残留的蛋白质骨架,构成90 - 98% (w / w)的分子质量,(2)二肽的蛋白质骨架通常富有图案Ala-Hyp, Ser-Hyp, Thr-Hyp, Val-Pro, Gly-Pro Thr-Pro, (3) glycosylphosphatidylinositol (GPI)膜锚,预测出现在大多数,但不是全部,(4)与一类合成化学染料(称为Yariv试剂)结合的能力[9],这不仅可用于检测,量化和分离AGPS,而且还用于功能研究[10].
通过对拟南芥花粉特异AGP基因的鉴定,研究了各自空突变体的表型变化。我们之前鉴定了两个雄性配子体AGP基因(AGP6和AGP11.)显示出功能冗余[11].一个AGP6 AGP11.随后获得双空突变体。双零突变体表现出分离畸变,从败育的花粉粒数来看,表明配子体的世代受到了影响。花粉发芽率和花粉管生长速率明显降低,花粉早异位萌发(在花药内)[12,促使我们进一步分析该突变体,以了解agp的作用模式。我们决定检查一下AGP6 AGP11.双空突变体花粉管,使用Affymetrix ATH1基因组阵列。
在此,我们鉴定了1022个基因,与野生型花粉管相比,它们在双空突变花粉管中的表达或减少或增加。这些基因可以作为分析花粉管生长过程中agp参与的基因调控网络的起点。同时,我们进行了酵母双杂交实验,鉴定AGP6和AGP11的相互作用者,为这些agp的生物学功能提供证据。
结果
一个拟南芥系同时没有两个花粉特异的AGP基因,AGP6和AGP11.,已在我们的实验室进行了特性分析,并发现其表现出显著的表型改变,即花粉粒部分败育、发芽势降低和花药内早熟[11,12].此外,在本研究中使用的条件下,双突变体的花粉管均比野生型(100μm)的统计学上短(83μm)。
为了进一步描述AGP6 AGP11.采用差异芯片技术对8个花粉管中修饰表达的基因进行了鉴定AGP6 AGP11.与野生型花粉管相比。
一般数据分析
的数量表达基因在野生型花粉管(最低2显示3现在要求一式三份GeneChip实验)6886年被发现,这大约是总数的28%的基因在GeneChip拟南芥基因组ATH1数组。这一数值与使用相同类型芯片和实验设置的拟南芥花粉管微阵列研究(即:在体外- 萌发后4-6小时收获的花粉管[5,6].微阵列数据在Geo(http://www.ncbi.nlm.nih.gov/geo/info/linking.html.)记录号GSE40861。
野生型花粉管转录组的功能分类
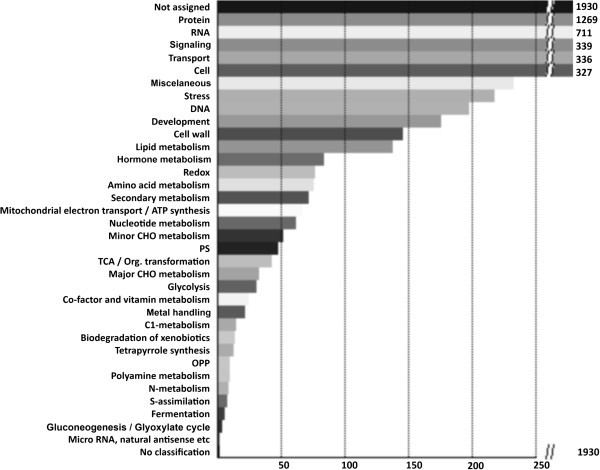
野生型花粉管(6886基因)的转录组根据Mapman可视化软件分为34个官能团(图1).在已知基因中,28.7%的基因功能未知,其余基因主要参与蛋白质合成(18.8%)、RNA转录和加工(10.6%)、信号转导(5.0%)、转运(5.0%)和细胞组织和细胞骨架(4.9%)。这种功能分布与花粉管生长所需细胞资源的募集相一致,也与其他花粉和花粉管微阵列研究相一致[4,5].
野生型拟南芥花粉管转录组的功能分类。使用MapMan来源的Classification SuperViewer工具进行分析[13].
拟南芥agp6 agp11差异表达基因
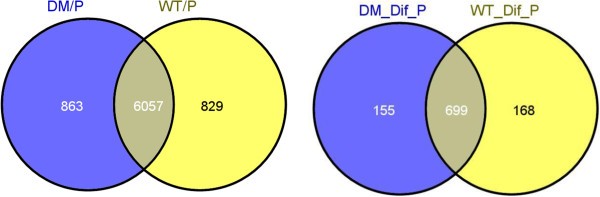
表达基因的数量AGP6 AGP11.突变体花粉管的表达基因与野生型对照的表达基因大致相同,但只有87.5%的表达基因在两个数据集上相同(图)2).有两种特定的基因群体;2)仅存在于野生型花粉管中。然而,对显著差异表达基因的统计分析必然产生与图中所示相当不同的基因群体2.如果实验和基线之间fold change的90%的置信界限高于1.3,导致中位数错误发现率(FDR)小于5%,则认为与那些与之比较的基因存在差异表达。观察这一标准,获得了1022个差异表达基因,占花粉管转录组的14.7%(图2和额外的文件1).这些1022个基因仅包括155个基因AGP6 AGP11.168个基因仅在野生型中存在,699个基因在两者中都有表达。在这699个基因中,约60%的基因表达上调AGP6 AGP11.,剩下的40%下调。总的来说AGP6 AGP11.突变导致拟南芥花粉管中超过500个基因的上调。
基因表达验证
通过实时荧光定量PCR (qPCR)或常规半定量RT-PCR,对一组基因的RNA水平进行独立验证。根据两组微阵列数据和绝对信号值的表达差异选择基因(表)1).所有基因的相对表达量与芯片实验结果一致,验证了芯片实验的可靠性。
差异表达基因的功能分类
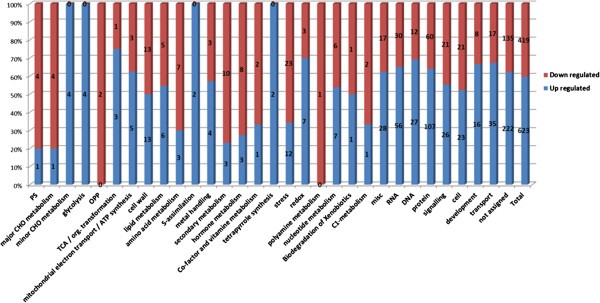
根据MapMan分类软件,整个双突变体转录组的功能分类,与野生型转录组的功能分类并没有本质上的分歧(图)1).然而,有相当数量的基因存在差异表达,即在两种AGP基因产物缺失的情况下,它们或上调或下调表达。这些差异表达基因的MapMan功能分类如图所示3..
MapMan功能BINs“Protein”、“RNA”、“Transport”、“Signaling”、“Cell”、“DNA”和“Stress”是基因发生改变最多的组,它们共同占据了几乎一半的差异表达基因(46%)。
一个更大的“蛋白质”簇的亚簇包含F-box基元,其不同的信号强度和受影响的基因数量特别引人注目,相对于拟南芥基因组的代表因子为1.8×。同样,子集群“发出信号”。钙”,和“stress.abiotic。与全基因组相比,差异表达基因集的富集因子分别为1.5×和2.1×。signaling.receptor类”。激酶”和“压力。在差异表达基因组中并未富集,但由于其部分成员的LBFC值较高而被选择(见表)2).
另一组与压力相关的基因(CAP基因;表格3.)的信号强度也很显著,特别是与野生型相比,其两个成员各自的信号强度有较大的增加(表)3.).
为了鉴定我们使用的基因相互作用和/或关联,我们使用了旨在分析基因列表和优先考虑功能测定的基因的基因界面(Genemania)[15].从具有最高信号强度的500个基因列表中提取差异表达基因,产生基因网络,突出显示“对热”基因簇的“响应”(图4).
热休克蛋白基因在AGP6 AGP11.花粉管。互联网工具GeneMANIA被用来建立一个基因关联网络。输入数据是从野生型微阵列数据集中信号强度最高的500个基因中分离出来的所有差异表达基因。其中一些基因(At1g53540, hsp20样伴侣超家族蛋白;At3g46230, 17.4 kDa I类热休克蛋白;At5g12030,热休克蛋白17.6A;At2g29500, HSP20-like伴侣超家族蛋白)属于“热响应”功能簇(粉色圆圈)[15].
酵母 - 两个混合测定检测的AGP6和AGP11交互式
为了实验检测AGP6和AGP11的潜在互作体,我们使用这两个蛋白的核心结构域作为诱饵,筛选一个规范化的拟南芥表达库。采用全株cDNA文库,认为该文库是鉴定AGP互作体的最佳选择。该文库是由从几个不同发育阶段的器官(包括开花前和开花时的花序发育、角果发育和成熟花)中提取的mRNA获得的cdna库生成的。图书馆被正常化是为了更好地代表低数量的信使。
对于AGP6图书馆交配板,111个菌落增长了选择性介质。在随机选择48个中间进行测序,并显示37种独特的候选人。在我们的阵列实验中没有呼吁的那些,以及其他公开的花粉和花粉管阵列[5- - - - - -7]被排除在外,导致一组22个可能的相互作用候选者(表4).对于AGP11图书馆交配板仅11种菌落在选择性培养基上增长,并且所有均被测序。那些可能有5个可能的互动候选人(表4).
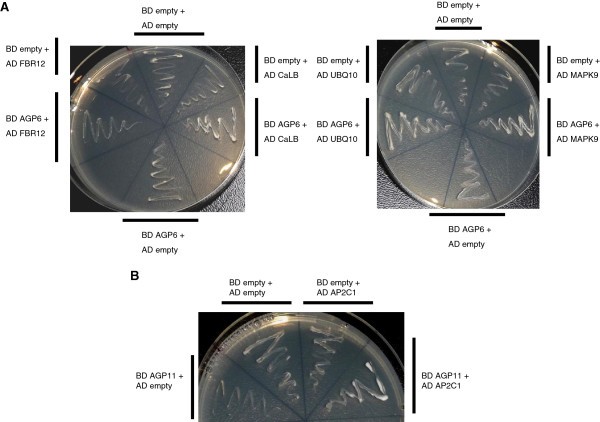
在发现的可能的相互作用子中,选择4个与AGP6和1个与AGP11相互作用,分别是CaLB结构域家族蛋白(At1g70810)、MAPK9 (At3g18040)、UBQ10 (At4g05320)和FBR12 (At1g26630)和AP2C1 (At2G30020)。所有与AGP共转化的菌落和每个候选菌落都在所有选择性培养基上生长,而每个阴性对照都没有,因此证实了相互作用(图)5).
讨论
植物有性生殖依赖于将花粉转移到柱头上,在柱头上花粉被水合并发芽进入花粉管,花粉管通过雌蕊组织延伸到其目标——胚囊。的AGP6 AGP11.双零突变体除了表现出花粉管生长缺陷外,还表现出早期“花药内”萌发表型。这些缺陷为agp在细胞壁沉积和生长中的作用提供了进一步的证据,并可能代表了在接收或响应萌发信号方面的缺陷。
AGPS是一类分子,其研究特别具有挑战性。分子量的90%以上是碳水化合物(主要由阿拉伯糖和半乳糖残留组成),以及多肽链(如果有的话)的作用是未知的。此外,糖含量和质量如何在不同的基因产物之间变化,以及不同的基因产物是否相同糖基化表征较差。对此的直接后果是用于研究蛋白质的技术和方法通常不适用于AGPS。围绕蛋白质核心的大规模糖组分可能具有生物学作用,但其生物相互作用和作用机制迄今为止突出表征。野生型和双突变花粉管之间的表型差异只能归因于AGP6和AGP11缺乏。不可能确定差异基因表达是否是由于缺乏AGPS对这些基因的表达的直接效应,或者改变的表达谱是减少生长速率的二次和非特异性后果。然而,基于表达的研究应该通过鉴定缺乏特定AGPS改变的基因来改善我们对AGP的理解及其功能。当应用于已知AgPS的过程中,这种类型的调查可能是特别的信息,在植物结构中,在植物结构中,花粉管,其转录组小于基因组的三分之一。
本研究获得了一些可能与agp直接或间接互作并在花粉管生长中发挥作用的候选基因。然而,将目前的数据与经过Yariv苯基糖苷试剂处理的拟南芥培养细胞的表达谱进行对比分析,该试剂能特异性结合并沉淀agp [44.- - - - - -48.,被认为是鉴定可能直接受AGP6和AGP11缺乏影响的基因的有价值的帮助。
微阵列屏幕
与野生型对照相比,对表达基因获得的总体差异是基本的,在双缺点中,在双缺点中有1022个差异表达基因。这些1022差异表达的基因可以进一步分为三个亚组:155个基因,其在双突变体中表达“de novo”,在突变体中不存在的168个基因,但在对照中存在,以及一组表达水平的699个基因被发现被改变,但这并没有影响现在/缺席的地位。
利用MapMan软件进行基因聚类,发现聚类“Protein”中差异表达基因的比例最大。“蛋白质降解”无疑是最具代表性的一类,其中泛素介导的蛋白质降解这一类别较为明显,其中有几个基因属于F-Box蛋白家族。F-box是由大约50个氨基酸组成的蛋白质基元,作为蛋白质-蛋白质相互作用的位点[49.].据报道,仅拟南芥就含有大约700个F-Box基因[50.].相比之下,只有20、27和69个F-Box蛋白被编码酿酒酵母酿酒酵母,黑腹果蝇,和人类基因组[51.].也发现这种表观大规模投资与将特定植物F箱蛋白联系起来的遗传研究一致,包括激素感知和信号,应力保护,染色质重塑,稳态,昼夜节律,自我不相容和防御病原体[52.].在拟南芥中,最近的遗传研究为在配子发生过程中提供了该蛋白质降解系统的作用的明确证据,涉及F-Box 17 [53.]和一对泛素特异性蛋白酶(UBP3/UBP4) [54.].
通过对本工作获得的数据进行分析,还发现钙信号传导簇中的钙调素(CaMs)在LBFC评分最高的差异表达基因中,即At5g24880和At4g20780 (CML42),后者在毛状体分支中起作用,并在花粉中强烈表达,如CML42::GUS转基因植株所示[55.].钙信号在植物的生长发育中起着重要的作用,包括花粉管的生长,而CaMs是真核生物中最普遍的钙传感器。Popescu等[56.]开发出一种蛋白质微阵列,以全面调查拟南芥凸轮/凸轮状相互作用,并确定这些钙传感器的新靶标,其中一个是F箱蛋白。AGPS和钙之间的关系是不成熟的,因为这些蛋白质参与花粉管细胞壁生长,并且已知钙调节花粉管生长和施肥[57.].所获得的数据可能表明agp通过钙调素与钙相互作用。这也暗示了使用另一种方法来研究AGP的功能,包括使用(β-D-Glc)-3 Yariv试剂,该试剂可特异性结合,并可能失活,广泛的AGP。Guan和Nothnagel [44.]分析了拟南芥培养细胞经Yariv苯基糖苷试剂处理1和10 h后的基因表达谱。尽管生物材料具有特异性,但在两个实验中发现了一些差异表达的基因(附加文件)2).本研究中使用的LBFC值不能直接与Guan和Nothnagel的数据进行比较[44.].但是,折叠变化的所有值AGP6 AGP11.附加文件中显示的基因2, LBFC值高于1.3,这是我们分析中使用的标准。在yariv处理过的细胞中改变的基因还包括几个热休克蛋白基因,这是一个功能组,也被发现受到了影响AGP6 AGP11..
比较雌蕊转录组分析[58.,59.]鉴定了许多编码蛋白质可能涉及压力和防御反应的基因。这特别有趣,因为有证据表明授粉和应力/防御反应的分子可能是进化和功能相关的。许多作者提出,通过修改预先存在的病原体防御机制,可能会出现某些自我不相容机制[60.].
对现有数据的胁迫聚类分析表明,与生物和非生物胁迫类型相关的基因,即PR和热休克蛋白基因的表达水平发生了显著变化。在这一簇中,At2g19970和At2g19980基因编码CAP(富含半胱氨酸、抗原5和病原体相关蛋白)超家族的蛋白质。CAP超家族的成员在生物体内广泛存在,[61.,并在哺乳动物受精机制方面进行了深入研究。它们是最常见的分泌蛋白,参与多个过程,包括受精过程中的细胞粘附。植物致病蛋白PR-1家族属于CAP超家族,是在病原菌感染或其他胁迫应答过程中合成的,但这些蛋白的具体功能目前还不清楚。在最近的研究中[62.],提示胶质瘤发病相关蛋白1 (GLIPR1L1)与CAP超家族的其他成员和其他几种蛋白一起参与了精子与卵母细胞复合物的结合。此外,在水稻胚囊细胞微阵列的研究中[63[揭示了过敏原V5 / TPX-1相关蛋白,其是帽超家族的成员,在水稻合酶中含量丰富。总的来说这些发现加强了含帽结构域蛋白质在细胞粘附和施肥中的可能作用。
拟南芥花粉管中7个CAP超家族成员的高表达与它们预测的信号功能有关。此外,知道这些蛋白质很可能是分泌的,而且它的一个成员(At2g19970)只存在于AGP6 AGP11.双突变体,可以指示AGPS和盖帽处理之间的某种关系。
获得了不同的生物信息工具,Genemania,获得了一种共表达网络,其突出了应力官能基因簇。令人惊讶的是,一些与发现表达的那些基因通过用Yariv试剂处理10小时(AT2G29500,AT3G46230,AT1G53540和AT5G12030)来改变这些基因。44.].Guan和Nothnagel [44.将Yariv处理诱导的基因与之前已证实由其他条件诱导表达的基因进行比较,得出Yariv处理诱导的基因表达谱与创伤反应相似。我们知道花粉管的生长和排泄与抵抗真菌攻击的防御在许多方面是相似的,而且花粉管和真菌都利用相似的受体蛋白[64,65]我们在此过程中提出了AGP的作用,显然,花粉管和真菌菌丝激活植物细胞应答。
酵母二者混合实验
为了鉴定可能的AGP6和/或AGP11相互作用体,进行了酵母双杂交实验。这些实验揭示了一些有趣的伙伴,参与了蛋白酶体独立的泛素化在信号转导和内吞作用中的作用。
除了众所周知的蛋白体降解作用外,泛素结合还参与了膜受体、转运体和通道的下调。质膜蛋白的泛素化导致它们的内吞作用进入多泡核内体,泛素连接酶家族的大多数成员负责各种蛋白质的运输,携带一个n端钙依赖的脂质/蛋白C2结构域,该结构域特别结合酵母中的磷酸肌苷[66,67].
核内体主要是细胞内的分选细胞器,从生物合成和内吞途径接收蛋白质和脂质。被内吞作用内化的质膜蛋白要么被回收回质膜,要么被分类降解,降解过程由中/晚期核内体完成,也称为多泡体(MVBs) [68,69].
众所周知,花粉管通过快速尖端卵细胞增长而生长,大部分可能与尖端局部化内吞作用协调。使用Arabidopsis和Nicotiana Pollen管作为模特,Zhao等人。[70表明磷脂酰肌醇-4-磷酸5-激酶6 (PIP5K6)调节花粉管中网格蛋白依赖的内吞作用。
通过MVBs的阿拉伯半乳糖丰富糖蛋白的内化和分泌已被描述,但仅在显微镜下[71,72].本研究中获得的数据表明AGP与内体系统成员的生理相互作用,AGP6和AGP11,拟南芥花粉和花粉管中的两种特异性和高表达蛋白可以参与发出和回收蛋白质的信号通路到细胞外基质。在酵母双杂交筛选测定中,存在克拉汀适配器配合物,例如Mug13.13和MAPK9,Syta(参与膜运输的跨膜蛋白),Raba1b(也参与细胞内蛋白质贩运的小GTP结合蛋白)和MAG1(酵母回报子亚单位vps29的同源物。这些结果进一步支持花粉管中受体内化的克拉仑机械。
虽然AGPS推测胸骨细胞外,但它们通过囊泡靶向血浆膜的外叶,该囊泡源于ER和GOLGI网络。在贩运细胞外基质期间,AGPS与细胞溶质蛋白如BZIP60或FBR / EIF5A相互作用,这两个调节蛋白在酵母双杂交实验中鉴定。
内吞作用作为必需植物细胞功能[69]和AGP6和AGP11可能参与了这一过程,我们进一步研究了微阵列数据。三种被称为植物核内体特异分子标记的Rab GTPases Ara6 (At3g54840)、Ara7 (At4g19640)和Rha1 (At5g45710,也是热胁迫转录因子家族成员)均下调agp6 agp11。RABA2(AT3G46830)和RABA3 GTP酶限定了覆盖具有VHA-A1(AT2G28520)的反式GOLGI内体膜(AT2G28520)一种特异性定位于TGN的膜整体V-ATP酶的同种型中的一种同种型[73].V-ATP酶的另一个亚基Det3是本研究中最下调的基因之一,并且已知参与植物生长和发展[74].
C2结构域是一种蛋白质结构域,参与将蛋白质靶向到细胞膜上。C2结构域是在多种蛋白质中发现的模块化脂质结合结构域,其功能包括囊泡运输、GTPase调节、脂质修饰、蛋白质磷酸化和泛素化[75].最后一组中研究最广泛的蛋白质是突触agmins (SYT)。有报道描述了c2结构域蛋白参与植物对非生物和生物胁迫的反应。Yang等人[26.,76表明拟南芥c2结构域蛋白BAP1在生物刺激诱导的细胞程序性死亡中起负调控作用。该基因在目前的微阵列实验和Guan和Nothnagel描述的Yariv微阵列实验中有差异表达[44.].在目前的数据集中,上调幅度第三大的基因是钙依赖的脂质结合蛋白CaLB (At3g57880),这是一个C2蛋白,在Yariv阵列中也上调。强调C2钙依赖膜靶向蛋白At1g70810在酵母-双杂交试验中被鉴定为AGP6的相互作用者似乎是相关的。此外,在对alata烟草进行的酵母双杂交试验中[77为了鉴定花粉蛋白可能参与破译雌蕊提供的化学信号,来自传递束的两个雌蕊特异性agp与花粉cDNA文库杂交。作者发现了与这些雌蕊agp相互作用的3个花粉蛋白,其中一个是C2结构域蛋白(NaPCCP)。
对本结果的分析进一步确定了AGP6和AGP11在膜运输中的可能累及,并且植物回货物可能存在于花粉管中,其中囊泡的运动非常重要。回转器是一种多蛋白复合物,其在真核续中被牢固地保守。它涉及跨膜受体的再循环,其介导真空/溶酶体水解酶的运输[78].在酵母中,转换由具有三个真空蛋白分选(VPS)蛋白,VPS35P,VPS29P和VPS26P的大亚基组成。这些蛋白质的同源物存在于哺乳动物和植物中。最近,Oliviusson等。[37.[植物复合物的三个VPS蛋白,即VPS35(AT3G51310),VPS29(AT3G47810)和VPS26(AT5G53530)局部局部化为烟草BY2细胞中的多猪体(MVB)。Mag1,VPS29的同源物在本阵列中差异地表达,如VPS26。此外,VPS29也在Yariv MicroArray数据中差异表达,MAG1是酵母 - 两个混合实验中的AGP11交互式之一。最近的数据强烈建议,转发器复杂在调解逆行贩运时保存了一种功能[38.VPS29参与了某些PM蛋白的循环,是植物器官启动过程中细胞极性建立所必需的[66].
本文提出了一个agp在花粉管发育中作用的工作模型,该模型整合了本工作中获得的数据(图)6).
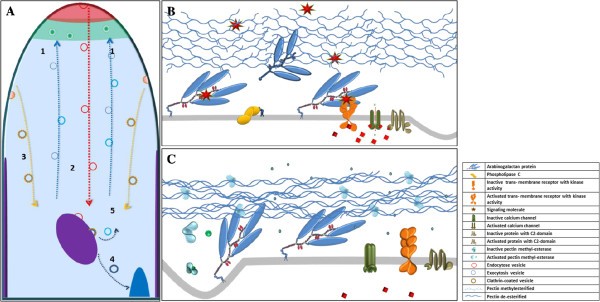
agp在花粉管生长中的作用模型。(一个)花粉管生长的公认模型[70,79图中显示了囊泡胞外吞作用(1)、平滑胞内吞作用(2)、网格蛋白囊泡胞内吞作用(3)、降解途径(4)和循环途径(5)。顶端圆顶(红色)、胞外吞作用区(绿色)、多囊体(紫色)和液泡(蓝色)。(B)提出了AGP信号在花粉管顶端圆顶中的作用模型。agp作为细胞外信号的受体,与跨膜蛋白(可能是受体激酶或C2结构域蛋白)相互作用。这些相互作用导致钙通道打开,触发各种细胞内事件。在花粉管生长过程中,agp通过内吞作用循环利用,并通过多泡体重复利用或降解。(C)提出的亚根尖区模型。细胞壁果胶由于与钙络合而硬化,阻碍AGP与假定的信号分子接触,使AGP失活。
方法
植物材料和生长条件
一个Ds-taggedAGP6 AGP11.纯合双零突变系[11通过杂交理研株系Ds54-4754-1和Ds11-4025-1(理研GSC拟南芥Ds转座子标签行收集,[81]),用于从生态型Nossen(NO-0线NACH NASC)的花粉收获和植物被用作对照。所有植物都萌发,生长在半力量Murashige和Skoog(MS)介质中互补,互补0.7%琼脂。然后将小植物转移到土壤中并在长期(16小时光/ 8小时暗)下在22℃下保持生长室,辐照为130μmolm-2年代-160%的相对湿度。
花粉分离和花粉管培养
根据Dardelle等人的研究,花粉是从新开放的花朵和发芽的花朵中采集的[82].将40朵开放的拟南芥放入每个1.5 mL微管中,用1 mL花粉生长培养基(5 mM KCl, 5 mM CaCl)轻轻旋转2,1 mm mgso4,0.01%h3.薄3.(10%蔗糖,pH 7.4)静置5分钟。然后用镊子取出花,微管3000rpm离心3分钟,弃上清。将准备用于花粉管培养的颗粒花粉分3组组合,重悬于1.25 mL新鲜花粉生长培养基中。将制备好的花粉转移到直径为20mm的平板烧瓶中,在22℃黑暗中培养8小时。将萌发的花粉管用60 μm目尼龙网过滤器(Millipore NY6004700)用生长介质冲洗,以丢弃未萌发的花粉粒。用大约1600朵花的花粉管获得每个独立的重复AGP6 AGP11.和野生类型。
affymetrix基因芯片的RNA分离、靶标合成及杂交
使用RNeasy Mini Kit (Qiagen, Hilden, Germany)提取总RNA。通过分光光度法测定浓度和纯度,使用安捷伦2100生物分析仪和RNA 6000纳米分析(安捷伦技术,帕洛阿尔托,CA)确认完整性。
根据制造商的GeneChip 3'IVT Express套件用户手册,将RNA处理用于Affymetrix(Santa Clara,CA,USA)GeneChip Arabidopsis Ath1基因组阵列。简而言之,在逆转录反应(GeneChip 3'IVT Express kit; Affymetrix)中使用100ng含有掺入的聚-RNA对照中的RNA总RNA;染色条件,以产生第一链cDNA。在第二链合成后,在16小时内使用双链cDNA在体外转录(IVT)反应生成aRNA (GeneChip 3 ' IVT Express Kit;Affymetrix)。使用Agilent 2100 Bioanalyzer和RNA 6000 Nano Assay分别评估了aRNA和片段aRNA的大小分布。
将15 μg片段的aRNA加入含有杂交对照的300 μl杂交混合物中。200 μl混合物在阵列上45℃杂交16 h。标准后杂交洗涤和双染色协议(FS450_0004;基因芯片HWS试剂盒,Affymetrix)用于Affymetrix基因芯片流体站450。在Affymetrix基因芯片扫描仪3000 7 G上扫描阵列。
GeneChip数据分析
首先使用Affymetrix Expression Console软件对扫描阵列进行分析,以获得缺席/在场通话,并确保所有质量参数均在推荐范围内。随后的分析由dna芯片分析仪(dChip) 2010进行(http://www.dchip.org哈佛大学程力实验室)。应用不变集归一化方法将6个阵列归一化为CEL强度中值的基线阵列[83].阵列的归一化仪的强度用于获得基于PM(完美匹配)的基于模型的基因表达指标 - 单模型[84].条件的重复数据(3个重复)采用反平方标准误差作为权重按基因进行加权。如果实验与基线fold change之间90%的低置信限高于1.3,则认为被比较的基因存在差异表达。下置信界准则意味着我们可以有90%的信心相信折叠变化是在下置信界和变量上置信界之间的一个值。李和王[83,84]的研究表明,低置信界限(LBFC)是fold变化的保守估计,因此作为基因表达变化的排名统计更可靠。
实时定量PCR (qPCR)
来自微阵列实验中使用的相同RNA制剂的样品使用Promega逆转录系统和Poly(DT)逆转录12 - 18来启动反应。利用iQ™SYBR®Green Supermix在iQ™5 Real-Time PCR检测系统(Biorad)上扩增cDNA。
所有QPCR反应都以重复运行。热循环设置如下:在95℃下初始变性3分钟,然后在72℃下以95℃,30秒在95℃和30秒处由10 s组成的四十℃。在每次运行之后,通过将样品从60至95℃加热来检查解离曲线以检查放大特异性。
串联稀释率AGP6 AGP11.和野生型花粉管cDNA,测定各引物对的效率曲线。所用引物如表所示5.以UBQ10作为内参基因。PCR循环结束时,采用iQ5 2.0, Standard Edition Optical System Software v2.0.148.060623 (Biorad), Livak计算方法分析数据[85].
半定量逆转录(RT)-PCR
在RT-PCR测定中也使用QPCR实验中使用的cDNA样品。RT-PCR反应在8个基因上进行,两种参考基因,UBC9和UBQ10进行(表5).用DreamTaq DNA聚合酶(Fermentas)进行PCR反应。每个PCR反应在95℃变性5分钟后开始,95℃30 s, 56℃30 s(所有引物对),72℃30 s。分别在25、30和35个循环后取样。使用两个内参基因对每个样品的cDNA数量进行归一化。采用柯达DC120凝胶电泳分析系统评估条带强度。
酵母双杂交文库筛选试验
AGP6和AGP11的预测肽核,其次是止挡密码子,被单独克隆到PGBTKT7向量(CLONTECH,PALO ALTO,CA)中,在XMAI部位修改以包括网关盒。诱饵构建体在α-y187菌株中引入[86].YPAD、SD和适当的漏出介质已在前面描述过[87].
诱饵品系与正常配对拟南芥PGADREC(Sommer和Masiero,未发布数据)中克隆的总植物cDNA文库,并在α-AH109酵母菌株(CLONTECH)中引入。
进一步对生长在所有选择性培养基(−Trp-Leu-Adenine-His和添加15mm 3-氨基-1,2,4-三唑)上的菌落进行了表征。提取pGADrec质粒,PCR扩增cDNA插入片段并测序。
酵母双杂交相互作用试验
利用每个候选基因的cDNA进行互作验证。利用RNeasy Mini Kit (Qiagen)从含有不同发育阶段花朵的拟南芥花序中提取RNA。用RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, Waltham, MA, USA)合成cDNA。通过PCR扩增这些基因的全长cDNA(见表1)6)与Phusion高保真DNA聚合酶(New England Biolabs, Ipswich, MA, USA)和使用GeneJET凝胶提取试剂盒(Thermo Scientific)从琼脂糖凝胶纯化。在可变剪接形式时,根据TAIR选择成熟形式对应的剪接。将每个基因的cDNA序列分别克隆到pGADT7载体(Clontech)中。
将每个诱饵/猎物对引入α-AH109酵母株(Clontech)中,作为自激活假阳性的对照,每个诱饵与空AD载体共转化到酵母株中,每个猎物与空BD载体共转化。在所有选择性介质(−Trp-Leu-Adenine-His和添加浓度从1 mM到2.5 mM 3-氨基-1,2,4-三唑)上生长的诱饵/猎物对群体被认为具有相互作用。
参考文献
- 1.
根毛和花粉管的膜运输和极性生长。昆虫学报。2007,58(1):65-74。
- 2。
Becker JD, Boavida LC, Carneiro J, Haury M, Feijó JA:拟南芥组织的转录分析揭示了花粉转录组的独特特征。植物营养与肥料学报。2003,33(4):713-725。10.1104 / pp.103.028241。
- 3.
HONYS D,TWELL D:拟南芥花粉转录组的比较分析。植物杂志。2003,132(2):640-652。10.1104 / pp.103.020925。
- 4.
Pina C,Pinto F,FeijóJA,Becker JD:拟南芥花粉转录组的基因家庭分析显示了对细胞生长,分裂控制和基因表达调节的生物学意义。植物杂志。2005,138(2):744-756。10.1104 / pp.104.057935。
- 5。
关键词:拟南芥,花粉萌发,花粉管生长,转录组分析,基因表达植物营养与肥料学报。2008,29(3):441 - 446。10.1104 / pp.108.126375。
- 6。
Qin Y, Leydon AR, Manziello A, Pandey R, Mount D, Denic S, Vasic B, Johnson MA, Palanivelu R:柱头和花柱的渗透在花粉管中诱导了一个新的转录组,指向雌蕊生长的关键基因。acta photonica sinica, 2009, 40(8): 1195 - 1196。10.1371 / journal.pgen.1000621。
- 7.
HONYS D,TWELL D:拟南芥单倍体男性配子瘤发育的转录组分析。基因组Biol。2004,5(11):R85。10.1186 / GB-2004-11-R85。
- 8.
Borner Ghh,Sherrier Dj,Weimar T,Michaelson LV,霍金斯ND,Macaskill A,Napier Ja,Beale MH,Lilley Ks,Dupree P:拟南芥中的洗涤剂膜分析。血浆膜脂筏的证据。植物杂志。2005,137:104-116。10.1104 / pp.104.053041。
- 9.
李志强,李志强,李志强:用糖基苯基偶氮染料沉淀阿拉伯酸和种子多糖。生物化学学报,2017,36(1):1 - 8。
- 10.
Ellis M,Egelund J,Schultz CJ,Bacic A:Arabinogalactan-蛋白:细胞表面的关键调节剂?植物杂志。2010,153:403-419。10.1104 / pp.110.156000。
- 11.
Coimbra S,Costa M,Jones B,Mendes Ma,Pereira LG:花粉谷物发育在Arabidopsis AGP6 AGP11 Null突变体中受到损害。J Exp Bot。2009,60(11):3133-3142。10.1093 / JXB / ERP148。
- 12.
Coimbra S,Costa M,Mendes Ma,Pereira Am,Pinto J,Pereira LG:Arabidopsis Pollen的早期萌发在Arabinogalactan蛋白基因AGP6和AGP11的双重突变体中。性植物团体。2010,23(3):199-205。10.1007 / s00497-010-0136-x。
- 13。
朱涛:基于浏览器的拟南芥基因组学功能分类管理器。中国海洋大学学报,2003,31(4):421 - 427。
- 14。
Berardini TZ, Mundodi S, Reiser L, Huala E, Garcia-Hernandez M, Zhang P, Mueller LA, Yoon J, Doyle A, Lander G, Moseyko N, Yoo D, Xu I, Zoeckler B, Montoya M, Miller N, Weems D, Rhee SY:拟南芥基因组受控词汇的功能注释。植物营养与肥料学报。2004,27(2):441 - 446。10.1104 / pp.104.040071。
- 15.
Warde-Farley D, Donaldson SL, Comes O, Zuberi K, Badrawi R, Chao P, Franz M, Grouios C, Kazi F, Lopes CT, Maitland A, Mostafavi S, Montojo J, Shao Q, Wright G, Bader GD, Morris Q: GeneMANIA预测服务器:基因优先排序和预测基因功能的生物网络集成。核酸学报2010,38(增刊2):W214-W220。
- 16。
Bindschedler LV,Palmblad M,Cramer R:用于定量植物蛋白质组学的整个植物(HILEP)的水培同位素标记;氧化应激案例研究。植物化学。2008,69(10):1962-1972。10.1016 / J.Phytochem.2008.04.007。
- 17.
Fernandez-Calvino L, Faulkner C, Walshaw J, Saalbach G, Bayer E, benites - alfonso Y, Maule A:拟南芥胞间连丝蛋白组。公共科学学报。2011,6 (4):e18880。10.1371 / journal.pone.0018880。
- 18.
ITO J,Batth Ts,Petzold CJ,Redding-Johanson Am,Mukhopadhyay A,Verboom R,Meyer EH,Millar Ah,Heazlewood JL:拟南芥细胞溶质蛋白质组的分析突出了中枢植物代谢的亚细胞分配。J蛋白质组。2011,10(4):1571-1582。10.1021 / PR1009433。
- 19.
Mitra S,Gantt J,Ruby J,Clouse S,Goshe M:使用替代溶解技术的拟南芥膜蛋白质组学分析。J蛋白质组。2007,6(5):1933-1950。10.1021 / PR060525B。
- 20.
Kronegg J, Buloz D:检测/预测蛋白(DGPI)中GPI切割位点(GPI-anchor)。1999年,http://129.194.185.165/dgpi/.
- 21.
在拟南芥和水稻中转录因子的质体和线粒体靶向特性的比较研究。中国生物医学工程学报。2007,27(6):631-646。10.1007 / s00438 - 007 - 0214 - 4。
- 22.
Schwacke R, Schneider A, van der Graaff E, Fischer K, Catoni E, Desimone M, Frommer WB, Flügge UI, Kunze R: ARAMEMNON,一个新的拟南芥完整膜蛋白数据库。植物生理学报。2003,31(1):16-26。10.1104 / pp.011577。
- 23.
梁晓东,李晓东,李晓东。拟南芥基因调控信息服务器的研究进展。生物工程学报,2011,39(4):591 - 598。10.1093 / nar / gkq1120。
- 24。
Zybailov B, Rutschow H, Friso G, Rudella A, Emanuelsson O, Sun Q, van Wijk KJ:分选信号,n端修饰和叶绿体蛋白质组丰度。公共科学图书馆。2008,3 (4):e1994。10.1371 / journal.pone.0001994。
- 25。
本书AJ, Gladman NP, Lee SS, Scalf M, Smith LM, Vierstra RD:拟南芥26S蛋白酶体的亲和纯化揭示了多种植物蛋白水解复合物。中国生物医学工程学报。2010,27(3):457 - 461。10.1074 / jbc.M110.136622。
- 26。
杨华,杨树华:拟南芥BAP1和BAP2基因对程序性细胞死亡的抑制作用。植物营养与肥料学报。2007,32(4):457 - 461。10.1104 / pp.107.100800。
- 27。
Benschop JJ,穆罕默德S,O'Flaherty M,Heck AJ,Slijper M,Menke FL:拟南芥早期Elicitor信号传导的定量磷蛋白质。Mol细胞蛋白质组学。2007,6(7):1198-1214。10.1074 / MCP.M600429-MCP200。
- 28。
Marmagne A, Ferro M, Meinnel T, Bruley C, Kuhn L, Garin J, Barbier-Brygoo H, Ephritikhine G:高含量的脂质修饰外周蛋白和整合受体激酶是拟南芥质膜蛋白组的特征。细胞蛋白质组学。2007,6(11):1980-1996。10.1074 / mcp.M700099-MCP200。
- 29.
Bayer EM, Bottrill AR, Walshaw J, Vigouroux M, Naldrett MJ, Thomas CL, Maule AJ:利用多维蛋白质鉴定技术定义拟南芥细胞壁蛋白质组。蛋白质组学。2006,6(1):301-311。10.1002 / pmic.200500046。
- 30.
Jaquinod M,Villiers F,Kieffer-Jaquinod S,Hugouvieux v,Brululy C,Garin J,Bourguignon J:从细胞培养中分离的拟南芥植物植物的蛋白质组学解剖。Mol细胞蛋白质组学。2007,6(3):394-412。
- 31.
帕森斯HT,克里斯琴森K, Knierim B,卡罗尔,Ito J, Batth TS, Smith-Moritz,莫里森年代,杰•麦克伦尼P,哈迪MZ,奥尔米,Mukhopadhyay,作品CJ, Scheller高压,Loque D, Heazlewood杰:隔离和蛋白质组学特征的拟南芥高尔基小说定义功能和组件参与植物细胞壁的生物合成。植物生理学报。2012,59(1):12-26。10.1104 / pp.111.193151。
- 32.
Nikolovski N, Rubtsov D, Segura MP, Miles GP, Stevens TJ, Dunkley TP, Munro S, Lilley KS, Dupree P: LOPIT蛋白质组学揭示了推定的糖基转移酶和其他植物高尔基体蛋白。植物杂志。在出版社。
- 33.
Borderies G, Jamet E, Lafitte C, Rossignol M, Jauneau A, Boudart G, Monsarrat B, Esquerré-Tugayé MT, Boudet A, Pont-Lezica R:拟南芥细胞悬浮培养松散结合细胞壁蛋白的蛋白质组学:一个关键分析。电泳。2003,24(19-20):3421-3432。
- 34.
拟南芥synaptotagmin SYTA调控细胞内吞作用和病毒运动蛋白的细胞-细胞运输。美国国家科学院学报。系统工程理论与实践,2016,35(6):527 - 534。10.1073 / pnas.0909080107。
- 35.
拟南芥中钙依赖的抗冻性涉及通过synaptotagmin SYT1的膜重新封闭。植物学报。2008,20(12):3389-3404。10.1105 / tpc.108.062679。
- 36。
Minic Z, Jamet E, Négroni L, Arsene der Garabedian P, Zivy M, Jouanin L:拟南芥成熟茎的亚蛋白质组被刀豆蛋白A捕获,在细胞壁糖苷水解酶中富集。应用生态学报。2007,58(10):2503-2512。10.1093 / jxb / erm082。
- 37。
在拟南芥中,植物反转录因子可能与液泡分选受体相互作用。acta botanica sinica(云南植物研究),2006,28(4):429 - 434。10.1105 / tpc.105.035907。
- 38。
jillais Y, Santambrogio M, Rozier F, Fobis-Loisy I, Miège C, Gaude T:反转录蛋白VPS29连接植物细胞极性和器官启动。细胞。2007,130:1057-1070。10.1016 / j.cell.2007.08.040。
- 39。
基于反转录酶依赖液泡靶向的植物生长素外排载体PIN2的降解。美国国家科学院学报。中国科学(d辑:地球科学),2008,35(4):417 - 417。10.1073 / pnas.0808073105。
- 40.
Grienenberger E, Besseau S, Geoffroy P, Debayle D, Heintz D, Lapierre C, Pollet B, Heitz T, Legrand M:一种BAHD酰基转移酶在拟南芥花药的绒膜中表达,并参与羟基肉桂酰亚胺的合成。植物学报,2009,58(2):246-259。10.1111 / j.1365 - 313 x.2008.03773.x。
- 41.
Dobritsa AA, Geanconteri A, Shrestha J, Carlson A, Kooyers N, Coerper D, Urbanczyk-Wochniak E, Bench BJ, Sumner LW, Swanson R, Preuss D:拟南芥花粉外壁产生相关基因的大规模遗传筛选。植物营养与肥料学报。2011,27(2):457 - 461。10.1104 / pp.111.179523。
- 42。
(1)拟南芥丝裂原活化蛋白激酶磷酸酶PP2C5对种子萌发、气孔开度和脱落酸诱导基因表达的影响。植物营养与肥料学报。2010,29(3):441 - 446。10.1104 / pp.110.156109。
- 43.
Schweighofer A, Kazanaviciute V, Scheikl E, Teige M, Doczi R, Hirt H, Schwanninger M, Kant M, Schuurink R, Mauch F, Buchala A, Cardinale F, Meskiene I:拟南芥中pp2c型磷酸酶AP2C1负调控MPK4和MPK6,调节天然免疫、茉莉酸和乙烯水平。植物学报。2007,19(7):2213-2224。10.1105 / tpc.106.049585。
- 44.
Yariv苯基糖苷与阿拉伯半乳糖蛋白的结合在拟南芥细胞培养中引发创伤样反应。植物营养与肥料学报。2004,27(3):441 - 446。10.1104 / pp.104.039370。
- 45.
丁磊,朱建坤:阿拉伯半乳糖蛋白在根表皮细胞扩张中的作用。植物学报。1998,21(4):497 - 503。10.1007 / s004250050194。
- 46.
王志强,王志强,王志强,等:百合花粉管中苯基糖苷对细胞壁组装的影响。植物学报。1998,20(4):457 - 461。10.1007 / s004250050279。
- 47.
王志强,王志强,王志强:阿拉伯半乳聚糖蛋白、花粉管生长和亚立夫苯糖苷的可逆效应。原生质。2002,219:89-98。10.1007 / s007090200009。
- 48.
南芥(Arabidopsis thaliana)根内半乳糖蛋白(arabin半乳糖)蛋白的破坏。植物学报,2007,52:240-251。10.1111 / j.1365 - 313 x.2007.03224.x。
- 49。
F-box蛋白家族。中国生物医学工程学报。2000,1 (5):R3002。
- 50.
许国光,马洪,内明,孔洪涛:植物F-box基因的进化:序列分化的不同模式及其与功能多样化的关系。美国国家科学院学报。2009年,106:835 - 840。10.1073 / pnas.0812043106。
- 51.
王志强,王志强,王志强,等。F-box蛋白的分子生物学研究进展[j] .中国生物医学工程学报,2009,29(6):641 - 646。10.1016 / j.cell.2009.05.039。
- 52.
华志,邹超,邵绍华,陈志强:植物界F-Box (FBX)超家族的系统发育比较揭示了基因组漂移的不同进化历史。公共科学图书馆。2011,6:e16219。10.1371 / journal.pone.0016219。
- 53.
Gusti A,Bauberger N,Dyack M,Pusch S,Eisler H,Potuschak T,De Veylder L,Schnittger A,Genschik P:Arabidopsis Thaliana F Box Protein FBL17对于通过调查过程中的第二种有丝分裂的进展至关重要。Plos一个。2009,4(3):E4780。10.1371 / journal.pone.0004780。
- 54。
Doelling JH, Phillips AR, Soyler-Ogretim G, Wise J, Chandler J, Callis J, Otegui MS, Vierstra RD:泛素特异性蛋白酶亚家族UBP3/UBP4在拟南芥花粉发育和传播中至关重要。植物营养与肥料学报。2007,31(4):457 - 461。10.1104 / pp.106.095323。
- 55.
Dobney S, Chiasson D, Lam P, Smith SP, Snedden WA:钙调素相关钙传感器CML42在毛状体分支中起作用。中国生物医学工程学报。2009,31(4):457 - 461。10.1074 / jbc.M109.056770。
- 56.
Popescu SC, Popescu GV, Bachan S, Hang Z, Seay M, Gerstein M, Snyder M, Dinesh-Kumar SP:通过高密度拟南芥蛋白微阵列揭示钙调素相关蛋白与靶蛋白的差异结合。美国国家科学院学报。[j] .光子学报,2007,40(11):4730-4735。10.1073 / pnas.0611615104。
- 57.
Schiøttm,罗马斯基SM,Bækgaardl,jakobsen mk,palmgren mg,harper j:正常花粉管生长所需的植物质膜Ca2 +泵。美国国家科学院学报。2004,101:9502-9507。10.1073 / PNAS.0401542101。
- 58.
通过对雌蕊转录组的比较分析,揭示了干、湿和半干柱头中保守基因和新基因的表达。植物营养与肥料学报,2010,29(4):513 - 514。10.1104 / pp.110.162172。
- 59.
Boavida LC, Borges F, Becker JD, Feijó JA:拟南芥花粉-雌蕊相互作用中基因表达的全基因组分析揭示了信号和代谢途径的协调激活。植物营养与肥料学报。2011,32(4):457 - 461。10.1104 / pp.110.169813。
- 60.
埃雷曼CJ,Dickinson HG:花粉/耻辱和宿主/病原体相互作用之间的共性:Brassica Oleracea花粉管的耻骨渗透过程中的钙积累。性植物团体。1999年,12:194-202。10.1007 / S004970050192。
- 61.
Gibbs GM, Roelants K, O’bryan MK: CAP超家族:富含半胱氨酸的分泌蛋白,抗原5和致病相关蛋白-在生殖、癌症和免疫防御中的作用。endr Rev. 2008, 29: 865-897。10.1210 / er.2008 - 0032。
- 62.
Gibbs GM, Lo JCY, Nixon B, Jamsai D, O’connor AE, Rijal S, Sanchez-Partida LG, Hearn MTW, Bianco DM, O’bryan MK:胶质瘤发病机制相关的1-like 1在男性生殖细胞成熟过程中富集睾丸、动态修饰和重新分布,并在精子-卵母细胞结合中具有潜在作用。内分泌与内分泌学杂志。10.1210 / en.2009 - 1255。
- 63.
Ohnishi T, Takanashi H, Mogi M, Takahashi H, Kikuchi S, Yano K, Okamoto T, Fujita M, Kurata N, Tsutsumi N:细胞类型特异性微阵列显示水稻卵子和助细胞的独特基因表达谱。植物营养与肥料学报。2011,32(4):591 - 598。10.1104 / pp.110.167502。
- 64.
关键词:花粉管接收,真菌入侵,保守分子,分子生物学中国科学(d辑):地球科学(英文版)。10.1126 / science.1195211。
- 65.
Govers F, Angenent GC:特洛伊木马般的生育女神。中国科学:地球科学,2010,33(6):922-923。10.1126 / science.1198347。
- 66。
质膜蛋白的泛素化和内吞作用:泛素蛋白连接酶Nedd4/Rsp5p家族的作用。中国生物医学工程学报,2000,22(1):1- 7。
- 67.
Dunn R, Klos DA, Adler AS, Hicke L: Rsp5泛素连接酶的C2结构域结合膜磷酸肌苷并引导内体货物的泛素化。中国生物医学工程学报。2004,31(1):135-144。10.1083 / jcb.200309026。
- 68.
Šamaj J, Read D, Volkmann D, Menzel D, Baluska F:植物的内吞网络。细胞生物学杂志。2005,15:425-433。10.1016 / j.tcb.2005.06.006。
- 69.
王志强,王志强,王志强:植物核内体系统的研究进展。植物营养与肥料学报。2008,31(4):457 - 461。10.1104 / pp.108.120105。
- 70.
赵Y,燕,Feijo是的,Furutani M, Takenawa T,黄,傅Y, Z杨:磷酸肌醇调节clathrin-dependent内吞作用在拟南芥和烟草花粉管的尖端。植物学报。2010,22(12):4031-4044。10.1105 / tpc.110.076760。
- 71.
Herman EM, Lamb CJ:富含阿拉伯半乳糖的糖蛋白位于细胞表面和泡内多泡体中。植物生理学报。1992,19(4):591 - 598。10.1104 / pp.98.1.264。
- 72.
Šamaj,Šamajováo,彼得斯M,Baluškaf,lichtscheidli,knox jp,Volkmann d:与植物细胞端瘤相关的LM2 Arabinogalactan-蛋白表位的免疫循环化。原生质。2000,212:186-196。10.1007 / BF01282919。
- 73.
黄建平,张建平,张建平:拟南芥液泡中H+- atp酶活性对胞内吞和分泌的调控作用。acta botanica sinica(云南植物研究),2006,28(4):427 - 434。10.1105 / tpc.105.037978。
- 74.
拟南芥突变体det3揭示了液泡内H(+)- atp酶在植物生长发育中的重要作用。基因工程学报,1999,13:3259-3270。10.1101 / gad.13.24.3259。
- 75.
Catz SD, Johnson JL, Babior BM:在活细胞中,JFC1的C2A结构域与3 ' -磷酸化的磷酸肌苷结合并指导质膜关联。美国国家科学院学报。[j] .中国机械工程,2017,27(18):1292 - 1298。10.1073 / pnas.172382799。
- 76.
关键词:拟南芥,C2结构域蛋白BAP1,防御反应植物学报,2006,48:238-248。10.1111 / j.1365 - 313 x.2006.02869.x。
- 77.
花粉蛋白结合到烟草唇形雌蕊阿拉伯半乳糖蛋白的c端结构域。中国生物医学工程学报。2008,29(3):457 - 461。10.1074 / jbc.M804410200。
- 78。
Pourcher M,Santambrogio M,Thazar N,Thierry Am,Fobis-Loisy I,Miègec,jaillais y,Gaude t:分析Nexins揭示了拟南芥的开发和蛋白质分类中的独特反射子分组功能。植物细胞。2010,22(12):3980-3991。10.1105 / TPC.110.078451。
- 79.
Bove J,Vaillancourt B,Kroeger J,Hepler PK,Wiseman PW,Geitmann A:使用时空图像相关光谱(STICS)生长花粉管中的囊泡动力学的幅度和方向和光漂白(FRAP)后的荧光回收。植物杂志。2008,147(4):1646-1658。10.1104 / pp.108.120212。
- 80.
果胶甲基酯酶与花粉管中的果胶动态。植物学报。2005,17(12):3219-3226。10.1105 / tpc.105.037473。
- 81.
Kuromori T, Hirayama T, Kiyosue Y, Takabe H, Mizukado S, Sakurai T,秋山K, Kamiya A, Ito T, Shinozaki K:拟南芥中11800个单拷贝Ds转座子插入系。植物学报,2004,37:897-905。10.1111 / j.1365.313X.2004.02009.x。
- 82.
Dardelle F, Lehner A, Ramdani Y, Bardor M, Lerouge P, Driouich A, Mollet JC:拟南芥花粉管细胞壁的生化和免疫细胞学特征。植物营养与肥料学报。2010,29(4):453 - 457。10.1104 / pp.110.158881。
- 83.
李C,黄HW:基于模型的寡核苷酸阵列分析:表达指数计算和异常检测。美国国家科学院学报。2001,98:31-36。10.1073 / pnas.98.1.31。
- 84.
李超,黄宏文:基于模型的寡核苷酸阵列分析:模型验证、设计问题和标准误差应用。中国生物医学工程学报。2001,2 (8):R32。
- 85.
Livak KJ, Schmittgen TD:使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001,25(4):402-408。10.1006 / meth.2001.1262。
- 86.
陈志强,陈志强,陈志强:酵母细胞高效转化的新方法。核酸学报1992,20:1425。10.1093 / nar / 20.6.1425。
- 87.
谢尔曼·F:先从酵母开始。方法:酶法。2002,350:3-41。
致谢
作者谨此感谢Yu Guan和Eugene Nothnagel,以便提供微阵列文件和ZoëPopper,以便阅读稿件。
这项工作得到了通过COMPETE计划的联邦基金和FCT (Fundação para a Ciência e Tecnologia,葡萄牙)国家基金在PTDC/AGR-GPL/67971/2006和PTDC/AGR-GPL/115358/2009项目中的支持。此外,COST Action FA0903支持MSN对米兰大学的合作研究访问。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MC进行了分子遗传学研究;MSN进行酵母 - 二杂交测定;SM设计了酵母 - 二杂化测定;JB进行了微阵列实验;MIA参加了数据分析;LGP参与了研究的设计,并帮助起草了手稿。该项目的PI,PI构思了该研究及其协调并起草了手稿。所有作者阅读并认可的终稿。
电子辅料
突变微阵列数据。
额外的文件1:AGP6 AGP11.突变微阵列数据。(XLSX 3 MB)
12870 _2012_1196_moesm2_esm.docx
附加文件2:agp6和agp11突变体共同的差异表达基因,用Yariv苯基糖苷试剂处理1小时和10小时(docx20 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
科斯塔,诺布雷,m.s.,贝克尔,J.D.et al。拟南芥花粉和花粉管中阿拉伯半乳聚糖蛋白6和阿拉伯半乳聚糖蛋白11互作子的表达和定位检测。BMC植物BIOL.13,7(2013)。https://doi.org/10.1186/1471-2229-13-7
收到了:
接受:
发表:
关键字
- 拟南芥
- Arabinogalactan蛋白质
- 花粉管
- 微阵列
- 酵母2台混合动力