摘要
背景
Thaxtomin A (TA)是植物病原菌产生的一种植物毒素链霉菌属仕达屋优先计划.负责马铃薯常见结痂。TA在扩张植物组织中抑制纤维素生物合成,是诱导疾病所必需的。各种植物组织的生长素处理已多次被证明可以抑制TA毒性和减少常见的结痂。这项工作利用了拟南芥对纤维素生物合成抑制剂(CBIs)的抗性突变体进行研究,以研究TA、其他CBIs和生长素之间的相互作用。
结果
三抗CBI答:芥突变体;txr1-1(对TA的公差),ixr1-1(耐受异沙本- IXB)和KOR1(纤维素缺乏症)表明,使用天然或合成生长素或生长素外排转运抑制剂2,3,5-三碘苯甲酸(TIBA)处理后,根的生长反应没有改变。然而,所有突变体对1-萘基邻苯二甲酸(NPA)的耐受性都显著增强,NPA是另一种生长素外排运输抑制剂,它在与TIBA不同的位点阻断生长素的极性运输。NPA公差txr1-1而且ixr1-1的电生理分析进一步支持了净H+通量在成熟区,但没有伸长的根。这三个突变体对IXB的耐受性都有所增加,但只是txr1-1对TA表现出耐受性。没有突变体表现出对第三种CBI双氯苯腈(DCB)的耐受性增强。
结论
我们已经证明,植物对TA和IXB的耐受性,以及根系细胞壁合成的修改,导致了对NPA特异的共抗性,而不是TIBA。这表明CBI抗性对与NPA结合蛋白相关的生长素极性外排转运过程有影响。结果表明,NPA抑制反应发生在成熟根区,而非伸长根区。突变体对CBIs的反应表明TA和IXB的作用模式相似,但不完全相同,而DCB则相反。
背景
Thaxtomin A (TA)是病原菌产生的主要植物毒素链霉菌属马铃薯常见赤霉病是全球重要的马铃薯病害[1].TA在扩张植物组织中抑制纤维素生物合成,其产生对疾病诱导至关重要[2- - - - - -4].根据所产生症状的相似性,认为TA与其他纤维素生物合成抑制剂密切相关,如异沙本(IXB)和二氯苯尼尔(DCB) [5].这些化合物的作用模式之间的联系已通过对TA的习惯化研究得到证实,揭示了对IXB和DCB的交叉耐药性[6],尽管没有研究耐药性的机制。
TA的细胞靶点尚未确定[6,7].这与IXB形成对比,在IXB中,突变分析已经确定了来自质膜的特定纤维素合成酶(CesA)复合物(CesA3和CesA6)作为毒素靶点[8,9].也间接鉴定出DCB的假定细胞靶点,包括CesA1或CesA5和其他调控蛋白[10,11].最近的一项研究表明,在TA和IXB处理后,相似的基因被上调答:芥细胞表明这两种CBI之间的活性可能存在联系[12].TA与植物细胞膜之间的初始相互作用导致离子通量信号传导已被报道[13],如诱导程序性细胞死亡[14].然而,关于TA细胞毒性的确切机制尚不清楚。TXR1基因参与了一个细胞运输系统,在这个基因的突变拟南芥txr1-1导致毒素敏感性下降,很可能是由于毒素摄取减少[15].
在先前的研究中,我们已经证明了TA毒性与生长素或生长素样化合物之间的负相关[13,16,17].用生长素和类生长素化合物处理马铃薯叶片已被证明可抑制常见赤霉病的发展[17,18].我们实验室的工作提供了证据,证明疾病抑制机制是由于生长素抑制TA毒性[16,17].这和其他电生理数据一样,由此可见生长素的敏感性答:芥突变体(Ucu2-2和gi2)对TA的敏感性增加[13]进一步支持了生长素与TA毒性之间的联系。然而,其他研究人员[12他们对TA和生长素本身之间的直接因果关系提出了质疑,因为他们注意到很少有生长素基因会对TA做出反应。因此,生长素与TA之间的相互作用仍不清楚。
利用抗CBI答:芥具有良好特征的突变体可能为描述和理解抗病途径、作用机制和相互作用提供重要资源[19].在TA的例子中,一个抗性突变体txr1-1已被描述[15]也有抗IXB突变体ixr1-1[20.以及细胞壁合成所需基因的功能丧失突变KORRIGAN(KOR1) [21,22].这些突变体和其他突变体可能在描述对cbi和生长素化合物反应的异同方面发挥作用,并可作为定义TA和相关化合物之间进一步相互作用的有用工具。
在本工作中,我们研究了TA毒性的独特相互作用及其生长素的改善。我们证明这种相互作用不是生长素的直接作用本身,而是通过与外排载体的NPA结合蛋白相关的生长素极性转运相互作用介导的。此外,关键突变体的反应表明,IXB和TA的作用模式可能具有共性,而DCB的关系似乎更遥远。
结果
抗各种生长素来源的突变体筛选
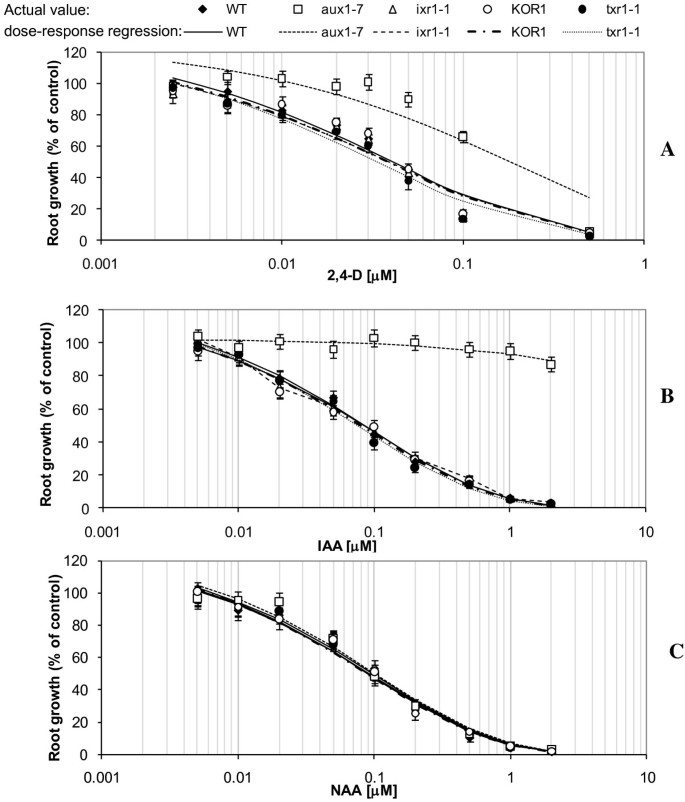
与以往的研究一致[23),aux1-7对2,4- d (P= 0.0004,F= 15.6)和IAA (P< 0.0001,F= 35.4),但NAA (P= 0.81,F= 0.06),与RG相比50WT控制的值(图1).抗TA系txr1-1(P= 0.32 - -0.85,F= 0.04 - -1.02),ixr1-1(P= 0.78 - -0.93,F= 0.01-0.08)和KOR1(P= 0.56 - -0.95,F= 0.01-0.56)均表现出对所有三种生长素的敏感性,与WT对照相当(图1).
对生长素转运抑制剂反应改变的突变体
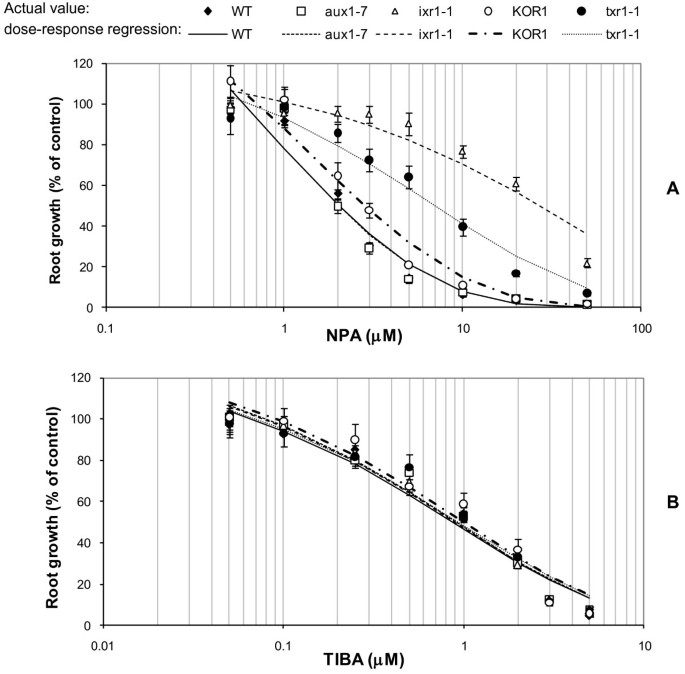
所有三个答:芥检测CBI突变体(ixr1-1,txr1-1, KOR1)显示出与WT相比,增强了根部对生长素转运抑制剂NPA的抗性(图2A).抑制根生长50%所需的NPA浓度水平(RG50)的比例约为(ixr1-1;RG50: 27.1 μm;P< 0.0001,F= 25.2), 3.5倍(txr1-1;RG50: 7.08 μm;P= 0.0005,F= 14.5倍)及1.5倍(KOR1;3.07μM,P= 0.047,F= 4.2)高于WT (RG .50: 2.04 μm)。回应aux1-7与WT (P= 0.94,F= 0.01)。相比之下,所有突变品系和WT对照在不同浓度的生长素转运抑制剂TIBA处理下表现出相当的根系生长抑制(图2)2B)。
生长素转运抑制剂NPA预处理后根系离子通量
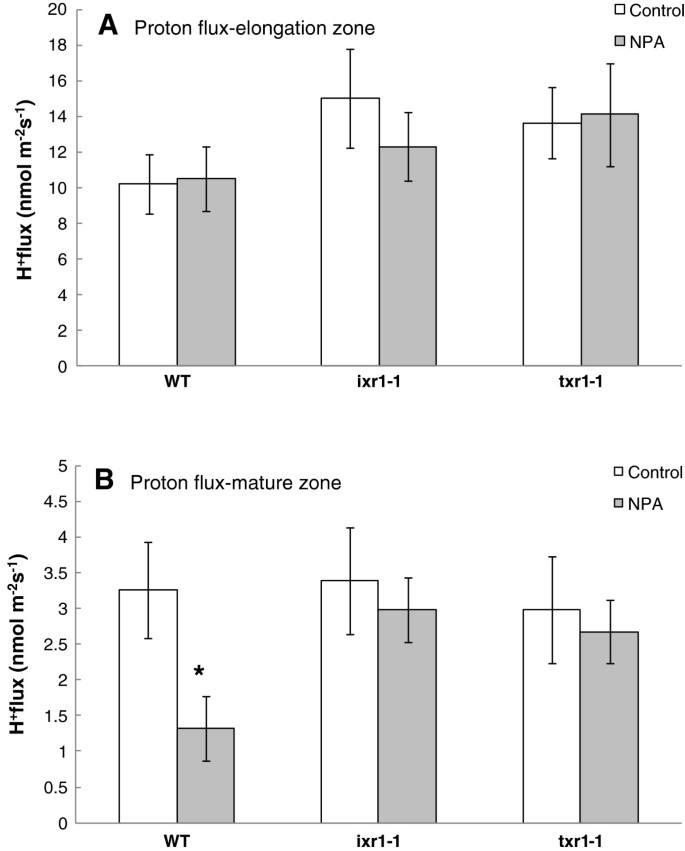
没有区别答:芥净H分析显示基因型+根系伸长区对NPA的响应通量;所有植物均为净H+吸光度10 ~ 16 nmol m-2年代-1,与未处理对照组无显著差异(图3.A).成熟根区净H较低+摄取(0.5 ~ 5 nmol m-2年代-1)在所有基因型中都有记录。与延伸区相比,NPA导致净H显著降低+摄取,WT (P< 0.05),但在CBI抗性突变体中无明显差异(ixr1-1,txr1-1)(图3.B)。
对CBIs有差异反应的突变体
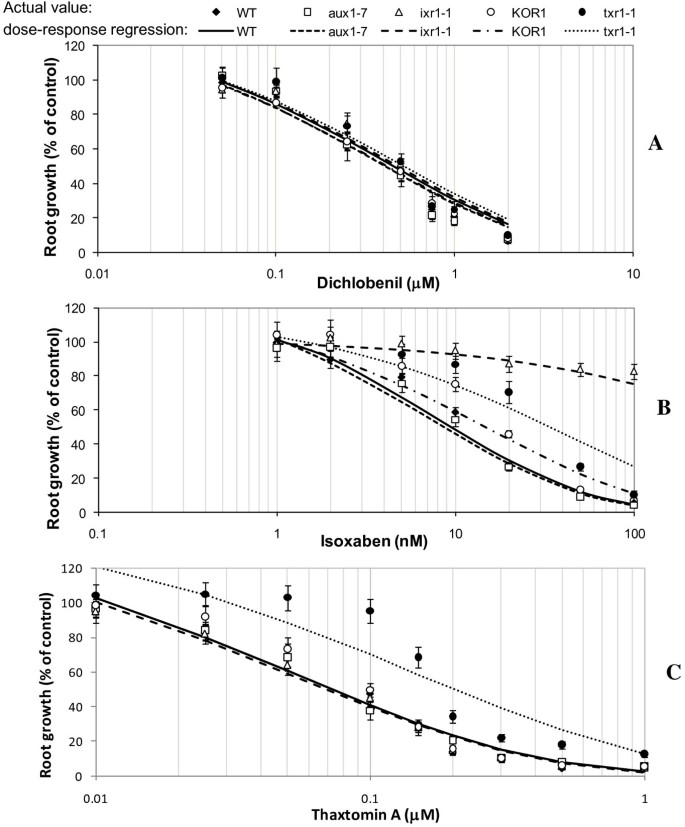
根的生长速度答:芥测试的线每天变化在5到9毫米之间-1(取决于基因型)在没有施加毒素的对照条件下(数据未显示)。用RG测试的所有5个基因型的根生长模式对DCB的反应是一致的50与对照WT基因型相比,差异无显著性(图4一个)。
3个CBI突变体对IXB的耐受性增强aux1-7对WT的响应没有不同(图4B).耐受性增强的幅度随ixr1-1, txr1-1和KOR1大约有10倍(P< 0.0001,F= 26.3), 4倍(P= 0.0004,F= 15.2)和1.8倍(P= 0.04,F= 4.8)对IXB的耐受性分别大于WT。
各品系的根生长速率随TA浓度的增加而降低(图2)4C),并伴有其他典型症状,包括肥大、坏死和褪绿[15,17,24]也观察到。如预期[15],在助教在场的情况下txr1-1突变体的根生长速率(RG500.20 μM;P< 0.0001,F= 24.5)500.073 μM)。其他突变体对TA的耐受性均与WT不同(aux1-7 P= 0.92,F= 0.01;ixr1-1 P= 0.77,F= 0.09,和KOR1 P= 0.85,F= 0.03)(图4C)。
CBI和NPA处理后根组织中CBI水平的定量研究
与以往的研究一致[15),txr1-1是唯一显著积累(PTA值< 0.05,4倍)低于其他供试品系;加入NPA和TA,产生相同的结果(表1).来自根组织的IXB定量显示出一些变化,尽管NPA处理和未处理的株系之间没有显著差异。这条线txr1-1的最低检出率(表1).
讨论
生长素:thaxtomin相互作用-生长素可能与抗CBIs没有直接关系
我们之前对IAA和NAA的研究答:芥[13,17]和马铃薯中2,4- d的含量[17]表明TA毒性与处理介质或植物组织内生长素含量呈负相关。然而,这种关联的具体性质尚不清楚。最近对TA和IXB反应的转录谱研究表明,这些cbi上调了少数生长素反应基因,作者认为这些化合物不作用于生长素受体[12].此外,Errakhi和他的同事[25]发现添加IAA对TA诱导的电生理H无影响+的变化拟南芥,并建议TA和IAA在这个层面上没有相互作用。为了支持这些发现,我们证明了三种CBI的根系生长响应答:芥突变体(ixr1-1,KOR1,txr1-1)没有被任何三种生长素(2,4- d, IAA和NAA)改变。这表明,在这些突变体中赋予抗性的共同机制:ixr1-1-改变的特异性纤维素合成酶(CesA)配合物[8,9,26];KOR1-纤维素缺乏[21,22,27];txr1-1-改变纤维素合成活性[7,15];不影响生长素的吸收和相关的根生长反应,表明没有直接的CBI -生长素相互作用。
生长素运输与抗CBIs的联系
虽然在本研究或其他研究中没有发现直接的CBI -生长素相互作用[12,25]杜瓦尔和博杜安[12]发现PINOID- binding protein (PBP1)基因和TOUCH3基因(TCH3)都与PINOID (PID)结合,在IXB和TA的作用下表达上调。PID是一种蛋白激酶,可作为生长素外排极性转运的正调节因子[28].虽然这表明抑制纤维素合成和生长素运输之间存在联系,但还需要更明确的证据[12].我们在这里提出的结果可以利用答:芥为描述和理解抗病途径和作用机制提供重要资源的突变体[19].在这种情况下,纤维素生物合成中的修饰答:芥突变体提供了生长素运输和抑制纤维素合成之间的联系。
微分响应答:芥两种关键生长素转运抑制剂的CBI突变
三种纤维素合成特性改变突变体的抗性(ixr1-1,KOR1,txr1-1)向NPA转化意味着纤维素合成和这种生长素运输外排抑制剂之间可能存在相互作用。研究发现,这些突变体对第二种生长素外排抑制剂TIBA的抗性都没有增强,而TIBA具有与NPA不同的细胞结合位点,这证明了这种相互作用的特异性[29,30.].
生长素外排载体位点和作用于这些位点的抑制剂的作用方式都不完全清楚[29,31]随着生长素运输的复杂性和载体的不断进化[32- - - - - -34].然而,NPA作为分泌过程的一般抑制剂(通过与假定的NPA结合蛋白结合),与生长素外排载体位点相关[31,35].相比之下,TIBA的结合位点直接与生长素外排载体位点相关[30.]不同于假定的npa结合蛋白[35].值得注意的是,生长素转运和结合研究表明,所有类型的生长素转运抑制剂作用的位点与外排载体上的生长素结合位点不同,即它们与生长素不具有竞争性[30.].考虑到所有三个CBI突变体对生长素源均无反应,这表明这些与纤维素合成相关的突变也引发了对抑制生长素极性转运的特定化合物(即NPA)的修改反应,而不是生长素本身,并表明CBI-生长素相互作用可能与NPA特异性结合生长素外流载体相关的间接过程有关。
的NPA电阻ixr1-1而且txr1-1我们研究的突变株分别比野生型高13倍和3.5倍,但NPA抗性的性质尚不清楚。在这两种CBI突变体中发现NPA抗性,此前未见报道。这些突变体为进一步理解npa结合提供了有用的研究工具[36],纤维素生物合成及其复杂性。
必须指出的是,在这些研究中使用NPA确实有一些局限性。其中包括NPA具有复杂的作用模式,它不是特定于生长素运输,而是分泌过程的一般抑制剂[31,35].此外,NPA可能以不同浓度靶向不同的蛋白质和转运蛋白[32,33].
生长素转运抑制剂NPA影响成熟根区离子稳态,但不影响延伸根区离子稳态
在WT线中,NPA处理对成熟根区质子通量有影响,但对延伸根区无影响。H的抑制+成熟根区的通量反映了所研究的三种基因型的根系生长抑制模式。H的减少+通量可归因于正常生长类型反应的停止,如对毒素的反应[13]或外来化合物[37].考虑到生长素在根尖控制细胞分裂方面已被证实的作用,主要的反应发生在成熟区而不是伸长区,这是出乎意料的[38]表示不同的动作模式。NPA可能在一定程度上抑制了内生生长素从根尖向成熟区的极性转运,从而影响了成熟区的正常生长过程和通量动态。在本试验中,CBI抗性突变体再次证明了NPA耐受性ixr1-1而且txr1-1.这些结果进一步支持了纤维素合成的抑制与NPA影响的生长素外排转运过程之间的联系。
CBI的吸收不受NPA存在的影响
为了确定CBI和NPA抗性之间可能的相互作用,对突变系中两种毒素、TA和IXB的摄取进行了监测。从这些定量分析得出的结论是,NPA不影响CBI的摄取,这表明这些化合物之间没有直接的相互作用。必须指出的是,这项工作只是初步的性质,生长素化合物本身的存在可能对CBI的吸收有更大的影响,因为这已在以前得到证明[16,17],因此有必要进一步研究存在生长素源的CBI摄取。尽管如此,这里提出的新方法证实了以前的发现txr1-1改变了运输成分,减少了TA的摄取[15从而减少了在根组织中积累的化合物。
对CBIs有差异反应的突变体
测试CBI答:芥本文所述突变体或其他植物细胞系统中的突变体,如对CBIs具有抗性的习惯性杨树细胞悬液[6]可以帮助识别各种毒素的共同机制[19,39以及突变体抵抗机制的相似性。更好地理解这些复杂性将有助于更好地理解植物细胞如何对毒素做出反应,以及有关纤维素合成的关键信息[6].事实上,在这项研究中,相似的反应尤其由txr1-1而且ixr1-1对IXB和NPA的多重抗性增强表明TA和IXB具有共同的作用模式。众所周知,txr1-1缺乏TXR1基因产物,怀疑该产物参与转运系统[15].因此,IXB和NPA都可能以某种方式利用这种传输系统。相比之下,ixr1-1突变体,纤维素合酶基因的组成部分发生改变[9],未表现出抵抗TA。缺乏交叉阻力ixr1-1,本研究观察到这种改变的靶酶不是TA的靶标[12].
TA与IXB关系密切,但与DCB关系较远
先前的研究表明,TA和IXB在作用模式上存在共性,两者都抑制纤维素合成[7,26],启动程序性细胞死亡反应[14],并上调一组相似的基因答:芥悬浮细胞[12].我们发现txr1-1,ixr1-1而且KOR1这些突变体对IXB和NPA的抗性均增强,对DCB的抗性均无变化。基于我们对三种不同突变体的互补结果,TA似乎与IXB密切相关,但与DCB关系较远[12].
结论
虽然TA的作用模式和具体靶点尚未确定[6]这里提出的数据提示生长素外排运输过程之间的直接联系,可能被NPA抑制和纤维素生物合成的抑制。MIFE离子通量数据强调了成熟根区作为可能的生长素- ta相互作用的另一个靶点的重要作用,并提供了对这些独特的CBI的电生理学见解。用法很有特点拟南芥突变体使毒素作用模式之间的关联与IXB和TA相关联,相比于更遥远的CBI, DCB。在阐明机制方面还需要进一步的工作,但要确定两者对NPA表达的强烈抵抗ixr1-1而且txr1-1使这些突变体成为进一步了解生长素运输过程的独特工具。
方法
植物材料及化学品
拟南芥种子来自美国俄亥俄州哥伦布市俄亥俄州立大学的拟南芥生物资源中心(ABRC)和英国莱斯特郡拉夫堡诺丁汉大学的诺丁汉拟南芥种质中心(NASC)。选择突变体N298:KOR1-纤维素缺乏,[21,22],由美国国家科学技术委员会(NASC)提供;CS3074:aux1-7-抗NAA和2,4- d的突变生长素流入载体[40,41];CS6201:ixr1-1-抗IXB [20.],由ABRC提供;而且txr1-1-抗TA [15],由R. Loria(美国康奈尔大学)提供。除了KOR1哥伦比亚生态型为野生型(WT);后者采用Wassilewkija生态型。然而,由于在Columbia和Wassilewkija生态型之间没有发现TA反应的差异(数据未显示),在其他实验中只使用了Columbia植物。
从燕麦肉汤培养物中纯化TA,纯度为> 98%链霉菌属scabiei(分离g# 20),如前所述[42].除非另有说明,所有其他化学品(包括植物毒素和激素)均来自Sigma-Aldrich Inc (St Lois, USA)。主要化学品溶解在一系列溶剂中:TA, IXB和DCB -甲醇,IAA(吲哚-3-乙酸)和2,4- d(2,4-二氯苯氧乙酸)-乙醇,NAA(1-萘乙酸)和TIBA(2,3,5-三碘苯甲酸)- NaOH, NPA (Naptalam®:n -1-萘酞酸)-二甲基亚砜(DMSO)。工作溶液中含有< 0.025%的这些溶剂,而对照处理总是含有等效浓度的溶剂。
根植物毒素测定
所有根系实验均在环境温度22°±1°C、光照强度60 μmol m、日长16 h的生长室中进行-2年代-1).答:芥种子在漂白剂溶液(有效氯:1.5% m/v)中表面消毒15分钟。将20粒种子直接分两排镀入含有Murashige和Skoog (MS)基础培养基的培养皿[43]添加8 g/L琼脂和10 g/L蔗糖。在4°C下分层2天后,将平板转移到生长室中,并以85°左右的垂直位置定位,使根沿琼脂表面生长而不穿透琼脂表面。5天后,将植株转移到含有添加植物毒素和/或生长素处理的MS基础培养基的新平板上,并在平板上标记每个根尖的位置。在进一步培养3天后,通过测量根生长超过标记点的距离来获得根长,并量化处理对根生长的影响。
CBI,生长素和生长素转运抑制剂筛选
五行答:芥进行筛选(WT,aux1-7,ixr1-1,KOR1而且txr1-1).在添加(i)生长素- IAA、2,4- d和NAA的MS培养基上观察其根系生长;生长素运输抑制剂- NPA和TIBA;(iii) cbi - DCB、IXB和TA。每个处理设4个重复,每板5株(n = 20)。
无创离子通量测量从A. thaliana根
了消毒答:芥种子置于1.5 mL离心管中0.8% (w/v)琼脂上,4℃黑暗分层48 h。取下试管底部,将试管悬浮在含有(宏量营养素)1.25 mM KNO的曝气生长溶液上3., KH为0.625 mM2阿宝4, 0.5 mM MgSO4, 0.5 mM Ca(NO3.)20.045 mM FeNaEDTA和0.16 μM CuSO(微量元素)4, 0.38 μM ZnSO4, 1.8 μM MnSO4, 45 μm h3.薄3., 0.015 μm (nh4) 6月7O24, 0.01 μM CoCl2,调整为pH 5.6。琼脂含有半浓度的宏量营养素和全浓度的微量营养素(pH值5.6)。基因型(WT、ixr1-1而且txr1-1)随机放置在室温恒定光照下,每三天更换一次营养液。两个治疗;将对照组(0.025% DMSO)或3 μM NPA (DMSO含量约为0.025%)加入到11日龄幼苗的生长培养基中,将pH调至5.6。
H的测量+如前所述,使用非侵入性离子选择微电极MIFE技术(ROCU,塔斯马尼亚大学,霍巴特,澳大利亚)处理24小时后制备助熔剂[13,44].使用圆柱形扩散几何的MIFEFLUX软件计算净离子通量[45].在测量前40分钟,将每个12天大的幼苗放置在1毫升有机玻璃测量室中,其中含有1毫升基本盐介质BSM(单位为mM: 0.1 KCl, 0.1 CaCl2, pH 5.6未缓冲,加上各自的处理)。从成熟区和延伸区(分别距离根尖1 mm和100 μm)测量5 min的净稳态离子通量。由于处理溶液对离子传感器性能的影响,电极在含有该特定测量(即DMSO±NPA)和新H的处理溶液的溶液中进行校准+-选择性电极用于每棵幼苗。每种处理在伸长区和成熟区都进行了8次测量。
异沙本和他霉素水平的定量答:芥根
基因型基本上是按照上面所述的方法在水培装置中进行通量测量。将6天大的幼苗转移到4种不同的处理溶液中:1 μM TA±3 μM NPA;100 nM IXB±3 μM NPA;所有处理都含有DMSO,浓度约为0.025%,pH为5.6。
24小时后将植株从处理介质中移除,切除根系,用蒸馏水冲洗6次以除去处理溶液。每个处理溶液和基因型将五个根聚集在一起。称量后,置于1.5 mL Ependorf管中,用Ependorf杵捣碎,加入30%甲醇600 μL。将陶瓷珠(0.5和2.8 mm)加入到试管中,将试管放在Vortex genie搅拌器上10分钟,以确保根组织被彻底浸没,以使IXB或TA进入甲醇溶液。在13000 rpm下离心10 min,取200 μL上清液,4℃保存定量前。每个处理组合设3个重复。
TA和IXB水平由UPLC- ms测定,使用Waters Acquity h系列UPLC与Waters Xevo三重四极杆质谱仪耦合。在Waters Acquity UPLC C18色谱柱(2.1 × 100 mm × 1.7微米颗粒)上进行注射,流动相a = 1%醋酸水,B =乙腈。色谱柱保持在35°C,流速为0.35 mL/min,在5分钟内从70% a, 30% B到10% a, 90% B线性梯度,然后在运行之间重新平衡3分钟。在这些条件下,TA在1.78分钟洗脱,IXB在4.28分钟洗脱。使用标准溶液进行外部校准,每5个样品后进行QC运行。thaxtomin注射量为35 uL, IXB注射量为10 uL。
质谱仪对TA在负离子电喷雾模式下工作,对IXB在正离子电喷雾模式下工作,并在2.4 min时切换模式。通过多重反应监测(MRM)对两种目标化合物进行通道检测m / z437.15到140.0和m / z437.15至155.0的TA(两个通道的锥电压为50 V,碰撞能量分别为35 V和27 V),以及m / z333.15到150.0和m / zIXB为333.15至165.0(两个通道的锥电压为27 V,碰撞能量分别为40 V和23 V)。每个通道的停留时间为145毫秒。离子源温度为130℃,脱溶气体为氮气950 L/hr,脱溶温度为450℃,毛细管电压为2.8 KV。
数据分析
使用Genstat 11.1(英国哈福德郡哈彭登罗斯塔姆试验站)对数据进行方差分析。如前所述,在P = 0.05或P = 0.01时计算显著性,并采用最小显著性差异(LSD)比较治疗手段。对于根系生长抑制数据,使用SAS (SAS/STAT, version 9.1, 2002-2003, SAS Institute Inc., Cary, NC, USA.)中的NLMIXED程序来拟合非线性模型Y = a*(b(√(x)),其中“Y”是模拟百分比,“x”是测量变量(毒素浓度等),“a”和“b”是每个基因型的估计参数。“a”参数对应于在零浓度时达到的最大值,“b”控制拟合直线的陡度。通过计算抑制根生长(RG)到50%水平所需的浓度来比较处理效果,并使用f测试比较基因型之间的效果;例如RG50.对MIFE离子通量数据和定量数据,分别采用t以及。
缩写
- CBI:
-
纤维素生物合成抑制剂
- 中国极限运动协会:
-
纤维素合酶
- DCB:
-
敌草腈
- 2:
-
4-D: 2,4-二氯苯氧乙酸
- DMSO溶液:
-
二甲亚砜
- 国际宇航科学院:
-
Indole-3-acetic酸
- IXB:
-
Isoxaben
- 女士:
-
Murashige和skoog
- 乙酰天冬氨酸:
-
1-萘乙酸
- NPA:
-
1-napthylphthalamic酸
- 助教:
-
Thaxtomin一
- 三碘苯甲酸:
-
2、3、5-Triiodobenzoic酸
- WT:
-
野生型。
参考文献
李志强,李志强,李志强:植物致病性的进化链霉菌属.植物学报,2006,44:469-487。10.1146 / annurev.phyto.44.032905.091147。
Kers JA, Cameron KD, Joshi MV, Bukhalid RA, Morello JE, Wach MJ, Gibson DM, Loria R:一个大型的,可移动的致病性岛赋予植物致病性链霉菌属物种。中国生物医学工程学报,2005,29(3):344 - 344。
King RR, Lawrence CH, Clark MC, Calhoun LA:与植物毒素相关的分离和特征链霉菌属疥疮.化学学报,1998,13:849-850。
劳伦斯CH,克拉克MC,金RR:无菌培养的马铃薯块茎的常见结痂症状诱导的活毒素,thaxtomin。植物病理学杂志,1990,30(4):357 - 357。10.1094 /发朵- 80 - 606。
金·R,劳伦斯·C,格雷·J:植物毒素中菌毒素群的除草特性。食品化学学报,2001,49:2298-2301。10.1021 / jf0012998。
Brochu V, Girard-Martel M, Duval I, Lerat S, Grondin G, Domingue O, Beaulieu C, Beaudoin N:杂交杨树细胞悬浮液对thaxtomin A的习惯化可增强和持久地抵抗纤维素合成抑制剂。植物科学学报,2010,30(4):344 - 344。10.1186 / 1471-2229-10-272。
Bischoff V, Cookson SJ, Wu S, Scheible WR: Thaxtomin A影响cesa复合体密度、细胞壁基因表达、细胞壁组成,并引起异位木质化拟南芥幼苗。应用物理学报,2009,30(3):344 - 344。10.1093 / jxb / ern344。
Desprez T, Vernhettes S, Fagard M, Refregier G, Desnos T, Aletti E, Py N, Pelletier S, Hofte H:同一纤维素合成酶异型CESA6的不同突变引起的对除草剂异沙本的抗性和纤维素缺乏。植物科学学报,2002,29(4):349 - 349。10.1104 / pp.010822。
Scheible WR, Eshed R, Richmond T, Delmer D, Somerville C:纤维素合成酶的修饰使植物对异沙酯和噻唑烷酮除草剂具有抗性拟南芥ixr1突变体。美国国家科学研究院。2001, 29(3): 349 - 349。10.1073 / pnas.191361598。
梅丽达,李志强,李志强,李志强,李志强。纤维素生物合成抑制剂二氯苯腈对玉米细胞习惯化的影响。植物学报,2010,3:842-853。10.1093 / mp / ssq027。
Nakagawa N, Sakurai N:通过纤维素生物合成抑制剂2,6-二氯苯腈增加烟草by -2细胞中celA1蛋白的数量。植物生理学报,1998,39:779-785。10.1093 / oxfordjournals.pcp.a029434。
Duval I, Beaudoin N:转录谱分析在响应抑制纤维素合成由thaxtomin A和异沙滨拟南芥悬浮细胞。植物细胞学报,2009,28:811-830。10.1007 / s00299 - 009 - 0670 - x。
杨晓明,李志强,李志强,等:植物细胞对链霉菌毒素thaxtomin A的离子通量响应:基于MIFE技术的钙、氢离子通量模式。植物生理学报,2005,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pci069。
杜瓦尔I, Brochu V, Simard M, Beaulieu C, Beaudoin N: Thaxtomin A诱导细胞程序性死亡拟南芥悬浮细胞。植物学报,2005,22(3):344 - 344。10.1007 / s00425 - 005 - 0016 - z。
Scheible WR, Fry B, Kochevenko A, Schindelasch D, Zimmerli L, Somerville S, Loria R, Somerville CR: An拟南芥对thaxtomin A有抗性的突变体,一种纤维素合成抑制剂链霉菌属物种。植物科学学报,2003,26(3):344 - 344。10.1105 / tpc.013342。
叶面化学制剂防治马铃薯常见赤霉病的作用及其与菌毒素A毒性的关系。植物科学进展,2012,29(3):344 - 344。10.1094 / pdi - 05 - 11 - 0397。
Tegg RS, Gill WM, Thompson HK, Davies NW, Ross JJ, Wilson CR:生长素诱导马铃薯对常见赤霉病的抗性与抑制thaxtomin A毒性有关。植物保护学报,2008,29(3):344 - 344。10.1094 / pdi - 92 - 9 - 1321。
McIntosh AH,张伯伦K,道森GW:叶片喷雾剂防治马铃薯常见赤霉病:与3,5-二氯苯氧乙酸有关的化合物。中国农业科学,2004,19(4):379 - 379。10.1016 / 0261 - 2194(85) 90052 - 3。
夏皮罗广告:使用拟南芥描述抗病信号通路的突变体。植物病理学杂志,2000,22:199-216。10.1080 / 07060660009500465。
Heim DR, Roberts JL, Pike PD, Larrinua IM:基因座突变拟南芥对除草剂异沙本具有抗性。中国农业科学,2004,27(3):349 - 349。10.1104 / pp.90.1.146。
Nicol F, His I, Jauneau A, Vernhettes S, Canut H, Hofte H:一种质膜结合的假定的内-1,4- β - d -葡聚糖酶对正常的壁组装和细胞伸长是必需的拟南芥.中国生物工程学报,2001,30(4):553 - 553。10.1093 / emboj / 17.19.5563。
左JR,牛庆文,Nishizawa N,吴勇,Kost B,蔡新华:KORRIGAN,一个拟南芥endo-1,4-葡聚糖酶通过极化靶向定位于细胞板,是细胞质分裂所必需的。植物学报,2000,29(4):457 - 457。
山本M,山本KT: 1-萘乙酸、吲哚-3-乙酸和2,4-二氯苯氧乙酸对抗生长素突变体根系向地性反应的差异影响拟南芥, aux1。植物生理学报,1998,39:666 -664。10.1093 / oxfordjournals.pcp.a029419。
Fry B, Loria R: Thaxtomin A:植物细胞壁靶标的证据。中国生物医学工程学报,2002,30(2):344 - 344。10.1006 / pmpp.2001.0371。
Errakhi R, Dauphin A, Meimoun P, Lehner A, Reboutier D, Vatsa P, Briand J, Madiona K, Rona JP, Barakate M, Wendehenne D, Beaulieu C, Bouteau F:早期Ca2 +涌入是thaxtomin a诱导细胞死亡的先决条件拟南芥细胞。应用物理学报,2008,39(4):459 -4270。10.1093 / jxb / ern267。
Paredez AR, Somerville CR, Ehrhardt DW:纤维素合成酶的可视化显示与微管的功能关联。科学通报,2006,31(4):344 - 344。10.1126 / science.1126551。
Sato S, Kato T, Kakegawa K, Ishii T, Liu YG, Awano T, Takabe K, Nishiyama Y, Kuga S, Nakamura Y, Tabata S, Shibata D:膜结合内-1,4-葡聚糖酶的作用KORRIGAN在细胞伸长和纤维素合成中拟南芥.植物生理学报,2001,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pce045。
李双生,赵海涛:PINOID正向调节植物生长素外排拟南芥根毛细胞和烟草细胞。植物学报,2006,30(4):344 - 344。10.1105 / tpc.105.035972。
《生长素的极地运输——老问题和新概念?》中国生物医学工程学报,2002,29(3):344 - 344。10.1023 /: 1015248926412。
Lomax T, Muday G, Rubery P:生长素转运。植物激素:生理学、生物化学和分子生物学。第二版。编辑:Davies P. Dordrecht,荷兰:Kluwer学术出版社;1995: 509 - 530。
杨晓燕,李志强,李志强,等。植物生长素在植物生长中的作用机制。植物化学学报,2002,49:319-338。10.1023 /: 1015242627321。
Peer WA, Blakeslee JJ, Yang H, Murphy AS:我们认为我们知道生长素运输的7件事。植物学报,2011,4:487-504。10.1093 / mp / ssr034。
黄志刚,李志刚。植物生长素在植物发育中的运输途径。科学通报,2009,29(3):344 - 344。10.1242 / dev.030353。
Zazimalova E, Murphy AS, Yang H, Hoyerova K, Hosek P:生长素转运蛋白——为什么这么多?中国生物医学工程学报,2010,2:a001552。10.1101 / cshperspect.a001552。
Peer WA, Bandyopadhyay A, Blakeslee JJ, Makam SI, Chen RJ, Masson PH, Murphy AS:植物生长素转运改变的黄酮突变体中生长素外排促进蛋白PIN家族的表达变化和蛋白定位拟南芥.植物学报,2004,26(3):344 - 344。10.1105 / tpc.021501。
Sieberer T, Leyser O:生长素的运输,但在哪个方向。科学通报,2006,31(3):344 - 344。10.1126 / science.1127659。
杨晓明,杨晓明,杨晓明,杨晓明,杨晓明,杨晓明:植物抗真菌活性的研究进展+- atp酶通过诱导酶去磷酸化。中国农业科学,2004,27(4):457 - 457。
Petersson SV, Johansson AI, Kowalczyk M, Makoveychuk A, Wang JY, Moritz T, Grebe M, Benfey PN, Sandberg G, Ljung K:植物生长素的梯度和最大值拟南芥根尖通过高分辨率细胞特异性分析显示IAA的分布和合成。植物学报,2009,21:1659-1668。10.1105 / tpc.109.066480。
Sharples KR, Hawkes TR, Mitchell G, Edwards LS, Langford MP, Langton DW, Rogers KM, Townson JK, Wang YL:一种新型噻唑烷酮类除草剂是葡萄糖掺入细胞壁材料的有效抑制剂。中国农业科学,1998,54:368-376。10.1002 / (SICI) 1096 - 9063 (199812) 54:4 < 368:: AID-PS845 > 3.0.CO; 2 - 6。
Bennett MJ, Marchant A, Green HG, May ST, Ward SP, Millner PA, Walker AR, Schulz B, Feldmann KA:拟南芥AUX1基因:根向地性的量程调节基因。科学通报,1996,27(3):344 - 344。10.1126 / science.273.5277.948。
Swarup R, Kargul J, Marchant A, Zadik D, Rahman A, Mills R, Yemm A, May S, Williams L, Millner P, Tsurumi S, Moore I, Napier R, Kerr ID, Bennett MJ:假设的结构功能分析拟南芥生长素渗透酶AUX1。中国生物医学工程学报,2004,26(3):349 - 349。10.1105 / tpc.104.024737。
Wilson CR, Luckman GA, Tegg RS, Yuan ZQ, Wilson AJ, Eyles A, Conner AJ:通过体细胞选择增强马铃薯对普通赤霉病的抗性。李文华,李志军,李志军,等。植物毒素的研究进展。2009,28(3):337 - 344。10.1111 / j.1365-3059.2008.01903.x。
Murashige T, Skoog F:烟草组织培养快速生长和生物测定的修订培养基。植物学报,2004,15:473-497。10.1111 / j.1399-3054.1962.tb08052.x。
夏芭拉,陈志明,李志强,李志强,等:烟草抗凋亡基因CED-9的表达对盐胁迫和氧化胁迫下质膜离子通量的影响。植物学报,2007,27(3):379 - 379。10.1007 / s00425 - 007 - 0606 - z。
沙bala L, Ross T, McMeekin T, Shabala S:无创微电极离子通量测量研究微生物对环境的适应性反应。微生物学通报,2006,30:472-486。10.1111 / j.1574-6976.2006.00019.x。
致谢
对于统计分析方面的协助,我们感谢D. Ratkowsky和R. Corkrey。这项工作得到了塔斯马尼亚大学(RT)研究生奖学金的支持,澳大利亚园艺有限公司(HAL)与澳大利亚土豆加工协会和澳大利亚政府(CW)合作提供的资助,以及澳大利亚研究委员会(SS)的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
RT参与研究设计,进行根系抑制试验,标注并撰写稿件;SS参与设计的研究和协调;协助进行无创离子通量测量,协助起草稿件;TC进行了无创离子通量测量;ND开发检测方法,进行CBI定量;CW构思了研究,参与了研究的设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
泰格,r.s.,莎芭拉,s.n.,昆,T.A.et al。增强了对纤维素生物合成抑制剂、噻菌霉素A和异沙本的抗性拟南芥突变体也对生长素转运抑制剂1-NPA提供特异性共抗性。BMC植物生物学13,76(2013)。https://doi.org/10.1186/1471-2229-13-76
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-76
关键字
- 1-萘基酞酸- NPA
- 2,3,5-三碘苯甲酸- TIBA
- Thaxtomin一
- Isoxaben
- 敌草腈
- 纤维素生物合成抑制剂
- 常见的黑星病
- 离子通量
- 等离子体膜