- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
水稻纯系、F1杂交和多倍体的组织培养诱导遗传和表观遗传改变gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba13gydF4y2Ba,文章号:gydF4y2Ba77gydF4y2Ba(gydF4y2Ba2013gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
遗传和表观遗传改变可以通过植物组织培养引起,这可能导致表型的遗传变化,这种现象统称为体细胞无性系变异。虽然已经对组织培养诱导的基因组改变的分子性质和光谱进行了广泛的研究,但不同的植物基因型(如纯系、杂交和多倍体)是否以及在多大程度上可能对组织培养条件产生不同的反应,这一问题仍然知之甚少。gydF4y2Ba
结果gydF4y2Ba
我们研究了一组水稻基因型的组织培养诱导遗传和表观遗传改变,包括两个纯系(不同亚种),一对由这两个纯系亲本组成的互惠F1杂交种,以及一对杂种产生的互惠四倍体。利用扩增片段长度多态性(AFLP)和甲基化敏感扩增多态性(MSAP)两个分子标记,在6个基因型愈伤组织和再生体中均检测到遗传和DNA甲基化改变,但遗传改变比表观遗传改变更为突出。虽然这两种改变的频率存在显著的基因型差异,但只有遗传改变在三种基因组中表现出不同的特征,其中一个杂交(N/9)异常不稳定。令人惊讶的是,一对F1互交杂种之间的遗传变异频率差异远远大于两个纯系亚种之间的差异。互交四倍体间也存在差异,但差异小于杂交种间的差异。在愈伤组织和再生组织中,参与DNA修复和DNA甲基化的基因的稳态转录丰度均发生了显著改变,其中一些基因的稳态转录丰度与遗传和表观遗传改变有关。gydF4y2Ba
结论gydF4y2Ba
我们的结果,基于分子标记分析gydF4y2Baca。gydF4y2Ba1000个基因组位点表明,遗传改变是水稻体细胞无性系变异的主要原因,而这种变异与表观遗传改变相伴而生。一组41个编码参与DNA修复和DNA甲基化的酶的基因的组织培养干扰表达与遗传和表观遗传改变有关。不同基因型、纯系、杂交种和四倍体在组织培养条件下发生遗传和表观遗传改变的倾向存在根本差异。原点父点对改变频率有显著影响。gydF4y2Ba
背景gydF4y2Ba
植物组织培养,由连续的去分化(愈伤组织形成)和再分化(再生成植株)两个阶段组成[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba],代表了植物细胞的创伤性应激,并经常引发一系列遗传和表观遗传不稳定性[gydF4y2Ba3.gydF4y2Ba].至少一部分遗传和/或表观遗传改变可表现为可遗传的表型变化,这些表型变化统称为体细胞无性系变异[gydF4y2Ba4gydF4y2Ba].基于体细胞无性系变异的复杂性以及通常与遗传环境相关的特征,Phillips和同事(1994)提出,体细胞无性系变异是一种“自我强加的”诱变,这在很大程度上可归因于正常细胞对遗传和表观遗传完整性控制的破坏[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
虽然已经对组织培养诱导的基因组改变的分子性质和光谱进行了广泛的研究[gydF4y2Ba6gydF4y2Ba- - - - - -gydF4y2Ba11gydF4y2Ba],不同的植物基因型(如纯系、杂交种和多倍体)是否以及在多大程度上对组织培养条件有不同的反应仍有待充分了解。gydF4y2Ba
杂交种(扩展为异体多倍体)基因组与纯种基因组之间的差异及其伴随的生物学效应是根本的和无数的,这反映在它们作为生物物种的独特进化轨迹和作为不同作物的农业利用上。一个具有理论和应用意义的问题是,在不同的环境条件下,不同类型的基因组(纯系、杂交和多倍体)是否存在差异,以及在多大程度上存在差异[gydF4y2Ba12gydF4y2Ba].鉴于上文提到的植物组织培养的独特性,比较不同类型的基因组在组织培养条件下的基因组不稳定性是很有意义的。到目前为止,这个问题还很少得到解决。gydF4y2Ba
我们最近报道了高粱(gydF4y2Ba高粱二色的gydF4y2BaL.)在组织培养下随机取样的F1杂种与其亲本纯系之间的遗传和表观遗传不稳定性程度存在显著差异,前者高度稳定,而后者高度可变[gydF4y2Ba13gydF4y2Ba].然而,在一组玉米(gydF4y2Ba玉米gydF4y2BaL.)自交系及其F1杂种,其中遗传和表观遗传改变的频率在很大程度上取决于基因型,F1杂种并不比近交系亲本更稳定[gydF4y2Ba14gydF4y2Ba].虽然这种差异可以用植物类群的差异来解释,但为了揭示可能的一般规律,还需要对不同植物进行更多的研究。此外,一个与纯系和F1杂交种具有不同特性的异源多倍体基因组,尚未对其在组织培养的遗传和表观遗传稳定性方面可能的差异反应进行评估。gydF4y2Ba
在这项研究中,我们研究了一组水稻的组织培养诱导的遗传和表观遗传改变(gydF4y2Ba栽培稻gydF4y2BaL.)基因型包括两个纯系(不同亚种,gydF4y2Ba粳稻gydF4y2Ba而且gydF4y2Ba籼稻gydF4y2Ba)、一对由这两个纯系亲本产生的互惠型F1杂交种和一对互惠型四倍体。在这项研究中使用水稻系统有双重优势,即作为单子叶模型,其无与伦比的丰富基因组信息,以及其作为三分之二人类人口的主食作物的地位[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].我们旨在探讨这三种不同类型的水稻基因型是否以及在多大程度上对组织培养条件的遗传和表观遗传改变做出不同的反应,以及它们与参与DNA修复和DNA甲基化的关键基因的表达紊乱可能存在的联系。gydF4y2Ba
结果gydF4y2Ba
水稻纯系愈伤组织和再生体的遗传改变及其F1杂交后代和四倍体gydF4y2Ba
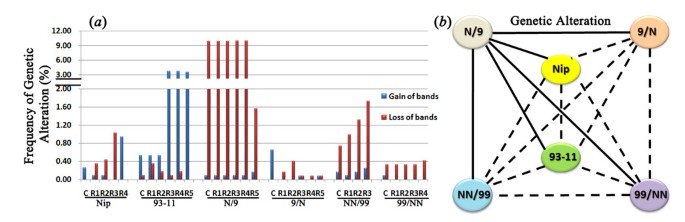
AFLP已被广泛用于检测限制性DNA片段在PCR扩增后的长度变化[gydF4y2Ba13gydF4y2Ba].从全球角度来看,这是指纹基因组不稳定性的选择方法,而不需要大规模(重新)测序。通过使用18对选择性引物组合(附加文件gydF4y2Ba1gydF4y2Ba)、1,165、1,142、1,221、1,227、1,216和1,215个可复制条带(在两个技术重复之间,gydF4y2Ba看到gydF4y2Ba方法)从6种基因型中分别提取3种样品(种子植物、愈伤组织和再生体)。这六种基因型包括两个亚种的纯系(Nipponbare和93-11),gydF4y2Ba粳稻gydF4y2Ba而且gydF4y2Ba籼稻gydF4y2Ba分别为N/9和9/N)、1对F1互交杂交体(N/ 99和99/NN)和1对互交四倍体(NN/99和99/NN)。在所有6种基因型的愈伤组织和再生体中都检测到AFLP带型的改变,与它们各自的种子植株作为对照进行了比较。改变可分为两种类型,损失(原有的种子-植物控制带的消失)和增益(gydF4y2Ba新创gydF4y2Ba新带的出现)(图gydF4y2Ba1gydF4y2Ba一个;额外的文件gydF4y2Ba2gydF4y2Ba).由于AFLP标记的共显性性质,只有在相关位点的两个拷贝都被改变时,才能在纯系和四倍体中检测到损失,但如果位点是杂合的,则在F1杂交种中检测到一个拷贝的损失。因此,相对于杂交种,纯系和四倍体的损失型变异频率可能被低估了。事实上,在一个纯系(93-11)中,增益型变异占主导地位,但在另一个纯系(Nipponbare)中,变异类型主要依赖于不同的再生子(图)gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba
水稻组织培养诱导的遗传改变。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba在愈伤组织(C)和独立再生植株(R .)中,AFLP检测到的基因改变频率gydF4y2BangydF4y2Ba在6个水稻基因型中:2个纯系Nipponbare (Nip)和93-11,1对由这2个纯系亲本产生的互惠型F1杂交种(N/9和9/N), 1对由F1杂交种产生的互惠型四倍体(NN/99和99/NN)。两种类型的改变模式,亲本带的损失和新带的获得。(gydF4y2BabgydF4y2Ba)“基因改变频率”两两比较之间基因型差异的图解。实线和虚线表示统计显著性(gydF4y2BapgydF4y2Ba< 0.05),无显著性(gydF4y2BapgydF4y2Ba> 0.05)差异,分别基于单因素方差分析检验(gydF4y2Ba看到gydF4y2Ba方法)。gydF4y2Ba
遗传变异频率差异最大的是一对F1杂种,N/9 (Nipponbare为母本)的愈伤组织和再生体的变异比9/N(93-11为母本)的愈伤组织和再生体的变异多30倍以上,而且几乎所有的变异都是损失型(图)gydF4y2Ba1gydF4y2Ba一个;额外的文件gydF4y2Ba2gydF4y2Ba).在互交四倍体组合中,NN/99的愈伤组织和再生体(WGD为N/9)的变异频率也高于99/NN (WGD为9/N),但其变异幅度远小于互交组合,且变异也以损失型为主(图1)gydF4y2Ba1gydF4y2Ba一个;额外的文件gydF4y2Ba2gydF4y2Ba).在所有6个基因型中,F1杂交N/9的遗传变异频率最高(几乎完全是损失型),其次是纯种93-11(主要是获得型),而其余4个基因型的遗传变异频率都要低得多。然而,值得注意的是,虽然四倍体(NN/99和99/NN)的遗传变异频率(相对于F1杂交9/N)与两个纯系相似,但它们的类型不同,即主要是四倍体的条带损失gydF4y2Bavs。gydF4y2Ba纯线中的带增益(图gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba
为了进一步测试由于组织培养而产生遗传改变的基因型差异是否具有统计学意义,我们通过包括六种基因型中的每一种的所有再生剂进行了ANOVA和lsd的多重比较。我们发现N/9与其余5个基因型确实存在显著差异,而其余5个基因型的两两比较差异均未达到统计学显著性水平(图gydF4y2Ba1gydF4y2Bab),验证N/9在组织培养条件下唯一容易发生遗传改变。gydF4y2Ba
水稻纯系的愈伤组织和再生体的表观遗传改变,它们的互惠F1杂交和四倍体gydF4y2Ba
MSAP是AFLP的一个改进版本gydF4y2Ba均方误差gydF4y2BaI酶与一对胞嘧啶甲基化敏感的同分异构体,gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba二世和gydF4y2BaMspgydF4y2Ba一、这对酶识别相同的四核苷酸限制性内切位点(5’-CCGG),但对两种胞嘧啶甲基化状态的敏感性不同:gydF4y2Ba下丘脑-垂体-肾上腺轴的gydF4y2Ba如果双链中的任一胞嘧啶被甲基化,II将不会切割,而gydF4y2BaMspgydF4y2Ba如果外部胞嘧啶完全或半(单链)甲基化,我将不切割[gydF4y2Ba17gydF4y2Ba].因此,对于一个给定的DNA样本,在检测的5 ' -CCGG位点上,双链内胞嘧啶甲基化或单链外胞嘧啶甲基化可以被MSAP标记物明确识别。gydF4y2Ba13gydF4y2Ba].为清楚起见,我们在此分别将这两种类型的模式称为CG甲基化和CHG甲基化。gydF4y2Ba
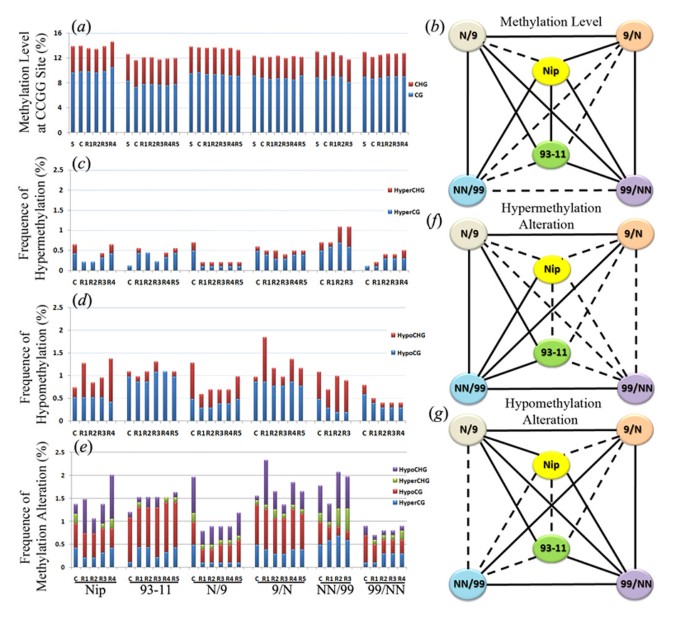
使用16对选择性gydF4y2Ba生态gydF4y2Ba国际扶轮gydF4y2Ba+ HpagydF4y2Ba2 /gydF4y2BaMspgydF4y2BaI引物组合(附加文件gydF4y2Ba1gydF4y2Ba), 940,922,1,018,1,031,1,017和1,013个清晰和可重复的MSAP波段(在两次技术复制之间,gydF4y2Ba看到gydF4y2Ba方法)分别对6种基因型的种子、愈伤组织和再生体进行评分,以AFLP为例。首先,通过在5’- ccgg位点上绘制代表两种主要甲基化类型(CG-和CHG-甲基化)的条带数量,我们计算出愈伤组织和再生体中的CG、CHG和总或集体(两者相加)甲基化水平(图2)gydF4y2Ba2gydF4y2Ba一个;额外的文件gydF4y2Ba3.gydF4y2Ba).CG-和CHG-的明显波动,因此,在测定的5 ' - ccgg位点的总甲基化水平在六个基因型中都是明确的;相比之下,在给定的基因型内,三种样品(种子植物、愈伤组织和再生体)的甲基化水平基本上是恒定的(图gydF4y2Ba2gydF4y2Baa).的确,基于方差分析和lsd的统计分析表明,15个可能的基因型成对比较中有10个(NipgydF4y2Bavs。gydF4y2Ba93 - 11,夹gydF4y2Bavs。gydF4y2Ba杂交9/N, NipgydF4y2Bavs。gydF4y2Ba四倍体NN/99, NipgydF4y2Bavs。gydF4y2Ba四倍体99/NN, 93-11gydF4y2Bavs。gydF4y2Ba杂交N/ 9,93 - 11gydF4y2Bavs。gydF4y2Ba四倍体99/NN,杂交N/9gydF4y2Bavs。gydF4y2Ba杂交9/N,杂交N/9gydF4y2Bavs。gydF4y2Ba四倍体NN/99,杂交种N/9gydF4y2Bavs。gydF4y2Ba四倍体99/NN,杂种9/NgydF4y2Bavs。gydF4y2Ba四倍体99/NN)的甲基化水平存在显著差异(图gydF4y2Ba2gydF4y2Bab)。gydF4y2Ba
水稻组织培养诱导的表观遗传改变。gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba)通过甲基化敏感扩增多态性(methylation-sensitive amplification polymorphism, MSAP)检测6种水稻基因型中随机取样的5’-CCGG位点上的CG、CHG和total(两者相加)的DNA甲基化水平,如图所示gydF4y2Ba1gydF4y2Ba.(gydF4y2BabgydF4y2Ba)“总甲基化水平”两两比较之间基因型差异的图解,见(gydF4y2Ba一个gydF4y2Ba).(gydF4y2BacgydF4y2Ba), (gydF4y2BadgydF4y2Ba)及(gydF4y2BaegydF4y2Ba通过甲基化敏感扩增多态性(methylation-sensitive amplification polymorphism, MSAP)在6个水稻基因型中随机取样的5’-CCGG位点上,对4种主要类型甲基化模式,CG超和CHG超,CG低和CHG低,以及4种类型的集体改变(加起来)进行了改变,如图所示gydF4y2Ba1gydF4y2Ba.(gydF4y2BafgydF4y2Ba)“总高甲基化改变”两两比较之间基因型差异的图解显示在(gydF4y2BacgydF4y2Ba).(gydF4y2BaggydF4y2Ba)“总低甲基化改变”两两比较的基因型差异图示见(gydF4y2BadgydF4y2Ba).在所有情况下,实线和虚线表示统计显著性(gydF4y2BapgydF4y2Ba< 0.05),无显著性(gydF4y2BapgydF4y2Ba> 0.05)差异,分别基于单因素方差分析检验(gydF4y2Ba看到gydF4y2Ba方法)。gydF4y2Ba
接下来,我们将愈伤组织和/或再生体中进一步定义的甲基化模式的改变频率与相应的每种基因型的种子-植物对照进行了比较。每种CG和CHG甲基化模式可以进一步分为两个亚型,即高甲基化和低甲基化。与相应的种子植株相比,6个基因型的愈伤组织和再生体均表现出高甲基化和低甲基化的变化,依次为CG低、CHG低、CG高、CHG高(图2)gydF4y2Ba2gydF4y2Bac, d)。虽然六个基因型之间存在明显的差异,但在纯系、F1杂交和四倍体这三种基因型之间没有明显的特征(图2)。gydF4y2Ba2gydF4y2Bac,d),这与遗传改变形成对比(图gydF4y2Ba1gydF4y2Baa).值得注意的是,将所有四种甲基化模式亚型放在一起,改变频率(图gydF4y2Ba2gydF4y2Bae)明显低于AFLP显示的基因改变(图gydF4y2Ba1gydF4y2Baa).这揭示了本研究的一个重要观察,即在水稻中,体细胞无性系变异的主要成分是gydF4y2Ba遗传gydF4y2Ba而不是gydF4y2Ba表观遗传gydF4y2Ba.这与用相同方法研究的其他植物物种形成对比,例如高粱[gydF4y2Ba13gydF4y2Ba]和玉米[gydF4y2Ba14gydF4y2Ba],其中两种类型的改变出现的频率相似。值得注意的是,杂交N/9的愈伤组织和再生体的遗传变异频率最高(图9)gydF4y2Ba1gydF4y2Baa)是甲基化改变频率最低的基因之一(图gydF4y2Ba2gydF4y2BaE),这表明水稻组织培养诱导的遗传和表观遗传改变是不耦合的,因此可能由不同的机制控制,相关基因的表达分析也证实了这一点,后续章节将详细介绍。gydF4y2Ba
还进行了基于方差分析和lsd的统计分析,以检验组织培养诱导的高甲基化和低甲基化改变频率的基因型差异的显著性。结果显示(gydF4y2Ba我gydF4y2Ba)的高甲基化改变频率,15对比较中有7对(NipgydF4y2Bavs。gydF4y2Ba神经网络/ 99,93 - 11gydF4y2Bavs。gydF4y2BaN / 9, 93 - 11gydF4y2Bavs。gydF4y2Ba神经网络/ 99,N / 9gydF4y2Bavs。gydF4y2Ba9 / N, N / 9gydF4y2Bavs。gydF4y2Ba神经网络/ 99 9 / NgydF4y2Bavs。gydF4y2BaNN/99和NN/99gydF4y2Bavs。gydF4y2Ba99/NN)差异有统计学意义(图gydF4y2Ba2gydF4y2Baf);(gydF4y2Ba2gydF4y2Ba)对于低甲基化改变的频率,15对比较中有9对(NipgydF4y2Bavs。gydF4y2BaN / 9,夹gydF4y2Bavs。gydF4y2Ba99 /神经网络,93 - 11gydF4y2Bavs。gydF4y2BaN / 9, 93 - 11gydF4y2Bavs。gydF4y2Ba99 / NN, N / 9gydF4y2Bavs。gydF4y2Ba9 / N, N / 9gydF4y2Bavs。gydF4y2Ba99 / NN 9 / NgydF4y2Bavs。gydF4y2Ba神经网络/ 99 9 / NgydF4y2Bavs。gydF4y2Ba99/NN和NN/99gydF4y2Bavs。gydF4y2Ba99/NN)差异有统计学意义(图gydF4y2Ba2gydF4y2Bag)。gydF4y2Ba
组织培养诱导的遗传和表观遗传改变的染色体分布和基因组位点的功能相关性gydF4y2Ba
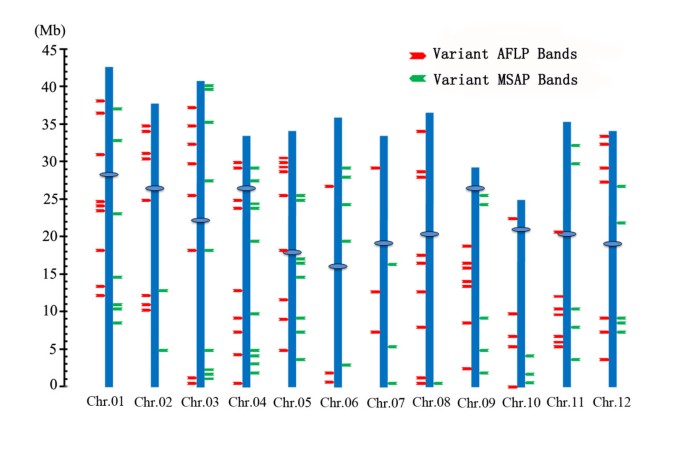
为了了解由于组织培养而发生遗传和甲基化改变的位点的特性,我们分别从AFLP和MSAP谱中分离、克隆和测序了86个和67个变异条带。根据水稻全基因组参考序列(gydF4y2Bahttp://rice.genomics.org.cn/rice/index2.jspgydF4y2Ba), 84个(97.7%)和63个(94.0%)变异带被定位到水稻染色体上的唯一位点(图gydF4y2Ba3.gydF4y2Ba),表明这些基因座大部分为单拷贝或低拷贝。为了进一步检验这些可变位点在水稻染色体中的随机或非随机分布,通过比较理论预期值(E)和实验观察值(O),对随机分布的原假设进行χ 2 t检验(χ-test)。预期值与观测值之间的差异不显著(AFLP:gydF4y2BapgydF4y2Ba= 0.969 > 0.05, msap:gydF4y2BapgydF4y2Ba= 0.844 > 0.05)(附加文件gydF4y2Ba4gydF4y2Ba),表明组织培养诱导的遗传和表观遗传改变在水稻染色体中是随机分布的。gydF4y2Ba
经组织培养诱导的AFLP变异条带(红色箭头)和MSAP变异条带(绿色箭头)的染色体位置。gydF4y2Ba该图谱是基于BlastN对水稻全基因组序列(gydF4y2Bahttp://rice.genomics.org.cn/rice/index2.jspgydF4y2Ba).采用卡方检验对这两个标记在12条水稻染色体内的非随机分布进行了统计检验,结果发表在附加文件中gydF4y2Ba4gydF4y2Ba.gydF4y2Ba
为了探索变异AFLP和MSAP位点是否可能具有功能相关性,我们分别在NCBI网站(gydF4y2Bahttp://blast.ncbi.nlm.nih.gov/Blast.cgigydF4y2Ba).我们发现两个AFLP变异条带和一个MSAP条带与已知功能基因有显著的同源性,44个AFLP条带和23个MSAP条带与推测的蛋白质编码基因有关,7个条带(3个AFLP和4个MSAP)与低拷贝转座因子(TEs)同源,36个AFLP条带和40个MSAP条带与当前水稻数据库无同源性(表2)gydF4y2Ba1gydF4y2Ba;附加文件gydF4y2Ba5gydF4y2Ba而且gydF4y2Ba6gydF4y2Ba).三个已知功能的AFLP和MSAP分别是乙酰转移酶NSI、丝裂原活化蛋白激酶和泛素偶联酶。这表明,水稻组织培养诱导的遗传和表观遗传改变都可能影响愈伤组织和再生体的生物化学和生理,因此,在表型水平上可能表现为体细胞无性系变异。gydF4y2Ba
通过组织培养参与DNA修复和DNA甲基化的酶编码基因改变转录丰度gydF4y2Ba
有人认为,组织培养诱导的遗传和表观遗传改变的一个主要原因可归因于正常细胞对遗传和表观遗传保真度的控制的破坏[gydF4y2Ba5gydF4y2Ba].已知在正常情况下,维持遗传保真度的主要修复途径有三种,即体细胞同源重组(somatic homologous recombination, SHR)、错配修复(mismatch repair, MMR)和细胞周期检查点(cell-cycle checkpoint) [gydF4y2Ba18gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba].因此,可以想象,组织培养引起的遗传改变可能与这些途径的酶编码基因在该条件下的紊乱或错表达有关。同样,在植物中,胞嘧啶甲基化的水平和模式是通过至少三类酶的交错作用来建立和维持的,即胞嘧啶甲基转移酶、活性去甲基化酶和几种与特定类型的24 nt小干扰(si) rna的生物发生相关的Argonaute蛋白(AGOs) [gydF4y2Ba22gydF4y2Ba- - - - - -gydF4y2Ba24gydF4y2Ba].越来越多的证据也表明,至少去甲基化酶(DME)的活性去甲基化过程也涉及核苷酸切除修复[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba],而甲基化和非甲基化的胞嘧啶经脱氨作用对单核苷酸转化突变具有不同的倾向[gydF4y2Ba27gydF4y2Ba].总之,可以想象,在这种情况下,组织培养诱导的DNA序列和甲基化的改变可能是由上述所有酶中的一种或多种的表达和/或活性的改变引起的。此外,还可以设想,一些或所有这些细胞机制将内在地相互作用,并产生遗传和表观遗传不稳定性的集体结果。gydF4y2Ba
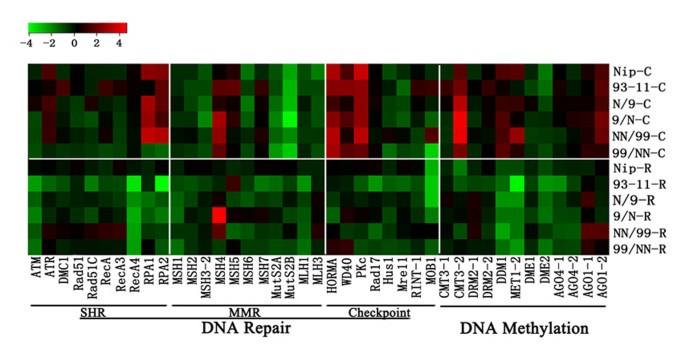
为了检测上述基因在组织培养中可能受到的干扰表达,我们通过实时定量RT-PCR (q-RT-PCR)分析,测量了这六种基因型中每一种基因型中涉及愈伤组织和再生体中DNA修复和DNA甲基化的四个细胞通路中代表性成员的稳态转录丰度(有关基因及其引物的详细信息,请参阅附加文件)gydF4y2Ba7gydF4y2Ba).其中SHR基因10个,MMR基因11个,检查点基因8个,DNA甲基化基因12个。折叠变化(2gydF4y2Ba——ΔΔCtgydF4y2Ba)这些基因在愈伤组织和再生体中相对于相应的种子-植物对照的转录丰度(附加文件)gydF4y2Ba8gydF4y2Ba)和汇总(以log为单位)gydF4y2Ba2gydF4y2Ba)(图gydF4y2Ba4gydF4y2Ba).以下观察结果可以推广。(gydF4y2Ba我gydF4y2Ba)与相应的种子-植株对照相比,愈伤组织和再生体各途径中大部分分析基因的表达均发生了显著变化(图gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba8gydF4y2Ba).(gydF4y2Ba2gydF4y2Ba)虽然上调和下调调控在愈伤组织中同样突出,但在再生组织中观察到的下调调控主要是下调的(图gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba8gydF4y2Ba).(gydF4y2Ba3gydF4y2Ba)虽然通路之间的差异并不明确,但个体基因之间的差异是明显的,并且在基因型之间很大程度上是一致的(图gydF4y2Ba4gydF4y2Ba).(gydF4y2Ba4gydF4y2Ba)最引人注目的是,一对F1互交杂种中许多这些基因的表达差异(N/9gydF4y2BavsgydF4y2Ba.9/N)和四倍体(NN/99)gydF4y2Bavs。gydF4y2Ba99/NN)也一样伟大的两个纯线(NipponbaregydF4y2Bavs。gydF4y2Ba在愈伤组织和再生剂中(图93-11)gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba8gydF4y2Ba),反映基因改变的结果(图gydF4y2Ba1gydF4y2Ba).为了探究这些基因表达改变的显著起源亲本差异是由于组织培养的影响还是已经存在于种子植物中,我们比较了这六种基因型种子植物叶片组织中所有这些基因的表达。我们发现在种子植物中也存在起源亲本差异,但程度要小得多(附加文件)gydF4y2Ba9gydF4y2Ba).这表明,即使在正常条件下,维持遗传和表观遗传稳定性所涉及的这四种途径的基因的表达对起源亲本效应本质上是敏感的,但组织培养诱导的错误表达极大地增强了预先存在的起源亲本效应。gydF4y2Ba
在6种水稻基因型的对照中,在愈伤组织和再生体中涉及DNA修复和DNA甲基化的一组基因的相对稳态转录丰度的变化(详细见图)gydF4y2Ba1gydF4y2Ba)基于q-RT-PCR分析。gydF4y2Ba共分析41个基因,包括体细胞同源重组蛋白(SHR, 10个基因)、错配修复蛋白(MMR, 11个基因)、检查点蛋白(8个基因)、DNA甲基转移酶(6个基因)、5-甲基胞嘧啶DNA糖基酶(2个基因)和siRNA生物发生相关蛋白(4个基因)。3个水稻管家基因,1个β-肌动蛋白基因(Genbank accession no.;该基因编码蛋白合成延伸因子1A, eEF-1a (Genbank登录号:X79378)。AK061464)和一个泛素基因UBQ5 (Genbank登录号:UBQ5)。AK061988),被用作标准化的内部控制。这些基因的稳态转录丰度以折叠变化(以对数为单位)表示gydF4y2Ba2gydF4y2Ba)的原始数据(附加文件gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
组织培养诱导的遗传/表观遗传改变与DNA修复和DNA甲基化相关的酶编码基因转录丰度的改变之间的相关性gydF4y2Ba
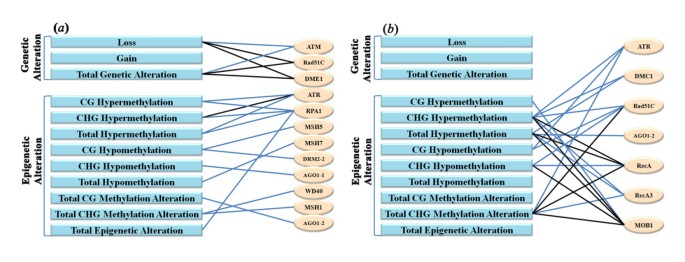
虽然组织培养诱导的遗传/表观遗传改变之间不一致(图gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba)和编码参与DNA修复和DNA甲基化的酶的基因转录丰度的改变(图gydF4y2Ba4gydF4y2Ba),这仍然是一种有趣的可能性,它们之间可能仍然存在一些神秘的相关性,例如,特定类型的遗传/表观遗传改变和特定基因表达的改变或某些类型的集体。为了探究这一点,我们对所有可能的成对关系进行了皮尔逊相关分析。该分析表明,首先,组织培养诱导的特定类型的遗传/表观遗传改变与一些编码参与DNA修复和DNA甲基化的酶的分析基因的表达改变之间确实存在显著相关性(图gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba10gydF4y2Ba).其次,更多的分析基因(41个中的12个)与组织培养诱导的愈伤组织的遗传/表观遗传改变具有统计学上的显著相关性(41个中的7个)(图)gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba10gydF4y2Ba).第三,只有3个基因(ATR、Rad51C和aga1 -2)显示出与愈伤组织和再生体中特定的遗传和/或表观遗传改变的相关性,而其余基因(9个在愈伤组织中,4个在再生体中)的相关性仅限于愈伤组织或再生体,而不是两者都有(图)gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba10gydF4y2Ba).最后,所有基因改变与再生组织中的任何基因表达均无相关性,而大多数表观遗传改变模式与再生组织中基因表达改变的相关性甚至高于愈伤组织(图)gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba10gydF4y2Ba).最后一个结果是有意义的,因为在再生剂中检测到的所有遗传改变都应该发生在愈伤组织阶段,而表观遗传改变的发生不仅局限于愈伤组织阶段,而且也发生在再生过程中,这是由于植物DNA甲基化模式的发展动态[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
分别在愈伤组织和再生组织中,组织培养诱导的各种类型的遗传/表观遗传改变和参与DNA修复和DNA甲基化的基因表达改变之间的相关性图解。gydF4y2Ba共分析41个基因(详见图)gydF4y2Ba4gydF4y2Ba),且仅显示与愈伤组织或再生组织中至少一种遗传或表观遗传改变相关。Pearson相关分析在附加文件中进行详细说明gydF4y2Ba10gydF4y2Ba.蓝线和黑线表示在水平上的显著相关性gydF4y2BaPgydF4y2Ba< 0.05和gydF4y2BaPgydF4y2Ba分别< 0.01。gydF4y2Ba
讨论gydF4y2Ba
虽然体细胞无性系变异现象的分子基础仍未完全了解,但最近的一系列研究已经提供了实质性的证据,证明遗传和表观遗传机制都参与其中[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba28gydF4y2Ba- - - - - -gydF4y2Ba30.gydF4y2Ba].这与Phillips及其同事早期的认识相一致,即植物组织培养诱导的变异是一种自我强加的突变,是正常细胞控制中断的结果[gydF4y2Ba5gydF4y2Ba].例如,详细的调查gydF4y2Ba拟南芥gydF4y2Ba表明,相对于幼苗,大量参与染色质调控的基因的表达在细胞悬浮培养中优先发生改变(主要是上调),并且发现这与两个大小组sirna的谱的转移有关(21 ntgydF4y2Bavs。gydF4y2Ba24 nt)扮演不同规管角色[gydF4y2Ba31gydF4y2Ba].有人认为,在组织培养条件下染色质基因的错误调控,从而失去表观遗传靶向(siRNAs)是细胞悬浮培养中基因组不稳定的主要原因[gydF4y2Ba31gydF4y2Ba].与此同时,基因组重测序分析表明,核苷酸变化,包括单碱基取代(SNPs)和小插入/缺失(indels),与自发积累的自然突变具有不同的分子光谱,在两者的再生体中广泛发生gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba15gydF4y2Ba]和米[gydF4y2Ba7gydF4y2Ba].有趣的是,尽管通过组织培养转座元件(TEs)的再激活一直被认为是与植物组织培养相关的普遍现象[gydF4y2Ba32gydF4y2Ba- - - - - -gydF4y2Ba37gydF4y2Ba],尤其在稻米中有详细记载[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba38gydF4y2Ba- - - - - -gydF4y2Ba40gydF4y2Ba],但在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba15gydF4y2Ba],指出了不同植物类群体细胞无性系变异分子基础的根本差异。gydF4y2Ba
从进化的角度来看,两个不同基因组的合并(杂交)和一个现有基因组的加倍,无论是一个基因组(同源多倍体)还是一个杂交基因组(异源多倍体),都是革命性的事件,往往具有重要的生物学效应,因为它们可能导致生物的快速多样化,甚至是停滞的物种形成[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].与纯系相比,新生杂交和多倍体基因组的一个特征是它们易于改变,这可能赋予了与纯系相比更强的进化性。gydF4y2Ba41gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].因此,在各种环境条件下,一个新生或已建立的同倍体杂交或多倍体基因组是否与纯种基因组不同,以及在多大程度上不同的问题近年来引起了广泛关注[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].这是因为,除了明显的进化意义之外,考虑到许多重要的农作物是杂交或多倍体或其衍生物,这个问题还具有应用意义[gydF4y2Ba41gydF4y2Ba].鉴于植物组织培养的独特属性[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],探索纯系、杂交种和多倍体不同基因组对这一过程的响应可能存在的差异是很有意义的。gydF4y2Ba
我们最近在高粱中发现,F1杂种与其亲本纯系在组织培养诱导的遗传和表观遗传改变频率上存在显著差异,前者明显比后者更稳定[gydF4y2Ba13gydF4y2Ba].相比之下,基于相同的分析工具,一组玉米自交系及其F1杂种在组织培养诱导的遗传和表观遗传改变上没有表现出明显的差异[gydF4y2Ba14gydF4y2Ba],再次强调了不同植物类群对组织培养的反应差异。这种差异也要求更多的调查使用额外的植物分类,以解开可能的一般性。在这里,使用六个基因型的水稻,其中包括两个纯系栽培品种代表gydF4y2Ba粳稻gydF4y2Ba而且gydF4y2Ba籼稻gydF4y2Ba的亚种gydF4y2Ba栽培稻gydF4y2BaL.是由这两个纯系亲本组成的一对互惠的F1杂交种,以及由这对F1杂交种产生的一对互惠的四倍体,我们进一步探讨了这一问题,并将多倍体也纳入了研究范围。有几个新颖的观察结果:(gydF4y2Ba我gydF4y2Ba)所有6个基因型的愈伤组织和再生组织均检测到遗传和DNA甲基化改变,但遗传改变比表观遗传改变更普遍;(gydF4y2Ba2gydF4y2Ba)两种变异频率均存在显著的基因型差异,但只有遗传变异在三种基因组中表现出显著的特征,其中1个杂种(N/9)变异频率异常高;(gydF4y2Ba3gydF4y2Ba)最令人惊讶的是,F1对偶亲本之间的遗传变异频率差异远大于两个纯系亚种之间的遗传变异频率差异,且这种强的亲本起源效应在对偶四倍体中显著减弱;(gydF4y2Ba4gydF4y2Ba)在愈伤组织和再生组织中,参与DNA修复和DNA甲基化的基因的稳态转录丰度均发生了显著改变,其中部分转录丰度与遗传和/或表观遗传改变相关。我们需要提醒的是,虽然我们的结果是基于相对较大数量的随机取样位点的分子标记分析(gydF4y2Baca。gydF4y2BaAFLP和MSAP各1000个),与基于全基因组测序的方法相比,它们肯定是苍白的。尽管如此,我们的结果为未来利用全基因组重测序、转录组分析、甲基组分析等系统生物学方法对植物体细胞无性系变异的分子机制进行更深入的研究提供了新的可测试的结果。gydF4y2Ba
结论gydF4y2Ba
本研究表明,虽然纯系、F1杂交种和四倍体这三种不同的水稻基因型都存在分子水平的体细胞无性系变异,但在组织培养条件下,它们产生遗传和表观遗传变异的倾向存在根本差异。遗传改变是水稻体细胞无性系变异的主要组成部分,并伴随着胞嘧啶DNA甲基化模式的表观遗传改变。此外,起源亲本效应在互交杂交种的遗传变异频率中起主要作用,从而进一步暗示了体细胞无性系变异中表观遗传机制的分配,尽管其主要表现为遗传改变。这种复杂的遗传和表观遗传交错进一步被参与DNA修复和DNA甲基化的酶编码基因的表达紊乱与遗传和表观遗传改变的强烈关联所证实。gydF4y2Ba
方法gydF4y2Ba
植物行gydF4y2Ba
本研究使用的6个水稻品系包括2个纯系品种Nipponbare (gydF4y2Ba栽培稻gydF4y2Bal . ssp。gydF4y2Ba粳稻gydF4y2Ba)及93-11 (gydF4y2Ba栽培稻gydF4y2Bal . ssp。gydF4y2Ba籼稻gydF4y2Ba)gydF4y2Ba,gydF4y2Ba通过秋水仙素介导的全基因组加倍获得F1杂交后代(Nipponbare/93-11和93-11/Nipponbare,第一个系为母系)和两个四倍体(NN/99和99/NN)。两个纯系品种的单株在实验室经过严格的自交繁殖,经过多代保存后用于F1杂交和四倍体的构建。在组织培养前,通过细胞学和分子标记分析验证了所构建植株的真实性。gydF4y2Ba
组织培养与再生gydF4y2Ba
在含2 mg/L 2,4- d的Murashige-Skoog固体培养基上诱导6个品系萌发的种子愈伤组织。在26±1°C黑暗中培养约1个月后,收集愈伤组织转移到NMB固体培养基中。26±1°C黑暗培养2个月后,选择胚性愈伤组织在改良的NMB培养基上继代培养,26±1°C光周期14h培养植株再生[gydF4y2Ba44gydF4y2Ba].将高度超过5cm的再生芽转移到生根培养基(含2% (w/v)蔗糖和0.68% (w/v)琼脂的不含生长调节剂的半强MS培养基上,用于根发育和芽强化。当植株长到10厘米高时,将具有健康根系的植株从培养基中取出,用自来水冲洗,并移植到经过消毒的混合土壤中,在正常的温室条件下生长。gydF4y2Ba
DNA提取,AFLP和MSAP分析gydF4y2Ba
用高盐CTAB法从膨胀叶片中分离基因组DNA [gydF4y2Ba45gydF4y2Ba].标准扩增片段长度多态性(AFLP)协议[gydF4y2Ba46gydF4y2Ba]之后对银染色进行了修改[gydF4y2Ba13gydF4y2Ba].甲基化敏感扩增片段长度多态性(MSAP)协议与描述完全一致[gydF4y2Ba47gydF4y2Ba].对于这两种标记,进行了两次技术复制(从独立的DNA分离开始),只对清晰和完全可重复的条带进行评分。gydF4y2Ba
AFLP和MSAP变异条带的恢复和测序gydF4y2Ba
在愈伤组织和/或再生植株(再生植株)中显示出相对于供体种子植株的各种遗传或甲基化改变模式的条带从银染的AFLP或MSAP凝胶中洗脱,并用适当的选择性引物组合重新扩增。PCR产物的大小通过琼脂糖凝胶电泳验证,然后克隆到pMD18-T载体(Takara Biotech。公司,大连,中国)。利用自动测序技术,用载体引物对克隆的变异条带进行测序。先进的BlastN和BlastX计划在NCBI网站(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/gydF4y2Ba)进行同源性分析。克隆的AFLP和MSAP条带进行了图谱分析gydF4y2Ba在网上gydF4y2Ba根据水稻全基因组序列(gydF4y2Bahttp://rice.genomics.org.cn/rice/index2.jsp)。gydF4y2Ba卡方检验用于检验变异带在水稻基因组12条染色体上的随机或非随机分布(附加文件)gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
实时逆转录酶(RT -PCR)定量分析gydF4y2Ba
根据制造商的说明使用Trizol试剂(Invitrogen)分离总RNA,然后使用无rnase - DNase I (New England Biolabs)处理以去除任何污染的基因组DNA,并使用RT系统(Invitrogen, Carlsbad, USA)按照制造商的方案进行反转录(RT)反应。基于功能相似性,筛选出41个基因,包括编码推测DNA甲基转移酶(6个)、5-甲基细胞素DNA糖基酶(2个)、sirna相关蛋白(4个)、体细胞同源重组蛋白(SHR, 10个)、错配修复蛋白(MMR, 11个)和checkpoint蛋白(8个)。内控基因为β-actin、eEF-1a和UBQ5。用于q-RT-PCR的引物由Primer 5项目设计(Premier Biosoft International, Palo Alto, USA)。筛选出44对优质引物(其中3对用于归一化的管家基因),扩增效率在92.5% ~ 104.9%之间。所有引物对的序列、预期扩增子大小和扩增效率在附加文件中给出gydF4y2Ba7gydF4y2Ba.q-RT-PCR扩增使用Applied Biosystems StepOnePlus™实时PCR系统(Applied Biosystems, Foster City, USA)和SYBR Premix Ex Taq (Takara)作为dna特异性荧光染料。q-RT-PCR条件报道[gydF4y2Ba13gydF4y2Ba].数据分析采用ABI公司(Applied Biosystems, Foster City, USA)提供的软件进行,计算采用2gydF4y2Ba——ΔΔCtgydF4y2Ba方法,根据以往研究[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
统计数据gydF4y2Ba
采用单因素方差分析(one- one ANOVA),通过分析6个水稻基因型中每个基因型的3 ~ 5个独立再生子,统计检验组织培养诱导的遗传和表观遗传变异(包括“遗传改变”、“甲基化水平差异”、“高甲基化改变”和“低甲基化改变”)的基因型差异。基于AFLP和MSAP变异频率和改变基因表达计算的变异频率数据,使用Pearson相关分析进行相关性检验。具体来说,使用了SPSS v.14.0 (SPSS Inc., USA)软件中的“二元相关,双尾相关系数,Pearson’s”。为了检验q-RT-PCR数据基因表达差异的统计学意义,采用SPSS v.14.0软件包(SPSS Inc., USA)进行单因素方差分析检验。均值采用最小显著差异(LSD)进行比较;p值< 0.05为差异有统计学意义。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Grafi G, Avivi Y:干细胞:去分化的教训。生物技术,2004,22(8):388-389。10.1016 / j.tibtech.2004.06.001。gydF4y2Ba
- 2.gydF4y2Ba
Grafi G, Florentin A, Ransbotyn V, Morgenstern Y:植物发育中的干细胞状态和对胁迫的反应。植物科学进展,2011,2:53。gydF4y2Ba
- 3.gydF4y2Ba
McClintock B:基因组对挑战反应的重要性。科学通报,2004,26(3):344 - 344。10.1126 / science.15739260。gydF4y2Ba
- 4.gydF4y2Ba
拉金PJ,斯考克罗夫特WR:体细胞无性系变异——植物改良中细胞培养变异的新来源。应用理论,1981,60(4):197-214。10.1007 / BF02342540。gydF4y2Ba
- 5.gydF4y2Ba
李志刚,李志刚,李志刚:植物组织培养的遗传不稳定性:正常对照的破坏。美国国家科学研究院。1994, 91(12): 5222-5226。10.1073 / pnas.91.12.5222。gydF4y2Ba
- 6.gydF4y2Ba
Neelakandan AK, Wang K:植物组织培养诱导基因组水平变化的研究进展及潜在应用。植物细胞学报,2012,31(4):597-620。10.1007 / s00299 - 011 - 1202 - z。gydF4y2Ba
- 7.gydF4y2Ba
Miyao A, Nakagome M, Ohnuma T, Yamagata H, Kanamori H, Katayose Y, Takahashi A, Matsumoto T, Hirochika H:利用全基因组测序揭示再生水稻体细胞无性系变异分子谱。中国生物医学工程学报,2012,29(1):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcr172。gydF4y2Ba
- 8.gydF4y2Ba
王秋梅,王丽:植物组织培养的进化观:体细胞无性系变异与选择。植物细胞学报,2012,31(9):1535-1547。10.1007 / s00299 - 012 - 1281 - 5。gydF4y2Ba
- 9.gydF4y2Ba
姜春,Mithani A, Gan X, Belfield EJ, Klingler JP,祝建奎,Ragoussis J, Mott R, Harberd NP:拟南芥再生系具有明显的全基因组突变谱,具有不同的表型。当代生物学:CB。2011, 21(16): 1385-1390。10.1016 / j.cub.2011.07.002。gydF4y2Ba
- 10.gydF4y2Ba
米格尔C,马鲁姆L:植物细胞体外培养的表观遗传学观点:体细胞无性系变异及超越。实验学报,2011,62(11):3713-3725。10.1093 / jxb / err155。gydF4y2Ba
- 11.gydF4y2Ba
Rodriguez-Enriquez J, Dickinson HG, Grant-Downton RT: MicroRNA调控错误:产生体细胞无性系变异的一个被忽视的因素?植物科学进展,2011,16(5):242-248。10.1016 / j.tplants.2011.03.002。gydF4y2Ba
- 12.gydF4y2Ba
李文杰,李文杰:植物多倍体与基因组进化。植物学报,2005,8(2):135-141。10.1016 / j.pbi.2005.01.001。gydF4y2Ba
- 13.gydF4y2Ba
张敏,徐超,闫红,赵宁,冯wettstein D,刘波:高粱纯系F杂种有限的组织培养诱导突变和连锁表观遗传修饰伴随着DNA甲基转移酶和5-甲基胞嘧啶糖基酶转录的增加。植物学报,2009,27(4):366 - 366。10.1111 / j.1365 - 313 x.2008.03719.x。gydF4y2Ba
- 14.gydF4y2Ba
于晓明,李霞,赵晓霞,蒋丽丽,苗国军,庞建军,齐晓霞,刘波:玉米自交系和F1杂交体的组织培养诱导基因组改变。中国生物医学工程学报,2011,32(3):357 - 357。10.1111 / j.1744-7348.2011.00458.x。gydF4y2Ba
- 15.gydF4y2Ba
蒋艳,蔡震,谢伟,龙涛,于宏,张强:水稻功能基因组学研究进展及其对作物遗传改良的意义。生物技术通报,2012,30(5):1059-1070。10.1016 / j.biotechadv.2011.08.013。gydF4y2Ba
- 16.gydF4y2Ba
黄霞,陆涛,韩波:水稻基因组重测序:水稻基因组学的新时代。植物学报,2013,29(4):225-232。10.1016 / j.tig.2012.12.001。gydF4y2Ba
- 17.gydF4y2Ba
mcelland M, Nelson M, Raschke E:位点特异性修饰对限制性内切酶和DNA修饰甲基转移酶的影响。中国生物医学工程学报,1994,22(17):3640-3659。10.1093 / nar / 22.17.3640。gydF4y2Ba
- 18.gydF4y2Ba
Culligan KM, Hays JB:拟南芥MutS同源物- atmsh2, AtMSH3, AtMSH6和一个新的atmsh7形成了三种不同的蛋白质异二聚体,对错配DNA具有不同的特异性。植物学报,2000,12(6):991-1002。gydF4y2Ba
- 19.gydF4y2Ba
Zhou BB, Elledge SJ: DNA损伤反应:透视检查点。自然科学,2000,39(4):344 - 344。10.1038 / 35044005。gydF4y2Ba
- 20.gydF4y2Ba
木村,坂口K:植物DNA修复。化学学报,2006,26(2):353 - 353。10.1021 / cr040482n。gydF4y2Ba
- 21.gydF4y2Ba
尹华,张旭,刘娟,王艳,何俊,杨涛,洪霞,杨青,龚忠:DNA聚合酶epsilon突变对拟南芥表观遗传调控、体细胞同源重组和脱落酸信号的影响。植物细胞学报,2009,21(2):386-402。10.1105 / tpc.108.061549。gydF4y2Ba
- 22.gydF4y2Ba
曹霞,Jacobsen SE:拟南芥DRM甲基转移酶在DNA甲基化和基因沉默中的作用。动物学报,2002,12(13):1138-1144。10.1016 / s0960 - 9822(02) 00925 - 9。gydF4y2Ba
- 23.gydF4y2Ba
曹霞,Jacobsen SE: DRM和CMT3甲基转移酶基因对CpNpG甲基化和不对称甲基化的位点特异性控制。美国国家科学研究院。2002, 99(4): 16491-16498。10.1073 / pnas.162371599。gydF4y2Ba
- 24.gydF4y2Ba
杨晓明,王晓明,王晓明,等:植物基因组DNA甲基化动力学研究。生物化学学报,2007,27(5):366 - 366。gydF4y2Ba
- 25.gydF4y2Ba
王志刚,王志刚,王志刚:DNA去甲基化修复的研究进展。植物学报,2009,25(2):82-90。10.1016 / j.tig.2008.12.001。gydF4y2Ba
- 26.gydF4y2Ba
王晓明,朱建军,王晓明。DNA去甲基化抑制转录基因沉默的研究进展。中国生物医学工程学报,2005,26(2):589 - 598。10.1016 / j.febslet.2005.08.039。gydF4y2Ba
- 27.gydF4y2Ba
李志强,李志强,李志强,李志强。大肠杆菌碱基取代热点的分子生物学研究。自然科学,1997,27(4):377 - 382。10.1038 / 274775 a0。gydF4y2Ba
- 28.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。烟草转基因外等位基因的遗传重组研究进展。中国生物医学工程学报,2009,29(3):344 - 344。10.1104 / pp.108.133165。gydF4y2Ba
- 29.gydF4y2Ba
李志强,李志强,李志强:植物体细胞无性系变异的表观遗传学研究。植物分子生物学,2000,43(2-3):179-188。gydF4y2Ba
- 30.gydF4y2Ba
李永强,李志强,李志强,李志强。玉米Myb转录因子外等位基因的研究进展。遗传学报,2010,186(3):843-855。10.1534 / genetics.110.117929。gydF4y2Ba
- 31.gydF4y2Ba
Tanurdzic M, Vaughn MW, Jiang H, Lee TJ, Slotkin RK, Sosinski B, Thompson WF, Doerge RW, Martienssen RA:永久植物细胞悬浮培养的表观基因组效应。公共科学图书馆,2008,6(12):2880-2895。gydF4y2Ba
- 32.gydF4y2Ba
Madlung A, Comai L:胁迫对基因组调控和结构的影响。学报学报,2004,94(4):481-495。10.1093 / aob / mch172。gydF4y2Ba
- 33.gydF4y2Ba
Grandbastien MA, Audeon C, Bonnivard E, Casacuberta JM, Chalhoub B, Costa AP, Le QH, Melayah D, Petit M, Poncet C,等:茄科植物Tnt1逆转录转座子的应激激活和基因组影响。中国生物医学工程学报,2005,29(4):344 - 344。gydF4y2Ba
- 34.gydF4y2Ba
植物转座因子的表观遗传调控。植物学报,2009,30(4):344 - 344。10.1146 / annurev.arplant.59.032607.092744。gydF4y2Ba
- 35.gydF4y2Ba
转座子对植物进化有多重要?植物学报,2012,14(1):49-61。gydF4y2Ba
- 36.gydF4y2Ba
Yaakov B, Kashkush K:合成异体多倍体中转座因子的甲基化、转录和重排。中国植物学报,2011,第4期,第6期。gydF4y2Ba
- 37.gydF4y2Ba
Pecinka A, Mittelsten Scheid O:应激诱导的染色质变化:其遗传性的关键观点。中国生物医学工程学报,2012,29(5):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcs044。gydF4y2Ba
- 38.gydF4y2Ba
Hirochika H, Sugimoto K, Otsuki Y, Tsugawa H, Kanda M:水稻组织培养诱导突变的逆转录转座子。美国国家科学研究院。1996, 93(15): 7783-7788。10.1073 / pnas.93.15.7783。gydF4y2Ba
- 39.gydF4y2Ba
Sabot F, Picault N, El-Baidouri M, Llauro C, Chaparro C, Piegu B, Roulin A, Guiderdoni E, Delabastide M, McCombie R,等:利用高通量重测序数据对端作图揭示水稻基因组转位格局。植物学报,2011,26(2):344 - 344。10.1111 / j.1365 - 313 x.2011.04492.x。gydF4y2Ba
- 40.gydF4y2Ba
林超,林霞,胡玲,杨娟,周涛,龙龙,徐超,邢松,齐斌,董勇,等:水稻逆转录转座子Tos17组织培养诱导迁移的基因型差异及其遗传杂交的影响。植物细胞学报,2012,31(11):2057-2063。10.1007 / s00299 - 012 - 1316 - y。gydF4y2Ba
- 41.gydF4y2Ba
Soltis PS, Soltis DE:杂交在植物形成中的作用。植物学报,2009,30(4):366 - 366。10.1146 / annurev.arplant.043008.092039。gydF4y2Ba
- 42.gydF4y2Ba
小麦基因组进化与异源多倍体化。遗传学报,2012,32(3):763-774。10.1534 / genetics.112.146316。gydF4y2Ba
- 43.gydF4y2Ba
奥托SP:多倍体的进化结果。光子学报,2007,31(3):452-462。10.1016 / j.cell.2007.10.022。gydF4y2Ba
- 44.gydF4y2Ba
徐明明,王海燕,姜丽丽,庞建军,刘波:水稻mPing转座活性与胞嘧啶甲基化的关系。中国生物医学工程学报,2009,29(3):344 - 344。10.1186 / 1471-2229-9-91。gydF4y2Ba
- 45.gydF4y2Ba
Kidwell KK, Osborn TC:简单的植物DNA分离程序。植物基因组:遗传和物理作图方法。编辑:贝克曼JS,奥斯本TC。多德雷赫特,荷兰:Kluwer学术出版社:1992,1-13。gydF4y2Ba
- 46.gydF4y2Ba
Vos P, Hogers R, Bleeker M, Reijans M, Van DLT, Hornes A, Frijters A, Pot J, Peleman J, Kuiper M: AFLP,等:一种新的DNA指纹识别技术。核酸研究,1995,23(23):4407-4414。gydF4y2Ba
- 47.gydF4y2Ba
董志智,王玉梅,张志军,沈勇,林晓霞,欧新峰,韩福平,刘波:水稻与小穗渐渗杂交水稻系DNA甲基化改变的程度和模式。应用理论与实践,2006,29(6):369 - 369。gydF4y2Ba
- 48.gydF4y2Ba
李qq, Skinner J, Bennett JE:唑治疗后无乳假丝酵母菌实时定量PCR内参基因的评价。BMC Mol biology, 2012, 13: 22。10.1186 / 1471-2199-13-22。gydF4y2Ba
- 49.gydF4y2Ba
胡娜,钱琳,胡艳,寿吉珍,王琛,Giffen C,王秋华,王艳,Goldstein A, Emmert-Buck M,等:实时荧光定量RT-PCR检测食管癌组织中SPARC、FADD、fasin、COL7A1、CK4、TGM3、ECM1、PPL和EVPL mRNA的差异表达。癌症杂志,2006,6(1):33。10.1186 / 1471-2407-6-33。gydF4y2Ba
致谢gydF4y2Ba
国家重点基础研究与发展计划项目(2011CB100205)、国家自然科学基金项目(30990243、31200198)、高校人才引进计划项目(B07017)资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明不存在利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
BL设计研究;XRW, RW, XYL, YB, CDS和NZ进行了研究;XRW、XMY、CMX和YZD对数据进行分析;XRW, YZD和BL共同撰写论文。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
王小冉、吴睿对这项工作做出了同样的贡献。gydF4y2Ba
电子辅助材料gydF4y2Ba
12870 _2013_1279_moesm1_esm.xlsxgydF4y2Ba
附加文件1:用于AFLP和MSAP分析的适配器、预选择引物和选择性扩增引物。(xlsx13kb)gydF4y2Ba
在两个纯系(93-11和Nip)的愈伤组织(C)和再生体(R)中显示两种类型的遗传改变,它们的互惠F1杂交(N/9和9/N)和四倍体(99/NN和NN/99)。S车道、C车道和R车道分别为种子植物、愈伤组织和再生植物。gydF4y2Ba
附加文件2:填充箭头和空箭头分别表示与给定基因型的相应种子植株相比,愈伤组织和/或再生体中条带的损失和增加。引物组合为gydF4y2Ba生态gydF4y2Bari + atc /gydF4y2Ba均方误差gydF4y2Bai + cag。(tiff 5mb)gydF4y2Ba
在两个纯系(93-11和Nip)的愈伤组织(c)和再生体(R)中显示了不同类型的表观遗传c改变,它们的互惠F1杂交(N/9和9/N)和四倍体(99/NN和NN/99)。S车道、C车道和R车道分别为种子植物、愈伤组织和再生植物。gydF4y2Ba
附加文件3:填充的箭头表示与给定基因型的相应种子植株相比,愈伤组织和/或再生体中DNA甲基化模式的改变。引物组合为gydF4y2Ba生态gydF4y2BaRi + agg &gydF4y2Ba偶然发生gydF4y2Ba2 /gydF4y2BaMspgydF4y2Bai + tcg。(tiff 5mb)gydF4y2Ba
12870 _2013_1279_moesm4_esm.xlsxgydF4y2Ba
附加文件4:变种AFLP和MSAP带在12个水稻染色体上非随机分布的统计检验(xlsx11kb)gydF4y2Ba
12870 _2013_1279_moesm5_esm.xlsxgydF4y2Ba
附加文件5:从6个水稻基因型愈伤组织和再生植株中分离的AFLP变异条带的序列分析(xlsx28kb)gydF4y2Ba
12870 _2013_1279_moesm6_esm.xlsxgydF4y2Ba
附加文件6:从6个水稻基因型愈伤组织和再生植株中分离的变异MSAP条带的序列分析(xlsx25kb)gydF4y2Ba
在6种水稻基因型中,涉及愈伤组织和再生体中DNA修复和DNA甲基化的41个基因相对于相应种子植物的相对稳态转录丰度的改变。gydF4y2Ba
附加文件8:相对定量表达概况(2gydF4y2Ba——ΔΔCtgydF4y2Ba),通过将6个基因型的愈伤组织和再生体与相应的种子植株进行比较,对41个水稻基因进行了分析。对3个水稻管家基因β-actin进行归一化后,计算了每个研究基因的相对转录丰度。X79378), eEF-1a(注册编号:X79378)。AK061464)和UBQ5(注册编号:;AK061988)。(xlsx26kb)gydF4y2Ba
12870 _2013_1279_moesm9_esm.tiffgydF4y2Ba
附加文件9:基于q-RT-PCR分析,6种水稻基因型种子植物中涉及DNA修复和DNA甲基化的41个基因的相对稳态转录丰度的变化。基因型包括:2个纯系Nipponbare (Nip)和93-11,1对由这2个纯系亲本产生的F1互交杂交种(N/9和9/N), 1对由F1杂交种产生的互交四倍体(NN/99和99/NN)。详细的基因分析见附加文件8。(tiff 2mb)gydF4y2Ba
12870 _2013_1279_moesm10_esm.xlsxgydF4y2Ba
附加文件10:基于Pearson相关分析,分别对愈伤组织和再生组织中不同类型的遗传和表观遗传改变进行相关分析。(xlsx46 kb)gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(gydF4y2Bahttps://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王,X,吴,R,林,X。gydF4y2Baet al。gydF4y2Ba水稻纯系、F1杂交和多倍体的组织培养诱导遗传和表观遗传改变。gydF4y2BaBMC植物生物学gydF4y2Ba13,gydF4y2Ba77(2013)。https://doi.org/10.1186/1471-2229-13-77gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-13-77gydF4y2Ba
关键字gydF4y2Ba
- 扩增片段长度多态性gydF4y2Ba
- 体细胞无性系变异gydF4y2Ba
- 表观遗传变化gydF4y2Ba
- 组织培养条件gydF4y2Ba
- CCGG网站gydF4y2Ba