摘要
背景
豆类具有与两种重要的根瘤生物有关的独特能力:根瘤结节共生和丛枝菌根共生。Medicago truncatula广泛用于在这些根系中解开基因的功能。在这里,我们描述了人造小罗脉(AMIR)介导的基因沉默系统的发展m . truncatula根。
结果
选择内源性microRNA(MIR)MTR-MIR159B作为用于驱动AMIR表达的骨干分子。烟草中MTR-MIR159B-AMIR构建体的异源表达表明,骨干是功能性的,并介导有效的基因沉默。Amir介导的可见标记的沉默在根转换后也有效m . truncatula构成性地表示可见标记。最重要的是,我们应用了新的amiR系统来阐明一个假定的转录因子的功能,MTERF.1,在菌根共生过程中,在含丛枝的细胞中被强烈诱导。MtPt4启动子驱动的amir沉默导致转录水平的强烈下降和未完全截断的枝叶变形,这表明MTERF.ArbUscule开发需要1。
结论
这里展示的内源性amiR系统提供了一种新型的、高效的工具来揭示根内共生体中的基因功能。
背景
在过去的几十年中,已经建立了豆类作为重要的模型系统,以发现根瘤结节和丛枝菌根共生的分子和生理学背景。根末端生物学期间基因功能的分析需要基于表达扰动实验的逆向遗传方法。过去,RNA干扰(RNAi)或病毒诱导的基因沉默(Vigs)已被广泛应用于产生植物击倒突变体。两种系统都利用真核生物的内源性后术语基因沉默(PTGS)途径[1- - - - - -7].
尚未建立有效的重视系统M. Truncatula,因此,RNAI方法已被广泛应用于阐明基因功能根出杆菌根草杆菌转变根。然而,使用RNAi构建体的本系统中的先前淘汰方法通常不会导致RNAI方法的截止目标效果的一致结果。RNAi基于具有由内含子分离的感兴趣基因的短倒置序列片段的发夹构建体,并通过IR-PTGS途径加工。所表达的RNA折叠成完美匹配的双链,并通过DCL4加工至短干扰RNA(SIRNA)。但是,在某些情况下,由于未知原因,这种方法受肉豆蔻中靶基因的效率低下的限制[8].另外,RNAi方法导致SiRNA产品的异质积累,衍生自表达的发夹,这可能导致相关基因(偏离靶标)的未指定下调,特别是在具有高序列相似性的大型基因家族中[9].此外,称为转运效力的机制导致siRNA物种的扩增和扩展,屈服于初级siRNA信号的次级siRNA [10.].这些辅助siRNA覆盖设计的RNAi构造之外的序列信息,从而提高了偏离目标效果。人工miRNA的先例更具体地作为RNAi构建[11.,12.],在这里,我们建议人工miRNA作为基因击倒方法的替代工具。但是,我们不提供两种方法关于效率和目标特异性的方法的直接比较。
通过基因分析基因函数敲出方法A. rhizogenes.转换的根系在实验系统内的高变异性也受到了妨碍之后的高可变性,其中在根系系统中存在独立的变换事件A. rhizogenes.转换。因此,为了便于研究基因在非均匀转化根系中的功能,需要基因敲除结构具有较强的表达强度。然而,广泛应用于驱动敲除的35S启动子介导了较弱的表达强度m . truncatula根[13.],在髓质根部的氨丛细胞中特别弱的表达[14.].因此,我们开发了一种载体系列,其中三种不同的启动子用于击倒构建表达,35s启动子或泛素3启动子拟南芥蒂利亚纳或mtpt4启动子m . truncatula.后者是在含灌木的细胞中介导一种特殊的强表达[15.].
仲裁是在植物的内皮质细胞层中形成的细胞内真菌结构。仲裁的发展需要深切重新编程根细胞[16.[已鉴定在嵌入细胞中特异性表达的多种基因已被鉴定[17.,18.].然而,在仲裁开发和功能期间对这些基因的确切作用的分析通常是通过关于菌根中表达扰动实验的前所未有的不便而阻碍了m . truncatula根。
在这里,我们证明MTR-MIR159B从其前体分子有效地处理,因此代表了高度合适的骨架,用于表达AMIRm . truncatula.高效的靶基因敲除可以通过amiR对一个可见的标记物在异体系统和在m . truncatula.此外,我们使用MTPT4启动子,其介导在菌根根部的强烈表达[15.]为了驱动AMIR对先前识别的推定转录因子的表达(MTERF.1)。knockMTERF.1表达导致表达水平的表达Rhizophagus irregularis表明菌根定殖减少的基因。此外,MTERF.1似乎是仲裁开发所必需的,因为只有截断的非完全分支的仲裁,并在具有Amir沉默的根中存在MTERF.1的表达。
结果与讨论
miR159b代表了用于人造microRNA(AMIR)表达的合适骨架m . truncatula
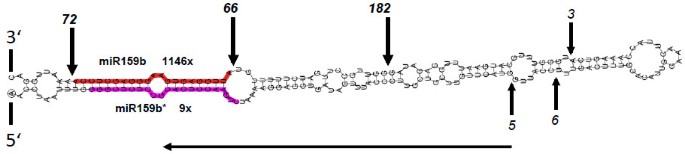
人造miRNA的表达需要miRNA骨干序列,其中成熟miRNA被人工miRNA(AMIR)所取代,其结合并切割其靶序列。AMIR构建体的一个先决条件是星序列和其他从这些构造的小RNA不会累积,因此无法调节其他偏离目标。为了正确处理AMIR,内源性miRNA骨架必须具有非规范的环 - 基础处理类型,其具有第一切割步骤,这对于在前体的顶部区域中发生的miRNA处理似乎是最关键的miRNA序列本身[19.,20.].假设第一裂解位置和miRNA序列的清晰物理分离为操纵amiR序列提供了高度的灵活性[19.,21.].以前的研究雇用了A. Thaliana.loop-to-base处理miR319作为mir表达的前体m . truncatula,导致根中flottilin基因表达显著下调[22.].但是,为了优化阿米尔的表达m . truncatula,我们决定使用内源性miRNA分子作为前体。为此,我们筛选了我们最近的miRNA和降解组数据m . truncatula根[23.,并选择mtr-miR159b作为合适的前体(图)1),因为它显示了上述所有必要的功能。降解体标签在miR159b前体序列上的分布证实了该环对该miR159家族成员的碱基加工m . truncatula.MiR159B初级转录序列克隆在由限制性位点侧翼的Pbluescript II SK +载体中克隆,这允许在适当的二元载体中克隆AMIR序列进行植物转换(附加文件1:图S1)。
MTR-MIR159B代表AMIR表达的合适骨干M. Truncatula。垂直箭头和数字表示降级标签的确切位置。水平箭头表示一个从循环到主干的DCL1处理。成熟的miR159b用红色标记,miR159b*用紫色标记。从小RNA库中读取miR159和miR159*的数量[23.]。
一种向量扰动实验的矢量系统A. rhizogenes.介导的根转换
反向遗传方法m . truncatula根,我们开发了一种载体系列(PRED),其中组成型表达的DSRED基因允许易于检测转换的根源(附加文件1:图S2)。我们已经开发了RNAi(Pred-RNAi)的表达向量(Pred-Exp)和向量。两种类型的载体可用于表达基因或RNAi构建体的三种不同的启动子,即2×35s启动子,UBI3启动子拟南芥蒂利亚纳和mtpt4启动子m . truncatula[15.].
MiR159B介导的AMIR表达介导在烟草中强烈沉默
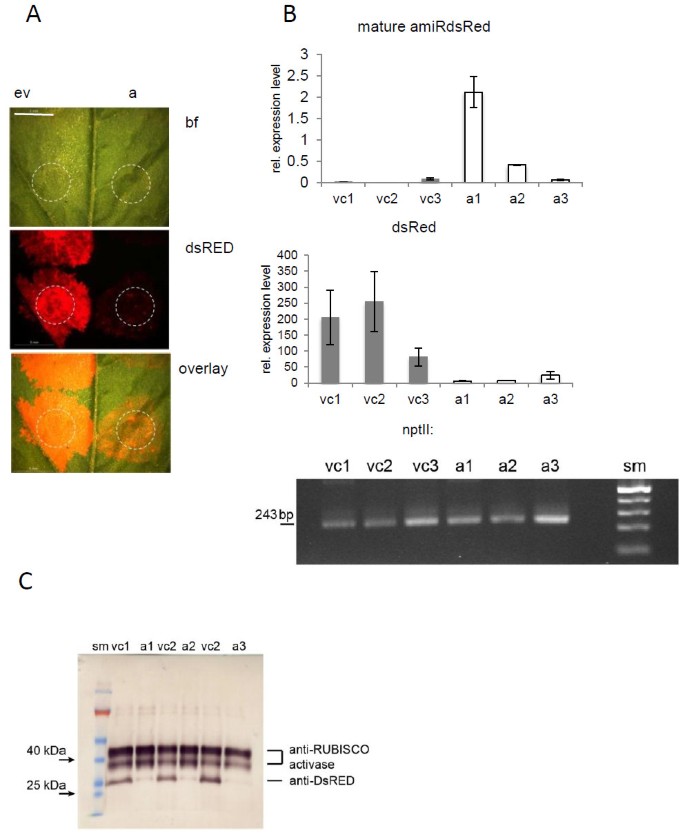
为了测试MTR-MIR159B骨干系统的功能,我们首先在使用DSRED荧光作为基因沉默的可见标记的异源系统中生成靶向DSRED的AMIR并在异源系统中测试。使用WMD3 Web MicroRNA设计师设计了针对DSRED的AMIR。使用重叠的PCR策略产生构造,如最近描述的[12.,成熟的miR159b序列被与靶基因某个选定区域互补的序列所取代。新的星形序列设计的方式是miR159b骨干的二级结构是保守的。在首次尝试测试mtr- mir159b介导的amiR表达时,我们引入了35Spro::阿米尔-安全域通过烟草农药(尼古利亚娜·宾夕法尼亚州).由于用于转换的载体(pred-35spro:: Amir-DSRED)携带组成型表达的转型的DSREDVISIBLE标志物,我们预计来自同一载体的AMIR-DSRED表达将介导DSRED的沉默。作为一个控制,我们将相同的叶子转换为空的pred-35spro向量。正如预期的那样,空载体对照的浸润部位显示DSRED荧光,而PRED-35S的渗透pro:: Amir-DSRED构造仅导致荧光弱(图2).从浸润部位分离的mRNA水平分析证实了amir - sred基因的沉默。与载体对照相比,所有三个amir渗透叶片中dsRed mRNA的丰度显著降低(图)2b)。与载体对照相比,Western印迹确认了在Amir-渗透叶中的DSRED蛋白积聚的显着降低了(图2C)。
mt- mir159b介导的mir沉默在烟草叶片中是有效的。一个)DSRED荧光在PRED-35SPRO :: AMIR的渗透后强烈降低安全域(一个)与空向量(EV)相比,构造(a)。示出了明亮的归档图像(BF),DSRED荧光(DSRED)和两个通道的覆盖。渗透部位由虚线表示。秤栏:5毫米。B)茎环qRT-PCR检测成熟amiR-dsred的相对水平,qRT-PCR检测成熟amiR-dsred的相对转录水平,qRT-PCR检测成熟amiR-dsred的相对转录水平nII(卡那霉素耐药)。vc:载体对照,a: amiR样本,sm:大小标记,扩增大小为243 bp。C)Western印迹展示Amir-DSRED介导的DSRED在烟草叶中的沉默后减少了DSRED的表达。所示是由同一叶子上的三种不同渗透斑点的蛋白质表示的蛋白质沉默(A)和载体对照(VC)的三种复制,每个构建体。使用抗DSRED抗体可视化AMIR-DSRED渗透后DSRED的表达降低。抗Rubisco Activase示出了等于样品载荷。
MIR159B骨干驱动的AMIR构建体导致有效的倒下m . truncatula根
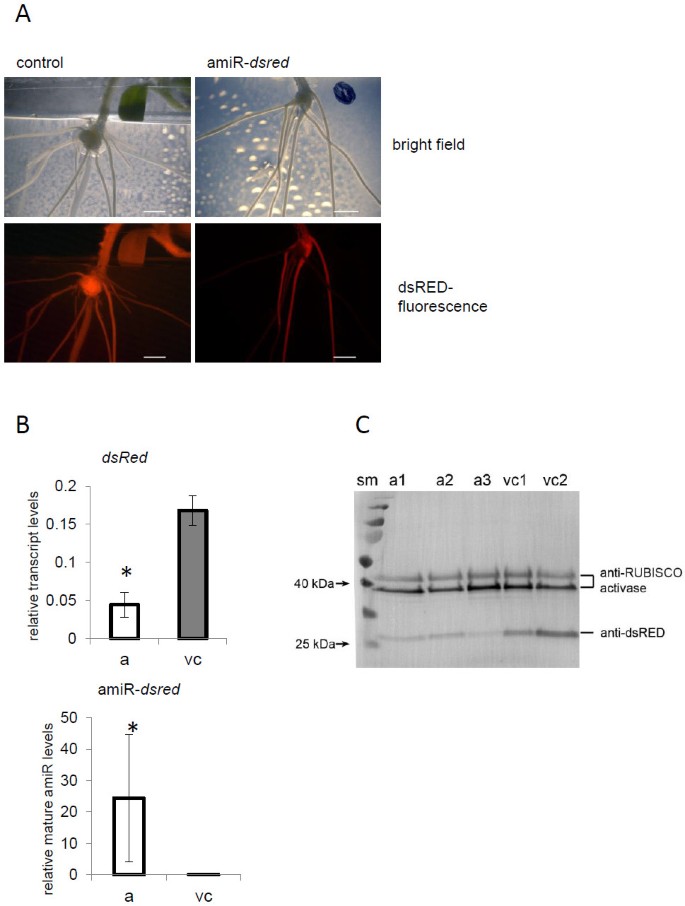
接下来,我们测试了MiR159B介导的AMIR表达的功能m . truncatula.稳定了m . truncatula在植物中表达了sred (ubi10pro::安全域)用于此目的。我们预计,在与amiR-转化后,dsRED在根中的表达会减少安全域构造,这表明MIR159B骨干驱动的AMIR系统工作m . truncatula根。DSRED.-特定的阿米尔被克隆在孔-E4载体后面[24.].作为对照,使用空载体。和预期的一样,根变换与amiR-安全域在载体控制下,所有的根都保持了dsRED荧光(图)3.).
人工microRNA (amiR)介导的沉默DsRED的表达m . truncatula根。一个)稳定的DSRED表达m . truncatula植物(35spro :: dsred)用于A. rhizogenes.介导的根转化。随着AMIR转换后 -安全域(右),由于amir介导的基因沉默,部分根失去了dsRED荧光。比例尺代表5毫米。B)通过茎环QRT-PCR和通过QRT-PCR测量的DSRED测定的相对转录物水平确定的成熟AMIR-DS的相对水平。所示值是3-4生物复制+/-标准偏差的平均值。星号表示统计差异(P <0.05)。C) Western blot分析证实,用amiR-转化后,根系中dsRED蛋白的积累减少安全域构建(a)。显示的是Amir沉默的根样本和两种载体对照(V)的三种重复。agir-在amir后减少了Dsred蛋白的积累安全域使用抗DSRED抗体可视化渗透。抗Rubisco Activase示出了等于样品载荷。
MtPt4启动子驱动的amiR沉默MTERF.1分在仲裁开发中的TF的作用
最后,我们想确认Amir介导的基因沉默也有效地在含仲卷的细胞中工作。由于35s启动子似乎只是含仲卷的细胞中的弱活跃[14.的MtPt4启动子m . truncatula[15.],以使amiRs能够强烈而特异地表达。MtPt4编码一种磷酸盐转运体,这种转运体在含丛枝植物的细胞中被强烈诱导[15.,25.].
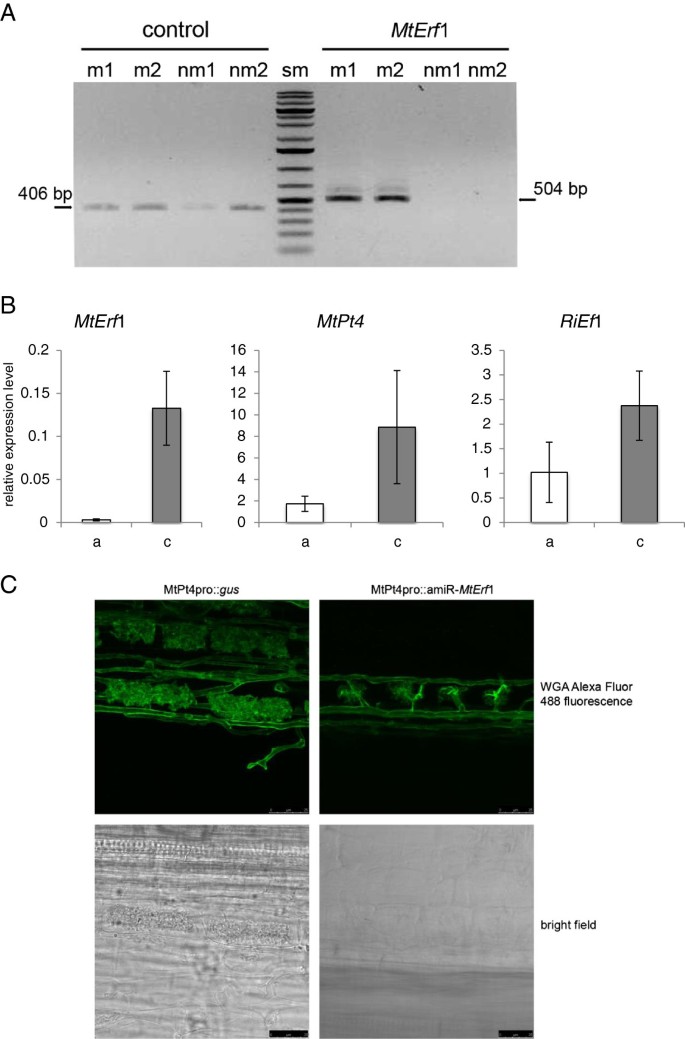
作为概念实验证明的候选基因,我们选择了MTERF1,AP2(APETALA2)的推定构件-EREBP(乙烯响应元素结合蛋白)转录因子家族。发现MTERF1(MEDTR7G009410)强烈,在含仲卷的细胞中表达(图4a和附加文件1:图S3)。先前鉴定了基因m . truncatula转录因子分析[26.,以识别在菌根中诱导的转录因子(Reinert et al.未发表)。MtERF1由392个氨基酸组成,在蛋白质的n端有两个AP2结构域。因此,MtERF1属于AP2- erebp家族AP2基因亚家族。这与前面所描述的相反m . truncatulaNOD因子信号转导所需的ERF转录因子[27.,28.].值得一提的是,MtERF1氨基酸序列的c端部分似乎只是弱保守的。在几种植物中发现了同源序列,但在非菌根植物中未发现同源序列A. Thaliana.(附加文件1图S4)支持MtERF1可能在丛枝植物发育或功能中具有特定功能的假设。为了检验这个假设,anMTERF.如前所述,设计了1-特异性amiR,并克隆在pRed的MtPt4启动子后面。作为控制,MtPt4pro::uid在同一个向量中使用了一个构造。在转化了amiR结构的根中,表达量显著降低MTERF.1成绩单(图4B).另外,一个功能性AM共生的两个诊断标记物的转录水平,MTPT.4和r . irregularis在表达amiR后,根中也明显减少了伸长因子。这表明MtPt4启动子在含丛枝的细胞中介导了有效的amir沉默。此外,减少MTERF.转录本水平导致与功能性菌根定殖相关的基因表达减少,从而降低菌根定殖水平。接下来我们研究了丛枝植物在病媒控制和amiR-中的形态MTERF.1根。在amiR-中,arbus的形态明显受损MTERF.根中只有小的、截短的丛枝(图4C)。这指出了该推定的TF在仲裁开发中的函数,并且表示似乎是ArbUscules的完整成熟所需的MTERF1。
人工microRNA (amiR)介导的沉默DsRED的表达m . truncatula根。一个)MTERF.1转录物在菌根(MYC)中特异性诱导,并在非菌根(NM)根中不可检测。MTERF.1,MTEF.从菌根和非菌根的cDNA中扩增出1作为参考(对照)转录本m . truncatula通过RT-PCR。表示扩增子尺寸。显示了两个生物重复。B)相对水平MTERF.1,MTPT.4和r . irregularis伸长因子1α(r1) (29.],采用qRT-PCR检测。所示值为3-4次生物重复+/−1个标准差的平均值。每个复制由MtPt4pro::amiR-转化的几个根(n<5)组成MTERF.1(a)构造或mtpt4pro ::uid一个控制(c)。C)Amir介导MTERF.敲除导致丛枝变形。图中显示的是在MtPt4pro:: amiR-转化的根中观察到的具有代表性的丛枝MTERF.1构造或mtpt4pro ::uid控制。显示明场图像和WGA-Alexafluor 488荧光。比例条重新注销25μm。
结论
本文介绍的内源性AMIR介导的基因沉默系统提供了一种有用的工具,用于研究生根胚胎中涉及的基因的功能。此外,我们表明,MTPT4启动子在菌根根系中提供了强烈的AMIR构建体。Amir - 沉默的推定转录因子迈尔夫1表明该基因在丛枝植物发育过程中的推定功能,因为在减少的根中只观察到有缺陷的丛枝MTERF.amir介导的基因沉默导致的表达。
方法
生物材料
本研究使用了以下几种植物:尼古利亚娜·宾夕法尼亚州简历。TW16,Medicago truncatula简历。Jemalong(A17)和Medicago truncatula简历。用pKDSR稳定转化的2HA (I)(参见载体和克隆程序了解载体的细节)。菌株包括大肠杆菌TOP10 (Invitrogen)或DH5α用于克隆目的,根出杆菌根草杆菌应变ARqua1 [30.为苜蓿根转换和农杆菌肿瘤术菌株GV2260 [31.]对于叶片渗透测定。真菌Rhizophagus irregularis(菌株BB-E,由法国agauxine提供)繁殖并用于菌根定殖研究,如[23.].
Medicago truncatula生长,转化和接种
Medicago truncatula使用浓缩H吞气种子2所以4随后用HCLO灭菌。将种子放在水琼脂平板上,并在黑暗中保持在4℃过夜以使发芽同步。然后,将种子转移到室温,但保持在黑暗中两天。m . truncatula根据[32.].幼苗随后转移到淡水琼脂板,在黑暗中保存,并在室温下再培养两天。最后将幼苗转移到垂直的方形板(amiRdsRED)或罐子(amiR)中MTERF.1)含法氏培养基加卡那霉素25 μg/ml。这些盘子和罐子在植物培养器中保存3周,以使转化的根生长。植管条件为:200 μE·m-2·S.-1, 16小时/8小时昼夜循环,22°C, 65%的湿度。三周后,表达amiR-和对照结构的植株被DsRed荧光标记,盆栽于石英砂(0.6-1.2 mm)/膨胀粘土/蛭石/接种物混合物(7:1:1 [v/v])的土壤混合中。盆栽植物每周施肥2次,每次20 μM P我Hoagland的解决方案[33.].
m . truncatulaJemalong,Genotype 2Ha用于植物转化与载体pKDSR(I)(见载体)[34.].
叶片渗透测定
尼古利亚娜·宾夕法尼亚州植物在植物加速器中生长4周,并在开花前进行渗透。试验在2株单株上重复进行,每株6次渗透。在入渗前,植物浇水3h,直到土壤水分饱和。叶子被浸透了农杆菌肿瘤术(gv2260)含有pred-35spro:: Amir-dsred或空的pred-expr。收获细菌,用培养基洗涤(10mm MES,10mM MgCl2,pH 5.6),重新播放到OD600含有150μm乙酰苯胺酮的载体0.8含量,并在室温下在振荡器(50rpm)上温育3小时。使用注射器,将500μl的细菌悬浮液渗透到每种叶子的亚轴侧。渗透寄存机标有永久性标记。将植物置于植物中,并在两次和三天后分析。分析后,切除标记的叶片区域,在液氮中冷冻并储存在-80℃下进行进一步的蛋白质和RNA提取。
真菌结构的染色和测定
用Alexa Fluor 488 (Invitrogen)结合的小麦胚芽凝集素(WGA)观察真菌结构。简而言之,大约。1厘米长的根切片在90°C的10% KOH [w/v]中浸泡5分钟,并用磷酸盐缓冲液(pH 7.4)冲洗5次。然后在含有0.01% WGA Alexa Fluor 488 [w/v]的PBS缓冲液(pH 7.4)中培养过夜。
荧光成像
烟草叶片的DSRED荧光和嵌合的根m . truncatula采用带有DsRed滤光系统的Leica M165 FC立体荧光显微镜(Leica 10447227)对植物进行监测。荧光曝光时间为500 ms,增益设置为2.0×。叠加图像使用徕卡LAS-AF 2.8.1版本生成。
在徕卡TCS-SP5共聚焦显微镜(Leica Microsystems, Exton, PA USA)上,使用63×水浸物镜NA 1.2, zoom 1.6采集WGA-Alexa Fluor染色的丛枝标本的共聚焦图像。Alexa Fluor在488 nm激发,发射光从505到582 nm采集。光学切片间隔0.3-0.5 μm。图像处理使用ImageJ软件(Wayne Rasband,美国国家卫生研究院;http://imagej.nih.gov/ij.).
小RNA和降低体的映射读取miRNA前体和人工miRNA的设计
全部m . truncatula属于MiR159和MiR319的家族的前体序列被收集并分析小RNA和降级读取位置以及丰度。以前映射到Medicago 3.0基因组的小RNA和降低组读数[23.].读取的精确位置及其丰度的信息被手动注释给适当的前体。21 nt长期人工miRNA序列安全域和MTERF.1使用Web MiRNA Designer WMD3设计(http://wmd3.weigelworld.org/cgi-bin/webapp.cgi.)按照网站上给出的说明。使用PSRNATarget选择并检查绿色标记序列并检查其靶序列和Medicaco Genome V3.5(http://plantgrn.noble.org/psrnatarget/).选择无或最小脱靶序列进一步构建人工miRNA。
载体和克隆程序
通过转换独特创建的载体pkdsr(i)ASC.preroot的I [35.]到A.Pac我网站,以一种与其启动子和终结者的基因侧翼的方式Pac我网站。同样,A.KpnPk7gwiwg2(i)的网站[36.变成了Pac我的网站。的Pac我侧翼的盒子被从倾角切除并连接到新颖之中PacI位点pK7GWIWG2(I)。得到的载体命名为pKDSR(I)。
在构建pRed-amiR载体时,首先将重叠PCR的最终扩增产物克隆到pCR2.1 (Invitrogen)中。PCR产物包含部分pBluescript II SK(+)多克隆位点。将mir前体分子从pCR2.1载体中去除SPE.我和MLU.I限制位点并连接到pRed载体的适当位点。最终的pRed-amiR结构被测序并用于根转换(pRed-35Spro::amiR-安全域pRed-MtPt4pro::阿米尔-MTERF.1)如最近所述[32.].另外,对于烟草叶片渗透测定,AMIR-安全域前体分子被插入通过没有我和KpnI位点进入pORE-E4 [24.].
利用miR159b主链进行重叠PCR设计人工miRNA
通过基因合成(MWG)合成MiR159B骨架,将另外的MLUI位点加入到MIR前体的3'末端。将该分子克隆到SpeI和PstIPbluescript II SK(+)的限制性位点。得到的PB159B载体表示重叠PCR以产生AMIR前体分子的模板。为此目的,根据[37.].
底漆I:GTX1…X21.AAATTGGACACGCGTct (X1-X21.是设计的amiR序列)。
引物2:遥控1......21.Acaaaaagatcaaggc(Y.1- 我21.是反向补体方向的amiR序列)。
底漆III:TTZ1... z.21.tctaaaaggaggtgtgatag(z.1-Z.21.是反向补充取向的AMIR序列,例外情况下11.和Z.12.必须修改为不配对(也没有G:U非沃森-克里克配对)到位置X10.和X.11., 分别。z.21.必须改变为不配对x1.
底漆四:氮化镓1......21.AATTAGGTTactagt (N1-N21.是Z的逆补吗1-Z.21.).用于创造突变和amir的底漆序列mterf1.在附加档案中2S1:表。
用PB159B作为模板和以下三种引物组合(1)底漆A +引物I,(2)引物II +引物III,(3)引物B +引物IV进行三种独立的PCR。将PCR产物加载到2%琼脂糖凝胶的单个孔中,然后凝胶纯化。使用底漆A +引物B将所得产物的混合物用作最终PCR的模板。将单PCR产物亚克隆到PCR2.1(Invitrogen)中并进行测序以检查正确的AMIR前体序列和茎环折叠与MTR-MIR159B相同。
RNA提取,RT-PCR和定量RT-PCR
根据制造商的说明,使用Mirvana miRNA提取试剂盒(AMBION)和植物隔离助剂步骤(AMBION)从液氮冷冻和地组中提取总RNA。所有PCR都如前所述进行[23.,38.].
蛋白质提取和蛋白质印迹
将冷冻植物组织被研磨,并用严格的涡旋中萃取蛋白质,在每克鲜重的4ml均质缓冲液中萃取。均质化缓冲液由100mM HEPES pH 7.5,10%甘油,5mM DTT,完全超片剂 - EDTA FREE(Roche)蛋白酶抑制剂鸡尾酒组成。将提取物以14000g离心15分钟(4℃),收集上清液并在-20℃下冷冻等分试样。使用MictioRiter板方案的制造商的说明书,使用Quickstart Bradford蛋白质测定(BiORAD)测定蛋白质浓度。
将15 μg烟草提取物蛋白和10 μg苜蓿根提取物蛋白分别在1 mm的12% SDS-PAGE微凝胶上进行western blot分析,然后根据Immobilon-P转移膜用户指南,通过半干印迹转移到Immobilon-P PVDF膜(Millipore)上。用0.4 μg/ml(1:50 50)兔抗rfp标签抗体(GenScript)与兔抗RubisCO活化酶(Agrisera)在1:10000稀释液中混合的一抗进行DsRed检测,后者用于检测RubisCO活化酶作为负载对照。用偶联碱性磷酸酶(Abcam)的山羊抗兔二次抗体1:10000稀释。采用NBT/BCIP (Roche)技术观察蛋白条带。通过与预先染色的蛋白大小标记物(Thermo scientific)进行比较,确定了特定的蛋白。
统计数据
为了检验植物基因型和处理之间的差异,利用学生的数据进行分析t-使用Sigmaplot软件包(Systat, Germany)进行两两比较测试。
参考文献
- 1。
沃特豪斯,Graham MW,王明波:同时表达反义RNA可以诱导植物抗病和基因沉默。中国科学(d辑:地球科学),1998,16(4):531 - 534。10.1073 / pnas.95.23.13959。
- 2。
Smith NA, Singh SP, Wang MB, Stoutjesdijk PA, Green AG, Waterhouse PM:内含子剪接发夹rna的总沉默。自然。2000,407(6802):319-320。10.1038 / 35030305。
- 3.
Small I:用于揭示和工程植物基因功能的RNAi。生物技术学报,2007,18(2):148-153。10.1016 / j.copbio.2007.01.012。
- 4.
balcombe D:植物的RNA沉默。自然科学学报。2004,431(7006):356-363。10.1038 / nature02874。
- 5。
BaulCombe D:RNA沉默。趋势Biochem SCI。2005,30(6):290-293。10.1016 / J.TIBS.2005.04.012。
- 6。
Kjemtrup S,Sampson Ks,Peele Cg,Nguyen Lv,Conkling Ma,Thompson Wf,Robertson D:由Geminivirus携带的植物DNA沉默的基因。植物杂志:用于细胞和分子生物学。1998,14(1):91-100。10.1046 / J.1365-313x.1998.00101.x。
- 7。
Wesley SV,Helliwell Ca,Smith Na,Wang MB,Rouse Dt,Liu Q,Gooding PS,Singh Sp,Abbott D,Stoutjesdijk Pa,等:构建植物中高效,有效和高通量基因沉默的设计。植物杂志:用于细胞和分子生物学。2001,27(6):581-590。10.1046 / J.1365-313x.2001.01105.x。
- 8。
Melito S,Heuberger Al,Cook D,DIES BW,MacGuidwin Ae,弯曲AF:转基因根系中的线虫人口统计测定显示RHG1基因座LRR激酶对大豆囊肿线性耐药性没有显着影响。BMC植物BIOL。2010,10:104.101186 / 1471-2229-10-104。
- 9。
Xu P, Zhang Y, Kang L, roossink j, Mysore KS:植物转录后基因沉默中脱靶沉默的计算和实验验证。植物营养与肥料学报。2006,32(2):429- 434。10.1104 / pp.106.083295。
- 10。
Brodersen P,Voinnet O:植物中RNA沉默途径的多样性。趋势类型。2006,22(5):268-280。10.1016 / J.tig.2006.03.003。
- 11.
利用人工微rna和其他小rna对植物进行基因沉默。植物杂志:用于细胞和分子生物学。[j] .地理学报,2008,53(4):674-690。10.1111 / j.1365 - 313 x.2007.03328.x。
- 12.
王志强,王志强,王志强:人工微rna介导的定向基因沉默。方法:中国生物医学工程学报,2010,592:71-88。10.1007 / 978 - 1 - 60327 - 005 - 2 - _6。
- 13。
Aurac MC,Timmers AC:模型豆类的核磁研究Medicago truncatula:使用本组成型EF1Alpha启动子的优点和在结节组织中检测荧光报道蛋白的局限性。分子植物微生物相互作用:MPMI。2007,20(9):1040-1047。10.1094 / mpmi-20-9-1040。
- 14。
关键词:磷酸转运蛋白,极性定位,分泌调节中国科学(d辑:地球科学),2012,39(11):1102 - 1102。
- 15。
Harrison MJ,Dewbre Gr,Liu J:磷酸盐转运蛋白Medicago truncatula参与获取由丛枝菌根真菌释放的磷酸盐。植物学报。2002,14(10):2413-2429。10.1105 / tpc.004861。
- 16。
哈里森MJ:用于丛枝菌根共生的细胞计划。CurrOp植物BIOL。2012,15(6):691-698。10.1016 / J.PBI.2012.08.010。
- 17。
Gaude N,Bortfeld S,Duensing N,Lohse M,Krajinski F:粘菌根的仲裁和非殖民化皮质细胞经历广泛而特异性的重新编程,在丛枝腐败的发育中。植物杂志:用于细胞和分子生物学。2012,69(3):510-528。10.1111 / J.1365-313x.2011.04810.x。
- 18。
Hogekamp C, Arndt D, Pereira PA, Becker JD, Hohnjec N, Küster植物营养与肥料学报。2011,27(4):423 - 427。10.1104 / pp.111.186635。
- 19。
Bologna Ng,Mateos JL,Bresso,例如Palatnik JF:环到基础加工机制是植物MicroRNA MIR319和MIR159的生物发生。Embo J. 2009,28(23):3646-3656。10.1038 / emboJ.2009.292。
- 20。
Schwab R,Voinnet O:miRNA处理颠倒了。Embo J. 2009,28(23):3633-3634。10.1038 / emboj.2009.334。
- 21。
Bologna Ng,Schapire Al,Palatnik JF:植物MicroRNA前体的加工。简短的Funct基因组学。2013,12(1):37-45。10.1093 / BFGP / ELS050。
- 22。
Haney Ch,Long SR:氮素固定细菌感染需要植物氟苯胺。Proc Natl Acad Sci U S A. 2010,107(1):478-483。10.1073 / pnas.0910081107。
- 23。
Devers EA,Branscheid A,May P,Krajinski F:星星和共生:MicroRNA-和MicroRNA *介绍的转录裂解参与丛枝菌根共生。植物理性。2011,156(4):1990-2010。10.1104 / pp.111.172627。
- 24。
Coutu C,Brandle J,Brown D,Brown K,Miki B,Simmonds J,Hegedus DD:孔:一个适用于单子叶和Dicot植物转型的模块化二元载体系列。转基因Res。2007,16(6):771-781。10.1007 / s11248-007-9066-2。
- 25。
Javot H,Penmetsa RV,Terzaghi N,Cook Dr,Harrison MJ:aMedicago truncatula磷酸铁酯对于丛枝菌根共生不可或缺。Proc Natl Acad Sci U S A. 2007,104(5):1720-1725。10.1073 / PNAS.0608136104。
- 26。
Kakar K, Wandrey M, Czechowski T, Gaertner T, Scheible W-R, Stitt M, Torres-Jerez I, Xiao Y, Redman J, Wu H, et al .:一种高通量定量RT-PCR分析转录因子基因表达的社区资源Medicago truncatula.植物方法。2008,4(1):18 .101186 / 1746-4811-4-18。
- 27。
Middleton PH, Jakab J, Penmetsa RV, Starker CG, Doll J, Kalo P, Prabhu R, Marsh JF, Mitra RM, Kereszt A,等:ERF转录因子Medicago truncatula这对于点头因子信号转导必不可少。植物细胞。2007,19(4):1221-1234。10.1105 / TPC.106.048264。
- 28。
Cerri Mr,Frances L,Laloum T,Aurac MC,Niebel A,Oldroyd Ge,Barker DG,Fournier J,De Carvalho-Niebel F:Medicago Truncatula Enn转录因子:在整个根瘤菌感染中的NSP1 / NSP2 GRAS因子和表达动态的监管相互作用.植物理性。2012,160(4):2155-2172。10.1104 / pp.112.203190。
- 29。
Helber N, Wippel K, Sauer N, Schaarschmidt S, Hause B, Requena N:一种在丛枝菌根真菌Glomus sp中运作的多功能单糖转运体,对与植物的共生关系至关重要。植物学报。2011,23(10):3812-3823。10.1105 / tpc.111.089813。
- 30.
关键词:毛蚕豆,转基因根瘤,不确定型,基因表达植物营养与肥料学报。1993,6:699-706。10.1094 / mpmi - 6 - 699。
- 31。
Deblaere R, Bytebier B, Degreve H, Deboeck F, Schell J, Vanmontagu M, Leemans J: agrobacterium介导的基因转移到植物的高效Octopine Ti质粒衍生载体。中国生物医学工程学报,1998,13(3):477 - 488。10.1093 / nar / 13.13.4777。
- 32。
boison - dernier A, Chabaud M, Garcia F, Becard G, Rosenberg C, Barker DG:根出杆菌根草杆菌- 转化根Medicago truncatula用于固氮和菌根内共生关系的研究。植物营养与肥料学报。2001,14(6):695-700。10.1094 / MPMI.2001.14.6.695。
- 33。
Hoagland Dr,Arnon Di:不含土壤的种植植物的水培素。加利福尼亚州agr expt sta circ。1950,374:1-32。
- 34。
夏博·M, Larsonneau C, Marmouget C, Huguet T:桶医的转变(Medicago TruncatulaGaertn)农杆菌肿瘤术利用Mtenod12结节蛋白启动子与Gus报告基因融合的转基因植株体细胞胚发生再生。植物学报,1996,15(5):305-310。
- 35。
Limpens E,Ramos J,Franken C,Raz V,Compaan B,Franssen H,Bisseling T,Geurts R:RNA干扰根出杆菌根草杆菌- 拟南芥的转变根源Medicago truncatula.J Exp Bot。2004,55(399):983-992。10.1093 / JXB / ERH122。
- 36。
Karimi M,Inze D,Depicker A:用于农杆菌介导的植物转化的网关载体。趋势植物SCI。2002,7(5):193-195。10.1016 / s1360-1385(02)02251-3。
- 37。
Schwab R,Ossowski S,Riester M,Warthmann N,Weigel D:通过拟南芥中的人造小罗式沉默的高度特异性基因。植物细胞。2006,18(5):1121-1133。10.1105 / TPC.105.039834。
- 38。
Branscheid A,Sieh D,Pant Bd,May P,Devers EA,Elkrog A,Schauser L,Scheible WR,Krajinski F:表达模式表明MiR399在丛枝菌根共生期间对局部PI增加的细胞反应调节的作用。分子植物微生物相互作用:MPMI。2010,23(7):915-926。10.1094 / MPMI-23-7-0915。
致谢
马克斯·普朗克学会支持这项工作。我们感谢Igor Kryvoruchko构建了pKDsRed向量。我们感谢Ursula Krause提供了抗rubisco激活酶抗体以及Derek Nedveck对手稿的批判性阅读。
作者信息
隶属关系
通讯作者
附加信息
竞争利益
作者声明没有竞争利益。
作者的贡献
EAD和JT进行了分子分析,参加了研究的设计,进行了统计分析并起草了手稿。AR进行了启动子记者分析。NG进行了稳定的植物转化。FK构思了这项研究,并参与了其设计和协调,并帮助起草了手稿。所有作者阅读并认可的终稿。
Emanuel A devers,Julia Teply对这项工作同样贡献。
电子补充材料
图S2。
附加文件1:图S1:在pBluescriptII SK+载体中表达amiRNA的mtr-miR159b骨干序列。使用重叠PCR策略从这个模板生成AmiRNA结构(Schwab等。,2006;ossowski.等, 2008;施瓦布等。,2010)。额外的MLU.引入I型酶切位点亚克隆到pRed载体上。图S2。pRed向量序列的T-DNA示意图。载体有表达载体(amiR表达载体)或RNAi载体。泛素10 (ubi10)启动子驱动的sred基因允许通过sred荧光鉴定转化的根。MtPt4启动子在含丛枝的细胞(pRed-PT4)中介导强表达。另外,ubiquitin10 (pRed-ubi3)或2×35S (pRed-35S)启动子介导相应结构表达。TL/R: T-DNA左/右边界,pro:启动子,nptII:新霉素磷酸转移酶(卡那霉素抗性),ter:终止子,OCS: Octopin合酶。图S3。MtErf1启动子在含丛枝菌根细胞中的活性m . truncatula.1145 BP.MTERF.1个启动子区与青荧光蛋白(CFP)融合。和转移根出杆菌根草杆菌转化为m . truncatula根。根源殖民r . irregularis.接种后三周,收获根,在横截面中观察到CFP荧光。真菌结构用WGA- alexafluor 594染色。箭头表示ArbUscules,Ih:细胞间菌丝,P:狭窄,鳞片条表示25μm。图S4。MTERF1机智同源物的对齐甘氨酸最大GM_1(XP_003533548.1),GM_2(XP_003551723.1),GM_3(XP_003530686.1),GM_4(XP_003553203.1),杨树trichocarpaPt_1 (XP_002323836.1), Pt_2 (XP_002315794.1),里纳斯市政府RC_1(XP_002517474.1),vitis ViniferaVV_1(CAN79925.1),VV_2(XP_003633849.1),VV_3(XP_002270149.1),Fragaria Vesca.FV_1(XP_004304943.1),FV_2(XP_00429847.1),Prunus PersicaPP_1(EMJ17977.1),PP_2(EMJ18018.1),PP_3(EMJ27523.1),Cucumis巨大成功CS_1(XP_004147491.1)。两个AP2域以红色和相同的位置强调,灰色突出显示。(PPTX 983 KB)
作者的原始提交的图像文件
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Demers,E.A.,Tepy,J.,Reinert,A。et al。一种用于阐明根内共生相关基因功能的内源性人工microRNA系统Medicago truncatula.BMC植物BIOL.13,82(2013)。https://doi.org/10.1186/1471-2229-13-82
已收到:
接受:
发表:
关键字
- 菌根殖民
- 阿米尔表情
- 菌根的根
- RNAi构造
- Paci网站