抽象的
背景
紫杉醇是一种抗癌药物收获tax树木,建议生态以充当杀菌剂。tax是宿主到真菌内心细胞,定义为栖息植物而不会引起疾病的生物。这tax已显示Endophyes合成紫杉醇体外,提供tax具有第二潜在的生物合成途径,用于该保护性代谢物。植物的紫杉醇水平在个体树之间有125倍,但潜在的原因仍然是未知的。
结果
比较tax树木内的树木或树枝,在紫杉醇含量和常驻紫杉醇的数量之间观察到相关性,帕拉克西托米SSM001。真菌内心细胞的消耗在足底通过杀菌剂减少植物紫杉醇的积累。杀菌剂处理完整的植物导致相应于植物紫杉醇生物合成所需的两个关键基因的转录本和/或蛋白质水平的下降。紫杉醇对产紫杉醇内生菌的自然栖息地针叶树的真菌病原真菌具有杀菌活性。与其他紫杉醇产生内生菌一致,SSM001对紫杉醇具有抗性。
结论
这些结果表明,完整之间的紫杉醇含量的变化tax植物和/或组织至少部分是由其紫杉醇产生的内心生物合成基因的不同程度的转录引发。由于紫杉醇是杀菌剂,并且内心对紫杉醇有抵抗力,我们讨论这种内心策略如何防止其真菌竞争对手的定植,但在最少的代谢成本下。
背景
Endophytes通常是真菌和栖息植物而不会引起疾病症状的细菌[1].已经证明了一些内心细胞通过提高营养可用性,克服非生物胁迫和植物病原体的生物控制剂来使其宿主受益[2那3.].在洛利姆草,真菌内心细胞,新磷酸钠共青磷脂,已被证明通过生产洛林生物碱来保护其宿主免受草食性,产生共生关系[4.].紫杉醇是从中收获的二萜类抗癌药物tax(yew)树[5.那6.].生态上,提出紫杉醇作为杀菌剂[7.].有趣的是,tax已经显示出植物饲养紫杉醇的真菌内心细胞[8.].据报道紫杉醇至少由至少18种不同的真菌属,主要是内心的内心内容tax和其他树木[8.那9.].使用HPLC / MS,植物紫杉醇单克隆抗体和NMR鉴定了真菌紫杉醇[10-12].虽然存在植物化合物是否需要其合成[13]真菌紫杉醇在几轮后独立于植物生产体外培养[10那14那15].最近我们孤立紫杉醇产生的真菌内皮菌株,帕拉克西托米SSM001来自Taxus X Media.,并类似地证明它可以产生紫杉醇体外独立于其宿主[16那17].
植物紫杉醇由衍生自甲基吡咯醇磷酸盐(MEP)途径的紫杉烷环组成,所述含苯丙氨酸衍生的侧链[18].其他报告表明甲羟戊酯途径有助于老年植物中的紫杉醇生物合成[19那20.].HMGR和DXR分别是MEP和Mevalonate途径中的速率限制酶[21].我们最近证明真菌可能类似地利用撒苯甲酸盐和非麦甲酸多醛途径用于紫杉醇生物合成[16],暗示植物和真菌生物合成途径的冗余。已显示植物紫杉醇生物合成需要另外≥19个生物合成步骤,具有税二烯合酶(TS; EC 4.2.3.17)[18].
已知完整树木的紫杉醇水平从树到树的树木变化达到125倍[22-26,但根本原因从未被提及。具体来说,植物紫杉醇的含量因物种而异[24甚至在物种中的树到树;在其他因素中,后一种变化与树龄有关[22那23或取样季节[27那28].作为一种可能的机制,产生了紫杉醇的真菌内心内体细胞来引发紫杉醇生产体外从tax植物悬浮培养[29].共同培养Taxus chinensis.和Fusarium Mairei.真菌在共培养系统中引起了38倍的增加[29], 尽管F. Mairei.真菌肉汤使紫杉醇产量增加了两倍Taxus cuspidata.悬浮培养[29].在其他研究中,真菌也被证明能诱发其他萜类化合物的产生在足底[30.-32].紫杉醇的诱导机制尚不清楚,也没有证据表明这些真菌也能在完整的植物中诱导植物紫杉醇的产生。
本文在前人研究的基础上,验证了植物紫杉醇含量剧烈变化的生态学假设,即植物紫杉醇生物合成途径中产生紫杉醇的真菌内生菌的潜在变异可能是导致植物紫杉醇含量剧烈变化的原因。
结果
树木对植物紫杉醇浓度的树木变异与其常驻真菌内心细胞的数量相关联
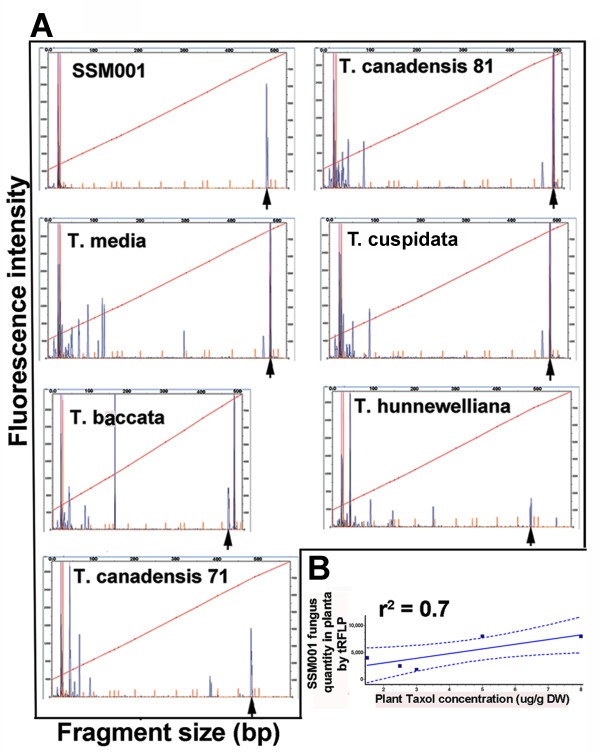
初始结果体外用一个T. X Media.细胞培养系显示植物紫杉醇积累之间的中等相关性体外其居民真菌内生社区的浓度[见附加文件1].为了确定紫杉醇含量与紫杉醇产生的完整植物中的紫杉醇生真菌内体之间有相关性,从附近的六个tax树木,代表五种植物[T. X Hunnewelliana,T.Canadensis,T. X Media,T. Cuspidata(S.等Z.),和t . baccata(L.)]。发现来自每种物种的木样品含有内生真菌。每个真菌都培养为纯洁;18S RDNA测序表明,所有真菌的身份对应于帕拉克西托米,与SSM001相比,〜1%的核苷酸取代序列[见附加文件2],生产紫杉醇的真菌菌株,我们最近从当地的特征T. X Media.植物 [16].随着各种植物中可能存在的不同内体,使用基于TRFLP的真菌群落18S rDNA荧光指纹识别半定量测量每个茎样样品中的SSM001真菌水平。TRFLP是一种基于PCR的方法,其使用从植物组织汇总的DNA放大整个真菌群落;扩增子是限制消化的,并且片段大小(x轴,图1A)表示真菌基因型,而峰值大小(y轴,图)1a)表示真菌的量。先前的小规模实验表明在足底使用TRFLP的真菌定量与使用定量PCR的结果一致[参见附加文件3.].使用TRFLP指纹识别,培养的SSM001显示出独特的峰(490个核苷酸片段)(图1A, SSM001面板),并且在所有树中都发现了相同的峰。tRFLP峰大小用于SSM001定量在足底(数字1a,b)。从每个汇集木材样本的植物紫杉醇水平表现出良好的相关性(Pearson系数R2= 0.70,p = 0.0382),常驻SSM001的数量(图1b)[查看其他文件4.].
树木植物紫杉醇浓度的树木变异与其居民的数量相关联帕拉克西托米SSM001真菌内心细胞。对于生态采样,单〜5-6厘米的茎件从多样性tax收获树木并切成小块。汇集了大多数子样品用于DNA提取或紫杉醇量化,其余部分用于分离内生真菌。(一)TRFLP DNA指纹纹理的真菌内心群落在每个茎样tax物种用于真菌18S rDNA引物的扩增和限制。培养的紫杉醇生产真菌,帕拉克西托米SSM001,用作阳性控制。X轴上的核苷酸尺寸识别独特的真菌分离株。Y轴表示真菌分离物的数量。(B)从不同的木材样品中植物紫杉醇产量之间的相应相关性tax物种和帕拉克西托米内生植物数量在planta。识别和量化帕拉克西托米使用TRFLP进行Endophyte,一种基于PCR的技术,其使用从合并的植物组织中收集的DNA放大整个真菌群落;扩增子是限制性消化的,并且片段尺寸(X轴,面板A)表示真菌菌株;同时,峰(Y轴,面板A)的尺寸表示真菌的量。对于所有实验,从每棵树中收获单个5-10cm茎片,分为少数部分,其中含有紫杉醇量化和/或真菌DNA指纹识别的〜8-10。
单一的紫杉醇产量的变化tax树枝与居民紫杉醇的数量的微尺度变异相关联
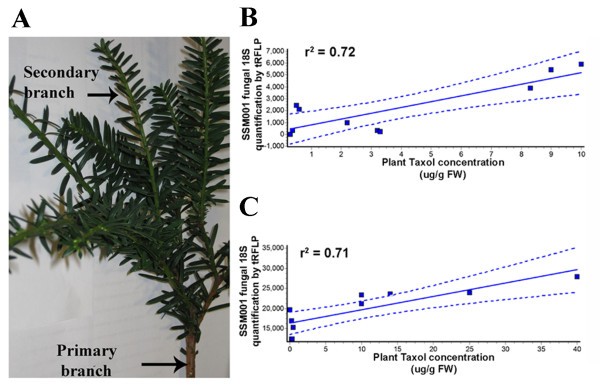
由于树内的内生真菌群体可能以微观尺寸变化,因此在个体内的不同邻近的主要分支中测量紫杉醇tax植物(图2a)并与生成的紫杉醇产生的真菌的数量相比帕拉克西托米SSM001(通过TRFLP半定量PCR测量)。植物紫杉醇在相邻的主要分支中的积累表现出良好的相关性(Pearson相关显示,r2= 0.72,p = 0.0037),具有SSM001真菌的数量(图2B).在更细的尺度上重复实验,测量属于同一一级枝的相邻二级枝中的紫杉醇(图)2一种)。植物紫杉醇在相邻的次级分支中再次与SSM001真菌的数量相关(Pearson相关,R2= 0.71,p = 0.0021)(图2C)。这些数据表明,完整内的紫杉醇产量的细度变化tax树木与税前内生真菌的局部变异相关。
内源性真菌会影响年轻人和成熟的植物紫杉醇产量tax植物
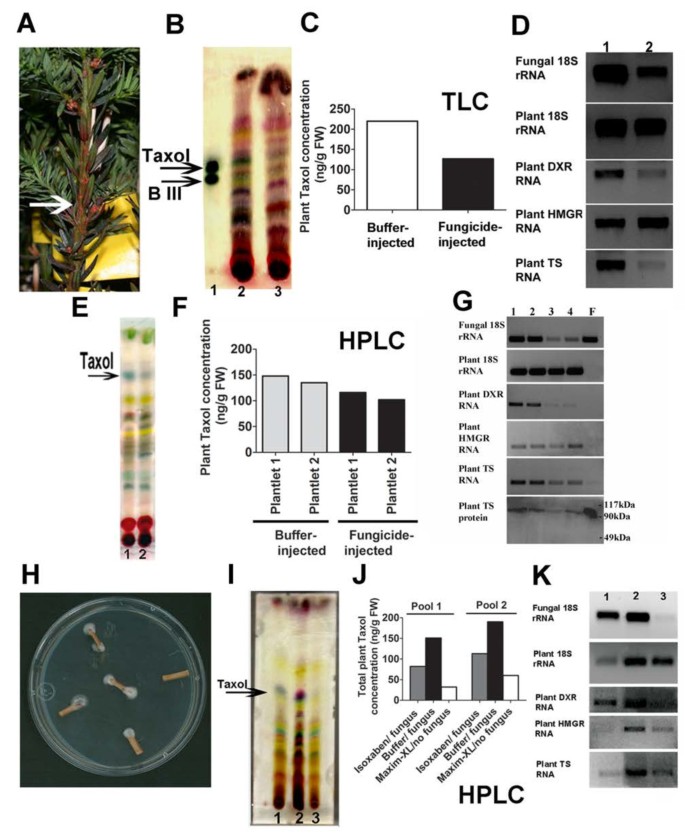
在完整的植物紫杉醇生物合成途径上表征常驻紫杉醇生产真菌的影响tax植物,我们决定用有效的杀菌剂,Maxim XL治疗植物。Maxim XL杀菌剂的疗效帕拉克西托米SSM001验证了体外:0.1μm足以完全抑制生长帕拉克西托米agar上的ssm001 [查看其他文件5.].一岁Taxus X Media.植物注射出不同浓度的杀菌剂(Maxim XL),并在三个月内重复注射(图3.一种)。实验开始五个月后,最高浓度的杀菌剂降低植物紫杉醇积累(图3.b,c)。通过降低真菌18s rRNA的表达相比,确认了杀真菌剂的特异性tax在杀菌剂处理后,植物18s rRNA显示没有变化(图3.d)。含有高杀菌剂浓度的额外的小植株,并且在基于TLC和HPLC测量的紫杉醇浓度再次显示下降(图3.e,f)。
内源真菌有助于(A-G)幼体和(H-K)成熟植株紫杉醇产量tax用诱使植物紫杉醇途径基因表达的木头。(广告)注射的效果T.X Media.plantlet与maxim杀真菌剂。(一)杀菌剂注射的小植物显示出从注射部位(箭头)的全身杀菌剂蔓延(红色)。(B.)紫杉烷谱TLC为:泳道1,标准紫杉醇和植物III(B.III);泳道2,缓冲植物;泳道3,杀菌剂注入的小植物。(C)相应的薄层色谱定量植物紫杉醇。(D)对植物萜类化和紫杉醇途径中内生真菌活性及速率限制酶表达的相应影响:泳道1,缓冲注入的小植物;泳道2,杀菌剂注入的小植物。(例如)注入两个额外的效果T.X Media.用杀菌剂和HPLC的植物饲料确认紫杉醇。(E)紫杉烷谱TLC为:泳道1,缓冲液注入植物,以及泳道2,杀菌剂注入的小植物。(F)相应的HPLC定量植物紫杉醇。(G)对植物三萜和紫杉醇途径中内生真菌活性及速率限制酶表达的相应影响:车道1和2,两个缓冲植物;车道3和4,两个杀菌剂注射的小植物;车道F, 纯的帕拉克西托米SSM001菌丝。(H-K)杀菌剂或除草剂对池塘的影响T.X Media.成熟的培养木材。对于每个生物重复的每一个,受到4-6件的处理,汇集,并按质量归一成的数据。(H)培养T.X Media.显示内生真菌生长的木材。(一世)先前用除草剂(泳道1,isoxaben,纤维素抑制剂),缓冲液(泳道2)或杀真菌剂(泳道3,maxim)处理24小时的TLC。(j)相应紫杉醇HPLC定量。(k)对细胞生真菌和植物18S rRNA表达的相应影响,植物紫杉醇途径(植物TS,右丙烯合酶)和植物萜类途径(植物DXR,非甲戊二醇盐途径;植物HMGR,Mevalonate途径)(单位表达/植物鲜重)[查看附加文件4.对于统计数据。
要独立地确认上述结果,同样的杀菌剂(Maxim XL)也适用于成熟tax木头。由于用杀菌剂处理成熟树木是不可行的,从成熟树木中提取新鲜木材(每个生物复制池4-6块)T. X Media.树(图3.H, >30年生)体外。木片暴露于杀菌剂或缓冲液24小时,培养2周,然后进行池积分析。根据薄层色谱分析,杀菌剂处理再次导致植物紫杉醇含量下降(图3.我,泳道3)并由HPLC确认(图3.j)。与植物18s rRNA相比,通过降低真菌18s rRNA的表达再次证实了杀真菌剂的高特异性(图3.k,泳道3)。然而,杀菌剂的效果可能在成熟的木材实验中人工夸张(紫杉醇下降75%,图3.J)相比于幼苗试验(下降20%,图3.f)作为为期两周的体外木质孵育允许缓冲控制中的内生真菌生长(图3.H)。
双向Anova(组织类型与治疗)统计证实,杀菌剂治疗在植物紫杉醇中引起显着下降[请参阅附加档案4.].这些数据表明了常规内生真菌与植物紫杉醇生产之间的重要关系。
内生真菌通过诱导植物紫杉醇生物合成基因的转录来影响植物紫杉醇产量
为了判断内心真菌对植物紫杉醇的贡献是否是紫杉醇直接真菌生物合成的结果或植物紫杉醇生物合成酶的表达,在幼儿植物和成熟木材中的杀菌剂治疗后,植物紫杉醇途径中的关键基因的表达.植物紫杉醇的二萜类紫茎骨架来自DXR,MEP途径中的一个关键酶[33].杀菌剂处理导致完整的植物(图)中的DXR转录量降低(图3.d,泳道2和图3.G,第3和第4巷)和成熟木材(图3.k,泳道3)。测试另一种植物酶的表达,HMGR,细胞溶质甲戊酯(MVA)途径的速率限制步骤,其有助于紫杉烷环,但仅旧tax树木[19那20.].杀菌剂处理未引起幼体中HMGR表达的明显下降(图)3.d,g),但造成旧木头的下降(图3.K.那最后,在幼苗和老苗中tax杀菌剂处理导致植物税二烯合酶(TS)的表达减少,植物紫杉醇途径中的速率限制步骤[18)(图3.D,G和图3.k,泳道3)。使用多克隆抗体在蛋白质水平上验证该结果taxTs(图3.G)。理论上,它可能是由于其与植物抗体交叉反应的降低的真菌TS,因此可能引起了一些观察到的TS蛋白的下降[见附加文件6.].但是,由于植物TER RT-PCR引物使用从未识别出纯培养物帕拉克西托米SSM001 TS(图3.G,Lane F),最简单的解释是内生真菌引发植物TS转录或成绩单积累。还应该注意的是,植物HMGR和DXR的引物未扩增真菌内体RNA(图3.g,泳道f)。六个月后,一套独立的一套tax植物注射有Maxim-XL杀菌剂或缓冲液,并显示与第一组实验相似的结果[见附加文件7.].用于量化表达的引物taxtaxadiene synthase (TS), DXR和HMGR从未使用真菌模板扩增任何真菌条带。其他几个tax从保守序列设计的植物引物(常规或简并)有时会扩增条带,但进一步测序表明,这些真菌扩增物不是真实的TS、DXR或HMGR[见附加文件]8.].
这些独立的结果是幼苗和老苗tax结果表明,植物内生真菌通过诱导限制性紫杉醇通路早期和晚期步骤的转录来促进植物紫杉醇的产量。然而,这些结果并不排除真菌对植物紫杉醇的直接生物合成贡献。
除草剂的应用表明,植物 - 内科互动对于高植物紫杉醇积累至关重要
与杀真菌剂处理平行,新鲜Taxus X Media.成熟木片(图3.H)同时用异沙苯(isoxaben)处理,这是一种针对植物而不是真菌的除草剂,因为它是一种纤维素抑制剂[34].将木片暴露于除草剂或缓冲液24小时,孵育两周,然后在分析之前汇集(每种生物重复4-6件)。虽然除草剂治疗导致植物18s rRNA,hmgr和Ts的表达更大的下降与平行杀菌剂处理(图3.K),杀菌剂处理对植物紫杉醇产量影响更大(图3.i,j)将内生真菌18s表达减少到更大程度的程度(图3.k)。因此,在这体外系统,真菌对紫杉醇产量进行了更大的贡献,而不是单独培养的木材。当植物18s rRNA和真菌18s rRNA表达都有高表明生态相互作用可能对最大紫杉醇生物合成可能是重要的最高紫杉醇产量在足底.
紫杉醇抑制其他真菌的生长,但不生产紫杉醇的内生真菌
令人惊讶的是,内生真菌SSM001能诱导植物紫杉醇的生物合成在足底,考虑到Endophyte可以自行产生相同的代谢物,至少体外[16].据报道紫杉醇有杀菌剂活性,我们假设SSM001可能刺激植物紫杉醇以抑制其真菌竞争对手在足底.菌株SSM001分离自tax木头。应用紫杉醇(高效液相色谱级,西格玛#T7402Taxus Brevifolia.)众所周知的三种不同的真菌,可感染针叶树木:Heterobasidion annosum那Phaeolus schweinitzii和Perenniporia subacida, 其中P. Schweinitzii.已知感染了tax木头 [35-37].紫杉醇抑制了所有三种木腐烂真菌的生长(图4.).然而,紫杉醇没有抑制一个增长链格孢属我们早些时候孤立的真菌tax树皮,也没有树内体(Pestalotiopsis.SSP。)或玉米的非树质病原体,镰刀菌素graminearum(数字4.).批判性地,紫杉醇也没有抑制SSM001内体的生长(图4.).这些数据表明紫杉醇作为一种杀菌剂可以对抗潜在的真菌竞争对手的内生菌SSM001可能共享其木材环境,但不对抗内生菌本身。
讨论
一些早期的报告显示悬浮文化中的紫杉醇水平[38]和完整的树木[23那24]变化达125倍,但下面的理由从未显示过。独立研究表明,生产紫杉醇的真菌内心生物细胞引出了紫杉醇的生产在体外排名细胞培养物[29]但虽然没有确定诱因的机制。在这里,我们提出了这两种现象的数据是机械手动相关的。具体来说,我们已经显示了树到树,甚至分支到分支,变化tax在这种情况下,植物紫杉醇积累与生产真菌内皮内的常驻紫杉醇的数量呈正相关,在这种情况下帕拉克西托米SSM001(图1那2).潜在机制涉及Endophyte诱导植物紫杉醇生物合成途径中速率限制基因的转录激活(图3.).
鉴于内生真菌菌株的自然环境是tax据报道,木头,紫杉醇是一种杀菌剂[39,我们假设内生菌可能刺激其宿主产生紫杉醇,以抑制真菌竞争对手也可以定植在相同的木本环境。与这一假设一致,紫杉醇抑制真菌的生长已知感染针叶树木材包括tax木头(图4.).
尽管如此,这提出了一个重要的问题,即如何刺激内心植物在内侧产生相同的次级代谢物时产生紫杉醇,至少体外[16].我们提出,这种内生菌策略可能是为了防止其竞争对手的定植,但对自身的代谢成本最小。我们最近证明了紫杉醇生物合成在这种真菌内生真菌(帕拉克西托米SSM001)消耗昂贵的萜类和苯丙素途径代谢物[16].这样的关系tax而它的真菌内生菌,其中内生菌利用其宿主,将代表一个有趣的共生现象。
这些结果提出了相反的问题:为什么tax寄主保留内生菌,它能产生自己能合成的次生代谢物?我们的结果甚至表明,一种用于识别紫杉醇生物合成中的限速步骤——紫杉醇二烯合酶(taxadiene synthase, TS)的抗体,与明显的内生真菌TS发生强烈的交叉反应(图)3.g),似乎使用阴性对照确认的结果(非紫杉醇生产镰刀菌素真菌)和阳性对照(两个真菌紫杉醇elictors)(附加档案6.).该结果表明植物与真菌内蛋白紫杉醇生物合成途径之间的共同进化关系,而不是收敛演变。一种有吸引力的可能性是,如果病原体能够成功地定植宿主,则由于所得植物组织损伤,该工厂可能无法在局部生产紫杉醇。由宿主维持产生紫杉醇的内心细胞,即使在短期内以代谢成本到本身,它可能会在不再产生紫杉醇杀菌剂的情况下对系统性感染的长期保护 - 一种时间形式共生。测试这个假设需要化学追踪紫杉醇的生物合成起源在足底在真菌病原体感染之前和之后。
其他真菌也被证明引发植物以生产基于萜类化合物在足底[30.-32].丛枝菌根真菌通过诱导1-脱氧-D-木糖糖5-磷酸合酶(DXS)和DXR,在MEP途径中的两个关键酶,通过诱导血红素植物根中的腐殖质菌累积[30.那31].Terpenoid生产中大戟属pekinensis(Rupr)植物随着内生真菌接种而增加,Phomopsis植物苯丙氨酸解氨酶(PAL)和DXR的诱导作用。最后,真菌激发子已被证明可以诱导抗疟疾萜类化合物青蒿素的生物合成Artemisia Annua.(L.)植物悬浮细胞[32].
值得注意的是,由于在SSM001和植物紫杉醇浓度之间仅观察到适度的相关性,而且由于杀菌剂处理没有专门针对SSM001,因此可能在其他真菌tax也可能引发植物紫杉醇生物合成,与紫杉醇作为杀菌剂一致。最近,我们还证明了其他真菌居住tax可以从内生真菌引发紫杉醇生产体外[17],提高复杂Elicitor相互作用对紫杉醇积累的可能性在足底.
结论
紫杉醇水平完好无损tax众所周知,树木从树到树上很大差异,但原因不明。比较五tax物种,在植物紫杉醇含量与产蛋素生真菌内皮内的数量之间观察到良好的相关性。在个人内测量不同的相邻分支tax植物,紫杉醇产量与内心体积的微尺度变化相关。杀菌剂处理完整tax植物或木材在内心浓度和植物紫杉醇积累中引起的,与相关结果一致。发现真菌内心细胞通过在植物紫杉醇生物合成途径中引发速率限制基因的转录来影响植物紫杉醇产量。紫杉醇是针对针叶树木材的真菌病原体的有效杀菌剂,产生了紫杉醇的内心的自然栖息地。内体本身抵抗紫杉醇。这些结果表明,真菌内心细胞刺激其宿主以产生杀菌剂的杀菌剂,也许是防止其竞争对手的殖民化,但在最小的代谢成本上。据我们所知,紫杉醇产生的真菌内体 -tax关系是自然界中报道的一种不寻常的植物-内生菌相互作用,在这种相互作用中,双方都从相同的次生代谢物中合成并可能受益。
方法
在附加文件中描述了一般的实验设计,试剂和材料[请参阅附加文件9.].
内生真菌的分离及基因分型
以前,从旧分支培养了紫杉醇的内生真菌Taxus X Media.在圭尔夫大学主校区和植物园种植的植物[16(加拿大圭尔夫)。真菌ITS序列与帕拉克西托米SPP [查看其他文件2],真菌被分配了名称帕拉克西托米SSM001 [16].对于分类分类分类并确保实验之间的一致性,通过PCR和DNA测序对每个真菌培养物进行基因分型,其中内部转录的间隔区(其)为18s rdna [40]确认应变身份和纯度[请参阅附加文件9.详情]。
终端限制片段长度多态性(TRFLP)
利用特异性荧光标记真菌18S引物进行扩增。引物序列为nu-SSU-0817 5 ' -TTAGCATGGAATAATRRAATAGGA-3 '和nu-SSU-1536 5 ' -ATTGCAATGCYCTATCCCCA-3 ',扩增一个762 bp的片段[41].TRFLP分离分析使用毛细管电泳ABI棱镜310DNA序列仪(PE应用生物系统,加拿大)。使用ABI Prism 310 Collection 2.0和PeakScanner分析软件(版本1.0)进行分析TRFLP数据[查看其他文件9.详情]。
紫杉醇量化
紫杉醇通过竞争性免疫分析程序进行验证和定量[42那43],TLC斑点密度测定法[44那45或通过HPLC-UV检测。其他详情已公布[16]并处于附加文件[请参阅附加文件9.].
Maxim XL杀菌剂对帕拉克西托米SSM001.
将不同浓度的Maxim XL杀菌剂(0、0.1、0.5、1.0、1.5、2.0、2.5、5.0 μM)混合在PDA平板上晾干。在每个培养皿表面分别培养一小片真菌菌丝,室温黑暗保存2周。用肉眼观察真菌菌丝生长情况。
杀菌剂对Taxus X Media.小植物
在试验实验中,将Maxim XL杀菌剂(Syngenta)的三种不同的体积(200μL/植物,500μL/植物和1毫升/植物)注射到一岁的茎中Taxus X Media.幼苗或缓冲(水)。然后利用特异性引物对真菌内生菌进行RNA提取和RT-PCR定量。与缓冲液注入的植株相比,只有1 mL的杀菌剂/植株能有效地减少包括内生真菌在内的内生真菌数量帕拉克西托米SSM001使用真菌18S量化。随后,一岁的孩子T. X Media.将植物用1ml /植物杀菌剂注射到柄茎中,只能超越外皮。小植物接受了两种分开的两剂杀菌剂。将植物在每周浇水中持续5个月。将植物在室温(25℃)下保持在24小时冷却白色荧光灯(60-80μmolm-2秒-2).对照苗和处理苗均随机排列。只对茎进行了分析。
杀菌剂和除草剂对紫杉醇产量的影响
每个生物复制,随机收集4-6块新鲜木片T. X Media.从圭尔夫校园大学获得的成熟树木,与Maxim-XL杀菌剂的15μm孵育(由25g / L氟胺,10g / l金属Xon-m),异象除草剂(n-(3-(1-乙基-1-甲基丙基)-5-异恶唑基)-2,6-二甲氧基苯甲酰胺粉末,或缓冲液(水)在25℃下在25℃下在50rpm下振荡24小时。然后将木片用水洗涤三次,然后如前所述在PDA培养基上培养2周之前灭菌2周。将四克的每种处理木材接地,50mg用于RNA提取;其余用于紫杉烷提取和紫杉醇量化。
紫杉醇杀菌剂测定
测试紫杉醇的杀菌剂,帕拉克西托米将SSM001与6种植物病原真菌和内生真菌分别放在含紫杉醇或溶剂对照的PDA平板上培养。根据文献和紫杉醇系列浓度测试(数据未显示),选择12 μM紫杉醇作为IC50。选择了以下几种真菌病原:Heterobasidion annosum那Perenniporia subacida,一个链格孢属ssp。aPestalotiopsis.ssp。Phaeolus schweinitzii和镰刀菌素graminearum.所有实验均在25℃黑暗条件下培养真菌平板,观察真菌生长一周。
rt - pcr
对于基因,3-羟基-3-甲基谷蛋白酶COA还原酶,使用引物Planthmgrf2(5'-tccctgtgggtgttgcaggc-3')和planthmgrr2(5'-aacctaacaacggcccc -3')。对于3-脱氧木糖糖-5-磷酸氧化酯酶(DXR),使用引物PlantDXRF4(5'-AggtggaAccatgactgg-3')和PlantDXRR4(5'-TgcagcatactttcTcGCC-3')。对于少税二烯合酶,使用引物Tsinf(5'-ggtttgctccaaatcaggc-3')和Tsinr(5'-taacattgtggtgccacaga-3')。对于真菌定量,使用真菌18S rRNA特异性引物:18SRDNA-RTF(5'-GGCATCAGTATTCAGTGTC-3')和18SRDNA-RTR(5'-GTTAAGACTACGACGGTATC-3')[46].tax使用Tax18SF2 (5 ' -TTTTCCCTTTGCAATGCC-3 ')和Tax18SR2 (5 ' -TCGCCCTTGTAATAACCCG-3 ')[见附加文件9.详情]。
Western blot法鉴定紫杉二烯合成酶(TS)
从液氮研磨中萃取蛋白质tax使用萃取缓冲液的干组织[47]补充有1%的甘氨酸[48]接下来是12%丙烯酰胺凝胶的SDS-PAGE [49]并转移到硝酸纤维素膜[50]随后使用多克隆抗TS抗体免疫印迹[见附加文件9.详情]。
参考
- 1.
STROBEL SA,Strobel GA:植物Endophytes作为基于探索的本科教育平台。NAT CHEM BIOL。2007,3(7):356-359。
- 2.
植物与内生真菌的关系:营养管理。全面的生物技术。编辑:Moo-Young M. Oxford: Elsevier:第二版2011。
- 3.
王志刚,王志刚:植物种子内生真菌的保护和多样性玉蜀黍属跨越进化,民族志法和生态学的界限。Plos一个。2011,6(6):1-22。
- 4.
Brosi G,McCulley R,Bush L,纳尔逊J,Classen A,Norby R:多种气候变化因子对高氟乙实 - 真菌内胚细胞共生的影响:感染频率和组织化学。新植物。2011,189(3):797-805。
- 5.
汉茹,李泽,刘B,王H,李克,叶H:植物萜类萜件代谢工程。中国j biotechnol。2007,23(4):561-569。
- 6.
罗伯茨SC:植物细胞培养中Terpenoids的生产和工程。NAT CHEM BIOL。2007,3(7):387-395。
- 7。
Banu N, Muthamary J:紫杉醇作为黄曲霉毒素的化学解毒剂曲霉菌曲藤与向日葵种子隔绝。健康。2010,2(7):789-795。
- 8。
周X,朱H,刘L,林J,唐·k:促进紫杉醇生成真菌的最新进展与未来前景。苹果microbiol biotechnol。2010,86(6):1707-1717。
- 9。
Stierle A,Strobel G,Stierle D:紫杉醇和紫杉烷生产Taxomyces andreanae,太平洋玉豆的内生真菌。科学。1993,260(5105):214-216。
- 10。
李杰,斯特罗布尔G,西德湖河,赫斯·威姆,福特ej:从秃头柏树的生成内心紫杉醇生产真菌。Tathodium distichum。微生物学。1996,142(8):2223-2226。
- 11.
N Moon-Jong, jae - kwon Y, Kyung-Soo K, Young-Mean Y, Kyoung-Ae K, Hee-Yong H, Sung-Bo S, Ho-Jin P:新型微生物的分离,Pestalotia heterocornis.,产生紫杉醇。中国生物工程学报,1998,16(5):641 - 641。
- 12.
紫杉醇内生真菌的研究进展,Pestalotiopsis.孤立的物种Taxus cuspidata..生物工程学报,2010,40(5):541-546。
- 13.
Staniek A, Woerdenbag HJ, Kayser O:Taxomyces andreanae:假设紫杉醇生产者脱脂了吗?Planta Med。2009,75(15):1561-1566。
- 14.
Strobel Ga,Hess Wm,Ford E,Sidhu Rs,Yang x:来自真菌内生物的紫杉醇和生物多样性问题。J Ind Microbiol Biotechnol。1996,17(5):417-423。
- 15.
郭立,王YC,周XW,Hu K,Tan F,Miao ZQ,Tang Kx:生成的紫杉醇生产真菌BT2Taxus chinensis.var。Mairei。AFR J BIOTECHNOL。2006,5(10):875-877。
- 16.
Soliman SSM, Tsao R, Raizada MN:化学抑制剂表明内生真菌紫杉醇来自甲戊酸和非甲戊酸样途径。中国生物医学工程学报,2011,27(12):2497-2504。
- 17。
索里曼SSM,Raizada Mn:共同居住真菌之间的相互作用,从主持人中引发紫杉醇的合成tax植物。前微生物。2013,4(3):1-14。
- 18。
紫杉醇生物合成基因。植物化学。2001,58(1):1-7。
- 19。
王永东,袁永军,陆敏,吴建春,蒋建林:南方红豆杉悬浮培养物中焦磷酸异戊酯合成抑制剂的研究。应用生物化学。2003,37(1):39-43。
- 20。
刘志,于林,李超,赵晨:福司霉素和洛伐他汀对紫杉醇悬浮培养细胞合成的影响Taxus chinensis..李武盛李玉芬z盛武薛薛宝。2005,31(2):199-204。
- 21。
Srinivasan V, Ciddi V, Bringi V, Shuler ML:代谢抑制剂,激发子和前体作为工具来探索紫杉烷生产的产量限制Taxus chinensis.细胞培养物。Biotechnol Prog。1996,12(4):457-465。
- 22。
王X,黄Y,莫特A,Zeng Y,Taeer C,Cochran K:针刺紫杉烷含量的变化Taxus X Media.具有不同生长特性的品种。Z Naturforsch C. 2006,61(9-10):619-624。
- 23.
喜马拉雅紫杉树皮中紫杉醇含量与树龄和性别的关系。植物化学。2002,60(6):627-631。
- 24.
Wheeler N,Jech K,Masters S,Brobst S,Alvarado A,Hoover A,Snader K:遗传,表观遗传和环境因素对紫杉醇内容的影响Taxus Brevifolia.和相关的物种。J Nat Prod。1992,55(4):432-440。
- 25.
Van Rozendaal Elm,Lelyveld GP,van Beek Ta:筛选不同紫杉醇和紫杉醇的品种和相关划分的品种。植物化学。2000,53(3):383-389。
- 26.
Ghassempour A,Rezadoost H,Ahmadi M,Aboul-Eniin Hy:Seasons研究四个重要的紫杉烷及10-Deacetylbaccatin III的纯化Taxus Baccata.L.通过二维液相色谱法。J LIQ Chromatogr Relat Technol。2009,32(10):1434-1447。
- 27.
Vance NC,Kelsey RG,Sabin Te:紫杉烷浓度的季节性和组织变异Taxus Brevifolia..植物化学。1994,36(5):1241-1244。
- 28.
Glowniak K,MRoczek T,Zobel A:四个丁杉的浓度的季节变化Taxus Baccata.L.在秋季春季期间。Phytomedicine。1999,6(2):135-140。
- 29。
李永春,陶文耀,程丽:紫杉醇共培养生产tax在共生物反应器中悬浮细胞和紫杉醇产生内生真菌。苹果microbiol biotechnol。2009,83(2):233-239。
- 30.
Walter M,Fester T,Strack D:丛枝菌根真菌诱导异戊二甲酸甲基甲醇磷酸盐途径与“黄色颜料”和其他偶体酸的积累相关。工厂J.2000,21(6):571-578。
- 31.
Strack D,Fester T,Hause B,Schliemann W,Walter M:丛枝菌根,生物学,化学和分子方面。J Chem Ecol。2003年,29:1955-1979。
- 32。
王继,郑L,棕褐色:从真菌内体的制备从真菌内体培养的毛发根培养中的制备Artemisia Annua.生物技术学报,2006,22(5):829-834。
- 33。
Eisenreich W,Menhard B,Hylands PJ,Zenk MH,Bacher答:紫杉醇生物合成的研究:紫杉烷碳骨架不是甲氧喹啉原产地。美国国家科学院学报。1996,93:6431-6436。
- 34。
Desprez T,Vernhettes S,Fagard M,Refregir G,Desnos T,Aletti E,Py N,Pelletier S,Hofte H:抗除草剂异氧和纤维素缺乏,由同一纤维素合酶同种型CESA6中不同突变引起的。植物理性。2002,128(2):482-490。
- 35.
伍德沃德S,Stenlid J,Karjalainen R,HüttermannA:异常的Annosum生物学,生态学。瓦莱德福德机会国际:影响与控制:1998年。
- 36.
巴雷特DK:感染生物学研究Phaeolus schweinitzii.EUR J Forest Pathol。1985,15(5-6):355-356。
- 37.
Tabata M, Suyama Y, Abe Y:遗传的分布Perenniporia subacida在立场Chamaecyparis optusa.(日本赛普拉斯)由AFLP指纹和体细胞不相容确定。植物DIS。2009,93(8):826-831。
- 38.
陈志强,陈志强,陈志强,等:紫杉醇悬浮培养基和培养物中紫杉醇稳定性和回收率的影响因素研究Taxus cuspidata.通过高效液相色谱法的CV致密型。J ChromatogR,A. 2001,911(1):55-61。
- 39.
紫杉醇及其类似物的抗真菌活性。中国生物医学工程学报,2012,31(9):1027 - 1034。
- 40。
Omar AP-V, María JY-M, Dionicio A-R, David C-T, Silvia EG-D:与真菌相关的桉树那桉树祖母山:女仆。农业古代。2005,39(3):311-318。
- 41.
Bangeman J,Hartin RJ:PCR引物从环境样品中扩增真菌RRNA基因。申请环境微生物。2000,66(10):4356-4360。
- 42.
Grothaus Pg,Raybould TJG,Bignami GS,Lazo CB,Brynes JB:用于确定紫杉醇和紫杉烷的酶免疫测定taxsp。组织和人血浆。J免疫酚方法。1993,158(1):5-15。
- 43.
在液体和固体发酵中紫杉醇生产的比较研究nigrospora.一种真菌,从Taxus Globosa..J appl microbiol。2010,109(6):2144-2150。
- 44。
Jirovetz L,Nikiforov A,Buchbauer G,Braun D:TLC /致密度 - 数据与毛细管GC-DATA的相关精油的一些主要挥发性组分的相关性。Microchim Acta。1989,99(1):1-6。
- 45。
Gangadevi V,Muthumary J:使用高性能薄层色谱法测定来自药用植物的真菌内心细胞产生的紫杉醇的简单且快速。Chin J Chromatogr。2008,26(1):50-55。
- 46。
方武,拜中奇卡MJ:参与萌发,菌生成和发病机制的基因的表达绿僵菌属anisopliae采用实时荧光定量RT-PCR。陈志强,陈志强。
- 47.
Roberts Dr,Flinn BS,Webb DT,Webster FB,Sutton BCS:脱离酸和吲哚-3-丁酸的储存蛋白在室内云杉中胚胎中的成熟和积累。physiol植物。1990,78(3):355-360。
- 48.
Konno K,Yasui H,Hirayama C,Shinbo H:Glycine防止油肺蛋白素的强蛋白质 - 变性活性,Privet叶中的酚类化合物。J Chem Ecol。1998,24(4):735-751。
- 49.
Laemmli U:在噬菌体T4头部组装过程中裂解结构蛋白。自然。1970,227(5259):680-685。
- 50。
蛋白质从聚丙烯酰胺凝胶到硝化纤维素的电泳转移:过程和应用。美国国家科学院学报。[j] .地理科学进展,2019,38(9):1279 - 1284。
确认
我们要感谢Rodney Croteau(华盛顿州立大学)为抗税前合成酶抗体的礼物。我们感谢Sean Fox(Guelph Arboretum大学)寻求收集tax样本。我们感谢Allan McFadden(陶氏农化公司,加拿大)和Francois Tardif(圭尔夫大学,加拿大)在除草剂方面提供的帮助。该研究得到了埃及政府向SSMS提供的慷慨奖学金和安大略省农业、食品和农村事务部(OMAFRA)向MNR提供的赠款的支持。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
作者声明他们没有金融竞争利益。
作者的贡献
SSMS和MNR设计了研究,分析了数据并写了纸张。SSMS执行了这项研究。RC帮助LC-MS和HPLC分析。CPT和JG有助于Western印迹分析。所有作者阅读并认可的终稿。
电子补充材料
紫杉醇含量的变异不同
附加文件1:tax悬浮培养剂适度地与其内生居民真菌的数量相关。(A-C)Taxus X Media.在不同阶段的B5CA培养基上的愈伤组织培养。(a)培养后14天;(b)后培养18天;和(c)30天后培养。(d)居民真菌数量与植物紫杉醇浓度在相同的10种不同悬浮培养瓶内之间的Pearson相关性Taxus X Media.植物细胞培养线。每种组织培养烧瓶都是针对RNA和紫杉醇进行的一次取样一次。(Doc 4 MB)
它的紫杉醇产生的内心序列
额外的文件2:帕拉克西托米SSM001。(医生1 MB)
比较qRT-PCR和TRFLP方法在定量木材、树皮和针叶内的真菌群落总数
额外的文件3:Taxus X Media.植物。(Doc 140 KB)
用于统计统计分析紫杉醇浓度与不同多样化的茎样浓度之间的相关性
附加文件4:tax物种和帕拉克西托米数量在planta。(Doc 106 KB)
Maxim XL杀菌剂的影响
附加文件5:帕拉克西托米SSM001。0.1μmMaximXL足以完全抑制生长帕拉克西托米SSM001。(医生823 KB)
来自Endophyte的蛋白质的蛋白质印迹检测
附加文件6:帕拉克西托米SSM001交叉反应于税偶氮合酶多克隆抗体。车道1,2:tax针蛋白提取物(阳性对照)。泳道3:镰刀菌素蛋白提取物(阴性对照)。4巷:SSM001液体培养的蛋白质提取物与木材腐烂真菌共培养(真菌紫杉醇激发剂)。通道5:经氯甲烷(真菌紫杉醇激发剂)处理的SSM001培养物的蛋白质提取物。第六道:蛋白提取自未经处理的SSM001培养物。每个车道上装载了等量的总蛋白质。(医生2 MB)
注入附加效应
附加文件7:Taxus X Media.血液用杀菌剂与缓冲器控制。杀菌剂对内生真菌活性的影响及植物萜类化和紫杉醇途径中速率限制酶的表达:泳道1和2,两个独立,缓冲植物;车道3和4,两个杀菌剂注射的小植物;泳道,纯净帕拉克西托米真菌菌丝。如图所示是植物DXR(1-脱氧-d -木酮糖-5-磷酸还原异构酶),非甲戊酸途径的限速步骤;植物HMGR(3-羟基-3-甲基戊二酰辅酶A还原酶)是甲戊酸途径的限速步骤,植物TS (Taxol途径的限速步骤)是植物Taxol途径的限速步骤[统计分析见补充文件4.].(Doc 824 KB)
以真菌基因组DNA或RNA为模板,结合相应的PCR引物扩增真菌条带的序列
附加文件8:tax植物税二烯合成酶,DXR和HMGR基因。扩增的谱带与真实的紫杉二烯合成酶、DXR和HMGR均无相似之处。放大乐队使用taxtaxadiene synthase, DXR和HMGR引物序列和tax使用DNA或cDNA模板作为阳性对照。(Doc 82 KB)
12870_2013_1306_moesm9_esm.doc.
附加文件9:附加方法细节,包括:实验设计、错误与重复、内生真菌的分离、真菌基因分型、末端限制性片段长度多态性(tRFLP)、紫杉醇定量、愈伤组织和悬浮培养起始方案、RT-PCR、实时定量PCR和Western blot分析鉴定紫杉醇二烯合成酶(TS)。(医生110 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Soliman,S.S.,Trobacher,C.P.,Tsao,R.等等。真菌内生菌在其宿主植物中诱导编码冗余杀真菌途径的基因转录。BMC植物杂志13,93(2013)。https://doi.org/10.1186/1471-2229-13-93
已收到:
公认:
发表:
关键词
- tax
- 帕拉克西托米
- 真菌
- Endophyte
- 紫杉醇
- 生物合成
- 杀菌剂
- DXR
- 税法合成酶