摘要
背景
花粉管的生长特征不是恒定的,但在雌蕊的不同组织中表现出不同的生长模式。柱头的生长速度慢,自养,而花柱的生长速度快,异养。关于这些不同的母体组织与穿越花粉管之间的相互作用以及这种相互作用对所观察到的代谢的作用,我们知之甚少。在这项工作中,我们描述了苹果花粉管的生长特征,并寻找两种不同的母系组织(柱头和花柱)之间糖蛋白表位定位的差异。
结果
虽然免疫细胞化学检测到的阿拉伯半乳聚糖蛋白在柱头中含量很高,但在花柱的传播组织中没有检测到它们,而在那里延伸素含量丰富。而在未授粉的雌蕊中,延长素仍处于较高水平,花粉管传代后,花柱中已不再存在延长素。同样地,在未授粉的花柱中,不溶性多糖如β-葡聚糖在授粉的雌蕊中减少。
结论
花粉管生长由自养向异养的转变与柱头和花柱之间糖蛋白表位的变化有关。花柱中花粉管传输期延伸素和多糖的减少可能对异养花粉管生长的加速有贡献,这意味着雌性组织对合子前的雄性-雌性相声有积极的贡献。
背景
在开花植物中,雄配子体的发育和功能惊人地保持得很好。花粉粒水合后,花粉管开始发育。承载生殖细胞或两个精细胞的营养细胞沿着花粉管可扩展的尖端移动,这是新壁形成的地方。在花粉管顶端不断建造新壁,使得花粉管顶端的生长朝向雌性配子体[1].然而,这一高度保守的过程与这堵墙建立速度的明显差异形成了对比。通过对多物种花粉管生长过程的比较,可以发现进化衍生的开花种子植物的花粉管生长速度比现存的非开花种子植物和早期发散被子植物要快[2,3.].
花粉管的生长是复杂和高度可变的,取决于条件。自20世纪40年代的早期工作以来,人们已经表明,在广泛的物种中,花粉管的生长速度取决于温度[4- - - - - -6].年的增长率在体外萌发介质较低在活的有机体内条件(7].此外,花粉管的生长速度也取决于周围的母体组织。花粉管在到达胚囊的过程中穿过雌蕊内的不同组织,花柱中记录的花粉管生长速度比柱头或子房快[8,9].正如观察到的不同物种,如桃子[10]或alders [11],子房的缓慢生长与等待特定结构(闭孔或胚珠)接受花粉管的过程中产生的停止和减速有关。的确,男女同步似乎是成功受精的先决条件。12].
配子体之间协调时间的要求提出了为什么花粉管以高速穿过大花柱的问题。达尔文(1886)[13],对花粉管如何迅速覆盖长花柱感到困惑,他认为花柱提供了某种支持。在20世纪70年代,花柱中的标记化合物被纳入生长中的花粉管[14],以及花粉管经过花柱时淀粉消耗殆尽的事实[15],表明花柱从自养型到异养型花粉管生长的变化与花粉管生长速度的加快有关[8,16].
花柱中心有一条由专门的分泌组织组成的通道或传输道,花粉管通过它进行尖向生长,这是雌雄分子相互作用的位置[17,18].在具有中空花柱的物种中,例如百合属植物,花柱管附近的分泌细胞发挥着至关重要的作用,为生长中的花粉管提供粘附和趋化性引导线索[19,20.].其中一些线索似乎也在具有固定风格的物种中发挥作用[21].大多数双子叶的花柱透射组织由细长细胞组成[22分泌一种果胶质的细胞外基质。在拟南芥时,子房花粉管伸长需要非蛋白质氨基酸γ-氨基丁酸(GABA) [23].在缺乏GABA的突变体中,卵巢传输组织中编码细胞壁分泌蛋白的基因表达也受到影响[24].然而,由于花粉管壁主要以碳水化合物为基础,营养关系可能依赖于单独的多糖或糖缀合物,如糖蛋白。
富羟脯氨酸糖蛋白(HPRGPs)是花柱中丰富的糖蛋白超家族,在花粉管壁中也被检测到含量丰富[25,26].在这个超家族中,阿拉伯半乳聚糖蛋白(AGPs)参与了植物生命周期中的许多发育过程[27].类型的agp已被发现烟草;特别是,传输组织特异性糖蛋白(TTS)已被证明在去糖基化梯度后吸引和刺激花粉管[28,29]并为花粉管的生长提供指导线索[30.,31].此外,延伸蛋白(ext),另一组通常与细胞伸长过程相关的HPRGPs [32,33],积极参与某些物种的前生殖阶段。在一些被子植物的生殖组织中已经发现了ext,例如茄科植物的雌蕊特异性伸展素样蛋白(PELPIII)最近被发现在种间不亲和中起作用烟草[34].PELPIII还显示agp的生化特征,并防止种间杂交[35].把所有这些信息放在一起表明花柱支持花粉管的生长[36],而花粉管壁的形成是由于雌性组织向雄性花粉管提供了大量的营养物质和信号[37,38].外源施用特定化合物可以模拟花柱的作用,以支持空心花柱突变体的花粉管生长[39].
在雄性这边,花粉管壁的扩张速度很快,在花粉管柄处主要含有去酯化果胶和胼胝质,在近端生长区域含有酯化果胶和纤维素[40].在花粉管伸长过程中,胼胝质塞将活跃的花粉管尖端与花粉管的其余部分隔离开来[41].花粉管伸长过程中可检测到伸展蛋白样蛋白[42].事实上,最具特征的延伸素是来自玉米和番茄的非经典的花粉特异性延伸素样蛋白(Pex),它已定位于花粉管的胼胝质内层[43].这些延伸蛋白包含丰富亮氨酸重复结构域(LRR),这是双子子和单子子共享的基序,并被认为参与通信[44].然而,到目前为止,“经典”延长蛋白在花粉-雌蕊相互作用中的作用仍然是难以捉摸的。
尽管TTS糖蛋白在花粉管生长中起着明显的作用,但由于母体组织对花粉管的遗传控制是难以捉摸的,因此很难将这些碎片化的信息整合在一起,除了花柱不亲和突变外,还没有报道过雌蕊突变在花柱亲和交配期间阻止花粉管生长[29,30.].作为一种替代方法,免疫细胞学可以通过识别雌蕊中的蛋白质及其授粉后的空间分布来阐明这一过程。该方法已成功应用于苹果花的柱头;两种特殊AGP表位的检测(通过JIM 8和JIM 13)与污名可受性的获得有关[45].这些AGP表位的消失与花粉管的生长有关。关于糖蛋白检测与花柱如何为花粉管壁的建立提供条件之间的关系的信息仍然缺乏。研究了苹果花柱花粉管生长速率,评价了雌蕊对花粉管壁形成的支持。众所周知,多糖[46]和s - rna酶存在于苹果的传质组织细胞中[47].我们的结果说明了在柱头和花柱的细胞间隙中糖蛋白表位的定位差异。虽然β-葡聚糖和伸展素在未授粉的雌蕊中含量丰富,但随着花粉管的通过,它们的丰度下降,在花柱中无法检测到。
结果
花粉管生长速率和传播组织特征
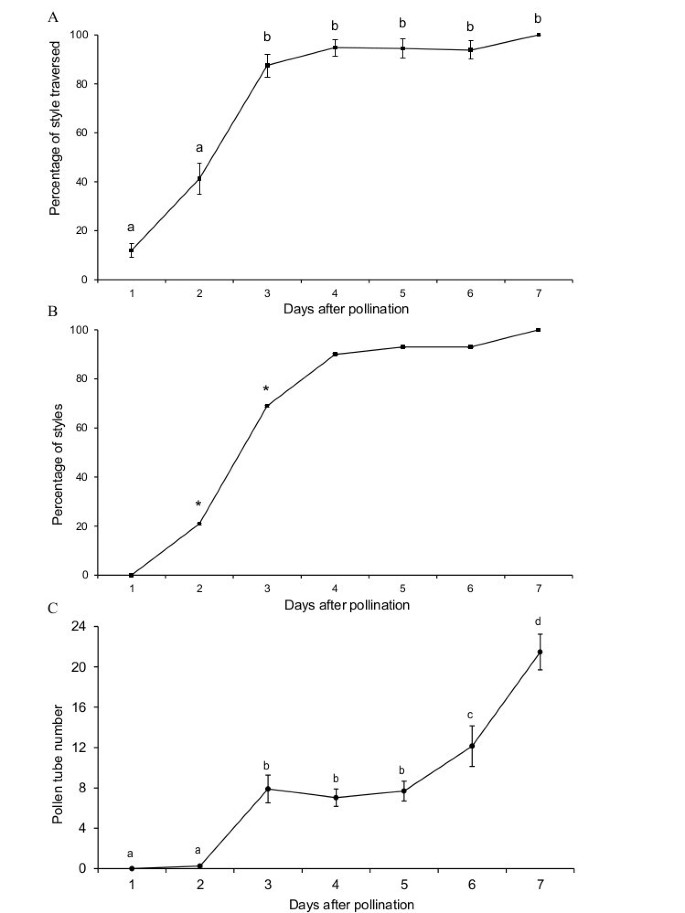
苹果的五掌形雌蕊有五种不同的风格。苹果和其他果树科植物一样,花柱的基部和子房被包裹在一个组织中,即托杯,成熟时构成果实的可食用部分(图1).在柱头表面,花粉粒在授粉后2h萌发,并沿柱头表面生长。授粉后10h,花粉管穿透缝线区域的传粉组织,从柱头边缘到缝线的距离约为700 μm。结果表明,花粉管生长速率为87 μm? ?h-1[700 μm/(10 h-2 h)]。一旦进入花柱,最长的花粉管在授粉两天后移动了花柱长度的50%,在授粉三天后移动了花柱长度的90%(图)2A).花柱中,花粉管在62小时内(柱头生长72小时- 10小时)生长了11毫米,大约等于177 μm? ?h-1.花粉管生长在花柱之间有所不同,20%的花柱在授粉后2天到达托杯入口,70%的花柱在授粉后3天到达托杯入口(图)2B).此时平均每个花柱有8个花粉管到达托杯入口(图2C).这个数量一直维持到授粉后的第五天,不知什么原因,第二波花粉管到达。授粉7 d后,托杯入口平均有20个花粉管。
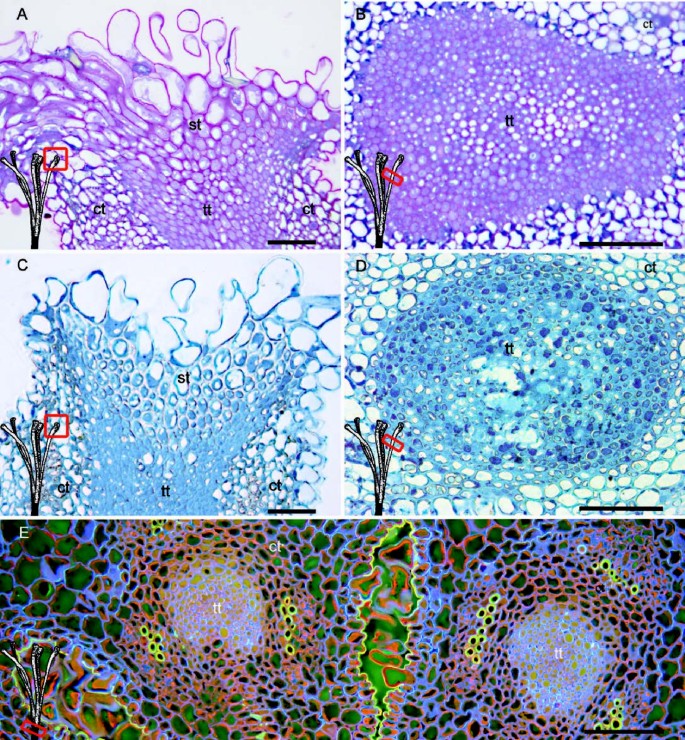
在花期,柱头组织和上部花柱传递组织的细胞间隙中淀粉颗粒的缺失与不溶性多糖的存在形成对比(图3.然而,用萘酚蓝黑对蛋白质进行染色,在柱头样组织的细胞间隙中没有反应(图3.C)与传输组织细胞内和细胞间的强蛋白染色(图3.D).由于观察到生长花粉管的数量减少,并且柱头上只有8%的萌发花粉粒到达花柱基部,我们寻找花柱基部传播组织所占面积可能减少的原因。上部结构的透射组织截面积为14.900 μm2,在样式的底部(图3.E)减小到2.500 μm2,减少了6倍。
多糖的风格
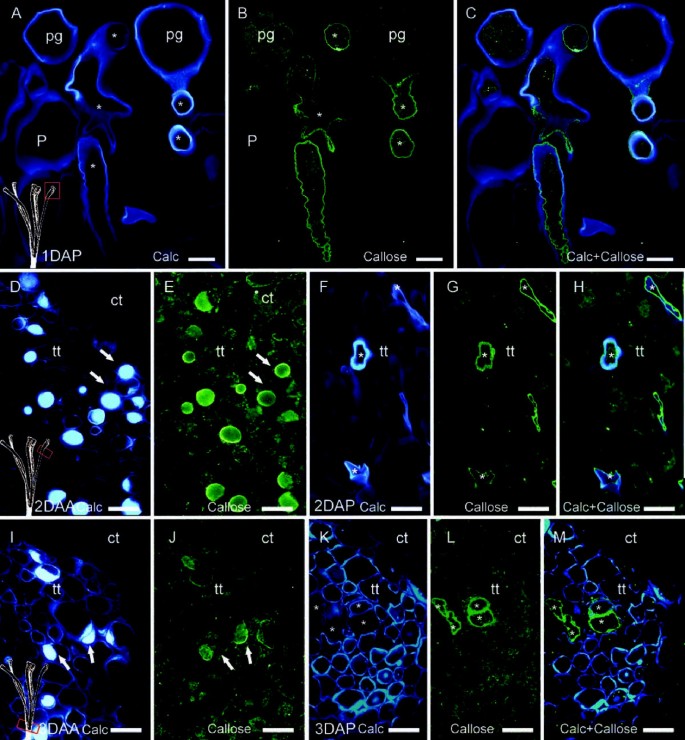
由于花粉管壁由果胶、纤维素和胼胝质组成[40],未授粉和授粉的花柱用钙氟白色染色,以显示纤维素和其他多糖[48],并对胼胝体的主干线性β-(1-3)葡聚糖进行免疫标记[49].授粉后,柱头上的乳突细胞壁被纤维素染色,但没有胼胝质(图4A, B).萌发的花粉粒则表现为胼胝质定位于花粉管壁(图4C)。
未授粉和授粉雌蕊的钙荧光染色和胼胝质内定位马吕斯x有明显柱头(A-C),花柱中部(D-H)和花柱基部(I-M)。(一)授粉后1天(1DAP),纤维素染色花粉粒内壁、花粉管壁和柱头样组织细胞壁。(B)同一段沿花粉管壁内壁免疫定位线性β-(1,3)-葡聚糖(胼胝质),(C)纤维素和胼胝质的图像重叠。(D)在未授粉的雌蕊花后2天(2DAA)的花柱传递组织细胞中检测到纤维素和其他多糖(箭头)。(E)未授粉雌蕊(2DAA)胼胝质免疫定位(荧光绿箭头)。(F)传粉后2天(2DAP)传播组织中的花粉管(星号)。(G)胼胝质细胞免疫定位于花粉管壁,而不定位于授粉雌蕊的传粉组织细胞。(H)授粉后2天花粉管壁胼胝质和纤维素重叠图。(我)在未授粉的雌蕊中,花柱传输组织(箭头)基部的纤维素和其他多糖在开花后3天积累(3DAA)。(J)在未授粉的雌蕊中,胼胝质与纤维素共定位(箭头)。(K)传粉3天后(3DAP),在授粉雌蕊中不再检测到纤维素和其他多糖,(左)花粉管壁在横切面上标明胼胝质(星号)。(M)灰白色和胼胝体在柱基的重叠图像。Calcofluor染色(a d f i k),线性β-(1-3)-葡聚糖免疫定位,荧光绿色为FITC二级Ab标记(b, e, g, j, l),和合并图像callose-calcofluor(c, h, m)纵向4μm(两者),和截线(D-M)上部剖面图(两者)、中(d - h),和更低(我)风格。星号表示花粉管。Ct,皮质组织;P,乳头状突起;Pg,花粉粒;Tt,花柱传输组织。比例尺:10 μm。
在花柱中,未授粉的花朵中纤维素和其他多糖呈阳性,这些多糖在传输组织细胞中以向心的方式从边缘积聚到中心(图4D)。此外,免疫定位显示这些糖堆积周围有胼胝质层(图4E).然而,在传粉花柱中,胼胝质只在花粉管壁中检测到(图4F, G),而不是在传输组织细胞(图4H)。在开花后3天,未授粉花柱的碳水化合物按照基瓣的方式积累,并出现在花柱的基部(图4I, J).在传粉花柱中,纤维素(图4K)和胼胝质(图4L)在花粉管壁中存在,但在传播组织细胞中未检测到(图4K L M)。
不同的糖蛋白表位
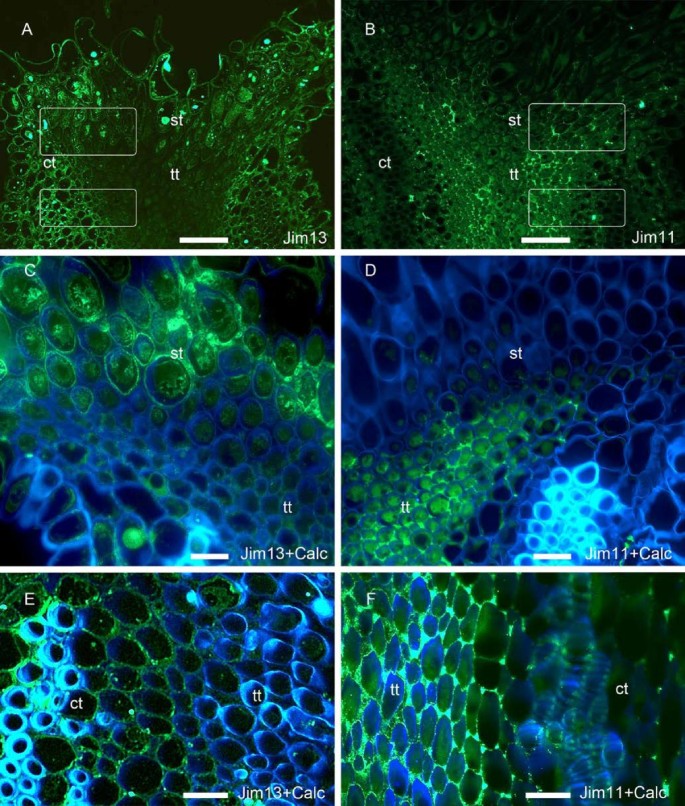
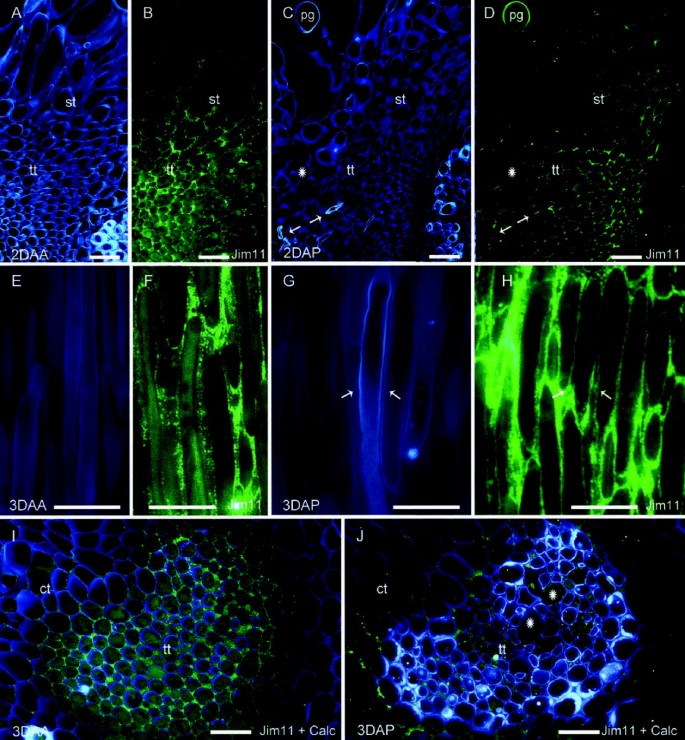
在开花时,在皮质组织和柱头样组织中观察到用JIM13 mAb检测到的阿拉伯半乳聚糖蛋白(图5A及[45])。然而,它们在花柱的传导组织中缺乏(图5A)。相比之下,JIM11单抗识别的延伸素表位在柱头样组织中缺乏,但在花柱传输组织的细胞外间隙中明显检测到(图11所示)5B)。近距离观察柱头显示,JIM13单抗识别的agp填充了柱头样组织的细胞间隙(图5C), JIM11 mAb识别的延伸素填充了花柱的邻近组织,即传输组织的细胞间隙(图5D)。这在花柱上得到了进一步的证实,而在皮质组织的细胞壁中检测到AGP表位(图5E),不在花柱传导组织中。另一方面,与更接近柱头的观察结果一致,传输组织的细胞间基质显示了大量的延伸素表位(图5F)。
柱头和花柱传递组织中的糖蛋白马吕斯x有,在开花.(一)用JIM13单抗标记的阿拉伯半乳聚糖蛋白存在于皮层和柱头样组织中,但在花柱传递组织中不存在。(B)与此相反,延伸素表位在花柱的传导组织中显著。(C)当柱头样组织细胞间隙对被JIM13单抗识别的阿拉伯半乳聚糖表位的存在发生阳性反应时,(D)相邻传输组织的细胞间隙以延伸蛋白的存在为标志。(E)上部类型在传输组织中进一步缺乏JIM13阿拉伯半乳聚糖表位。(F)与此相反,花柱传输组织的细胞间隙中含有延伸素。柱头型转变纵向4μm断面(模拟),以及款式(E-F),用JIM13 mAb标记阿拉伯半乳聚糖蛋白(A, C, E)或JIM11 mAb扩展蛋白(B, D, F).FITC标签(绿色)与钙氟白色(蓝色)的合并图像(氟).白色方块表示被放大的位置C、E而且D, F图片分别在每一栏。Ct,皮质组织;St,柱头样组织;Tt,花柱传输组织。a - b比例尺:50 μm;氟比例尺:10 μm。
由于其位于花粉管伸长的位置,通过比较授粉和未授粉的花柱,评估了延伸素在花粉管生长中的可能作用。在未授粉的花中,传粉组织上部的细胞间隙(图6A)对扩展素表位反应强烈,并在开花后积累到较高水平(图6B).在授粉的花中,在细胞间隙观察到花粉管(图6C);在传粉组织中检测到延伸素表位,然而,与未授粉的花相比,延伸素的积累水平要低得多(图6D).花柱中间,花后三天纤维壁(图6E)划入传输组织致密的细胞质大细胞,扩展素明显填满细胞间隙(图6F).在传粉的花中,花粉管沿着花柱传粉组织的细胞间区域伸长(图6G),观察到花粉管壁与富含伸展素的细胞外基质之间不断接触(图6H)。在花柱基部也可以看到类似的模式,未授粉雌蕊传粉组织的胞外基质中明显存在extensin表位(图6有趣的是,在授粉的花朵中,延伸素表位的检测水平要低得多,特别是在靠近花粉管传代的区域(图6J)。
雌蕊中的延伸素马吕斯x有,未授粉(A,B,E,F,I)和授粉(C,D,G,H,J)的花;柱头(A-D)、花柱中部(E-H)和花柱基部(I-J)。(一)传送组织的细胞壁被纤维素染色,以及(B)开花后2天(2DAA),在花柱上部传导组织中,细胞间隙进行了扩展素表位(荧光绿色)免疫定位。(C)传粉后2天(2DAP),传粉组织染色细胞壁和花粉管(箭头)。(D)扩展素表位降低了细胞外空间的可检测性,特别是在花粉管穿过的区域(星型)。(E)开花后三天未授粉的传粉组织的细胞。(F)同一切片显示JIM11单抗在致密细胞质拉长细胞的胞外结构域识别了扩展素表位。(G)传粉三天后穿过传粉组织细胞外基质的花粉管(箭头)。(H)在细胞外基质中免疫定位JIM11扩展素表位的同一部分显示与花粉管壁有明显接触。(我)钙氟和JIM11扩展素表位的重叠图像延长素在花柱基部的细胞间隙中填满(3DAA)。(G)花柱基部的同一区域,在花粉管传代后,无延伸蛋白(星号)。风格4 μm纵向(a)或横向(i j)用氟钙白色染色的切片(a, c, e, g),免疫定位的扩展素表位显示荧光绿色FITC标记(b, d, f, h),并合并钙氟白蛋白和FITC信号的图像(i j).Ct,皮质组织;Pg,花粉粒;St,柱头样组织;Tt,传输组织。(模拟)比例尺:50μm;(E-J)比例尺:10 μm。
结果表明,β-葡聚糖多糖和扩展素沿花柱传代组织呈向心和基瓣方向发育积累,但在花粉管传代过程中已无法检测到这些化合物。
讨论
结果表明,花柱传递组织中的延伸素和多糖有助于苹果花柱花粉管的生长。虽然它们以未授粉的花柱积累,但它们在授粉的花柱中不再被检测到。这些延伸素和多糖只出现在花柱中,而不在柱头中,这强烈地表明它们有助于花柱中花粉管的生长。
花粉管生长由自养向异养的变化
在不同花柱类型的大范围物种的报告中,已经为传输道的营养作用提供了证据,在传输道中淀粉的消耗与花粉管的伸长是一致的[9,16,50- - - - - -53].这项工作中描述的免疫细胞学定位为这一想法提供了进一步的支持。而在苹果传粉组织中未检测到淀粉,多糖在未授粉花柱的细胞外基质中积累。通过PAS染色检测一般不溶性多糖,钙荧光检测纤维素和果胶,以及通过免疫定位线性β-(1,3)-葡聚糖片段(胼胝质主干)来确定多糖的组成和存在。
不同被子植物花粉管柄内壁多次检测到胼胝质[16,38,54].有人认为它的功能与具有一定渗透性的抗压能力有关[55].这些功能能力也得到花粉管壁的果胶-纤维素成分的支持[44,56].在花粉管可伸长的尖端,胞吐新创物质似乎是花粉管伸长的主要贡献者,但也需要内吞作用来回收和调节壁物质,如膜蛋白[57].尽管胼胝质主要是由花粉管的内部机制产生的,但花粉管中这种令人难以置信的高含量多糖也可能是由雌蕊组织的前体摄入造成的。然而,关于建立花粉管壁所需的胼胝质和纤维素来源的证据很少[44].柱头细胞缺乏胼胝质,萌发花粉粒富含β-葡聚糖,花粉萌发后生长花粉管壁内侧有较强的定位信号。然而,在未授粉的花柱中,这些多糖和其他多糖积聚在传粉道中,它们在授粉的雌蕊中不再被检测到。在未授粉的花柱中,胼胝质的积累可能在防御中发挥作用,但在授粉的雌蕊中,这些β-葡聚糖的消失强烈地表明,在花柱中,母体对花粉管生长的支持作用[8,16,17].
花柱控制花粉管生长的策略
花柱传递组织面积减少,β-葡聚糖和延伸素减少,导致花粉管伸长,提示花柱可能在花粉管竞争中发挥作用。花粉管穿过的花柱面积的减少已被报道在既有固体[58,59],以及镂空样式[53].花柱漏斗状结构的物理约束是花柱花粉管竞争和选择的主要因素之一,从而产生更高质量的后代。37,60- - - - - -62].这项工作的结果支持这一模型,即积累储备面积的减少限制了可用资源,导致只有一小部分花粉管到达花柱的底部。然而,尚不清楚到达花柱基部的第一批花粉管是否更成功地实现受精[63].苹果花粉管不是一次到达,而是分两波到达花柱基部,首先在花柱内进行选择,然后在子房部位进行第二次选择。这里的所有数据表明,父系和母系之间的相互作用对植物的性冲突具有微妙的影响[64],因此孢子体对雄性配子体的雌性选择可能受到母体传输体组织(花粉管通路)中糖蛋白的特定空间排列的影响。
不同的雌蕊区域有不同的糖蛋白表位
虽然结果表明花柱可能有利于花粉管竞争,但问题仍然是为什么柱头的花粉管生长速度比花柱的慢。这可能与花粉管途径的不同区域存在不同的糖蛋白表位有关。在苹果雌蕊内,阿拉伯半乳聚糖蛋白在柱头状组织中含量丰富,而在花柱传递组织中含量较低。值得注意的是,使用抗体在柱头中检测不到延伸素,但在花柱传输组织的细胞间隙中大量存在。鉴于柱头和花柱是相邻的组织,这种特化的糖蛋白分布令人惊讶。据报道,在茄科雌蕊中,伸展素样蛋白(PELPIII)通过最初定位于花柱传输道,然后重新定位到生长花粉管的胼胝质层,在种间不亲和中发挥作用[33- - - - - -35].阿拉伯半乳聚糖蛋白也定位于不同被子植物物种的传输组织,从早期发散被子植物[65到诸如烟草,其中糖基化梯度与花粉管营养有关[28- - - - - -31].此外,在草的柱头和花柱中,细胞外基质中的扩张素与花粉管穿透的细胞间隙松弛有关[66- - - - - -69].柱头型转变也以花粉管生长速度加快为标志。这种生长速度的增加之前在其他物种中也有报道,包括佩妮[15],桃子[9]、猕猴桃[50]、杏[70].花柱中的花粉管生长也比子房中的花粉管生长快[11,71],而这些差异与卵巢结构成熟的要求有关。花柱中花粉管生长速度的加速可能是由于花粉管本身的发育事件,如第一个胼胝质塞的沉积,有丝分裂II的完成,或由内部程序转向异养生长。结果表明,在柱头和花柱中观察到的糖蛋白组成的不同也可能起作用。
我们的研究结果表明,延伸蛋白在苹果花柱传输道中也有作用。它们在花粉管通过后无法检测,这为花柱中异养花粉管生长提供了额外的证据。延伸蛋白是新植物细胞壁的重要构建者[72],与花蕊花粉管沿雌蕊生长的密切关系表明,伸展素在花粉管壁的形成和花柱生长速度的加快中起着重要作用。延伸蛋白已被证明在生长细胞的抗拉强度中发挥生化作用[73].然而,鉴于某些扩展蛋白中存在富亮氨酸重复序列(LRR)结构域[34],不能排除其作为识别信号分子的作用。在最具特征的基因中,玉米和番茄花粉管中的LRR嵌合体扩展素(Pex)被认为在花粉型相互作用中发挥作用[37,38,73].这项研究表明,在苹果花中,花粉管的生长是由不同的雌蕊组织调节的。进一步的工作将阐明这是否在其他被子植物中也是一种保守的模式。
结论
综上所述,这些结果有力地表明,精确的糖蛋白分布在不同的雌蕊组织中是调节花粉-雌蕊相互作用的重要因素。从柱头的自养型花粉管生长到花柱的异养型花粉管生长,花粉管的生长速度加快了两倍。这伴随着延伸素和β-葡聚糖的存在,它们以花柱基部的方式积累,而不是在柱头上。虽然这些资源存在于未授粉的花朵中,但当花粉管经过时,它们在授粉的花朵中不再被检测到,这表明它们有助于花粉管快速形成壁。到达花柱基部的花粉管数量的减少伴随着花柱基部面积和可利用资源的减少,这强烈地表明这种减少有利于花粉管竞争。这一观察结果为理解种特异性花粉-雌蕊相互作用以及这些相互作用在物种形成前合子机制中的可能作用打开了一扇门。
方法
植物材料
本研究以生长在海拔461米的西班牙韦斯卡省(Huesca)的金香刺(Golden Delicious Spur)苹果树花为材料。为评估花柱花粉管延伸情况,在球囊期对120朵花进行去势处理,静置24 h直至人工授粉[74].
由于苹果是自交不亲和的,所以从成熟的花药中采集花药,在20℃左右的室温下纸上晾干24-48小时,直至开裂。花粉用直径孔径为0.26 mm的筛网筛分,-20ºC保存至所需。其中一半花(60朵)没有授粉,另一半花(60朵)用油漆刷人工授粉。
花柱上花粉管生长速率的评价
为了监测柱头和花柱的花粉管生长速度,在人工授粉后,每隔2小时至12小时采集5朵花(30朵雌蕊),然后每天采样同样数量的花,并在FAA(福尔马林:乙酸:70%乙醇)中固定(1:1:18)[75授粉后七天。固定后,将雌蕊在蒸馏水中洗涤三次,每次洗涤1小时,并在5%亚硫酸钠中放置24小时。样品在1kg cm的高压下蒸压10分钟-2在5%亚硫酸钠中,然后将不同的样品压在0.1NK、0.1%苯胺蓝的玻片上3.阿宝4使胼胝形象化[76,77]和花粉管[41].用带有340/400 nm滤光片的LEICA DM2500荧光显微镜观察花粉管,并在托杯入口计数花粉管数量。在授粉后不同时间固定的雌蕊中,记录花粉管位于花柱基部的花柱百分比,并采用卡方均匀性检验对授粉后的花柱比例进行比较P0.05≤?。采用单因素方差分析(ANOVA)对花柱穿越率和花粉管基部平均数进行均值比较,并在a处采用Duncan多极差检验(multiple range test)将显著的独立组分开P0.05≤?。采用SPSS软件(SPSS Inc.,芝加哥,美国)进行统计分析。
组织化学制剂
根据花粉管动力学结果,分别在花期、授粉后2天、3天选择花进行组织化学检查。每天两支花(10支)固定在2.5%戊二醛的0.03M pH7.3盐水磷酸盐缓冲液中4小时[78].然后将雌蕊在0.03M盐磷酸盐缓冲液中洗涤,依次在乙醇系列(30%、50%、70%和96%)中脱水,在每种乙醇浓度中放置1小时。将雌蕊在4ºC的包埋液中放置5天,然后用JB4塑料树脂(Polysciences Inc., 0226A)包埋。用玻璃刀在LEICA EM UC6超微仪上切出厚度为2μm的纵断面和横断面,然后放在涂有1%明胶的载玻片上的蒸馏水上。用周期性酸移试剂- pas对多糖进行染色[79]一般结构用0.02%甲苯胺蓝反染,蛋白质用0.25%萘酚蓝黑在1%乙酸中反染[80].0.07%钙氟白用于纤维素[48]和其他多糖[52], 0.01%金胺在0.05M磷酸缓冲液中用于角质层和脂质[81], 0.03%磷酸盐缓冲液中的0.01%吖啶橙,pH7.4 [82],观察花柱形态。
载玻片在携带100W光源的亮场LEICA DM2500显微镜下观察,并使用连接徕卡应用套件软件的徕卡DFC320相机拍摄。荧光观察是用同样的显微镜进行的,显微镜配有荧光源,并连接到CANON Power Shot S50相机,该相机与CANON Remote Capture软件相连。滤光片用于钙氟白的滤光片为355/455 nm,用于金胺和吖啶橙的滤光片为450/510 nm。
胼胝质、agp和扩展素的免疫定位
从开花开始,每天两朵花,授粉后2天和3天,固定在1x磷酸盐盐缓冲液(PBS) pH7.3中多聚甲醛新鲜制备的4%甲醛中,放置在4ºC过夜,然后保存在0.1%甲醛溶液中[83].然后将雌蕊在丙酮系列(30%,50%,70%,90%,100%)中脱水,并嵌入Technovit 8100 (Kulzer and Co, Germany) 2天。树脂在4ºC下聚合,并以4 μm厚度进行切片。将切片放入一滴水中,并在载玻片上覆盖2%(3-氨基丙基)三乙氧基硅烷- APTEX (Sigma-Aldrich),并在室温下干燥。胼胝质用抗近体抗体(AntiCal)鉴定,该抗体识别线性β-(1,3)-葡聚糖片段(抗-β-(1,3)-葡聚糖;免疫球蛋白G1),生物供应公司,澳大利亚[49].使用Alexa 488异硫氰酸荧光素(FITC)偶联抗小鼠IgG作为二抗(F-1763;σ)。此外,单克隆抗体JIM13 [84]抗AGPs糖基表位的单克隆抗体JIM11 [85本文从Carbosource Services (University Georgia, USA)获得。二抗为抗大鼠IgG,与上述相同的Alexa 488结合。切片在pH7.3 PBS中孵育5min,然后在PBS中加入5%牛血清白蛋白(BSA)孵育5min。然后用AntiCal primary mAb、JIM13和JIM11在室温下孵育1h。之后,在PBS中洗涤三次,每次5分钟,然后用1/25稀释的次级异硫氰酸荧光素(FITC)与抗体在1% BSA PBS中结合,在黑暗中孵育45分钟,然后在PBS中洗涤三次[83].切片用氟钙白反染纤维素[86],安装在PBS或Mowiol中,并在连接到LEICA DFC320相机的LEICA DM2500荧光显微镜下进行检查。calcofluorewhite的过滤器为355/455 nm, Alexa 488荧光素标记的抗体的过滤器为470/525 nm (white Level?=?255;黑色等级= 0;ϒ? = 1)。每种抗体的暴露(Exp)时间调整为重叠照片的最佳妥协:antic, Exp = 15.30ms (Calcofluor Exp = 1.20ms);JIM13 Exp. = 2.52ms (Calcofluor?= 0.41ms);JIM11, Exp. = 31.59 ms (Calcofluor Exp. = 1.40ms)。亮度和对比度调整,以获得最清晰的图像与徕卡应用程序套件软件。
缩写
- 经验值:
-
曝光时间
- GABA:
-
γ-aminobutiric酸
- HPRGs:
-
Hydroxyproline-rich糖蛋白
- agp:
-
Arabinogalactan-proteins
- AntiCal:
-
抗-β-(1,3)-葡聚糖单克隆抗体
- TTS:
-
传递组织特有的糖蛋白烟草
- ext:
-
伸展蛋白
- PELPIII:
-
茄科雌蕊特异性延伸蛋白样蛋白
- Pex:
-
花粉特异性延伸蛋白样蛋白
- 远程雷达:
-
富含亮氨酸重复结构域
- 联邦航空总局:
-
福尔马林-醋酸-酒精
- PBS:
-
磷酸盐缓冲盐水
- 马伯:
-
单克隆抗体
- FITC:
-
异硫氰酸荧光素。
参考文献
- 1.
花粉萌发与花粉管生长。中国生物医学工程学报,1997,27(3):344 - 344。
- 2.
Williams JH:花粉管生长速率与开花植物繁殖周期的多样化。中国植物学报,2012,29(2):344 - 344。10.1086/665822。
- 3.
Williams JH:开花植物花粉萌发时间的演化:Austrobaileya飞(Austrobaileyaceae)。AoB植物,2012,http://aobpla.oxfordjournals.org/doi10.1093 / aobpla / pls010
- 4.
Lewis D:植物不亲和的生理学。一、温度的影响。中华微生物学杂志,2004,27(3):326 - 326。
- 5.
赫德利,吉荷玛扎,赫雷罗:全球变暖与植物有性繁殖。植物科学进展,2009,14:30-36。10.1016 / j.tplants.2008.11.001。
- 6.
开花植物配子体对温度波动的敏感性。环境科学学报,2011,44(3):344 - 344。
- 7.
蔡k, Lord EM:花粉管生长和引导:小的,分泌蛋白的作用。学报学报,2011,38(3):344 - 344。10.1093 / aob / mcr015。
- 8.
黄志刚,李志刚:花粉管发育佩妮矮牵牛种内配种兼容和不兼容。中国生物医学工程学报,2001,27(3):344 - 344。
- 9.
黄志刚,李志刚,李志刚:桃花粉管发育过程中雌蕊对花粉管动力学的影响(碧桃).学报学报,1998,26(3):344 - 344。10.2307 / 2444430。
- 10.
Herrero M:卵巢与花粉管引导有关的变化。学报学报,2000,44(3):344 - 344。
- 11.
Sogo A, Tobe H:桤木雌蕊花粉管的间歇性生长(赤杨皮).美国国家科学研究院。2005, 32(4): 457 - 457。10.1073 / pnas.0503081102。
- 12.
开花植物的雄性和雌性同步和交配的调节。中国生物医学工程学报,2003,27(3):319 - 324。10.1098 / rstb.2003.1285。
- 13.
达尔文C:在同一种植物上开不同形式的花。第二版。默里·j·伦敦编辑;1884.
- 14.
花粉管壁形成过程中雌蕊渗出液的营养作用百合longiflorum2柱头和花柱管分泌物的产生和利用。植物科学学报,2003,27(4):457 - 457。10.1104 / pp.52.2.87。
- 15.
李志强,李志强,李志强:花粉-雌蕊不亲和佩妮矮牵牛:种内亲和和不亲和杂交后雌蕊的变化。中国生物医学工程学报,1997,36(3):344 - 344。
- 16.
Stephenson AG, Travers SE, Mena-Ali JI, Winsor JA:花粉管生长自养-异养转变前和过程中的花粉性能。中国生物医学工程学报,2003,29(3):344 - 344。10.1098 / rstb.2003.1290。
- 17.
查普曼LA,戈林DR:花粉-雌蕊相互作用调节芸苔科成功受精。中华物理学报,2010,29(3):344 - 344。10.1093 / jxb / erq021。
- 18.
Chae K, Kieslich CA, Morikis D, Kim SC, Lord EM:一种功能获得性突变拟南芥脂质转移蛋白5干扰花粉管尖的生长和受精。植物学报,2009,21:3902-3914。10.1105 / tpc.109.070854。
- 19.
金st,张凯,董娟,Lord EM:外源游离泛素增强了百合花粉管对离体花柱基质的粘附,可能促进了花粉管的内食作用。中国生物医学工程学报,2006,29(4):344 - 344。10.1104 / pp.106.086801。
- 20.
Chae K, Gonong BJ, Kim SC, Kieslich CA, Morikis D, Balasubramanian S, Lord EM:柱头/花柱富半胱氨酸粘连素(SCA)样的多面研究拟南芥脂质转移蛋白(LTPs)在植物生长和繁殖中具有多种作用。应用物理学报,2010,29(4):497 - 497。10.1093 / jxb / erq228。
- 21.
诺克斯RB:花粉-雌蕊相互作用。植物生理学百科全书。卷17。Linskens HF编辑,Heslop-Harrison J. Berlin:施普林格;1984.
- 22.
Crawford BCW, Yanofsky MF:开花植物中雌性生殖道的形成和功能。中国生物工程学报,2008,18:R972-R978。10.1016 / j.cub.2008.08.010。
- 23.
Palanivelu R, Brass L, Edlund AF, Preuss D:花粉管的生长和引导受POP2,一个拟南芥控制GABA水平的基因。细胞学报,2003,14:47-59。10.1016 / s0092 - 8674(03) 00479 - 3。
- 24.
Renault H, El Amrani A, Palanivelu R, Updegraff EP, Yu A, Renou JP, Preuss D, Bouchereau A, Deleu C: GABA的积累导致细胞伸长缺陷,编码分泌蛋白和细胞壁相关蛋白的基因表达减少拟南芥.中国生物医学工程学报,2011,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcr041。
- 25.
Estévez JM, Kieliszewski MJ, Khitrov N, Somerville C:含阿拉伯半乳聚糖蛋白和延伸蛋白基序的合成富羟脯氨酸蛋白多糖的表征拟南芥.植物科学学报,2006,29(4):344 - 344。10.1104 / pp.106.084244。
- 26.
肖华,李海峰,李海峰,陈晓明,陈晓明:基于生物信息学的富羟脯氨酸糖蛋白的鉴定、分类和分析。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.110.156554。
- 27.
Seifert GJ, Roberts K:阿拉伯半乳聚糖蛋白的生物学。植物学报,2007,28(3):357 - 357。10.1146 / annurev.arplant.58.032806.103801。
- 28.
张AY,王辉,吴红梅:一种花传输性组织特异性糖蛋白吸引花粉管并刺激花粉管生长。细胞,1995,82:383-393。10.1016 / 0092 - 8674(95) 90427 - 1。
- 29.
吴红梅,王辉,张AY:花粉管促生长糖蛋白被花粉管去糖基化,在花中呈现糖基化梯度。细胞科学,1995,32(3):395-403。10.1016 / 0092 - 8674 (95) 90428 - x。
- 30.
吴敏敏,王娥,Ogdahi J,张AY:一种促进花粉管生长的阿拉伯半乳聚糖蛋白烟草alata与烟草中的TTS蛋白相似。植物学报,2000,26(3):344 - 344。10.1046 / j.1365 - 313 x.2000.00731.x。
- 31.
Wu H, de Graaf B, Mariani C,张AY:植物生殖组织中富羟脯氨酸糖蛋白的结构、功能与调控。中国生物医学工程学报,2001,29(4):344 - 344。10.1007 / PL00000785。
- 32.
植物细胞壁糖蛋白延伸蛋白的羟基脯氨酸- o -糖苷连锁。《自然》,1997,26(3):344 - 344。10.1038 / 2161322 a0。
- 33.
de Graaf BHJ, Knuiman BA, Derksen J, Mariani C: PELP III传输组织特异性蛋白的鉴定和定位烟草.应用物理学报,2003,44(3):344 - 344。10.1093 / jxb / erg002。
- 34.
de Graaf BHJ, Knuiman BA, van der Weerden GM, Feron R, Derksen J, Mariani C:茄科植物PELP III糖蛋白在花粉管壁的表达和转移。植物生殖学报,2004,16(4):344 - 344。10.1007 / s00497 - 003 - 0196 - 2。
- 35.
Eberle C, Anderson NO, Clasen BM, Hegeman AD, Smith AG: PELPIII: III类烟草雌蕊特异性延伸样蛋白对种间不亲和至关重要。植物学报,2013,29(4):344 - 344。10.1111 / tpj.12163。
- 36.
赫雷罗,吉荷玛扎:控制花粉管生长的雌蕊策略。植物生殖学报,1996,9:343-347。10.1007 / BF02441953。
- 37.
Sánchez AM, Bosch M, Bots M, Nieuwland J, Feron R, Mariani C:控制授粉的雌蕊因子。植物学报,2004,16:S98-S106。10.1105 / tpc.017806。
- 38.
Johnson MA, Lord EM:指导花花管生长的胞外引导线索和胞内信号通路。花粉管,细胞和分子的观点(植物细胞专论)。编辑:Malhó R. 2006,柏林:斯普林格出版社,223-242。
- 39.
Eberle CA, Clasen BM, Anderson NO, Smith AG:一种新的花粉管生长分析,利用传输束消融烟草风格。性植物生殖,2012,25:27-37。10.1007 / s00497 - 011 - 0177 - 9。
- 40.
柴伯利,金田M, Zerzour R, Geitmann A:拟南芥花粉管细胞壁中多糖的空间分布、再循环和网络形成。中国农业科学,2012,30(4):344 - 344。10.1104 / pp.112.199729。
- 41.
Linskens HF, Esser KL: Über eine spezifische anfärbung der pollenschläuche im griffel und die zahl der kallosepfropfen nach selbstinund freremdung。自然科学学报,1997,34(4):344 - 344。
- 42.
刘志刚,刘志刚,刘志刚,刘志刚,刘志刚拟南芥花粉管细胞壁。中国生物医学工程学报,2010,29(3):344 - 344。10.1104 / pp.110.158881。
- 43.
Strattford S, Barnes WS, Hohorst DL, Sagert JG, Cotter R, Golubiewski A, Showalter AM, McCormick S, Bedinger P:单子叶和双子叶花粉扩展素样(Pex)蛋白中有一个富含亮氨酸的重复区。植物分子生物学杂志,2001,46:43-56。10.1023 /: 1010659425399。
- 44.
Geitmann A, Steer M:花粉管细胞壁的结构和性质。花粉管,细胞和分子的观点(植物细胞专论)。编辑:Malhó R. 2006,柏林:斯普林格出版社,177-200。
- 45.
Losada JM, Herrero M:阿拉伯半乳糖蛋白分泌与苹果花柱头接受性的获得有关。学报学报,2012,29(3):344 - 344。10.1093 / aob / mcs116。
- 46.
花蕊的超微结构和组织化学特征马吕斯普通的:花柱透射组织。科学通报,1980,12:327-337。10.1016 / 0304 - 4238(80) 90047 - 3。
- 47.
李涛,龙松,李敏,白松,张伟:野生S- rnase 5个新等位基因的鉴定和基因型的测定马吕斯物种。植物分子生物学杂志,2012,30:453-461。
- 48.
Herth W, Schnepf E:氟色素,钙氟白,结合导向结构多糖原纤维。生物工程学报,2000,28(4):344 - 344。10.1007 / BF01279855。
- 49.
Meikle PJ, Bonig I, Hoogenraad NJ, Clarke AE, Stone BA: (1-3)-β-葡聚糖在花粉管壁上的位置烟草alata使用(1-3)-β-葡聚糖特异性单克隆抗体。植物学报,1997,18(3):344 - 344。
- 50.
González MV, Coque M, Herrero M:猕猴桃花粉雌蕊相互作用。(猕猴桃deliciosa;猕猴桃科)。学报学报,1996,29(3):344 - 344。10.2307 / 2445931。
- 51.
Martínez-Pallé E, Herrero M:花粉管通路在点裂生殖黄连木维拉林志强,王志强,王志强,等。植物保护学报,2004,26(3):366 - 366。10.1086/297574。
- 52.
张志刚,张志刚,张志刚:早分化被子植物的柱头接受性,番荔枝(番荔枝科):温度和湿度的影响。学报学报,2011,29(4):344 - 344。10.3732 / ajb.1000185。
- 53.
黄志刚,王志刚,王志刚:单性果核柑桔花粉-雌蕊相互作用及其早期结果。学报学报,2011,38(4):344 - 344。10.1093 / aob / mcr187。
- 54.
Parre E, Geitmann A:不仅仅是密封剂-花粉管中胼胝质的物理特性。植物科学学报,2005,37(3):344 - 344。10.1104 / pp.104.050773。
- 55.
Ferguson C, Teeri TT, sika -aho M, Read SM, Bacic A:花粉管和花粉粒中纤维素和胼胝质的定位烟草.植物学报,1998,29(3):344 - 344。10.1007 / s004250050421。
- 56.
Stone BA, Clarke AE: (1-3)-β-葡聚糖的化学和生物学。澳大利亚:拉筹伯大学出版社;1992.
- 57.
关勇,郭俊,杨震:花花管生长信号:串扰、反馈和缺失环节。植物学报,2013,6:1053-1064。10.1093 / mp / sst070。
- 58.
杨建平,陈建平,陈建平:利用配子DNA研究被子植物花粉竞争的研究进展。自然科学进展,1999,26(3):366 - 366。10.1073 / pnas.96.16.9201。
- 59.
粗粒RW:花粉粒大小,柱头深度和花柱长度:关系的重新审视。植物生态学报,2009,27(3):344 - 344。10.1007 / s00606 - 008 - 0142 - 8。
- 60.
Hormaza JI, Herrero M:花粉选择。《应用理论》,1998,33(3):366 - 366。
- 61.
Erbar C:花粉管传递组织:雄配子体竞争的地方。中国植物学报,2003,26(4):357 - 357。10.1086/377061。
- 62.
Bocheneck GM: Eriksen:先到先得:延迟受精不会增强风传粉树的花粉竞争,franxinus excelsior l。中国植物学报,2011,29(2):344 - 344。10.1086/657298。
- 63.
Lankinen A, Larsson MC:植物繁殖功能和物种形成的冲突选择压力。生态学报,2009,23:147-157。10.1007 / s10682 - 007 - 9227 - z。
- 64.
Bernasconi G, Ashman TL, Birkhead TR, Bishop JDD, Grossniklaus U, Kubli E, Marshall DL, Schmid B, Skogsmyr I, Snook RR, Taylor D, Till-Bottraud I, Ward PI, Zeh DW, Hellriegel B:合子前阶段的进化生态学。科学通报,2004,30(3):344 - 344。10.1126 / science.1092180。
- 65.
Sage TL, hristova - vski K, Koehl V, Lyew J, Pontieri V, Bernhardt P, Weston P, Bagha S, Chiu G:基缘被子植物的传输组织结构:传输组织起源的意义。[J] .机械工程学报,2009,29(3):344 - 344。10.3732 / ajb.0800254。
- 66.
Crossgrove DJ, Li LC, Cho HT, Hoffmann-Benning S, Moore RC, Blecker D:膨胀子的成长世界。植物生理学报,2002,29(4):344 - 344。10.1093 /卡式肺囊虫肺炎/ pcf180。
- 67.
Valdivia ER, Stephenson AG, Durachko DM, Crossgrove D: B类β -扩张素是花粉分离和柱头穿透所必需的。植物生殖学报,2009,22:141-152。10.1007 / s00497 - 009 - 0099 - y。
- 68.
Tabuchi A, Li LC, Crossgrove DJ: β -膨胀素(1组过敏原)对玉米花粉基质的溶解和细胞壁的削弱。植物学报,2011,29(3):344 - 344。10.1111 / j.1365 - 313 x.2011.04705.x。
- 69.
Hepler PK, Rounds CM, Winship LJ:花粉管生长过程中细胞壁延伸性的控制。植物学报,2013,6:998-1017。10.1093 / mp / sst103。
- 70.
黄志刚,黄志刚,黄志刚:杏树雌蕊性状与花缘的关系(李属armeniaca).中国生物医学工程学报,2009,29(3):344 - 344。10.1111 / j.1744-7348.2008.00305.x。
- 71.
闭孔器在桃花粉管进入子房控制中的意义(碧桃).杨文杰,2004,30(3):366 - 366。
- 72.
Cannon MC, Terneus K, Hall Q, Tan L, Wang Y, Wegenhart BL, Chen L, Lamport DTA, Chen Y, Kieliszewski MJ:植物细胞壁的自组装需要扩展支架。中国科学:自然科学,2008,29(4):531 - 531。10.1073 / pnas.0711980105。
- 73.
陈勇,陈志强,陈志强,陈志强,陈志强:延伸蛋白超家族在原代细胞壁结构中的作用。中国生物医学工程学报,2011,29(3):344 - 344。10.1104 / pp.110.169011。
- 74.
苹果树虫媒和风媒的重要性比较。自然学报,1964,201:726-727。
- 75.
约翰森·达:植物微技术。纽约:麦格劳-希尔出版社;1940.
- 76.
Jefferies CJ, Belcher AR:一种用于体内花粉管鉴定的荧光增白剂。印染技术,2004,19(4):497 - 497。
- 77.
Currier HB:植物细胞中的胼胝质。学报学报,2004,27(4):488 -488。10.2307 / 2438916。
- 78.
王志强,王志强,王志强,等。细胞化学与电子显微镜。醛固定对细胞超微结构和内皮活性的保存。细胞生物学杂志,1996,17:19-58。10.1083 / jcb.17.1.19。
- 79.
费德·N,奥布莱恩:植物微技术:一些原理和新方法。中华科学技术学报,2004,29(3):344 - 344。10.2307 / 2440500。
- 80.
Fisher DB:光镜下条带状epon切片的蛋白质染色。组织化学,1968,16:92-96。
- 81.
Hughes J, McCully ME:光学增白剂在植物结构研究中的应用。染色技术,1995,20(3):319-329。
- 82.
Nicholas JR, Gates PJ, Grierson P:利用荧光显微镜监测微培养外植体根系发育。中国生物医学工程学报,1997,33(4):344 - 344。
- 83.
Solís MT, Pintos T, Prado MJ, Bueno MA, Raska I, Risueño MC, Testillano PS:橄榄体外小孢子重编程胚胎发生的早期标记物(齐墩果欧洲公司l .)。植物科学学报,2008,44(4):344 - 344。10.1016 / j.plantsci.2008.03.014。
- 84.
诺克斯JP,林stead PJ, Peart J, Cooper C, Roberts K:细胞表面阿拉伯半乳糖蛋白发育调控表位及其与根组织模式形成的关系。植物学报,1998,1:1 -3。10.1046 / j.1365 - 313 - x.1991.t01 - 9 - 00999. x。
- 85.
杨晓明,王晓明,王晓明,王晓明,王晓明。胡萝卜根尖细胞壁蛋白与根尖发育的关系。植物学报,2004,27(3):357 - 357。10.1046 / j.1365 - 313 x.1994.05020237.x。
- 86.
Coimbra S, Almeida J, Junqueira V, Costa ML, Pereira LG:阿拉伯半乳聚糖蛋白的分子标记拟南芥有性生殖。应用物理学报,2007,38(4):344 - 344。10.1093 / jxb / erm259。
确认
我们非常感谢Iñaki Hormaza和Faye Rosin对手稿的关键评论。这项工作得到了Ministerio de Ciencia e Innovación (MICINN)-FEDER [AGL2006-13529-C02-01, AGL 12221 - c02 -01, AGL 2012-40239]和Gobierno de Aragón [group A43]的支持。JIM11和JIM13抗体的分布部分得到了美国国家科学基金会的资助[DBI-0421683, RCN 009281]。J.M.L.获得了MICINN的FPI奖学金[BES-2007-16059]的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者都宣称没有利益冲突。
作者的贡献
MH设计并监督工作。JML执行实验工作。两位作者都参与了数据分析、讨论结果和撰写稿件。两位作者都阅读并批准了最终的手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取的文章,根据创作共用署名许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
李国强,李国强,李国强,等。黄芪雌蕊糖蛋白组成马吕斯x有明显以及花粉管生长的调节。BMC植物生物学14日,1(2014)。https://doi.org/10.1186/1471-2229-14-1
收到了:
接受:
发表:
关键字
- 阿拉伯半乳聚糖蛋白质
- agp
- 苹果
- 有硬块的
- 伸展蛋白
- ext
- 马吕斯x有明显
- 雌蕊
- 花粉管
- 风格
- 传输组织