摘要
背景
锈病在全球小麦生产中具有重要意义。随着新锈病菌株的不断进化及其对高温的适应,持续和持久的抗病性是一项关键挑战。环境条件影响抗性基因的表现,但其基础尚不清楚。
结果
在这里,我们证明了白天温度的变化会影响小麦的抗性柄锈菌striiformisf . sptritici(太平洋标准时间),是黄色(或条纹)锈病的致病因子。利用近等基因系UC1041 +/-的成体植株Yr36之间无显著差异太平洋标准时间白天温度为18℃或25℃的UC1041 +成体植物的尿道覆盖率Yr36植物。但是,当植物转移到日温较低的时候太平洋标准时间接种后,感染率增加了两倍。有趣的是,这种反应是独立的Yr36该基因之前被报道为一种温度响应性抗性基因太平洋标准时间UC1041的发育-Yr36植物也同样受到温度降低的影响。此外,UC1041-Yr36在较低温度下生长,然后转移到较高温度下的植物有效地抵抗了,并且任何方向的温度变化都显示出了影响太平洋标准时间在接种前8天发育。幼苗的结果相似,但与成体植物相比变化更大。增强抵抗力太平洋标准时间UC1041和三叶草品种移栽到较高温度时,幼苗均有明显的变异。不同方向的温度变化对冬至幼苗的抗性没有影响。
结论
Yr36是有效的在18°C,精炼温度的较低范围内抵抗太平洋标准时间与以前的研究相比。结果揭示了UC1041背景下以前未被描述的防御温度敏感性,这是由温度变化引起的,独立于Yr36.这种新的表型在一些品种中存在,但在其他品种中不存在,这表明太平洋标准时间当植物暴露在不同的温度下时,某些品种的防御能力可能比其他品种更稳定。
背景
锈病是全球范围内最具经济意义和最广泛的小麦病害之一。黄色(或条纹)锈病,由柄锈菌striiformisf . sp。tritici(太平洋标准时间),主要分布于温带地区,主要通过叶表面尿道内产生的无性孢子繁殖。太平洋标准时间正变得越来越普遍,可能是由于进化出更具侵略性的分离株,这些分离株已经进化到能够忍受更高的温度[1,2].与此同时,小麦的几种主要抗性来源太平洋标准时间近几年都出现了故障。这些事态发展加快了确定更有效和更持久的耐药性来源的需要。
太平洋标准时间芽孢孢子在小麦叶片表面萌发,形成芽管,通过气孔进入植物。一旦进入,在气孔腔内形成一个气孔下囊泡(SSV),感染菌丝从那里形成。吸器母细胞在每个感染菌丝末端与植物叶肉细胞接触时形成。感染钉破坏植物细胞壁,在细胞内形成真菌的喂养结构,称为吸器。进一步的菌丝由感染菌丝发展而来,并在整个叶片中增殖[3.].在病原体进入植物大约两周后,在易感反应中可以看到明显的症状,如叶片表面形成脓疱,称为尿道。
温度对抗性基因表现的影响是有据可查的。几种定量抗病(QDR)基因,增强了抗病能力太平洋标准时间在高温或低温下,小麦中[4].QDR通常被描述为成虫或部分抗性,或“缓慢生锈”。温度对抗黄锈病基因的影响是众所周知的(综述于[5])。耐高温成虫(HTAP)的小麦品种的幼苗易受所有品种的虫害太平洋标准时间在高温和低温下。抗HTAP品种的成体植株在低温下易感,但在高温下耐。抗黄锈病基因Yr36而且Yr39它们最初被指定为HTAP基因,因为暴露在更高的温度下对它们在植物生长后期的功能至关重要[6,7].然而,Yr36后来证明,当暴露在超过25°C的温度下时,在所有生长阶段都具有温度依赖性抗性[8].与HTAP基因相反,叶锈病抗性由Lr34 / Yr18在较低温度下增强[9- - - - - -12].Lr34/Yr18是一种公认的抗性,存在于许多小麦品种中,在发展中国家占有超过2600万公顷的面积[13),而Yr36最近是否通过紧密相连的渐渗被引入世界各地的许多品种Gpc-B1基因(14- - - - - -16].此外,一些小麦品种已被鉴定含有未鉴定的黄锈病温度响应抗性基因,这表明此类基因在农业中广泛应用[17- - - - - -19].
植物有好几层防御层来抵御入侵的微生物。植物通过模式识别受体(PRRs)识别保守的微生物激发子,即病原体(或微生物)相关分子模式(PAMPs/MAMPs),启动pamp触发的免疫(PTI)。PTI激活诱导防御,包括细胞壁增强、产生抗微生物化合物和气孔关闭,这些足以击退或阻止大多数入侵微生物[20.,21].毒性病原体已经进化到抑制PTI,产生干扰PRR功能或下游信号组件的效应蛋白。另一层防御由抗性(R)蛋白提供,它们检测这些效应蛋白,启动效应蛋白触发免疫(ETI),这是一种以与宿主细胞死亡相关的超敏反应(HR)为典型的抵抗[22].大多数R基因被预测编码具有核苷酸结合位点(NBS)和富亮氨酸重复序列(LRR)结构域的蛋白质,涉及效应子识别。然而,克隆QDR基因Yr36而且Lr34揭示了这些基因不属于主要的NBR-LRR类基因,这表明这些基因所赋予的抗性机制可能与R基因的机制有根本不同[8,13].
目前,人们对温度响应电阻的基础知之甚少[10,12,13].本研究利用六倍体小麦育种系UC1041的近等基因系(NILs)研究了小麦黄锈病致病系统的温度敏感性+ / - Yr36.植物在两种温度条件下生长,黑暗期保持12°C,光照期保持18°C或25°C(这里称为12°C/18°C或12°C/25°C)。接种后,植物要么保持在它们生长的原始温度下,要么转移到其他温度制度下。我们的研究结果揭示了UC1041对温度变化的背景敏感性Yr36.防御太平洋标准时间成人UC1041-Yr36受到两个方向的温度变化的影响,这种影响在接种前8天转移的植株中是一致的。当植物经历温度升高时,在幼苗中观察到抗性增强,与保持在较低温度下的幼苗相比,表现为菌丝定植减少。我们还表明,这种温度敏感性在小麦幼苗中是基因型依赖的。我们的工作强调了温度变化的重要性,而不是定义的阈值,当表征小麦的抗病机制时。研究结果有可能为培育环境更稳定的小麦品种提供育种策略太平洋标准时间阻力。
结果
白天温度的降低降低了抵抗太平洋标准时间独立于Yr36
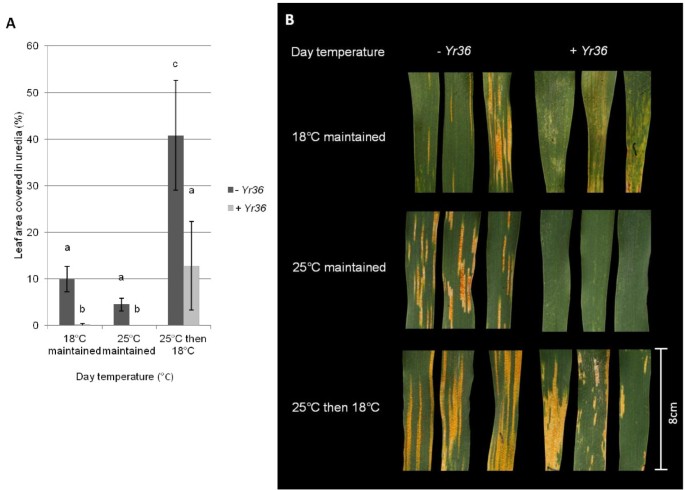
Yr36UC1041在成年植株中具有近乎完全的抗性+ Yr36接种前和接种后分别在12°C/18°C或12°C/25°C的温度条件下进行。然而,Yr36在最初生长于12°C/25°C的植物中,在接种后转移到12°C/18°C的植物中,-介导的抗性显著降低,尿道覆盖率显著提高(p < 0.01,图1A、B)。不出所料,UC1041-Yr36植株的抗性低于UC1041+ Yr36接种前和接种后分别维持在12°C/18°C和12°C/25°C时,植株的病害水平无显著差异(图1A、B)。然而,在UC1041阻力-Yr36当成年植株从接种后的12°C/25°C转移到12°C/18°C时,叶片尿道覆盖率也显著降低,增加了两倍(p < 0.01).因此,改变温度会影响两种UC1041 NILs的电阻,而不依赖于Yr36.
温度的变化影响太平洋标准时间UC1041接种前抗性可达8天
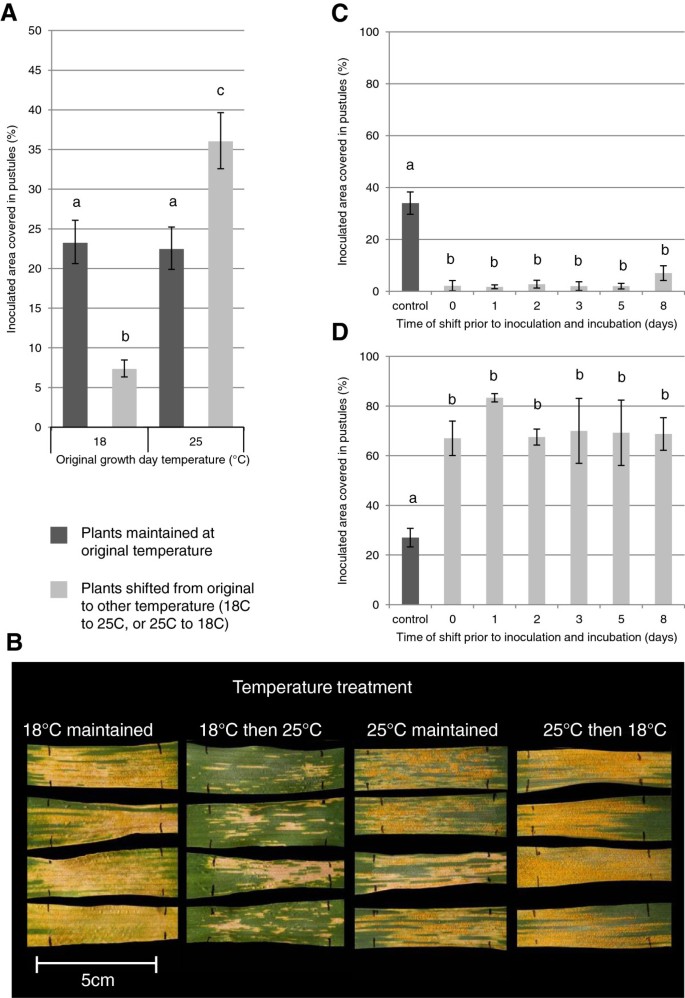
UC1041 +/-的初步观察Yr36NILs使我们进一步描述了温度响应太平洋标准时间UC1041背景电阻。如前所述,接种前和接种后12°C/18°C或12°C/25°C条件下,输尿管覆盖率无显著差异(图2)2A,B),而从温度较高的地区转移到温度较低地区的植物抗性较差(p < 0.01).相反,在12°C/18°C下生长,接种后转移到12°C/25°C的植物抗性更强,尿道水平显著降低(P< 0.001,图2A、B)。的范围太平洋标准时间虽然应用的孢子数量相似,但三个实验的定殖量各不相同。尽管如此,成人UC1041 -Yr36植物在每次试验中保持一致,温度降低降低抗性,温度升高导致抗性增强。UC1041电阻在12°C/18°C和12°C/25°C时的响应不同。在12°C/25°C时,尿道被坏死组织(死亡细胞)包围,表明细胞死亡/超敏反应(HR)。输尿管常被褪绿组织包围,HR较弱。从12°C/18°C到12°C/25°C的变化可能引发细胞死亡反应,并导致尿道形成迟缓。
影响温度的变化,可在8天前接种用太平洋标准时间,UC1041 -小麦成体植株抗黄锈病能力的研究Yr36。一)在接种的成年植株上,尿道覆盖叶面积的平均百分比(%)为18dpi太平洋标准时间将08/21分离开来,接种前后保持在12°C/18°C或12°C/25°C(深灰色)或接种后转移到其他温度(浅灰色)。三次独立实验均为平均值(±1标准误差)。不同字母表示差异有统计学意义(p < 0.01).B)太平洋标准时间在四种温度状态下,在18 dpi时旗叶上的症状。坏死/褪绿区可观察到尿路。c - d)在18 dpi接种的成年植株上尿道覆盖的平均叶面积百分比(%)太平洋标准时间分离08/21并保持在原温度状态C)12°C / 18°C或D)接种前后12°C/25°C(深灰色)或接种前不同时间点转移到其他温度制度(浅灰色)。4个生物重复均取平均值(±1标准误差)。不同字母表示差异有统计学意义(p < 0.01).
在接种前8天,将成年植株从一种温度转移到另一种温度,进行了类似的实验。接种时从12°C/18°C转移到12°C/25°C的植株,与接种前1、2、3、5或8天转移的植株相比,输尿管减少水平无显著差异(图2)2同样,从12°C/25°C转移到12°C/18°C的成年植株,无论是在接种时转移,还是在接种前1、2、3、5或8天转移,其输尿管数量都有相当的增加(图2)2D)。
白天温度的降低会影响后期的太平洋标准时间UC1041幼苗的定殖
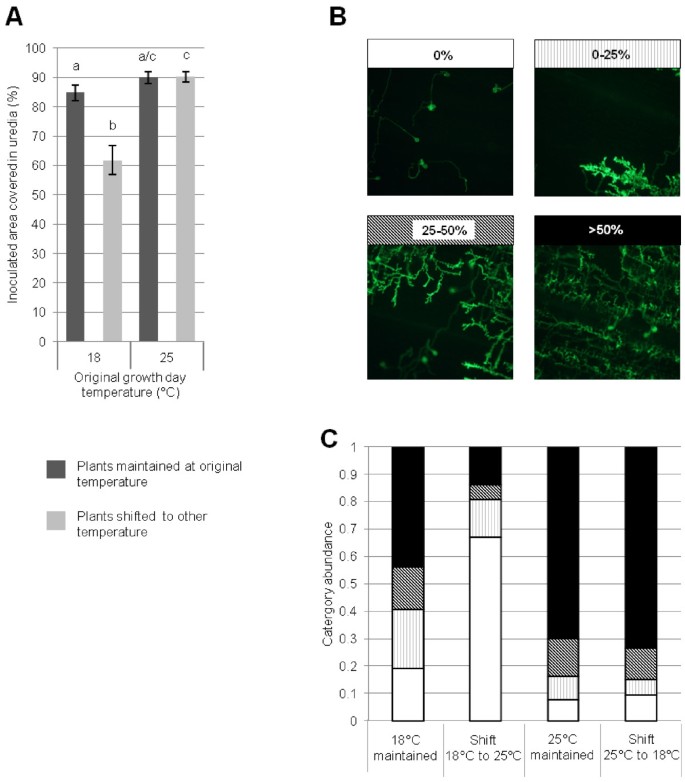
为了确定温度变化效应是否受寄主发育阶段的影响,对幼苗进行了进一步的研究。没有太平洋标准时间UC1041幼苗具有抗性-Yr36感染隔离08/21,导致较高水平太平洋标准时间尿路比在成体植物上看到的多。与UC1041成体植株一样,接种前和接种后保持在12°C/18°C或12°C/25°C的植株之间的病害水平没有显著差异(图3.A).与成年植物一样,当幼苗从12°C/18°C转移到12°C/25°C时,观察到抗性增强(p < 0.001,图3.A).然而,12°C/25°C保存的植株与12°C/25°C转移到12°C/18°C后的植株之间的尿道水平没有显著差异太平洋标准时间接种,与在成年植物中观察到的抗性降低相反。
温度变化对太平洋标准时间小麦品种UC1041 -的幼苗发育Yr36。一)UC1041 -上尿道覆盖的平均叶面积(%)18dpiYr36幼苗。叶片接种太平洋标准时间将08/21分离,接种前后保持原温度12°C/18°C或12°C/25°C(深灰色)或接种后转移到其他温度(浅灰色)。在三个独立的实验中,从多达50个视野中获得平均值(±1标准误差)。不同字母表示差异有统计学意义(p < 0.01).c)显微表征太平洋标准时间由菌丝定植的程度分类的发展。B)的说明太平洋标准时间菌丝丰度,每一类丰度用不同的交叉孵化表示(上表)。C)每种温度处理中每种类别出现的频率。从三个生物重复中获得每个类别的平均值。
太平洋标准时间在显微镜下观察到UC1041幼苗的发育和定植,表明转移到更高的温度后抗性增强。在1 dpi的4种温度处理之间,尿道孢子的萌发率无显著差异(附加文件)1:图S1A)和3 dpi(附加文件1:图S1C)。同样,在1 dpi或3 dpi的四种温度条件下,萌发的尿道孢子形成ssv的百分比没有显著差异(附加文件)1:图S1B,D)。接种后在12°C/25°C下生长并转移到12°C/18°C的6 dpi幼苗,其内部真菌结构显著变小(p < 0.001)与所有其他治疗相比(附加文件1:图S1E)。到8 dpi时,与12°C/25°C的幼苗相比,接种前12°C/18°C生长的幼苗菌丝定殖量较低,无论随后的温度变化如何(p < 0.001,图3.B, C)。正如预期的那样,幼苗在12°C/18°C下生长,然后转移到更高的温度状态太平洋标准时间接种后菌丝定植率明显低于12°C/18°C (p < 0.001).接种后12°C/25°C的幼苗与从12°C/25°C转移到12°C/18°C的幼苗在12°C/25°C下的菌丝生长没有显著差异(图3.B, C)。
温度变化对太平洋标准时间小麦品种的抗性依赖于基因型
以确定温度变化是否会引起抗药性太平洋标准时间在其他小麦品种中,对选定的英国优良品种的幼苗进行了相同的实验程序。抵抗太平洋标准时间三叶草分离株08/21显示出与UC1041相似的表型,从较低温度转移到较高温度的幼苗显示出尿道水平显著降低(p < 0.05,图4然而,冬至日的抗性不受温度制度之间转移的影响,因为所有四种处理之间的疾病水平没有显著差异(图4B).与UC1041幼苗一样,三叶草的抗性增强不一致。当幼苗从12°C/18°C转移到12°C/25°C时,4个实验中有3个观察到抗性增强。
讨论
我们的调查表明Yr36几乎完全抵抗太平洋标准时间与之前的研究一致,在25°C分离08/21。我们还展示了Yr36在18°C时有效,细化了授予电阻的较低温度范围。此外,我们发现UC1041基因背景对温度变化的反应是独立的Yr36,影响生长Pst。我们的研究结果表明Yr36-介导的抗性可能受到uc1041背景中先前未鉴定的防御温度敏感性的影响。在野外,Yr36在地中海环境中生长的成年植物上传递QDR表型[6].根据本文给出的结果,频繁的温度变化可能会影响UC1041 +观测到的QDRYr36在野外。此外,我们的结果还表明Yr36在相对较冷的温带条件下,-介导的抗性应在田间有效。
在不同的接种前和接种后条件下进行了一些描述温度响应性抗性基因的研究,但很少考虑温度变化的影响。然而,在自然条件下,温度是不断变化的,这对抗性的影响需要进一步研究。其他对温度敏感的抗性基因可能以与UC1041 +/-相似的方式对温度变化做出反应Yr36,而不是只需要暴露在一个温度阈值[10,23,24].例如,Broers和Wallenburg的研究[12]观察到温度下降会增加Lr34 / Yr18抗叶锈病,尽管在本研究中没有涉及未暴露于温度变化的植物的阴性对照处理。普里托里厄斯等[10]后来指出布罗尔和瓦伦堡[12]研究不排除来自栽培品种的背景效应Lr34 / Yr18基因居住。我们的研究结果强调了温度变化在病理学研究中的重要性,特别是在描述温度响应性抗性基因时。
成虫试验是评价抗性的最合适方法,但限制了试验的数量。虽然苗期试验能够更快速地筛选和测试抗性,但我们的结果表明,结果不如成体试验可靠。对UC1041幼苗的研究表明,温度升高可以增强对植物的抗性太平洋标准时间在植物发育的早期阶段。尽管这些结果与在成年植物中观察到的结果不太一致,但这些结果表明,温度变化的影响可能不仅仅是由于UC1041背景中先前未鉴定的APR抗性。同样在幼苗中,温度的降低并不会降低对植物的抵抗力太平洋标准时间在UC1041的成年植株中可见(40%的侵染率),但这可能是由于较高水平的太平洋标准时间UC1041幼苗感染(约90%感染)。成体植物和幼苗之间的差异可能是由太平洋标准时间接种量或反映影响防御的生理差异,考虑到某些类型的抗性直到发育后期才能检测到[25].与UC1041一样,在三叶草中观察到的抗性增强在所有的幼苗实验中都没有出现。在未观察到表型的情况下,与观察到温度效应的实验相比,两个品种的尿虫丰度都更高。这表明高水平的太平洋标准时间接种和随后的重感染负荷可能掩盖温度变化的影响。
我们证明了太平洋标准时间能够成功地发芽和穿透植物,无论温度制度,植物已经暴露。这表明温度响应性抗性并不涉及依赖于病原体最初识别的机制。当UC1041和三叶草植物从12°C/18°C转移到12°C/25°C时,观察到的表型类似于一种QDR类型,通常与感染频率降低、潜伏期增加和尿道大小减小有关,通常只在生长季节后期显示感染迹象[11,26- - - - - -28].这种表型的某些方面可以在HTAP抗黄锈病中看到,这是一种QDR,通常在茎伸长后和白天温度为25°C -30°C时有效[7].然而,我们观察到的成年植物抗黄锈病的增强是由温度升高引起的,而不是长期暴露在25°C下,并且在幼苗中也观察到。因此,我们的研究结果表明,温度变化,而不是暴露在阈值温度下,可能会影响一些QDR机制。
植物必须不断适应不断变化的环境,并在生长和防御之间平衡资源,以获得最大的生产力[29,30.].研究拟南芥提示激素介导的生长可能拮抗免疫反应的一般权衡机制[31,32].因此,温度变化可能引发某些小麦品种能量供应的重组,间接导致养分有效性降低太平洋标准时间,一种生物营养真菌[33,34].另一种可能性是温度变化可能导致病原体抑制代谢物的积累[35].虽然QDR机制在很大程度上是未知的,Lr34而且Yr36不属于一般的NBS-LRR类R基因,因此有理由假设这些通常不参与病原体识别。当暴露于温度变化时,一些QDR基因可能具有间接影响病原体发育的其他功能。
我们的结果表明,接种前8天的温度变化会影响防御太平洋标准时间UC1041成体植物。因此,预先暴露在不同的温度下会影响随后的防御,这表明了一种适应性反应。我们没有证据表明温度变化导致了应激反应,但抗逆性增加或减少的持久影响与启动效应相当,即植物先前暴露于应激下能够对后续应激做出更快的反应[36].与本研究中使用的环境温度变化类似,已被证明通过甲基化对DNA活性的表观遗传修饰引起适应性变化[37].人们很容易推测,小麦相应的温度变化也可能是表观遗传启动植物,影响防御的后期阶段,如UC1041所示。
三叶草幼苗在接种后移栽到较高温度时对UC1041表现出类似的抗性表型。然而,冬至幼苗的抗性不受温度变化的影响,这表明这种反应是基因型依赖的,一些品种可能具有更稳定的防御能力太平洋标准时间在不同的温度下。公园等[38]支持这些观察,报告了小麦品种之间的差异太平洋标准时间在不同的接种前和接种后温度制度。作者将在高温下增强的抗性归因于控制成年植物抗性的因素,例如在他们研究中使用的品种中存在的未鉴定的QDR基因。如果我们观察的基础是宿主对温度变化的适应,那么其他病原体的相互作用也可能受到影响。不同小麦品种对温度变化的抗性有显著差异Blumeria茎f . sptritici,小麦白粉病的致病因子,表明该现象可能不限于抗黄锈[39].了解温度变化对植物防御的影响对于培育更能抵御气候变化潜在影响的作物至关重要。稳定的作物性能和可靠的抗病性是植物育种中的重要性状。我们的结果提出了一种实验方法来研究电阻对温度变化的响应。进一步的研究将揭示这一性状是否与其他抗性相互作用,以及它是否可以用于选择具有更一致、温度稳定抗性的小麦品种太平洋标准时间还有其他疾病。
结论
Yr36可以防止太平洋标准时间脓疱的发展在温度持续低于25°C,这与以前所显示的相反。此外,在UC1041背景中发现了一种以前未被描述的防御温度敏感性,这表明温度的变化可以影响小麦对黄锈病的后续抗性,并且可能以品种依赖的方式产生这种影响。了解温度变化如何影响抗性可以使作物培育出更稳定的病原体抗性。
方法
植物及病原材料
六倍体小麦近等基因系UC1041+/-Yr36来自美国加州大学戴维斯分校,品种为三叶草和夏至,来自英国诺里奇研究园的英国种质资源单位。所有毒力测定均用太平洋标准时间2008年从英国剑桥大学国家农业植物学研究所(NIAB)分离出的小麦品种Solstice中分离出08/21。本研究使用的种质都没有完全的苗期抗性太平洋标准时间2008 /21,在标准苗木试验中确定(数据未列示)。
植物生长条件
种子直接播种到1升的花盆中,生长到第一片旗叶出现(Zadok 's Growth Stage (GS) 47),或在P15种子盘中进行幼苗(Zadok 's GS 13-14)试验[40].植物在受控环境室(CERs)中生长,该环境室的暗/光周期为8小时/16小时,相对湿度恒定为80%,光强约为350 μmol m-2年代-1.两种日温度制度分别为12°C/18°C和12°C/25°C,夜间/白天温度(日间温度是处理之间唯一的差异)。为了同步生长阶段,植物在12°C/18°C条件下提前一周生长。对于小麦幼苗的测定,根据不同品种,在12°C/18°C条件下提前1至2天播种。
小麦黄锈病的接种
在成年植株的旗叶和幼苗最新完全展开的叶片上进行接种。植物接种太平洋标准时间尿孢子在光期结束前1小时出现。确定叶片正面4厘米(幼苗)或5厘米(成体植株)区域,用细刷按1:8(幼苗)或1:4孢子/滑石粉混合物(成体植株)施用尿素孢子。叶片表面喷H2O含Tween20®(0.01% v/v),以促进发芽。UC1041 +/-Yr36空白对照实验采用相同的程序,但接种全叶。在UC1041的所有实验中-Yr36仅行,植物在规定的区域接种。然后将植物放置在12°C的露珠室中,在完全黑暗的环境中22小时,然后将其恢复到原来的温度制度,或转移到新的制度。在接种后18天(dpi),同样的4-5厘米区域(或UC1041 NIL比较的整个叶片)被用于确定感染百分比(Pi),测量为被孢子尿管覆盖的叶片组织的百分比(独立于褪色或坏死)。
亚细胞的显微分析太平洋标准时间发展
UC1041在接种后1、3、6、8 dpi取样。收获叶片的4厘米接种区域,并使用改编自Ayliffe的方法进行显微镜检查等[41].为了去除叶绿素,将样品置于12 ml 1 M KOH和2 μl Tween20®中,在37℃下清除一夜。在pH值7.5的50mm Tris中冲洗组织三次,然后用WGA-FITC在50mm Tris中以1mg /ml的浓度染色1小时。将组织固定在载玻片上,在荧光显微镜(Nikon 800 Eclipse;尼康精密欧洲有限公司,兰根,德国)。从早期时间点的样本检测了尿道孢子的萌发和萌发后尿道孢子形成气孔下囊泡(SSVs)的能力。随后,通过测量真菌内部结构的大小(μm)和菌丝的丰度,在多达50个视野下以10倍放大的方式对时间点进行评分。
数据分析
使用Genstat for Windows 12版统计包(VSN international, Hemel Hempstead, UK)对数据进行分析。感染百分比(Pi)评分使用LOGIT +变换进行转换,以获得接近正态[42].
在日志n为自然对数,Pi为脓疱覆盖百分比。对转换后的数据使用一般线性回归模型,模型输出提供了预测均值,并进行重复实验。模型中考虑了温度体系和实验(重复)的影响。太平洋标准时间显微镜数据还使用一般线性回归模型和百分比数据的LOGIT +转换进行分析。
作者的信息
在读博士,约翰·英纳斯中心。GM -博士后研究员。AM -谢菲尔德大学本科生。HS - John Innes中心博士后研究员。LB - NIAB研究小组负责人。CU -项目负责人,John Innes中心。SD -东英吉利大学大气科学高级讲师。CR -约翰英纳斯中心资深科学家。
缩写
- 指数:
-
Effector-triggered免疫力
- 人力资源:
-
过敏的反应
- HTAP:
-
高温成虫(耐高温)
- MAMP:
-
微生物相关分子模式
- PAMP时:
-
病原体相关分子模式
- PRR:
-
模式识别受体
- 太平洋标准时间:
-
柄锈菌striiformisf . sptritici
- PTI:
-
PAMP-triggered免疫力
- 评估报告:
-
定量抗病性
- 科学价值:
-
Sub-stomatal泡。
参考文献
Singh RP, Hodson DP, Huerta-Espino J, Jin Y, Bhavani S, Njau P, Herrera-Foessel S, Singh PK, Sukhwinder S, Govindan V:茎锈病真菌Ug99种的出现对世界小麦生产构成威胁。植物学报,2011,49:465- 466。10.1146 / annurev -发朵- 072910 - 095423。
Markell SG, Milus EA:在美国东部出现了一个新的条纹锈菌种群。植物病理学杂志,2008,32(6):632-639。10.1094 /发朵- 98 6 - 0632。
霍夫莫勒MS, Sorensen CK, Walter S, Justesen AF:多样性柄锈菌striiformis谷物和草。植物病理学年度评论,第49卷。编辑:VanAlfen NK, Bruening G, Leach JE。2011年,197 - 217。卷,49。
Navabi A, Tewari JP, Singh RP, McCallum B, Laroche A, Briggs KG:澳大利亚小麦品种“Cook”对条锈病和叶锈病持久性抗性的遗传和QTL分析。基因组学报,2005,48(1):97-107。10.1139 / g04 - 100。
陈小明:美国条锈病防治面临的挑战与对策。中国农业科学,2007,28(6):648-655。10.1071 / AR07045。
Uauy C, Brevis JC, Chen XM, Khan I, Jackson L, Chicaiza O, Distelfeld A, Fahima T, Dubcovsky J:高温成体植物(HTAP)抗条锈病基因Yr36与籽粒蛋白质含量基因座Gpc-B1密切相关。应用理论,2005,112(1):97-105。10.1007 / s00122 - 005 - 0109 - x。
林峰,陈晓明:春小麦品种Alpowa全期抗性和高温成体抗条锈病基因的遗传及分子定位。应用理论与实践,2007,29(3):379 - 379。10.1007 / s00122 - 007 - 0518 - 0。
傅德林,Uauy C, Distelfeld A, Blechl A, Epstein L,陈晓明,Sela H, Fahima T, Dubcovsky J:小麦条锈病的温度依赖性抗性激酶- start基因。Sci(华盛顿)。2009, 39(5): 528 - 528。10.1126 / science.1166289。
Plotnikova LY, Stubei TY:小麦的有效性Lr22b, Lr34,Lr37西西伯利亚成年植物抗叶锈病的基因及其作用的细胞生理学基础。环境科学学报,2013,(1):47-53。10.1134 / S2079059713010115。
李志刚,李志刚,李志刚,李志刚。接种密度和温度对小麦抗叶锈病3个组分的影响。中国生物工程学报,2004,27(2):344 - 344。
Rubiales D, Niks RE:的表征Lr34这是一种对小麦叶锈病具有非超敏抗性的主要基因。植物保护学报,2004,18(3):344 - 344。10.1094 / pd - 79 - 1208。
Broers LHM, Wallenburg SC:侵染后温度对小麦叶锈病部分抗性3组分的影响。植物学报。1989,44(3):215-224。10.1007 / BF00037528。
Krattinger SG, Lagudah ES, Spielmeyer W, Singh RP, Huerta-Espino J, McFadden H, Bossolini E, Selter LL, Keller B:一种假定的ABC转运蛋白赋予小麦对多种真菌病原体的持久抗性。科学通报,2009,29(5):528 - 528。10.1126 / science.1166453。
库马尔J, Jaiswal V,库马尔A,库马尔N, Mir RR,库马尔S, Dhariwal R, Tyagi S, Khandelwal M, Prabhu KV,等:印度面包小麦品种籽粒蛋白质含量高的一个主要基因的渗透。中国农学通报,2011,29(3):344 - 344。10.1016 / j.fcr.2011.05.013。
Randhawa HS, Asif M, Pozniak C, Clarke JM, Graf RJ, Fox SL, Humphreys DG, Knox RE, DePauw RM, Singh AK,等:分子标记在加拿大小麦育种中的应用。植物营养学报,2013,29(4):344 - 344。n / a n / a。
Tabbita F, Lewis S, Vouilloz JP, Ortega MA, Kade M, Abbate PE, Barneix AJ:影响Gpc-B1一个籽粒蛋白质含量高的基因座渗入阿根廷小麦种质。植物营养学报,2013,32(1):344 - 344。10.1111 / pbr.12011。
张震,冯军,白勇,林荣,彭勇,徐松:小麦品种霍德法斯抗条锈病的遗传分析。中国农业大学学报,2011,16(5):1-5。
冯俊,左丽丽,张志智,林瑞敏,曹友友,徐顺生:温度敏感抗性的数量性状位点小麦锈菌在小麦品种Flinor中。自然科学进展,2011,29(3):344 - 344。10.1007 / s10681 - 010 - 0291 - z。
万安,牛勇,吴林:22个小麦品种对黄锈病的温敏抗性。中国农业科学,2000,33:101-103。
Zipfel C: pamp引发免疫的早期分子事件。植物学报,2009,12(4):414-420。10.1016 / j.pbi.2009.06.003。
Schwessinger B, Ronald PC:植物先天免疫:保守微生物特征的感知。植物生物学年度评论,第63卷。编辑:Merchant SS. 2012, 451-482。63卷。
Jones JDG, Dangl JL:植物免疫系统。自然科学,2006,44(4):323-329。10.1038 / nature05286。
Ramage RA, Sutherland MW:接种前温度过高和过低会降低接种效果Lr20而且Sr15小麦的抗锈病基因。植物病原学杂志,1995,44(5):772-778。10.1111 / j.1365-3059.1995.tb02734.x。
戴克PL,约翰逊R:小麦抗病性基因的温度敏感性柄锈菌recondita.中华植物病理学杂志,1998,5(4):229-234。10.1080 / 07060668309501601。
Basnet BR, Singh RP, Herrera-Foessel SA, Ibrahim AMH, Huerta-Espino J, Calvo-Salazar V, Rudd JC:普通春小麦Quaiu 3号成体抗黄锈病和叶锈病的遗传分析。植物学报,2013,97(6):728-736。10.1094 / pdi - 02 - 12 - 0141 - re。
王志刚,王志刚,王志刚:小麦抗慢锈病的表型和分子特征柄锈菌striiformis即。f.sptritici.中国植物学报,2010,32(6):366 - 366。
Herrera-Foessel SA, Singh RP, Huerta-Espino J, Rosewarne GM, Periyannan SK, Viccars L, Calvo-Salazar V, Lan CX, Lagudah ES:Lr68:小麦抗叶锈病的一种新基因。应用理论与实践,2012,29(4):344 - 344。10.1007 / s00122 - 012 - 1802 - 1。
William HM, Singh RP, Huerta-Espino J, Palacios G, Suenaga K:春小麦成株抗叶锈病和条锈病遗传位点的鉴定。中国生物工程学报,2006,49(8):977-990。10.1139 / g06 - 052。
Mosher S, Moeder W, Nishimura N, Jikumaru Y, Joo S- h, Urquhart W, Klessig DF, Kim S-K, Nambara E, Yoshioka K:损伤模拟突变体cpr22显示脱落酸信号的改变和脱落酸不敏感的水杨酸依赖方式。中国生物医学工程学报,2010,29(4):344 - 344。10.1104 / pp.109.152603。
Koga H, Dohi K, Mori M:脱落酸和低温抑制水稻植株对稻瘟病的全株特异性抗性反应稻瘟病菌.中国生物医学工程学报,2004,29(1):344 - 344。10.1016 / j.pmpp.2004.11.002。
Albrecht C, Boutrot F, Segonzac C, Schwessinger B, Gimenez-Ibanez S, Chinchilla D, Rathjen JP, de Vries SC, Zipfel C:油菜素内酯抑制病原体相关分子模式触发的免疫信号,独立于受体激酶BAK1。中国科学:自然科学,2012,29(1):1 - 6。10.1073 / pnas.1109921108。
Anderson JP, Badruzsaufari E, Schenk PM, Manners JM, Desmond OJ, Ehlert C, Maclean DJ, Ebert PR, Kazan K:脱落酸和茉莉酸-乙烯信号通路的拮抗相互作用调节防御基因表达和抗病性拟南芥.植物细胞学报,2004,16(12):3460-3479。10.1105 / tpc.104.025833。
Viola R, Davies HV:温度对马铃薯块茎碳水化合物代谢途径的影响(Solanum-tuberosum L).中国植物科学,2004,27(2):339 - 344。10.1016 / 0168 - 9452(94) 90201 - 1。
Grof CPL, Campbell JA, Kravchuk O, Lambrides CJ, Albertson PL:温度对两个商业甘蔗品种碳分配的影响。植物学报,2010,37(4):334-341。10.1071 / FP09216。
胡波,Simon J, Rennenberg H:干旱和气候变暖对酸性和钙质土壤上3种橡树叶片胁迫代谢产物的影响。树物理学报,2013,33(5):489-504。10.1093 / treephys / tpt025。
Conrath U, Beckers GJM, Flors V, Garcia-Agustin P, Jakab G, Mauch F, Newman M-A, Pieterse CMJ, Poinssot B, Pozo MJ,等:启动:准备战斗。植物与微生物相互作用,2006,19(10):1062-1071。10.1094 / mpmi - 19 - 1062。
Kumar SV, Wigge PA: H2A。含z的核小体介导小鼠的热感反应拟南芥.中国生物医学工程学报,2010,40(1):136-147。10.1016 / j.cell.2009.11.006。
Park RF, Ash GJ, Rees RG:温度对部分澳大利亚小麦品种的响应影响Puccinia-striiformisf-sptritici.中国医药科学,2004,27(3):366 - 366。10.1016 / s0953 - 7562(09) 80961 - 1。
葛玉峰,Johnson JW, Roberts JJ, Rajaram S:温度与抗性基因相互作用在水稻抗病表达中的作用黑麦.植物学报,1998,99(2):103-109。10.1023 /: 1018392725474。
Zadoks JC, Chang TT, Konzak CF:谷物生长阶段的十进制编码。杂草学报,1994,14(6):415-421。10.1111 / j.1365-3180.1974.tb01084.x。
王珊珊,梁海红,陈晓明,陈晓明,王晓明,王晓明:水稻非寄主抗锈病抗性的研究进展。自然科学进展,2011,29(1):1 -4。10.1007 / s10681 - 010 - 0280 - 2。
Powell NM, Lewis CM, Berry ST, MacCormack R, Boyd LA:英国冬小麦品种Claire的抗条锈病基因。应用理论与实践,2013,26(1):1 - 7。10.1007 / s00122 - 013 - 2077 - x。
确认
我们要感谢Nikolai Adamski提供本研究中使用的小麦种质资源的种子。我们也要感谢约翰·英尼斯园艺公司的工作人员对植物的管理。RB由生物技术和生物科学(BBSRC)目标优先奖学金和约翰·英纳斯基金会资助,CR和CU由BBSRC资助BB/J004553/1, GMcG和LB由BBSRC资助BB/G024987/1, HJS由BBSRC资助BB/G042060/1, AM由英国植物病理学学会的学生奖学金资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
在AM的帮助下,RB完成了大部分不同品种的实验工作。RB和CR构思了本研究,RB、CR、CU和GM在构思和实验设计上做出了贡献。RB和GM进行统计分析。HS, SD和LB参与了稿件的修改。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2013_1443_moesm1_esm.pdf
附加文件1:图S1:太平洋标准时间UC1041的发展(-Yr36)幼苗。幼苗接种太平洋标准时间将08/21分离,接种前后保持在12°C/18°C或12°C/25°C的相同温度(深灰色)或接种后转移到另一种温度(浅灰色)。一)的百分比太平洋标准时间尿孢子在1 dpi时萌发。B)萌发尿道孢子在1 dpi时形成气孔下囊泡(SSVs)的百分比。C)的百分比太平洋标准时间尿孢子在3 dpi时萌发。D)萌发尿道孢子在3 dpi时形成ssv的百分比。均值(±1标准误差)从两个独立实验的多达50个视野中获得。不同字母表示差异有统计学意义(P< 0.01)。E)的大小太平洋标准时间菌丝集落(μm)在6 dpi。3个生物重复均取平均值(±1标准误差)。不同字母表示差异有统计学意义(P< 0.001)。(pdf 89kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
布莱恩特,R.R.M,麦克格兰,G.R.D,米切尔,A.R.et al。温度的变化调节小麦品种UC1041对黄条锈病的防御,而不依赖于抗性基因Yr36.BMC植物生物学14日,10(2014)。https://doi.org/10.1186/1471-2229-14-10
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-10
关键字
- 条锈病
- 植物防御
- 温度
- Yr36
- 柄锈菌striiformisf . sptritici
- HTAP