摘要
背景
淀粉是地下植物组织(如根和块茎)的主要储存化合物。一个例外是甜菜根(Beta vulgaris ssp altissima),专门储存蔗糖。在甜菜中这种不同的储存积累背后的潜在机制目前还不完全清楚。从甜菜根和块茎中淀粉的普遍存在可以推测,甜菜根中淀粉的缺乏可能源于淀粉途径的缺乏。因此,以淀粉积累为重点,利用防风草(Pastinaca漂白亚麻纤维卷)作为比较。
结果
对甜菜根的代谢和结构分析证实了蔗糖是唯一的贮藏成分。甜菜和野生祖先海甜菜的根中均未检出淀粉粒(普通贝塔。maritima).对防风草的分析表明,它的主要贮藏成分是淀粉,但牙根组织也发现含有大量的糖。令人惊讶的是,在甜菜和防风草丝根中,四种主要的淀粉生物合成酶,磷酸葡萄糖转化酶,adp -葡萄糖焦磷酸化酶,淀粉合成酶和淀粉分支酶的活性相似。转录分析证实了相应基因的表达。此外,在这两种植物的抽根中可以确定淀粉积累的基因表达,如质体己糖运输和淀粉调节功能。
结论
作为地下贮藏器官,甜菜龙头根具有专储蔗糖的独特特性。在祖先海甜菜中淀粉的缺乏也表明了生物学重要性的进化特征。
本研究结果表明,甜菜根在贮藏积累过程中存在淀粉主要生物合成功能的基因表达和酶活性。鉴于此,甜菜根中完全缺乏淀粉是一个谜。
背景
植物为各种目的生产和储存能量储备。这些能量储备的一个主要用途是促进下一代的生长和繁殖,它们储存在下沉组织中,例如种子和块茎。植物储存的淀粉、油和糖为人类提供了大部分的热量,但也有重要的工业应用。储存化合物的类型和储存产品所在的植物组织因植物种类而异。一般来说,储存化合物、淀粉、油和糖的生物合成已经相当详细,但对这些产品的某一类型的积累及其潜在机制的知识在很大程度上缺乏[1,2].随着对控制某种储存化合物在储存库中积累的关键点的了解的增加,植物可能会适应增加积累和产量。或者,植物可能被设计成比自然存在的积累更多的储存化合物。
一般来说,丝锥根具有淀粉的生物合成和沉积能力,在防风草、胡萝卜和瑞典菜的细胞中很容易发现淀粉颗粒。甜菜是个例外(普通贝塔。altissima)和相关的亚种,这些亚种在抽根发育过程中只产生蔗糖而不产生淀粉。甜菜只含有蔗糖作为储存化合物的原因尚不清楚。然而,一个可能很重要的因素是其野生祖先海甜菜(普通贝塔。maritima),生长。海甜菜,顾名思义,生长在海边,有一年和两年的生命周期,细胞组织和储存积累与甜菜相似[3.].甜菜的生命周期为两年,第一年有一个最初的抽根,第二年储存用于抽苔、开花和结实子的能量。早在19世纪初开始从甜菜中提取时,人们就知道海甜菜根富含糖,并将其作为糖的来源[4].通过育种,甜菜已成为一种具有大根的植物,其含糖量占干重的65-75% [5,6也是我们今天糖的主要来源之一。
地下贮藏组织的发育,如丝根和块茎,在蔗糖进入细胞、细胞成分的构建和贮藏器官的扩张方面显示了类似的时间事件周期。最初,蔗糖的外质体卸载占主导地位,与细胞壁结合的酸性转化酶将蔗糖分解为己糖,用于生长和代谢[7,8].当器官发育阶段过渡到细胞能量储备的充盈阶段时,蔗糖的输入转换为共生负荷。在这一阶段,植物激活不同的合成途径,并以淀粉体中的淀粉或液泡中的蔗糖的形式将碳化合物填充细胞器。研究了甜菜丝根中蔗糖的转运和贮藏[9,10].与淀粉在淀粉体中的储存相反,由于渗透势的产生,蔗糖在液泡中的储存需要持续的能量输入,以维持与细胞质相比,该细胞器中的蔗糖浓度高得多。维持这一浓度差异的膜电位由利用ATP和焦磷酸盐(PPi)的质子泵实现[11,12].
淀粉的生物合成发生在地下组织,如根和块茎,在一个专门生产淀粉的质体中[13].蔗糖是同一分子,从源组织中运输,因此理论上在液泡中储存之前不需要进一步的修饰,而淀粉则需要许多酶的步骤来形成。对于双子叶植物,葡萄糖-6-磷酸通过葡萄糖-6-磷酸转运体(GPT)进入淀粉体后,淀粉聚合物的形成有四个必不可少的酶促步骤[14].一种可塑磷酸葡萄糖酶将传入的葡萄糖-6-磷酸转化为葡萄糖-1-磷酸,其与ATP一起可被adp -葡萄糖焦磷酸化酶用于形成adp -葡萄糖。adp -葡萄糖是淀粉合成酶在淀粉聚合链中形成α-1,4键的基本组成部分。淀粉分支酶催化形成α-1,6键,形成聚合物链的分支。淀粉分支酶不产生净淀粉,但它对支链淀粉的结构很重要[15].还需要其他具有淀粉调节能力的酶,如异淀粉酶和淀粉磷酸化酶,以构建和组织成结构良好的淀粉颗粒[14].
甜菜叶片在光合作用期间产生的淀粉是昼夜循环的一部分,这表明所有淀粉生物合成的核心基因都存在于甜菜中,就像在所有其他植物中一样[16].从甜菜表达序列标记(est)的公共数据库中也可以得到同样的结论。在甜菜叶上进行了一些淀粉生物合成和相关酶的研究[17- - - - - -19].然而,有关甜菜根中淀粉合成相关基因的表达和酶活性的研究目前尚未见报道。
本研究的目的是,在一个发育周期内,研究储存化合物的性质,以及淀粉生物合成的核心基因和酶在甜菜和防风草(Pastinaca漂白亚麻纤维卷).甜菜根和防风草根具有相似的性状和形态,但其主要贮藏物质不同。在温室中种植甜菜和防风草,并在两个不同的发育时间点采集样本。在这两个时间点,分别在白天的光照结束时和黑暗结束时采集样本,以监测潜在的昼夜变化。比较研究了两种植物根系的碳分配、淀粉积累必需基因的表达和主要淀粉生物合成酶的活性。
本研究对海甜菜进行了贮藏化合物分析,以分析缺乏淀粉是否是这种野生祖先的保守性状。我们的研究结果表明,必需淀粉生物合成基因的转录和活性淀粉生物合成酶的存在,但没有淀粉积累在甜菜根。这意味着甜菜根中淀粉的缺乏及其碳分配并不是导致淀粉途径的基因功能的简单损失。
结果
结构研究
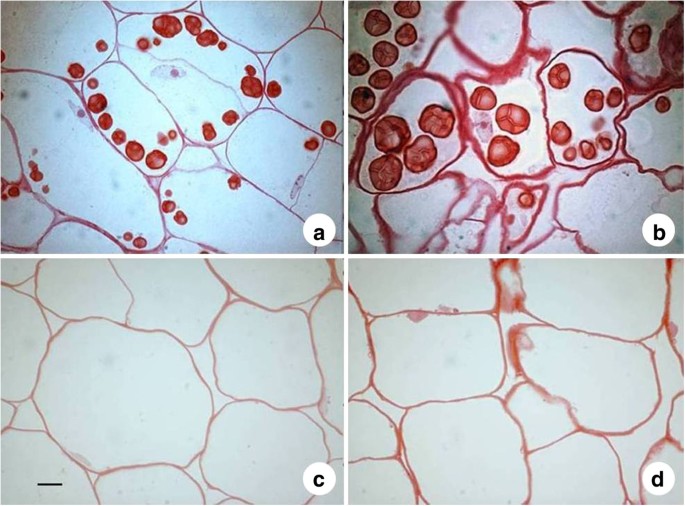
进行了结构研究,以便在细胞水平上比较不同的物种和亚种。这样做是为了确认其他测量,如成分研究和对样品进行时间区分,以验证材料处于储存积累阶段。用塑料包埋防风草和甜菜的根和叶组织,用一般组织化学染色和特异性组织化学染色对切片进行了研究。
研究表明,甜菜和防风草抽根细胞在活跃贮藏积累之前的细胞早期发育具有结构相似性(图1).在防风草和甜菜中,早期的抽根细胞都是空泡化的,与后期相比,细胞的大小已经很大了。在防风草抽头根中,小的初始淀粉颗粒被液泡转移到细胞外围,液泡占据了细胞的大部分空间。随着进一步发育,防风草根系细胞通过淀粉粒增大积累更多的淀粉。在研究的两个收获时间点,甜菜根细胞中均未检测到淀粉颗粒。甜菜根细胞的不同样品在细胞大小上没有明显差异,但细胞壁在发育过程中变厚。特别是在晚期样品中,β-葡聚糖在细胞壁中积累(结果未显示)。甜菜根细胞液泡在生长过程中保持相对大小,而防风草则相反,生长中的淀粉颗粒占细胞体积越来越大(图1).
对甜菜的起源——海甜菜的均质根组织进行了淀粉粒检测。光镜检查未发现任何类似淀粉颗粒的结构(结果未显示)。
防风草和甜菜的叶片表现出与任何其他光合来源组织一样的行为。叶片组织显示出白天的变化,光合作用中产生的过量蔗糖在光照期以淀粉的形式储存,随后随着蔗糖的重新合成而降解,并在黑暗期运输到植物的其他部位(附加文件)1).
时间点根发育与化合物积累
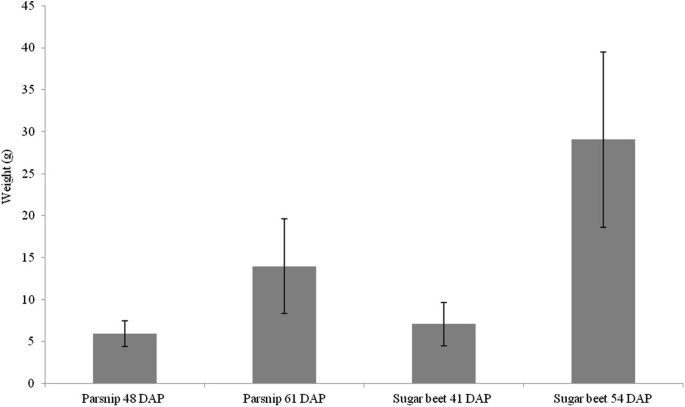
在两个不同的时间点测量鲜重和干重,以确定采样根处于持续积累的阶段。在甜菜根的组织切片上,可以看到3-5个次生形成层环(附加文件)2).一个成熟的甜菜根由大约12个二级形成层环组成,其中前8个形成层环在前8周发育[20.].我们的研究结果证实了植物样本是本研究的合适材料。在一个光照期结束时和随后的黑暗期结束时对丝锥根进行采样。没有考虑到个体体重测量的结果,因为在光照期后的收获与随后的黑暗期后的收获之间,鲜重没有发现差异。正如预期的那样,两种植物的抽根鲜重都随着时间的推移而增加2).防风草抽头根的干重从平均14%增加到平均20%,而甜菜抽头根的干重也从15%增加到19%(结果未显示)。
甜菜和防风草抽根中的糖和淀粉
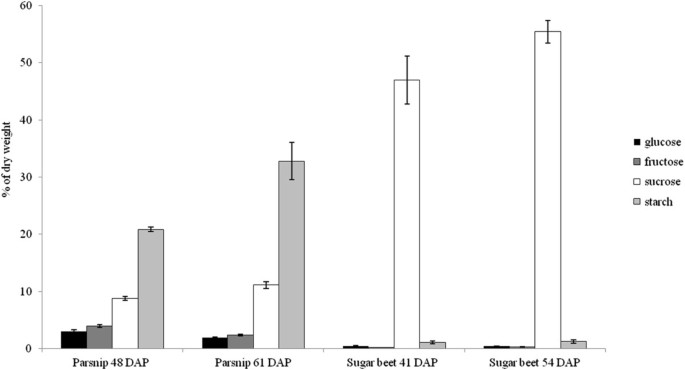
分析了两种植物丝根的糖含量、组成和淀粉含量(图3.).甜菜和防风丝根具有不同的贮藏成分。
甜菜几乎只储存蔗糖,其中己糖和潜在淀粉只占干重的很小比例,而防风草储存了相当数量的淀粉、蔗糖和己糖。
测定了甜菜根和防风根中糖(葡萄糖、果糖和蔗糖)和淀粉的含量,并以干重物质百分比计算。同一发育时间点的浅色和深色丝根样品之间没有差异。因此,将结果与甜菜41 DAP、甜菜54 DAP、防风48 DAP和防风61 DAP组合。在这两个时间点,甜菜的淀粉含量在干重的1%左右都不显著。糖含量从41 DAP的48%增加到54 DAP的56%。甜菜根中超过98%的糖是蔗糖,只能检测到非常少量的果糖和葡萄糖(图3.).防风草抽头根淀粉含量从48dap时的21%增加到61 DAP时的33%。对于两种样品,防风草抽根的糖含量相对稳定,约为干重的15%3.).
除蔗糖外,在防风草中还发现了大量的己糖。在糖中,蔗糖的比例在第二个时间点从56%增加到72%。结果,己糖的比例随着发育而下降,葡萄糖从19%下降到12%,果糖从25%下降到16%。
蛋白质的提取
从甜菜和防风根中提取可溶性蛋白,进一步分析淀粉生物合成中涉及的酶活性。与甜菜样品相比,防风草样品的鲜重蛋白质浓度大约是甜菜样品的两倍,收获时间点之间波动很小(结果未显示)。
甜菜和防风根中淀粉生物合成酶的活性
研究了防风草和甜菜根粗蛋白提取物中淀粉生物合成途径中主要酶的活性。四种酶在淀粉体中支链α-葡聚糖的构建中起关键作用;磷酸葡萄糖转化酶(PGM), adp -葡萄糖焦磷酸化酶(AGPase),淀粉合酶(SS)和淀粉分支酶(SBE)。在防风草和甜菜根样品中都可以检测到所有四种酶的活性(表2)1).由于不同品种中可提取蛋白质水平的差异,观察到的酶活性水平在鲜重水平上的波动比在蛋白质水平上的波动更明显。
在细胞质和细胞质中可以发现磷酸葡萄糖转换酶的活性。在甜菜和防风根中检测到PGM活性,每蛋白质水平的活性相似(表2)1).不能确定活性是否来源于细胞质和/或质体。
AGPase酶活性在防风草和甜菜样品中与每蛋白质水平的酶活性相似(表2)1).在不同收获时间点之间,AGPase活性没有变化。
防风草和甜菜维持相当水平的淀粉合酶每蛋白质水平导致沉淀α-葡聚糖(表1).
各品种样品均表现出淀粉分枝酶活性。甜菜每μg蛋白的SBE活性水平为防风草中SBE活性水平的38% ~ 61%。晚期防风草的淀粉分枝酶活性水平普遍高于甜菜(表2)1).
淀粉积累重要基因的表达
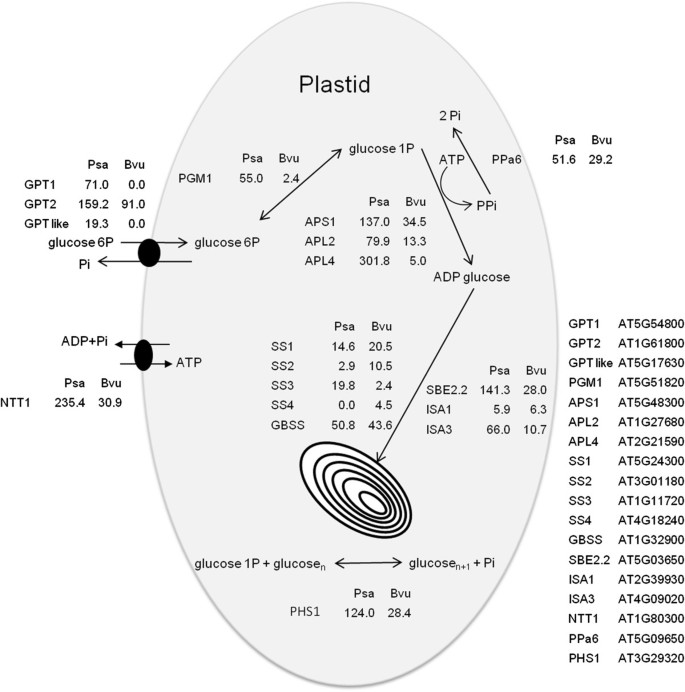
比较了甜菜(54 DAP)和防风草(61 DAP)在积极贮藏积累阶段根系组织的转录组。这一分析表明,所有编码淀粉生物合成酶的主要基因或编码己糖-磷酸转化的基因都在甜菜丝根中表达,即使没有产生淀粉(图4).
防风草和甜菜编码淀粉积累功能基因的表达水平。的参考程序集上映射的Illumina HiSeq 2000每百万次读取(RPM)的tap-root读取数p .漂白亚麻纤维卷(Psa)和b .寻常的(Bvu)对应于参与淀粉积累功能的不同cdna。最接近的同源拟南芥图中给出了BLASTx的位点。GPT -葡萄糖磷酸转运蛋白、PGM1 -塑化磷酸葡萄糖转化酶、APS - ADP-葡萄糖焦磷酸化酶小亚基、APL - ADP-葡萄糖焦磷酸化酶大亚基、SS -可溶性淀粉合成酶、GBSS -颗粒结合淀粉合成酶、SBE -淀粉分支酶、ISA -异淀粉酶、PHS -淀粉磷酸化酶、NTT - ATP/ADP转运蛋白和PPa6 -塑化焦磷酸化酶。
磷酸葡萄糖转换酶(PGM)以胞质和可塑性两种形式存在,来源于不同的基因,其中可塑性形式已被证明对双子代淀粉合成很重要[21,22].转录组数据分析表明,与甜菜相比,防风草中PGM的可塑性形式多23倍(图2)4).在甜菜中,编码adp -葡萄糖焦磷酸化酶(AGPase, APL)大亚型基因的表达量明显低于防风草。此外,在甜菜中发现的小亚基(APS)转录本比大亚基的转录本更多,这与防风草中发现的大亚基映射读数更多的情况相反(图4).在防风草和甜菜中,大小亚基转录本之比分别为2.79和0.53。在甜菜中主要表达淀粉合酶1和2 (SS1和SS2),而在防风草中主要表达淀粉合酶1和3 (SS1和SS3)。颗粒结合淀粉合酶(GBSS)在甜菜和防风草中的表达水平相当。甜菜和防风草抽根中均有淀粉分支酶2 (SBE2.2)基因表达,但未发现分支酶1 (SBE1)基因表达。对淀粉调节很重要的基因,异淀粉酶(ISA1和ISA3)以及淀粉磷酸化酶(PHS1)在两个物种中都有表达。ISA1在防风草中表达水平相当,但ISA3(6倍)和PHS1(4倍)更丰富。编码淀粉合成支持活性的基因通常在防风草中高表达。在防风根中共鉴定出3个编码葡萄糖磷酸盐转运蛋白(GPT)的基因,其中2个基因在甜菜根中完全缺失。一个编码ATP/ADP转位器(NTT1)的基因在两个物种中都被发现表达,但在防风草中表达量高出8倍(图4).一个编码可塑性焦磷酸化酶(PPa6)的基因在防风草中含量略高,其比例接近2:1。还研究了与淀粉降解和水解典型相关的基因的表达水平(表2)2).α-淀粉酶和β-淀粉酶基因在防风草中表达量较高,β-淀粉酶基因在甜菜和防风草中表达量较高存在差异。综上所述,防风草中α-和β-淀粉酶基因的表达量较高。α-葡聚糖、水二激酶/磷酸葡聚糖、水二激酶(GWD/PWD)和歧化酶(DPE)基因在防风草中表达量较高。
讨论
本研究旨在研究甜菜和防风抽根发育过程中的碳储量积累。此外,我们还研究了淀粉生物合成酶活性的存在或缺乏,以及相应基因的表达,这可能解释了两种植物贮藏策略的差异。由于防风草部分储存淀粉,而甜菜储存蔗糖,这两个物种之间的比较将更好地了解这些地下储存组织中的碳分配,也将更好地了解控制两种不同碳储存化合物积累的遗传和酶因素。
采样的两个时间点是在假设根处于早期积累阶段时选择的,以确保槽细胞的填充正在进行。甜菜在相当早期的阶段就被认为是完全活跃的[23].据我们所知,在这方面还没有研究过防风草。一般而言,防风草的发芽速度比甜菜慢,这是导致其比甜菜晚7天收获的原因。测量结果证实,这些植物是在持续的累积阶段收获的。
在根和块茎贮藏器官发育的早期,细胞主要由一个大液泡组成。液泡中含有糖,糖被用作细胞增殖和扩张的能量和积木。幼根细胞中的小淀粉粒在这个阶段被移向细胞壁。在发育过程中,细胞由器官的结构扩张转变为储存积累,大部分细胞转为储存淀粉粒或油滴等,液泡逐渐被压缩[24- - - - - -26].甜菜根的细胞似乎不同于其他典型的地下贮藏器官,处于幼年贮藏器官阶段,以充满蔗糖的液泡为主要成分。
对组织样本的调查为牙根细胞中淀粉颗粒的存在与否提供了直观证据。观察到防风草抽根细胞在生长过程中淀粉颗粒增大,液泡变小,证实了淀粉生物合成酶活性的活跃。然而,甜菜保持相对液泡大小,而细胞壁增厚,没有可见的淀粉颗粒形成。
在光合源细胞中产生的蔗糖被运输到库细胞,在那里蔗糖裂解酶(蔗糖合酶和蔗糖转化酶)将蔗糖在不同的亚细胞区室中转化为己糖。甜菜根中的己糖被认为是通过蔗糖磷酸合酶和蔗糖磷酸磷酸酶重新合成蔗糖,然后转运到液泡中[9,27- - - - - -29].我们对糖成分的测量显示,在发育中的甜菜根中,几乎只有蔗糖积累和极低水平的己糖。在甜菜根中存在或积累的极低水平的己糖表明,要么蔗糖被非常快速地加工成储存的蔗糖,要么蔗糖有一个直接的运输途径进入储存液泡,而不需要事先降解和重新合成运输的蔗糖。
在典型的淀粉积累植物中,如马铃薯,己糖作为己糖磷酸盐被运输到淀粉体中,在那里它被用来合成淀粉。淀粉的积累是对蔗糖有效性的反应,因此马铃薯块茎中不储存己糖[30.].在我们的实验中,防风草的糖成分分布在己糖和蔗糖的更均匀的部分,这表明防风草的牙根不是一个纯粹的淀粉储存器官,而是介于甜菜和典型的淀粉积累器官之间。与甜菜和马铃薯等典型的蔗糖或淀粉积累器官相比,防风根中己糖的存在反映了其淀粉合成和蔗糖积累的效率较低。防风草根中的己糖可能表明淀粉和蔗糖之间正在进行相互转化。
几个参与淀粉生物合成的基因已经被分离出来并在甜菜中进行了研究,尽管这是在光合结构方面进行的。从表达序列标签(EST)数据库中可以找到甜菜中与淀粉生物合成相关的其他表达基因。对甜菜叶片组织的结构研究通过说明光合组织产生淀粉的日常能力,支持淀粉生物合成酶活性的存在。然而,据我们所知,到目前为止,还没有针对甜菜丝根中淀粉生物合成相关的表达基因或酶活性的存在或缺乏的研究,可以解释这些结构中淀粉的完全缺失。我们酶学研究的目的主要是确定淀粉生物合成酶活性的存在与否,令人惊讶的是,我们的研究表明甜菜根具有良好的主要淀粉生物合成酶活性,但没有淀粉积累。参与支链葡聚糖合成的四种酶PGM、AGPase、SS和SBE均在甜菜丝根中具有活性,且与防风草丝根具有相同的活性数量级。通过比较甜菜和防风丝根中编码这些淀粉合成关键酶的基因的表达量,可以看出这些基因的表达量大多在同一数量级内。例外的是编码可塑性磷酸葡萄糖酶和adp -葡萄糖焦磷酸化酶的大亚基的基因。然而,这并不能解释甜菜根中完全缺乏可见的淀粉颗粒。例如,这两个基因的突变或沉默以及拟南芥和豌豆的转基因沉默研究显示淀粉含量低,但淀粉积累并未完全丧失[31- - - - - -33].与本研究相似,在评估Bellin等人的补充信息时,可以发现这些关键酶编码的一些基因的表达与甜菜中的表达相同。[20.].一般来说,淀粉合成的支持功能,如编码己糖磷酸盐转运体的基因和ATP形式的能量,在甜菜中比在防风草丝根中表达较少,尽管只有几个转录本完全缺乏表达。一个例子是编码具有推定葡萄糖6-磷酸转运功能的蛋白质的基因,但尚未完全破译究竟是哪些基因在编码各种转运功能。发现甜菜根完全缺乏对应于两种形式的转录本的映射reads,这两种形式可以预测具有相关的运输功能,但在防风草根中可以找到表达。
许多关于α-1,4键与α-1,6分支的分支聚合结构的重要基因和酶的研究已经发表。淀粉颗粒的形成比长支链葡萄糖聚合物的生产更为复杂。为了将长而分支的葡萄糖分子组织成组织良好的颗粒,需要进行去分支活动来修剪葡聚糖,从而构建颗粒[34- - - - - -36].去分支活性的作用尚不完全清楚,但已有研究表明,在糖-1突变玉米胚乳中,去分支酶的缺乏与植物糖原的积累成正比,植物糖原是一种高度分支的水溶性葡聚糖[37].本研究发现,编码淀粉粒形成的关键酶异淀粉酶的基因在甜菜和防风根中均有表达。去分支酶和其他淀粉水解酶的活性先前已在甜菜丝根中被报道和描述[38,39].从这些信息也可以推测,甜菜丝根中淀粉积累不足可能是由于α-葡聚糖或淀粉降解酶基因的高表达。对编码与淀粉降解和水解相关的酶的基因转录本的检查显示,与防风草相比,甜菜中的淀粉含量较低,这可能表明任何淀粉的快速转化。
即使是被认为不含淀粉的块根作物,如胡萝卜,淀粉也会积累。40].事实上,在不产生淀粉的甜菜根中,与淀粉途径相关的如此程度的表达和活性是有趣的。
结论
综上所述,尽管结构分析和化学分析未发现淀粉的存在,但在甜菜中淀粉生物合成的主要参与者的基因表达和酶活性可以被发现。尽管有些基因在甜菜根中表达较少,但完全缺乏淀粉颗粒不能用这些结果来解释。因此,肯定有另一种或多种机制可以阻止甜菜在牙根中产生淀粉,牙根是地下水槽器官的默认存储化合物。淀粉是一种节能的储存形式,由于不溶性淀粉颗粒与可溶性蔗糖相比。在一年到下一年的贮藏阶段,甜菜丝根需要保持能量势,以保持液泡中高浓度的蔗糖,相对于细胞质中的75mm蔗糖,前者为500mm蔗糖[12].这种明显的基于蔗糖的能量消耗储存策略可能是祖先海甜菜盐碱化生长条件的结果,在那里,高蔗糖浓度对防止盐进入细胞很重要。因此,海甜菜中糖的储存可能是其环境适应的结果,从淀粉积累的tap-root祖先进化而来。因此,甜菜丝根中淀粉生物合成途径基因和酶活性的一般表达可以看作是一种没有现有功能的遗传遗存。
方法
植物材料
甜菜籽(普通贝塔。altissima,“秃子”)和海甜菜(普通贝塔。maritima)由瑞典阿尔纳普的北欧遗传资源中心提供。
防风草种子(Pastinaca漂白亚麻纤维卷“白色宝石”)在网上购买,网址为Fröhandel,朱丽塔,瑞典,http://www.impecta.se.
生长条件,鲜重和干重
防风草和甜菜种子于春季在温室中播种于2升花盆中。这些植物定期施肥和浇水。叶片和抽根分别在2个时间点取样,每个时间点分别在光照期末和暗期末取样。防风草在种植后48天和61天进行采样。在41 DAP和54 DAP对甜菜进行了取样。测定初生根鲜重。干重测定采用冷冻干燥法(n > =3),直至无重量变化(≈72小时)。植物组织被冷冻在液氮中,并储存在−80°C下,以供进一步研究。
海甜菜在气培系统中栽培[253个月后采集样本。
结构研究
固定和塑料嵌入
对欧洲防风草和甜菜的新鲜根和叶进行固定和塑料包埋,如前所述[25].
切片染色概述
亚甲基蓝-蓝a -红素O (MAS)三染色,可见蛋白质、脂质和淀粉,以获得嵌入的牙根组织的概况[41,42].
切片淀粉染色
为了染色淀粉,将叶片切片用50%的Lugol 's溶液(Scharlau, Barcelona, Spain)覆盖1分钟,用水冲洗,风干,并用Biomount (British Biocell, Cardiff, UK)安装。
在光学显微镜下研究MAS和Lugol染色切片(Leica Microsystems, Wetzlar, Germany)。
均质组织淀粉染色
均匀化的海甜菜根组织铺在显微镜载玻片上,加入卢戈尔溶液。染色组织在光学显微镜下进行研究(Leica Microsystems, Wetzlar, Germany)。
β葡聚糖
使用荧光色素Calcofluor White(荧光增白剂28,Sigma Aldrich, St. Louis, MO, USA)在420 nm处观察β-葡聚糖[43,44].切片用0.0001% calcoflor覆盖10分钟,用dH冲洗2O,安装Mowiol 4-88 (La Jolla, CA, USA) [45在荧光显微镜下进行研究(Leica Microsystems, Wetzlar, Germany)。作为对照,研究了未染色切片的自体荧光。
淀粉和糖分析
由于测量是在整个根均质上进行的,因此获得的值的一小部分来自细胞的非存储部分,如细胞壁或非存储细胞隔室。此外,在测量淀粉时,所使用的方法也可能包括其他α-葡聚糖,例如植物糖原。
该分析是一种标准化方法,SCAN-P 91:09,被斯堪的纳维亚纸浆、纸张和纸板行业推荐使用。
将甜菜和防风草根组织冷冻干燥并在砂浆中研磨均质。将匀浆液溶解在适当体积的ddH中进行淀粉测定2O,经两步酶促过程水解为葡萄糖[46].用离子交换色谱仪(Bioscan, Metrohm, Herisau, Switzerland) Colonn Metrosep Carb1,进样量6 μl,洗脱液0.2 M NaOH,流速1 ml/min,环境温度,检测器PAD(脉冲安培检测)检测葡萄糖。该方法测定样品中α-葡聚糖(如淀粉和植物糖原)的总量。
对于糖分析,将100 mg冷冻干燥的匀浆溶解在1 ml 80%乙醇中,并在−20°C下提取两周。糖的分析是在离子交换色谱仪(Bioscan, Metrohm, Herisau,瑞士)上进行的,使用与淀粉分析相同的设置和程序。以已知浓度和组成的糖溶液为标准进行分析。
蛋白质提取与测定
粗蛋白提取物是通过在混合机(MM400, Retsch GmbH, Haan, Germany)的不锈钢容器中均质根组织,在液氮中预冷冻以保持组织冷冻和酶活性完整而获得的。根据从提取缓冲液中排除牛血清白蛋白的改进方案从细粉中提取蛋白质[47].提取液按等分,在液氮中快速冷冻,并在−80°C保存。蛋白质浓度由BCA蛋白测定-还原剂兼容(Pierce, Rockford, IL, USA)测定。
淀粉生物合成酶的测定
Phosphoglucomutase
用分光光度耦合法测定PGM活性。葡萄糖-1-磷酸(G1P)的转化由PGM催化,得到的葡萄糖-6-磷酸(G6P)随后由葡萄糖-6-磷酸脱氢酶催化成6-磷酸葡萄糖酸盐。与第二反应平行,NADP被还原为NADPH,在340 nm [48].将20 μg粗蛋白提取液加入底物溶液中,分别测定2、5、10、15、25分钟后340 nm处吸光度的变化。在与样品相同的条件下,通过测定不同浓度的磷酸葡萄糖转化酶(来自兔子肌肉的磷酸葡萄糖转化酶,P3397, SIGMA Aldrich,圣路易斯,密苏里州,美国)制成标准曲线。通过从底物中排除G1P来检测该方法的特异性。酶活以可溶性粗蛋白(ng) / min G1P转化为G6P (μmol)计算。
ADP-glucose焦磷酸化酶
AGPase活性测定[4920 μg粗蛋白。分别在0、30和90分钟后测量样品。
AGPase催化ATP和G1P转化为adp -葡萄糖和焦磷酸盐(PPi)的反应。该方法测定了无机焦磷酸酶裂解产生PPi后的磷酸盐含量。将不同浓度的KH混合制成磷酸盐的标准曲线2阿宝4用Mg-Am染色,并按照测定方法中的测量程序。粗蛋白提取物中磷酸盐含量的测定方法是将粗酶提取物在60℃下失活10分钟,然后按照标准曲线所描述的方法测量样品。灭活粗提物用无机焦磷酸酶孵育,然后按标准曲线测定磷酸盐含量,测定本底含量。酶活以每分钟可溶性粗蛋白(μg)产生的adp -葡萄糖(nmol)计算。
通过分别和联合从底物中排除G1P和ATP,以确定并排除胞质udp -葡萄糖焦磷酸化酶活性,检测该方法的特异性。
可溶性淀粉合成酶
测定粗根蛋白提取物(10 μg)的淀粉合酶活性。通过测量0、30、90和120分钟后的活动来计算。淀粉合酶试验如前所述进行,但进行了小的修改,其中底物溶液中的支链淀粉被交换为糖原[50].95℃终止反应2分钟,按方案沉淀洗涤,用1 ml ddH溶解2O.将5ml闪烁混合物(Ultima-Flo M, Packard, Perkin Elmer, Waltham, MA, USA)添加到0.5 ml溶解淀粉产品中,并在液体闪烁计数器(Philips PW 4700, Eindhoven, the Netherlands)中测量放射性。淀粉合酶活性以每分钟adp -葡萄糖转化为淀粉的量和μg总蛋白计算。
淀粉分枝酶
粗蛋白提取物(10 μg)测定淀粉分支酶活性[51作了一些修改。在底物中添加糖原(3 μg)作为葡聚糖链的引物。对照反应不包括磷酸化酶a,以排除提取物中可能的内源性磷酸化酶活性。如淀粉合酶试验所述,进行放射性沉淀、溶解和计数。通过测量0、60和90分钟后的活动来计算。淀粉分枝酶活性以每分钟葡萄糖-1-磷酸转化为分枝淀粉的量和μg总蛋白计算。
转录组测序和分析
总RNA提取
样品取自第二次取样的甜菜(54 DAP)和防风草(61 DAP)。用植物RNA试剂(Invitrogen, Life technologies Ltd, Carlsbad, CA, USA)分别从三个混合个体的根或叶组织匀浆中提取总RNA。浓度在NanoDrop (NanoDrop™1000分光光度计,Thermo Scientific, Waltham, MA, USA)上测量,质量在1.2%的E-gel (Invitrogen, Life Technologies Ltd, Carlsbad, CA, USA)上确认。
cDNA文库合成
DNA测序和数据处理由Eurofins提供服务。分别从甜菜和防风草的混合叶片和丝状根mRNA中提取了两个归一化随机引物cDNA文库。随后使用Roche GS FLX Titanium系列化学技术对每个cDNA文库进行½段的测序。
Trancriptome分析
经过质量分析后,将通过的reads组装成contigs,将甜菜和防风草的contigs分别收集到一个参考文件中。甜菜通过531,058个reads,防风草通过563,841个reads。
从甜菜和防风草的丝根mRNA中分别获得了2个带有条形码适配器的3'片段cDNA文库。随后使用Illumina HiSeq 2000技术对两个样本进行测序,总共使用一个通道。甜菜通过了24,586,598次质量分析,防风草通过了39,749,856次质量分析。下一步,Illumina reads被组装并用于改进Roche GS FLX Titanium测序和组装后产生的参考文件,其中contigs由来自两组测序的数据组成。
通过的Illumina读数被映射到甜菜和防风草的最终参考文件。将映射到每个contig上的读取数与映射到其他contig上的读取数相比较,可以估算出对应于特定contig的基因表达。由于只有3'片段用于映射,这本身就导致了每个转录本的读取规范化。因此,每个转录本的基因表达都表示为每百万次读取的特定contig (RPM)的映射读取数。
缩写
- est序列:
-
表达序列标签
- 衣冠楚楚的:
-
种植后天数
- 的PGM:
-
Phosphoglucomutase
- AGPase:
-
ADP-glucose焦磷酸化酶
- SS:
-
淀粉合成酶
- SBE:
-
淀粉分支酶。
参考文献
- 1.
Olsson H, Sun C, Palmqvist S, Boren M, Jansson C: SUSIBA转录因子参与淀粉生物合成,并在大麦中有差异表达。中国生物医学工程学报,2003,23 (2):322 -
- 2.
于BY, Gruber M, Khachatourians GG, Hegedus DD, Hannoufa A:发育中的甘蓝型油菜种子与主要贮藏化合物变化的基因表达谱分析。中国植物科学,2010,44(4):381-389。10.1016 / j.plantsci.2010.02.007。
- 3.
Biancardi E, De Biaggi M, Skaracis GN, Campbell LG:甜菜的遗传和育种。2005, Enfield, NH,美国:科学出版社
- 4.
关于糖的一些事情:它的历史、生长、生产和分销。1917年,美国加州旧金山:JJ·纽贝京
- 5.
农业企业手册:甜菜白糖。[http://www.eastagri.org/publications/pub_docs/4_Sugar_web.pdf]
- 6.
甜菜新品种成分考虑的共识文件:主要食物和饲料营养素和抗营养素。[http://www.olis.oecd.org/olis/2002doc.nsf/LinkTo/env-jm-mono (2002) 4]
- 7.
Godt D, Roitsch T:蔗糖裂解酶在甜菜根中的发育和器官特异性表达表明了在根根中,韧皮部在质外和质外卸载之间的过渡。植物物理学报,2006,44(11-12):656-665。
- 8.
维奥拉R, Alison GR, Haupt S, Gazzani S, Hancock RD, Nelson M, Gordon CM, Oparka KJ:马铃薯的结节化涉及到韧皮部从异型到异型卸载的转换。植物学报,2001,13(2):385-398。10.1105 / tpc.13.2.385。
- 9.
蔗糖在甜菜中的转运和储存。植物科学进展,2004,27(5):528 - 528。10.1104 / pp.63.5.828。
- 10.
Lohaus G, Burba M, Heldt HW:甜菜高、低糖杂交种叶片、韧皮部液和主根中蔗糖和氨基酸含量的比较。实验学报,1994,45(8):1097-1101。10.1093 / jxb / 45.8.1097。
- 11.
Schulz A, Beyhl D, Marten I, Wormit A, Neuhaus E, Poschet G, Büttner M, Schneider S, Sauer N, Hedrich R:由液泡转运体SUC4和TMT1/2提供质子驱动的蔗糖symport和antiport。植物学报,2011,29(3):344 - 344。10.1111 / j.1365 - 313 x.2011.04672.x。
- 12.
孙晓明,李志强,李志强,等:甜菜主根组织中蔗糖吸收与区室化的关系。植物营养学报,2003,22(1):1-6。10.1104 / pp.72.1.1。
- 13.
Martin C, Alison MS:淀粉生物合成。植物生理学报,2004,27(3):344 - 344。10.1105 / tpc.7.7.971。
- 14.
史密斯AM,丹尼尔K,马丁C:淀粉颗粒的合成。植物物理学报,1997,48(1):67-87。10.1146 / annurev.arplant.48.1.67。
- 15.
Buléon A, Colonna P, Planchot V, Ball S:淀粉颗粒:结构和生物合成。中华生物医学杂志,1998,23(2):85-112。10.1016 / s0141 - 8130(98) 00040 - 3。
- 16.
Sakalo VD, Kurchii VM:内源蔗糖对甜菜叶片碳水化合物代谢的调控。文化生物学报,2007,39(6):506-513。
- 17.
饶文敏,李志强,李志强,李志强。甜菜叶片磷含量、光合作用和碳分配:3。碳分配和碳输出的日变化。中国植物学报,1990,20(1):29-36。10.1104 / pp.92.1.29。
- 18.
杨晓明,王晓明,王晓明,王晓明。植物叶片中淀粉生物合成的调控:adp葡萄糖焦磷酸化酶的活化与抑制。植物科学进展,2004,27(3):417-427。10.1104 / pp.43.3.417。
- 19.
李波,李文杰,李文杰:甜菜叶片淀粉和蔗糖合成的昼夜节律调控。中国农业科学,2004,27(4):457 - 457。10.1104 / pp.99.4.1393。
- 20.
Bellin D, Schulz B, Soerensen TR, Salamini F, Schneider K:甜菜不同生育期和根尖区转录谱分析及其发育代谢途径实验学报,2007,58(3):699-715。
- 21.
周亚平,周丽娟,周丽娟,周丽娟。拟南芥可塑性磷酸葡萄糖转化酶的研究进展。在代谢控制中起重要作用的可逆酶反应。植物营养学报,2000,22(4):344 - 344。10.1104 / pp.122.4.1193。
- 22.
Tauberger E, Fernie AR, Emmermann M, Renz A, Kossmann J, Willmitzer L, Trethewey RN:马铃薯块茎淀粉体以葡萄糖-6-磷酸的形式从细胞质中导入碳的反义抑制提供了有力的证据。植物学报,2000,23(1):43-53。10.1046 / j.1365 - 313 x.2000.00783.x。
- 23.
王晓明,王晓明,王晓明,等:甜菜根系功能分化对根系发育阶段变化的影响。中国生物医学工程学报,2009,35(1):344 - 344。10.1111 / j.1399-3054.2008.01169.x。
- 24.
马铃薯块茎韧皮部脱落。atp酶的途径和位点。中国生物医学工程学报,1998,31(3):379 - 379。10.1007 / BF01282983。
- 25.
Turesson H, Marttila S, Gustavsson K-E, Hofvander P, Olsson ME, Bülow L, Stymne S, Carlsson AS:香莎草(莎草科)块茎中油脂和淀粉积累的表征:一种研究非种子组织油脂储备的新模型系统。学报学报,2010,37(4):344 - 344。10.3732 / ajb.1000200。
- 26.
徐旭,Vreugdenhil D, Lammeren AAM:马铃薯块茎形成过程中的细胞分裂和细胞扩大。应用物理学报,1998,29(3):344 - 344。10.1093 / jxb / 49.320.573。
- 27.
王晓明,王晓明,王晓明,等。甜菜贮藏根中糖转运和代谢酶的研究。altissima)。植物营养学报,2000,26(2):326 - 326。10.1016 / s0176 - 1617(11) 80084 - 2。
- 28.
王晓明,王晓明,王晓明,王晓明:甜菜蔗糖-磷酸合酶基因的克隆与表达分析(普通β, L。).中国生物医学工程学报,2004,24(4):515-520。10.1007 / BF00293155。
- 29.
Klotz KL, Finger FL:蔗糖合成酶异构体与蔗糖分解代谢在甜菜根发育中的作用。中国农业科学,2002,39(1):1-24。
- 30.
马铃薯块茎生长过程中蔗糖到淀粉转化的调控。应用物理学报,2003,29(3):344 - 344。10.1093 / jxb / erg074。
- 31.
林婷萍,Caspar T, Somerville CR, Preiss J:拟南芥(Arabidopsis thaliana) adp葡萄糖焦磷酸化酶活性低的淀粉缺乏突变体缺乏该酶的两个亚基之一。植物营养学报,2004,18(4):344 - 344。10.1104 / pp.88.4.1175。
- 32.
Harrison CJ, Mould RM, Leech MJ, Johnson SA, Turner L, Schreck SL, Baird KM, Jack PL, Rawsthorne S, Hedley CL, Wang TL:豌豆的rug3基因座编码plasdial phosphoglugmutase。植物营养学报,2000,22(4):357 - 357。10.1104 / pp.122.4.1187。
- 33.
于天生,吕文林,王淑梅,陈娟:拟南芥质体磷酸葡萄糖异构酶突变对叶片淀粉合成和花起始的影响。中国植物学报,2000,23(1):319-326。10.1104 / pp.123.1.319。
- 34.
Hussain H, Mant A, Seale R, Zeeman S, Hinchliffe E, Edwards A, Hylton C, Bornemann S, Smith AM, Martin C, Bustos R:异淀粉酶的三种亚型对马铃薯葡聚糖的去分支有不同的催化性能。植物学报,2003,15(1):133-149。10.1105 / tpc.006635。
- 35.
Burton RA, Jenner H, Carrangis L, Fahy B, Fincher GB, Hylton C, Laurie DA, Parker M, Waite D, Van Wegen S, Verhoeven T, Denyer K:淀粉粒启动和生长在缺乏异淀粉酶活性的大麦突变体中发生改变。植物学报,2002,31(1):97-112。10.1046 / j.1365 - 313 x.2002.01339.x。
- 36.
黄桂生,郭波,王俊林,陈建林,陈建林,陈建林,陈建林:水稻糖-1突变体胚乳支链淀粉和植物糖原的结构与性质。粮食科学,2003,37(2):139-149。10.1006 / jcrs.2002.0485。
- 37.
潘d,纳尔逊OE:在玉米的糖-1突变体胚乳的去分支酶缺乏。植物营养学报,2004,27(2):324- 324。10.1104 / pp.74.2.324。
- 38.
Masuda H, Takahashi T, Sugawara S:甜菜成熟根中淀粉水解酶的纯化及其性质。中国植物学报,2004,27(2):366 - 366。10.1104 / pp.84.2.361。
- 39.
采后蔗糖在甜菜根组织中降解的酶。植物营养学报,2004,27(3):357 - 357。10.1104 / pp.53.3.507。
- 40.
缓冲剂G:胡萝卜根中淀粉的积累和降解。科学通报,2013,30(3):344 - 344。
- 41.
Heneen W, Karlsson G, Brismar K, Gummeson P-O, Marttila S, Leonova S, Carlsson A, Bafor M, Banas A, Mattsson B, Debski H, Stymne S:燕麦籽粒胚乳中油体融合。植物学报,2008,228(4):589-599。10.1007 / s00425 - 008 - 0761 - x。
- 42.
何文华,李世林j:植物组织半薄环氧切片染色方法的改进。生物技术组织化学,1976,51(3):179-185。10.3109 / 10520297609116696。
- 43.
Izawa M, Takashio M, Koshino S:影响钙氟流动注射分析法测定β-葡聚糖含量的几个新因素。环境科学学报,2004,27(5):371-374。10.1002 / j.2050-0416.1995.tb00875.x。
- 44.
欧提欧K,萨尔门卡利奥-马蒂拉M:谷物,面团和面包的光学显微镜研究。Lebensmittel-Wissenschaft und-Technologie。2001, 34(1): 18-22。10.1006 / fstl.2000.0725。
- 45.
李志刚,李志刚,李志刚。大麦花器官中防御相关蛋白的免疫定位。中国植物学报,2005,26(3):344 - 344。
- 46.
王志强,王志强,王志强,等。植物性食品中膳食纤维非淀粉多糖含量测定方法的改进。中国肛肠化学杂志,1998,21(4):344 - 344。
- 47.
甜爱LJ, Burrell MM, apRees T:转基因马铃薯(Solanum tuberosum)块茎adp葡萄糖焦磷酸化酶升高的特性。中国生物工程学报,1998,29(4):489 - 497。
- 48.
王志刚,王志刚,王志刚:酵母磷酸葡萄糖转化酶的纯化及其性质研究。中国生物医学工程学报,1997,26(1):1 - 6。10.1111 / j.1432-1033.1975.tb02282.x。
- 49.
Fusari C, Demonte AM, Figueroa CM, Aleanzi M, Iglesias AA:一种测定adp -葡萄糖焦磷酸化酶的比色法。中国生物医学工程学报,2006,36(1):344 - 344。10.1016 / j.ab.2006.01.024。
- 50.
王志刚,王志刚,王志刚,王志刚。马铃薯139 kDa淀粉合成酶cDNA的克隆及功能分析。植物学报,1996,10(6):981-991。10.1046 / j.1365 - 313 x.1996.10060981.x。
- 51.
Hawker JS, Ozbun JL, Ozaki H, Greenber E, Preiss J:菠菜叶腺苷-二磷酸葡萄糖α -4-葡聚糖-4-糖基转移酶与α -1,4-葡聚糖,α -1,4-葡聚糖-6-糖基转移酶在支链α -葡聚糖合成中的相互作用。生物化学学报,2004,16(2):344 - 344。10.1016 / 0003 - 9861(74) 90430 - 5。
确认
作者感谢Kerstin Brismar在结构工作期间提供的熟练技术支持,以及Sten Stymne教授对手稿的批判性阅读和有用的建议。这项工作由Vinnova, Formas和Lyckeby Stärkelsen研究基金会资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
本研究部分由Lyckeby Stärkelsen研究基金会资助,该基金会是一个商业实体的研究基金会。这种关系并不影响我们对数据的解释或信息的表示。
作者的贡献
HT设计并进行了大部分的实验工作。MA参与设计协调项目,编辑修改稿件,SM参与结构工作,编辑稿件,IT进行糖和淀粉分析,PH参与设计协调项目,进行转录组分析。HT和PH撰写了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_1528_moesm1_esm.tiff
附加文件1:说明日变化的叶子切片。用Lugol溶液染色的叶子切片,说明了日变化。a.日出后12小时采集的甜菜叶。箭头所示的黑点表示积累的淀粉。b.在黑暗中采集甜菜叶,未检测到淀粉。c.日出后12小时采集防风草叶。检测到淀粉。d.防风草叶片深色取样,未检出淀粉,但叶绿体显示清楚。比例尺50 μm。(tiff 3mb)
12870 _2014_1528_moesm2_esm.tiff
附加文件2:形成层环的插图。种植后41天(a)和种植后54天(b)温室种植甜菜根的形成层环。切片用Lugol溶液染色。比例尺5毫米(TIFF 3mb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
杜尔松,H.,安德森,M.,马丁拉,S.。et al。淀粉合成基因和酶在没有淀粉积累的甜菜根中表达和活性。BMC植物生物学14日,104(2014)。https://doi.org/10.1186/1471-2229-14-104
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-104
关键字
- 甜菜属
- Pastinaca漂白亚麻纤维卷
- 存储积累
- 碳分配
- 淀粉
- 蔗糖