摘要
背景
这rapidopsis thaliana lec2.基因编码B3结构域转录因子,其在Zygotic和体细胞胚胎发生过程中起重要作用。LEC2通过复杂的遗传调节网络对确定胚性潜力和各种代谢过程产生重大影响。
结果
拟南芥叶子叶2基因的同源物(AtLEC2)为特征的Theobroma可可(TcLEC2)。TcLEC2编码在早期和晚期胚胎发育期间优先表达的B3结构域转录因子。表达TcLEC2体细胞胚性愈伤组织的去分化细胞(胚性愈伤组织)含量高于非胚性愈伤组织。瞬态过度表达TcLEC2在未成熟的胚胎中导致基因表达谱和脂肪酸组合物的变化。异位表达TcLEC2在可可叶中改变了几个种子相关基因的表达水平。过度的TcLEC2在可可外植体中大大提高了稳定转化的体细胞胚的再生频率。TcLEC2过表达的子叶外植体表现出非常高的胚胎发生能力,在无激素培养基上培养时,表现出迭代的胚胎发生连锁反应。
结论
我们的研究揭示了TcLEC2在合子和体细胞胚发育中的重要作用。总的来说,我们的证据支持这样的结论TcLEC2函数的正交是ATLEC2.在可可体细胞胚胎发生过程中,它参与了类似的基因调控网络。据我们所知,这是第一个详细的功能分析报告LEC2拟南芥以外物种的同源物。TcLEC2可作为生物标记物,用于可可种质资源改良和筛选优良品种。
背景
热带树Theobroma Cacao.在许多发展中国家,它是一种经济作物,也是巧克力生产的主要原料。2011年,全球巧克力行业市值超过1000亿美元,对可可豆(种子)的需求持续增长[1].可可树通常是高度杂合子的,当种子繁殖时,只有一小部分个体是高产的[2-4.].因此,营养传播系统通过克隆顶部精英个体基因型来提供避免特性变异问题的手段。
可可常用几种无性繁殖方法(嫁接和根茎扦插技术)。此外,在体外体细胞胚胎发生(SE)组织培养具有极高的增殖率和可扩展性,为加快基因改良型的开发和应用提供了一种途径。关于可可中一级和二级SE的协议已经有很好的文献记载[5.-8.].然而,SE受胚胎发生效率的限制,基因型之间差异显著。对调控可可中硒过程的基因和机制的深入了解,可能有助于改进用于商业化植物生产的硒方法。为了描述调控胚胎发生的机制,我们选择了翻译生物学方法,利用从模式植物拟南芥获得的知识。
在拟南芥中,叶状子叶(LEC.)转录因子,包括atlec1.[9.],ATLEC2.[10] 和AtFUS3[11]被认为是合子胚胎发育的主要调控者[12].这ATLEC2.基因编码一个B3结构域转录因子,该因子特异性地结合于ry.主题在5 '侧翼区域ATLEC2.全身的基因(13].ATLEC2.只在发育早期和成熟阶段的受精卵胚胎中表达。它对胚柄和子叶的发育和维持以及对脱水耐性的获得和对过早萌发的抑制都是必需的[10].职能丧失拟南芥lec2突变体表现出多种效应,包括胚柄解剖异常,具有毛状体的子叶异常,过早激活的茎尖分生组织,高度着色的子叶尖具有显著的花青素积累和减少种子贮藏化合物的积累[10那14那15].ATLEC2通过诱导控制各种发育和代谢途径的其他转录因子以及通过直接靶向和调节种子储存基因的级联效应来起作用16那17].例如,ATWRI1.,另一个关键转录因子对胚胎发育至关重要,是直接目标ATLEC2.是调节正常脂肪酸生物合成所必需的[17].
LEC.基因在体细胞胚胎发生过程中也很重要。例如,lec2突变体在拟南芥中以非常低的效率产生SEs [18],异位表达ATLEC2.在拟南芥和烟草植物组织诱导SE形成[10那19那20.].此外,SE的能力被双重废除(Lec1 lec2, Lec1 fus3, lec2 fus3)或三倍(Fus3 LEC1 LEC2.)LEC.突变体,进一步证实了LEC蛋白在SE期间的临界和冗余作用[18].众所周知,需要外源施用激素,如合成生长素(2,4- d)和细胞分裂素,以诱导SE [21-23[此外,养仑和悬停之间的功能相互作用ATLEC2.已被观察到。在拟南芥中,表达ATLEC2.在SE诱导期,对外源施加2,4- d的响应显著上调[14].同样,表达水平ATLEC2.与同一年龄的非胚胎发生愈伤组织相比,观察到胚胎愈伤组织显着较高[14].有趣的是,过度的ATLEC2.在未成熟合子胚中,转基因外植体能够直接诱导体细胞胚发生,很少形成愈伤组织,并且缺乏外源生长素[14].关于这一点,石头和Wojcikowska建议ATLEC2.可能激活参与生长素生物合成的基因,如YUC1那YUC2那YUC4和YUC10[24那25].一起携带,ATLEC2.是通过与转录调控因子和生长素的复杂相互作用来维持植物体细胞胚性能力所必需的[26].
这LEC.基因还参与了胚胎发育过程中脂肪酸生物合成和贮藏脂质沉积的调控。种子特异的过度表达ZmLEC1和BnLEC1导致玉米和油菜籽油含量分别增加35%和20% [27那28].异位表达ATLEC2.在拟南芥叶中导致种子特异性脂肪酸的积累(C20:0和C20:1),并增加了油蛋白的mRNA水平[16].此外,一个直接的下游目标ATLEC2.那ATWRI1.已知通过与途径上游的关键基因的相互作用来控制脂肪酸代谢[29].
虽然ATLEC2.已在拟南芥中广泛研究,以及几种植物物种中描述的同源物[30.,迄今为止,在任何其他植物中还没有发现这种功能同源物。我们在这里提出一个假定的同系物的鉴定ATLEC2.在可可,TcLEC2.我们描述了TcLEC2并探讨了TcLEC2活性在调节愈伤组织胚胎发生潜能和调节脂肪酸生物合成途径中的关系。
结果
基因分离和序列比较
拟南芥的ATLEC2.基因(At1G28300)是一个包含B3结构域的大家族的一部分,涉及多种功能。在拟南芥基因组中,已有87个基因被注释为B3结构域,并进一步划分为5个不同的家族:生长素反应因子(auxin response factor, ARF)、脱落酸不敏感因子(aba - inscisic acid-insensitive3, ABI3)ATLEC2.是与ABI3 / VP1(RAV)和生殖分泌物(REM)相关的糖诱导(HSI)的高水平表达,高水平表达(HSI)和生殖分泌[31].
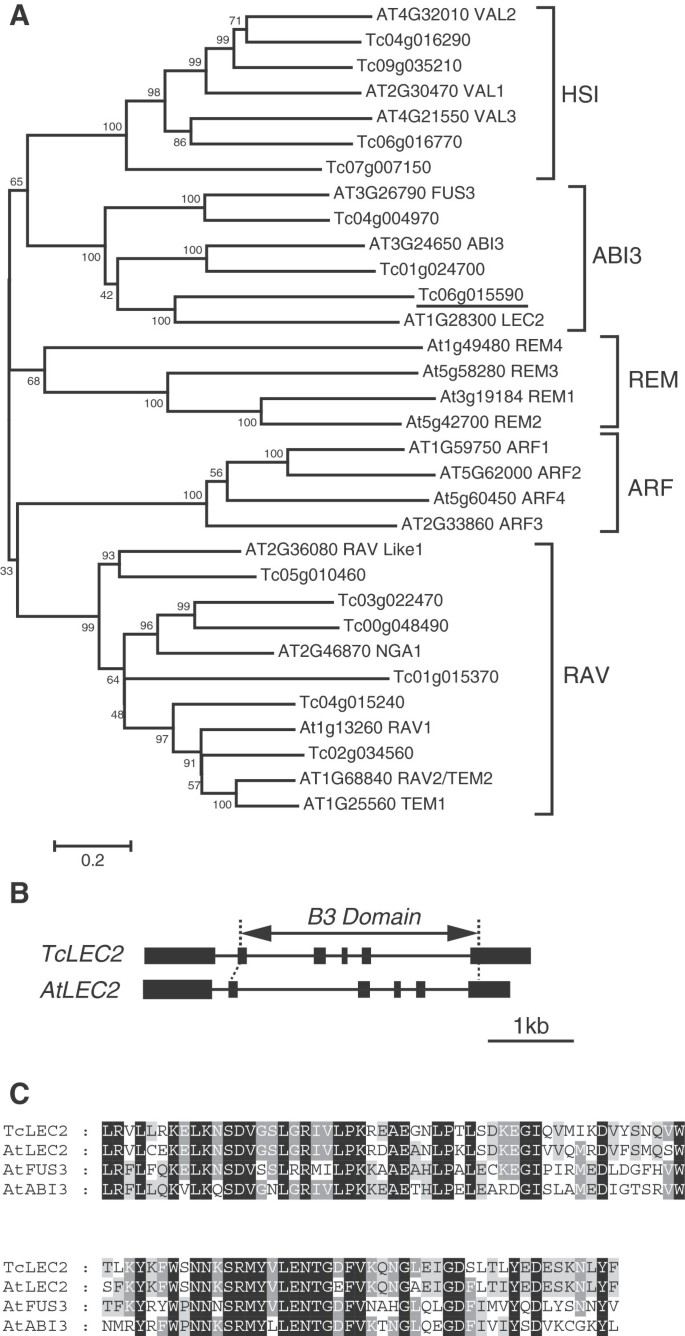
为了确定一个假定的ATLEC2.在可可中,拟南芥的全长氨基酸序列ATLEC2.对伯利兹Criollo基因型(B97-61/B2)的预测蛋白质组(http://cocoagendb.cirad.fr/[32])使用带有电子值的BLASTP算法1E-5[33],这导致鉴定了13个可能的候选基因(附加文件1).作为鉴定可可的第二种方法LEC2基因,13个候选基因中的每一个的预测蛋白质序列用于从CV的第二序列的可可基因组中搜索预测的蛋白质组。Matina 1-6 V1.1(http://www.cacaogenomedb.org.[34]),并对每个同源基因进行了一组几乎相同的鉴定(附加文件1).在这种可可中没有发现其他相关基因。在13个候选基因中Tc06g015590结果是最好的对齐ATLEC2.,导致BLASTP期望值为3E-75。
找出最有可能的ATLEC2.- 用13个候选的可可基因和来自拟南芥中的每种B3结构域家族中的每一个的几个代表性基因进行系统发育分析(图1一种)。将13个CaCaO基因与含有基因家族(他,ABI3,Rav)的三个B3结构域聚集。在ABI3亚家族内聚集的三种可可基因,其中一个可可基因与该组的三个拟南芥成员中的每一个配对(Tc04g004970与AtFUS3那Tc01g024700与AtABI3和Tc06g015590与ATLEC2.),再次表明Tc06g015590最可能的同系点是ATLEC2.在可可基因组中。这个基因以单一副本的形式存在,我们暂时将其命名为TcLEC2.
含可含可基因B3结构域的系统发育分析及基因结构。一种.拟南芥和拟南芥全长氨基酸序列的无根邻居连接共识树Theobroma Cacao.B3结构域包含基因。标尺表示每个残差的0.2个估计替换,节点旁边的值表示1000个重复的bootstrap值。共鉴定出5个含有B3结构域的基因家族。与之最接近的基因ATLEC2.(带下划线)被指定为TcLEC2.B..相对比TcLEC2和ATLEC2.基因结构。盒子代表外显子,线代表内含子。明确了保守B3域的位置。C.B3结构域的氨基酸比对TcLEC2那ATLEC2.那AtFUS3,AtABI3.所有四种蛋白质的黑盒子中的残基都是相同的;深灰色盒子中的残留物在四种蛋白质中有三种是相同的;浅灰色盒子里的残留物在四种蛋白质中有两种是相同的。
诠释TcLEC2(Tc06g015590)在可可基因组数据库中预测了两个相隔72 bp的翻译起始位点。根据5 '可能的翻译起始位点和预测的全长编码序列,设计PCR引物TcLEC2从中提取的cDNA扩增SCA6成熟合子的子叶。对1368 bp的片段进行测序,并与TcLEC2基因组序列,构建了基因模型,由六个外显子和五个内含子组成,几乎相同ATLEC2.基因结构(图1第一个和最后一个外显子的长度略有不同,其余四个是相同的。这TcLEC2编码一个455个氨基酸残基的开放阅读框,其B3结构域预测在多肽的中心区域。全长TcLEC2蛋白与AtLEC2的同源性为42%(附加文件2);然而,它们在B3域中是81%相同的(图1C)。
TcLEC2主要在胚乳和早期成熟胚子叶中表达
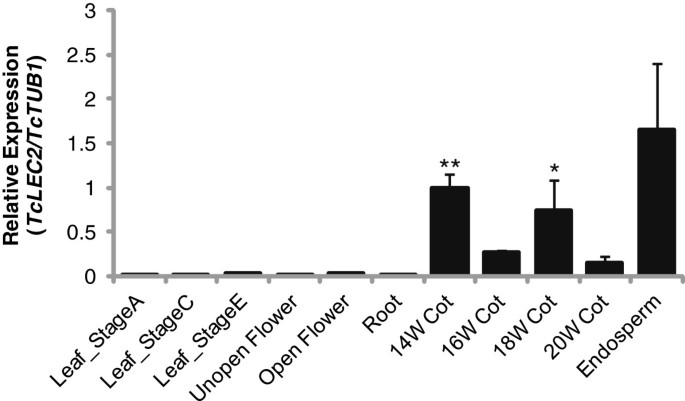
为了研究TcLEC2在可可中的功能,我们通过qRT-PCR检测其在不同组织中的表达,包括发育A、C和E阶段的叶片(定义见[35]),未开封的花朵,开花,根,胚乳和授粉后的14,16,18,16,18,授粉后20周(WAP)。含可β-小管蛋白基因(TcTUB1那Tc06g000360),之前被证明在可可种子发育过程中表现出稳定的表达水平(未发表的数据)。TcLEC2被含可胚乳和宫内节(图)仅表达(图2),并且在其他组织中未检测到显着的转录物,与ATLEC2.拟南芥的表达模式[10那30.].而且,表达了TcLEC2在14和18 WAP的Cacao子叶中显着高于16和20 WAP,先前定义为可可胚胎形态发生和种子成熟阶段的阶段[36].报道了类似的双相表达模式LEC2在拟南芥30.,提示TcLEC2可能在合子胚胎发生的早期发育诱导和成熟阶段发挥作用。值得注意的是TcLEC2在胚乳中(授粉后90天),当胚胎刚刚开始发育时(图2).胚乳的功能是为发育中的胚胎提供营养支持,以及母体组织和胚胎之间的相互作用,是胚胎成功发育的关键决定因素[37].因此,丰富的TcLEC2发育中的可可胚珠的胚乳转录本表明TcLEC2胚乳的表达可能与控制可可胚的发生有关。
异位表达TcLEC2是否足以激活可可叶中种子特异基因的表达
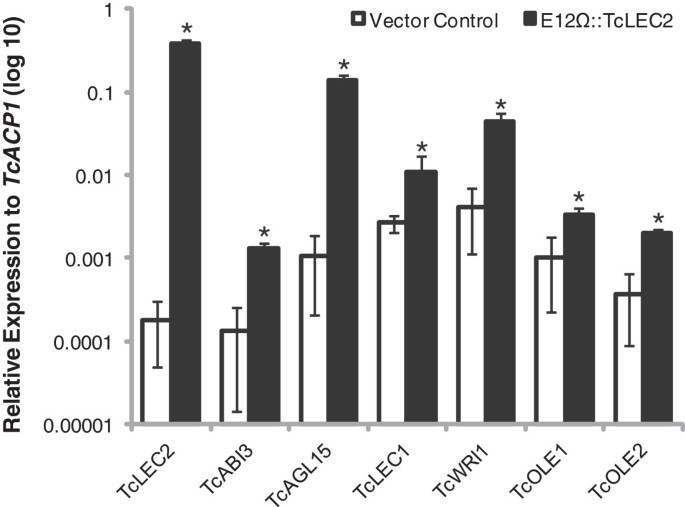
为了测试CaCAO TCLEC2在基因表达的调节中的功能并鉴定其推定的下游靶标,利用了利用可可叶组织的快速瞬态转化测定[38)(参见方法,附加文件3.).TcLEC2异位过度表达E12-ω.改进的CAMV35S启动子(E12ω:: TCLEC2那PGZ12.0108,GenBank登录:KF963132,附加文件4.)在完全展开的幼龄期C可可叶使用农杆菌属真空渗透。农杆菌属包含空的Vector PGH00.0126(对照矢量,GenBank登录:KF018690,EGFP仅)也与对照渗透。正如预期的那样,TcLEC2仅在用e12ω:: tclec2载体转化的叶片中高度表达,但在控制叶中没有可检测到(图3.).为了确定TcLEC2的潜在靶点,我们还通过qRT-PCR检测了一组拟南芥种子发育相关的可可推测同源基因(见表)1).的预测正交AGAMOUS-Like15,一种MADS box型转录因子,参与从茎尖分生组织诱导体细胞胚胎发生[39],高度诱导(> 129折)TcLEC2异位过表达(图3.),这与拟南芥中LEC2和AGL15能够相互激活的观察结果一致[40].预测的直接同源阿巴不敏感3(ABI3),其在种子发育期间编码B3结构域转录因子,并以拟南芥在AtleC2的下游靶标中被鉴定为[41那42],也被TcLEC2诱导(>9倍)(图3.).但是,另一个B3结构域转录因子FUSCA 3(Fus3.)[43那44没有回应TcLEC2在我们的实验条件下叶组织的过度表达(表1).预测的直接同源皱纹1(WRI1),AP2 / ereAb家族转录因子是ATLEC2的直接下游靶标,并在拟南芥中指定ATLEC2致脂肪酸生物合成途径的作用[17那29],TClec2诱导十多个折叠(图3.).此外,两个基因编码OLEOSIN参与油体结构的蛋白质也在可可叶中被激活TcLEC2异位过表达(图3.).这些结果表明,TcLEC2足以诱导可可叶片中几个重要的种子特异基因的异位转录,支持其作为胚胎和种子发育的关键调控因子的功能。
TcLEC2表达与愈伤组织细胞的胚性能力有关
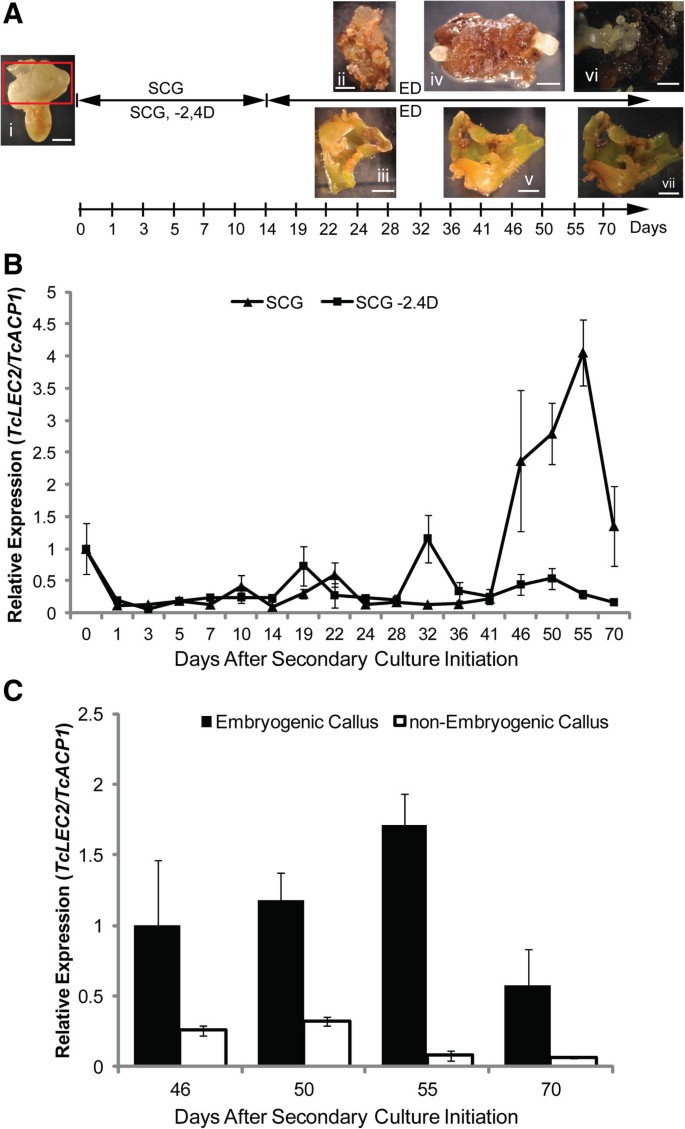
基于上述结果,我们推断TcLEC2也可能是体细胞胚胎发生的关键调控因子。去探索,TcLEC2在用或没有SE诱导激素2,4-D生长的组织中测量(图4.).来自高度胚胎源性神经植物基因型的雄蕊PSU-SCA6.用于生产初级体细胞胚(图4.A,小组i)遵循我们先前公布的协议[5.].子叶外植体(图4.切除,面板I,红色盒子)并置于具有(SCG)或没有(SCG-2,4d)助体素2,4-D(SE诱导所需的次级胚胎发生诱导培养基。在这些培养基两周后,组织将双周转移到激素游离胚胎发育介质(ED)。在SCG培养基上培养的外植体开始在培养开始(ACI)(aci)(面板II)后两周产生呼叫,并在四个额外的几周(小组IV和VI)后看到次级体细胞胚。然而,在SCG-2,4d上,在前六周内,外植体扩大和逐渐变绿,然后停止开发并变成棕色。在SCG-2,4d培养基(面板III,V和VII)的外植体中没有产生CALLI也不是胚胎。
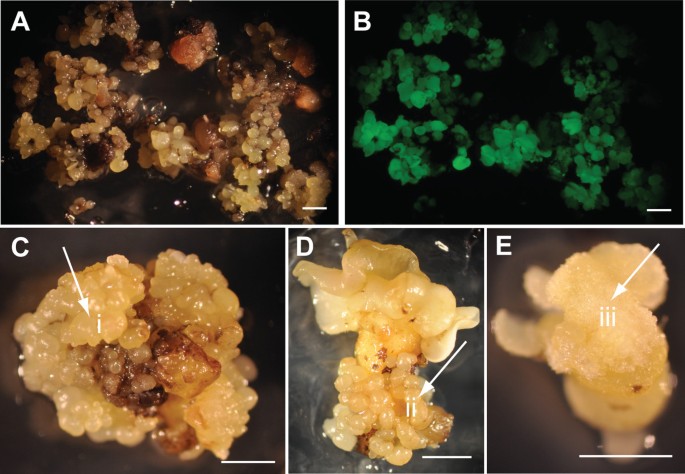
TcLEC2表达与胚性潜力相关。一种.可可次级体细胞胚胎发生阶段和时间框架的例证,表示用于样品收集的点。胚胎发育的几个关键阶段的代表性图像:(i)子叶阶段PSU-SCA6.胚作为外植体启动次生体细胞胚发生培养;(i)和(iii) ACI 28天无激素培养基上的子叶外植体,分别来自含2,4d的SCG培养基和不含2,4d的改良SCG培养基上的培养;(iv) & (v)在ACI 46 d ED下的子叶外植体(上述处理同);(vi) & (vii) ACI 70 d ED下的子叶外植体(上述处理同);(棒= 2毫米)。B..时间进程表达模式TcLEC2在含2,4d的SCG培养基和不含2,4d的改良SCG培养基上启动培养的可可次生体细胞胚胎发生过程中。的表达TcLEC2是相对于Tcacp1.(n = 3或4,平均值±SE)。C.表达水平的TcLEC2在胚性和非胚性愈伤组织的不同时间点。的表达TcLEC2是相对于Tcacp1..条表示平均值±SE(n = 3或4)。T检验建立了意义(* P值<0.05的代表)。
TcLEC2在整个培养期间,测量在SCG和SCG-2,4D培养基上培养的组织的表达水平(图)4.B)。TcLEC2初生体细胞胚子叶在0时刻可检测到表达,外植体放置在SCG或SCG-2,4D培养基上一天后显著下降(图)4.B)。TcLEC2在接下来的两周,两种治疗方法的表达都保持低水平,表明TcLEC2诱导期对外源生长素反应不快。然而,在第32天到第36天,TcLEC2两种治疗中的表达水平略微增加和变量。值得注意的是,在46天时,ACI首先在来自Calli(胚胎愈伤症)产生的SCG培养基上观察到胚胎的发育。从胚胎愈伤组织(没有可见胚胎)中提取RNA,大幅增加TcLEC2qRT-PCR检测基因表达。在SCG-2、4D培养基上未观察到胚胎TcLEC2未检测到表达。
组织培养中常见的现象是不同类型的愈伤组织去分化,这些愈伤组织的全能性各不相同,以再生体细胞胚[45那46].通过可可组织培养,我们和我们的合作者经常观察到两种类型的愈伤组织,一种是产生大量胚胎的愈伤组织(胚性愈伤组织),另一种是产生很少胚胎的愈伤组织(非胚性愈伤组织)(未发表的观察)。为了研究TcLEC2活性与愈伤组织胚胎发生潜能的关系,TcLEC2比较了SCG培养基上胚性愈伤组织和非胚性愈伤组织的基因表达。观察到的平均水平TcLEC2胚性愈伤组织的表达是同龄非胚性愈伤组织的20倍(图)4.c),暗示之间的紧张关系TcLEC2表达和胚胎发生能力。考虑到AtLEC2在控制拟南芥胚发育中的作用,我们推测TcLEC2可能在控制可可体细胞胚发育中发挥类似的作用。
过度的TcLEC2显著提高转基因胚体细胞胚发生和再生效率
的当前方法农杆菌属-介导的可可基因型转化可产生可复制但极低的转基因胚胎回收率[47].我们推测,这是稳定的T-DNA整合到可可基因组和相同的细胞进入胚胎发生途径的非常低的共发生率的结果。我们假设过度表达TcLEC2可能通过增加与T-DNA整合事件的共发生率来提高体细胞胚胎发生率,从而提高转基因se的回收率。
要测试这一点,我们执行了农杆菌属-介导转化试验的子叶外植体摘自初生胚共培养农杆菌属包含控制矢量(PGH00.0126)或E12ω:: TCLEC2向量(PGZ12.0108)。共培养两周后,用对照矢量转化的组织中GFP的初始瞬时表达水平总是高于E12ω:: TCLEC2(附加文件5.).这可能是由于E12Ω::TcLEC2含质粒相对于对照质粒的尺寸更大,包含了重复启动子元件,或添加了第三个高表达转基因。我们已经在其他不相关的含有转基因的质粒中观察到这种现象(未发表的数据)。
在胚胎发生介质的培养周期内,在所有三种独立的转化试验中观察到大量的非转基因胚胎(GFP阴性),无论存在TcLEC2转基因(附加文件6.).在累积的非转基因胚胎生产方面,对照载体和E12ω:: TCLEC2的转化之间没有观察到的常量显着差异(附加文件6.).为鉴定稳定转化的胚胎,采用立体显微镜观察GFP荧光作为可视化标记。控制矢量缺乏TcLEC2结果表明,在176个子叶外植体上均未发现表达GFP的胚。令人惊讶的是,使用E12Ω::TcLEC2的转换包含TcLEC2结果表明,300多个稳定的转基因胚胎分布在子叶外植体的整个表面5.A-B)。该结果显着高于多年来观察到的稳定转化结果,其中几种不同的转基因,其中单个转化的先前记录(约200个类网状外植体)是8种GFP阳性胚胎[47-49].因此,虽然TCLEC2没有影响瞬态转换的初始水平(附加文件5.)非转基因胚胎的胚胎发生频率(附加文件6.),它大大增加了转基因胚胎生产的频率,这证实了我们的假设。
虽然有大量的转基因TcLEC2获得的胚胎中,大多数表现出明显的发育和形态异常(图5.C,D和E),并且在球状或心脏阶段的最停止的发育以及子叶的启动显着受到严重损害。少数胚胎形成于子叶阶段在子叶上形成的愈伤组织(图5.E),偶尔有新的胚沿着胚轴发生(图5.C和D).试图从这些胚胎中恢复植物的尝试没有成功。
测试稳定过度表达的效果TcLEC2从完全发育成熟的转基因E12Ω::TcLEC2胚胎的子叶切除和培养用于三级胚的生产,如前所述[5.].基因顿外植体免于非转化PSU-SCA6.培养SEs作为对照。值得注意的是,转基因E12Ω::TcLEC2系的子叶外植体早在ACI第4周就开始产生第三系胚胎(图)6.B), compared to six weeks forPSU-SCA6.行(图6.一种)。此外,虽然大多数大多数胚胎生产PSU-SCA6.生产线在14周的ACI完成,之后很少生产SEs(图)6.C),转基因E12Ω::TcLEC2系的外植体继续产生大量的胚胎,直到ACI 20周,实验终止(图)6.总的来说,在20周的时间内,转E12Ω::TcLEC2系产生了大约2.5倍于每个外植体的第三代胚胎(p值< 0.001)PSU-SCA6.行(图6.e)。
过度的TcLEC2改变脂肪酸生物合成相关基因的表达
在拟南芥中,除了AtLEC2在胚胎发生起始中的作用外,AtLEC2还调节胚胎发育过程中的从头脂肪酸生物合成。证据包括但不限于(a)转基因35S::AtLEC2胚珠显示出成熟的种子样脂肪酸谱[24];(b)异位过度表达ATLEC2.在叶片中导致种子特异性脂质的积累和非常长的链脂肪酸[16];(c)ATLEC2.直接调节AtWRI1,已知在发育胚胎中调节脂肪酸代谢的调节作用[17].由于脂肪酸,以三酰基甘油(标签)的形式是成熟的可可种子的主要储存组分,所以我们研究了TCLEC2在可可病原胚胎(Izes)中脂肪酸生物合成的控制中的作用。
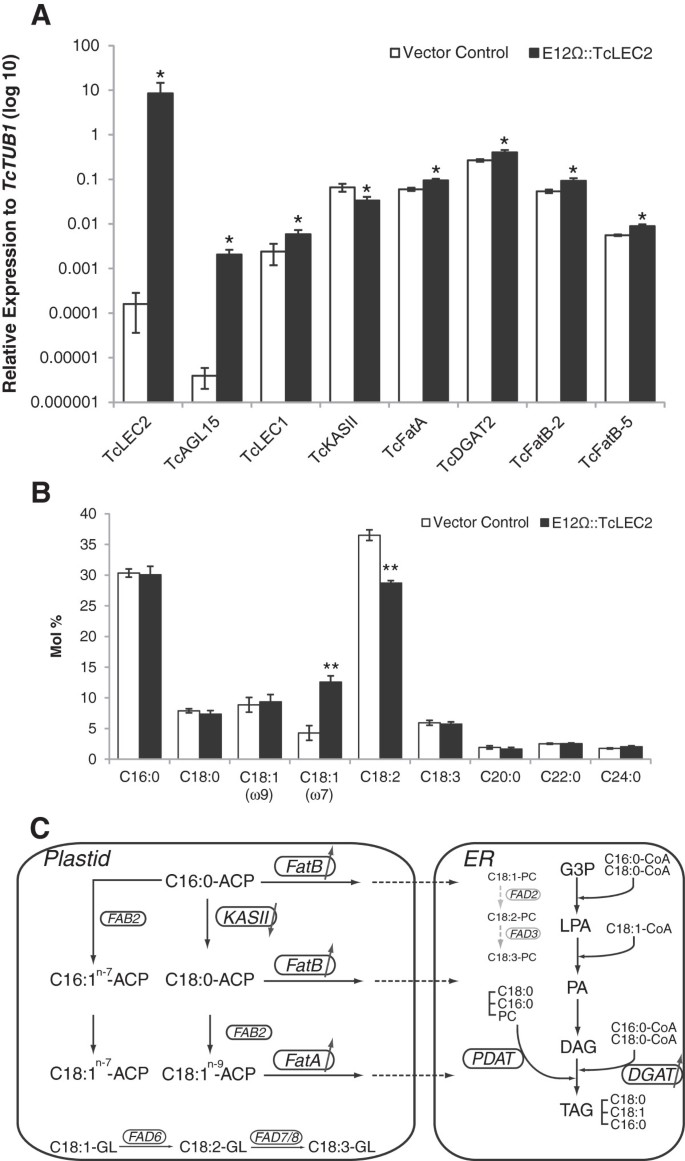
e12ω:: TCLEC2在Izes(12周龄)并行与控制矢量(PGZ00.0126)瞬时过表达。通过荧光显微镜证实高瞬态表达,以检测约90%的外植体表面(附加文件)检测EGFP7.).超表达水平的TcLEC2通过QRT-PCR进一步证实转化的Izes,并与基础水平相比TcLEC2在控制向量中变换(图7.).与附件叶瞬态测定中的观察一致(图3.),过度表达TcLEC2导致成绩单升高Tcagl15.和TcLEC1在IZE组织(图7.不同于瞬时转化的叶组织,诱导表达TcWRI1在我们的QRT-PCR条件下未在转换的Izes中检测到(40个周期)(附加文件8.).
E12Ω::TcLEC2在IZE中瞬时过表达改变了脂肪酸组成和基因表达。一种.脂肪酸生物合成途径中响应酶表达水平的变化基因表达水平相对于TcTUB1;(n = 3,平均值±SE)*通过T检验表示p值<0.05。B..可可未成熟合子胚胎瞬时过表达载体control和E12Ω::TcLEC2脂肪酸组成的摩尔百分比;(n = 3,平均值±SE)。**表示t检验p-value < 0.001。C.解释基因表达水平与脂肪酸组成改变之间关系的模型示意图。酶用圆圈标出。受TcLEC2活性调节的酶为黑色,否则为灰色。缩写:ER,内质网;ACP:酰基载体蛋白;辅酶A,辅酶A;FAB2:脂肪酸去饱和酶;脂肪,脂肪酰基- acp硫酯酶;ka, 3-ketoacyl-ACP合酶; FAD2, oleoyl desaturase; FAD3, linoleoyl desaturase; FAD6, oleoyl desaturase on membrane glycerolipid; FAD7/8, linoleoyl desaturase on membrane glycerolipids; PC, phosphatidylcholine; G3P, glycerol-3-phosphate; LPA, lysophosphatidate; PA, phosphatidate; DAG, diacylglycerol; TAG, triacylglycerol; PDAT, phospholipid:diacylglycerol acyltransferase; DGAT, 1,2-sn-diacylglcyerol transferase.
为了进一步了解TcLEC2在胚胎发育过程中的调节功能,我们通过拟南芥基因序列同源性鉴定了可可基因组中控制脂肪酸生物合成和TAGs生产的关键酶的最可能的同源基因(图)7.C和附加文件9.),比较它们在过表达E12Ω::TcLEC2和对照载体上的ize组织中的表达水平(图)7.A). mRNA水平TcKASII(Tc09g006480),一种浓缩酶β-酮酰基-[酰基载体蛋白]合酶II负责C16到C18的伸长[50],较低的(p值<0.05)是两倍TcLEC2转化后的组织与对照组相比(图7.A).此外,预测的正交tcfata.(Tc01g022130)和两种同种型TCFATB.(Tc01g022130和Tc03g015170),两种酰基-[酰基载体蛋白]硫酯酶,专门将C18:1 (FatA)和其他饱和脂肪酸部分(FatB)从质体输出到胞质[51],显著上调1.5倍以上(p-值< 0.05)。有趣的是,预测的甘油酰基转移酶2 (TcDGAT2, Tc01g000140),一种催化通过酰基-CoA依赖性途径催化标签组装的最后一步的关键酶[52],显着上调1.5倍(P值<0.05)。两种同种型脂肪酸去饱和酶2的表达水平没有显着差异(Fab2,TC04G017510和TC08G012550)被观察(附加文件8.).
为了确定基因表达中的这些变化是否导致改变的代谢物谱,通过用E12ω:: Tclec2和对照载体转化的Izes组织中的气相色谱/质谱(GC / MS)测量脂肪酸组合物。过度的TcLEC2导致CIS-VACCENIC酸的水平显着增加:1N-7.(p值< 0.001),油酸(OA)的亚型,显著降低亚油酸(LA, C18:2N-6)与通过病媒控制转化的组织相比(图7.B)。
讨论
TcLEC2参与可可体细胞胚胎发生
体细胞胚胎发生长期以来一直被认为是许多农作物的优越的传播系统[53-55]由于其固有的高倍增率和全年的潜力,均匀疾病自由植物生产。虽然理论上,但每个体细胞植物细胞都具有消化植物(Totipotency)的能力和改组,植物细胞进入体细胞胚胎发生的能力在不同组织,发育阶段和物种之间变化。积累的证据表明,ATLEC2的活性与胚性能力高,涉及与其他一些监管因素的相互作用。我们的结果与Cacao Tclec2在调节同性拟南芥中的体细胞胚胎发生中的作用。支持证据包括;(1)异位过表达TcLEC2C期叶片能诱导种子转录因子基因的表达,如Tcagl15.那Tcabi3.和TcLEC1;(2)诱导的表达水平TcLEC2与外植体的胚胎源性相关联;(3)组成型过度表达TcLEC2在次生体细胞胚组织中,与较早的胚胎均导致初期和增加的第三胚胎再生增加PSU-SCA6.控制。总的来说,我们的证据支持这样的结论,即TcLEC2是AtLEC2的功能同源物,并且在可可体细胞胚胎发生过程中参与了类似的遗传调控网络。
瞬态过度表达TcLEC2在子叶外植物本身不足以增加非转基因体细胞胚的胚胎发生效率(附加文件6.).这表明,在我们的胚胎发生培养系统中,细胞去分化和再分化所需要的其他因素并不存在。然而,结构性的过度表达TcLEC2在稳定转化的细胞中,与没有转化的6 - 7周相比,在4周内体细胞胚胎发生大大增强TcLEC2超表达(图5.B,6.B和e)暗示TCLec2的增强活性足以促进可可中细胞胚胎发生的效率。
可可胚胎胚胎源性能力的高度基因型变异限制了其大规模传播的实际应用[5.].因此,TcLEC2可作为筛选高胚性可可豆基因型的分子标记。此外,它的水平TcLEC2在愈伤组织和其他组织中的表达在体外可用于评估不同媒体和其他变量的效果,以便进一步优化SE协议。可能,我们可以通过不同的表达促进可可叶或其他组织中细胞胚胎发生的可能性TcLEC2.
TcLEC2调控可可种子成熟过程中脂肪酸的生物合成
可可种子的脂肪酸组成和脂质曲线是巧克力行业的重要品质性状。因此,对调节其生物合成的遗传网络的鉴定非常感兴趣。LEC2及其合作伙伴LEC1,ABI3和FUS3是拟南芥和其他物种中脂肪酸和脂质生物合成的关键调节因子,从而影响种子发育的许多方面。此外,与本知识的应用特定相关性,WRI1的水平,LEC1,LEC2和FUS3的下游靶标与不同的种子油含量高度相关显著基因型[28].我们的观察结果TcLEC2过度表达导致表达增加TcLEC1和TcWRI1(数字3.)在附着的可可叶中促使我们推测,这可能导致脂肪酸组成和标签组件的变化。实际上,瞬态过度表达TcLEC2在合子胚胎中导致C18:1增加N-7.和减少C18:2N-6水平(图7.B),类似于在可可种子成熟过程中发生的变化,主要是多不饱和脂肪酸(C18:2)N-6和C18:3N-3)几乎完全饱和(C16:0和C18:0)和单不是饱和脂肪酸(C18:1N-9.)[36].然而,鉴于这一事实TcWRI1是不是由于过度表达TcLEC2在未成熟的胚胎中,它表明WRI1不需要介导TCLEC2对脂肪酸生物合成的影响,并且TCLEC2与其他转录因子之间的调节网络在恶性腺中的不尽相同,因为它们在拟南芥和拟南芥中显著.过度的TcLEC2也导致了脂肪酸生物合成的一些主要结构基因的表达改变,这可能为我们所观察到的脂肪酸组成变化提供了解释。C18:1N-7.通过C16:1的C16:1合成N-9.通过Fab2和进一步伸长到C18:1N-7.[56].减少表达水平TcKASII可以增加C16:0的衬底可用性,作为TcFAB2生产C16:1的衬底N-9.进一步导向C18:1N-7.积累(图7.C)tcfata.和两种同种型TCFATB.(均显著上调1.5倍以上)可促进饱和脂肪酸(C16:0和C18:0)和单不饱和脂肪酸(C18:1)的产生和积累N-9.),在可可种子成熟过程中(图7.C)。
有趣的是TCDGAT2.过度表达也显着增加TcLEC2,但表达水平TCDGAT1.1.没有受到影响(附加文件8.).DGAT基因的活性与油籽中的油含量和组合物高度相关[57[底粒子特异性和亚细胞本地化,三种已知类型的DGAT基因(DGAT1,DGAT2和DGAT3)不同[58].根据一项未发表的研究,TCDGAT2.在酵母中的表达导致了在TAG片段中积累更多的C18:0TCDGAT1[59].考虑到可可成熟种子中的大多数tag仅由sn-2上的不饱和脂肪酸(C18:1)和sn-1和sn- 3上的饱和脂肪酸(C16:0和C18:0)组成(图7.C),似乎可以推测,与TcDGAT1相比,TcDGAT2的活性在催化TAG组装的sn-3上的最终酰化更重要。我们的结果进一步支持了这一论点,表明表达水平TCDGAT2.大约是TCDGAT1在可可不成熟的种子(图7.A和附加文件8.).综上所述,我们的数据表明TcLEC2可能通过调控可可种子成熟过程中的脂质生物合成而参与调控TCDGAT2.基因的表达。然而,TcLEC2是否能够直接反式激活TCDGAT2.或者它的作用是由其他转录因子介导的,目前还不清楚。进一步研究可可中脂肪酸生物合成和TAG组装的调控机制,有助于鉴定途径中的关键酶,有助于筛选满足工业需求的优质可可品种。
结论
的分离和功能表征LEC2从CacaO基因组出发的矫形器揭示了TCLEC2在调节Zygotic和体细胞胚胎发生方面的关键作用。种子中的独家表达模式和其监管目标的识别,如AGL15和WRI1,强烈指示ATLEC2和TCLEC2之间的功能相似之处。然而,TCLEC2对可可脂肪酸生物合成的影响还表明TCLEC2能够直接或间接地与途径上许多关键酶相互作用,这尚未在拟南芥中表征得很好。此外,可可体细胞胚胎发生期间TClec2和胚胎势活性与胚胎潜力之间的相关性为我们提供了更好的理解和改善CACAO的低效和可变传播系统的绝佳机会。
方法
系统发育分析和序列比对
B3结构域包含基因Theobroma Cacao.BLASTP使用ATLEC2(AT1G28300)作为查询(E-Value切断1E)-5).多蛋白序列比对由MUSCLE进行[60].用臀部校正模型的邻近算法和成对删除的选项,由Mega4.1构建系统发育树。61].引导值表示1000复制。全长拟南芥AtLEC2 AtABI3,和AtFUS3,使用蛋白质序列来搜索可可基因组数据库(http://cocoagendb.cirad.fr/)由tblast [33]以获取全文TcLEC2, TcABI3和tcfus3.分别核苷酸序列。使用Interpro程序预测功能B3域(http://www.ebi.ac.uk/interpro/)。中5个亚家族的B3结构域蛋白拟南芥鉴定并根据[31].
RNA提取,TcLEC2克隆及表达载体构建
首先将采自sc6基因型可可豆的植株组织在液氮中碾碎。使用植物RNA纯化试剂(Life Technologies, Cat. 12322-012,遵循制造商的协议)提取总RNA。使用Nanodrop 2000c (Thermo Scientific)测量RNA浓度。进一步用RQ1 RNase-free DNase (Promega, Cat。M6101)以去除潜在的基因组DNA污染(按照制造商的协议)。用新英格兰生物实验室(New England Biolabs) M-MuLV逆转录酶(M-MuLV Reverse transcripase, M-MuLV Reverse transcripase)和oligo-(dT)15引物对250 ng处理后的RNA进行逆转录。完整的长度TcLEC2被放大SCA6成熟种子子叶cDNA引物对(TcLEC2-5 '-SpeI: GCACTAGTATGGAAAACTCTTACACACC和tclec2-3'-HpaI: GCGTTAACTCAAAGTGAAAAATTGTAGTGATTGAC)并克隆到pGH00.0126 [47E12-Ω启动子驱动pGZ12.0108质粒(附加文件7.).将重组二元质粒引入A. Tumefaciens.拉紧AGL1.[62通过电穿孔)。
TcLEC2qRT-PCR表达分析
提取RNA样本,逆转录为cDNA,如上所述。要检测的引物TcLEC2转录本根据编码序列设计TcLEC2 (Tc06g015590[32])(TcLEC2-Realtime-5”: TGACCAGCTCTGGTGCTGACAATA;TcLEC2-Realtime-3”:TGATGTTGGGTCCCTTGGGAGAAT)。QRT-PCR在含有4μl稀释的cDNA(1:50)的10μl混合物中进行,5μlssbrGreenPCR主混合物(Takara),0.2μlrox和0.4μl每5μm引物。每次反应在Roche施用的生物系统中重复进行,在以下程序下,在下列程序下,在94℃下的15分钟,40个循环在94°C,20s在60°C,40秒,72°C为40℃。.通过在2%琼脂糖凝胶和解离曲线上观察引物对的特异性。酰基载体蛋白(Tc01g039970那Tcacp1.[32]TcACP1-5”:ggaaagcaagggtgtctcgttgaa和TcACP1-3”: GCGAGTTGAAATCTGCTGTTGTTTGG),可可豆微管蛋白基因(TC06G000360,TCTUB1.[32]tctub1-5':GGAGGAGTCTCTATAAGCTTGCAGTGG和tctub1-3': ACATAAGCATAGCCAGCTAGAGCCAG)作为内参基因。
Cacao附着的叶和未成熟的胚胎瞬态基因表达测定
A. Tumefaciens.拉紧AGL1.携带控制载体(pGH00.0126, GenBank Accession: KF018690,仅EGFP)或E12Ω::TcLEC2 (pGZ12.0108, GenBank Accession: KF963132,附加文件4.)接种在含有50 μg/ml卡那霉素的100 ml 523培养基中,并在25℃振荡(200 rpm)过夜,420 nm光密度(od值)为1.0。AGL1.1500xg室温成球17分钟,在诱导培养基中重悬[63在420 nm处od值为1.0。AGL1.在100rpm下在25℃下诱导3小时,并加入终浓度为0.02%。对于所附的叶片瞬态转化测定,我们使用完全扩展的年轻叶(如[中所定义的发育阶段C.64])来自基因型SCA6在温室里生长。叶子的叶柄用薄膜包裹,并置于改良的真空干燥器的凹槽中,以形成密封,避免对叶子造成损害。叶片在干燥器中浸泡在AGL1诱导介质中,并使用真空泵(GAST型号No. 0523-V4F-G582DX)在-22 psi下真空渗透2分钟。真空渗透3次,提高转化效率。转化后的可可叶在植物上保存3天,然后收集并使用荧光显微镜进行评估。选择GFP高表达区域(>80%覆盖率)进行进一步分析。为未成熟合子胚的瞬时转化试验,正在发育的果实(开放授粉SCA6.,授粉四个月的授粉)来自波多黎各的USDA种质收集。收集Zygotic胚胎子叶并悬浮在ED培养基中[5.转换之前)。将合子子叶浸泡在AGL1诱导培养基中,按上述方法进行叶片瞬时表达试验。浸润5天后对转化组织进行分析。
可可稳定转化的初级体细胞胚
初级体细胞胚胎发生如前所述[8.].从健康和成熟的初生胚胎中取出光滑的子叶,切成4mm x4mm的方形块,并感染A. Tumefaciens.如前所述,AGL1菌株携带T-DNA二元载体[47],稍作修改:(1)将AGL1成球重悬于诱导培养基中[63在420 nm时od值由0.5变为1.0;(2)转化后,与感染的子叶共培养A. Tumefaciens.在滤纸上在25℃的滤纸上菌株AgL1在黑暗中而不是48小时。培养转化的外植体,通过如前所述的GFP荧光筛选转基因次要体细胞胚状物[47].
用GC/MS分析脂肪酸
在液氮中研磨新鲜植物组织,并在含有MeOH / FUM HCl /二氯甲烷(10:1:1,v / v)中的1ml缓冲液中提取的约30mg组织制备脂肪酸甲酯(FAME)。孵育在80°C下摇晃2小时。用涡旋1mL缓冲液H 2 O /己烷/二氯甲烷(5:4:1,v / v)重新提取脂肪酸甲酯,1分钟。通过以1500xg离心5分钟,将己烷(上阶段)分离,转移至安静玻璃GC小瓶并在真空下蒸发至干。然后将来自500μL己烷溶解的GC / MS分析。戊二烷酸(C15:0)(Sigma,猫。P6125)用作萃取和非癸酸甲酯(C19:0-甲酯)(Sigma,Cat.N5377)之前添加的内标准物作为尖峰控制,在GC注入之前添加到样品中。分析脂肪酸衍生物在配备名称混合ωAx250毛细管GC柱(Sigma,Cat。24136)上的Agilent 6890气相色谱仪上分析了脂肪酸衍生物。水的GCT经典质谱法直接连接到GC操作。70 ev的ei被应用。 Peak height areas were used to quantify the abundance of each fatty acid species, and the mass spectra were interpreted by comparing with the NIST/EPA/NIH Mass Spectra Library [65].
加入号码
来自本文的序列数据可以在rabidopsis信息资源(Tair)或CocoAgendB中找到(http://cocoagendb.cirad.fr/gbrowse/cgi-bin/gbrowse/theobroma/)列于下表的加入编号2.
缩写
- SCA6:
-
Scavana 6
- LEC:
-
叶子子叶
- abi3:
-
ABA的3
- Fus3:
-
FUSCA3
- SE:
-
体细胞胚胎发生
- 泽:
-
合子的胚胎发生
- WRI1:
-
皱纹1
- AGL15:
-
AGAMOUS-like 15
- 奥立:
-
OLEOSIN
- YUC:
-
丝兰
- 东盟地区论坛:
-
助线响应因子
- HSI:
-
糖诱导的高水平表达
- 雷夫:
-
ABI3 / VP1有关
- REM:
-
生殖分生组织
- TUB1:
-
管蛋白
- ACP1:
-
酰基载体蛋白
- 2:
-
4D:2,4-二氯毒乙酸
- SCG:
-
次生胚胎发生介质
- ACI公司:
-
文化开始后
- IZE:
-
未成熟合子胚
- 标签:
-
三酰甘油
- GC / MS:
-
气相色谱/质谱分析
- OA:
-
油酸
- 拉:
-
亚油酸
- 呃:
-
内质网
- 辅酶a:
-
辅酶A
- FAB2:
-
脂肪酸去饱和酶
- 脂肪:
-
脂肪acyl-ACP thioesterase
- 内:
-
3-ketoacyl-ACP合酶
- FAD2:
-
油酰desaturase
- FAD3:
-
Linoleyl Desaturase.
- FAD6:
-
膜甘油胆管上的Oleyl去饱和酶
- FAD7/8:
-
膜甘油脂上的亚麻油酰去饱和酶
- PC:
-
磷脂酰胆碱
- G3P:
-
甘油-3-磷酸盐
- 摘要:
-
溶血磷酸盐
- PA:
-
Phosphatidate
- DAG:
-
甘油二酯
- 标签:
-
三酰甘油
- PDAT:
-
磷脂:二酰基甘油酰基转移酶
- DGAT:
-
1, 2-sn-diacylglcyerol转移酶。
参考文献
- 1.
匿名:可可市场更新:世界可可基金会。2012,http://worldcocoafoundation.org/wp-content/uploads/cocoa-market-update-as-of-3.20.2012.pdf.那
- 2.
鸢尾属H, Goenaga R:基于嫁接树早期产量表现的可可无性系选择。农业大学学报2000,8(3-4):153-163。
- 3.
Irizarry H,Rivera E:五个地区的五个地区的早期产量在波多黎各。JAGRIC UNIV PR。1999,82(3-4):167-176。
- 4.
Cheesman EE, Pound FJ:可可均匀性试验。中国农业科学。2003,9(9):277-287。
- 5.
Maximova Sn,Alemanno L,年轻A,Ferriere N,Traore A,Guiltinan MJ:效率,基因型变异性和细胞胚胎细胞胚胎胚胎发生的初级和次级体细胞胚胎发生。2002,38(3):252-259。10.1079 / IVP2001257。
- 6.
vc,Hasegawa PM,Janick J:Asexual胚胎发生在Theobroma-Cacao L. J AM Soc Hortic SCI。1979,104(2):145-148。
- 7.
Lopez Baez O,Bollon H,Eskes A,Petiard V:来自Cocoa Theobroma-Cacao L.Cr Acad Sci III-VIE的细胞胚胎发生和植物再生。1993年,316(6):579-584。
- 8.
李ZJ,Traore A,Maximova S,Guiltinan MJ:使用Thidiazuron的Cacao(CacroMaoLmao.)的体细胞胚胎发生和植物再生。体外细胞驱动厂。1998,34(4):293-299。10.1007 / BF02822737。
- 9.
Lotan T, Ohto M, Yee KM, West MA, Lo R, Kwong RW, Yamagishi K, Fischer RL, Goldberg RB, Harada JJ:拟南芥叶子叶1在营养细胞中足以诱导胚胎发育。细胞。1998,93(7):1195-1205。10.1016 / s0092 - 8674(00) 81463 - 4。
- 10。
Stone SL, Kwong LW, Yee KM, Pelletier J, Lepiniec L, Fischer RL, Goldberg RB, Harada JJ:叶状子叶2编码一个B3域转录因子诱导胚胎发育。中国科学(d辑:地球科学),2001,21(4):591 - 598。10.1073 / pnas.201413498。
- 11.
Luerssen H,Kirik v,Herrmann P,Misera S:Fusca3用保守的VP1 / AB13样B3结构域编码蛋白质,这对于拟南芥中的种子成熟的调节具有功能性的重要性。工厂J.998,15(6):755-764。10.1046 / J.1365-313x.1998.00259.x。
- 12.
Braybrook SA,Harada JJ:LEC在胚胎发育中疯了。趋势植物SCI。2008,13(12):624-630。10.1016 / J.Plants.2008.09.008。
- 13.
Braybrook SA, Stone SL, Park S, Bui AQ, Le BH, Fischer RL, Goldberg RB, Harada JJ:叶叶子叶2直接调控的基因为胚胎成熟和体细胞胚胎发生的控制提供了见解。中国科学(d辑:地球科学),2006,30(9):1468 - 1473。10.1073 / pnas.0511331103。
- 14.
LEDWON A,GAJ MD:叶状曲囊2基因表达和植物素治疗与拟南芥胚胎细胞的胚性能力有关。植物细胞代表2009,28(11):1677-1688。10.1007 / s00299-009-0767-2。
- 15.
Feeney M,Frigerio L,Cui Y,Menassa R:在拟南芥叶片的植物中饲养胚胎细胞变化之后过表达叶状子叶2。植物理性。2013,162(4):1881-1896。10.1104 / pp.113.220996。
- 16.
Santos Mendoza M,Dubreucq B,Miquel M,Caboche M,Lepiniec L:叶状子叶2激活足以引发拟南芥叶片的油和种子特异性mRNA的积累。费用。2005,579(21):4666-4670。10.1016 / J.Febslet.2005.07.037。
- 17.
Baud S,Mendoza MS,到A,Harscoet E,Lepiniec L,DubRecq B:Wrinkdled1指定拟南芥种子成熟过程中叶状子叶2对脂肪酸代谢的调节作用。工厂J. 2007,50(5):825-838。10.1111 / J.1365-313x.2007.03092.x。
- 18.
叶子叶基因在诱导拟南芥体细胞胚发生中的作用植物学报。2005,222(6):977-988。10.1007 / s00425 - 005 - 0041 - y。
- 19.
郭FD,刘克,夏H,毕yp,赵力解,赵sz,侯l,李fg,王Xj:诱导atlec1和Atlec2的表达差异促进转基因烟草植物中的体细胞胚胎发生。Plos一个。2013,8(8):E71714-10.1371 / journal.pone.0071714。DOI:10.1371 / journal.pone.0071714
- 20.
左军,牛庆文,池田英,蔡恩华:无标记转化:利用再生促进基因提高转化频率。生物技术学报,2002,13(2):173-180。10.1016 / s0958 - 1669(02) 00301 - 4。
- 21.
胡萝卜细胞悬浮培养中内源生长素与体细胞胚胎发生的关系。张志刚,张志刚,张志刚。中国生物医学工程学报。1999,19(1):1 - 9。10.1016 / s0044 - 328 x(79) 80023 - 9。
- 22.
松香N:养肝对葡萄(Vitis-SPP)叶片蛋白细胞胚胎发生的影响。JPN J品种。1992,42(4):879-883。10.1270 / jsbbs1951.42.879。
- 23.
Visser C,Qureshi Ja,Gill R,Saxena PK:Thidiazuron的形态外科作用 - 养猪和细胞蛋白素的替代诱导恶性胚囊培养物中体细胞胚胎发生的要求。植物理性。1992,99(4):1704-1707。10.1104 / pp.99.4.1704。
- 24.
(2)拟南芥叶子叶2诱导成熟性状和生长素活性对体细胞胚发生的影响。中国科学(d辑:地球科学),2008,31(6):591 - 598。10.1073 / pnas.0712364105。
- 25。
Wojcikowska B, Jaskola K, Gasiorek P, Meus M, Nowak K, Gaj MD:叶状子叶2 (LEC2)通过yucca介导的生长素生物合成促进拟南芥体细胞胚发生。植物学报。2013,238(3):425-440。10.1007 / s00425 - 013 - 1892 - 2。
- 26。
Karami O,Aghavaisi B,Mahmoudi倾泻来:植物中体细胞致胚胎发生过渡的分子方面。J Chem Biol。2009,2(4):177-190。10.1007 / s12154-009-0028-4。
- 27。
Shen B, Allen WB, Zheng PZ, Li CJ, Glassman K, Ranch J, Nubel D, Tarczynski MC: ZmLEC1和zmwr1的表达增加玉米籽油产量。植物营养与肥料学报。2010,29(3):429 - 434。10.1104 / pp.110.157537。
- 28。
谭华,杨晓霞,张芳,郑晓霞,曲春,穆军,傅芳,李军,关瑞,张华,王刚,左军:油菜叶片子叶1和LEC1-LIKE基因在油菜籽粒中的条件表达。植物营养与肥料学报。2011,32(3):457 - 461。10.1104 / pp.111.175000。
- 29。
Maeo K,Tokuda T,Ayame A,Mitsui N,Kawai T,Tsukagoshi H,Ishiguro S,Nakamura K:AP2型转录因子,rapidopsis拟南芥拟合基因近端上游区域之间的Aw-box序列。参与脂肪酸合成。工厂J.2009,60(3):476-487。10.1111 / J.1365-313x.2009.03967.x。
- 30.
种子发展计划:双子叶植物和单子叶植物的系统生物学比较。植物学报。2013,64:189-217。10.1146 / annurev - arplant - 050312 - 120215。
- 31.
Romanel EA,Schrago CG,CuaraGo RM,Russo Ca,Alves-Ferreira M:B3 DNA的演变为Superfamily:新见解REM家族基因多样化。Plos一个。2009,4(6):E5791-10.1371 / journal.pone.0005791。
- 32。
Argout X, Salse J, Aury JM, Guiltinan MJ, Droc G, Gouzy J, Allegre M, Chaparro C, Legavre T, Maximova SN, Abrouk M, Murat F, Fouet O, Poulain J, Ruiz M:可可树基因组。acta photonica sinica, 2011, 43(2): 101-108。10.1038 / ng.736。
- 33。
Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990,215(3):403-410。10.1016 / s0022-2836(05)80360-2。
- 34。
Motamayor JC,Mockaitis K,Schmutz J,Haiminen N,Livingstone D,Cornejo O,Findley SD,Zheng P,Utro F,Royaert S,Saski C,Jenkins J,Podicheti R,Zhao M,Scheffler B:基因组序列最广泛栽培的可可类型及其用于识别调节豆荚颜色的候选基因。基因组Biol。2013,14(6):R53-10.1186 / GB-2013-14-6-R53。
- 35.
Mejia LC,Guiltinan MJ,Shi Z,Landerr L,Maximova SN:Cacao L的设计抗微生物肽的表达降低了植物植物植物SPP引起的叶坏死。ACS SYM SER。2012,1095:379-395。
- 36.
陈志强,陈志强,陈志强,等。硬脂酰-酰基载体蛋白去饱和酶基因在可可-豆科植物胚胎发育中的表达。植物学报。1994,13(1):83-88。
- 37.
超过一个卵黄:植物胚乳的短寿命和复杂时间。植物科学进展,2004,9(10):507-514。10.1016 / j.tplants.2004.08.007。
- 38.
史志强,张永强,陈志强,等:TcNPR3在植物抗病中的作用。生物谷bioon . 2013, 13: 204-10.1186/1471-2229-13-204。
- 39.
HARDING EW,TANG WN,NICHOLS KW,FERANDEZ DE,PERRY SE:通过抗敏氨酸般的15μl植物理性的组成型表达来增强胚胎源性潜力的表达和维持。2003,133(2):653-663。10.1104 / pp.103.023499。
- 40.
郑烨,仁n,王H,Stromberg Aj,Perry Se:全球鉴定拟南芥的目标肌肉域蛋白静脉蛋白静物蛋白蛋白静脉曲张蛋白蛋白。植物细胞。2009,21(9):2563-2577。10.1105 / TPC.109.068890。
- 41。
Nambara E, Naito S, Mccourt P:一个在种子发育和贮藏蛋白积累方面存在缺陷的拟南芥突变体是一个新的ABI3等位基因。植物学报,1992,2(4):435-441。10.1111 / j.1365 - 313 x.1992.00435.x。
- 42。
Monke G, Seifert M, Keilwagen J, Mohr M, Grosse I, Hahnel U, Junker A, Weisshaar B, Conrad U, Baumlein H, Altschmied L:拟南芥ABI3调控基因的鉴定与调控。中国生物医学工程学报,2012,31(4):531 - 534。10.1093 / nar / gks594。
- 43。
Moreno-Risueno MÁ, González N, Díaz I, Parcy F, Carbonero P, vicentere - carbajosa J:大麦FUSCA3揭示了谷物和拟南芥之间种子特异性基因的共同转录调控。植物学报,2008,53(6):882-894。
- 44.
Yamamoto-Toyoda A,Kagaya Y,Tanaka S,Tsutsumida K,Kagaya M,Kojima M,Sakakibara H,Hattori T:通过转录组分析显示的Fus3转录因子调节种子成熟的机制。植物细胞生理。2007,48:S190-S190。
- 45.
马文军,叶小刚:小麦幼胚体细胞胚发育过程中生长素暴露时间和过氧化氢酶代谢的变化与再生潜能的关系。植物营养与肥料学报,2013,34(2):451-460。10.1007 / s12033 - 012 - 9583 - y。
- 46.
陈建平,王志强,王志强:小麦体细胞胚胎发生过程中再生特性和基因转移的表达谱分析[j] .华北农学报,2013,40(10):5883-5906。10.1007 / s11033 - 013 - 2696 - y。
- 47.
acta botanica yunnanica(云南植物研究中心);acta botanica yunnanica(云南植物研究中心);植物学报,2003,21(9):872-883。
- 48.
Mejia L,Guiltinan M,Shi Z,Landerher L,Maximova S:设计抗微生物肽的表达Theobroma Cacao.L.树木减少叶坏死引起的疫霉SPP。ACS SYM SER。2012年,美国化学学会,1095:379-395。
- 49。
Maximova Sn,Marelli JP,Young A,Pishak S,Verica Ja,Guiltinan MJ:CaCaO类I Cacao L的CaCaO类胰蛋白酶基因的过表达增强了对病原体的抗性,Collettrichum GroooSporioides。Planta。2006,224:740-749。10.1007 / S00425-005-0188-6。
- 50.
Wu G-Z,Xue H-W:Arabidopsisβ-酮烷基 - α-己酰载体蛋白]合成酶I对于脂肪酸合成至关重要,并在叶绿体分区和胚胎发育中起作用。在线植物细胞。2010,22(11):3726-3744。10.1105 / TPC.110.075564。
- 51.
Moreno-Perez AJ, Venegas-Caleron M, Vaistij FE, Salas JJ, Larson TR, Garces R, Graham IA, Martinez-Force E:拟南芥中FatA硫酯酶的表达减少影响种子的含油量和脂肪酸组成。植物学报。2012,235(3):629-639。10.1007 / s00425 - 011 - 1534 - 5。
- 52.
二酰基甘油酰基转移酶:植物三酰基甘油合成的关键中介。油脂。2006,41(12):1073-1088。10.1007 / s11745 - 006 - 5057 - y。
- 53.
体细胞胚胎发生衍生咖啡(Coffea arabica L.)离体和离体再生植株的比较:形态、矿物和水分特征。张志强。基于遗传算法的计算机辅助设计[j] .计算机工程与应用,2003,19(1):1 -8。10.1093 / aob / mcf149。
- 54.
Kita Y,Nishizawa K,Takahashi M,Kitayama M,Ishimoto M:大豆细胞胚胎发生和再生的遗传改善和改良育种线的转化。植物细胞代表2007,26(4):439-447。10.1007 / s00299-006-0245-z。
- 55.
Samaj J,Baluska F,Pretova A,Volkmann D:植物缺陷诱导玉米体细胞胚胎发生的发育开关,涉及从内质子的微管和肌动蛋白长丝的重新分布到皮质细胞骨骼阵列。植物细胞代表2003,21(10):940-945。10.1007 / s00299-003-0611-z。
- 56。
Barthet VJ:(N-7)和(N-9)CIS-MONOUNSATURATED脂肪酸含量为12个芸苔属。植物化学。2008,69(2):411-417。10.1016 / J.Phytochem.2007.08.016。
- 57。
Zheng P, Allen WB, Roesler K, Williams ME, Zhang S, Li J, Glassman K, Ranch J, Nubel D, Solawetz W, Bhattramakki D, Llaca V, Deschamps S, Zhong G, Tarczynski M, Shen B: DGAT中苯丙氨酸是玉米含油量和组成的关键决定因素。acta photonica sinica, 2008, 40(3): 367-372。10.1038 / ng.85。
- 58。
DGAT1和DGAT2在三酰基甘油生物合成中具有非冗余功能,并定位于内质网的不同亚域。植物学报。2006,18(9):2294-2313。10.1105 / tpc.106.043695。
- 59.
张颖:饱和脂肪酸积累组织中植物甘油酰基转移酶的重组表达。2012,艾伯塔省埃德蒙顿:艾伯塔省大学
- 60.
Edgar RC: MUSCLE:多序列比对,高精度,高通量。核酸学报2004,32(5):1792-1797。10.1093 / nar / gkh340。
- 61.
Tamura K, Dudley J, Nei M, Kumar S: MEGA4:分子进化遗传学分析(MEGA)软件版本4.0。中国生物化学学报,2007,24(8):1596-1599。10.1093 / molbev / msm092。
- 62.
农杆菌介导拟南芥基因组文库的构建。生物技术学报,1991,9(10):963-967。10.1038 / nbt1091 - 963。
- 63.
Maximova Sn,Dandekar Am,Guiltinan MJ:使用绿色荧光蛋白的农杆菌介导的Apple介导的转化:高瞬时表达和低稳定的转化表明,T-DNA转移以外的因素是速率限制。植物mol biol。1998,37(3):549-559。10.1023 /答:1006041313209。
- 64.
Shi Z, Maximova SN, Liu Y, Verica J, Guiltinan MJ:拟南芥中可可NPR1基因的功能分析。植物生态学报。2010,30(4):481 - 481。
- 65。
从质谱库搜索结果中估计正确识别的概率。中国科学(d辑),1997,5(4):316-323。
致谢
我们要感谢来自蛋白质组学和质谱核心设施的Phillip Smith博士在气相色谱分析方面的巨大帮助,感谢Lena Landherr和Sharon Pishak在维护我们的可可组织培养管道方面的技术援助。我们也感谢安德鲁·费希尔提出的宝贵意见,以改进手稿。我们感谢位于波多黎各马亚圭斯的美国农业部农业研究所的布莱恩·爱尔兰提供的可可豆荚。这项工作得到了宾夕法尼亚州立大学农业科学学院、哈克生命科学研究所、美国研究机构宾夕法尼亚州立大学资助的可可豆分子生物学项目和美国国家科学基金会与比尔和梅琳达·盖茨基金会(NSF0965353)合作的BREAD项目(NSF0965353),该项目支持可可豆瞬时基因表达分析的发展。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
YZ进行了大多数实验,例如系统发育分析,基因表达分析,瞬态和稳定的转化测定,命名分析,并起草了手稿。AC参与了载体构建,基因表达分析,体细胞胚胎发生转化,并审查了手稿。SNM参与设计和指导实验,并修改稿件。MJG构思了这项研究,给出了关于实验的建议,起草并最终确定了稿件。所有作者阅读并认可的终稿。
电子辅料
12870 _2014_1520_moesm2_esm.pdf
附加文件2:TcLEC2, AtLEC2, AtFUS3和AtABI3全长氨基酸比对。所有四种蛋白质的黑盒子中的残基都是相同的;深灰色盒子中的残留物在四种蛋白质中有三种是相同的;浅灰色盒子里的残留物在四种蛋白质中有两种是相同的。(PDF 160 KB)
对照载体pGH00.0126和E12Ω::TcLEC2的异位过表达。
附加文件3:转化后3天拍摄叶片中GFP表达(可视化标记)的荧光显微照片(Bars = 0.4mm)。一种.对照载体转化可可C期叶片的GFP荧光图像。B..GFP荧光图像的可可阶段C叶子用E12ω:: TCLEC2转化。(PDF 4 MB)
12870 _2014_1520_moesm4_esm.pdf
附加文件4:E12Ω::TcLEC2的矢量图。TcLEC2和GFP转基因的定位,NPTII选择标记基因的定位,以及所有植物启动子和终止元件的定位。对照载体质粒(pGH00.0126, GenBank: KF018690.1)相同,但缺少E12Ω-TcLEC2-35S终结者转基因片段。(PDF 7 MB)
12870_2014_1520_moesm5_esm.pdf.
附加文件5:与PSUSCA6相比,SE中TcLEC2转化的相对瞬时GFP表达水平。(PDF 64 KB)
每片子叶外植体产生的非转基因胚总数的平均比较。
附文件6:每个培养基上放置16片子叶外植体。每次转化试验用3或4个板(作为生物复制)进行控制载体或E12Ω::TcLEC2的瞬时转化(n=3或4,平均值±SE)。一种.转型试验1(n = 3)。B..变换试验2 (n=4)。C.变换试验3 (n=4)。(PDF 4 MB)
对照载体的过度表达和Cacao Zygotic胚胎瞬态测定中的e12ω:: Tclec2。
额外的文件7:转化后五天捕获GFP表达(可视化标志物)的GFP表达(可视化标记)的荧光显微照片(棒= 2mm)。一种&B..用白色光和GFP荧光成像的控制载体转化。C&D..Ize用e12ω:: tclec2转换为白色光线和GFP荧光成像。(PDF 7 MB)
基因的表达水平不受瞬时过表达的显著影响
额外的文件8:TcLEC2(n=3,平均值±SE,通过t检验确定显著水平)。还测量编码TCWRI1的基因,但没有检测到表达。(PDF 55 KB)
12870 _2014_1520_moesm9_esm.pdf
附加文件9:可可脂肪酸生物合成相关基因列表。比较这些基因的表达在瞬时过表达对照载体和E12ω:: TCLEC2中进行了Cacao IZE。(PDF 759 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张玉华,张玉华,张玉华et al。这Theobroma Cacao.B3域转录因子TcLEC2在控制胚胎发育和成熟方面起着双重作用。BMC植物杂志14,106(2014)。https://doi.org/10.1186/1471-2229-14-106
已收到:
公认:
发表:
关键字
- LEC2
- 可可合子胚胎发育
- 可可体细胞胚胎发生
- 胚胎发生的潜在
- 脂肪酸生物合成