摘要
背景
茄属植物lycopersicum关于番茄在成熟期乙烯代谢的研究非常广泛,主要集中在果皮上。在这项工作中,乙烯生物合成途径检测了所有主要的番茄果实组织:果皮,隔膜,小柱,胎盘,房室凝胶和种子。在果实发育、成熟期和采后贮藏过程中,测定了组织比乙烯生产速率。所有乙烯中间代谢物(1-氨基环丙烷-1-羧酸(ACC),丙二醇-ACC (MACC)和年代-腺苷- l-蛋氨酸(SAM))和酶活性(acc -氧化酶(ACO)和acc -合成酶(ACS))进行了评估。
结果
各组织的乙烯产量变化规律相似,但幅度不同。在代谢和酶水平上发现了组织类型之间的巨大差异。果皮组织中乙烯含量最高,但ACC含量较低,ACS活性有限;房胶中ACC、MACC和SAM积累较多,ACO和ACS活性有限。中心组织(间隔、小柱和胎盘)显示ACC和MACC的强烈积累。这些差异表明乙烯生物合成途径是以组织特异性的方式组织和调节的。讨论了组织间和组织内运输的可能作用来解释这些差异。此外,ACO与乙烯生物合成抑制蛋白E8之间的拮抗关系被证明是组织特异性和发育调控的。此外,E8对乙烯的抑制不是通过ACO和E8之间的直接相互作用来实现的,如文献中所述。
结论
乙烯生物合成途径和E8在番茄果实发育和成熟过程中表现出组织特异性和发育分化。
背景
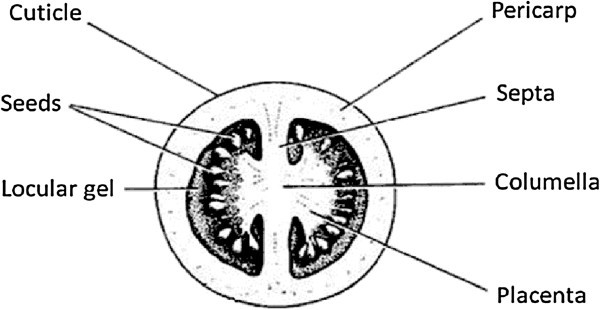
乙烯是一种调节更年期果实成熟的植物激素。多年来,番茄(茄属植物lycopersicumL.)已成为研究肉质果实成熟的模式作物[1和其他研究得很好的更年期水果(如苹果、牛油果、柿子或香蕉)相比,它的组织分工要复杂得多。番茄水果(图1)由种子所在的几个室室组成,周围的室室凝胶对其进行保护。种子通过珠柄附着在胎盘上。胎盘组织由更坚实的内部小柱组织连接。小柱组织通过花梗将果实与植株连接起来。每个子房由两个隔隔开,隔将小柱与果皮外组织连接起来,果皮外组织被果皮包围。
早期的工作已经很好地描述了乙烯生物合成途径的生化和分子组织和调控。乙烯是由其前体1-氨基环丙烷-1-羧酸(ACC)在氧气存在下由ACC氧化酶(ACO)合成的[2,3.].ACC也可通过ACC- n -丙二酰转移酶转化为生物非活性丙二酰-ACC (MACC) [4,5]或转化成少量的衍生物,如1-γ-谷氨酰胺- acc (GACC) [6或茉莉酸- acc (JA-ACC) [7].ACC本身由s -腺苷- l-蛋氨酸(SAM)由ACC合成酶(ACS)合成[8].
过去,番茄果实生物学几乎只关注果皮组织[9].人们对其他番茄果实组织的生理和生物化学知之甚少,更不用说它们的相互依赖性了。研究人员已经对番茄果实中的组织专业化进行了一些重点研究,例如DNA甲基化[10,多胺代谢[11,苹果酸和富马酸代谢[12,糖代谢[13] - [16]和光合作用[17].除了这些有针对性的研究外,一些大规模的组学研究也描绘了番茄果实组织之间的差异。通过转录组学和初级和次级代谢代谢组学进行组织特异性筛选[18] - [20.].最近,(9]分析了主要果皮细胞类型(外表皮细胞和内表皮细胞、胶原质、薄壁组织和维管细胞)的转录组,从而发现了果皮内角质层。
关于乙烯代谢,组织特异性分析在很大程度上是缺乏的,尽管先前的工作表明房室凝胶破裂在实际的果实成熟和果皮软化之前[21,22].房室凝胶先于其他组织产生乙烯[21它对外部乙烯的反应类似于果皮组织[23].在破裂阶段,凝胶和小柱组织比外果皮组织产生更多的乙烯,从而得出番茄果实由内到外开始成熟的结论[21].acc - n -丙二酰转移酶在柑橘果皮组织和成熟种子中形成MACC最为活跃[24].GACC的形成在成熟番茄的果皮和胎盘组织以及破果果的种子中最为活跃。6].
我们之前的工作对果皮组织中的乙烯代谢进行了广泛的靶向系统生物学研究,揭示了在收获后的一种新的调控模式,其中ACO是速率限制步骤[25].在系统生物学方法的更广泛的概念中,我们提出了番茄乙烯生物合成途径的组织特异性研究。所有主要果实组织在果实发育、成熟期和采后贮藏过程中均有分布。测定中间代谢物(SAM、ACC和MACC)、ACS和ACO活性以及组织特异性乙烯产量。这种详细的筛选可以对乙烯代谢进行全面的3D解释,识别出水果内部的许多组织特异性生化差异。我们的数据清楚地表明,乙烯代谢在番茄中的组织和调节是不同的。
结果
果实成熟生理特性
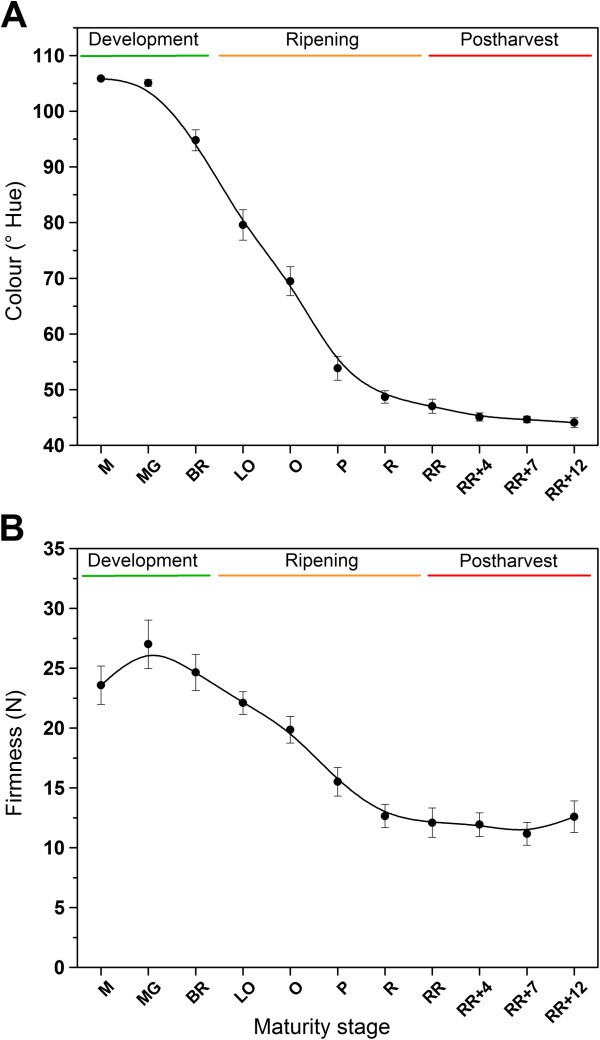
为了表征番茄果实不同成熟期的特性,对完整果实的颜色、硬度、修复性和乙烯产量进行了测定。数字2和图3.在果实发育、更年期成熟和采后贮藏期间显示这些性状的结果。水果的颜色范围从绿色(约107°)到红色(约45°)。与果实成熟相对应的颜色的最强下降从破果期开始,直到红熟期。在采后贮藏期间,果实颜色不再发生变化。果实硬度从破裂期一直下降到红熟期,与成熟过程密切相关。在采后贮藏期间,硬度保持不变。水果呼吸速率(CO2小果实的产量很高,但迅速下降。在果实成熟初期(破裂期),呼吸速率短暂增加,与果实的更年期行为相对应。在果实发育过程中,果实乙烯产量较低,这与乙烯自抑制系统1的乙烯基础产量水平相对应。从裂解阶段开始,果实乙烯产量急剧增加,与系统2的自催化乙烯产量水平相对应。在更年期后期,乙烯产量又逐渐下降。
缠绕乙烯的表征
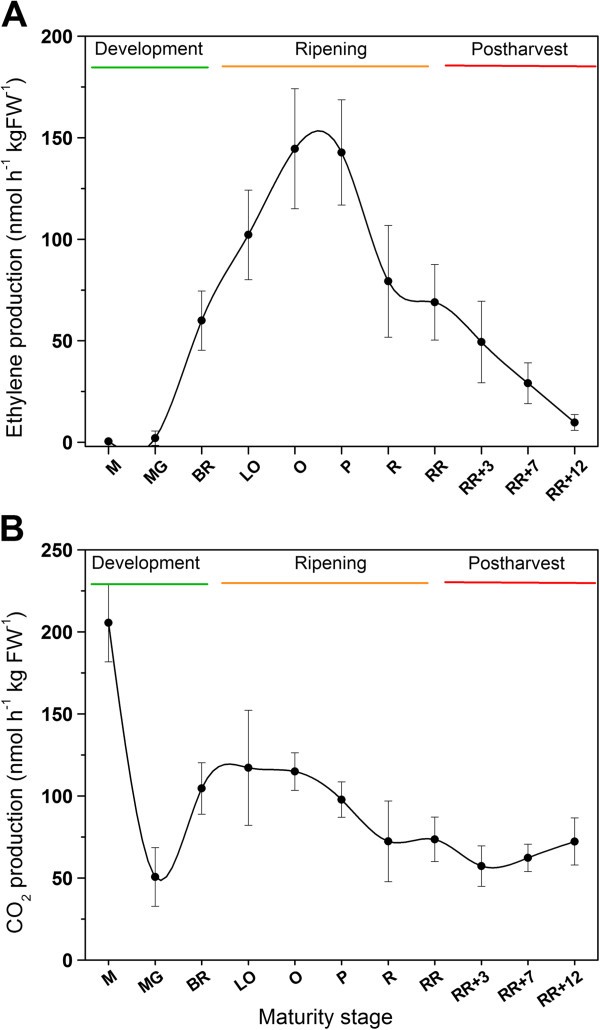
为了研究不同组织的乙烯自主生产水平,需要解剖水果,这反过来触发了伤口乙烯反应。为了从自主组织特异性乙烯生产水平中排除额外的伤口乙烯,我们需要知道伤口乙烯何时开始并变得可观察到。数字4显示了三个不同成熟期(成熟青、破、红)果实切块后的乙烯释放速率。这张图可以分为三个不同的阶段。第一阶段(1)的特征是乙烯释放速率下降。这种最初的下降可以用损伤细胞/组织中扩散梯度的降低来解释。内部乙烯水平迅速下降,因为主要的气体扩散屏障被移除,由于切割水果。与成熟的绿色果实相比,红色果实和破裂果实的乙烯释放速率下降得更厉害,可能是因为这些果实最初含有更多溶解的乙烯,因此在受伤后可以扩散出组织。伤后25 ~ 65 min,乙烯释放速率基本不变。第二阶段(2)对应于切片番茄果实的自主乙烯生产水平。这张图代表了所有组织的整体乙烯产量水平,因为整个水果被切成小块。伤人后65分钟,乙烯产量再次缓慢增加。 This third phase (3) is characterized by the wound-induced ethylene response. Note that breaker fruit had a higher wound ethylene production rate compared to mature green or red wounded tomatoes. Breaker fruit also showed more variation in their ethylene production rate, probably because this group is in transition from immature green to ripening fruit. This graph clearly shows that it lasts up to one hour before wound ethylene production starts. It also shows that measuring ethylene production levels immediately after wounding can be misleading. Therefore all subsequent experiments were done during the autonomous ethylene production phase: 25 – 65 min after wounding.
数据归一化
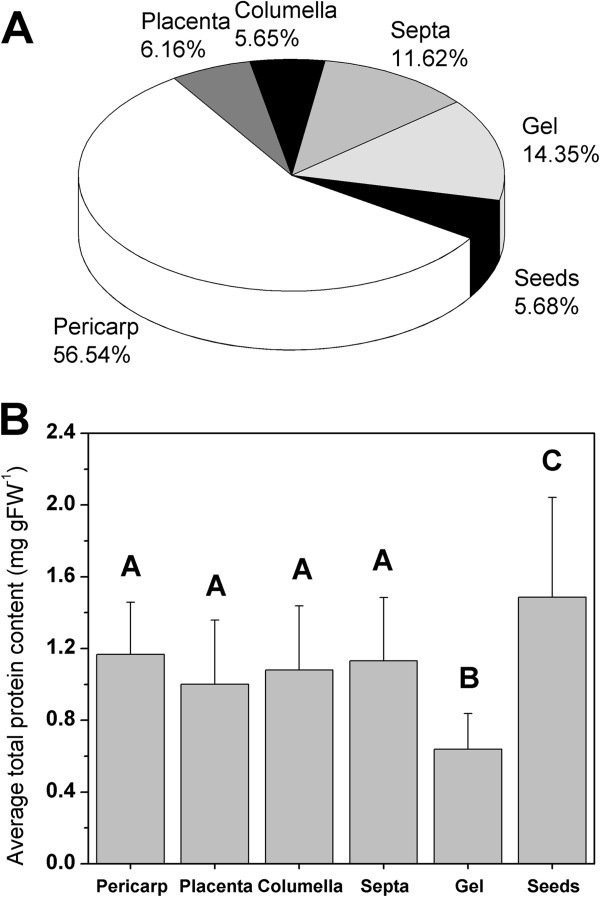
由于不同的组织包含不相等的水分和干物质,人们通常通过表示相对于组织的总蛋白质含量的测量值来规范化生化数据。数字5显示了不同组织对番茄果实新鲜重量的平均贡献百分比和不同组织的平均蛋白质含量(在所有成熟阶段的平均值)。很明显,果皮是番茄果实中最丰富的组织,种子和小柱是最不丰富的组织。所有的组织都有或多或少相同的蛋白质含量(大约在1.0-1.5毫克gFW之间-1),除了凝胶,它含有大约一半的蛋白质(约0.7毫克gFW)-1).该组织特异性蛋白含量用于规范化收集的代谢和酶数据。
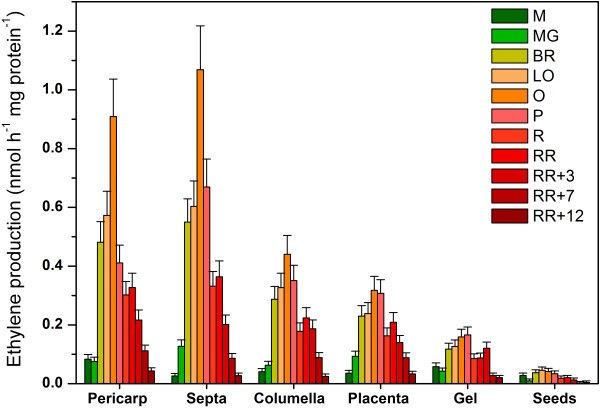
乙烯的产生是组织特异性的
在乙烯自主生产阶段测量了不同组织的乙烯产量。因为不是所有的组织都有相同的干物质含量,乙烯生产速率表示与组织的蛋白质含量,而不是他们的新鲜重量。数字6显示每个番茄果实组织的乙烯产量(以纳摩尔/小时毫克蛋白质为单位)。尽管以同样的方式归一化,单个组织产生的乙烯远远少于整个果实(见图)3.).各组织均表现出果实发育时期乙烯产量低、成熟过程中自催化增产、成熟后和采后贮藏过程中乙烯产量下降的变化规律。乙烯的产生速率以果皮和萼片最高,胎座和小柱居中。凝胶的增温幅度最小,而种子的乙烯产量基本保持在基础水平。在收获后的最后阶段,所有组织的乙烯产量下降到同样低的水平。
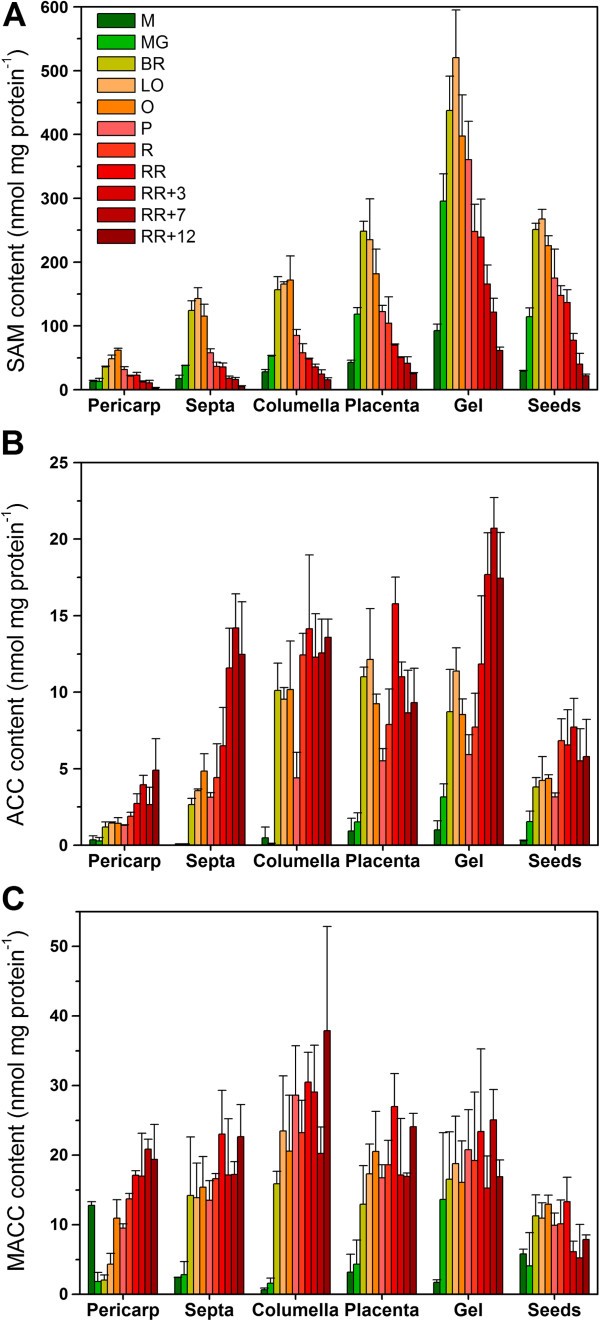
乙烯生物合成代谢产物(SAM、ACC和MACC)的表征
除了乙烯的产生,该途径的所有中间代谢物在果实发育、成熟和采后贮藏期间都被量化(图7).除SAM外,所有组织均表现出相似的代谢谱。籽粒中SAM含量在成熟前增加,在红红期再次下降。SAM含量的变化总是先于乙烯产量的变化。凝胶中的SAM含量最高,大约是果皮中SAM含量的10倍。与果皮相比,种子、间隔、小柱和胎盘也含有大量的SAM。
在果实发育过程中,ACC和MACC含量极低,在果实成熟初期开始升高。两种代谢物在所有组织中持续增加,在采后贮藏期间达到最高水平。ACC在房腔凝胶(如SAM)中最为显著,在果皮组织中最低。MACC水平远高于ACC水平(如果皮组织约为4倍)。MACC主要存在于凝胶和小柱中,但果皮、隔膜、胎盘和凝胶中也含有大量的MACC。种子中MACC含量最低。
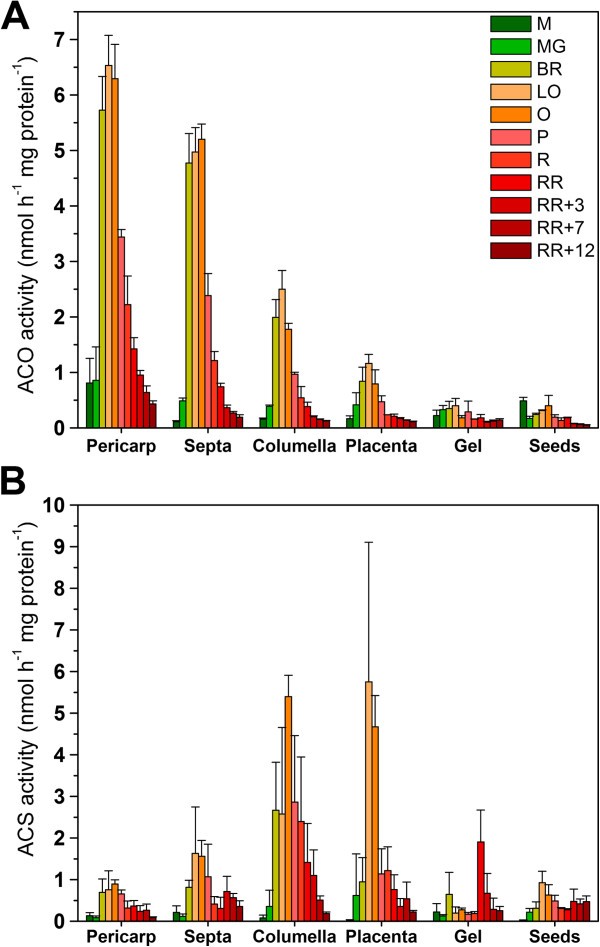
酶活性(ACO和ACS)的表征
为了获得更多关于代谢物如何合成和消耗的信息,在体外在果实发育、成熟和采后贮藏期间,测量了所有不同组织中ACO和ACS的酶活性(图8).ACO活性表现为更年期模式在活的有机体内乙烯生产(见图)6),换句话说,在果实发育过程中活性较低,在果实开始成熟时活性显著增加,在进一步成熟和采后贮藏过程中活性逐渐下降。果皮组织ACO活性最高,其次是间隔和小柱。凝胶和种子几乎没有显示出任何ACO活性,尽管凝胶有一些在活的有机体内乙烯生产。
ACS活性从破溃期开始增加,在浅橙黄色期达到最大值。果皮、种子和凝胶在成熟过程中仅表现出较低的ACS活性,而间隔表现出中等的ACS活性。胎盘和小柱等内部组织的ACS活性最高,约为果皮组织的6倍。
Western blotting显示ACO与E8之间存在拮抗关系
因为ACO被发现是围变后期乙烯生产的速率限制步骤[25],我们决定进一步研究组织特异性乙烯生物合成在蛋白质水平上对ACO的蛋白印迹(图9).本试验中使用的抗体针对一种保守肽,存在于四种ACO亚型(ACO1-4)中。值得注意的是,观察到两条清晰的条带(在印迹上用数字1和2表示)。下面的带(2)与ACO的预测蛋白质量相匹配,上面的带(1)位于高10 kDa左右。当用商业抗aco抗体开发Western blots时,也可以观察到这两个离散的条带,对番茄叶和苹果果实组织也可以观察到1:图S1)。为了识别这两个波段,在SDS-PAGE的37 kDa区域周围的不同区域进行了MALDI-TOF/TOF质谱肽段测序(附加文件1:图S2)。通过分析,ACO蛋白被确定为低带(2),前面描述的E8蛋白被确定为上带(1)。
有了这些知识,西方墨迹图如图所示9进行了进一步的分析。ACO丰度与ACO相关在体外在所有组织和整个发育时期的活动。在某些阶段,甚至可能看到两个条带彼此重合(例如,在破裂阶段的小柱),这很可能代表两种不同的ACO异构体。
Western blot分析还发现E8在果实发育和成熟过程中与ACO呈拮抗关系。当ACO丰度下降时,E8丰度增加(在收获后阶段),在粉色期附近有轻微重叠。有趣的观察是,E8在胎盘中高度丰富,而ACO含量几乎没有观察到,ACO活性是最低的。不产生大量乙烯的种子只显示出少量的E8。另一方面,凝胶没有显示出任何可观察到的ACO或E8的量。
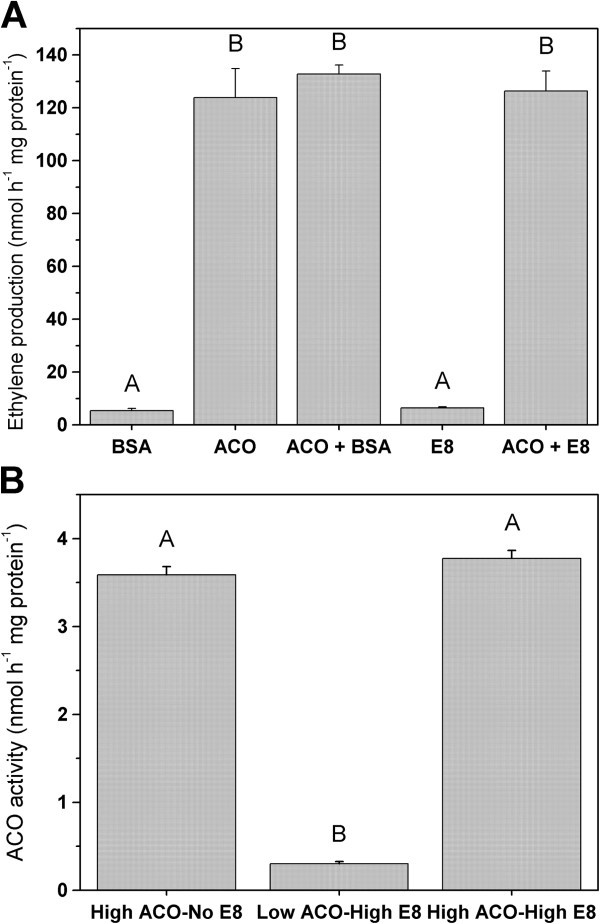
E8对ACO活性无直接抑制作用
为了进一步研究E8与ACO丰度/活性,特别是乙烯产量之间的拮抗关系,进行了过表达研究。对ACO1而且E8含c端His-tag扩增的全长cDNA序列,在大肠杆菌(BL21)。IPTG诱导后,使用Ni-NTA柱从总细胞裂解液中纯化两种蛋白质,并在考马斯色染色SDS-PAGE上检查其纯度和鉴别1:图S3)。纯化后的蛋白也用MALDI-TOF/TOF进行双重检查,以进一步鉴定和Western blot检测抗体特异性(附加文件1:图S4)。所有这些结果表明,ACO1和E8确实都是过表达和高度纯化的。本研究中使用的抗体与ACO和E8相互作用1:图S5),尽管这两种蛋白质彼此之间只有有限的氨基酸序列相同(34%;额外的文件1:图S6)。
一个在体外结果表明,E8对ACO产乙烯无抑制作用10).对于纯化的异位表达酶和提取的番茄果皮蛋白样本都是如此。Western blot数据结合这些活性分析表明E8明显表现出与ACO的拮抗关系,但E8不可能通过ACO介导的蛋白相互作用影响乙烯的产生。E8的确切生化功能有待阐明,下文将进一步讨论。
讨论
乙烯代谢的组织特异性热图可视化
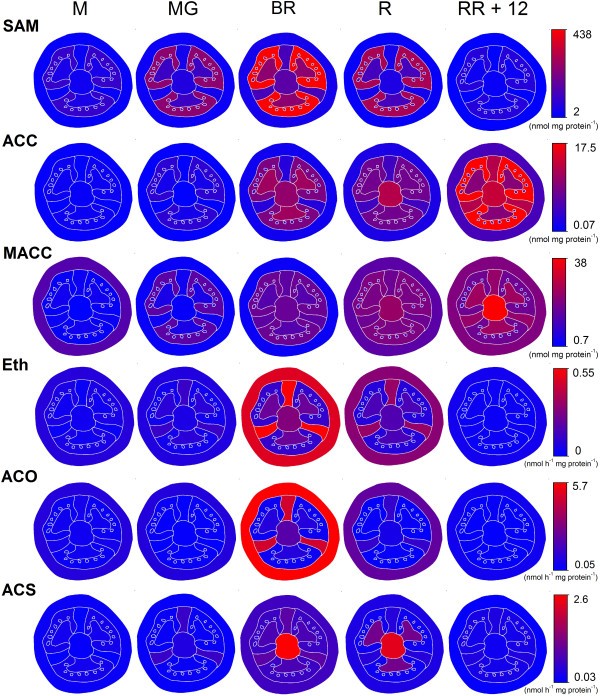
为了总结果实乙烯代谢的主要变化,对果实不同组织在5个主要发育阶段(小、成熟绿、破裂、红、RR + 12)进行了热图可视化分析。该可视化(图11)可以直接解释每个组织的每个代谢物或酶的活性,相对于邻近的组织。乙烯生产和ACO在体外活动之间是密切相关的。这意味着乙烯主要在果皮组织中产生,尽管其前体代谢物ACC和SAM在果皮中含量很低。SAM主要位于凝胶中,在成熟的绿色阶段非常丰富,刚好在乙烯生产开始之前。ACC含量在凝胶中也很高。MACC主要位于凝胶和其他内部组织(小柱、胎盘和间隔)中,只在采后贮藏期结束时在果皮中积累。乙烯的产生似乎与ACS活性关系不大,ACS活性主要发生在成熟过程中的中心组织(小柱和间隔)和采后贮藏阶段的种子中。总的来说,图11说明了番茄果实中乙烯代谢的强组织特异性组织。
乙烯代谢是以组织特异性的方式组织的
通过对所有乙烯生物合成中间体和酶活性的选择性分析,全面表征了番茄果实成熟过程中的乙烯内部代谢。为了合成乙烯,细胞需要底物(ACC和SAM)、必要的酶(ACO和ACS)和其他必要的辅助因子(Fe)2 +和吡哆醛-5-磷酸),激活剂(碳酸氢盐)和辅助底物(抗坏血酸和氧)。从数据可以清楚地看出,果皮组织产生的乙烯最多(两者都是)在活的有机体内而且在体外).虽然果皮组织具有很高的ACO活性,但它只有有限的ACS活性和最低水平的前体(ACC和SAM)。这表明果皮中由ACS形成的ACC都能迅速转化为乙烯,证实了ACS是乙烯生物合成的限速步骤(如前所述)。26])。果皮组织产生的乙烯量最高,而ACC和acs活性最低。可能是果皮组织积累的ACC较少,因为它具有较高的ACO活性,而其他组织(如胎盘和小柱)可以积累更多的ACC,因为它们的ACS活性较高,因为它们产生的乙烯较少,但这并不能解释在果皮组织中观察到的ACS活性较低。为了达到如此高的乙烯合成速率,ACC可能是从另一个组织(如凝胶)供应到果皮的。果皮中MACC含量较低,说明ACC主要用于乙烯的生物合成,而不是MACC的形成。这些观察表明,果皮中ACC的水平保持在足够高的水平,以确保乙烯的充分生产。总之,这些差异表明乙烯代谢在不同的组织类型中受到不同的调节。
另一方面,房性凝胶几乎没有显示任何ACO和ACS活性,尽管它含有大量的中间产物(ACC和SAM)。这表明代谢物很可能来自不同的组织,并在凝胶中积累。也许凝胶起着某种存储组织的作用,从周围的某些组织(如胎盘)接收多余的代谢物,并向其他需要代谢物的组织(如果皮)提供代谢物。
隔、小柱和胎盘均含有中间量的SAM和ACC,表现出相当高的ACS活性。因此,乙烯生物合成的最终速率似乎是由ACO的量决定的。实际上,间隔和小柱中的中间ACO活性会产生中间产物在活的有机体内乙烯的生产,而较低的ACO活性在胎盘反映在一个较低在活的有机体内乙烯的产生,与胎盘中的大腿ACS活性相反。这些数据表明ACO可能是这些组织的控制和/或速率限制步骤。
从结果可以清楚地看出,乙烯代谢是有组织的特定组织,因此每种组织类型都有与乙烯生物合成相关的独特的代谢/酶谱。这种差异调节很可能与每个组织的特定生理功能相匹配。尽管如此,在整个果实发育过程中,所有组织的乙烯生产都表现出相似的更年期模式,但振幅不同。这说明,尽管乙烯代谢存在组织特异性差异,但果实成熟的发育线索在每个组织中都是程序化的。
ACO与E8之间的拮抗关系在不同的组织和果实发育过程中保持不变
在我们的研究中,抗体显示出与E8酶的交叉反应,揭示了与ACO丰度的拮抗关系。E8先前被鉴定为番茄中的乙烯诱导基因[27].其表达通过成熟诱导,并通过乙烯处理以剂量响应方式增强[28].对E8反义系的研究表明,E8蛋白在成熟过程中缺失,导致乙烯产量增加[29,30.].这些结果表明,E8是乙烯和成熟诱导的,是乙烯生物合成和/或番茄果实成熟的负调控因子。
结果表明,ACO丰度与E8丰度之间存在发育和拮抗关系。当成熟过程中ACO丰度下降时,E8丰度就会增加。E8含量的增加也与乙烯产量的下降相一致,证实了E8和乙烯产量之间的负相关关系,如之前的文献所述。此外,我们的研究结果还表明,某些只产生少量乙烯的组织(如种子、胎盘和小柱)都显示出较高的E8含量,这表明E8也以组织特异性的方式对乙烯的产生产生负面影响。
这些结果与这两种蛋白质都是依赖于2-氧戊二酸的双加氧酶的事实相结合[31两种酶都含有亮氨酸拉链,这可能表明ACO和E8之间存在直接的蛋白质相互作用。尽管如此,两种酶只有34%的氨基酸序列相似1:图S6)。为了进一步表征这种拮抗关系,ACO和E8都进行过表达和纯化。在体外酶法测定表明,在E8存在的情况下,ACO对乙烯合成没有抑制作用,而且E8在测试条件下自身不产生任何乙烯。本研究表明很可能ACO和E8之间没有直接的相互作用,这与之前文献的观点相矛盾[30.].也许E8对乙烯生产的负面影响是通过另一种间接调控或通过代谢反馈实现的。E8是双加氧酶家族的一员,和许多双加氧酶一样,E8可能参与次生代谢物的生物合成途径。也许这种来自E8介导的合成代谢的次生代谢物,可能对乙烯的生物合成有深远的影响。虽然E8的确切生化功能尚未阐明,但我们的研究结果表明,ACO和E8之间没有直接的相互作用,E8和乙烯产量之间的拮抗关系在番茄中是组织和发育调控的。
ACC的细胞间、细胞内和细胞外易位或韧皮部和木质部介导的转运可能调节局部乙烯的生物合成
测定的代谢浓度和/或酶活性是一种稳定状态的观察,即合成、消耗和运输的净总和。运输的最后一项经常被忽视。代谢物的转运可能会澄清本研究中所测代谢物及其相应酶之间的一些差异。例如,房室凝胶含有大量的代谢物(SAM, ACC和MACC),但只显示非常少的ACO和ACS活性。也许来自其他组织的代谢物会迁移到贮存它们的凝胶(或重定向到其他组织)。另一方面,果皮组织只显示出有限的ACS活性,而产生最高数量的乙烯。也许ACC是由其他组织供给到果皮的比如凝胶?这两种假设都要求细胞具有ACC运输能力(主动或被动)。
代谢物(和/或蛋白质)的局部运输可以是细胞内(主要是被动扩散,或不受细胞质流的促进)或细胞间(通过胞间连丝的共塑运输或胞外运输)[32] - [34].长距离运输通过韧皮部(代谢产物和大分子)和木质部(主要是水、糖、离子、氨基酸和激素)[35,36].ACC从根系到地上部分的长距离运输是番茄植株遭受根系胁迫(盐度、水分亏缺和缺氧)时的典型反应[37] - [39].这种顶瓣运输需要木质部对高极性的非蛋白氨基酸ACC进行特定的加载和卸载。棉花植株中也观察到韧皮部介导的ACC转运[40].也观察到细胞内被动和主动的ACC运输穿过液泡体[41,42].ACC装载的确切机制和这些ACC转运体的结构特征仍有待发现。总之,这些观察表明,细胞拥有多种工具来适应ACC从一个组织到另一个组织的运输。这些潜在的运输系统将为果实提供一种额外的调节机制,以控制果实在特定发育阶段某些部位的乙烯生产水平。
SAM和MACC的转运也能调节乙烯的生物合成吗?
对于ACC的丙二酰衍生物也可以做出类似的反应。这种代谢物的重要性在整个果实中都是保守的,因为我们的结果表明,MACC在所有分析的组织中都非常丰富。这些结果也证实了MACC是最终产品的普遍看法,因此很容易积累[26].注意,本研究中使用的检测方法没有区分MACC和其他衍生物,如GACC和JA-ACC。最后这些衍生物的特征很差,只占ACC衍生物库的一小部分。尽管如此,这些衍生品的重要性可能被低估了。此外,在植物中观察到两次MACC形成的反反应(MACC水解)[43,44,提供了一种潜在的控制乙烯生物合成的机制。MACC可能是最终产物的事实也得到了观察结果的支持,即MACC可以通过atp介导的液泡体载体从细胞质转运到液泡,然后再转运回来[41,45,46].也许这些或类似的过程可以控制MACC在不同组织之间的转运量。
对SAM的了解较少。尽管这个重要的分子有多种作用途径,但在许多乙烯相关的研究中,它常常被忽略。除了乙烯的生物合成外,SAM主要参与多胺的生物合成和众多的转甲基化反应[47].这种多方面的使用需要通过合成、消耗、回收和可能的易位对SAM池进行严格的监管[48].在拟南芥中鉴定了SAM特异性转运蛋白,以确保SAM从细胞质转运到线粒体和叶绿体[49].这种亚细胞离域的SAM是否会对乙烯的生物合成产生影响,或者SAM是否也可以在不同的组织之间运输,还有待研究。
结论
为了更好地理解乙烯在番茄成熟过程中的生物合成,对不同果实组织:果皮、间隔、房室凝胶、胎座、小柱和种子的乙烯生物合成途径进行了分析。结果表明,所有组织在乙烯生产过程中表现出相似的更年期模式,但中间代谢物和酶的差异较大。房房凝胶只产生少量的乙烯,但积累了大量的中间产物(ACC、MACC和SAM)。中心组织(隔膜、胎盘和小柱)主要积累ACC和MACC。果皮组织在成熟过程中乙烯产量最高,但只含有有限的中间产物,令人惊讶的是只显示出轻微的ACS活性。此外,还研究了ACO与E8的拮抗关系。研究还表明,这两种蛋白质不相互作用以抑制乙烯的产生。最后,讨论了组织间和组织内运输以适应观察到的组织特异性差异,这可能是控制水果乙烯生产的潜在机制。
方法
植物材料
番茄果实(茄属植物lycopersicumL. ' Bonaparte ')的不同成熟期从Sint-Katelijne-Waver和Hoogstraten蔬菜生产研究站(比利时)于2013年3月至5月收获。在自然闪电条件下,在最佳温度(23/21°C /日夜)和湿度(70% RH)下,在岩棉上水培,以获得商业产量。每个成熟期12个果实(中等大小,M;成熟的绿色,毫克;断路器,BR;光橙色,瞧;阿,橙色;粉色,P;红,R和红熟,RR)的果实颜色,硬度,乙烯生产和呼吸速率(CO2生产)由[22,50].另外,在18°C和80% RH的保质期条件下,采后贮藏4天、7天和12天(每个阶段12个果实),采集红熟果实进行分析。
这些批次的水果随后被解剖,在液氮中粉碎,并在- 80°C保存,以进一步测量代谢和酶活性。
缠绕乙烯的表征
组织特异性鉴定只能通过解剖果实来实现。这种破坏性操作诱导了伤口的乙烯反应,应该考虑到,以排除伤口诱导的乙烯生产从自主组织的乙烯生产能力。在三个不同的成熟阶段(成熟的绿色、破碎和红色),分别收获了5个水果,以评估这种伤口乙烯反应。在收获后,每个水果都被单独切成小块,因此所有不同的组织类型都被混合在一起,形成5个生物重复。从这个组织混合物,来自一个水果和代表所有的组织,3克新鲜重量在一个密封玻璃罐中(20毫升)培养5分钟,包含隔膜。顶空中的乙烯通过气相色谱法(紧凑气相色谱法,Interscience, louvin -la- neuve,比利时)进行评估,描述如下[50].乙烯测量结束后,用正常空气对样品进行短暂冲洗,再次密封5分钟。在损伤后200分钟的总时间段内,以固定时间间隔连续监测顶空的乙烯水平,期间进行系统冲洗。这个实验允许对伤口诱导的乙烯生产尚未开始的时间段进行表征。
组织特异性乙烯生产的评估
为了测量组织特异性乙烯产量,每个成熟阶段的另一批12个果实被解剖,每个成熟阶段的不同组织类型被聚集在一起。这样做是为了每个组织有足够的材料来评估乙烯的生产。这个过程重复3次,以获得3个生物重复。在伤口无乙烯时隙中评估了组织特异性乙烯生产(见上文)。乙烯产量测量每3克新鲜重量的组织类型。将组织置于20ml含隔的密闭玻璃罐中孵育5分钟。顶空中乙烯含量的测量方法为[50].
代谢物和酶活性测定
最初对每个成熟期的12个番茄进行了整体果实乙烯产量评估,随后将其解剖,不同的组织在液氮中快速冷冻,并在−80°C保存。为了有足够的材料进行所有的生化分析,来自12个水果的组织被汇集在一起,这个过程重复了3次,以进行3次生物重复。对于每个成熟阶段和每个组织类型,从乙烯生物合成途径的所有代谢物(SAM, ACC和MACC)和酶活性(ACO和ACS)都进行了量化。用毛细管电泳(P/ACE-MDQ, Beckmann Coulter, Fullerton, CA, USA)在甘氨酸:磷酸盐缓冲液(300:50 mM, pH 2.5)中提取和定量SAM,如[51].ACC和MACC含量的测量方法与[50].
的在体外ACO和ACS的酶活性也通过[50],但对于ACO评估,MOPS缓冲液被100 mM Tris缓冲液(pH 8.0)所取代,ACO测定的孵育时间优化为15分钟。ACO和ACS提取液的总蛋白含量在Bradford测定后测定[52].
ACO蛋白印迹
针对四种ACO亚型(ACO1 [UniProt P05116]、ACO2 [UniProt P07920]、ACO3 [UniProt P10967]和ACO4 [UniProt P24157] - CQDDKVSGLQLLKDE)的共识表位开发了多克隆抗体(GenScript, GE Healthcare, Piscataway, NJ, USA)。对于SDS-PAGE, 15 μg总蛋白含量加载在12孔8-16% TGX Criterion预制凝胶(Bio-Rad, Hercules, CA, USA)上,在Laemmli缓冲液中180 V运行45分钟。在转移缓冲液(25 mM Tris, 140 mM甘氨酸,20% (V / V)甲醇)的存在下,在PVDF膜(GE Healthcare)上进行电印迹1小时20分钟,电压为100伏。膜在含5%奶粉的TBS-T (25 mM Tris, 125 mM NaCl和0.1% (v/v) Tween-20)中阻塞1 h。封膜后,用一抗溶液(1/1000抗aco AB在5%奶粉TBS-T中)在4℃下孵育过夜。随后将膜在TBS-T和二抗(1/2000 Anti-Rabbit-HRP-linked AB;Cell Signaling Technologies Inc., Danvers, MA, USA)在4℃下孵育2小时。再次清洗膜,随后使用Clarity ECL西底物(Bio-Rad)进行增强化学发光,并使用ImageQuant LAS4000系统(GE Healthcare)进行检测。
质谱法鉴定ACO和E8
在western blot上,在37kda附近可见两个条带。为了识别这些条带,我们对从考马斯色染色凝胶中分离出来的37 kDa左右的几个区域进行了MALDI质谱分析。切割出来的区域在凝胶如前所述,使用胰蛋白酶消化并提取[53].MALDI质谱分析采用4800 MALDI TOF/TOF质谱仪(4800蛋白质组学分析仪,应用生物系统公司,福斯特市,CA, USA)进行。测量在正离子模式下执行,质量范围设置在900-3500之间m / z.对于每个波段,选择15个强度最大的离子进行MS/MS分析。使用了胰蛋白酶自消化产生的峰值排除表。得到的峰值列表被提交到吉祥物数据库服务器(版本2.2)进行识别,并辅以NCBI的番茄蛋白质序列数据库。对其他感兴趣的物质进行质谱/质谱分析进行鉴定。
ACO1和E8的克隆、过表达和纯化
ACO和E8蛋白的过表达进一步研究。两个基因的全长cDNA (ACO1[NCBI ×04792]为ACO和E8[NCBI X13437])被克隆到pET28a载体(使用XbaI和SalI),导致与c端His-tag融合。质粒序列经测序验证,转化为BL21 (DE3)大肠杆菌蛋白过表达菌株。在35°C下共培养500 mL,直到OD达到0.5-0.6。加入1 mM IPTG诱导蛋白表达,30°C孵育3 h。细胞在4℃4800 × g离心15 min后收集,并在15 mL的50 mM Tris pH 8.0中洗涤颗粒。悬浮液再次在4℃、4800 × g离心15分钟。裂解球在裂解液中溶解(4 mL / g细胞),裂解液中添加1 mg mL-1溶菌酶,5 μg mL-1 DNase I和10 μg mL-1 RNase。随后将悬浮液以20%的浓度在冰上超声30秒,然后休息30秒,总时间为4分钟。重复三次。然后在4℃,10 000 × g离心40 min,上清保存于- 80℃进一步纯化。
裂解液在UPLC系统(AktaPurifier, GE Healthcare)上使用Nikkel-NTA色谱柱进行纯化。过表达蛋白(ACO和E8)用80 mM咪唑洗脱,20 mM磷酸盐,0.5 M NaCl, pH 7.4。为了验证洗脱液的纯度,样品在SDS-PAGE上进行考马斯色染色。通过MALDI TOF/TOF质谱(如上所述)进行额外的肽序列测序,以验证蛋白质的鉴定。
代heat-plots
为了以组织特异性的方式可视化结果,构建了主要发育阶段的热图。这允许直接观察主要代谢和酶的差异在发育和组织特异性的方式。利用Microsoft Office软件生成了番茄果实横截面的文本图像®用图像J重新上色54].每个组织都有一个固定的颜色刻度(0 - 255),对应于每个数据集的最小值(0)和最大值(255)之间的测量值。
统计分析
使用统计分析软件(SAS企业指南4.2;SAS研究所Inc .)。置信区间设为95%。
参考文献
- 1.
乔凡诺尼JJ:果实发育和成熟的基因调控。植物学报,2004,16:S170-S180。10.1105 / tpc.019158。
- 2.
Hamilton AJ, Bouzayen M, Grierson D:通过酵母表达鉴定番茄乙烯生成酶基因。美国国家科学研究院。1991年,88:7434 - 7437。10.1073 / pnas.88.16.7434。
- 3.
董建刚,杨淑芳,杨建刚:苹果果实中1-氨基环丙烷-1-羧酸氧化酶的纯化与鉴定。美国国家科学研究院。1992年,89:9789 - 9793。10.1073 / pnas.89.20.9789。
- 4.
霍夫曼,杨顺峰,Mckeon T:高等植物中乙烯前体1-氨基环丙烷-1-羧酸的主要共轭物1-(丙二胺基)环丙烷-1-羧酸的鉴定。生物化学与生物物理学报,2002,23(3):366 - 366。10.1016 / 0006 - 291 x(82) 90703 - 3。
- 5.
刘勇,Hoffman NE,杨顺峰:绿豆下胚轴中1-氨基环丙烷-1-羧酸丙二酰化与d -氨基酸的关系。植物学报,2003,31(4):433 - 433。10.1007 / BF00397737。
- 6.
Martin MN, Cohen JD, Saftner RA:番茄果实中1-氨基环丙烷-1-羧酸的新共轭活性。植物生理学报,2003,21(3):366 - 366。10.1104 / pp.109.3.917。
- 7.
Staswick PE, Tiryaki I:在拟南芥中,oxylipin信号茉莉酸被一种结合异亮氨酸的酶激活。植物学报,2004,16(4):381 - 381。10.1105 / tpc.104.023549。
- 8.
Boller T, Herner RC, Kende H:乙烯前体1-氨基环丙烷-1-羧酸的测定和酶促生成。植物学报,1997,25(4):394 - 394。10.1007 / BF00454455。
- 9.
Matas AJ, Yeats TH, Buda GJ, Zheng Y, Chatterjee S, Tohge T, Ponnala L, Adato A, Aharoni A, Stark R,等:膨胀番茄果实的组织和细胞型特异性转录组分析为代谢和调节特化和角质层形成提供了深刻的认识。植物学报,2011,23:3893-3910。10.1105 / tpc.111.091173。
- 10.
Teyssier E, Bernacchia G, Maury S, Kit AH, Stammitti-Bert L, Rolin D, Gallusci P:番茄果实发育和成熟过程中DNA甲基化和核内再复制水平的组织依赖性变化。植物学报,2008,28(4):391-399。10.1007 / s00425 - 008 - 0743 - z。
- 11.
Neily MH, Matsukura C, Maucourt M, Bernillon S, Deborde C, Moing A, Yin YG, Saito T, Mori K, Asamizu E,等:在过表达亚精胺合酶的番茄果实中,增强多胺积累改变了转录水平上的类胡萝卜素代谢。植物生理学报,2011,29(4):447 - 447。10.1016 / j.jplph.2010.07.003。
- 12.
Centeno DC, Osorio S, nnes - nesi A, Bertolo ALF, Carneiro RT, Araujo WL, Steinhauser MC, Michalska J, Rohrmann J, Geigenberger P,等:苹果酸在番茄果实淀粉代谢、成熟和可溶性固溶物含量中起关键作用,并影响采后软化。植物学报,2011,23:162-184。10.1105 / tpc.109.072231。
- 13.
Brown MM, Hall JL, Ho LC:从番茄果实组织中分离的原生质体对糖的吸收在果实生长的不同阶段。植物工程学报,1997,32(4):533-539。10.1111 / j.1399-3054.1997.tb01034.x。
- 14.
程永春,王婷婷,陈建华,林婷婷:化学位移成像技术在番茄成熟过程中番茄红素和糖含量时空分析中的应用。植物工程学报,2011,29(4):447 - 447。10.1016 / j.postharvbio.2011.04.006。
- 15.
Luengwilai K, Beckles DM:番茄果实淀粉的结构和形态研究。农业食品学报,2009,57:282-291。10.1021 / jf802064w。
- 16.
王峰,王晓燕,王晓燕。番茄果实发育过程中蔗糖合酶的时空表达规律。植物生理学报,1994,25(4):356 - 356。
- 17.
[摘要]:番茄果实花萼、绿肩、果皮和房室实质的光合活性。中国机械工程学报,1999,30(5):571 - 571。
- 18.
Lemaire-Chamley M, Petit J, Garcia V, Just D, Baldet P, Germain V, Fagard M, Mouassite M, Cheniclet C, Rothan C:转录谱的变化与番茄早期果实组织专业化有关。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.105.063719。
- 19.
Mounet F, Moing A, Garcia V, Petit J, mauccourt M, Deborde C, Bernillon S, Le Gall G, Colquhoun I, Defernez M,等:番茄果实早期发育组织的基因和代谢物调控网络分析发现了控制果实组成和发育的新候选基因。植物生理学报,2009,29(4):359 - 361。10.1104 / pp.108.133967。
- 20.
Moco S, Capanoglu E, Tikunov Y, Bino RJ, Boyacioglu D, Hall RD, Vervoort J, De Vos RCH:番茄果实发育过程中代谢产物水平的组织专业化。中国生物医学工程学报,2007,38(5):561 - 561。10.1093 / jxb / erm271。
- 21.
番茄果实发育过程中房室凝胶的形成与乙烯产生的启动。科学通报,1987,22:476-479。
- 22.
Van de Poel B, Bulens I, Hertog MLAT, Van Gastel L, de Proft MP, Nicolai BM, Geeraerd AH:基于模型的番茄果实发育和成熟与生理成熟相关的分类。生物技术与应用,2012,29(5):559 - 567。
- 23.
Atta-Aly MA, Brecht JK, Huber DJ:番茄果实房室凝胶组织对乙烯的响应。生物技术学报,2000,19:239-244。10.1016 / s0925 - 5214(00) 00099 - 5。
- 24.
Martin MN, Saftner RA:番茄果实中1-氨基环丙烷-1-羧酸n -丙二酰转移酶的纯化与鉴定。植物生理学报,2004,24(3):381 - 381。
- 25.
Van de Poel B, Bulens I, Markoula A, Hertog MLAT, Deesen R, Wirtz M, Vandoninck S, Oppermann Y, Keulemans J, Hell R,等:番茄果实的靶向系统生物学分析揭示了成熟期后的阳周期协调和乙烯生物合成的明显调控。植物生理学报,2012,29(4):369 - 369。
- 26.
杨顺峰,Hoffman NE:乙烯在高等植物中的生物合成及其调控。植物生理学报,1988,35:155-189。10.1146 / annurev.pp.35.060184.001103。
- 27.
林肯,科德斯,瑞德,费希尔,等:乙烯对番茄果实发育过程中基因表达的调控。中国科学:地球科学,1998,27(3):369 - 369。10.1073 / pnas.84.9.2793。
- 28.
Lincoln JE, Fischer RL:乙烯诱导基因表达调控的不同机制。中华医学杂志,1988,32(4):371 - 371。10.1007 / BF00322446。
- 29.
Penarrubia L, Aguilar M, marrumors An L, Fischer RL:反义基因促进番茄果实成熟过程中乙烯激素的分泌。植物科学学报,1994,4:681-687。
- 30.
番茄E8基因影响果实中乙烯的生物合成,但不影响花中乙烯的合成。植物生理学报,1998,25(4):366 - 366。
- 31.
Prescott AG:双加氧酶的困境(或生物化学和分子生物学不能满足的地方)。中国科学(d辑),1999,38(4):449 - 461。10.1093 / jxb / 44.5.849。
- 32.
细胞质流在共塑运输中的作用。植物细胞环境学报,2003,26:1-15。10.1046 / j.1365-3040.2003.00845.x。
- 33.
李金勇,李金勇:植物胞间连丝作为植物的超细胞控制网络。细胞生物学杂志,2004,5:712-726。10.1038 / nrm1470。
- 34.
陈晓霞,金金勇:大分子在韧皮部和胞间连丝间的转运。植物工程学报,2006,26(6):569 -571。10.1111 / j.1399-3054.2006.00630.x。
- 35.
Oparka KJ, Cruz SS:大逃逸:韧皮部运输和大分子卸载。植物生理学报,2000,31(5):323- 327。10.1146 / annurev.arplant.51.1.323。
- 36.
De Boer AH, Volkov V:水和盐在植物中运输的物流:木质部的结构和功能。植物细胞环境学报,2003,26:87-101。10.1046 / j.1365-3040.2003.00930.x。
- 37.
杨顺峰,杨福军:1-氨基环丙烷-1-羧酸(乙烯前体)在涝渍番茄植株中的木质部转运。植物生理学报,2004,25(3):322-326。10.1104 / pp.65.2.322。
- 38.
杨顺丰:水分亏缺胁迫乙烯的生物合成。植物生理学报,2001,27(3):366 - 366。10.1104 / pp.68.3.594。
- 39.
Albacete A, Ghanem ME, Martinez- andujar C, Acosta M, Sanchez-Bravo J, Martinez V, Lutts S, Dodd IC, Perez-Alfocea F:盐渍化番茄植株生物量分配和幼苗生长障碍的激素变化实验植物学报,2008,59:4119-4131。10.1093 / jxb / ern251。
- 40.
杨晓东,李文华,李文华,等。棉花叶片中1-氨基环丙烷-1-羧酸在韧皮部的转运和结合。植物生理学报,2003,24(4):429-436。10.1016 / s0176 - 1617(11) 82004 - 3。
- 41.
Tophof S, Martinoia E, Kaiser G, Hartung W, Amrhein N: 1-氨基环丙烷-1-羧酸和N-丙二酰-1-氨基环丙烷-1-羧酸在大麦和小麦叶肉细胞和原生质体中的分隔和转运。植物工程学报,1998,25(4):333-339。10.1111 / j.1399-3054.1989.tb04635.x。
- 42.
Saftner RA, Martin MN: 1-氨基环丙烷-1-羧酸进入分离的玉米叶肉液泡的转运。植物工程学报,1998,25(4):535-543。10.1111 / j.1399-3054.1993.tb02504.x。
- 43.
焦晓铮,哲德哈达斯,苏丽丽,杨顺峰:植物组织中1-(丙二胺基)环丙烷-1-羧酸转化为1-氨基环丙烷-1-羧酸。植物生理学报,2003,21(4):366 - 366。10.1104 / pp.81.2.637。
- 44.
陈晓燕,陈晓燕,陈晓燕。1-(丙二胺基)环丙烷-1-羧酸诱导乙烯对香石竹花衰老部位活性的影响。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.91.3.1126。
- 45.
Bouzayen M, Latche A, Alibert G, Pech JC: 1-(丙二酰氨基)环丙烷-1-羧酸在癌假斜胞细胞内的合成和储存。植物生理学报,1998,28(4):369 - 369。10.1104 / pp.88.3.613。
- 46.
Bouzayen M, Latche A, Pech JC, Marigo G:载体介导的1-(丙二胺基)环丙烷-1-羧酸在莲藕细胞空泡中的摄取。植物生理学报,2003,21(3):366 - 366。10.1104 / pp.91.4.1317。
- 47.
Roje S: S-腺苷- l-蛋氨酸:超越通用甲基供体。植物化学学报,2006,29(4):366 - 366。10.1016 / j.phytochem.2006.04.019。
- 48.
Van de Poel B, Bulens I, Oppermann Y, Hertog MLAT, Nicolai BM, Sauter M, Geeraerd AH:番茄成熟期s -腺苷-l-蛋氨酸的使用与乙烯和多胺生物合成及转甲基化能力的关系。中国生物医学工程学报,2013,38(4):369 - 369。10.1111 / j.1399-3054.2012.01703.x。
- 49.
Palmieri L, Arrigoni R, Blanco E, Carrari F, Zanor MI, Studart-Guimaraes C, Fernie AR, Palmieri F:拟南芥s -腺苷甲硫氨酸转运蛋白的分子鉴定。分析器官分布、细菌表达、脂质体重组和功能表征。植物生理学报,2006,32(4):359 - 361。10.1104 / pp.106.086975。
- 50.
Bulens I, Van de Poel B, Hertog MLAT, de Proft MP, Geeraerd AH, Nicolai BM:方案:乙烯生物合成代谢产物和酶活性分析的最新综合方法。植物学报,2011,7:17-10.1186/1746-4811-7-17。(doi: 10.1186 / 1746-4811-7-17)
- 51.
Van de Poel B, Bulens I, Lagrain P, Pollet J, Hertog MLAT, Lammertyn J, de Proft MP, Nicolai BM, Geeraerd AH:毛细管电泳法测定水果中s -腺苷- l-蛋氨酸。植物化学,2010,21:602-608。10.1002 / pca.1241。
- 52.
Bradford MM:利用蛋白质与染料结合的原理,快速、灵敏地定量微量蛋白质的方法。生物化学学报,2003,24(3):354 - 354。10.1016 / 0003 - 2697(76) 90527 - 3。
- 53.
D 'Hertog W, Overbergh L, Lage K, Ferreira GB, Maris M, Gysemans C, Flamez D, Cardozo AK, Van den Bergh G, schfs L,等:细胞因子诱导胰岛素生产INS-1E细胞功能障碍和死亡的蛋白质组学分析。细胞蛋白质组学。2007,6:2180-2199。10.1074 / mcp.M700085-MCP200。
- 54.
Schneider CA, Rasband WS, Eliceiri KW: NIH图像到ImageJ: 25年的图像分析。自然学报,2012,9:671-675。10.1038 / nmeth.2089。
Aknowledgements
我们感谢来自比利时Pittoma N.V.的G. Pittoors以及Sint-Katelijne-Waver和Hoogstraten的蔬菜生产研究站提供的植物材料。我们也感谢弗兰德斯采后技术中心(VCBT)的合作和提供基础设施。本研究由佛兰德斯通过科技促进创新研究所(IWT-Vlaanderen)向B.V.d.P.和I.B.提供的博士补助金资助。佛兰德斯为B.V.d.P.提供了国际流动补助金,为T.N.提供了博士补助金,为S.S.提供了博士后奖学金
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有竞争利益。
作者的贡献
设计研究(B.V.d.P M.L.A.T.M。,M.P.D.P B.M.N, A.H.G.)。进行生化分析(B.V.d.P, N.V, C.S, I.B, I.M.)。进行质谱分析(s.v., r.d., E.W.)。进行蛋白过表达和纯化(B.V.d.P, T.N, s.s., J.V.)。分析了数据(B.V.d.P M.L.A.T.M。,M.P.D.P B.M.N, A.H.G.)。起草这份手稿(B.V.d.P M.L.A.T.M。,B.M.N A.H.G.)。所有作者阅读并批准了最终稿件。
电子辅料
图S2。
附加文件1:图S1:描述两个波段的额外的Western blots。MALDI-TOF/TOF两条带肽分析。图S3。考马斯色对纯化的his标记ACO和E8蛋白进行SDS-PAGE染色。图S4。过表达后纯化的ACO和E8的鉴定。图S5。自定义抗aco多克隆抗体的序列特性。图S6。番茄ACO1和E8的序列比对。(医生420 KB)
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
B.范德波尔,N.范登扎维尔,C.斯梅特。et al。组织特异性分析表明,番茄成熟期乙烯生物合成和E8在组织和调控上存在差异。BMC植物杂志14,11(2014)。https://doi.org/10.1186/1471-2229-14-11
收到了:
接受:
发表:
关键字
- 茄属植物lycopersicum
- 番茄
- 乙烯生物合成
- 组织
- 果皮
- 隔
- 小柱
- 胎盘
- 种子
- 有小室的凝胶
- E8