摘要
背景
植物根系及其根际微生物群之间的自然相互作用对植物适应性至关重要,调节促进生长和抑制疾病。在大米中(栽培稻),这是一种全球重要的粮食作物,由于真菌病原体引起的稻瘟病,高达30%的产量损失Magnaporthe oryzae.利用自然存在的水稻土壤细菌的能力来减少m . oryzae感染可以提供一种可持续的解决方案,以减少稻瘟病造成的作物损失。
结果
从加州水稻(M-104)中分离到天然存在的根际细菌,通过16s rRNA基因测序和脂肪酸甲酯(FAME)分析鉴定了其中11种细菌。测试了细菌分离物对水稻破坏性真菌病原体的生物防治活性,m . oryzaepathovar 70 - 15所示。在体外,一个假单胞菌菌株EA105的抑菌作用可使附着孢形成减少近90%,直接抑制真菌生长达76%。虽然氰化氢(HCN)是一种通常由生物控制假单胞菌产生的挥发性物质,但EA105的活性似乎与它产生的HCN无关。在在足底实验结果表明,EA105可减少33%的损伤形成Pantoea agglomeransEA106分离率为46%。我们的数据还表明,EA105和EA106都能触发茉莉酸(JA)和乙烯(ET)依赖的水稻诱导系统抗性(ISR)反应。
结论
从水稻土壤中分离出的11种细菌中,假单胞菌EA105最有效地抑制了真菌的生长和附着孢的形成m . oryzae通过一个不依赖氰化物产生的机制。除了直接拮抗外,EA105似乎还通过依赖于JA和ET信号的机制在水稻植株中触发ISR,最终导致较少的稻瘟病病变。将本地细菌作为生物防治剂,与当前的疾病保护策略相结合,有助于全球粮食安全。
背景
随着世界人口的迅速增长,粮食安全和作物保护至关重要。最重要的主食作物之一是水稻,超过35亿人每天依赖水稻消耗能源。稻瘟病是由广泛传播的叶片真菌病原体引起的病害Magnaporthe oryzae疟疾在超过85个国家发生,造成毁灭性的作物损失。这种疾病每年破坏的大米足以养活约6000万人[1不幸的是,目前还没有有效的方法来持久、充分地控制这种病原体。
目前的低成本保护策略包括种植未受感染的种子、限制氮肥施用、永久农田淹水和收获后焚烧植物遗骸[2];然而,这些策略既不能消除感染,也不能解决油田感染的情况。具有抗稻瘟病基因的水稻品种,例如,一个携带稻瘟病基因的品种Pi-tar基因可以有效地启动基因对基因的相互作用m . oryzae无毒性(AVR)基因及赋予抗性;然而,病原体迅速克服了植物编码的耐药性[3.,4].化学农药对该病的保护作用有限,但对环境构成风险,并可能使包括人类在内的非致病性生物处于危险之中[5].因此,目前采用的控制策略在效果上是有限的,并可能导致进一步的问题。另一种作物保护方法是使用生物防治剂(BCA)。
研究人员正在努力描述与植物有关的微生物群及其对植物健康和生产力的影响。与人类肠道菌群一样,根际微生物群落通过争夺养分和产生抗菌剂来帮助养分获取和控制土壤病原体[6].一些革兰氏阴性假单胞菌物种是经过充分研究的生物防治细菌,已被证明可产生若干抗微生物次级代谢产物[7].这些药物包括但不限于phenazines [8]、氰化氢[9,10], 2,4-二乙酰间苯三酚[11]、吡咯硝丁[12]和pyoluteorin [13],以及循环脂肽紧张素[14]和粘胶酰胺[15].研究得最充分的革兰氏阳性生物防治细菌在属内芽孢杆菌,并已被证明可产生具有抗真菌活性的低分子表面素[16]以及抗真菌脂肽库尔斯塔金[17].
BCA还通过改变宿主的免疫系统来帮助植物抵御叶状病原体,以获得更快的防御反应。这种诱导系统抗性(ISR)反应通过根发射长距离的植物内信号,使植物更好地抵抗病原体的攻击[18].在大多数情况下,ISR依赖于茉莉酸(JA)和乙烯(ET)植物信号,而不是水杨酸(SA)信号,如系统性获得性抗性所见[19].启动作用发生在植物识别微生物细胞成分、分泌物或挥发物时[20.].在受到病原体攻击时,被启动的植物有更快速的细胞防御反应[21].这是由于作为对微生物定植的反应,非活性转录因子的积累增加,然后在病原体攻击期间被激活,产生增强的防御基因表达[22].荧光假单胞菌菌株WCS417r是第一个有文献记载的在康乃馨中引起全身反应的细菌(石竹类植物caryophyllusL.),使其更能抵抗镰刀菌素威尔(23].
Schroth等人[24]描述了在某些土壤中生长的植物如何更不容易生病。这些疾病抑制土壤可以自然产生,因为它们的理化性质促进了生物防治(以下简称生物防治)微生物的定植,或者在生物胁迫下,无论土壤类型如何,都可以通过植物将有益微生物补充到根部来建立。例如,拟南芥叶面病菌感染两光伏番茄DC3000(以下简称DC3000)诱导根分泌l-苹果酸,可以吸引有益的根瘤菌枯草芽孢杆菌FB17到根[25,26].然后FB17触发防御相关基因的表达答:芥叶片,包括致病相关蛋白PR1和植物防御素PDF1.2,降低DC3000的生长和疾病发病率[25,26].
了解和控制水稻植物及其根际群落之间的自然联系,结合当前的疾病控制战略,将是减少感染和增加粮食产量的全面和有效途径。本研究的目的是分离和鉴定天然存在和密切相关的水稻根际细菌,以确定可能的生物防治细菌m . oryzae.细菌和细菌衍生的成分可以用作真菌抑制剂。我们已经确定了假单胞菌分离出EA105,显示出抑制作用m . oryzae通过直接拮抗作用和诱导水稻系统抗性。
结果
根际细菌的分离鉴定
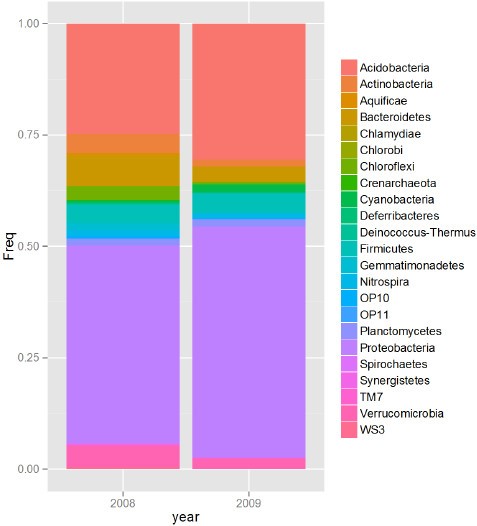
对加利福尼亚田间种植的M-104水稻根际土壤样品进行了细菌16S rDNA测序和门的分布(图2)1)和属(附加文件1:图S1)测定土壤样品中细菌的含量。在2008年和2009年的数据中,分别有8到10个门(在酸杆菌门、放线菌门、拟杆菌门、蓝藻门、厚壁菌门、Gemmatimonadetes、Nitrospira、Planctomycetes、Proteobacteria、Verrucomicrobia中)被认为是丰富的(图1).对于这些,16S rRNA序列每个单独占总数的1%以上。除了变形菌门(Proteobacteria)占16S序列的44%和50%外,第二丰富的门是酸杆菌门(Acidobacteria),分别占2008年和2009年样本序列的24%和30%。其他门占比超过4%的序列是放线菌门,拟杆菌门和厚壁菌门。在属级上,前1%的序列(第99百分位)由酸杆菌亚科Gp1, Gp3, Gp4和Gp6组成,也包括亚硝化螺旋体,Betaproteobacteria的一员(附加文件)1:图S1)。从相同的土壤样品中,分离出天然存在的根相关和根结合的根际细菌(表2)1).标记EA101-EA108的菌株在TY琼脂上分离,标记EA201-EA202的菌株在LB琼脂上分离。其中一种细菌被标记为EA303绿硫细菌以苯甲酸盐为唯一碳源,对(CP)琼脂板进行电镀。利用脂肪酸甲酯(FAME)分析对11株分离株进行了分类鉴定,并利用16S rRNA基因测序对其进行了进一步鉴定(表1)1).11个分离体中有6个属于这类人Gamma-proteobacteria,其中5个属假单胞菌.这可能是由于它们的培养能力和它们在土壤环境(包括根际)中的天然丰度。
水稻根际细菌分离株的体外抗真菌特性
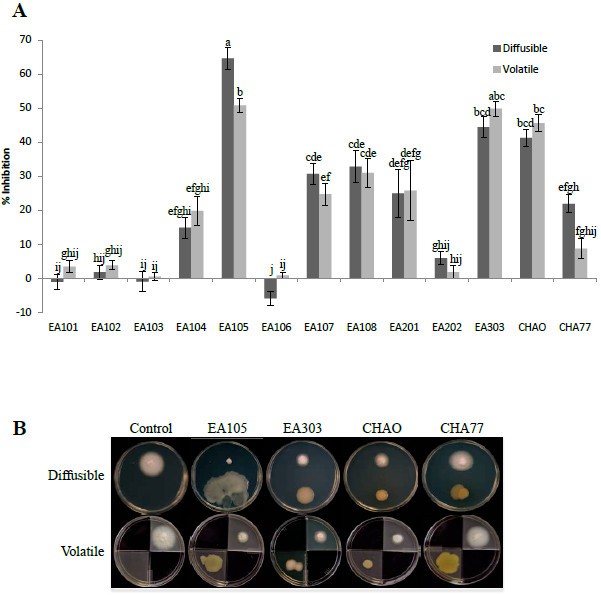
天然共生的水稻根瘤菌的影响(见表1的成长和发展m . oryzae菌株70-15采用培养皿法进行鉴定。扩散试验评估的影响,如果有的话,细菌衍生的扩散化合物m . oryzae70-15(以下简称70-15)无直接联系。这两种微生物可以通过挥发性化合物和扩散性化合物进行交流和相互作用。所有分离株均进行了检测,其中5株假单胞菌分离株(EA104、EA105、EA107、EA108和EA303)对70-15的生长有显著抑制作用(图2A).最引人注目的效果是由假单胞菌分离出EA105,相对于对照,5天后抑制真菌生长65%(图2一个)。
细菌挥发物不仅作为气味,而且作为植物刺激剂、抗菌剂和化合物,在诱导系统性抗性反应方面也受到越来越多的关注[27- - - - - -29].为了检查挥发性抗真菌代谢物是否在观察到的70-15生长障碍中起作用,使用分为四个象限的培养皿进行挥发性(隔室)板试验。m . oryzae水稻细菌分离株被放置在相反的隔间中,它们共享相同的顶空间,但没有扩散化合物的交换。因此,观察到的任何抑制都是由于挥发性化合物。所有的假单胞菌除EA105外,分离株的生长显著降低,其生长程度与直接培养皿中相同(图2)2A).细菌的运动性允许进行一些有益的活动,包括获取更多的营养物质,避开有毒物质,并在最佳环境中定居。29].EA105能够通过游动和群集在板块间迅速传播(附加文件)2:图S2)和限制在板的一个象限可能有助于抑制的减少。当EA105在CM琼脂上而不是LB琼脂上生长时,以及在液体培养基上而不是琼脂上生长时,EA105的抑制活性也有类似的降低(附加文件)3.:表S1)。
为了确定EA105所表现出的直接拮抗作用是否需要代谢活性细胞,使用相同的扩散实验装置进行了对照实验,除非使用热杀死的EA105细胞或废培养基(无细胞上清液)来代替活细胞。无论是热杀死细胞还是用过的培养基都没有显示出对真菌生长的任何显著影响(附加文件4:图S3A),表明真菌抑制需要活性细胞。为了进一步研究ea105衍生抑制的性质,m . oryzae从暴露于EA105(抑制)的70-15个培养皿中取出70-15个栓子,传代到新鲜CM琼脂上。当不再接触细菌时,70-15个细胞正常生长(附加文件)4:图S3B),表明EA105具有抑菌性。
一种经常被报道的由一些假单胞菌产生的毒素是氰化氢(HCN),它与胞衣c氧化酶结合并阻止细胞呼吸[30.].HCN可以以气态或水溶液的形式存在,这表明它可以作为一种挥发性物质被细菌释放,也可以分泌到介质中。因此,我们测试了70-15对已知氰化物(CN)生产者的耐受性,荧光假单胞菌曹国伟(31],其HCN产生阴性突变体,p .荧光CHA77 [32].在扩散板中,CHAO显著降低了46%的真菌生长(图2一个);然而,这并不像EA105那样具有强烈的抑制作用。CHA77也显著减少了真菌的生长,但仅直接减少了22%,通过挥发物减少了10%2一个)。
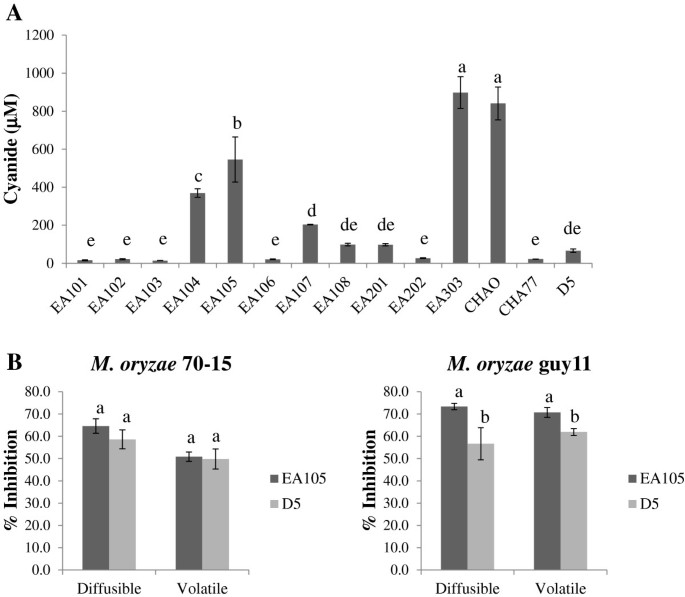
因为很多已知的假单胞菌,包括p .荧光应变CHAO [31],产生CN作为主要抗菌成分,使用Lazar模型LIS-146CN-CM微氰化物离子电极定量测定了所有水稻分离株固定相培养上清液中细菌CN的产生[33].作为对照,我们还测量了由p .荧光CHAO和CHA77。EA105在孵育24小时后产生500 μM左右的氰化物,而EA303和CHAO产生700 μM左右的氰化物(图3.A)。正如预期的那样,在CHA77中CN的产量严重减少,它有一个中断的CN生物合成操纵子(图3.A).尽管EA105产生的氰化物较少,但它抑制氰化物m . oryzae营养生长大于CHAO,说明其他抗真菌代谢产物也参与其中。
此外,在EA105中创建了一个HCN生物合成突变体D5hcn参与CN合成的ABC操纵子中断,CN生成减少(图3.A).利用两种平板生物试验评价CN在EA105对70-15抗菌中的重要性。我们的数据显示,在扩散和挥发性实验中,EA105和D5突变体对70-15和guy11的生长有相似程度的衰减(图3.B). CHAO的氰化物缺乏突变体CHA77显示出抑制能力的急剧下降m . oryzae(图2A),而EA105的缺氰突变体D5的抗真菌活性仅表现出最小程度的降低,这表明EA105和CHAO具有不同的抗菌机制。这也说明了的限制m . oryzaeEA105的生长主要独立于CN,并且需要一种未知的细菌衍生化合物。
细菌产生的有机和无机挥发性化合物已被证明对植物病原体具有生物防治活性[34,35].为了确定EA105挥发物的抗真菌活性是由于有机或无机化合物,或两者兼而有之,使用了挥发物(隔室)板设计。如前所述,m . oryzae70- - - - - -15和细菌被放在相反的隔间里;然而,剩下的两个隔间被活性炭/碳填充,这将吸附有机细菌挥发物。用活性炭修饰的平板显示真菌生长正常,细菌挥发性化合物没有抑制作用(附加文件)5:图S4)。这意味着活性抗真菌挥发物是有机化合物,因此被称为挥发性有机化合物(VOCs)。
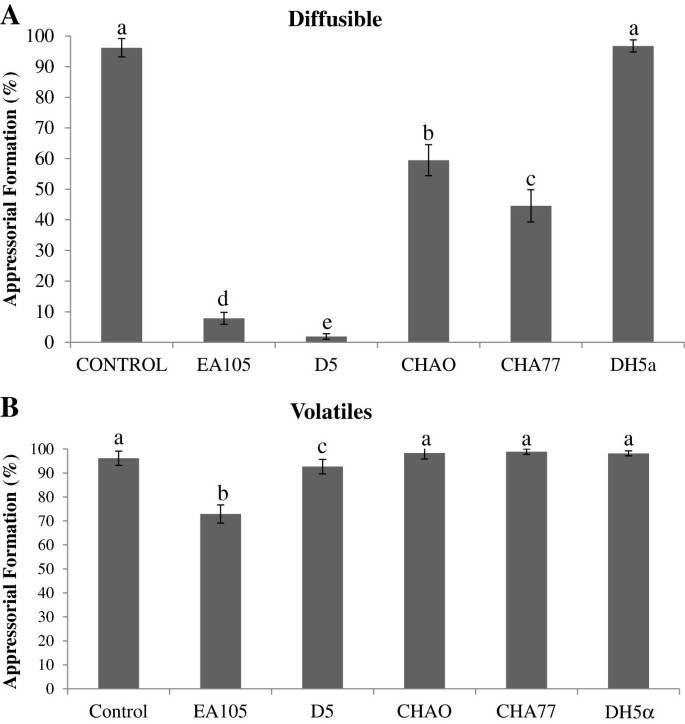
除了对营养生长的影响,这些细菌还影响分生孢子发育成一种特殊的感染结构,称为附着胞。在发病过程中,附着胞顶端发育出一个穿透钉,使植物角质层被物理刺穿并感染寄主[36].EA105对70-15个附着体形成的抑制作用较对照降低了近90%;而一种已知的生物防治菌株p .荧光, CHAO通过直接治疗抑制约60%(图4A).一个意想不到的观察结果是,氰化物突变体D5和CHA77对附着体形成的抑制程度分别略高于氰化物突变体EA105和CHAO。虽然还没有在真菌中显示出来,但有证据表明亚致死浓度的氰化物可以触发线虫的防御机制[37].通过间接处理,CHAO完全不能抑制附着形成,而EA105仍能减少约20%的附着形成(图4B).这表明,在EA105的情况下,挥发性化合物可能参与了抑制营养生长以及减少附着体形成。
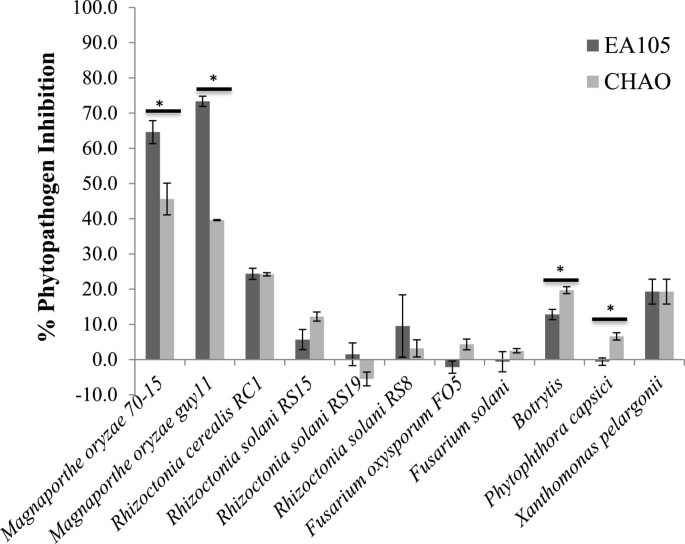
为了更好地了解EA105对各种植物病原体的抗菌潜力,对EA105进行了针对各种自然分离的病原体的测试。EA105和CHAO对其他植物病原菌的抑制程度与EA105相近,但较CHAO弱m . oryzae;而EA105能够抑制m . oryzae的增长明显高于CHAO(图5).这表明,与其他非特异性病原体相比,EA105对水稻病原体的抗菌活性更加特异性和有效。
EA105抗真菌代谢产物的鉴定
采用固相微萃取-气相色谱-质谱法(SPME-GC-MS)对EA105产生的挥发性有机化合物(VOCs)进行了鉴定(表2).EA105顶空剖面中含量最高的峰为1-十一烯,根据商业标准,在270 μM浓度下24小时内产生(附加文件)6:表S2;额外的文件7:图S5A)。过去对1-十一烯的抗菌研究表明它对菌核病sclerotiorum[34],对…的影响很小镰刀菌素culmorum[38].在EA105的挥发性剖面中也鉴定出s -甲基硫酯,在24小时内产生约30 μM(附加文件)6:表S2;额外的文件7:图S5A)。这些化合物对70-15的抗真菌活性进行了检测,在生物相关浓度下没有发现显著的生长减少(附加文件)7:图S5B-C),表明这些化合物不是EA105产生的抗真菌活性挥发物。
虽然与营养生长减少没有直接关系,但我们有兴趣看看ea105衍生的巯基酯是否能降低毒性;因此,研究了EA105处理对70 ~ 15分生孢子萌发和附着胞形成能力的影响。虽然没有看到很大的影响,但在100 μM浓度下,所有化合物的附着形成都显著减少(附加文件8:表S3)。
EA105处理提高了水稻根系对稻瘟病的抗性
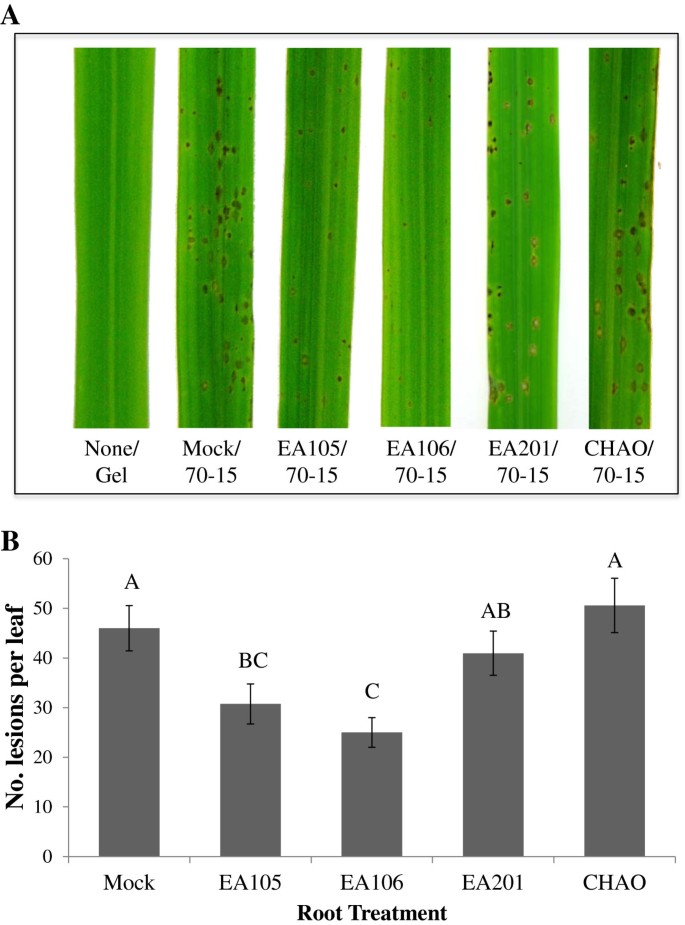
诱导系统抗性(ISR)是由植物促生菌(PGPR)诱导的,可提高植物的抗病性。我们之前的数据显示,EA105通过产生一种抗真菌化合物直接抑制真菌生长。接下来,我们测试了EA105是否也能抑制m . oryzae间接地通过诱导寄主植物发生变化。土生水稻三周生根。马拉泰利(高度易感m . oryzae)接种根瘤菌,24小时后接种m . oryzae70 - 15孢子。除EA105外,水稻还分离出EA106、aPantoea agglomerans, EA201, an节细菌属葡萄糖酸,也进行了测试(见表1).引人注目的是,根经EA105和EA106预处理或“启动”的植物显示出明显减少的blast病变数量(P≤0.0087和0.0003),与未进行预处理的植物相比(图6).有趣的是,预处理与先前表征的直接拮抗剂m . oryzae,p .荧光曹国伟(39],对叶片的疾病形成没有保护作用(图6).虽然以前有报道CHAO诱导ISR拟南芥[40],水稻是CHAO的非本地寄主,最初是从瑞士土壤中分离出来的,可抑制黑根腐病[41].这些结果清楚地支持了EA105和EA106的根定殖诱导水稻叶片攻击的植物编码机制的假设m . oryzae,增强防御反应,从而减少m . oryzae植物气生部分的感染。
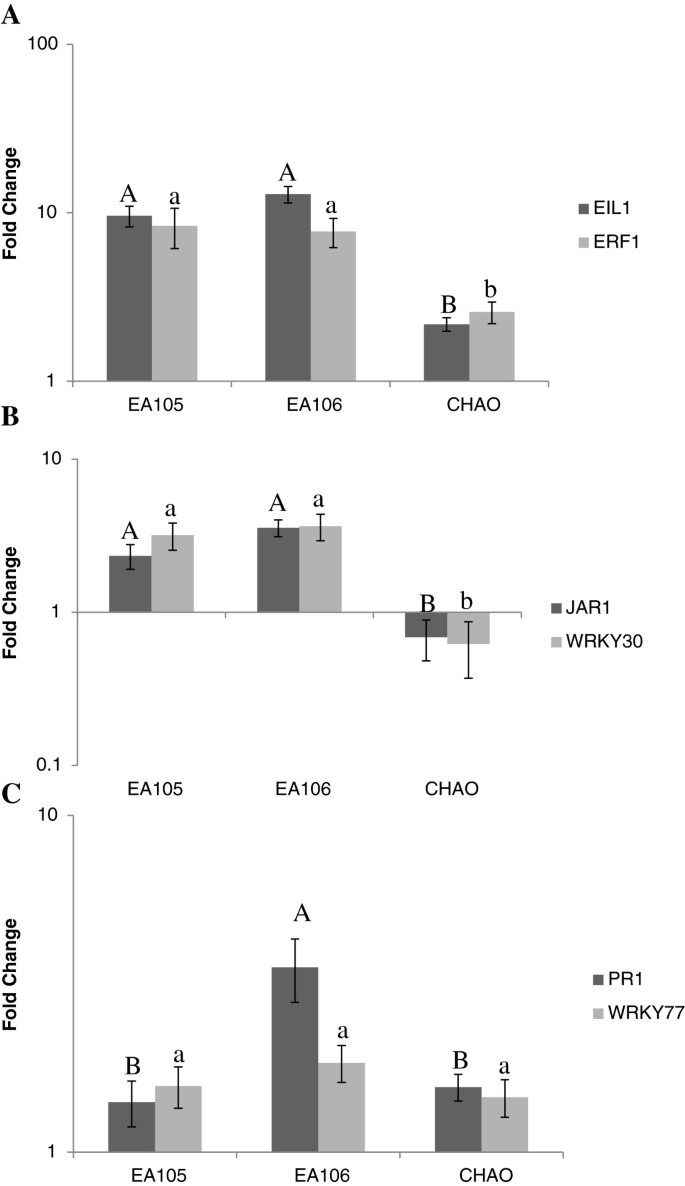
为了进一步探索分离株EA105和EA106通过植物介导机制减轻病变的机制,在细菌处理后24小时检测了水稻中几个关键ISR基因的表达。作为对照,我们也检查了CHAO的效果,它没有减少数量m . oryzae水稻病害。在EA105和EA106处理下,JA反应基因显著上调,JAR1而且WRKY30,而CHAO处理则下调了这些基因。类似地,ET反应基因,EIL1而且ERF1,EA105和EA106处理也上调,但CHAO处理的上调幅度要小得多(图7).JA (50 μM)处理的阳性对照也诱导了JAR1和WRKY30(数据未显示)。细菌处理仅轻微诱导SA反应基因PR1和WRKY77(图7C). SA处理也诱导SA反应基因(1 mM)(数据未显示)。在所检测的6个基因中,除PR1外,EA105和EA106处理中所有基因的表达模式相似。在EA106处理的水稻中,PR1的诱导明显强于EA105处理的水稻。这些数据表明,EA105诱导了JA和ET依赖的ISR,可以保护植物m . oryzae.
讨论
为了对全球粮食安全产生重大影响,必须开发一种有效和可持续的水稻稻瘟病生物防治解决方案,同时减少或消除对合成化学杀菌剂的需求。我们发现水稻根际的微生物会变弱米氏菌体外培养而且在足底.最值得注意的是p . chlororaphis菌株EA105,该菌株已被证明具有严重限制水稻病原菌生长的能力m . oryzae因此,它是防治稻瘟病的一种新型生物防治剂。在此之前,p . chlororaphis分离物已被证明在农业上对几种植物病原体的生物防治具有重要意义,包括菌核病sclerotiorum[42],丝核菌cerealis[43],Seiridium cardinale[44),而Leptosphaeria maculans[45].据我们所知,这是第一次报道p . chlororaphis减轻稻瘟病症状。与化学杀菌剂相反,生物防治细菌产生抗真菌化合物的混合物,可根据环境线索波动[46].EA105的抑菌活性可能导致一种比现有化学杀菌剂更长期、更有效的防治稻瘟病的策略,化学杀菌剂对稻瘟病施加更大的选择压力m . oryzae产生抵抗力此外,作为活生物体,这些生物防治微生物正在与它们的根际邻居一起继续进化,以确保更可持续的解决方案。
为了更好地了解水稻根际土壤的组成和多样性,我们使用宏基因组方法研究了自然栖息在这个生态位的门和属。各生长季节门的分布基本一致,主要为酸菌门和变形菌门。酸杆菌是最近才发现的,目前绝大多数是无法培养的。然而,它们在土壤中的丰富程度已被记录在案,它们可能在根际中发挥着至关重要的作用,但这一作用尚未确定[47].变形菌门是一个非常广泛的门,包括各种细菌,包括假单胞菌,它是γ -变形菌门[48].
有证据表明,对植物气生部分的胁迫可刺激化学引诱剂在根际沉积,以增强根际细菌的定殖[26,27].有效的植物防御可能是由于寄主植物有能力调节根分泌物的组成,吸引微生物,从而引发植物抗性。有益微生物的招募还可以改变植物的生理功能,以抵御空气病原体[49].虽然m . oryzae是最常见的叶面病原体,它也有能力感染根[50,51],并与其他根部病原体密切相关,如M. poae, M. rhizophila,Gaeumannomyces茎[51].根部感染m . oryzae通常随后扩散至新梢并形成传统的爆孔病变[51].因此,EA105的直接抗真菌活性m . oryzae可能对预防原爆菌感染有生态学意义。
我们的数据表明,用EA105处理土壤水稻植株可以激活对70-15的基础抗性机制在足底.水稻根际微生物诱导宿主(水稻)生理效应的确切机制尚不清楚,尽管其中一些变化是通过水杨酸(SA)、茉莉酸(JA)或乙烯(ETH)等小分子信号调节的[52].与发病机制相关的PR基因如PR1和WRKY77对SA有反应[53]并在病原体感染期间上调,最终引发防御反应并减轻疾病症状[54].然而,有益的根瘤菌如p .荧光WCS374r已被证明能刺激水稻的防御反应,从而诱导水稻抵抗m . oryzae,但完全独立于SA信号[55].与这一发现类似,我们的基因表达数据表明,EA105通过一种涉及JA和ETH以及较小程度上SA信号的机制触发水稻的ISR。JA响应基因JAR1和WRKY30对JA信号通路至关重要,是刺激ISR的必要条件答:芥和大米一样[56,57]且这两种基因在EA105和EA106处理后24小时均有高表达,而CHAO处理后则无高表达。我们发现乙烯反应基因EIL1和ERF1也有类似的上调,它们也与ISR信号转导和疾病易感性降低有关[58].此外,我们还证明了EA105能够严格限制70-15的菌丝生长,并几乎完全阻止非生物疏水表面附着胞的形成。这说明水稻有益菌群可以通过多种机制降低稻瘟病毒力;因此,根际调控是一种有价值的综合生物胁迫调控方法。
生物防治剂目前用于防治引起水稻纹枯病的真菌病原体[59- - - - - -63]和引起稻瘟病的真菌病原体的一个子集[64,65].除了少数例外[66,67]与从水稻根际分离的菌株EA105相比,所测试的生物防治剂不是从水稻中分离出来的。我们推测,一种被证实与大田种植的水稻根系有关的微生物,如EA105,与不相关的生物防治分离株相比,可能对水稻保护有更好的意义,因为它能够在水稻根际竞争和生存。之前的研究表明假单胞菌的一个亲戚,Delftia tsuruhatensis,直接抑制m . oryzae还可以减少水稻中约50%的病变,但病变减少的机制尚未得到研究[66].从水稻和小米根际分离的13株杆菌和6株伪单胞菌对寄主植物谷子(Setaria italicaL)尽管这些分离株没有在水稻中进行测试[68].也有报道称,在巴西的好氧种植水稻中发现了自然分离的水稻根瘤菌,但这些分离菌尚未被鉴定,它们诱导抗性的机制也尚未得到研究[69].类似地,Naureen等人研究了来自块状土壤和水稻根际的多种分离株对真菌的直接拮抗作用m . oryzae以及减少损伤的能力在足底,但这些活动背后的机制尚未被探索。5个被检查的分离株是假单胞菌sp。但这5个菌株来自块状土壤,而不是水稻根际[67].根际的两个分离物Lupinus hispanicus,荧光假单胞菌Aur 6和Chryseobacterium balustinumAur 9在共接种时显示出降低稻瘟病严重程度和提高水稻产量的能力[70然而,这些分离物最初并不是从水稻根际分离出来的,它们减少病变的方式还没有被描述。De Vleesschauwer等人[55],彻底研究了p . fluroescensWCS374r在水稻中诱导抗性,不依赖于SA信号,通过ETH和十八糖类途径介导。菌株WCS374r是实验室菌株WCS374的自发利福霉素突变体[55].De Vleesschauwer等人对ISR背后的机制提供了有价值的见解m . oryzae我们已经证明,一种天然水稻分离物EA105在最低限度地影响SA信号的同时,也具有相似的触发ETH信号的能力。在某种程度上,我们将这些故事结合起来,研究天然水稻分离物如何通过直接和植物介导的机制来减少稻瘟病。
Shimoi等人[71]通过从水稻中选择性分离叶层微生物,研究了一种减少稻瘟病的新机制p . geniculata菌株,分解胶原蛋白和明胶。这些微生物中的一些能够减少稻瘟病症状,当共接种到水稻叶片上时,可能是通过破坏孢子尖端黏液和细胞外基质从叶片表面的粘附,阻止适当的附着m . oryzae[71].将这种方法与根相关微生物(如EA105)结合测试将是有趣的,EA105可以通过植物信号诱导抗性。
生物防治细菌导入植物的试验方法已打下了坚实的基础。滑石粉的应用p .荧光对水稻种子进行叶面喷施,可最有效地减轻稻瘟病症状[72].生存的两种菌株p .荧光在3个水稻品种中进行了检测,在整个110天的实验中,对种子进行细菌处理导致细菌的持久性[65].然而,这两种菌株减少爆炸症状的模式尚未阐明,似乎与EA105使用的机制不同。虽然我们注意到JA和ET信号的升高对SA的影响很小,但这两个假单胞菌导致水稻SA水平升高[73].
据我们所知,这是第一个报道假单胞菌chlororaphis该分离物具有抗稻瘟病的作用机制,即直接抗真菌活性和诱导宿主产生抗性。此外,还显示出EA105抑制植物营养生长的能力m . oryzae,我们也显示出减少的能力m . oryzae发病机制通过抑制附着胞的形成。有趣的是,EA105的活性在很大程度上与氰化物的产生无关,尽管氰化物通常与伪单胞菌的生物控制活性有关。
微生物对动物健康和免疫至关重要,有令人信服的理由相信,与根相关的微生物对植物和动物同样重要。植物根系遇到土壤中多样的微生物种群,通过向根际分泌资源为微生物创造独特的生态位。这些根际资源数量有限,一些微生物进化出了抗菌特性,以减少来自其他微生物的竞争,并增强其植物宿主的健康。然而,我们对微生物群中单个微生物菌株对植物生长和保护的贡献缺乏清晰的认识。由于生物防治已被证明是一种成功的作物保护方法,因此需要作出更多努力,从不同的根际细菌库中确定潜在的生物防治剂,并了解它们对植物生产力产生积极影响的机制。
结论
从水稻根际土壤中分离到11种细菌,并进行了鉴定。孤立EA105,Psuedomonas chlororaphis对爆炸病菌表现出最强的生物防治潜力m . oryzae.EA105抑制了菌丝生长,几乎完全阻止附着胞的形成m . oryzae.EA105中的HCN突变体D5表现出类似的拮抗能力m . oryzae,表明其作用机制独立于HCN。同时分离EA105Pantoea agglomeransEA106能减少水稻稻瘟病病变的数量m . oryzae.EA105和EA106在水稻中引起的反应是通过JA和ET信号介导的。分离物EA105是唯一有效的直接拮抗m . oryzae以及水稻中ISR反应的激发子。分离出的EA105有望作为一种有潜在价值的生物防治剂,减少稻瘟病造成的作物损失。由此带来的水稻产量增加可能对全球粮食安全产生巨大影响。
材料与方法
根际土壤DNA提取及加工
收获田间种植的水稻植株,获得根系相关微生物DNA,用于16S rRNA序列的克隆和测序。水稻植株的大部分地上部分被去除,围绕根球的一团土壤被保留下来进行处理。从单个植物的单个根一次处理一个,直到为该植物获得足够的根材料。从根球的中间切除一个完整的根,认为在收获期间未动。用戴着手套的手从根部去除多余的土壤,直到只剩下紧密结合的土壤。然后将根添加到30 ml PBS缓冲液(pH 7.0)中。再加入同一株植物的根,直到收集到的根的体积约为12毫升。PBS缓冲液中的根被涡旋,将约16毫升的根洗土壤悬浮液(水稻根际土壤)旋转,并将颗粒储存在-80℃下,直到DNA提取。使用MoBio超清洁土壤DNA分离试剂盒从0.25至1克根际土壤中提取微生物DNA,并使用最高产量的“替代方案”。采用引物27 F(AGAGTTTGATCCTGGCTCAG)和1492R (GGTTACCTTGTTACGACTT)扩增16S rDNA。利用Mallard方法筛选可能的嵌合体序列[74],然后根据核糖体数据库项目(RDP)资源(http://rdp.cme.msu.edu/).具体来说,序列分类使用基于java的RDP Naïve Bayesian rRNA Classifier Version 2.1 [75]使用分类参考集RDP 10.18 [76].R包ggplot2 [77]用来生成描绘分类组成的barplot。扩增产物经凝胶纯化后,利用Topo TA载体进行克隆。纯化有插入物的菌落,通过Sanger测序获得插入物DNA序列。
根际细菌的分离鉴定
天然的根细菌是从根相关的土壤和M-104水稻植物的根中分离出来的,M-104水稻是一种广泛生长在加利福尼亚的温带粳稻品种。收集M-104根,使用无菌抹刀去除粘附在根上的土壤,并收集为根相关土壤样品。然后将根系冲洗、粉碎并加工成根系样品,其中包括内生细菌和紧密结合的根系细菌。样品悬浮在无菌水中(0.1 g/ml),并在LB上连续稀释[78], ty [79],或CP +苯甲酸酯[80琼脂板。在30℃下孵育48小时,根据形态选择单个菌落,在新鲜琼脂板上重新划线。分离物鉴定采用集落PCR和通用引物27 F (AGAGTTTGATCCTGGCTCAG)和1492R (GGTTACCTTGTTACGACTT)对16S rDNA进行测序。使用核糖体数据库项目(RDP)网站分类器确定分类学分配。MIDI公司(MIDI -inc.com)通过脂肪酸甲酯(FAME)分析进行了进一步鉴定。相似度(SIM)指数为1.000表示由脂肪酸组成决定的物种精确匹配。SIM指数越低,脂肪酸含量变化越大。除非另有说明,否则SIM指数截断值0.600用于确定可信物种匹配。
植物材料和生长条件
栽培稻M-104种子是Thomas Tai博士(加州大学戴维斯分校)赠送的礼物。这些种子是在戴维斯的一块田里旱种的,那里以前种过几年水稻。出苗后不久进行淹田,种植后约1个月采收根系取样。o .漂白亚麻纤维卷马拉泰利,一种对爆炸菌敏感的品种m . oryzae菌株70-15用于研究。所有植物都在一个生长室中生长,每天循环光照16小时(28°C, 80% RH),暗8小时(26°C, 60% RH)。
体外抗菌试验
使用培养皿创建了两种实验设计,以确定细菌分离物的拮抗活性。第一种是扩散试验,即无菌培养皿中充满高压灭菌的全培养基(CM)琼脂,包括10克蔗糖,6克酵母提取物,6克卡胺酸,15克琼脂和1毫升曲霉属真菌nidulans1l水中的微量元素。5毫米插头m . oryzae菌丝70-15或guy - 11置于5 μl 5 × 10的4厘米处5细菌细胞。用保鲜膜密封,放在25°C的培养箱中,置于黑暗中。5天后拍照,用ImageJ软件测量菌丝体从塞子中生长出来的直径。抑菌率(%)由公式计算:%抑菌率= ([C - T) × 100]/C),其中C =对照板真菌直径(cm), T =处理板真菌直径(cm)。进行3个生物重复,取平均值。其次,挥发性(隔间)试验使用隔间的培养皿,其中细菌在LB琼脂或LB液体上生长m . oryzae分别在CM琼脂上培养。进行3个生物重复,取平均值。活性炭试验采用与挥发性试验相同的实验设计,除了其余两个隔间分别装满了1克活性炭(Darco®,20-40目的颗粒大小,颗粒,Aldrich, Milwaukee, WI)包裹在KimWipes中。进行两次生物重复,取平均值。对于热杀灭和废培养基试验,细菌分离物EA105在10 mL LB液体中在50 mL falcon管中过夜,光密度为600 nm (OD)600)进行了测量。培养物放置在65°C水浴中24小时,或向下旋转(以4000转/分的速度离心8分钟),上清液通过0.45 μm过滤器(Millipore, Billerica, MA)。无菌过滤盘放在CM琼脂板上,距5毫米的琼脂塞4厘米远m . oryzae70 - 15所示。滤盘分别接种LB液50 μl、EA105热杀细胞50 μl或EA105上清液(无细胞废液)50 μl。进行两次生物重复,取平均值。使用ImageJ测量所有真菌直径,并按上述方法计算抑菌率。
细菌运动性
为了评估细菌的运动性,根据已发表的方案对水稻分离株进行了游泳和群集试验[81].简单地说,将细菌刺放在游泳板(5 g/L NaCl, 10 g/L色氨酸,0.03% (w/v)琼脂糖)和群板(8 g/L营养肉汤,5 g/L葡萄糖,0.5% (wt/vol)琼脂上,30°C孵育后,测量细菌生长直径。
氰化物的测定
细菌培养上清液中氰化物的生成使用来自Lazar研究实验室的Lazar型号LIS-146CNCM微氰化物离子电极进行测量。细菌培养物在LB中培养24小时,转速为200转,温度为30°C。600 nm处的光密度600)。将细胞离心(4000rpm下离心8分钟),取上清进行测量。电极在使用前经过调节,在每个样品读数之间用70%乙醇和水冲洗。进行两次生物重复。
氰化物突变体D5的构建
D5突变体是使用Targetron基因敲除系统(Sigma-Aldrich)来破坏氰化氢生物合成操纵子的一个区域,该区域包含两个hcnB而且hcnC基因。II组内含子插入位置的引物由Sigma-Aldrich计算机算法根据输入序列从hcnBC基因。这些引物(IBS, EBS1d和EBS2)以及EBS通用引物被用于扩增内含子模板。所得扩增物用QiaQuick PCR纯化试剂盒(Qiagen)纯化,用hind ii和BsrGI双酶切,然后用T4 DNA连接酶和2X快速连接缓冲液(Promega)以1:2摩尔比的载体插入DNA连接到线性pACD4K-C载体上。转换按照Targetron的建议进行,除了热休克延长到60秒,恢复时间延长到3小时,孵化温度为30℃。根据Targetron协议使用IPTG诱导II组内含子插入。利用菌落PCR选择潜在的转化体,并使用LIS-146微氰化物探针(Lazar研究实验室)确认不产生氰化物。
固相微萃取-气相色谱-质谱(SPME-GC-MS)
用65 μm聚二甲基硅氧烷/二乙烯基苯(Sigma-Adrich)包覆的SPME熔融石英纤维提取EA105产生的挥发性代谢物。EA105在LB琼脂上生长2天,然后将纤维暴露在EA105上方的顶空24小时。然后人工将纤维注入Agilent 6890 GC,使用5973 N MS检测器(Agilent Technologies),安装HP-5MS毛细管柱(30 m × 0.25 mm, 0.5 μm)和火焰电离检测器。入口温度为250℃。烘箱条件在40°C启动2分钟,从10°C/min上升到250°C,并保持2分钟。使用质谱库(NIST)识别VOCs。所鉴定化合物的标准曲线是使用市售化合物创建的。用甲醇稀释,注入2 μl。通过比较EA105剖面与标准曲线的峰高来确定所产生的挥发物的浓度。进行4个生物重复。
孢子萌发和附着胞形成
塑料覆盖物用乙醇消毒,用作孢子孢子的疏水表面。m . oryzae70-15个孢子在燕麦琼脂上生长10天,悬浮在水中并用Miracloth过滤。对于s -甲基硫酯处理,在100%甲醇中使用100 mM的化合物库存,并与具有相同最终甲醇量的对照处理进行比较。对于氰化物处理,将氰化钾溶解在35 mM KOH中,制成100 mM的原液,进一步在水中稀释。将孢子与化合物1:1 (v:v)的溶液制成,最终浓度为105孢子/ml,化合物浓度为1-500 μM。对于细菌处理,OD的最终浓度600= 0.02 (~1×107cells/mL)。五个塑料覆盖物被放入培养皿中,培养皿中央有一个潮湿的过滤盘,以保持湿度。将处理过的孢子滴入50 μL。对于间接细菌处理,在每个覆盖物旁边放置一滴细菌细胞,并在覆盖物上放置50ul未经处理的孢子。培养皿被封上防滑膜,置于室温下的黑暗环境中。使用蔡司Axioscope2直立光学显微镜测定处理3小时后附着胞萌发率和24小时后附着胞形成率。在每个封面的不同位置拍摄5张图像,每次处理共拍摄25张图像。通过计算图像中发芽孢子的数量和孢子总数来计算萌发率。附着胞形成百分率是通过计算产生附着胞的萌发分生孢子的数量来确定的。按照上述方案检查了三个生物重复。
根际细菌介导的ISR评价
根状细菌分离株在30°C震动200 rpm的LB中生长过夜。细胞通过离心(4000rpm, 8分钟)旋转,上清液被丢弃。细胞在无菌水中洗涤两次,然后重悬至外径6000.5 (~2.5×108细胞/毫升)。每株3周龄的土生马拉泰利水稻植株用2毫升的根际细菌悬浮液进行根部引物处理。每个处理设8个重复。用2 mL无菌水处理模拟植物。24小时后,每株植株的茎叶上喷1毫升m . oryzae以10的浓度过滤70-15510天前的孢子悬浮在无菌水中,用miraccloth过滤,用血细胞计计数。孢子浓度调整为1×105孢子/mL水和1:10 (v:v)的0.2%明胶加入悬浮液。用艺术家的喷枪将植物喷洒在装有湿纸巾的塑料袋内,密封以保持湿度,并用塑料箱覆盖24小时的黑暗。作为预防措施,接种了病原体的植物被转移到单独的生长室,并在与其他处理组相同的生长条件下生长。1周后拍摄叶片照片,使用图像分析程序ImageJ统计第二年轻叶片上的病变数量,以便准确评分。进行4个生物重复。
为了检测水稻基因表达的变化,M-104种子在培养皿中杀菌发芽。在发芽后7天,将幼苗转移到含有50 mL Hoagland液体培养基的透明无菌盒中。培养基pH维持在5.7。在萌发后14天,用水洗过的细菌接种液体培养基,最终浓度为106细胞/毫升。处理24小时后,将叶片组织冷冻在液氮中,使用Bio Basic EZ-10 Spin Column Plant RNA Mini-Prep Kit提取RNA。用Turbo DNAse (Ambion)处理RNA,用高容量cDNA逆转录试剂盒(Ambion)合成cDNA,使用500 ng RNA。PCR使用标准Taq聚合酶(New England Biolabs)进行。利用Nipponbare基因序列的引物Blast (NCBI)设计了SA响应基因PR1和WRKY77、JA响应基因JAR1和WRKY30以及ETH响应基因EIL1和ERF1的引物,并在SOM附加文件中列出9:表S4。PCR产物在1.4%琼脂糖凝胶上运行,用溴化乙锭染色,并使用Alpha Imager系统成像。使用ImageJ量化带强度。用泛素对照对所有样品进行正态化。每个生物重复来自9个植物,每个处理3个生物重复。
统计分析
采用统计软件jmp10进行数据分析。为了比较各处理之间的差异,采用Tukey 's HSD检验,当p < 0.05时,认为结果有统计学差异。
参考文献
- 1.
Zeigler RS,梁莎,Teng PS:水稻稻瘟病。水稻稻瘟病,1994,1-626。
- 2.
Skamnioti P, Gurr SJ:对抗谷物:保护水稻免受稻瘟病。生物技术,2009,27:141-150。10.1016 / j.tibtech.2008.12.002。
- 3.
Bonman JM, Khush GS, Nelson RJ:水稻抗虫害育种。植物学报,1997,30:457 - 457。10.1146 / annurev.py.30.090192.002451。
- 4.
Chuma I, Isobe C, Hotta Y, Ibaragi K, Futamata N, Kusaba M, Yoshida K, Terauchi R, Fujita Y, Nakayashiki H, Valent B, Tosa Y:稻瘟病菌Magnaporthe oryzae及其相关种染色体间AVR-Pita效应基因的多重易位《公共科学图书馆·病原体》,2011,7:e1002147-10.1371/journal.ppat.1002147。
- 5.
Aktar MW, Sengupta D, Chowdhury A:农业使用农药的影响:它们的好处和危害。化学学报,2009,2:1-12。
- 6.
Lugtenberg B, Kamilova F:促进植物生长的根状细菌。微生物学通报,2009,29(3):344 - 344。10.1146 / annurev.micro.62.081307.162918。
- 7.
Silby MW, Winstanley C, Godfrey SA, Levy SB, Jackson RW:假单胞菌基因组:多样性和适应性。中国生物医学工程学报,2011,35:652-680。10.1111 / j.1574-6976.2011.00269.x。
- 8.
Thomashow LS, Weller DM:来自荧光假单胞菌的phenazine抗生素在小麦高曼诺霉菌生物防治中的作用。中华微生物学杂志,1998,17(3):349 - 349。
- 9.
Voisard C, Keel C, Haas D, Defago G:荧光假单胞菌(Pseudomonas fluorescens)产生氰化物有助于抑制烟草黑根腐病。机械工程学报,1998,8:351-358。
- 10.
根际多营养相互作用对生氰假单胞菌的影响。PloS One, 2008, 3: 1-11。
- 11.
Raaijmakers JM, Weller DM, Thomashow LS:自然环境中产抗生素假单胞菌的频率。环境微生物学学报,1997,33(3):389 - 397。
- 12.
Howell CR, Stipanovic RD:荧光假单胞菌和细菌产生的抗生素对棉花幼苗的根瘤菌控制。植物病理学杂志,2009,29(4):344 - 344。10.1094 /发朵- 69 - 480。
- 13.
Howell CR, Stipanovic RD:荧光假单胞菌及其抗菌素pyolteorin对Pythium诱导的棉花幼苗衰减的抑制。植物病理学杂志,2000,30(4):344 - 344。10.1094 /发朵- 70 - 712。
- 14.
王晓明,王晓明,王晓明,王晓明,等。荧光假单胞菌(Pseudomonas fluorescens)抗真菌环状脂肽张力素(tensin)的结构、合成特征及抗真菌活性研究。中国生物医学工程学报,2000,29(3):349 - 349。10.1046 / j.1365-2672.2000.01201.x。
- 15.
王晓明,王晓明,王晓明,等。荧光假单胞菌DR54制备的一种具有表面活性和抗真菌活性的新型环分离肽粘菌酰胺。应用微生物学杂志,1999,37(3):344 - 344。10.1046 / j.1365-2672.1999.00798.x。
- 16.
Vitullo D, Di Pietro A, Romano A, Lanzotti V, Lima G:新型细菌表面素在解淀粉芽孢杆菌和尖孢镰刀菌抗真菌作用中的作用。植物病理学杂志,2012,29(3):349 - 349。10.1111 / j.1365-3059.2011.02561.x。
- 17.
王晓明,王晓明,王晓明,王晓明,王晓明。芽孢杆菌非核糖体脂肽的合成及活性研究。中国生物医学工程学报,2012,29(3):366 - 366。10.1007 / s00253 - 012 - 4181 - 2。
- 18.
Van Loon LC:植物对促进植物生长细菌的反应。中国植物病理学杂志,2007,29(3):344 - 344。10.1007 / s10658 - 007 - 9165 - 1。
- 19.
Van der Ent S, Van wes SCM, Pieterse CMJ:植物与抗性诱导有益微生物相互作用中的茉莉酸信号。植物化学学报,2009,30(4):344 - 344。10.1016 / j.phytochem.2009.06.009。
- 20.
Ryu C, MA Farag, Hu C, Reddy MS, Kloepper JW, Paré PW:细菌挥发物诱导拟南芥系统性抗性。植物科学进展,2004,27(3):344 - 344。10.1104 / pp.103.026583。
- 21.
Van威斯SCM, Van der Ent S, Pieterse CMJ:有益微生物引发的植物免疫反应。植物学报,2008,11:443-448。10.1016 / j.pbi.2008.05.005。
- 22.
Pozo MJ, Van Der Ent S, Van Loon LC, Pieterse CMJ:转录因子MYC2在拟南芥根细菌诱导的系统抗性过程中参与增强防御。环境科学学报,2008,30(4):344 - 344。10.1111 / j.1469-8137.2008.02578.x。
- 23.
王志强,王志强,王志强,等。植物抗菌素在植物抗菌素生物防治中的应用镰刀菌素康乃馨枯萎病假单胞菌sp.菌株WCS417r。植物病理学杂志,2001,29(3):344 - 344。10.1094 /发朵- 81 - 728。
- 24.
王志强,王志强,王志强,等。植物根系定植菌的研究进展。科学通报,2002,26(3):379 - 379。10.1126 / science.216.4553.1376。
- 25.
吴玉生,李志强,李志强,李志强,李志强,李志强:微生物相关分子模式(MAMPs)介导根际细菌在植物体内的增殖拟南芥.植物学报。2012,doi:10.1104/pp.112.200386
- 26.
王志强,王志强,王志强,Paré PW, Bais HP:植物根系分泌苹果酸对土壤有益菌的诱导作用。植物科学学报,2008,29(3):344 - 344。10.1104 / pp.108.127613。
- 27.
Haas D, Keel C:植根假单胞菌抗生素生产的调控及其与植物病害生物防治的相关性。植物学报,2003,29(4):344 - 344。10.1146 / annurev.phyto.41.052002.095656。
- 28.
Rudrappa T, Biedrzycki ML, Kunjeti SG, Donofrio NM, Czymmek KJ, Paré PW, Bais HP:根状细菌激发子acetoin诱导拟南芥系统性抗性。传播与整合生物学,2010,3:1-9。10.4161 / cib.3.1.9694。
- 29.
Ryu CM, Farag MA, Hu CH, Reddy MS, Wie HX, Paré PW, Kloepper JW:细菌挥发物促进拟南芥生长。中国自然科学,2003,30(4):377 - 382。10.1073 / pnas.0730845100。
- 30.
Blumer C, Haas D:细菌氰化物生物合成的机制、调控和生态作用。中国生物医学工程学报,2000,29(3):344 - 344。10.1007 / s002039900127。
- 31.
Pessi G, Haas D:厌氧调节因子ANR和群体感应调节因子LasR和RhlR对氰化氢生物合成基因hcnABC的转录控制。中华微生物学杂志,2000,29(4):349 - 349。10.1128 / jb.182.24.6940 - 6949.2000。
- 32.
Laville J, Blumer C, Von Schroetter C, Gaia V, Défago G, Keel C, Haas D:编码氰化氢合成酶hcnABC基因簇的鉴定及ANR对严格好氧生物控制剂荧光假单胞菌CHA0的厌氧调控。中华微生物学杂志,1998,18(3):387 - 387。
- 33.
Zlosnik JE, Williams HD:测定细菌培养上清中氰化物的方法。应用微生物学杂志,2004,38:360-365。10.1111 / j.1472 - 765 x.2004.01489.x。
- 34.
Fernando WGD, Ramarathnam R, Krishnamoorthy AS, Savchuk SC:潜在细菌有机抗真菌挥发物在生物防治中的识别和使用。土壤生物化学,2005,37:955-964。10.1016 / j.soilbio.2004.10.021。
- 35.
Howell CR, Beier RC, Stipanovic RD:阴沟肠杆菌产氨及其在细菌毕氏菌出菌前抑制中的可能作用。植物病理学杂志,1998,28(3):357 - 357。10.1094 /发朵- 78 - 1075。
- 36.
Wilson R, Talbot NJ:在压力下:调查植物感染稻瘟病菌的生物学。自然科学进展,2009,7:185-95。10.1038 / nrmicro2032。
- 37.
李志强,李志强,李志强,等。荧光假单胞菌CHA0与食性线虫相互作用的研究。中国生物医学工程学报,2011,29(3):344 - 344。10.1007 / s00248 - 011 - 9821 - z。
- 38.
Kai M, Haustein M, Molina F, Petri A, Scholz B, Piechulla B:细菌挥发物及其动作电位。中国生物医学工程学报,2009,29(3):344 - 344。10.1007 / s00253 - 008 - 1760 - 3。
- 39.
de Werra P, Péchy-Tarr M, Keel C, Maurhofer M:葡萄糖酸产生对荧光假单胞菌CHA0生物防治性状的调控作用。环境科学学报,2009,37(4):344 - 344。10.1128 / AEM.00295-09。
- 40.
Iavicoli A, Boutet E, Buchala A, Métraux JP:拟南芥对荧光假单胞菌CHA0根系接种的系统抗性诱导。植物生态学报,2003,6:851-858。
- 41.
黄志刚,李志刚,李志刚:烟草黑腐病的研究进展。植物病理学杂志,1986,27(3):344 - 344。10.1094 /发朵- 76 - 181。
- 42.
Berry CL, Nandi M, Manuel J, Brassinga AKC, Fernando WGD, Loewen PC, de Kievit TR: Pseudomonas sp DF41群体感应位点的鉴定及其在真菌拮抗中的作用。中国生物防治,2014,34(3):344 - 344。
- 43.
焦震,吴楠,黑尔玲,吴伟,吴东,郭艳:小麦小麦尖眼病防治菌株Pa40的鉴定。中国生物工程学报,2013,29(3):344 - 344。
- 44.
Raio A, Puopolo G, Cimmino A, Danti R, Della Rocca G,证据A: phenazine产菌chlororaphis subsp aurefaciens菌株M71对柏树溃疡病的生物防治生物防治,2011,58(2):133-138。10.1016 / j.biocontrol.2011.04.012。
- 45.
Ramarathnam R, Fernando WGD, de Kievit T:由chlororaphis假单胞菌、蜡样芽孢杆菌和解淀粉芽孢杆菌介导的抗生素作用和诱导系统抗性在控制油菜黑腿病中的作用。生物防治,2011,56(2):225-235。10.1007 / s10526 - 010 - 9324 - 8。
- 46.
Hoitink HAJ, Boehm MJ:土壤微生物群落背景下的生物防治:基质依赖现象。植物学报,1999,37:427-446。10.1146 / annurev.phyto.37.1.427。
- 47.
da Rocha UN, van Overbeek L, van Elsas JD:从根际探索迄今为止未培养的细菌。中国生物医学工程学报,2009,29(3):332 - 332。10.1111 / j.1574-6941.2009.00702.x。
- 48.
Rudramurthy SM, Chakrabarti A, Geertsen E, Mouton JW, Meis JF:与其他7种抗真菌药物相比,异伏康唑对208株黄曲霉的体外活性:根据欧洲抗菌药物敏感性测试委员会的方法进行评估。中华微生物学杂志,2011,29(3):357 - 357。10.1016 / j.diagmicrobio.2011.08.006。
- 49.
Kumar AS, Lakshmanan V, Caplan JL, Powell D, Czymmek KJ, Levia DF, Bais HP:根细菌枯草芽孢杆菌限制叶面病原体通过气孔进入。植物学报,2012,doi:10.1111/j.1365-313X.2012.05116.x
- 50.
马赛尔,Sawers R, Oakeley E, Angliker H, Paszkowski U:稻瘟病菌的组织适应性入侵策略。中国生物医学工程学报,2010,22:3177-87。10.1105 / tpc.110.078048。
- 51.
Sesma A, Osbourn AE:水稻叶瘟病菌经历了典型的根感染真菌的发育过程。自然科学进展,2004,29(4):344 - 344。10.1038 / nature02880。
- 52.
王志强,王志强,王志强。植物免疫应答的研究进展。电子学报,2006,34(4):344 - 344。10.1016 / j.cell.2006.02.008。
- 53.
Quilis J, Penas G, Messeguer J, Brugidou C, Segundo BS:拟南芥AtNPR1在转基因水稻中对真菌、细菌或病毒病原体的防御反应进行反向调节,同时对非生物胁迫产生超敏反应。植物生态学报,2008,29(4):531 - 531。10.1094 / mpmi - 21 - 9 - 1215。
- 54.
韩cu, Lee CH, Jang KS, Choi GJ, Lim HK, Kim JC, Ahn SN, Choi JE, Cha JS, Kim HT, Cho KY, Lee SW:水稻抗稻瘟病突变体诱导基因的鉴定。分子与细胞,2004,17:462-468。
- 55.
De Vleesschauwer D, Djavaheri M, Bakker P, Hofte M:荧光假单胞菌WCS374r诱导水稻对稻瘟病菌的系统性抗性是基于假杆菌素介导的水杨酸抑制多面防御反应的启动。中国农业科学,2008,29(4):344 - 344。10.1104 / pp.108.127878。
- 56.
Pieterse CMJ, Van Pelt JA, Van SCM, Ton J, Leon-Kloosterziel KM, Keurentjes JJB, Verhagen BWM, Knoester M, Van der Sluis I, Bakker P, Van Loon LC:根细菌介导的诱导系统性抗性:触发、信号和表达。中国植物病理学杂志,2001,27(3):344 - 344。10.1023 /: 1008747926678。
- 57.
彭XX,胡玉军,唐晓科,周培林,邓小斌,王海辉,郭志军:水稻WRKY30基因的本型表达增加了水稻内源茉莉酸积累、PR基因表达及对真菌病原体的抗性。植物学报,2012,26(3):344 - 344。10.1007 / s00425 - 012 - 1698 - 7。
- 58.
Nakano TK, Suzuki K, Fujimura T, Shinshi H:拟南芥和水稻ERF基因家族的全基因组分析。植物科学进展,2006,30(4):344 - 344。10.1104 / pp.105.073783。
- 59.
kanjanamaneesathan M, Kusenwiriyawong C, Pengnoo A, Nilratana L:水稻纹枯病潜在拮抗剂的筛选和有效应用的细菌配方的开发。植物生态学报,1998,27(3):379 - 379。10.1071 / AP98022。
- 60.
张志刚,张志刚,张志刚,张志刚。荧光假单胞菌诱导水稻纹枯病抗性的研究进展。土壤生物化学,2001,33:603-612。10.1016 / s0038 - 0717(00) 00202 - 9。
- 61.
曾谷N,中岛M,渡边K, Hibi T, Akutsu K:粘质沙雷菌B2在水稻纹枯病生物防治中的潜力。生物防治技术,2005,15:105-109。10.1080 / 09583150400016092。
- 62.
杨晓明,王晓明,王晓明,等。荧光假单胞菌Pf1对水稻纹枯病防治效果的研究。生物防治技术,1999,9:67-74。10.1080 / 09583159929910。
- 63.
Wiwattanapatapee R, Pengnoo A, Kanjanamaneesathian M, Matchavanich W, Nilratana L, Jantharangsri A:含控制鞘枯病细菌拮抗剂的漂浮颗粒。中国机械工程学报,2004,29(4):344 - 344。10.1016 / j.jconrel.2003.12.024。
- 64.
王志刚,王志刚,王志刚,等:拮抗细菌对水稻稻瘟病的生物防治及假单胞菌的拮抗作用。中国植物病理学杂志,2002,23(4):389 - 397。10.3186 / jjphytopath.58.380。
- 65.
李志强,李志强,李志强,等。荧光假单胞菌pf7 - 14对水稻稻瘟病的生物防治研究。中国生物防治杂志,1998,16(3):344 - 344。
- 66.
韩建刚,孙磊,董晓珍,蔡志强,孙晓亮,杨海林,王玉生,宋伟:一株新的植物促生菌tsuruhatensis HR4的重氮营养和潜在生物防治作用。应用微生物学报,2005,28:66-76。10.1016 / j.syapm.2004.09.003。
- 67.
张志刚,李志刚,张志刚,张志刚:水稻根际抑制稻瘟病菌株的鉴定。作物学报,2005,28:1052-1060。
- 68.
Karthikeyan V, Gnanamanickam SS:菌株对狗尾草瘟病的生物防治。作物保护,2008,27:263-267。10.1016 / j.cropro.2007.05.013。
- 69.
Filippi MCC, da Silva GB, Silva- lobo VL, Cortes M, Moraes AJG, Prabhu AS:根际细菌对巴西好氧水稻叶瘟病(Magnaporthe oryzae)的抑制和生长促进作用。生物防治,2011,38(4):344 - 344。10.1016 / j.biocontrol.2011.04.016。
- 70.
Lucas JA, Solano BR, Montes F, Ojeda J, Megias M, Manero FJG:两株PGPR在西班牙南部水稻稻瘟病综合治理中的应用。农学通报,2009,29(4):344 - 344。10.1016 / j.fcr.2009.09.013。
- 71.
下井,井上K,北川H,山崎M,对马S, Park P,池田K:胶溶菌分离作用对稻瘟病的生物防治。生物防治,2010,55:85-91。10.1016 / j.biocontrol.2010.07.008。
- 72.
Vidhyasekaran P, Rabindran R, Muthamilan M, Nayar K, Rajappan K, Subramanian N, Vasumathi K:一种用于水稻稻瘟病防治的荧光假单胞菌粉末配方的研制。植物病理学杂志,1997,29(4):344 - 344。10.1046 / j.1365 3059.1997.d01 - 27. x。
- 73.
水杨酸在植物体内的积累和抗性的诱导作用栽培稻杨晓明,李志军,李志军,等。水稻稻瘟病菌的生物抑制作用。微生物学通报,1998,14:935-937。10.1023 /: 1008872925755。
- 74.
Ashelford KE, Chuzhanova NA, Fry JC, Jones AJ, Weightman AJ:新的筛选软件显示,最近的大型16S rRNA基因克隆文库包含嵌合体。环境科学学报,2006,27(3):344 - 344。10.1128 / AEM.00556-06。
- 75.
王强,Garrity GM, Tiedje JM, Cole JR: Naïve用于rRNA序列快速分配的贝叶斯分类器。环境科学与技术,2007,29(3):357 - 357。10.1128 / AEM.00062-07。
- 76.
Wickham H: ggplot2:用于数据分析的优雅图形。纽约:施普林格2009。
- 77.
Cole JR, Wang Q, Cardenas E, Fish J, Chai B, Farris RJ, Kulam-Syed-Mohideen AS, McGarrell DM, Marsh T, Garrity GM, Tiedje JM:核糖体数据库项目:改进的比对和rRNA分析的新工具。中国生物医学工程学报,2009,37:D141-D145。10.1093 / nar / gkn879。
- 78.
Bertani G:溶生研究。一、溶原释放噬菌体的方式。大肠杆菌。中华微生物学杂志,2001,27(3):344 - 344。
- 79.
豆科根瘤菌中R因子的转移。中华微生物学杂志,2004,27(4):388 - 388。
- 80.
温热绿硫细菌偶联遗传转移的研究。中国生物医学工程学报,2003,26(3):344 - 344。
- 81.
拉希德MH, Kornberg A:铜绿假单胞菌的游动、群集和抽搐运动都需要无机聚磷酸盐。美国国家科学研究院。2000, 37(4): 457 - 457。10.1073 / pnas.060030097。
确认
H.P.B.和V.S.感谢NSF奖PGPR-0923806的支持。我们要感谢罗夫山·马哈穆多夫博士协助我们使用气相色谱-质谱联用。此外,我们要感谢南希·格雷戈里捐赠了自然分离的植物病原体,感谢亚当·德雷珀在涉及这些菌株的抑制实验中提供的帮助。最后,我们要感谢Dr. Thomas Hanson的建议和指导。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
CS和EA分离土壤细菌并进行抑菌试验。CS进行了氰化突变体的构建和检测、附着测定和基因表达测定。EA进行了GC-MS实验,并对所得化合物进行了测试。CR维持水稻植株,采集根际土壤样品,进行16S测序。利用CJ对16S序列进行生物信息学分析。CS, EA和HB起草了手稿。HB构思了这项研究,HP、VS和ND参与了设计和协调。所有作者都阅读并批准了最终的手稿。
卡拉·斯宾塞和艾米丽·阿尔夫都对这项工作做出了同样的贡献。
电子辅助材料
12870 _2014_1538_moesm1_esm.pdf
附加文件1:图S1:水稻根际微生物群落中主要细菌属的相对丰度(频率)在过去两年的记录。所显示的频率是通过对2008年和2009年分别对应654个和630个克隆的16S rDNA序列进行分类获得的。(pdf 87kb)
12870 _2014_1538_moesm2_esm.pdf
附加文件2:图S2:假单胞菌分离株的游动和群集运动。如Rashid & Kornberg(81)所述,细胞在活动板上生长24小时。所有配对的均值比较采用Tukey-Kramer HSD统计检验,其中相同字母的均值无显著差异(n=3)。在群集板和游动板中进行比较。(pdf 48kb)
12870 _2014_1538_moesm3_esm.pdf
附加文件3:表S1: EA105在直接板或隔室板上与琼脂或液体上对真菌抑制作用的比较(pdf 1mb)
一)
附加文件4:图S3:经热杀伤细胞处理的M. oryzae的生长和EA105抑制后的生长。热杀细胞和无细胞废液对真菌抑制作用的影响。在距离M. oryzae 70-15 4 cm处取50 μl热杀伤EA105细胞或无EA105细胞的废培养基,3 d后测量70-15直径。误差条表示标准偏差。使用Student 's t检验,对照组和处理间无显著差异,p值<0.05。B)EA105挥发物暴露后M. oryzae 70-15生长恢复。真菌栓子在先前暴露于由假单胞菌分离物EA105产生的抗真菌挥发物后,被复制到新鲜的CM琼脂上。3 d后测定真菌直径,观察其正常生长。对照组与先前暴露的70-15之间没有显著差异。误差条表示标准误差。(pdf 48kb)
12870 _2014_1538_moesm5_esm.pdf
附加文件5:图S4:细菌在活性炭存在下产生的挥发性化合物的活性。活性炭的存在消除了细菌挥发物的抑制作用。误差条表示标准偏差。根据学生的t检验,相同字母的平均值没有显著差异,p<0.05。没有活性炭的盘子用大写字母,用活性炭修饰的盘子用小写字母。(pdf 49kb)
一)
附加文件7:图S5: S甲基硫酯和1-十一烯对M. oryzae的抑制作用。用于计算EA105产生的挥发物生物浓度的标准曲线。将市售化合物稀释在甲醇(s -甲基硫代丙酸盐,s -甲基硫代异戊酸盐)或氯仿(1-十一烯)中,并注入GC-MS进行分析。B)M. oryzae在含有不同浓度s -甲基硫酯的培养皿上生长5天后70-15。除s -硫异戊酸甲酯外,其余均出现1 mM的显著抑制(Student 's t检验,p<0.05)。C)M. oryzae在培养基中含有不同浓度1-十一烯的培养皿上5天后生长70-15。5 mm1 -十一烯具有显著抑制作用(Student 's t检验,p<0.05)。误差条表示标准误差。(pdf 62kb)
12870 _2014_1538_moesm8_esm.pdf
附加文件8:表S3:用硫醇酯处理孢子对萌发和形成附壁能力的影响。(pdf 1mb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
斯宾塞,C.,阿尔夫,E.,约翰逊,C.et al。天然水稻根际微生物抑制稻瘟病感染。BMC植物生物学14日,130(2014)。https://doi.org/10.1186/1471-2229-14-130
收到了:
接受:
发表:
关键字
- 大米
- 爆炸
- Magnaporthe oryzae
- Psuedomonas
- 氰化氢
- 生物电控制
- 诱导全身耐药