摘要
背景
植物预先暴露于不同的非生物胁迫可能会改变其对随后胁迫的生理和转录反应,这表明了一种“应激记忆”形式。经历过多次脱水胁迫的拟南芥植物表现出转录行为,表明对早期胁迫的“记忆”。对第一次压力的反应是上调或下调转录,但在随后的压力中却有明显不同的反应,这些基因被定义为“记忆基因”。对每种压力反应相似的基因形成了“非记忆”类。目前尚不清楚在其他被子植物谱系中是否存在这样的记忆反应,以及记忆是否是对重复脱水应激的进化保守反应。
结果
在这里,我们确定了玉米的转录反应(玉米l)将反复暴露于脱水胁迫的植物与第一次遇到脱水胁迫的植物进行比较。四种不同的转录记忆反应模式类似于答:芥才被揭示出来。最重要的贡献是,单子叶植物和全子叶植物这两个在140 - 200万年前分化的谱系显示出类似的“记忆”脱水胁迫并相应修改其转录反应的能力。高灵敏度的RNA-Seq分析允许识别两个谱系中功能相似的基因,以及以物种特有方式发挥作用的基因。记忆转录模式表明,在重复胁迫下响应基因的转录行为与初始脱水胁迫下的转录行为不同,表明应激记忆是多种信号通路协调响应的复杂表型。
结论
在两种植物中显示相同记忆反应的结构相关基因表明,在植物脱水胁迫反应系统的进化过程中,基因的记忆是守恒的。另一方面,编码相似功能的基因的转录记忆反应存在差异,这表明存在种特异性记忆反应。该结果为我们目前关于植物如何应对多重脱水胁迫的知识提供了新的见解,与单一暴露相比,并可能作为研究记忆基因在单子叶和单子叶植物对水分亏缺适应性反应中的功能的参考平台。
背景
水分亏缺会影响植物的多种功能,包括生长、光合作用、代谢途径,如果严重到一定程度,还会导致组织损伤和死亡[1].植物对脱水胁迫的反应是通过生理调整来进行的,这些生理调整可能是由脱水胁迫反应中涉及的特定基因的表达所调节的[2,3.].预暴露于不同类型的压力,包括脱水压力,可能会改变随后的反应,这表明了一种形式的“压力记忆”[4- - - - - -7].答:芥在充分浇水恢复后,经历过一次或多次交替脱水胁迫处理的植物(“经过训练的”植物)保留了对早期脱水胁迫的记忆,这可以从第一次经历脱水胁迫的植物(“未经训练的”植物)保留叶片相对含水量(RWC)的能力中得到证明[8].经过训练的植物在转录水平上也有不同的反应,因为几个aba诱导的基因在随后的暴露中表现出更高的转录率和转录水平,这种行为与转录记忆一致[8].在最近的全基因组转录组分析中答:芥,我们发现在重复应激处理过程中,转录记忆模式出现了意想不到的多样性[9].
拟南芥是植物生物学研究的一个模式系统,并为影响农业重要过程的方法提出建议[10].为了确定拟南芥以外的被子植物系是否存在脱水胁迫记忆,我们对重复胁迫玉米(玉米l .)植物。鉴定显示相同记忆类型反应的同源基因将表明,在两个分化了140 - 200亿年的谱系中,记忆反应在进化上是保守的[11].另一方面,同源基因的非记忆或发散记忆反应说明了这些基因在脱水应激反应和/或进化过程中功能的多样化和专门化。
实验重复脱水胁迫系统包括将幼苗暴露于连续循环的空气干燥,一夜浇水恢复,然后暴露于新的脱水条件[8].这一过程与干旱条件下植物在土壤中生长时发生的水势每日振荡有相似之处,土壤中的水分有效性降低[12].在此,我们分析了玉米和拟南芥脱水胁迫响应相关基因的转录行为,以评估玉米和拟南芥结构相关基因的保守性和差异性脱水胁迫记忆反应,并比较了这两个物种脱水记忆基因编码的潜在细胞功能。
方法
植物生长和处理
玉米L.(栽培品种B73)幼苗在温室土壤中定期浇水。将两周大的幼苗从土壤中取出,将其根部放在水中的托盘中驯化一夜。第二天早上,将幼苗暴露在22°C的空气中干燥2小时(第一次脱水应激,S1),然后在22°C的22小时完全再水化恢复期,如前所述[8].重复的脱水压力是在暴露于空气干燥/过夜浇水恢复的相同交替循环下进行的。分析了非胁迫浇水(W)植物、经历单一胁迫暴露(S1)和三次胁迫暴露(S3)植物的叶片。每个处理点使用7到10株植物,RNA-seq分析使用两个独立的生物样本。从植物分离的叶片中测量相对含水量(RWC),并立即称重以确定其FW(鲜重)。同样的叶子在去离子水中浸泡24小时,吸干并称重以确定它们的TW(膨胀重量)。在牛皮纸袋中(65°C)烘烤24 h后测量叶片干重(DW)。RWC值的计算公式为:RWC (%) = ((FW - DW)/(TW - DW)) × 100% [13].
RNA提取和RNA- seq文库构建
收集叶片组织,并立即在液氮中冷冻。总RNA用Trizol (Invitrogen Inc.)提取。卡尔斯巴德,CA,美国),用DNase I (Qiagen, Valencia, CA)处理,用Qiagen RNeasy纯化。RNA完整性在生物分析仪2100上使用Nano 6000 LabChip(安捷伦科技,加州圣克拉拉)进行了确认。使用RNA- seq样品制备试剂盒(Illumina, San Diego, CA)从总RNA中制备互补DNA测序文库。所得到的cDNA文库在琼脂糖凝胶上进行大小分割,切除200 bp片段,并通过15次聚合酶链反应进行扩增。Cluster Station (Illumina)的流式细胞表面cDNA测序文库通过所谓的桥式扩增产生了Cluster。在内布拉斯加大学林肯分校基因组学核心设施的Illumina GAIIx上,分别在一个流池的单通道上对浇灌的、S1和S3样本库进行复制。
逆转录和实时PCR
总RNA分离和低聚物(dT) (18418-012, Invitrogen)逆转录如前所述[14].采用iCycler iQ real-time PCR仪(Bio-Rad)和SYBR Green mix (Bio-Rad)进行实时PCR分析,采用基因特异性引物检测单个基因的数量。特异性基因的相对表达量或数量用2——ΔΔCt计算(15],根据制造商的软件(Bio-Rad),其中的内参基因是泛素。实时RT-PCR中使用的引物在附加文件中1.
生物信息学分析
对水、S1和S3样本的转录组测序分别产生了76.0、74.6和7170万个reads,每个样本的两个生物重复相加(附加文件)2).每个样本第一次复制的读取长度为75个碱基,第二次复制的读取长度为76个碱基。为了确定重复的质量,我们对三个样本分别进行了最小二乘简单线性回归。我们计算了R2统计量(0.94≤R2≤0.98)和斜率(0.81≤b≤1.00),它们分别提供拟合优度和相关性的度量回归MATLAB®函数(版本8.1.0.604 [R2013a];MathWorks™,附加文件2).为了用于所有进一步的分析,从MaizeGDB下载了玉米的基因组(Maize Golden Path B73 RefGen_v2组装),基因模型(版本5b,过滤基因集FGS)和功能注释[16].
的领结(版本2.1.0的;[16])和大礼帽(版本2.0.8;[17])包使用默认参数将RNA序列从浇水、S1和S3读取到基因组,并确定每个样本中已知转录本的表达量。的cuffdiff袖扣包中的工具(2.0.2版本;[18])在默认参数下运行,计算每个基因在样本S1和水、S3和S1之间的表达变化和相关的q值(假发现率调整后的p值)。
当满足以下三个条件时,我们进一步将基因分类为显著差异表达:问≤0.05;|日志2(折叠变化)|≥1;两个样本中至少有一个样本的fpkm归一化表达式值需要大于第25百分位。的输出文件cuffdiff通过添加来自B73 RefGen_v2注释的基因功能描述进一步注释(内部Perl脚本)。由于39,635个基因中只有7164个有“假设的”或“假定的”蛋白质以外的注释,我们决定使用一个经过充分研究的模式生物的蛋白质同源性,即拟南芥,以推断每个基因的描述和GO分类玉米基因。拟南芥蛋白质和基因本体赋值从拟南芥信息资源下载(发布TAIR10, [19])。为每一个玉米我们用了蛋白质BLASTP(版本2.2.28 +;[20.]), e值为103得到一份暗杀名单拟南芥蛋白质;然后,我们根据上升的e值,下降的长度和下降的身份百分比(pid)对命中进行排序。从这个排序的列表中,我们取e值为10之前的所有匹配项10比最好的击中(例如10-63年到10-53年).使用这样的e值范围允许我们对拟南芥同源性最接近的蛋白质。根据这些,我们使用TAIR10描述中的前3个最长的公共子串总结出一个功能描述,并为每个GO域(细胞成分、分子功能和生物过程)创建一个前10个出现术语的列表。我们使用新的推断描述,如果玉米注释不存在,并且我们总是通过这种方法将GO术语分配给玉米蛋白质。
因此获得的所有注释合并到一个主文件中,其中包含S1与水和S3与S1基因表达谱的所有数据(附加文件3.).从这个主文件中,我们确定了2062个重要的干旱响应基因(S1和水),然后使用这个初始集,我们研究了S3和S1中响应显著不同的基因(816个基因)。我们对第一次胁迫(S1)期间的反应类型进行了简单的分类(+或-),表明转录水平高于或低于浇水(W)水平。对于后续的(S3)重音,符号(+,-或=)表示转录水平高于,低于或与S1中的水平相同。据此,将响应基因组合为[++]、[——]、[+-]、[-+]、[+=]和[-=]6类,前4类代表记忆类,后2类代表非记忆类(附加文件)4).另外两类[=/+]和[=/-]包含的基因与W中的预应力水平相比,S1中的表达没有显著变化(根据上述三个显著性标准)。这些基因显著改变了S3中的转录,定义了一种不同的晚反应基因。在形式上,记忆基因被定义为通过改变转录对S1作出反应,但在随后的胁迫下表现出不同的转录反应的基因。由于这些晚反应基因没有出现在对第一种压力做出反应的基因中,我们没有将它们包括在我们的分析中。对于每个不同的响应类,基因被根据(推断的)GO术语分为组(附加文件)5而且6).
water、S1和S3的原始转录组序列文件已与基因表达结果文件一起上传到NCBI的基因表达Omnibus,序列号为GSE48507。
结果
脱水应激反应性记忆和非记忆基因玉米
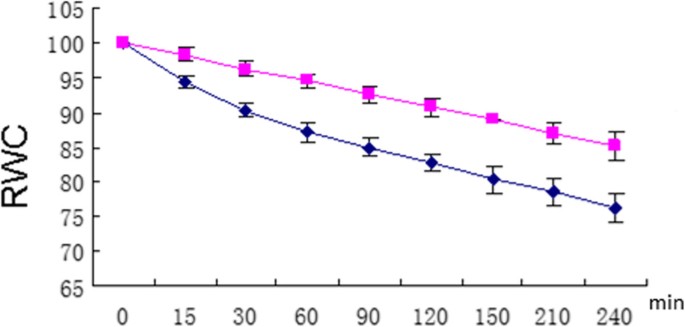
在我们实验室为拟南芥开发的重复脱水胁迫系统中处理两周龄的玉米幼苗[8].像拟南芥植物一样,先前受到胁迫的玉米植物在第二次暴露于干燥空气时表现出较低的失水速率(图1).这种行为与脱水应激记忆一致,使我们能够解决玉米基因是否在随后的脱水应激中显示转录记忆的问题。
分析了从非胁迫浇水(W)、第一次脱水胁迫(S1)和第三次脱水胁迫(S3)(每个胁迫都经过整整22小时浇水恢复期)的幼苗叶片中分离的RNA样本转录水平的全基因组定量分析。S1转录本水平与W转录本水平的显著差异决定了一般的脱水应激反应基因。在这个反应分数中,在S3中与S1中显示显著不同转录水平的基因定义了记忆类别,而在S3中产生与S1中相当水平转录水平的基因构成了非记忆类别。
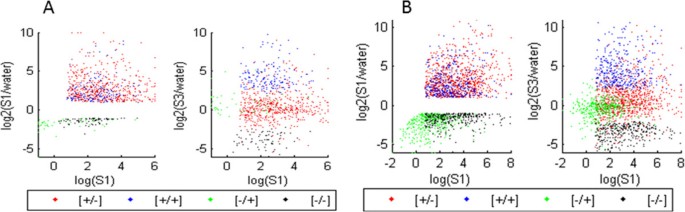
共鉴定出39,635个玉米基因(附加文件3.).其中,2062个基因代表了一般的脱水反应分数:与W相比,S1中有1636个基因上调,426个基因下调(表2)1;额外的文件3.).在脱水反应部分,816个基因(~40%)在S3中提供了不同的反应,构成了玉米转录记忆类别,而1246个基因在每次胁迫处理中产生了相似的转录量,代表玉米“非记忆”基因(表2)1;额外的文件3.).玉米基因S1和S3的脱水胁迫响应分布如图所示2一个。
内存类型的响应玉米脱水应激反应基因
对转录组数据的综合分析揭示了四种不同的转录模式的存在,这些模式与早期在研究中认识到的记忆反应相似答:芥([9];额外的文件4).S1中诱导而S3中超诱导的基因记为[+/+]记忆基因(图3.一个);在S1中表达较低,但在S3中产生转录物水平更低的基因代表[-/-]记忆类型(图3.B) S3/S1转录水平存在显著差异的玉米基因数量最多,S1转录水平增加,S3转录水平相对于S1水平下降([+/-]记忆类型),图3.C.互补转录模式,由S1中较低转录水平的基因显示,但在S3中产生显著较高的转录水平,定义了[-/+]记忆反应类别(图3.D)后两类基因的独特之处在于,这些基因在第二次暴露后会“修改”它们的转录,使其恢复到胁迫前的转录水平。相比之下,非记忆基因在S1和S3中产生相似水平的转录本(无论是重复诱导(图3.E),或减少(图3.F)对每种治疗的反应。的distribution of the maize memory genes according to their transcription patterns in S3 (Figure2A)清楚地说明修正后的[+/-]和[-/+]记忆基因转录水平的聚类更接近于其预应激(W)水平,而[+/+]和[-/-]记忆基因形成的聚类越来越远离预应激水平和S1水平。
玉米脱水胁迫响应基因在初始预施水(W)条件下、第一次暴露(S1)、浇水恢复(R2)和随后胁迫(S3)下的转录模式通过实时qRT-PCR检测。一)[+/+]记忆基因在S3中产生的转录水平高于S1:GRMZM2G179462编码一个假定的低温aba诱导的蛋白,整合到质膜上;GRMZM2G053669编码一个假定的天冬酰胺合成酶;GRMZM2G011598编码参与超敏反应的NAC结构域蛋白;B)S3中[-/-]记忆基因产生的转录本低于S1:GRMZM2G306104编码一个假定的质体基因;GRMZM2G151365编码未知蛋白;GRMZM2G303993编码假定的rna解旋酶;C)S3[+/-]记忆基因的修正反应:GRMZM2G390804编码一种功能未知的蛋白质;GRMZM2G012453编码一种假定的微管组织蛋白;GRMZM2G013170编码一种来自RPP家族的假定的抗病蛋白;D)在S1中被抑制,但在R1中恢复活性并在S3[-/+]记忆基因中保持活性的基因:GRMZM2G082830编码一个假定的膜相关激酶;GRMZM2G068519编码一种假定的黄素结合加氧酶;GRMZM2G110192是一个NCED4同族体;E)而且F)在每次脱水胁迫下,重复提供相似转录量的基因:[+/=]GRMZM2G159700而且GRMZM2G026892分别编码一个cupin超家族蛋白和一个未知蛋白。[-/=]不可训练基因GRMZM2G055973而且GRMZM2G467576编码来自RING家族的锌指蛋白。
大约3000个基因对第一次胁迫没有反应,保持在初始的胁迫前水平,但在随后的(S3)胁迫中增加或减少转录水平。这些基因标注为[=/+]和[=/-]类(包括在表中)1及附加文件3.,4,5,6)在本研究中没有进一步分析,因为我们关注的是记忆基因,根据我们的定义,记忆基因属于响应S1的基因部分。
函数分布玉米记忆基因
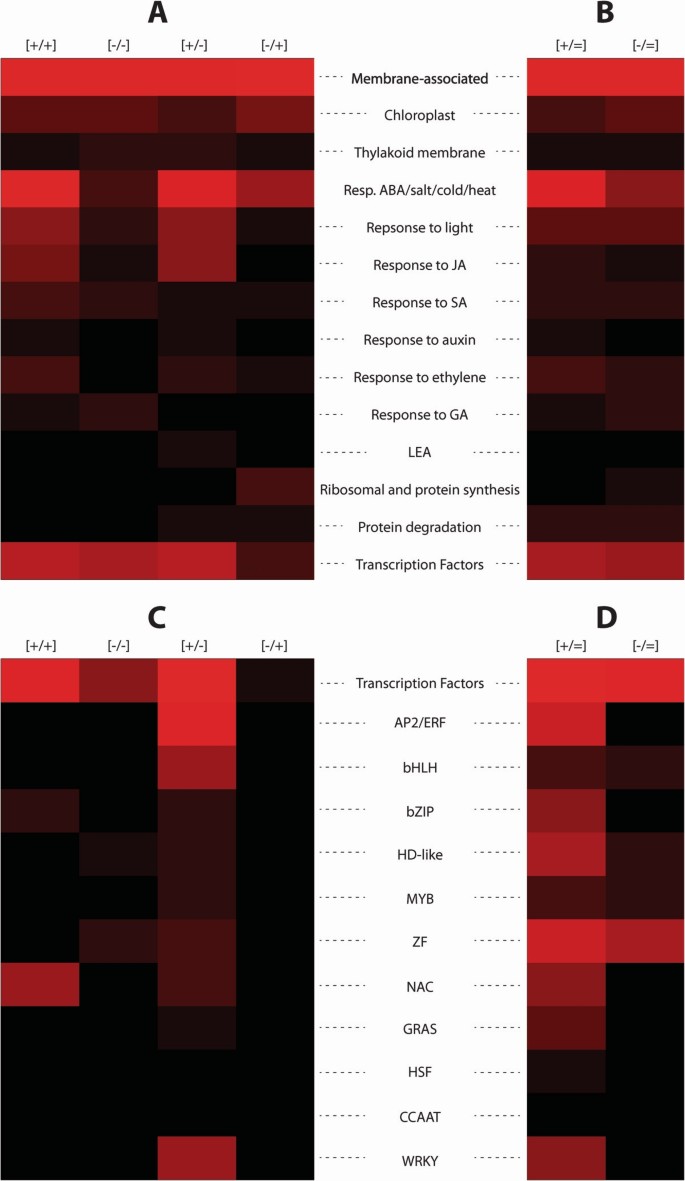
为了建立记忆响应基因编码的潜在功能,对玉米序列进行了检索答:芥。根据基因本体论(GO)分类,对记忆类别内的功能分布进行评估答:芥同源染色体。考虑到GO数据库中一些基因可能被错误地注释,我们分析了玉米记忆基因与各种膜、转录调节功能的关联,以及参与其他非生物或激素调节通路的情况。
膜相关功能
在整个脱水胁迫应答玉米转录组中显示的最大功能类别(也占每个记忆亚组中22-36%的基因)代表血浆和细胞器膜相关蛋白(表2)2;额外的文件6;数字4).在最小的[-/+]记忆类别中,膜相关功能的基因构成了最大的比例(表2)2).
然而,与类囊体膜相关的记忆基因在所有四种记忆类别中都很低(1-2%),在重复响应每种连续胁迫的非记忆基因中也是如此。值得注意的是,编码叶绿体和类囊体膜蛋白的最高数量的基因对重复的脱水胁迫有反应,但对第一次胁迫没有反应(附加文件)5而且6).
然而,尽管它们的分布明显均匀,但每种记忆类型的膜相关蛋白聚集在不同的亚群中,这些亚群因其参与的代谢过程的性质、孔蛋白通道的特异性、跨膜转移的分子类型以及在膜保护、抵抗病原体、疾病和有毒金属中的作用而不同(附加文件)6).例如,26%的[+/+]记忆基因编码膜相关的脱氢酶,用于合成保护性分子,即渗透酶,以及用于氨基酸、寡肽和碳水化合物的跨膜运输;22%的[-/-]记忆基因编码膜相关激酶、受体激酶和对光响应的信号转导器,无机磷酸盐和蔗糖的跨膜转运蛋白;36%的[-/+]记忆基因编码膜相关激酶,Ca2 +而30%的[+/-]记忆基因编码水运输,K+运输/摄取调节因子,以及涉及对各种金属、病原体和疾病抗性的广谱蛋白质(GO在记忆类型中的功能分布的完整列表见附加文件)6).
脱水应激记忆基因与其他非生物应激反应途径共享
由不同的非生物胁迫或植物激素刺激共同调节的共同基因是这些网络之间的重叠点,被认为是协调对环境因素的转录反应的中心[21- - - - - -24].脱落酸(ABA)是大量非生物胁迫响应系统的关键介质[22,25].在第一次胁迫期间,诱导了约400个涉及ABA、盐、冷、温度、光反应的玉米“相声”基因,约50个基因被抑制(附加文件)6).然而,在随后的处理中,这些s1应答基因提供了6种不同转录模式的应答。这些基因中的大多数对每种胁迫的反应相似,约有200个[+/=]和36个[-/=]非记忆基因。记忆相声基因中[+/+]基因有60个,[-/-]反应基因有5个。然而,128个修正后的响应基因(来自[+/-]和[-/+]类别)在S3中显示出与W相同的响应,实际上“取消”了与S1中触发的其他响应途径的串扰。值得注意的是,在第一次应激中转录下降的相声基因数量(46个[-/-],[-/+]和[-/=]反应基因)远远低于在第一次应激中转录水平上升的相声基因数量(397个[+/+],[+/-]和[+/=])(表2)2;数字4;额外的文件6).
脱水应激记忆基因与激素调节通路共享
脱水应激记忆反应基因与激素信号通路调控的基因重叠,尽管其数量远低于与非生物应激反应基因共享的数量(表2)2;数字4;额外的文件6).在S1中诱导的大部分共享基因都与ABA、乙烯、JA和sa反应有关,这一观察结果与干旱条件下这些途径之间的协同相互作用一致[21,26,27].茉莉酸(Jasmonate, MJ)被认为是生物胁迫反应和损伤中最重要的信号,在脱水胁迫中与ABA既合作又拮抗[28- - - - - -30.].我们的数据确定了在第一次脱水胁迫下改变表达的86个共同调节基因:79个共享基因转录增加,7个基因转录降低(表2)2;额外的文件6).然而,在随后的暴露中,这些共享的基因提供了不同的反应:32个[+/=]和6个[-/=]基因继续产生相似的转录水平,10个产生较高的[+/+]转录水平,一个产生较低的[-/-]转录水平,37个基因没有反应。后者常见的[+/-]记忆脱水/JA反应基因在第一次遭遇脱水应激时提高转录,但在第二次暴露时转录为非应激状态,因此,不提供对随后脱水应激的转录反应。在重复暴露于脱水胁迫期间,也观察到与其他植物激素共享的基因的转录模式的类似分离(表1)2;额外的文件6;数字4).
记忆基因编码转录因子(TFs)玉米
只有少数TF家族被脱水应激记忆基因所代表z梅斯,在四种记忆类别之间有强烈的偏倚分布(表2;数字4;额外的文件6): 83个玉米基因(约占玉米脱水胁迫记忆组的10%)编码的tf几乎完全由[+/+]和[+/-]记忆基因所代表,而只有9个tf基因(7个[-/-]和2个[-/+]记忆基因)在第一次胁迫反应中下调,表2;额外的文件6).大多数TF家族由每个记忆类中的一到四个基因代表,除了南汽家族TF基因,作为一个标志性的[+/+]记忆TF家族;基因来自AP2 /小块土地(Integrase-type)家族,从bHLH而且WRKY族只存在于[+/-]记忆子组中。有趣的是,[+/+]内存南汽ABA、乙烯、JA、SA和非生物胁迫应答基因为同源基因,[+/-]Integrase-type AP2 /小块土地家族记忆基因主要与ABA和乙烯通路共享,而不与JA和SA通路共享。的bHLH而且WRKY家族成员涉及对病原体、金属离子、JA和SA的反应(附加文件)6).
比较玉米而且拟南芥脱水应激反应基因
总体而言,通过RNA-seq转录组分析,共鉴定出39,635个玉米基因,其中2062个基因(约占玉米转录组的4.5%)显著改变了S1与W的转录1;额外的文件3.).相比之下,在33555个基因中发现了6597个基因答:芥(约20%的转录组)参与了第一次脱水应激反应(表1;[9])。这些数据强调了两个物种在转录水平上对第一次脱水胁迫的反应所涉及的基因数量的显著差异,图中的云的密度也说明了这一点2A和图2B。
对第一种胁迫的转录反应的其他物种特异性差异是z梅斯S1诱导基因数与下调基因数之比为4:1答:芥这些数字是可比较的(表1;[9])。对第一次胁迫反应的下调玉米基因的缺乏如图所示2答:此外,尽管与玉米脱水反应有关的基因数量较少,但显示记忆行为的816个基因几乎占全部基因的40%z梅斯在S1中,记忆基因占脱水反应的30%左右答:芥(表1).
记忆基因玉米而且拟南芥
本研究的主要目标之一是发现这两个物种的转录记忆反应是否保守。在两种植物中显示相同转录记忆的结构相关基因表明,在单子叶和总子叶脱水应激反应系统的进化过程中,记忆是守恒的。另一方面,编码相似功能的基因的不同转录反应表明记忆行为反映了物种对重复暴露于脱水应激的特定反应。
用816搜索z梅斯记忆基因对抗整个答:芥基因组序列鉴定出2,284个同源序列(高于方法中定义的阈值水平),在本文中称为拟南芥同源物。较高数量的答:芥基因同源于z梅斯记忆基因反映了一个以上的家族成员基因满足序列相似性阈值的事实(附加文件4).
近一半(1066个基因)的基因答:芥同源体在S1中转录水平没有变化,因此不属于一般的脱水应激反应片段;剩下的大约一半答:芥同源基因(662个)对脱水胁迫有反应,但缺乏记忆,而在拟南芥中也有556个是脱水胁迫记忆基因(图5一个;额外的文件6).
两种植物同源基因对重复脱水胁迫响应模式的分布。一)在拟南芥中,玉米整体记忆基因及其同源基因在较大的框架中显示。拟南芥同源基因的数量根据其对重复脱水胁迫的响应模式分布在下面的小框中。在拟南芥中,相当数量的同源体通过提供记忆或非记忆反应来应对脱水胁迫。不属于脱水反应类别的同源基因数量最多。拟南芥中与玉米记忆基因同源的基因家族成员占了较高的基因数量。B)玉米同源体在拟南芥中记忆响应类型的分布。特定记忆类别的玉米基因的数量在较大的框架内。拟南芥中对应的同源基因的数量以较小的框表示:记忆响应基因在阴影括号内(底部行);保存内存响应用绿色表示;非记忆基因和拟南芥同源基因在S1中没有反应(用=/*符号表示)在上面的括号中。一个基因家族的多个成员对脱水胁迫的反应不同,这解释了两个物种中基因总数较高的原因。
是否同源的z梅斯记忆基因表现出相似类型的记忆反应答:芥接着被调查了。的z梅斯将每个记忆类别中的基因与拟南芥中各自同源基因的反应进行比较(数据来自参考文献[9])。分析结果表明,玉米记忆基因的拟南芥同源基因表现出广泛的响应范围,包括保守性和非保守性记忆反应,但缺乏记忆或不参与第一次脱水胁迫反应的同源基因是最大的类别(图2)5B;完整的列表在附加文件7).
记忆基因z梅斯它们有相同的记忆类型行为答:芥在拟南芥中,34个[+/+],8个[-/-],8个[-/+],156个修正反应[+/-]玉米记忆基因具有同源性,在拟南芥中具有相同的转录记忆(图5B).此外,同源基因在两种物种中表现出不同转录记忆类型的记忆反应(图5B、附加文件中的完整列表7).在玉米和拟南芥中,这些基因除了作为脱水胁迫反应基因保守外,还具有对重复胁迫提供记忆反应的能力。然而,同源基因所表现出的不同记忆模式表明,在进化过程中,在转录水平上对重复应激的反应存在物种特异性的多样化。
函数分布z梅斯而且答:芥记忆基因
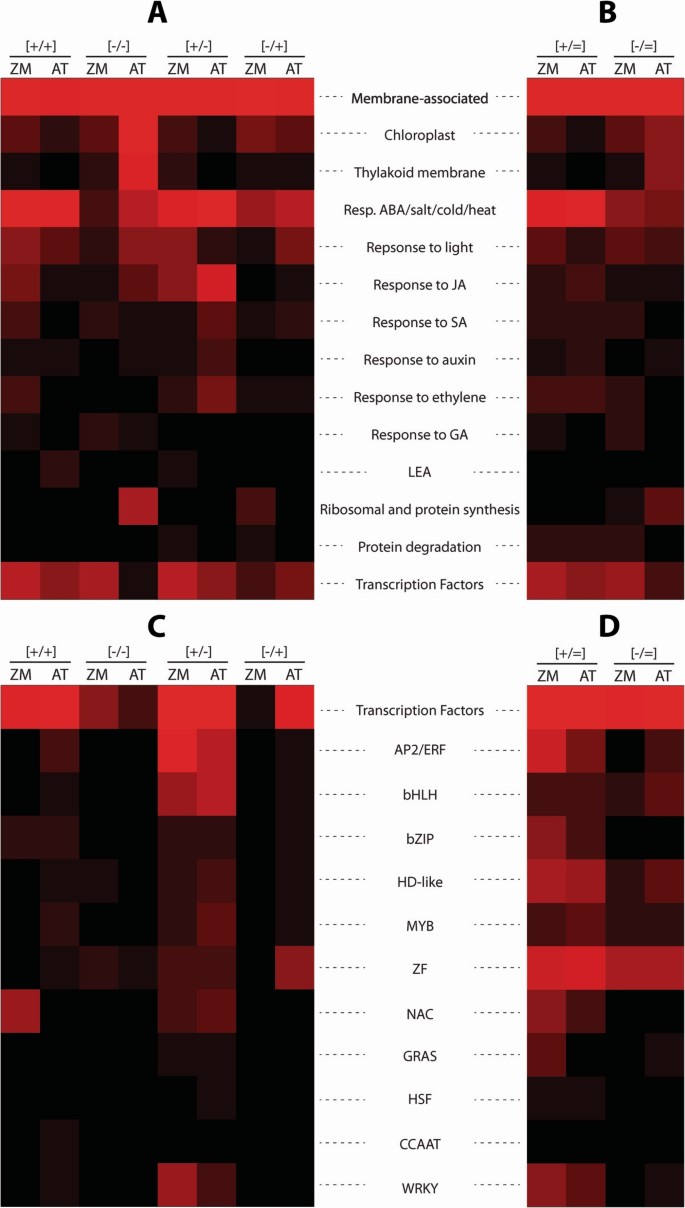
假设两种物种中结构相似的基因具有相似的细胞功能,我们基于基因本体论(GO)分类对记忆类别内的功能分布进行了比较分析答:芥同源染色体。玉米基因的数量及其每个记忆组的百分比见表2.所示的每个内存组和GO函数的百分比答:芥基因来自[9].
记忆基因编码的细胞功能在两种物种中的比较揭示了一些显著的差异。尽管在这两个物种中记忆基因编码膜结合功能的数量最多,但值得注意的是z梅斯与叶绿体和类囊体膜功能相关的蛋白质由非常少的[-/-]记忆基因编码(分别为4个叶绿体和2个类囊体膜基因),与128个形成鲜明对比答:芥[-/-]记忆基因在这些功能中的作用(表22,图6).z梅斯与非生物应激反应和核糖体组织/蛋白质合成相关的基因,也由[-/-]和[-/+]记忆基因的数量比中低得多答:芥(表2,图6).
脱水胁迫/JA共调控基因在[+/+]和[+/-]记忆基因中的种间分布(表2)2;数字6)和编码tf的记忆基因z梅斯而且答:芥也会显示出来。尽管TF编码的记忆基因比例相似(约10%),但TF家族类型及其在记忆类别中的分布是种特异性的。由于TF家族数量有限,每个家族代表1-3个基因z梅斯(表2;额外的文件7),编码NAC家族tf的[+/+]记忆基因(约占[+/+]记忆类别tf的50%)和编码Integrase-type AP2/ERF家族的[+/-]记忆基因作为该家族的独家特征脱颖而出z梅斯TF记忆基因。在玉米中仅鉴定出两个编码tf的[-/+]记忆基因(附加文件)7).
讨论
生物学相关性z梅斯脱水应激记忆基因
816个基因中的大部分转录记忆片段在z梅斯属于含有其他成员的基因家族,可能表现出不同的记忆或非记忆反应。例如,十个玉米PP2C-类磷酸酶基因在S1中被强烈诱导。然而,经过反复处理,三个基因(Grmzm2g159811, grmzm2g308615, grmzm5g818101)进一步提高转录([+/+]记忆基因),第二种处理([+/ -]记忆基因)没有诱导两种转录GRMZM2G465287, GRMZM2G342197)和5个[+/=]基因(Grmzm2g010855, grmzm2g059453, grmzm2g166297, ac208201.3_fg002, grmzm2g000603)重复制作S1水平的成绩单。由于PP2C磷酸酶在ABA介导的信号传导中至关重要[31- - - - - -33],即个体的转录反应PP2C在多次遭遇脱水压力时,重复暴露的基因可能会具体而不同地影响aba信号和其他重叠网络的行为。
据推测,脱水记忆基因的行为允许植物在重复的胁迫下调节它们的转录反应以提高存活率。编码保护功能(脱氢酶、热休克蛋白、伴侣蛋白)的[+/+]记忆基因转录物的增加,以及参与解毒、渗透物和膜保护脂质的合成的各种代谢酶的增加,与植物在逆境中采用的一般策略一致[31].此外,维持/重新调整细胞内稳态以及脱水与其他应激/激素调节途径之间的相互作用被认为是生存的关键[6,31,32].在这种情况下,考虑[-/+]和[+/-]记忆基因的生物学相关性是合乎逻辑的,因为修正的反应记忆基因编码了大量的代谢功能(附加文件)6).在S3中,[+/-]和[-/+]记忆基因可能在各种代谢过程中发挥作用,重新设置细胞代谢、光合作用和能量平衡,以适应新的条件。
调节渗透压、水分平衡和壁修饰的膜相关基因在植物的胁迫反应和环境适应中很重要[33].编码膜相关功能的基因在玉米的四种记忆类别中都有编码。重要的是,膜功能的性质在记忆类型中的分布是特定的。因此,具有保护功能的膜相关蛋白(脱氢酶)或用于渗透物合成的膜相关蛋白由[+/+]记忆基因编码(见下文),膜相关激酶、受体激酶和响应光的信号转导器,无机磷酸盐和蔗糖的跨膜转运蛋白由[-/-]和[-/+]记忆基因编码,而[+/-]记忆基因编码水运输、离子运输/摄取调节因子和与各种金属抗性有关的蛋白质。病原体和疾病(GO功能在记忆类型中的完整列表,请参阅附加文件6).
我们还注意到[+/-]记忆基因与其他非生物胁迫或激素调节通路共同调节。这些转录模式表明,这些信号通路之间的相互作用比在单一脱水胁迫下显示的复杂得多。通过改变转录,共享记忆基因可能会在随后的压力中影响串扰。因此,共享[+/+]记忆基因产生的转录本更多,[-/-]记忆基因产生的转录本更少,而修正反应记忆基因返回的转录本更接近其初始(W)水平。因此,在重复脱水压力下,脱水和其他应激反应/信号通路之间的串扰将与第一次相遇时发生的串扰不同。这种串扰也将不同于共享的非记忆[+/=],[-/=]基因的串扰,这些基因在每种压力下提供类似的相互作用(表2)2,附加文件6).这些修改后的反应可能有助于植物在承受重复脱水胁迫时节省资源[6,34].
由保守记忆基因编码的功能z梅斯而且答:芥
在两个物种中具有保守的[+/+]和[+/-]记忆行为的同源基因编码具有细胞保护功能的蛋白质和涉及代谢再调整的蛋白质:inz梅斯,[+/+]记忆基因编码脱氢蛋白GRMZM2G079440,与RAB18和XERO1相关答:芥;参与ABA代谢和信号通路的细胞色素GRMZM5G851862和GRMZM2G126505分别与CYP76C2和CYP707A3相关;脯氨酸生物合成酶(GRMZM2G028535,同源于P5CS1),解毒酶(GRMZM2G059836, GRMZM2G088396),以及参与调节各种共享应激反应通路的转录因子(根据记忆类别,所有同源物的具体功能在附加文件中7).保守的[+/-]记忆同源体涉及激素调节通路(特别是ja信号通路),编码tf(主要来自AP2/ERF家族)和不同的代谢功能(附加文件)7).拟南芥中36个同源[+/-]记忆基因的功能尚不清楚。
编码tf的记忆基因的种间分布z梅斯而且答:芥指出。尽管在两个物种中,编码TF的记忆基因比例相似(约10%),但大约一半的玉米TF记忆基因编码NAC家族成员,30%编码integrase型AP2/ERF家族成员,14%编码WRKY家族因子(表2)2;数字6C).这些家族成员在记忆基因中的表现答:芥(见表中方括号内的数字)2).揭示脱水记忆转录因子基因在依赖基因记忆行为中的作用,对于理解转录记忆调控的分子机制具有重要意义。然而,需要强调的是,即使TF直接与基因启动子结合,TF的记忆行为也不一定决定其所有目标的记忆行为。的内存模式A. thaliana MYC2基因只负责myc2依赖基因的一个特定子集的转录记忆行为,而RD22,是myc2调控的标记基因[35],在S2中显示不同于MYC2的内存响应[36].因此,TF的转录行为不能用来解释或预测其靶基因在重复胁迫下的转录行为。脱水应激基因转录记忆行为的调控机制多样化且基因特异性,即使是属于同一记忆类别的基因[37].
在一个物种中由记忆基因编码的具有类似保护/重新调整功能的同源蛋白可能由另一个物种中显示非保守反应的基因编码。例如,在拟南芥中,脂质转移蛋白(LTP2、LTP3、LTP4)和LEA蛋白(涉及保护细胞膜结构、流动性和离子平衡[34,38,39是由一些高度超诱导的[+/+]记忆基因编码的;而在玉米中,有6个LEA蛋白由[+/-]记忆基因编码,而与LTP2/3/4蛋白同源的GRMZM2G010868基因对S1胁迫没有反应;相反,玉米[+/+]记忆基因编码一个已知的冷盐反应蛋白(GRMZM2G179462),涉及ABA/非生物胁迫反应,在RCI2A家族中有四个同源基因,它们都在拟南芥中表现出非记忆(+/=)反应(表2)2;数字6;额外的文件7).
我们认为,在结构上相关的同源基因表现出非保守记忆反应,表明了物种特异性特征,反映了同源蛋白在两个物种中所起作用的分歧。因此,有7个基因参与了ja信号传导JAZ基因)和ja反应基因在玉米和拟南芥中都有保守的[+/-]记忆反应(附加文件)7).然而,重获(丙烯氧化物环化酶)JA生物合成关键基因仅在拟南芥中表现出[+/-]记忆反应;有四个重获但只有一个基因提供了弱的[+/=]非记忆反应,三个不受影响,这表明在脱水胁迫下,这两个物种与ja -通路存在不同的串音。
转录记忆的进化
高灵敏度的RNA-seq转录组分析允许识别在两个谱系中功能相似的基因,以及以物种特有方式发挥作用的基因。通过修改它们的转录反应,记忆基因很可能精细地调节保护性细胞功能的合成,修改与其他信号网络的相互作用,并在重复的脱水应激循环下重新调整生理过程。特别值得注意的是,在拟南芥中,玉米记忆基因的一些同源物表现为记忆基因,但表现出不同的转录反应模式(图5B;额外的文件7).由此可见,虽然两个物种中一些参与脱水应激反应的进化保守基因被保守为记忆基因,但它们属于不同的记忆反应范畴。这可能反映了C4单子叶植物和C3多子叶植物在重复脱水胁迫下对细胞功能的特定调节和调整。
玉米和拟南芥对多种脱水胁迫的记忆反应最显著的差异表现在[-/-]和[-/+]记忆基因上。因此,在玉米中只有8个[-/-]基因和8个[-/+]基因具有同源性,在拟南芥中具有相同的记忆反应(图5B;额外的文件7).与拟南芥中大量的叶绿体和类囊体膜[-/-]记忆基因形成鲜明对比的是,玉米中只有4个叶绿体和2个类囊体膜基因显示[-/-]记忆基因,而两个物种之间保守的[-/-]或[-/+]记忆基因中没有一个编码叶绿体/类囊体膜相关功能(表2)2;数字6;附加文件6而且7).总的来说,玉米和拟南芥同源基因的这些记忆反应表明,在经历重复脱水胁迫时,两个物种(分别具有C4和C3光合途径)的光合作用和相关代谢功能存在显著差异。
结论
本研究最重要的结果是证明单子叶植物和双子叶植物表现出脱水应激记忆,并通过相似的转录记忆模式改变它们的转录反应。RNA-Seq转录组分析允许识别两个谱系中功能相似的基因,以及以物种特有方式发挥作用的基因。这四种记忆转录模式表明,脱水应激反应基因在重复胁迫下的转录行为比单一脱水胁迫下的转录行为更为复杂,表明脱水应激记忆是多种信号通路协同反应的复杂表型。尽管有证据表明,在脱水胁迫反应基因的存在方面,两种世系之间存在保守性,但在转录反应中发现了物种特异性差异。首先,的数量z梅斯与一般(S1)脱水胁迫反应相关的基因(占玉米转录组的4.5%)显著低于拟南芥(占其转录组的20%)。第二,诱导玉米基因数与抑制玉米基因数之比为4:1答:芥这些数字具有可比性。第三而在拟南芥中,尽管涉及脱水反应的玉米基因数量比拟南芥少得多,但记忆基因在玉米中约占40%,而在拟南芥中约占30%。第四结果表明,在重复脱水胁迫条件下,两种表现转录记忆但记忆类别不同的物种中存在保守的同源基因,说明在反应系统进化过程中,记忆反应发生了特定的改变。该结果有助于我们了解植物如何应对多种脱水胁迫,并为研究单子叶和单子叶植物对水分亏缺的转录反应提供了参考平台。
参考文献
- 1.
Levitt J:植物对环境胁迫的反应。2 d版。纽约:学术出版社,1980年。
- 2.
arnholt - schmitt B:应激诱导细胞重编程。全球基因组调控的角色?植物科学进展,2004,26(1):357 - 357。10.1104 / pp.104.042531。
- 3.
杨晓明,李志强,李志强,王晓明,李志强:拟南芥干旱胁迫的分子生物学分析,揭示了干旱胁迫对拟南芥生长的影响。植物营养学报,2010,34(3):344 - 344。10.1104 / pp.110.161752。
- 4.
Bruce TJA, Matthes MC, Napier JA, Pickett JA:植物的应激“记忆”:证据和可能的机制。中国植物科学,2007,43(6):344 - 344。10.1016 / j.plantsci.2007.09.002。
- 5.
Conrath U, Beckers GJM, Flors V,加西亚-奥古斯丁P, Jakab G, Mauch F, Newman MA, Pieterse CMJ, Poinssot B, Pozo MJ, Pugin A, Schaffrath U, Ton J, Wendehenne D, Zimmerli L, Mauch- mani B:启动:准备战斗。植物与微生物相互作用,2006,19(10):1062-1071。10.1094 / mpmi - 19 - 1062。
- 6.
范胡腾,李志刚,李志刚,李志刚,李志刚。拟南芥启动蛋白诱导防御的研究进展。中国科学:自然科学,2006,26(2):357 - 357。10.1073 / pnas.0510213103。
- 7.
Ton J, D 'Alessandro M, Jourdie V, Jakab G, Karlen D, Held M, Mauch-Mani B, Turlings TCJ:空气信号启动增强玉米的直接和间接抗性。植物学报,2007,49(1):16-26。
- 8.
丁艳,吴晓明,张晓明,等:干旱胁迫对拟南芥转录应答的影响。环境科学学报,2012,30 (3):374 -
- 9.
丁艳,刘娜,Virlouvet L, Riethoven JJ, Fromm M, Avramova Z:拟南芥脱水胁迫记忆基因的四种不同类型。中国生物医学工程学报,2013,13:229-10.1186/1471-2229-13-229。
- 10.
孙晓燕,李志刚,李晓燕,李晓娟:拟南芥基因组网络分析的研究进展。生物技术学报,2011,22(2):260-270。10.1016 / j.copbio.2010.11.010。
- 11.
周明生,张春春,陈海林,李文华:用全叶绿体基因组定年单双子叶分化和核心双子叶的起源。中华生物医学杂志,2004,58(4):424-441。10.1007 / s00239 - 003 - 2564 - 9。
- 12.
脱落酸对叶片生长的控制:水力过程还是非水力过程?植物细胞环境,2010,33(4):636-647。10.1111 / j.1365-3040.2009.02091.x。
- 13.
休利特JD,克莱默PJ:阔叶植物水分亏缺的测量。原生质体,1996,57(1-4):381-391。
- 14.
刘宁,杨宜涛,刘海辉,杨广东,张恩华,郑成昌:NTZIP反义植物显示叶绿素水平降低。植物理化,2004,42(4):321-327。10.1016 / j.plaphy.2004.02.007。
- 15.
Livak KJ, Schmittgen TD:利用实时定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法,2001,25(4):402-408。10.1006 / meth.2001.1262。
- 16.
Schnable PS, Ware D, Fulton RS, Stein JC, Wei FS, Pasternak S, Liang CZ, Zhang JW, Fulton L, Graves TA, Minx P, Reily AD, Courtney L, Kruchowski SS, Tomlinson C, Strong C, Delehaunty K, Fronick C, Courtney B, Rock SM, Belter E, Du F, Kim K, Abbott RM, Cotton M, Levy A, Marchetto P, Ochoa K, Jackson SM, Gillam B,等:B73玉米基因组:复杂性、多样性和动力学科学通报,2009,26(5):528 - 528。10.1126 / science.1178534。
- 17.
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL: TopHat2:存在插入、缺失和基因融合时转录组的精确对齐。中国生物医学工程学报,2013,14 (4):R36-10.1186/gb-2013-14-4-r36。[印刷前Epub]
- 18.
崔文杰,刘志刚,王志刚,王志刚,王志刚:基于RNA-seq的基因调控差异分析。生物技术学报,2013,31(1):46—+
- 19.
Lamesch P, Berardini TZ, Li DH, Swarbreck D, Wilks C, Sasidharan R, Muller R, Dreher K, Alexander DL, Garcia-Hernandez M, Karthikeyan AS, Lee CH, Nelson WD, Ploetz L, Singh S, Wensel A, Huala E:拟南芥信息资源(TAIR):改进基因注释和新工具。中国生物医学工程,2012,40 (D1): D1202-D1210。10.1093 / nar / gkr1090。
- 20.
卡马乔C, Coulouris G, Avagyan V, Ma N, Papadopoulos J, Bealer K, Madden TL: BLAST plus:架构和应用。生物医学工程学报,2009,10:421-10.1186/1471-2105- 421。doi: 10.1186 / 1471-2105-10-421
- 21.
黄东,吴伟,Abrams SR, Cutler AJ:拟南芥干旱相关基因表达与激素和环境因子的关系。实验学报,2008,59(11):2991-3007。10.1093 / jxb / ern155。
- 22.
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D 'Angelo C, Bornberg-Bauer E, Kudla J, Harter K: AtGenExpress全球胁迫表达数据集:UV-B光、干旱和寒冷胁迫响应的协议、评估和模型数据分析。植物学报,2007,32(2):347- 353。10.1111 / j.1365 - 313 x.2007.03052.x。
- 23.
吴玉军,张海生,朱涛,王霞,Harper JF:盐胁迫、渗透胁迫和冷胁迫对拟南芥转录组的影响。植物营养学报,2002,26(4):344 - 344。10.1104 / pp.008532。
- 24.
Seki M, Ishida J, Narusaka M, Fujita M, Nanjo T, Umezawa T, Kamiya A, Nakajima M, Enju A, Sakurai T, Satou M, Akiyama K, Yamaguchi-Shinozaki K, Carninci P, Kawai J, Hayashizaki Y, Shinozaki K:利用全长cDNA微阵列监测ABA处理下约7000个拟南芥基因的表达模式。中国生物医学工程学报,2002,26(6):332 - 332。10.1007 / s10142 - 002 - 0070 - 6。
- 25.
植物低温驯化:耐冻基因及其调控机制。植物化学学报,1999,30(3):379 - 379。10.1146 / annurev.arplant.50.1.571。
- 26.
黄志刚,张志刚,张志刚:激素与气孔功能的相互作用。植物分子生物学,2009,69(4):451-462。10.1007 / s11103 - 008 - 9427 - 0。
- 27.
杨晓明,郭建明,杨晓明,杨晓明:茉莉酸甲酯和脱落酸诱导气孔关闭过程中,细胞质碱化是活性氧产生的重要因素。植物科学进展,2004,34(4):344 - 344。10.1104 / pp.103.032250。
- 28.
Adie BAT, Perez-Perez J, Perez-Perez MM, Godoy M, Sanchez-Serrano JJ, Schmelz EA, Solano R: ABA是植物抵抗影响JA生物合成和防御激活的病原体的必要信号。植物细胞学报,2007,19(5):1665-1681。10.1105 / tpc.106.048041。
- 29.
荣格C, Lyou SH》年代,金妈妈,Rhee年代,金米,李JS,彩码、畅JJ: jasmonate-responsive基因芯片筛选拟南芥.植物细胞学报,2007,26(7):1053-1063。10.1007 / s00299 - 007 - 0311 - 1。
- 30.
Munemasa S, Oda K, Watanabe-Sugimoto M, Nakamura Y, Shimoishi Y, Murata Y:拟南芥保护细胞中冠状冠素不敏感1突变揭示脱落酸和茉莉酸甲酯之间的激素信号相互作用。离子通道激活和第二信使产生的特异性损伤。中国农业科学,2007,27(3):344 - 344。10.1104 / pp.106.091298。
- 31.
Mahajan S, Tuteja N:寒冷,盐度和干旱胁迫:概述。中国生物工程学报,2005,26(2):357 - 357。10.1016 / j.abb.2005.10.018。
- 32.
De Vos M, Van Oosten VR, Van Poecke RMP, Van Pelt JA, Pozo MJ, Mueller MJ, Buchala AJ, Metraux JP, Van Loon LC, Dicke M, Pieterse CM:拟南芥在病虫害侵袭过程中的信号特征和转录组变化。植物微生物相互作用,2005,18(9):923-937。10.1094 / mpmi - 18 - 0923。
- 33.
杨文杰,李文杰,李文杰,李文杰,李文杰。干旱胁迫下植物细胞壁对水分流失的响应。中国生物医学工程学报,2008,34(2):344 - 344。10.1111 / j.1399-3054.2008.01134.x。
- 34.
Torresschumann S, Godoy JA, Pintortoro JA: Nacl诱导番茄茎中一个可能的脂质转移蛋白基因。植物分子生物学,1992,18(4):749-757。10.1007 / BF00020016。
- 35.
Shinozaki K, Yamaguchi-Shinozaki K:脱水和低温的分子响应:两种胁迫信号通路的差异和交叉。植物学报,2000,3(3):217-223。10.1016 / s1369 - 5266(00) 80068 - 0。
- 36.
刘宁,丁艳,陈志伟,陈志伟,Avramova Z:拟南芥脱水应激反应基因的转录模式与修正反应的基因特异性机制有关。核酸决议2014,4月17日。[Epub印刷前];PMID: 24744238
- 37.
刘宁,刘海燕,刘海燕,Avramova Z: H3K27me3和H3K4me3染色质环境对拟南芥超诱导脱水胁迫记忆基因的影响。分子植物学报,2014,7(3):502-513。10.1093 / mp / ssu001。
- 38.
Amara I, Odena, Oliveira E, Moreno A, Masmoudi K, Pages M, Goday A:洞察玉米LEA蛋白:从蛋白质组学到功能方法。植物生理学报,2012,32(2):329 -329。10.1093 /卡式肺囊虫肺炎/ pcr183。
- 39.
植物中的脂质转移蛋白。植物化学学报,2004,27(4):344 - 344。10.1146 / annurev.arplant.47.1.627。
确认
作者感谢Stephanie Canny女士(unl生物信息学核心研究设施)提供的数据2部分支持由NSF授予MCB-1121898给Z.A.和M.F, unl -生命科学竞赛项目给MF, ZA, J-JR和SR,内布拉斯加研究计划(NRI)给J-JR提供。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
LV、YD、NL进行实验。J-JR进行了生物信息学分析。MF和ZA构想了研究并解释了结果。所有作者都阅读并批准了最终的手稿。
电子辅助材料
完整清单
附加文件3:z梅斯基因鉴定答:芥基因作为模型。(xls 11mb)
四种记忆类型的记忆基因以及诱导和抑制的非记忆基因的转录体丰度
附加文件4:z梅斯。(xlsx2mb)
记忆基因及其同源物
附加文件7:z梅斯记忆基因及其同源物答:芥。(xls4mb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
丁勇,Virlouvet, L.,刘宁。et al。脱水应激记忆基因玉米;与拟南芥.BMC植物生物学14日,141(2014)。https://doi.org/10.1186/1471-2229-14-141
收到了:
接受:
发表:
关键字
- 基因本体论
- 相对含水量
- 转录反应
- 脱水压力
- 记忆的反应