摘要
背景
植物ALDH10酶是一种氨醛脱氢酶(AMADHs),可以氧化不同的ω-氨基或三甲胺醛,但其中只有部分酶具有甜菜碱醛脱氢酶(BADH)活性,并产生渗透保护剂甘氨酸甜菜碱(GB)。后一种酶在441位(菠菜酶编号,所以BADH),而那些不能氧化甜菜碱醛(BAL)的ALDH10s在这个位置上有异亮氨酸。只有含有A441-或c441型ALDH10同工酶的植物才能在渗透胁迫下积累GB。在这项工作中,我们探索了植物ALDH10s获得BAL特异性的进化史。
结果
我们进行了广泛的系统发育分析,并在动力学和结构上构造和表征了四个所以BADH变体,模拟从i441型到A441型或c441型酶进化途径中的吝啬中间产物。所有突变体都具有正确的折叠,平均热稳定性和与氨基丙醛相似的活性,但A441S和A441T对BAL表现出显著的活性,A441V和A441F则没有。突变体的动力学与通过建模得到的预测结构特征一致,证实了441位点对BAL特异性的重要性。BADH活性的获得可以通过这些中间产物中的任何一种发生,而不会损害原始功能或蛋白质稳定性。系统发育研究表明,这一事件在被子植物进化过程中独立发生过几次ALDH10在连续的两个单突变中,基因重复改变了Ala或Cys的关键Ile残基。ALDH10同工酶通常在植物家族中分为两个分支:一个包括过氧化物酶体I441型,另一个包括过氧化物酶体和非过氧化物酶体I441-, A441-或c441型。有趣的是,高GB蓄能体植物具有非过氧化物酶体A441-或c441型同工酶,而低GB蓄能体植物具有过氧化物酶体c441型同工酶,这表明过氧化物酶体GB合成存在一定局限性。
结论
我们的发现揭示了植物中GB合成的进化,这是一种与植物耐受干旱、高盐碱度土壤和寒冷的最具生态和生理相关性的代谢特征。总之,我们的结果与从祖先i441型AMADHs获得BADH功能的平稳进化途径一致,从而解释了该事件相对较高的发生率。
背景
渗透保护剂甘氨酸甜菜碱(GB)的合成是一种具有重要适应性的代谢特性,可以使拥有它的植物对抗由干旱、盐度或低温引起的渗透胁迫。由于这些不利的环境条件是农业生产的主要限制,在天然缺乏这种能力的作物中合成GB一直是,而且仍然是提高其对渗透胁迫耐受性的生物技术目标(在[1])。此外,人们越来越认识到食用植物的GB含量对人类和动物的营养有价值[2].
在植物中,GB由NAD形成+甜菜碱醛脱氢酶(BADHs)催化甜菜碱醛(BAL)的依赖氧化反应。在乙醛脱氢酶(ALDH)超家族中,植物badh属于家族10 [3.,其成员是ω-氨基醛脱氢酶(AMADHs)在体外能氧化具有ω伯胺基团的小醛,如3-氨基丙醛(APAL)和4-氨基丁醛(ABAL) [4- - - - - -12],一种三甲胺基,如4-三甲氨基丁醛(TMABAL) [9,12],或二甲基磺基,如3-二甲基磺酰丙醛[4,5].在活的有机体内,根据所使用底物的不同,这些酶可能参与不同的生化过程,从多胺的分解代谢到除GB外几种渗透保护剂(丙氨酸甜菜碱、4-氨基丁酸、肉碱或3-二甲基磺酰丙酸)的合成。虽然生物化学特征的植物ALDH10s氧化所有上述醛,但只有一些有效地使用BAL作为底物[9,13- - - - - -18],因此可以参与GB的合成。考虑到BAL与其他ω-氨基醛以及植物ALDH10酶之间的高度结构相似性,植物ALDH10酶之间BAL特异性的差异令人困惑。最近,通过x射线晶体学,在网上菠菜中ALDH10酶的模型构建、定点突变和动力学研究(所以BADH),我们发现只有441位的氨基酸残基对ALDH10酶能否接受或拒绝BAL作为底物至关重要[19].这种残基,位于第二球与底物相互作用的吲哚基团后面的色氨酸相当于W456中的所以BADH,决定了色氨酸残基和Tyr残基形成的口袋大小,相当于Y160和W456 (所以BADH编号),BAL的大分子三甲基胺基结合。如果这个残基是Ile,它会把Trp推到Tyr上,从而阻碍BAL的结合,而如果它是Ala或Cys, Trp会采取一种构象,为有效的BAL结合留下足够的空间[19].这一结论由Díaz-Sánchez得出et al。[19的晶体结构所以BADH (PDB代码4A0M)与两种不具有BADH活性的豌豆AMADH酶(PsAMADH1和PsAMADH2, PDB编码3IWK, 3IWJ, [12]),随后由Kopěcný证实等.[20.],他们报告了玉米ALDH10同工酶的晶体结构,其中含有相当于441位置的Cys (所以BADH编号)及显示BADH活动(Zm评选AMADH1a;PDB编码4I8P)和番茄ALDH10同工酶,该酶在该位置含有Ile,不具有BADH活性(SlAMADH1;PDB代码4I9B)。此外,通过将报告的ALDH10酶的BADH活性水平与这些残基中的任何一个相关联,Díaz-Sánchezet al。[19]预测那些在441位有一个Ile的酶(我们将在后面称之为i441型同工酶)只具有AMADH活性,而那些具有Ala或cys的酶(我们将在后面称之为A441型或c441型同工酶)也会表现出BADH活性。由于在报道的植物积累GB的能力与已证实或预测的BADH活性的ALDH10同工酶的存在之间发现了几乎完全的相关性,因此有人提出,这种同工酶的缺乏是植物中GB合成的主要限制[19].的确,一个显著的BADH活性不仅对产生显著水平的GB是必要的,而且对防止BAL的积累是必要的,BAL是在胆碱单加氧酶(CMO)氧化胆碱时形成的,达到有毒浓度。
氨基酸序列分析表明,大多数植物都有两个ALDH10同工酶,这可能是基因复制的结果,其中i441型同工酶是最常见的[19].后者的观察结果表明,这种残基与植物ALDH10家族的祖先特征相对应,并且当Ile位于相当于441的位置时,一些植物发生了功能特化所以BADH在两个复制基因中的一个突变为Ala或Cys [19].由于Ile的密码子与Ala或Cys的密码子在两个位置上不同,我们推断这些变化中的任何一个都必须通过中间产物发生。为了探索植物中GB合成的进化史,我们生成并表征了所以BADH突变体A441V, A441S, A441T和A441F,模拟了植物ALDH10同工酶途径中的四种吝啬中间产物,仅表现出AMADH活性,以A441I为例所以BADH突变体,到那些也表现出BADH活性,以野生型为例所以BADH或A441C突变体。在这项工作中,通过比较突变体与野生型酶的动力学性质和热稳定性,我们证实了441位残基的大小极大地影响了甜菜碱醛的特异性,并得出结论,新的BADH功能的获得既不损害其他氨基醛的氧化,也不损害蛋白质的稳定性。此外,我们在这里提供了强有力的系统发育证据,证实过氧化物酶体i441型同工酶对应于ALDH10的祖先形式,并且独立的复制事件发生在单子叶和真子叶植物中。事实上,a441型同工酶的变化在真子叶中最常见,而c441型同工酶的变化在单子叶中最常见。
结果
ALDH10酶的系统发育分析
我们扩展了植物ALDH10酶的氨基酸序列比对,包括在本系统发育研究中比以前的工作多三倍的序列[19,20.].检索到的非冗余序列主要属于植物(122条),但在真菌、原生生物和变形杆菌中也发现了ALDH10蛋白;动物或太古菌中无1:表S1)。数字1显示了一个未根的系统发育树,包括所有已识别的ALDH10序列(面板A),以及来自单子叶植物(面板B)和真子叶植物(面板C)的详细系统发育树。正如预期的那样,陆地植物(胚胎植物)以及种子植物(种子植物)和被子植物(开花植物)形成了一个支持良好的单系类群。在图1B .可以观察到,原始植物具有已知的基因组牛黄双球菌,发光双球菌,小微单胞菌,莱茵衣藻,卡特藻(绿藻门),Physcomitrella专利(Briophyta)和卷柏moellendorffii(石松属)只含有一种ALDH10酶。有趣的是,所有这些酶的Ile位置都相当于441 (所以BADH编号),这也是在其他植物科的ALDH10酶中最常见的残留物(图1B和1C).因此,在分析的122个非冗余植物ALDH10序列中,88个具有Ile、19个Ala和10个Cys。只有3个ALDH10同工酶葡萄,茄而且露兜树amaryllifolius-让瓦尔在这个位置,再派两名Auluropus lagopoides而且Theobroma可可——用力推。这些数据有力地支持了先前的建议[19i441型同工酶对应于ALDH10家族的祖先蛋白。
植物ALDH10酶的系统发育分析。一)无根系统发育树,包括所有已识别的ALDH10蛋白序列,显示它们所属的分类组。B)单子叶和非开花植物ALDH10序列。C)Eudicot ALDH10序列。显示存在/不存在符合一致序列(S/ a /C)-(K/R/H)-(L/M)(红色下划线部分)的过氧化物酶体靶向信号PST1,以及相当于441的氨基酸残基和密码子所以BADH。该树是使用ML方法从500个重复中推断出来的[61].给出具有最高对数似然(-32886.4851)的最佳树。采用MP法、ME法和NJ法得到了相似的树。该分析涉及131个氨基酸序列(122个来自植物,9个来自非植物)。在面板A中,未根树的分支按比例绘制,条形长度表示每个站点的替换数。在面板B而且C只显示分支拓扑。在自举测试(500个重复)中,相关类群聚集在一起的复制树的比例在分支旁边给出。bootstrap值非常低(<20%)的分支将被折叠。对于每个序列,给出了在发表的论文中分配的登录号和名称(在以前研究过的蛋白质的情况下)。X表示未知氨基酸/核苷酸。
数字1B也表明所有已知的单子叶ALDH10基因聚集在一起,说明复制的ALDH10单子叶植物的基因起源于单子叶植物分化之后。所有已知基因组的单子叶植物都有两个编码ALDH10蛋白的基因,除了玉米有三个基因。如前所述[20.],这两种基因都属于禾科(Poaceae),其中包括了大部分已知的单株植物的序列ALDH10基因在系统进化树中形成了一个不同的分支:一个(我们命名为Poaceae 1)只包含i441型同工酶,而第二个(我们命名为Poaceae 2)主要包含c441型同工酶。由于单子叶ALDH10序列数量有限,目前还不可能知道除了禾本科外,是否每个单子叶科都具有两种ALDH10同工酶。
已知基因组的eudiicots具有可变数量的编码ALDH10蛋白的基因(图1C).有些物种只有一个基因萝藦(大戟科),柑橘克莱门蒂娜(芸香料),耧斗菜coerulea(毛茛科),草莓属vesca(蔷薇科),Cucumis巨大成功(葫芦科)Mimulus guttatus(Phrymaceae) -,其他两个基因-拟南芥,天琴草,风疹芥,芸苔(十字花科),大豆,Medicago truncatula(豆科),棉,可可(锦葵科),杨树trichocarpa(杨柳科),茄属,茄属(茄科)甜菜属(苋科)-和另一种-葡萄(葡萄科)基因3。大豆,除了这两个ALDH10基因,拥有一个额外的副本,对应于假基因。所表现出的复杂分布格局ALDH10单子叶-单子叶分化后,在进化过程中发生了几次独立的基因复制事件(图1C).因此,发生在Fabaceae、Salicaceae、Solanaceae和Amaranthaceae的至少4个独立复制事件表现出很高的bootstrap支持(>90%)。在芸苔科、豆科、水杨科、蔷薇科和茄科植物中,由重复基因编码的蛋白质将Ile保存在相当于441的位置,但在苋科和棘花科植物中,这一残基被改变为Ala,锦葵科为Ala或Thr,而在唯一测序的葡萄科物种中,这一残基被改变为Val。与单子叶植物一样,在几个球花科的系统发育树中可以观察到两个不同的分支:第一种包括原来的i441型同工酶,唯一的例外是茄属植物tuberosum这个Ile突变成了Val;第二种包括来自i441型的重复i441型同工酶或A441-、V441-或t441型。有趣的是,大多数a441型同工酶都聚集在苋科2分支中,除了a441型苋属hypochondriacus,其系统发育与同一植物的i441型非常接近,这表明最近发生了复制事件。这种植物的基因组还没有完全测序,所以它可能拥有另一种a441型同工酶,与苋科2组在一起。此外,我们还不能解释a441型同工酶的意外位置用麦冬(一种单子叶植物),与苋科2支系的a441型同工酶聚在一起。由于a441型同工酶被预测具有BADH活性,即氧化BAL的能力[19),有趣的是o .对虾CMO与苋科CMO蛋白的氨基酸序列同源性也高于单子叶科CMO蛋白[21].对这种异常行为的一种可能解释是,这两个基因都是由o .对虾通过水平基因转移,这是植物基因组进化的重要力量[22,23].需要进一步的研究来提供支持或反对这种可能性的证据。
我们证实了先前的观察[19,20.]大多数i441型同工酶具有符合一致序列(S/ a)-(K/R)-(L/M/I)的过氧化物酶体靶向信号1型(PST1) [24,25而所有的a441型和大多数c441型同工酶都缺乏它(图1).就c441型而言,例外是玉米、高粱和谷子(Setaria italica),它们分别具有SKL和的信号结缕草,有一个SKI信号。过氧化物酶体靶向信号由于残基的改变或c端区域的截断而丢失。Poaceae 2的一些c441型同工酶的过氧化物酶体靶向信号中缺失Leu的密码子只需要一个时间突变就可以改变为一个停止密码子。同样的情况也发生在苋科a441型同工酶的编码基因上,其中第一个缺失Ser的密码子可以通过一个准时突变转化为一个停止密码子。苋菜科的序列分歧模式支持了这样一种观点,即在该科中,过氧化物酶体信号PST1的丢失发生在产生a441型同工酶的基因复制之前。在其他双子叶科和单子叶科中,c端截断或突变的酶聚集在系统发育支2中,这一发现进一步支持了这些酶源自过氧化物酶体i441型支1的观点。
可能的ALDH10进化中间体
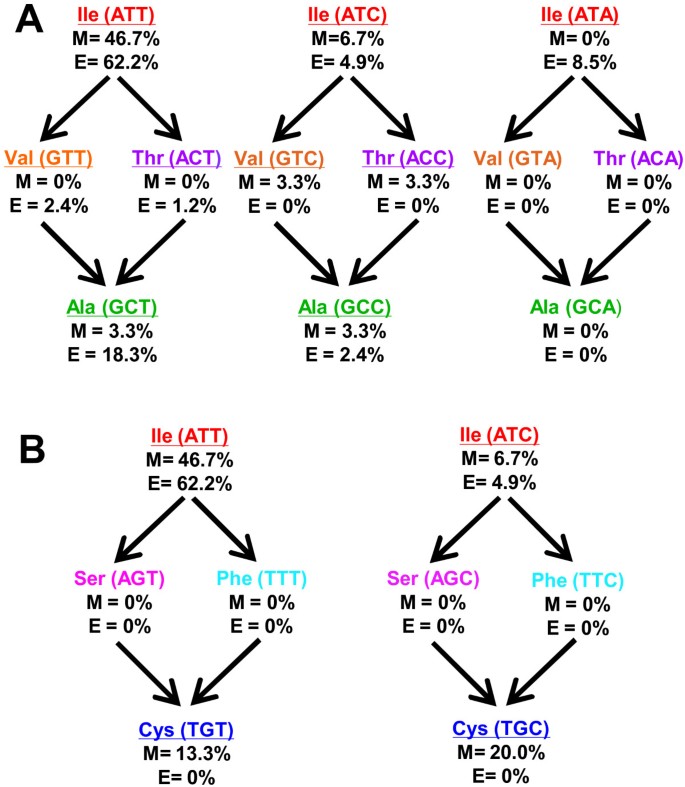
上述系统发育分析有力地支持了A441型和c441型同工酶由i441型进化而来。Ile可由ATT、ATC和ATA三个不同的三胞胎编码,其中在单子叶和双子叶中最常见ALDH10基因为ATT和最不常见的ATA,在单子叶中确实没有发现;丙氨酸由GCT、GCC、GCA和GCG四种编码,其中GCT在eudicot中使用最多ALDH10基因;半胱氨酸由TGT和TGC两种编码,均存在于单子乳中ALDH10基因。图中给出了单子子和双子子中这些密码子的观察频率2A.从这些数据中可以观察到,这个位置的ATT三元组比ATC三元组更频繁。年代ince the most parsimonious pathways from Ile to either Ala or Cys involve two nucleotide substitutions, there should have been intermediates in the evolution from the I441-type to the A441- or C441-type ALDH10 isoenzymes. Several pathways could be followed depending on the Ile codon of the original enzyme, but in all cases the amino acid substitution in the evolutive intermediate has to be either Val or Thr in the pathway from Ile to Ala, and Phe or Ser in that from Ile to Cys (Figure2B).这与已知序列的ALDH10酶在临界位置441处发现的5种不同氨基酸相一致(图1).Ile是编码频率最高的氨基酸(71.9%),其次是Ala(15.7%)、Cys(8.3%)、Val(2.5%)和Thr(1.6%)。有趣的是,在I441到C441通路中可能存在的中间产物ALDH10同工酶中含有相当于441位置的Ser或Phe,目前还未发现。由于c441型同工酶存在于单子叶中,且单子叶中可用的ALDH10序列数量(30条)与可用的eudicot序列数量(82条)相比仍然较低,当已知的单子叶ALDH10序列数量增加时,可以预期会发现缺失的中间产物。
结构和动力学表征所以BADH A441突变体
为了模拟可能的进化中间产物,我们生成了四个所以BADH变体:A441V, A441S, A441T和A441F,我们对它们进行了动力学和结构上的表征。在以前的作品中[19我们构建了A441I突变体,它代表了假定的原始ALDH10同工酶,只有AMADH活性,即没有显著的BADH活性,以及A441C突变体,它与野生型一起所以BADH,表示除了AMADH活性外也具有BADH活性的同工酶。野生型的动力学所以BADH以及A441I和A441C突变酶的突变,之前以BAL、APAL、ABAL和TMABAL为底物进行了研究[19], pH为8.0,NAD固定为0.2 mM+,这两种情况几乎都是生理上的[26,27].现在我们通过研究其他四种突变体以BAL或APAL为底物的稳态动力学来扩展这项工作。APAL可以作为其他ω-氨基醛的代表,这些ω-氨基醛没有靠近羰基的大体积的三甲基铵基团,因此它们的结合不受空间上由等同于Y160和W456的残基形成的空腔大小的限制(巴勒斯坦权力机构BADH编号)。因此,这些醛的动力学与BAL的动力学相似,但又非常不同,因为以前不仅在野生型中发现了这一点所以BADH以及A441C和A441I突变体[19].
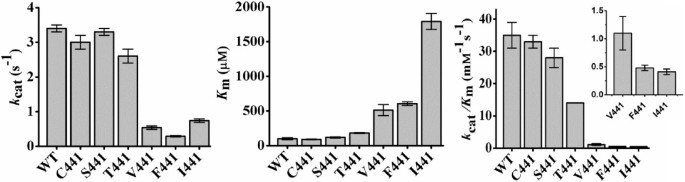
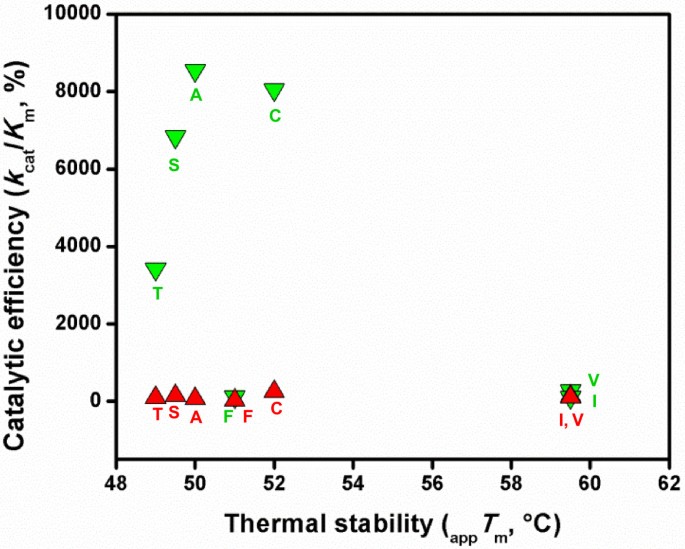
以BAL的动力学为标准,观察到两组酶:一组包括野生型和A441C、A441S和A441T突变体,其酶活性相对较高k猫、低K米(BAL)和高k猫/K米(BAL)值较低,另一个由A441V、A441F和A441I突变体形成k猫、高K米(BAL),非常低k猫/K米(BAL),尤其是A441I突变体(图3.和表1).因此,第一组中的酶具有显著的BADH活性,而第二组中的酶在预期的细胞内BAL水平下将缺乏这种活性,考虑到这种醛的已知毒性,细胞内BAL水平不应该很高[28].必须指出的是,第一组酶的BADH活性不仅是由它们小得多的酶实现的K米(BAL)值,这很可能反映了更好的醛结合,但也,虽然不是那么重要,由它们的显著较高k猫(BAL)值与第二组酶进行比较。我们还发现这两组在他们的K米(NAD+)的值,显示BADH活性的酶高于仅具有AMADH活性的酶,但A441F除外(表2)1).随着K米在双序稳态动力学机制中,第一个底物的值不仅取决于该底物结合的二阶速率常数,而且还取决于与中心三元络合物形成后的步骤相关的一阶速率常数,发现BADHs酶具有更高的速率K米(NAD+)的值高于单amadhs的值,可能是由于较高的k猫前者的价值观。
以APAL为底物比较两组酶的动力学时,两组酶之间的差异消失了2),表明441位置的残渣种类对APAL氧化影响不大。例外的是突变体A441F,其表现较低k猫/K米BAL和APAL的值均高于野生型和其他突变酶,这表明该突变体的活性位点发生了重要的结构改变。催化效率(k猫/K米)检测野生型APAL和突变体APAL所以BADH酶水平高于BAL2),因为其他A441-或c441型ALDH10同工酶除了AMADH活性外,还表现出BADH活性[7,9,20.].BAL和APAL的另一个动力学差异是APAL在野生型和突变型中产生了小而明显的底物抑制作用所以BADHs,而在研究的浓度范围内,BAL的饱和动力学中没有观察到这种抑制作用。在所有酶中观察到的高APAL浓度的抑制程度大致相同,但我们实验中使用的最高APAL浓度为0.2 mM,无法准确估计底物抑制常数K是,值,这些值在Table中没有给出2因为这个原因。如前所述[29],底物抑制源于醛与酶- nadh复合物的非生产性结合。因此,这些结果表明,酶- nadh复合物对BAL的亲和力低于APAL,生产酶- nad也是如此+复合体,作为判断K米醛的值。
结构表征所以BADH A441突变体
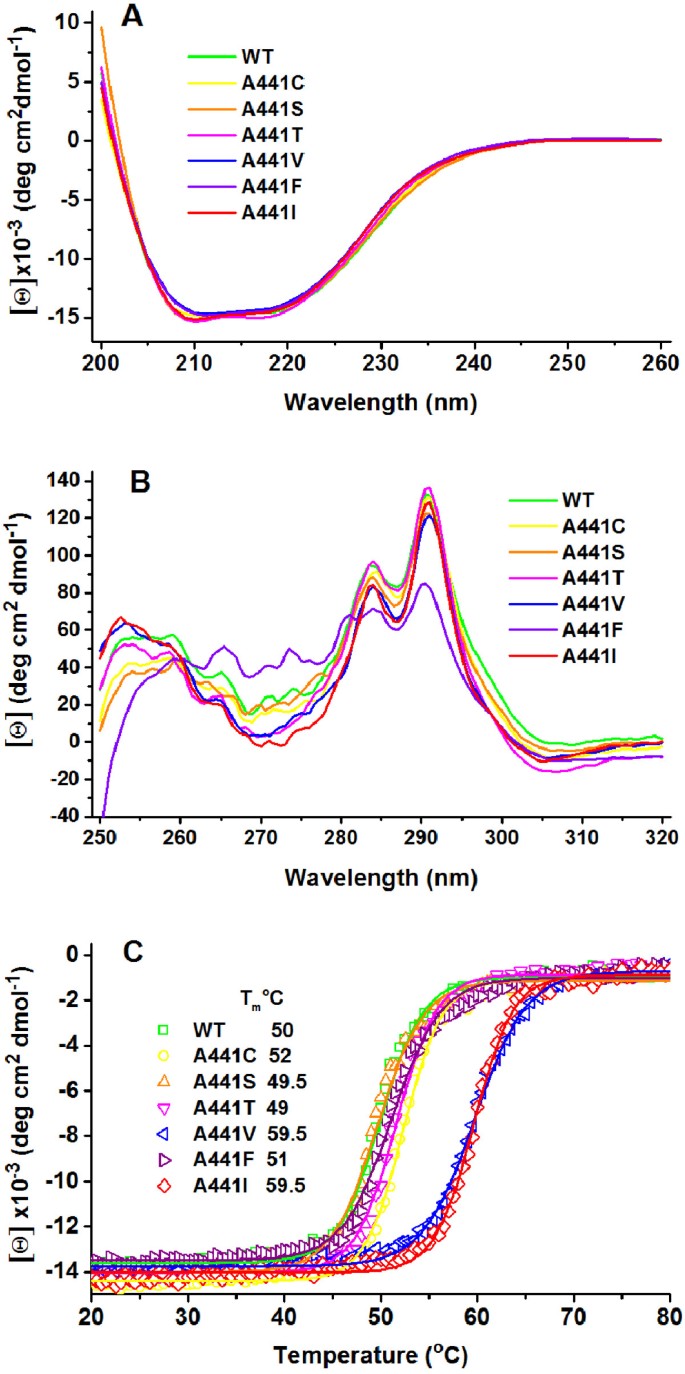
由于决定蛋白质进化的两个主要方面是功能和蛋白质稳定性,我们研究了441位的变化是否会影响突变酶的结构和/或热稳定性。第441位的氨基酸替换耐受良好,可溶性突变蛋白的表达水平与野生型酶的表达水平相似(结果未显示)。通过凝胶过滤实验(结果未显示)判断,突变既不影响酶的原生二聚态,也不影响蛋白质的二级结构,这是由它们几乎相同的远紫外CD光谱判断的(图)4A).在近紫外范围内,可以在CD光谱中检测到蛋白质三级结构的变化(图4B),其中信号来自芳香残留物。野生型的近uv - cd光谱所以BADH在284和291 nm处显示明确的阳性最大带,这是色氨酸残基的特征,在260到280 nm之间显示最小带[30.],在突变酶中也观察到。A441F是一个例外,它的近紫外CD光谱发生了改变,在284和291 nm处的峰值强度明显下降,在260到280 nm之间的波谷深度减少。这些变化可能是苯丙基环与W456相邻侧链相互作用的结果,下文将对此进行讨论。
突变体的稳定性所以BADH酶通过热变性测定,通过跟踪222nm远紫外CD信号监测。正如之前在野生型酶中发现的那样[30.],所有突变蛋白在90°C下发生不可逆变性,熔解曲线呈单相转变(图4C).所有酶热变性的不可逆性排除了该过程的平衡热力学分析。然而,使用相同的测量参数和相同的实验条件,我们可以通过比较它们的热转变中点,即它们的表观,来评估改变的氨基酸对突变酶稳定性的可能影响T米值。估计的表观T米A441C、A441S、A441T和A441F突变体的值与野生型酶的值相似,在50°C左右,但A441V和A441I突变体的值比野生型酶的值高约10°C(图4C).这些发现清楚地表明了蛋白质内部441位中体积或大体积疏水侧链的存在的稳定作用。在A441F突变体中,尽管引入的侧链是高度疏水的,并且该突变体的最小化模型表明它可能与W456的侧链发生μ-堆叠相互作用(见下文),但与A441I或A441V突变体相比,为适应Phe的大苄基环而施加在蛋白质上的应变可能导致该酶的稳定性下降。不考虑A441F突变体,有趣的是,酶的热稳定性的差异也表明存在由以BAL为底物的反应动力学参数的差异所确定的相同的两个基团。显然,这两种效应都依赖于侧链在位置441周围区域的堆积。
模型所以BADH A441突变体
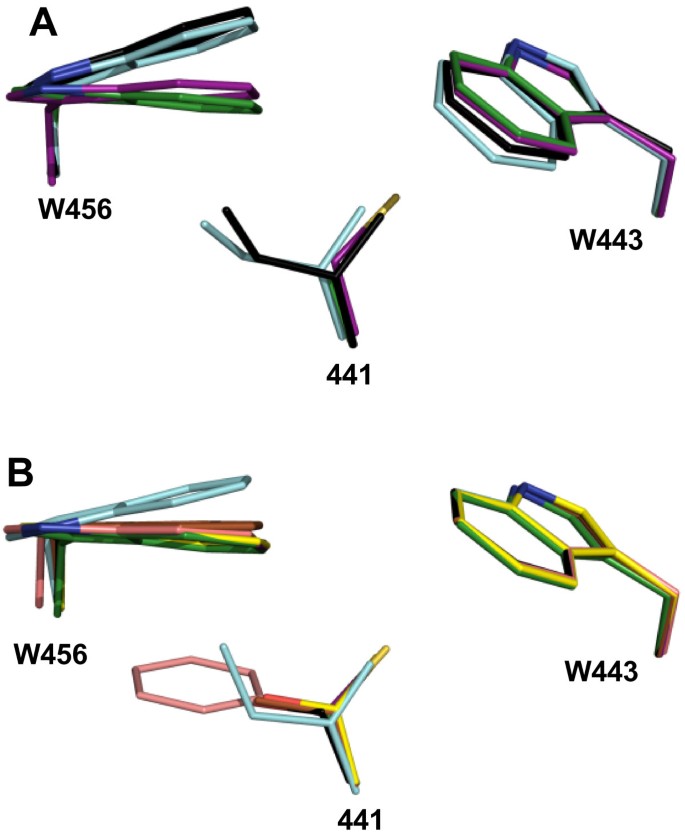
解释所观察到的动力学和稳定性性质所以BADH突变体,我们得到了估计的可能位置和接触所以BADH结构的改变使441残基得以执行在网上突变之后,突变结构的能量最小化。这些模拟的结果与已知的来自豌豆和番茄的ALDH10酶的晶体结构是一致的,它们在441号位置有Ile,而玉米在这个位置有Cys5).这支持了没有同源晶体结构的突变酶模型的有效性。当与野生型酶比较时,A441V模型,特别是A441I模型显示W456的位移与豌豆和番茄i441型同工酶晶体结构中观察到的位移相似。这种移位导致BAL的三甲基铵基团结合的腔体变窄,从而解释了这两种突变体BADH活性低的原因。相反,W456在A441C、A441S和A441T模型中的位置与野生型菠菜酶和玉米酶的位置几乎相同(图5A和B),这与这三个突变体表现出的显著BADH活性一致。
ALDH10同工酶A441区结构比较。一)441、443和456位残基侧链的叠加(所以BADH编号)在已知的植物ALDH10酶晶体结构中。侧链显示为红色的氧原子,蓝色的氮原子,黄色的硫原子。碳原子是绿色的所以BADH (PDB代码4A0M),青色PsAMADH2 (PDB代码3IWJ),洋红色Zm评选AMADH1a (PDB代码4I8P),黑色SlAMADH1 (PDB代码4I9B)。B)最小模型中相同区域的叠加在硅片中441位残基发生变化的BADH突变体。侧链显示为红色的氧原子,蓝色的氮原子,黄色的硫原子。野生型酶的碳原子是绿色的,A441C是品红的,A441S是灰色的,A441T是黄色的,A441V是棕色的,A441F是鲑鱼色的,A441I是青色的。在图中,野生型和A441T模型分别掩盖了A441C和A441S模型。图是使用PyMOL生成的(http://www.pymol.org).
在晶体结构中所以BADH, A441的侧链只与活性位点残基W456相互作用,但在其他三种植物ALDH10s的已知结构中,这个位置的残基也与W443 (所以BADH编号)(附加文件2:图S1A及表S2)。在所有已知序列的ALDH10s中,W456是高度保守的(97.5%),W443是严格保守的(100%)。W433位于单体之间的界面,在目前确定的ALDH10晶体结构中具有类似构象。模型所以BADH A441突变体显示,441位置残基侧链的接触数随着其侧链长度的增加而显著增加(附加文件)2:图S1B和表S2)。不管巯基在模拟开始时的位置如何,我们总是得到一个A441C的模型,其中巯基指向W443,如Zm评选AMADH1a晶体结构中,441位半胱氨酸残基的硫与W448的接触更紧密(相当于W443)所以BADH)比用W461(相当于用W456所以BADH)。A441S中的丝氨酸残基可以有两个不同的位置:羟基指向W443,羟基指向W456。这两种可能构象中的第一种,与Cys所采用的构象相似,不太稳定,因为这种构象中的羟基离W443的芳香环太远,无法与它发生任何相互作用。第二种构象,是附加文件中显示的模型之一2:图S1B被青睐,因为羟基与W456的环有范德华接触,可能还有极性-μ相互作用。在A441T突变体中,羟基只有一种可能的构象,即指向W456的构象,与A441S突变体模型中的Ser相似。在A441T最小化模型中,羟基氢原子到W456环芳香族面质心的距离为2.96 Å,这表明可能存在Levitt和Perutz [31].A441V中的Val侧链很适合这个位置,并与W456接触。突变体A441I中Ile的侧链与豌豆酶和番茄酶的晶体结构(PDB分别编码3IWJ和4I9B)中观察到的连接几乎相同,并类似地推动W456的侧链。最后,在突变体A441F中,容纳庞大的苄基的唯一可能方法是在W456的芳香环上堆叠。然而,A441F模型显示,在残基P455、W456和G457区域,F441环与主链发生碰撞,导致该区域移动以容纳苯丙氨酸残基,从而缩小醛入口通道(未显示)。
讨论
第441位侧链的尺寸、极性和构象的重要性所以BADH为动力学和稳定性
这项工作的所有数据都与我们之前的建议一致,即只有441位的一个氨基酸残基对ALDH10酶接受或拒绝BAL作为底物至关重要[19].i441型同工酶对BAL具有较低或极低的活性,而A441-和c441型同工酶对BAL具有较高的活性[19].的所以具有与Ala或Cys大小相似残基的BADH突变体,如A441S或A441T,对BAL具有较高的活性,但具有大量非极性残基的突变体,如A441V或A441I,对BAL具有非常低的活性(图3.).细腻的敏感所以BADH对BAL对441位残基侧链大小的亲和性反映在a的发现中K米A441T突变体的BAL值低于A441V。Val和Thr大小相似,但指向W456的Val的甲基是Thr中的一个羟基。由于氧的范德华半径比碳低0.27 Å [32],这一差异将导致W456在A441T突变体中对BAL的三甲基铵基团结合的空间位阻小于A441V突变体。此外,该模型表明T441的羟基与W456的芳香环之间的极性μ-相互作用缩短了这两个基团之间的距离,与突变体A441V相比,三甲胺结合腔变宽。虽然氧的范德华半径比硫低0.39 Å [32], A441C突变体的突变率略低,但显著降低K米(BAL)比A441S,这可以解释为它们的侧链根据模型所采用的构象不同(图5B和附加文件2:图S1B)。在A441C突变体中,与野生型酶一样,靠近W456环的原子是一个氢,而在A441S突变体中,这个氢的位置被一个更大的羟基占据。这可以解释A441C所以BADH突变体与野生型酶具有相似的BAL动力学参数。对于突变体A441F,它在这个位置引入了最粗大的侧链,让我们惊讶的是它有一个更低的K米(BAL)比突变体A441I强。这可能是由于F441的芳香环与W456的芳香环发生了叠加,使得两侧链的排列更加紧密,因此W456与A441I突变体相比,对BAL的三甲基铵基团结合的空间位阻较小。我们的模型也表明了主链的移动,以及由此导致的醛结合通道的狭窄,可以解释低水平k猫/K米(APAL)由该酶表现。综上所述,决定W456侧链位置的不仅是残基441侧链的大小,还有它所采用的构象,进而决定BAL的三甲基铵基团结合的口袋的大小和对BAL的亲和力。假设K米值是亲和性的指示,441位残基的大小似乎也会影响核苷酸的结合,尽管影响程度远小于醛的结合,但原因尚不清楚。
蛋白质对新功能的获取是有限的,因为大多数突变具有不稳定的影响,特别是如果突变的残基被埋藏的话[33],第441位的余数也是如此。然而,研究结果表明,变异的所以在441位有6个不同残基的BADH被正确折叠,并且在中温酶的预期范围内具有热稳定性,这表明该位置是高度进化的,能够适应几种突变,其中一些突变产生了新的功能:BADH活性,因此,参与渗透保护剂GB的合成的能力。A441V和A441I突变体的热稳定性高于野生型和A441C、A441S和A441T,这与Val和Ile侧链的广泛相互作用相一致,正如我们的模型和已知的在这个位置含有Ile的ALDH10酶的晶体结构所表明的那样,以及这两个残基的疏水性。在A441F突变体的情况下,与A441I或A441V突变体相比,苯丙氨酸的大苄基环施加在蛋白质上的应变可能导致该酶的稳定性下降。
植物ALDH10酶的进化
植物用来应对环境需求的策略之一是通过从旧的代谢途径中吸收酶来进化新的代谢途径。这里提出的系统发育证据表明,在被子植物中从i441型ALDH10酶进化而来的渗透保护剂甘氨酸甜菜碱(GB)的合成中表现出BADH活性的酶就是这种情况。
我们的结果表明,非开花植物只有一个ALDH10表达一种i441型酶的基因,但开花植物(单子叶和真子叶)具有不同数量的i441型酶ALDH10编码I441-、A441-或c441型同工酶的基因。在单子叶和双子叶中存在额外的基因拷贝可以用几个小的和大规模的重复来解释,这些重复伴随着基因损失和基因组重排[34].的确,在图中的系统发育树中可以看到复制的ALDH10酶的分布1与之前的观察结果一致:(i)不同的eudicot家族独立地进行了基因组复制[35,36];(ii)在单子叶谱系与真子叶谱系分化后,早在单子叶谱系中就发生了一次全基因组复制[37];(iii)玉米、大豆和葡萄最近发生了复制事件[34].复制是植物基因组结构的一个显著特征,植物多样性可能是在已有基因的复制和适应性专门化之后产生的[38].在这种情况下,复制的ALDH10在一些植物中,当I441突变为A441或C441时,该基因允许功能专一,正如Díaz-Sánchez所提出的那样et al。[19].古代酶很可能具有与现在的i441型同工酶相同的AMADH活性,但它们也可能具有残留的BADH活性,这种活性在植物进化过程中通过重复序列单突变的进化途径得到改善。通过这种方式,A441或c441型同工酶获得了额外的BADH活性,这是GB合成所必需的,而原始的过氧化物酶体i441型同工酶仍然是缺乏BADH活性的AMADHs,很可能保留了它们的代谢作用。虽然BADH活性的增加并不意味着其他AMADH活性的损失在体外([19];本工作),上述观察表明,这些同工酶的生理功能是不可互换的。事实上,在许多植物物种中,基因的复制ALDH10基因并没有导致功能冗余,因为重复的基因不仅来源于具有BADH活性的酶,而且来源于非过氧化物酶体i441型AMADH同工酶,如茄科、锦葵科、蔷薇科和芸苔科,其不同的细胞位置可能允许它们执行与过氧化物酶体不同的生理功能。这可能是编码非过氧化物酶体i441型同工酶的重复基因永久存在的原因之一。
我们的系统发育分析还表明,所有已知的植物基因组都至少包含一个ADH10编码过氧化物酶体i441型同工酶的基因,这种酶甚至存在于那些只有一个基因组测序的植物中ALDH10基因。这强调了这些过氧化物酶体i441型同工酶参与的生化过程的重要性,并表明,如上所述,在活的有机体内它们不能被获得额外BADH活性的ALDH10同工酶所取代,即A441-或c441型同工酶。总之,我们的研究结果强烈支持过氧化物酶体i441型同工酶的活性对植物是必不可少的,考虑到这些酶的AMADH活性参与了发生在过氧化物酶体中的多胺的分解代谢,这并不意外[39].如上所述,胞质i441型同工酶可能参与其他生理过程,例如通过氧化ABAL、APAL或TMABAL合成几种渗透保护剂,如4-氨基丁酸、β-丙氨酸或肉碱。ALDH10同工酶在细胞内的不同位置,根据预测和在某些情况下实验证明,表明有两种i441型-过氧化物酶体(最常见的)和胞质-,都不具有显著的BADH活性,并且可能有两种A441-和c441型-叶绿体和胞质-在第一种情况下,过氧化物酶体和胞质-,都具有BADH活性。
关于细胞内的位置,苋科a441型同工酶最有可能是叶绿体,如菠菜[40]和糖甜菜[28],尽管它们缺乏典型的叶绿体靶向信号[14].因此,在苋科中,GB的合成很可能发生在叶绿体中,正如菠菜的实验证明[13].这与CMO酶在该植物中的叶绿体位置一致[41]而且CMO活性需要还原铁还蛋白提供的电子[17]和植物铁氧化蛋白是可塑性蛋白[42].但是在具有c441型同工酶的禾本科植物中,GB的合成可能发生在细胞质中——因为这些同工酶中的一些不是过氧化物酶体,没有明确的叶绿体导信号——或者发生在过氧化物酶体中,因为其他c441型同工酶也有过氧化物酶体信号。事实上,有人认为大麦中GB的合成可能发生在过氧化物酶体中,因为在这种植物中发现了过氧化物酶体CMO [43].但这一提议与大麦c441型ALDH10同工酶已证实的非过氧化物酶体位置不一致[9],而且到目前为止还没有报道过氧化物酶体植物铁氧化蛋白。不管CMO的位置是过氧化物酶体还是非过氧化物酶体,与非过氧化物酶体的植物相比,在具有c441型过氧化物酶体同工酶的植物中,转运到胆碱或BAL的过氧化物酶体的需要似乎限制了GB的合成。这与在具有预测过氧化物酶体c441型同工酶的谷类植物(玉米、高粱和谷子)中观察到的GB积累水平远低于具有非过氧化物酶体c441型的植物(如小麦和大麦)的发现完全一致[44- - - - - -46].可以预测,其他禾科植物具有中等的GB积累能力,如狼尾草[44),黍[46],具有过氧化物酶体c441型同工酶,而高GB蓄能器,如Secale[44,46],具有非过氧化物酶体c441型同工酶。
由于渗透保护剂GB的合成能力保护植物免受最常见的环境压力,如盐度,干旱和低温,以及间接地抵抗其他压力,通常伴随着前者,如氧化应激和高温(在[47,48]),很明显,A441-或c441型同工酶的存在提供了强大的适应性优势。不仅是生长在盐碱地的盐生植物,还有可能经历间歇性缺水或低温的中生植物。这一点,再加上进化过程相对容易,解释了为什么A441-和c441型同工酶在开花植物的进化过程中独立进化了几次。然而,A441-或c441型同工酶表现出有限的系分布(图1B和1C),这与GB的积累也局限于某些双子叶科和单子叶科的发现相一致[19].这一发现进一步支持了一个重要的BADH活动对GB积累至关重要的建议[19].事实上,一个显著的BADH活性不仅对产生渗透保护剂所需的GB水平是必要的,而且对防止由cmo产生的bal积聚到有毒浓度也是必要的。但是尽管BADH活动是必要条件植物成为gb蓄能器的条件,是目前研究野生型gb蓄能器植物和转基因非蓄能器植物所获得的实验证据BADH或CMO基因(rev in [1]),表明通过进化一些植物ALDH10酶的BADH活性来获得合成GB的能力应该伴随着其他适应,例如:(i)获得显著的CMO活性;(ii)充分的细胞内靶向CMO和BADH酶;(三)通过渗透胁迫调控信号的表达CMO而且BADH基因,以及编码胆碱生物合成途径关键酶的基因;和(iv)也可能是通过胞膜高效胆碱和GB运输的发展。
植物ALDH10酶获得BADH活性的进化途径
我们的结果表明,植物ALDH10酶可能遵循了几种获得BADH活性的进化途径,特别是那些涉及Val, Thr, Ser位置相当于441的吝啬中间产物的进化途径所以BADH。携带F441的进化中间体的AMADH活性较低k猫/K米的值所以BADH A441F突变,这可能会使路径,但它的可能性较小。但是,由于经历这些突变的酶是由基因副本编码的,原始的i441型酶是保守的,即使发生Phe突变,植物也不会经历任何有害影响。但与Ala o Ser突变相比,这种突变也不会为植物提供任何优势,甚至与导致非过氧化物酶体i441型同工酶的突变相反。因此,Phe441突变可能在进化过程中被消除。有趣的是,从公共数据库检索到的植物ALDH10蛋白序列中发现了从I441到A441的吝啬途径中的中间突变体t441型(2个序列)和v441型(3个序列)的天然ALDH10s。我们预计,当更多的单子叶序列被发现时,将会发现s441型酶。a441型ALDH10同工酶相对较高的频率可能是现有报道的偏差所致,因为大多数研究都是在盐生植物中进行的,这些酶参与了它们的渗透耐受性机制。关于c441型同工酶,它们存在于谷类植物中,因其具有很高的农学价值而被广泛研究。事实上,在谷物中,可能发生了由人类指导的进化过程,以增加它们对干旱或盐胁迫的耐受性。
原Ile残基在此位置突变为Val, Thr或Ser,可以认为是中性的,因为它不会对原始AMADH功能产生任何有害影响k猫/K米(APAL)值。但是,在Val突变的情况下,所产生的酶仍然是一种缺乏显著BADH活性的AMADH,在Thr或Ser突变的情况下,酶将经历原始酶残留BADH活性的重要增加,这将使这些酶成为真正的BADH。突变酶的动力学数据表明,如果发生Ala或Cys的二次突变,t441型或s441型中间产物的BADH活性将增加。Val突变为Ala后BADH活性相同。这些增加可能具有足够的生理重要性,可以解释具有Ala或Cys第二种突变的酶的选择,这反过来可以解释,至少部分地,A441-或c441型同工酶相对于V441-、T441-或s441型的频率较高。
这些ALDH10酶的热稳定性下降,这些酶经历了突变事件,通过突变事件获得了BADH活性-正如我们的结果所表明的所以位于441位的BADH突变体在生理条件下不会损害它们的稳定性。从这些突变酶与可溶性蛋白相似的表达水平判断,折叠也不会受到影响大肠杆菌.作为一个总结,图6比较了七种催化剂的热稳定性和催化效率所以本研究研究了BADH蛋白(野生型和6个突变体),以说明在ALDH10家族中BADH活性进化的可能适应性景观。可以看出,441位Ile的变化不影响APAL为底物时的催化效率,但对BAL为底物时的催化效率影响较大。这种变化的热稳定性成本将被BADH活性的增益所超越。事实上,这可能是目前植物ALDH10s中V441型同工酶缺乏的原因,考虑到V441的I441的变化几乎对AMADH活性或蛋白质稳定性没有影响,这是相当令人惊讶的。可以推测,随后的A441突变对植物是如此有利,以至于大多数V441酶进化到了这一最后阶段。
结论
这里提出的系统发育、生化和结构证据支持在植物中获得BADH活性的相对平稳的进化过程,因此获得合成渗透保护剂GB的潜力,因为进化发生在重复的基因中,四种简约的进化中间体在功能和结构上是可行的,特别是其中三种。我们的研究结果有力地支持,在陆生植物进化过程中,编码过氧化物酶体i441型同工酶的祖先基因多次发生突变,因此,目前表现出BADH活性的A441-或c441型同工酶在ALDH10蛋白家族中没有形成单系群。我们还提供了更多的证据,证明441号位置的残留物所起的关键作用(所以BADH编号)与植物ALDH10酶对BAL的亲和力有关。最后,我们发现具有BADH活性的同工酶在细胞内位置的差异表明,GB的过氧化物酶体合成受到一些因素的限制,并解释了已知的事实,即存在高和中等GB蓄能型植物,前者具有非过氧化物酶体A441-或c441型同工酶,后者具有过氧化物酶体c441型。
方法
化学及生物化学
甜菜碱醛氯,APAL和NAD的二乙基缩醛+来自Sigma-Aldrich Química, S.A. de C.V. (Toluca, México)。如Flores和Filner所述,APAL是通过水解其二乙基缩醛形式而新鲜制备的[49].所得到的游离APAL的确切浓度在每个实验中由NADH在催化反应中完全氧化后产生的量来确定所以在过量NAD存在的BADH+.
野生型和突变型的定点诱变、生产和纯化所以BADH酶
质粒pET28-所以BADH,含有菠菜的全部序列BADH基因和一个n端his标签[19],作为模板进行定点诱变,使用Quick Change XL-II定点诱变系统(Agilent)和以下诱变引物:A441V, GAAGGCTCTAGAAGTTGGA,通过聚合酶链式反应(PCR)进行定点诱变GTTGTTTGGGTTAATTGCTCAC (forward)和TTGTGAGCAATTAACCCAAACAAC格式TCCAACTTCTAGAGCC(反向);A441S, GAAGGCTCTAGAAGTTGGA行为GTTTGGGTTAATTGCTCAC (forward)和TTGTGAGCAATTAACCCAAACAGTTCCAACTTCTAGAGCC(反向);A441T, GAAGGCTCTAGAAGTTGGAACCGTTTGGGTTAATTGCTCAC (forward)和TTGTGAGCAATTAACCCAAACGGTTCCAACTTCTAGAGCC(反向);A441F, GAAGGCTCTAGAAGTTGGA到达目标时间GTTTGGGTTAATTGCTCAC (forward)和TTGTGAGCAATTAACCCAAACAAATCCAACTTCTAGAGCC(反向);。非互补诱变密码子用斜体表示。DNA测序证实诱变。重组蛋白的表达和纯化如文献所述[19].用86,400 M的280 nm摩尔吸光度法测定蛋白质浓度-1厘米-1由Gill和von Hippel方法推导出的氨基酸序列[50].
野生型和突变型的活性测定和动力学特征所以BADH酶
野生型的稳态初速度所以采用分光光度法测定BADH及其突变体[19] pH 8.0,使用0.2 mM NAD+以及不同浓度的BAL或APAL。固定浓度的NAD+在这些实验中使用的是饱和,正如发现的非常接近k猫在实验中,核苷酸是可变底物,而醛的浓度保持不变,浓度是其十倍K米价值。所有的实验都是由添加酶开始的。每个饱和曲线至少用来自两个不同纯化批次的酶测定。初速度数据采用Michaelis-Menten方程进行非线性回归计算。方程1APAL饱和度数据,显示底物抑制:
在哪里v为实验确定的初速度,[E]为酶浓度,k猫是饱和底物下产物生成的一阶速率常数(等于最大速度,V马克斯,除以酶浓度),[S]为可变底物浓度,K米底物的浓度是最大速度的一半,和K是是底物抑制常数。尽管底物抑制所以BADH经氨基醛是部分的[19],我们实验中使用的最高底物浓度不能区分完全抑制和部分抑制,因此1用于完全抑制。
圆二色光谱
CD信号用Jasco J-715分光偏振仪(Jasco Inc., Easton, MD)记录,配备peltier型温度控制系统(型号PTC-423S)并校准d-10 - (+) -camphorsulfonic酸。分别将蛋白质浓度为0.25或1.0 mg/mL的样品分别置于路径长度为1.0 cm和0.1 cm的石英试管中,记录近紫外(250-320 nm)和远紫外(200-250 nm) CD光谱。数据采集在0.5 nm(近紫外)或1.0 nm(远紫外)间隔,带宽为1.0 nm,扫描速率为20 nm/min。对5次扫描的光谱进行平均,并减去不含蛋白质的参考样品的平均光谱。观察到的椭圆度被转换为平均残基椭圆度[Θ],基于每个残基的平均分子质量为109.1。通过以1.5°C/min的恒定速率将温度从20°C增加到90°C,跟踪在222 nm处椭圆度的变化来监测热诱导的蛋白质变性。表观测定T米数值是由非线性回归的数据拟合到一个单一的玻尔兹特曼s型函数。采用ORIGIN软件(OriginLab Corp.)进行数据分析和显示。
在网上诱变和建模
晶体结构的突变所以生成位置441的BADH (PDB代码4A0M)在网上使用Coot的标准旋转器库[51].突变体模型在UCSF Chimera中使用琥珀力场参数进行1000步能量最小化过程[52].
序列分析
ALDH10氨基酸和核苷酸序列通过Blast搜索在NCBI位点获得[53) (http://blast.ncbi.nlm.nih.gov/Blast.cgi)或Phytozome v9.1数据库([54];http://www.phytozome.net/).使用ClustalX version 2进行渐进式多氨基酸序列比对([55),http://www.clustal.org/clustal2/),以VAST算法构造的结构对齐作为指引[56]包括PDB中所有非冗余的taldh10蛋白结构[57].使用BioEdit手动校正氨基酸序列比对([58),http://www.mbio.ncsu.edu/bioedit/bioedit.html)根据缺口BLASTP结果。为了鉴别ALDH10家族成员的蛋白质序列,以前通过Julián-Sánchez进行了系统发育分析等.[59]被用作参考。系统发育分析使用MEGA5软件进行([60];http://www.megasoftware.net).四种方法用于推断系统发育关系:最大似然(ML),最大简约(MP),最小进化(ME)和邻居连接(NJ)。Whelan和Goldman描述的氨基酸替代模型[61],被选为最佳替代模型,因为它给出了最低的贝叶斯信息准则值,并修正了赤池信息准则值[62]在MEGA5 [60].gamma形状参数值(+G参数= 1.1824)由MEGA5直接从数据中估计。系统发生树内部分支的置信度采用ML法,通过自举分析(每个重复500次)确定。
缩写
- ALDH:
-
醛脱氢酶
- ABAL:
-
4-Aminobutyraldehyde
- AMADH:
-
Aminoaldehyde脱氢酶
- APAL:
-
3-Aminopropionaldehyde
- BADH:
-
甜菜碱醛脱氢酶
- 拜尔港:
-
甜菜碱醛
- 营销总监:
-
胆碱单氧酶
- GB:
-
甜菜碱
- PDB:
-
蛋白质数据库
- PsAMADH:
-
豌豆AMADH
- SlAMADH:
-
番茄AMADH
- 所以BADH:
-
菠菜BADH
- TMABAL:
-
4-Trimethylaminobutyraldehyde
- WT:
-
野生型
- Zm评选AMADH:
-
玉米AMADH。
参考文献
- 1.
陈thh, Murata N:甜菜碱保护植物免受非生物胁迫:机理及生物技术应用。植物细胞环境,2011,34(1):1-20。10.1111 / j.1365-3040.2010.02232.x。
- 2.
Craig SA:甜菜碱在人类营养中的应用。中华临床医学杂志,2004,20(3):539-549。
- 3.
Vasiliou V, Bairoch A, Tipton KF, Nebert DW:真核生物醛脱氢酶(ALDH)基因:人类多态性,以及基于分化进化和染色体定位的推荐命名法。药物遗传学,1999,9(4):421-434。
- 4.
Vojtechová M, Hanson AD, Muñoz-Clares RA:苋菜叶甜菜碱-乙醛脱氢酶有效催化nadd依赖性的二甲基磺酰丙醛氧化生成二甲基磺酰丙酸。中国生物工程学报,1997,37(1):81-88。10.1006 / abbi.1996.9731。
- 5.
Trossat C, Rathinasabapathi B, Hanson AD:转基因表达甜菜碱醛脱氢酶有效催化二甲磺酰丙醛和ω-氨基醛的氧化。中国农业科学,1997,26(4):457- 457。
- 6.
Šebela M, Brauner F, Radová A, Jacobsen S, Havliš J, Galuszka P, Peč P:均匀植物氨醛脱氢酶的表征。生物化学学报,2000,14(1):329-341。
- 7.
Livingstone JR, Maruo T, Yoshida I, Tarui Y, Hirooka K, Yamamoto Y, Tsutui N, Hirasawa E:甜菜碱醛脱氢酶的纯化及其性质燕麦属漂白亚麻纤维卷.植物保护学报,2003,26(2):344 - 344。
- 8.
黄志刚,王志刚,王志刚。甜菜碱醛脱氢酶cDNA的分离及酶学性质研究结缕草tenuifolia.植物营养学报,2005,26(3):379 - 379。10.1016 / j.jplph.2005.01.020。
- 9.
藤原T, Horia K, Ozaki K, Yokota Y, Mitsuya S, Ichiyanagi T, Hattori T, Takabe T:大麦过氧化物酶体和胞质甜菜碱醛脱氢酶的酶学表征。中国生物医学工程,2008,34(1):1 - 2。10.1111 / j.1399-3054.2008.01122.x。
- 10.
Bradbury LMT, Gillies SA, Brushett D, Waters DLE, Henry RJ:氨基醛脱氢酶失活是大米香味的原因。植物化学学报,2008,29(4):439-449。
- 11.
Brauner F, Šebela M, Snégaroff J, Peč P, Meunier J- c:豌豆幼苗氨醛脱氢酶的一级结构和活性位点残基。植物物理与生物化学,2003,41(1):1-10。10.1016 / s0981 - 9428(02) 00002 - 5。
- 12.
Tylichová M, Kopečný D, Moréra S, Briozzo P, Lenobel R, Snégaroff J, Šebela M:植物氨醛脱氢酶的结构和功能表征Pisum一对天然和合成的氨基醛具有广泛的特异性。中华分子生物学杂志,2010,396(4):870-882。10.1016 / j.jmb.2009.12.015。
- 13.
Hanson AD, May AM, Grumet R, Bode J, Jamieson GC, Rhodes D:甜菜碱在藜足科植物叶绿体中的定位。中国科学:自然科学,2005,26(2):389 - 397。10.1073 / pnas.82.11.3678。
- 14.
从菠菜叶中提取甜菜碱醛脱氢酶:纯化,在体外mRNA的翻译和盐度的调节。中国生物工程学报,1998,27(1):1 -6。10.1016 / 0003 - 9861(89) 90255 - 5。
- 15.
Arakawa K, Takabe T, Sugiyama T, Akazawa T:菠菜叶中甜菜碱-乙醛脱氢酶的纯化及其抗体的制备。中国生物工程学报,2004,27(6):489 - 497。
- 16.
Valenzuela-Soto E, Muñoz-Clares RA:甜菜碱乙醛脱氢酶的纯化及性质研究苋属hypocondriacusL.缺水。植物营养学报,2004,26(2):344 - 344。10.1016 / s0176 81678 - 0 - 1617(11)。
- 17.
Burnet M, Lafontaine PJ, Hanson AD:菠菜中胆碱单加氧酶的测定、纯化和部分特征。植物营养学报,2004,18(2):379 - 379。
- 18.
Hibino T,孟YL, Kawamitsu Y, Uehara N, Matsuda N, Tanaka Y, Ishikawa H, Baba S, Takabe T, Wada K, Ishii T, Takabe T:甜菜碱积累红树中两种甜菜碱-醛脱氢酶的分子克隆及功能鉴定矮小(Forsk)。Vierh。植物分子生物学,2001,45(3):353-363。10.1023 /: 1006497113323。
- 19.
Díaz-Sánchez AG, González-Segura L, Mújica-Jiménez C, Rudiño-Piñera E, Montiel C, Martínez-Castilla LP, Muñoz-Clares RA:参与甘氨酸甜菜碱合成的植物ALDH10同工酶对甜菜碱醛特异性的关键氨基酸残基。中国植物学报,2012,29(4):379 - 379。10.1104 / pp.112.194514。
- 20.
Kopěcný D, Konečitíková R, Tylichová M, Vigouroux A, Moskalíková H, Soural M, Ŝebela M, Moréra S:植物ALDH10科。鉴定底物特异性的关键残基并捕获硫半缩醛中间体。中国生物医学工程学报,2013,28(3):379 - 379。10.1074 / jbc.M112.443952。
- 21.
李志刚,李志刚,李志刚:甜菜碱的生物合成(滨藜属Spp .)在盐度胁迫下。生物学报,2013,68(5):879-895。10.2478 / s11756 - 013 - 0229 - 8。
- 22.
理查森·奥,帕尔默·JD:植物水平基因转移。实验学报,2007,58(1):1-9。
- 23.
Bock R: DNA的交换:植物中的水平基因转移。植物科学进展,2010,15(1):11-22。10.1016 / j.tplants.2009.10.001。
- 24.
Lingner T, Kataya AR, Antonicelli GE, Benichou A, Nilssen K, Chen X-Y, Siemsen T, Morgenstern B, Meinicke P, Reumann S:结合机器学习方法识别新型植物过酸酶体靶向信号在活的有机体内亚细胞靶向分析。植物细胞学报,2011,23(4):1556-1572。10.1105 / tpc.111.084095。
- 25.
Chowdhary G, Kataya ARA, Lingner T, Reumann S:非典型过氧化物酶体靶向信号:新型PTS1三肽的鉴定和增强子元素的计算排列分析。中国生物医学工程学报,2012,29(4):344 - 344。
- 26.
Werdan K, Heldt HW:碳酸氢盐在完整的叶绿体积累后的pH梯度。生物化学学报,2002,23(3):344 - 344。10.1016 / 0005 - 2728(72) 90260 - 5。
- 27.
Heineke D, Riens B, Grosse H, Hoferichter P, Peter U, Flugge U, Heldt HW:叶绿体包膜内氧化还原转移。植物营养学报,2001,26(4):344 - 344。10.1104 / pp.95.4.1131。
- 28.
Rathinasabapathi B, McCue KF, Gage DA, Hanson AD:甜菜碱合成的代谢工程:缺乏典型转运肽的植物甜菜碱醛脱氢酶靶向于烟草叶绿体,在那里它们使甜菜碱醛抗性。植物学报,1994,193(2):155-162。
- 29.
Vojtechová M, Rodríguez-Sotres R, Valenzuela-Soto EM, Muñoz-Clares RA:甜菜碱醛脱氢酶对叶片底物的抑制作用苋属hypochondriacus林志强,王志强。生物化学学报,1997,33(2):344 - 344。10.1016 / s0167 - 4838(97) 00059 - 9。
- 30.
Garza-Ramos G, Mújica-Jiménez C, Muñoz-Clares RA:钾和离子强度对两种乙醛脱氢酶构象和热稳定性的影响揭示了K的结构和功能作用+绑定的网站。公共科学学报,2013,8 (1):e54899-10.1371/journal.pone.0054899。
- 31.
Levitt M, Perutz MF:芳香环作为氢键受体。中华分子生物学杂志,1988,201(4):751-754。10.1016 / 0022 - 2836(88) 90471 - 8。
- 32.
阿尔瓦雷斯:范德华斯属地的地图。道尔顿学报,2013,42(24):8617-8636。10.1039 / c3dt50599e。
- 33.
Tokuriki N, Stricher F, Serrano L, Tawfik DS:蛋白质稳定性和新功能的权衡。计算机科学学报,2008,4 (2):e1000002-10.1371/journal.pcbi.1000002。
- 34.
Vande Peer Y, Fawcett JA, prost S, Sterck L, Vandepoele K:开花的世界:一个重复的故事。植物科学进展,2009,14(12):680-688。10.1016 / j.tplants.2009.09.001。
- 35.
范德培Y, Maere S, Meyer A:古代基因组复制的进化意义。植物学报,2009,10(10):725-732。10.1038 / nrg2600。
- 36.
Fawcett JA, Maere S, Van de Peer Y:具有双基因组的植物可能有更好的机会在白垩纪-第三纪灭绝事件中幸存下来。中国科学:自然科学,2009,26(3):379 - 379。10.1073 / pnas.0900906106。
- 37.
唐华,王旭,王晓华,Paterson AH:被子植物基因组比较揭示了单子叶谱系的早期多倍体。中国科学:自然科学,2010,26(2):344 - 344。10.1073 / pnas.0908007107。
- 38.
李文杰,李文杰,李文杰:植物基因复制与进化新颖性研究。植物保护学报,2009,36(3):557-564。10.1111 / j.1469-8137.2009.02923.x。
- 39.
Moschou PN, Sanmartin M, Andriopoulou AH, Rojo E, Sanchez-Serrano JJ, roubelakis angelakis KA:拟南芥多胺氧化酶的全反向转化途径。植物营养学报,2008,37(4):344 - 344。10.1104 / pp.108.123802。
- 40.
韦格尔P,韦蒂尼克EA,汉森AD:菠菜叶绿体氧化甜菜碱醛。植物营养学报,2004,27(3):344 - 344。10.1104 / pp.82.3.753。
- 41.
Brouquisse R, Weigel P, Rhodes D, Yocum CF, Hanson AD:菠菜叶绿体基质中铁氧还原蛋白依赖性胆碱单加氧酶的证据。中国植物学报,2004,19(1):322-329。10.1104 / pp.90.1.322。
- 42.
黄志强,李志强,李志强,等。植物型铁氧化蛋白及其代谢。植物细胞环境,2013,36(6):1071-1084。10.1111 / pce.12046。
- 43.
Mitsuya S, Kuwahara J, Ozaki K, Saeki E, Fujiwara T, Takabe T:大麦中一种新型过氧化物酶体胆碱单加氧酶的分离与鉴定。植物学报,2011,34(6):1215-1226。10.1007 / s00425 - 011 - 1478 - 9。
- 44.
Hitz WD, Hanson AD:用热解-气相色谱法测定谷物和草中的甘氨酸甜菜碱。植物化学,1980,19(11):2371-2374。10.1016 / s0031 - 9422 (00) 91029 - x。
- 45.
杨文杰,杨文杰,杨文杰,朱文杰,罗德斯D:玉米甜菜碱缺乏症的补充试验和代谢基础。植物营养学报,2004,19(4):319 - 319。
- 46.
Ishitani M, Arakawa K, Mizuno N, Kishitani S, Takabe T:积累甜菜碱和不积累甜菜碱的谷类植物叶片中甜菜碱醛脱氢酶的水平。植物细胞生理学杂志,1993,34(3):493-495。
- 47.
陈顺华,田田。N:甜菜碱:植物抗非生物胁迫的有效保护剂。植物科学进展,2008,13(9):499-505。10.1016 / j.tplants.2008.06.007。
- 48.
Ahmad R, Lim CJ, Kwon S-Y:甜菜碱:一种具有巨大潜力的基因聚合化合物,可以提高作物抗环境胁迫性能。植物学报,2013,7:49-57。10.1007 / s11816 - 012 - 0266 - 8。
- 49.
何志刚,李志刚,李志刚。高等植物多胺分解代谢:吡咯啉脱氢酶的表征。植物营养学报,2004,27(3):377 - 382。10.1007 / BF00117586。
- 50.
Gill SC, von Hippel PH:从氨基酸序列数据计算蛋白质消光系数。中国生物医学工程学报,2004,19(2):319-326。10.1016 / 0003 - 2697(89) 90602 - 7。
- 51.
Emsley P, Cowtan K:分子图形的模型构建工具。生物化学学报,2004,30(4):366 - 366。10.1107 / S0907444904019158。
- 52.
Pettersen EF, Goddard TD, Huang CC, Couch GS, Greenblatt DM,孟EC, Ferrin TE: UCSF chimera -一个用于探索性研究和分析的可视化系统。计算化学,2004,13:1605-1612。
- 53.
Benson DA, Clark K, Karsch-Mizrachi I, Lipman DJ, Ostell J, Sayers EW: GenBank。自然科学进展,2014,42:D32-D37。10.1093 / nar / gkt1030。
- 54.
Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N, Rokhsar DS: Phytozome:绿色植物基因组学比较平台。中国生物医学工程学报,2012,40:D1178-D1186。10.1093 / nar / gkr944。
- 55.
拉金MA, Blackshields G,布朗NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG: Clustal W和Clustal X 2.0版本。生物信息学,2007,23(21):2947-2948。10.1093 /生物信息学/ btm404。
- 56.
Madej T, Lanczycki CJ, Zhang D, Thiessen PA, Geer RC, Marchler-Bauer A, Bryant SH: MMDB和VAST+:追踪大分子配合物的结构相似性。中国生物医学工程学报,2013,42:D297-D303。
- 57.
Rose PW, Bi C, Bluhm WF, Christie CH, Dimitropoulos D, Dutta S, Green RK, Goodsell DS, Prlic A, Quesada M, Quinn GB, Ramos AG, Westbrook JD, Young J, Zardecki C, Berman HM, Bourne PE: RCSB蛋白质数据库:研究和教育的新资源。中国生物医学工程学报,2013,41:D475-D482。10.1093 / nar / gks1200。
- 58.
大厅TA: BioEdit:一个用户友好的生物序列比对编辑器和分析程序,适用于Windows 95/98/NT。化学学报,1999,41:95-98。
- 59.
Julián-Sánchez A, Riveros-Rosas H, Martínez-Castilla LP, Velasco-García R, Muñoz-Clares RA:甜菜碱醛脱氢酶的系统发育和结构关系。羰基代谢的酶学和分子生物学。编辑:Weiner H, Plapp B, Lindahl R, Maser E. 2007,西拉斐特,IN:普渡大学出版社,64-76。13
- 60.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S: MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011,28(10):2731-2739。10.1093 / molbev / msr121。
- 61.
惠兰S,戈德曼N:一个一般的经验模型的蛋白质进化源于多个蛋白质家族使用最大似然方法。分子生物学杂志,2001,18(5):691-699。10.1093 / oxfordjournals.molbev.a003851。
- 62.
Posada D, Buckley TR:系统发育中的模型选择和模型平均:Akaike信息准则和贝叶斯方法优于似然比检验。中国生物医学工程学报,2004,53(5):793-808。10.1080 / 10635150490522304。
确认
这项工作得到了联亚am - papiit向RAMC提供的IN217814赠款和向HRR提供的IN216513赠款的支持。我们感谢LP博士Martínez-Castilla(联南苏丹大学化学系)的有益讨论,感谢I. Chávez-Béjar博士(联南苏丹大学化学系)在重组突变酶测序方面的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
所有的作者都宣称他们没有竞争利益。
作者的贡献
RAMC构思、设计和协调了研究,分析了动力学和结构数据,并撰写了手稿。HRR和AJS进行了系统发育分析,解释并撰写了分析结果,并为手稿的一般性讨论和写作做出了贡献。CMJ构建并纯化突变蛋白并进行动力学实验。GGR进行了CD和热稳定性实验,并对这些数据进行了分析。LGS取得了在网上变种人,建立了他们的模型,并帮助制作人物。所有作者都阅读并批准了最终的手稿。
电子辅助材料
表S2。
附加文件2:图S1:等价于A441位置的残差的相互作用所以BADH。表S2。第441位残基侧链原子与其最近邻居的距离。(pdf 712kb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Muñoz-Clares, r.a.,里弗斯-罗萨斯,H.,加尔萨-拉莫斯,G。et al。探索植物ALDH10酶获取甜菜碱醛脱氢酶活性的进化途径:对渗透保护剂甘氨酸甜菜碱合成的启示。BMC植物生物学14日,149(2014)。https://doi.org/10.1186/1471-2229-14-149
收到了:
接受:
发表:
关键字
- Osmoprotection
- 渗透压力
- Aminoaldehyde脱氢酶
- 酶动力学
- 底物特异性
- 酶亚细胞定位
- 蛋白质的稳定性
- 蛋白质结构
- 蛋白质进化