抽象的
背景
TCP蛋白是植物特异性转录因子,已知在不同植物物种中具有广泛的功能,例如叶片发育,花对称,芽和衰老。只有少数TCP.基因已被番茄(茄属植物lycopersicum).在这里,我们举报了番茄基因组中的整个家庭成员的几种功能特征。
结果
我们已经确定了30番茄SlTCP基因,其中大部分以前从未被描述过。系统发育分析清楚地区分了SlTCP转录因子家族的两个同源类:I类和II类。II类分化为CIN-TCP亚类和CYC/TB1亚类,分别参与叶片发育和腋芽形成。采用定量PCR方法检测各成员的表达模式。几个SlTCP基因,就像SlTCP12,SlTCP15和SlTCP18在番茄果实中优先表达,表明在果实发育或成熟过程中起作用。这些基因受RIN (RIPENING INHIBITOR)、CNR (COLORLESS NON-RIPENING)和SlAP2a (APETALA2a)蛋白调控,这些蛋白是在成熟过程中起关键作用的转录因子。通过酵母单杂交实验,我们证明了RIN结合的启动子片段SlTCP12,SlTCP15和SlTCP18, CNR与SlTCP18启动子。这些数据有力地表明,这些I类SlTCP蛋白参与成熟。此外,我们证明了SlTCPs结合自己的家庭成员的启动子片段,表明它们相互调节。额外酵母单杂交研究,进行拟南芥转录因子揭示涉及乙烯信号转导途径蛋白的启动子片段的结合,有助于想法,这些SlTCP基因参与了成熟的过程。酵母双杂交数据表明,SlTCP蛋白可以形成同源二聚体和异源二聚体,表明它们共同作用,形成功能蛋白复合物,共同调控番茄的发育过程。
结论
我们进行的综合分析,如系统发育分析,表达研究,番茄TCP转录因子家族的上游调节因子和二聚化特异性为功能研究提供了揭示该家庭在番茄开发中的作用的基础。
背景
TCP蛋白,以TEOSINTE的三个第一个特征的家庭成员命名(TB)1,来自玉米,环脂亚斯(CYC)金鱼草,以及来自水稻的增殖细胞因子(PROLIFERATING CELL FACTORS, PCFs)是植物特异性转录因子,其特征是TCP结构域,该结构域包含非典型的basic-helix-loop-helix (bHLH)结构[1.].虽然最初这些转录因子参与了生长和发育的调节,但很明显,它们参与了许多过程,包括衰老、昼夜节律和激素信号传导(综述见:[2.,3.])。基于TCP域的同源性,TCP蛋白可以分为两大类,I类和II类。第一是由大米蛋白质PCF表示,并且它的许多成员都没有已知的功能为止。拟南芥基因AtTCP14已经证明可以调节拟南芥种子的胚胎生长潜能[4.]和一起AtTCP15,它调节节点长度[5.]. AtTCP20似乎在多种发育过程中发挥作用,如生长过程[6.]、茉莉酸(JA)生物合成与叶片衰老[7.].AtTCP16主要在发育梭菌中表达,其在转基因植物中的下调导致50%异常的花粉[8.].
第II类,代表为赛克和TB1,包含了大部分基因与已知功能。这赛克基因,与相关的相关Dichotoma(荻)在金鱼草是花的背甜不对称需要[9].拟南芥赛克/你同系物AtTCP1调节芸苔类固醇合成基因的表达矮人4.因此也与增长有关[10].这TB1基因影响玉米腋生分泌的命运。它可以防止下部节点处的芽的生长,并促进在较高节点处的雌性花序的形成[11]. 在拟南芥中,两个TB1,分支1(BRC1,ATTCP18.) 和BRANCHED2 (BRC2 AtTCP12)在腋芽中表达,且任一基因活性降低的突变体显示分枝增加[12].番茄原果树SLBRC1A和SLBRC1B.在番茄腋芽发芽和产卵中具有类似的功能[13].
其他例子TCP.影响植物结构的基因是CINCINATTA在里面金鱼草[14及其同系物矛尖形的(LA,SlTCP2)番茄酱[15].主导披针形番茄突变产生的是简单的小叶子,而不是通常的大叶子和复合叶子。相应的TCP.等位基因洛杉矶包含在点突变mir319.结合位点,导致对miRNA调节的敏感性降低。一个其它全长mRNA,并用推定的2个mRNA的片段mir319.指定绑定网站,SLTCP3.,SlTCP10和SlTCP24在拟南芥中也分别鉴定了它们最接近的同源物[15].拟南芥同系物,以及AtTCP2和AtTCP4(最近的同源物矛尖形的和CIN)前面已经确定为目标miRNA319通过激活标记突变体miRNA319编码下巴基因座[16],并且因此,被称为下巴思TCP.基因。在activation-taggedjawd.突变体,表现出降低的表达下巴思TCP.基因,细胞分裂的叶发育过程中差异调节被扰乱,引起负叶曲率和皱叶[17,18].MiRNA319寻靶作用AtTCP4是花瓣生长发育所必需的[19].同样的思考miRNA319在拟南芥基因调控的已显示控制JA合成和叶衰老[20.].拟南芥的研究表明CCA1徒步旅行探险(CHE)(attcp21)通过压制抑制昼夜节奏时钟规则生物钟ASSOCIATED 1(CCA1)基因[21].
拟南芥的一组同源TCPs通过对边界特异性基因的负调控,如杯形Cotelydon 1[22].唯一已知的例子TCP.影响水果发育的基因是主导阴性变体的表型AtTCP3,其中单片机较短,它们的表面皱纹[22].
与其他转录因子一样,TCP结构域的基本区域可能参与DNA结合,但缺失研究表明,保守bhlh结构域的N端和c端都是水稻PCF1识别目标位点所必需的[23].建模结合到目标DNA拟南芥TCP4二聚体表明,TCP结构域的基本区域的第一部分形成参与DNA碱相互作用和该区域的C-末端部分小α螺旋可形成α螺旋邻接基于动物的bHLH蛋白质的MyoD螺旋1.同源模建表明螺旋 - 环 - 螺旋区域是负责二聚[24].结果表明,TCP蛋白质倾向于形成具有相同类的其他的TCP蛋白[同源二聚体或异源二聚体25].
两个类的共识绑定站点序列是不同的,但是,这些序列共享的核心(GGNCCC的GTGGNCCC和GTGGNCCC的GGNCCCCC)具有严格的作用,在两个类的绑定中具有严格的作用[25].在各种细胞周期相关基因的启动子和编码核糖体蛋白的基因中发现了TCP结合元素[26].已经发现attcp20物理绑定到这些元素的合成版本,以及CIS.-有丝分裂细胞周期蛋白启动子中的元件cycb1; 1基因。有人提出,器官的生长速率和可能的形状是由积极和消极作用的TCP蛋白之间的平衡调节的,它们竞相与相同的启动子结合[27]. 后来,人们发现I类TCP蛋白与II类TCP蛋白具有拮抗作用下巴-TCP通过JA信令路径,如TCP20禁止LOX2(脂肪氧合酶2)与TCP4诱导LOX2表达式[7.].
在本手稿中,我们描述了来自番茄的30种不同的TCP编码基因的鉴定和表征(茄属植物lycopersicum).使用定量RT-PCR我们已经确定了在不同组织中的表达和果实发育期间,在果实发育和成熟过程中揭示了成员的差异表达模式。后者被证明依赖于乳渣(成熟抑制剂)等几个主要成熟调节转录因子[28]、MADS box蛋白、无色非成熟蛋白CNR、SQUAMOSA启动子结合蛋白SBP [29]和APETALA2a (SlAP2a), APETALA2/乙烯反应因子(AP2/ERF) [30.].这些熟化相关的转录因子通过乙烯和/或其信号传导的生物合成来调节成熟。
这是第一次研究揭示的TCP转录因子在肉质果实发育和成熟的关系。此外,我们还通过在酵母一个杂交测定与这些基因的启动子序列相互作用的转录因子的识别研究了它们的调节。此外,在酵母双杂交测定法,我们已经确定了容量番茄TCP蛋白以形成均聚物和异源二聚体的相互作用。的番茄家族成员与其他植物的特性比较可能揭示常见和分歧的特征,并可以提供关于番茄的功能线索TCP.基因。
结果和讨论
番茄TCP基因的鉴定与克隆
通过将番茄Unigene和BAC序列数据库从溶胶基因组学网络中挖掘,通过种族的同源搜索和随后的序列延伸,我们初始鉴定并克隆了编码推定的TCP转录因子的24个不同的番茄基因(表1.;SlTCP1-24).我们所识别的许多序列只有1个或少数代表EST在数据库中。四个基因没有代表性的EST,并直接从当时可用的基因组序列鉴定。番茄基因组序列的出版允许鉴定另外6个SlTCP基因(表1.). 在30个确定的独特基因中,2个全长mRNA序列披针形和SLTCP3.[15]和三个部分序列,以前命名SLTCP1,SLTCP2.,SLTCP3.[31],这里改名SlTCP22,SLTCP7.,SLTCP8.已分别存在于Genbank中。SLTCP7.和SLTCP9.[31后来也被点名BRC1B和BRC1A, 分别 [13].
基因组组织和系统发育分析
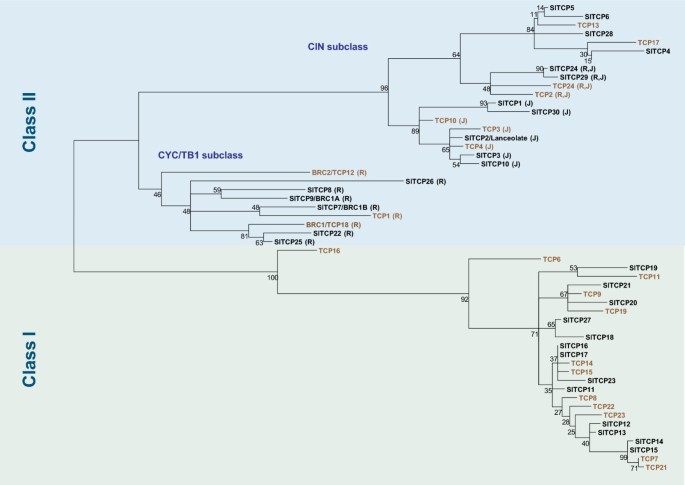
30个基因的染色体位置在附加文件中描绘1.:图S1。我们在发布的Heinz 1706基因组(v2.40)中找到了四个额外的全长副本SlTCP1(名为TCP1a-d)和每个部分复制SlTCP19 (a)和SlTCP28 (a),分别在不同的基因组位置(列于附加文件2.:表S1并在附加文件中显示1.:图S1)。额外的副本SLTCP1在他们的近距离与转座子序列具有同源性的开放阅读框架,表明它们是通过转换元素活性调动的结果。由于我们的实验确定的mRNA序列以及公共可用的EST序列唯一地映射到各种基因,而不是这些额外的副本,我们得出结论,这些副本没有在自己或其他人使用的条件下表达。通过观察植物基因组重复数据库(PGDD)基因组同步的观察进一步支持这一点[32],在哪里SLTCP1和它的基因组环境中被包含在显示用在11种植物22块不同的基因组序列的块广泛同线性的块,与所述四个拷贝(SLTCP1A-D.)与其他基因组完全不显示同线性(未显示)。同样,有一个几乎完美的拷贝(529个核苷酸中有3个错配)SlTCP28,其也与转座子样序列相关联。
与24个已知的拟南芥TCP蛋白比对,预测蛋白扩展TCP结构域的系统发育分析如图所示1..与拟南芥TCP蛋白的系统发育比较表明,两种物种的蛋白质之间的保存通常是低的。相同物种内蛋白质的较高相似性表明在两个谱系之间分裂后发生了基因重复。它还表明番茄中较多的基因数量相比拟南芥是番茄基因复制次数增多或复制后保留副本频率较高的结果。只有拟南芥AtTCP16在番茄中没有相似的同源基因。
系统发育分析表明,在大约60个氨基酸TCP结构域外的序列保温在TCP结构域的两侧的低且序列长度大大变化,导致蛋白质从113(TCP27)到409个氨基酸范围。由于与拟南芥TCP20的序列同源性远远超出止芯密码子,因此可能被帧移位突变截断的最小预测蛋白质SLTCP27。低总体保护导致相对低的引导值,表明某些分支的可靠性差。系统发育树的分析以及TCP域的对准(图2.A) 研究表明,番茄TCP蛋白可分为两个亚科,与迄今为止所有物种一样。如前所述,CYC/TB1或II类亚家族具有扩展的基本区,而I类亚家族成员具有来自TCP结构域的同源C末端,并且两个亚家族都具有内部保守但不同的环区序列[1.]. 系统发育树也支持了拟南芥和水稻在前面描述的另外两个亚科的II类蛋白质的分裂[33].根据这一划分,IIa类或CYC/TB1类含有番茄基因BRC1B(SLTCP7.),SLTCP8.,BRC1A(SLTCP9.),SlTCP22,SlTCP25,SlTCP26.从图中2.很明显,SLTCP26缺乏基本区域的保守N-末端部分,这表明该蛋白质可能无法结合DNA。
类IIB或CIN-TCP,所以以他们的同源性命名金鱼草CINCINATTA,是一组在拟南芥8个TCP蛋白参与叶生长调节(AtTCP2,-3,-4,-5,-10,-13,-17,和-24)[15,16].番茄在这个同源群中有11个蛋白,其中较早鉴定的LANCEOLATE、SlTCP1到SlTCP6、SlTCP10、-24、-28、-29和-30(图)1.).树的拓扑结构,特别是II类,进一步支持了共同分析。通过对植物基因组复制数据库(PGDD)的同源性检测发现,在CYC/ tb1亚类中,所有番茄和拟南芥的基因以及包含该亚分支的基因在基因组区域之间存在同源性披针形以及含有番茄的亚类TCP4- -5.- -6., 和 -28.这表明这些亚洲的成员源于古老的全部基因组或在拟南芥和番茄的共同祖先中的细分重复。番茄TCP24和 -29不显示在PGDD任何共线性,而其最接近的拟南芥同系物也有不同种类广泛的共线性。由于这些基因被布置为串联反向重复上8号染色体,它们可以是谱系特异性的重排即在拟南芥缺席的结果。
如拟南芥TCP1,TCP2,TCP12,TCP18和TCP24所述,这些拟南芥TCP蛋白,BRC1B(SLTCP7),SLTCP8,BRC1A(SLTCP9),SLTCP22,SLTCP24和SLTCP29的最近番茄同源物的子集包含所以-COLED TCP域的R域C末端[33].在SlTCP25和SlTCP26中也存在类似R域的序列,但保守性较差(图)2.B)。
在拟南芥中,5级IIB成员将由转型后监管miRNA319(attcp2,3,4,10,24) [15,16,18].这些拟南芥基因中与番茄最接近的同源基因是三个新基因,SLTCP1,SlTCP29,SlTCP30,和之前的鉴定SlTCP10,披针形(SlTCP2),SLTCP3.和SlTCP24, 分别 [15]),所有具有用于推定的结合位点mir319a..这表明通过冗余的miRNA调节同源调节叶片发育TCP.基因发生在番茄中。SlTCP2,-3,-10,-24,和-30在番茄叶中有相当大的表达,虽然不是完全的。数字2.C显示了这些基因的靶位点与mir319a.序列。在此前公布的降解组研究中,所有公认的成绩单mir319.这里识别的目标,但除了SlTCP30,被证明实际上在番茄水果中裂开[34].
番茄TCP基因的表达分析
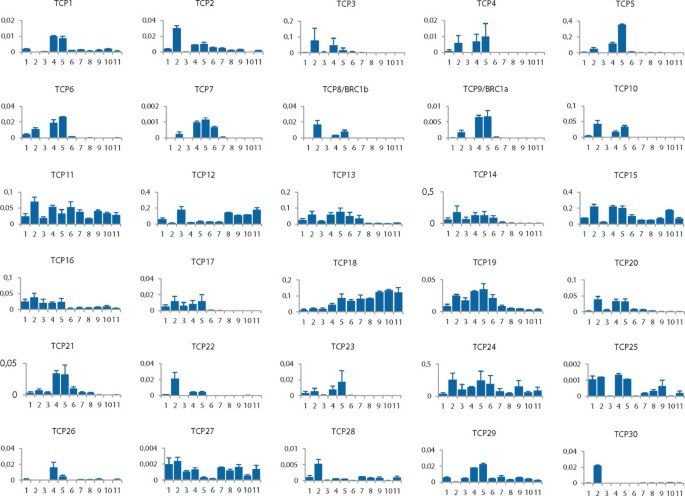
为了预测可能的功能以及通过番茄的重叠表达模式识别可能的功能冗余TCP.基因,我们通过定量RT-PCR确定的所有30个基因的表达水平。我们使用的mRNA中分离出:番茄幼苗,叶,根,花在花期,花2天时在两种尺寸(5mm直径和直径18mm时,分别地)花后(DPA),未成熟的绿色果实,成熟的绿色果实,断路器舞台水果,转向位置水果,红色成熟果实。作为与β肌动蛋白基因的表达所有表达水平(以该顺序)被示出在图的数字顺序3..从图中3.显而易见的是,在不同器官中的表达水平的番茄之间变化很大TCP.基因,以及个人的不同器官TCP.基因。II级TCP的代表主要表达高表达,在开花,2dPa和叶子。除了已经提到的器官外,SlTCP25在幼苗中显示出相对高的表达,较低的发展果实。
我们已经确定了13个蛋白质作为I级别的成员。许多级别的基因似乎更广泛且专门表达,例如在叶子,花朵和发展果实的早期阶段(图3.).SLTCP11和TCP27似乎缺乏器官特异性SlTCP12和SlTCP18是唯一在成熟过程中高表达的基因SlTCP12尤其是在成熟的绿色阶段和之后。大多数II类基因在花2 DPA期之后的果实中不表达。SlTCP15相对高度表达到5毫米的果阶段,之后表达下降并在成熟期间回来,在转动阶段中具有最高的表达。番茄果实中的表达特别令人兴趣,因为这是肉质果实物种中TCP基因表达广泛表征的第一个例子。SlTCP27成熟过程中被调节;然而它的表达在所有组织中低。SlTCP12和SlTCP18由于它们在果实成熟过程中表达特别有趣。表达模式SlTCP12与它最相近的同系物是惊人的互补吗SlTCP13,可能指向通过表达模式的发散的基因复制后的新功能化的一个例子。与向上调节相反SlTCP12熟化,SlTCP13,-14期间,-15和-19显示出高表达高达5mm的果实阶段,随后是急剧下降和SlTCP15在成熟过程中被再次表达。监管SLTCP12,-15和 -18在成熟的开始期间,可能具有可能在非肉质拟南芥中的功能性意义。
番茄TCP蛋白的相互作用
TCP蛋白倾向于形成与其他TCP蛋白的同偶氮或异二聚体,并且可以对其DNA结合活性进行二聚化,从而才能获得其生物活性。我们在酵母2-杂交测定中确定了24个克隆的番茄SLTCP蛋白之间的二聚体形成。开放阅读框架被克隆为具有酵母加仑转录因子结合 - (BD-)或激活 - (AD-)结构域的翻译融合,并且在矩阵设置中测试所有组合。结果在图中示意性地表示4.,其中所述的蛋白质根据它们的系统发育相关布置,且相互作用评分表可以在其他文件中找到3.:表S2。在测试的24种BD融合蛋白中,5种在酵母中具有自激活活性(图中用星号突出显示)4.)在两个选择媒体上,而四个在-lth介质上仅显示了自动激活。除了SLTCP12之外,发现这些是所有二级TCP转录因子,也是拟南芥TCP转录因子的过度陈述[7.].因此,无法对相应的BD克隆不评分交互(图中的空行)4.)或只能在-LTA中。我们总共观察了92种交互作用,在两种选择性介质上都有一些例外。其中,34个(17对)配合物在BD/ ad两种取向中相互作用,包括6个同源二聚体形成。后一个数字可能是一个低估,因为同型二聚体形成无法测试在自动激活家族成员。对相互作用结果的总结表明,番茄TCP蛋白既可以形成同源二聚体,也可以形成异源二聚体,后者优先与同类蛋白形成(77种相互作用),这一点之前在拟南芥中已经提到[35[尽管检测到几(15)次阶级的级别相互作用。SLTCP12显示在一个介质上的自动激活活动,仅与其最近的同源单位SLTCP13相比,只有SLTCP6和SLTCP21重叠和五种不同的交互,这不是自动激活的。与不同的表达模式一起,这指向基因重复后的功能性分歧。再次类似于拟南芥TCP蛋白,发现II类蛋白质的蛋白质的更多相互作用(42与33),尽管此外,由于自动激活成员,II类蛋白的相互作用的数量可以低估。番茄TCP转录因子的综合酵母双杂交筛网获得的相互作用尚未向其他物种的TCP成员的程度报告,而不是拟南芥。番茄TCP基因的这些酵母2杂交相互作用证实了稻米的早期观察[23,25,表明TCP蛋白形成同型二聚体和异型二聚体,特别是同类蛋白。表达分析和二聚化特性的结合可能在未来有助于识别共同作用的TCP蛋白对,并在相互作用图重叠的情况下解释观察到的功能冗余。
番茄TCP蛋白在酵母双杂交测定中的相互作用。bd -fusion列在左边。TCP蛋白质名称按照它们的子类排序(分别是高亮的绿色、浅绿色和深绿色)。bd -融合显示自激活,用星号标记。仅在-LTA介质上得分的交互作用显示为蓝色。在两个方向上(BD/AD和AD/BD)的相互作用被描述为黑色或深蓝色,单向相互作用分别用灰色和浅蓝色表示。酵母2杂交实验的评分表可在附加文件中找到3.:表S2。
番茄的表达TCP12.,TCP15和TCP18基因受主要成熟调节基因突变的影响
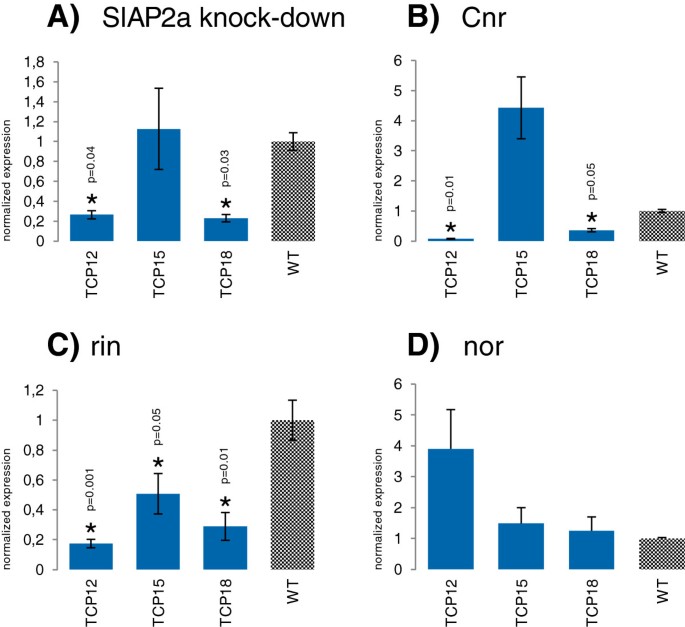
我们展示了这一点SlTCP12, 和 -18在果实成熟期间表现出差异表达,具有SlTCP12高度表达在成熟阶段和SlTCP18逐渐从早期表达到红成熟水果。SlTCP15表达在开花,2dPa和5mm果实中的花朵高,这是与高有丝分子指数率相关的阶段[36[然后在成熟期间再次调节,在断路器阶段达到峰值。这些TCP的表达模式表明它们可能通过成熟,因此可以通过该过程的一些已知的主要调节剂直接或间接地或间接地调节。我们确定了这些的表达TCP.通过QRT-PCR分析进行QRT-PCR分析,在番茄成熟缺陷突变体的BR + 7(断路器后7天)的果实中进行CNR(无色非熟)[37],rin(成熟抑制剂)[38],也不是[39]和转基因SlAP2a可拆卸的植物(40].正如预期的那样,SL的转录水平TCP12,SlTCP15和SlTCP18在几个成熟突变体进行调节(图5.A.5.B5.C)。SlTCP12,与成熟有关,受到显著的正向调节Slap2a,Cnr.和RIN(图5.A.5.B5.c),而表达SlTCP15,早期果实发育有关,是不是统计上显著的调节SlAP2a和北卡罗来纳州(图5.A.5.B). RIN正、显著调节SlTCP15(图5.C)。SlTCP18,它在果实发育的各个阶段表达,具有高增长催熟期间,显著下调的SlAP2aRNAi,CNR.和凛(图5.A.5.B5.C)。三个TCP不会显着受到监管也不突变体(图5.D) 。积极调节SlTCP12和SlTCP18经过北卡罗来纳州,SlAP2a和RIN,表示它们可能与成熟有关。此外,RIN积极调节SlTCP15也与成熟过程有关。
归一化的表达SlTCP12,SlTCP15和SlTCP18在番茄果实破碎+ 7期。与野生型相关的每个基因的表达值归一化,表示为2-ΔδCt.A..与成熟缺陷的转基因植物的RNAi抑制SlAP2a。T.-test p-value: 0.04 (SlTCP12),0.81(SlTCP15),及0.03(SlTCP18).B.在成熟缺陷突变体中CNR.,p值:0.01(SlTCP12), 0.19 (SlTCP15),及0.05 (SlTCP18).C.在成熟缺陷突变体中凛,p值:0.001(SlTCP12),0.05(SlTCP15)和0.01(SlTCP18).D.在成熟缺陷突变体中也不, p-值:0.3 (SlTCP12), 0.5 (SlTCP15)和0.7(SlTCP18).用星号表示差异显著(p≤0.05)。
熟化相关的番茄转录因子蛋白结合SlTCP12,-15和 -18启动子元件
的表达改变SLTCP12,-15和 -18在成熟突变体和SlAP2a转基因敲除植物表明它们受关键成熟调控基因的调控,但不表明这种调控是否是直接的。为了找出这些转录因子是否可以直接与启动子相互作用SLTCP12,SLTCP15和SlTCP18,我们使用酵母单杂交分析鉴定与成熟相关基因启动子片段结合的转录因子SlTCP基因。所使用的启动子元件位于转录起始位点的上游,如下所示:568 bp的启动子片段SlTCP12,500-bp片段SlTCP15和473-bp片段SlTCP18.在该测定中,我们检测到成熟调节器rin与启动子之间的相互作用SLTCP12,-15和 -18以及CNR和启动子之间TCP18(表2.).这种数据强烈表明了这些规定安全和rin和北卡罗来纳州是直接的。
在规范的情况下SlTCP检测到通过成熟调节转录因子的表达,但没有观察到对目标启动子的结合,可能是其他一些情况。测定中使用的启动子片段的长度是有限的,并且可能没有包含所有推定的转录因子结合位点。或者,表达调节可以通过调节结合靶促进剂的其他转录因子的表达来间接。
拟南芥转录因子结合启动子片段SlTCP12,SlTCP15和SlTCP18
为了识别番茄的更多的潜在监管SlTCP12,SlTCP15和SlTCP18,我们进行酵母单杂交测定与融合到GAL4激活结构域的转录因子。由于没有大量克隆的番茄转录因子,因此我们选择最初测试Arabidopsis转录因子的可用Regia收集,由1397个克隆的转录因子基因开放阅读框架组成[41].与一个或多个启动子片段的相互作用的所有转录因子在其他文件中列出的4.:表S3。这些结果表明了SlTCP12- -15和 -18启动子片段与115,99和86不同的拟南芥转录因子分别相互作用。九拟南芥转录因子结合所有三个发起人SlTCP基因(附加文件4.:表S3)。其中之一是乙烯应答基因AtDEAR1(DREB及EAR基序蛋白1),也命名CEJ1(协同诱导监管下乙烯和茉莉酸1).在拟南芥中,亲爱的通过病原体感染诱导表达[42].
对于常见的相互作用SlTCP15和SlTCP18除了Atdear1 / CeJ1蛋白外,启动子片段是九个。SlTCP12和SlTCP15分享其他11间常见的相互作用。SlTCP12和SlTCP18共有32个共同的相互作用,其中1个编码ERF/AP2转录因子家族DREB亚家族a -2的一个成员,另一个乙烯应答基因。事实上SlTCP12和SlTCP18与...相比有更常见的互动SlTCP12和SlTCP15或SlTCP18和SlTCP15,可能是由于它们在成熟期间的表达重叠。
该实验表明,有很多拟南芥转录因子结合启动子元素SlTCP12、-15和-18.是否相同的趋势可与番茄转录的转录因子中观察到可被进一步研究。在没有克隆番茄转录因子的综合库,我们推测,同样会番茄黄素观察。在拟南芥最近的研究表明,许多结合位点可以通过转录因子没有他们不一定是绑定的启动子的活性调节剂被占用,以动态的方式[43].我们进行基因Onthology(GO-)转录因子长期富集分析结合到三个的SlTCP启动子与测试1379拟南芥来自REGIA收集的转录因子。结果没有显示每GO类别的显著富集,表明这些TCP可能参与或受许多不同过程的调控。
一些拟南芥蛋白质结合SlTCP12启动子片段是已知是乙烯信号转导途径的一部分的转录因子。这些包括A.小块土地/ AP2编码转录因子基因与AP2 3相关(RAP2.3),来自ERF(乙烯反应转录因子)家族的其他基因,以及ETHYLENE-INSENSITIVE3-LIKE 2 (EIL2).几个AP2 / ERF蛋白也结合SlTCP12,SlTCP15和SlTCP18独立(附加文件4.:表S3)。规定SlTCP乙烯响应基因的基因可能表示这些乙烯依赖性表达的间接机制SLTCPS.在成熟。
番茄转录因子与之结合SlTCP12,-15和-18启动子元素
使用观察到的与拟南芥转录因子的相互作用导致来自番茄的候选调节因子,我们选择了一些最强的相互作用蛋白,并通过爆炸同源搜查鉴定了他们最近的番茄同源物。随后克隆这些并如上所述在酵母单杂交测定中使用。使用的番茄基因列于表中3.其次是它们的拟南芥同系物,以及它们与番茄TCP启动子的相互作用。
rapidopsis dear1,也命名为cej1绑定了启动子片段SlTCP12- -15和 -18(附加文件4.:表S3)及其鉴定的番茄同源物溶液互动与SlTCP12和SlTCP18发起人(表3.).Let12是拟南芥KNAT4和KNAT5的番茄同源物,它与之结合SlTCP12和 -15和SlTCP12和 -18分别启动子片段。然而,番茄同源物LeT12只与SlTCP12推动者(表格3.).Let12.[44是二类诺克斯基因(Solyc07g007120.2),在所有组织中均有表达,但在绿色水果和叶子中有高表达[45].
拟南芥SVP(短期营养阶段)绑定SlTCP18启动子片段。SVP的番茄同源物,无缝(J)与两者都结合SlTCP12和SlTCP18启动子片段(表3.).在拟南芥中,SVP.控制开花时间并在早期的花卉公司阶段保持共和文活动[46],而在番茄J调节分生组织花序的花梗离区形成和维持[47].
TCP转录因子结合启动子SlTCP12,SlTCP15和SlTCP18
对拟南芥TF收集和番茄启动子片段进行的蛋白质-DNA相互作用分析表明,存在拟南芥TCPs与番茄启动子片段结合TCP12.- -15和 -18(附加文件4:表S3)。AtTCP6和-13绑定SlTCP18启动子,而ATTCP1,-3,-4,-8和-19则绑定SlTCP15启动子。这SlTCP12启动子没有表现出任何结合活性拟南芥TCP转录因子。
在酵母单杂交测定中,我们还筛选了番茄TCP蛋白的启动子结合活性。该实验显示结合SlTCP12- -15和 -18由这件事拟南芥TCP转录因子与大多数番茄SlTCP同源物也存在。SlTCP1、-6、-9是类II TCP tf,绑定类ISlTCP12推动者(表格2.).这些蛋白质在鲜花和早期果实开发中的表达,相反SlTCP12,从成熟的绿色果实,在根系中。这些互补表达模式表明II类TCPS的结合抑制SlTCP12表达。有趣的是,SlTCP11,I类TCP在所有组织和调控最接近同源SlTCP12,也绑定到SlTCP12推动者(表格2.).
SlTCPs绑定SlTCP15启动子为SlTCP1、-9和-22,属于II类tcp1,在花的开花期和2 DPA中表达强烈,在叶中表达强烈2.).类I也绑定SlTCP15启动子。其中之一是SlTCP18,其表达在成熟期间增加(表2.).SlTCP15表现出不同的监管趋势,受到自己班级的更多代表的监管。通常,来自I类和II TCPS结合的蛋白质SlTCP15用鲜花,早期果实开发和叶子表达,这与表达相适合SlTCP15.因此,我们可以推测,这个结合导致激活的表达SlTCP15. 监管SlTCP15通过SLTCP18可以与成熟相关,因为两种基因在断路器期间具有更高的表达和果实阶段。
SlTCP18启动子只受到I类SLTCP的约束,哪些表达模式与之互补SlTCP18(表2.).这表明这些I类SLTCP可以调节SlTCP18以消极的方式。
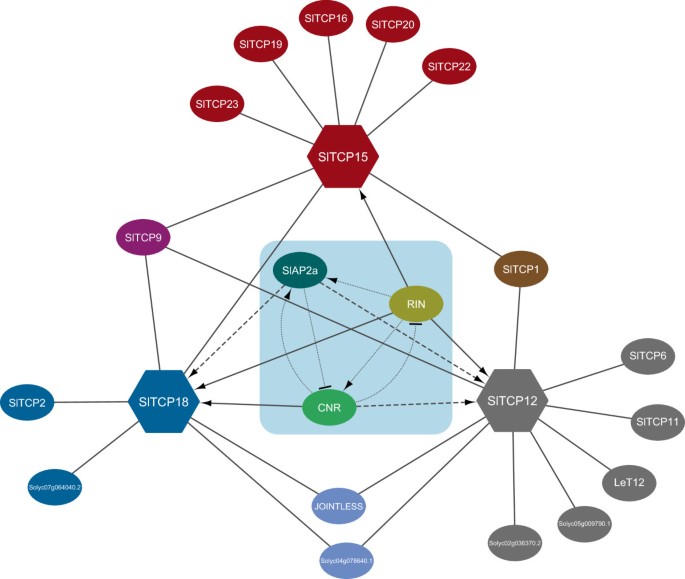
TCP转录因子与SlTCP12、-15和-18子元素表明,技术合作项目规范自己的家庭其他成员的表达。这种监管网络图可视化6..它还表明SLTCPS来自II级规范SLTCPS.从I类,并从类SlTCPs我调节SLTCPS.同一类。这中间交叉调整SlTCP基因表明,II类SlTCPs可能作为I类的抑制子,但另一方面,I类可能激活来自它们自己的类的基因,就像这可能的情况一样SlTCP15.因此,番茄TCP.基因是一个相互联系的调控网络的可能一部分,已经为描述TCP.基因在拟南芥[7.].由于这些调控性相互作用,从酵母单杂交测定结果,它们是易于产生假阳性,进一步推断体内和/或在足底需要实验来确认这些相互作用。
结论
总之,我们已经确定了番茄的30个成员国TCP.转录因子基因家族。与拟南芥密切相关的番茄基因TCP.基因,有相似的表达模式,这表明保守的功能。此外,番茄TCP蛋白形成同型二聚体和异型二聚体,特别是同一类的SlTCPs(图4.).这种趋势在其他物种之前报道,如拟南芥[35[米[25].SLTCP19是一个例外,因为它是I类SLTCP,仅用II类SLTCPS(SLTCP1和SLTCP2)二均化。有趣的是,番茄TCP12, TCP15和TCP18在肉质果实发育和成熟过程中,基因表现出不同的表达模式。表达研究表明SlTCP12- -15和 -18被这些TCP基因的启动子结合蛋白中的成熟调控因子RIN、CNR和SlAP2a正调控(图6.).这些数据表明SlTCP12- -15和 -18基因直接或间接地由这些成熟的调节器控制,并且可能在番茄果实成熟中发挥作用。此外,我们表明SLTCP蛋白可以与其他的启动子序列结合SlTCP基因(图6.),这表明它们可能协同或竞争调节它们的表达。我们的启动子和蛋白质 - 蛋白质相互作用研究表明,SlTCP12- -15和 -18,除了果实成熟之外,还可以参与各种其他功能。进一步的研究分析了SLTCP12,-15或-18的敲除或击倒的表型,将揭示关于这些基因的功能的更多信息。
方法
植物材料
茄属植物lycopersicum'MoneyMaker'被用作植物材料的来源。幼苗在琼脂培养上生长21天。对于根的收集,沿着Whattman滤纸生长幼苗,并用0.5 ms培养基喂28天。对于其他样品,植物在温室中生长,收获以下组织或器官:完全膨胀的叶片,开花在开花后两天,连续5毫米的果实,直径为5毫米,呈现为18毫米的果实,成熟的果实。果子,在断路器阶段,在转动阶段和果子的果子在红色成熟阶段的果子。用IKA A11Basic(德国Staufen),植物材料在液氮中冷冻并研磨。将材料储存在-80℃直至进一步使用。
TCP序列识别和克隆
为了鉴定拟拟合TCP转录因子的番茄基因,使用拟南芥TCP蛋白或拟南芥TCP蛋白的TBlastn算法搜索溶素痤疮基因组网络(SGN)基因组网络(SGN)-Unigene数据库(FORSESTS)以及由国际番茄排序项目沉积的BAC序列。TCP域作为查询序列。For thus identified unigenes, EST clones, when available, were obtained from the Boyce Thompson Institute for Plant Research at Cornell University (Ithaca, New York) and resequenced to confirm identity and to establish the presence or absence of 5’ and 3’ ends of an open reading frame. Where either one or both open reading frame ends were not present or where no EST was available, mRNA sequence was extended by 5’ and/or 3’ RACE, as was done for three partial cDNA sequences deposited earlier in GenBank (AAO45726, AAO45727, AAO45728 [31]). 三个假定的TCP.在BAC序列中发现的基因序列仅,基因组DNA序列被作为模板用于RACE引物的设计。为了这个目的,分离RNA的7个发育阶段(7天至授粉红熟后)番茄果实的果皮。的mRNA是使用RNAeasy试剂植物MINIKIT(50)(QIAGEN)分离。所有RNA的是等量混合在一起。5'和3’ RACE-准备cDNA文库,从RNA使用Clontech公司SMART RACE cDNA扩增试剂盒(Westburg B.V.,Leusden,荷兰)制成。全长开放阅读框通过PCR使用的EST(含有完整ORF时)扩增,5’ 和3’ RACE克隆,或基因组DNA。基因组DNA从使用较早描述的方法[叶中分离48].所有测序和开放阅读帧放大模板以及用于种族PCR和开放阅读框PCR的引物在附加文件中列出2.:表S4和S5。开放阅读框的引物使用具有5’ 延伸CACC扩增,并使用QIAquick PCR纯化试剂盒纯化,或从使用QIAquick凝胶提取试剂盒(Qiagen)进行凝胶和网关之间连接att.l1和att.使用Invitrogen pENTR的pENTR/D-TOPO中的L2位点™ 定向TOPO®克隆套件(http://www.lifetechnologies.com),生成网关入口向量。连接产物转化为蛋白质大肠杆菌DH5α感受态细胞通过电穿孔。所有进入克隆通过测序分析(测序的BigDye试剂盒,Applied Biosystems)上进行检查。(DYEnamic ET终止子(Dett)循环测序试剂盒来自Amersham Biosciences,GE Healthcare)上。第一标识24个SlTCPs的信使RNA序列已经下表列出登录号保藏在GenBank中1..
系统发育分析
将番茄TCP蛋白序列与全部24均进行比较答:芥TCP蛋白。用肌肉进行多个序列对齐[49在MEGA v5.10中实现[50].是由新泽西州(邻接)方法[获得系统重建51]使用具有站点之间的伽玛分布率(5种)的琼斯泰勒顿(JTT)替代模型用500次重复自举分析在一起。
基因表达分析
根据制造商的议定书使用破灭试剂(Roche Diagnostics,Indianapolis),进行总RNA的提取。根据方案,用DNA酶I(Invitrogen,Breda,荷兰)进行DNA酶处理。RNEasy柱(Qiagen,Venlo,荷兰)用于纯化RNA。使用Nanodrop ND-1000分光光度计(Nanodrop Technologies,USA)进行定量和定性浓度测量。
为了测定转录物浓度,在两个生物学复制中进行定量实时RT-PCR。简而言之,使用Taqman逆转录试剂盒(Roche Molecular System,Brenchburg,USA),使用1μg的总RNA用于cDNA合成。使用灯塔设计师(Biosoft International,Palo Alto,USA)设计了底漆,并从Biolegio(Nijmegen,荷兰)购买。使用以下程序在MyIQ单色实时PCR检测系统(Bio-Rad,Veenendaal,荷兰)中进行实时PCR:94°C的3分钟变性,40个循环为15秒,在94°C在60℃下30秒,然后是熔融曲线梯度,以分析特定基因的引物对的特异性。没有基于在11种番茄组织中观察到的最小变体的基因作为坯料和β-actin的模板对照。对于成熟的突变体,CNR.,凛,也不,以及击倒SlAP2a,RNA from Breaker + 7 was isolated using an InviTrap® Spin Plant RNA Mini Kit (http://www.invitek.de). 在凝胶上检查RNA质量,并使用TaqMan®反转录试剂(Invitrogen)合成cDNA™) 用1μg RNA。使用SYBR绿色荧光染料对BIORAD iQ5进行qRT PCR。所使用的程序如前所述,用于TCPs qRT PCR。
使用的引物对的序列中的其他文件中列出的2.:表S6。CT在杜普洛测量并平均化后的11个样品的 - 值,然后通过使用2的相对基因表达的计算-δCt表达的方法SlTCP番茄不同器官的转录本和2-ΔΔct方法[52用于表达SLTCPS.在成熟突变体中。使用LinRegPCR程序对反应效率进行分析[53].
酵母双杂化测定
所有TCP ORF都从入口克隆重组到pBDGAL4诱饵载体(pDEST)中™32,Invitrogen)和pADGAL4捕食载体(pDEST™22,Invitrogen)。将诱饵载体转化到酵母菌株PJ69-4α中(垫α)和所有猎物载体转化为菌株PJ69-4A(垫a[54])分别在缺乏Leu和Trp的SD平板上选择。随后,从每个转化子的单个菌落在选择性SD培养基中培养过夜培养物(30°C,300 rpm),并通过在SD完整培养板(Nunc Omnitary;VWR国际,阿姆斯特丹,荷兰)含有所有必需氨基酸。此外,还发现了一些阴性对照组合,使用水代替诱饵或猎物培养。随后,将平板在30°C下培养16小时,然后将酵母转移到缺乏Leu和Trp的SD平板上,以选择含有两种质粒的二倍体酵母。在30°C下生长2 d后,将酵母转移到四个不同的选择板上,其中含有缺乏Leu、Trp和Ade(-LTA)的SD培养基和缺乏Leu、Trp和His(-LTH)的SD培养基,并分别补充5、10或15 mM 3-氨基-1,2,4-三唑(3-at)。在缺乏相互作用的猎物蛋白质的情况下,通过在缺乏Leu和His的SD上电镀,并添加浓度不断增加的3-AT,对诱饵克隆进行自动激活试验。对于后续的相互作用实验,仅对选择性培养基(如有)上的生长进行评分,其中未出现自动激活克隆的生长。这些培养皿在20°C下培养,并在5天后对酵母的生长以及蛋白质-蛋白质相互作用事件进行评分。筛选分三次进行。在两种蛋白质中的一种的自动激活的情况下,仅获得特定组合的四个数据点。交配效率似乎为100%,如果用水交配,而不是诱饵培养或猎物培养,则在选择存在两种质粒的培养基上或在选择相互作用的培养基上均未获得生长。这表明,后续程序不会导致交叉污染。当组合在至少四分之三的实验中导致两个选择标记(腺嘌呤或组氨酸)中的至少一个生长时,被认为是真正的相互作用。在呈现结果时,仅在一种选择性培养基上生长的组合被标记为这样。
酵母单杂交测定
拟南芥转录因子与单个番茄TCP12、TCP15和TCP18蛋白之间的dna -蛋白相互作用被鉴定和表征。http://www.clontech.com.).该系统使用抗生素Aurebasidin作为记者的阻力。PJ69-4A酵母菌菌株用于TCP12,-15和-18启动子报告器构建体的转录因子诱饵和PJ69-α。单个启动子片段被克隆到Pabai报道载体中,该报告载体是兼容网关的。用于启动子元素克隆的引物可以在附加文件中看到2.:表S7。TCP12的报告构建组成568-BP(区域SL1.03SC00008:1785048..1785615),TCP15 - 500-BP(区域SL2.31C04133:30626689..30627956)和TCP18 - 473-BP(区域SL1)。03SC01076:4199969..4200441)。对于每个启动子片段,用Aurebasidin进行自身激活试验,浓度范围为0-500ng / ml。对于每个记者,在浓度为75ng / ml Aurebasidin A时进行Y1H筛选,这是检测到的最低背景激活。生长酵母克隆并选择在30℃下在选择性培养基上存在2至3d的质粒。转录因子诱饵和TCP记者克隆在SD完全培养基上进行过夜,然后转移到诱饵/报告选择培养基上3天。将介质选择的配合酵母转移至100μl无菌的毫水分水,并发现5μl液滴在含阿氟巴哌啶的板上。将板在20℃温育,并在5至7天后均均均进行。
用于酵母单杂交筛选的转录因子(TFs)文库(REGIA TF ORF文库)包含一组拟南芥转录因子开放阅读框(ORF)[41].在蛋白质- DNA结合鉴定后,发现拟南芥转录因子与番茄TCP蛋白启动子紧密结合,并被鉴定为候选基因。番茄候选转录因子的选择是基于它们最近的拟南芥同源物,并在SOL基因组网络数据库中进行蛋白质-核苷酸blast搜索。选择并克隆了部分在果实发育和成熟过程中表达的番茄候选基因(基于EST和Unigene的表达数据)和结合最强的拟南芥转录因子的番茄同源物(附加文件)4.:表S3)。
在酵母单杂交屏幕中使用的番茄候选TF的克隆
在PCR™8 / GW / TOPO载体(Invitrogen)中,扩增单个番茄候选TFS的ORF和独立克隆。通过测序分析来控制所有进入克隆,然后将其重组到PADGAL4载体(PDEST™22,Invitrogen)中并转化为PJ69-4A酵母菌株[55].总之,40番茄开放阅读框克隆(附加文件2.:表S5和S8)。与番茄TFs进行酵母单杂交试验,共3个重复。
网络数据集成,分析和可视化
cytoscape v3.0.2 [56用于生成酵母 - 一个混合交互的网络,并用于集成表达数据SlTCP12- -15和 -18在成熟的突变体中CNR.,凛和SlAP2a可拆卸的植物。默认设置使用嵌套网络样式。
Bingo 2.8 Cytoscape的插件[57]进行氧化石墨烯term富集分析。在寻找超额代表时,我们使用标准设置:benjaminihochberg FDR,显著性水平为0.05。
可用性支持数据
支持本文结果的数据集包含在本文及其附加文件(附加图表和表)中。
参考
- 1.
Cubas P,Lauter N,Doebley J,Coen E:TCP领域:在蛋白质调节植物生长和发育中发现的基序。工厂J.999,18(2):215-222。
- 2.
Martin-Trillo M,Cubas P:TCP基因:十年后的家庭快照。趋势植物SCI。2010,15(1):31-39。
- 3.
Uberti Manassero NG,Viola Il,Welchen E,Gonzalez DH:TCP转录因子:植物形式的架构。生物分子概念。2013,4(2):111-127。
- 4.
立松K,中林K,神谷浩Y,Nambara E:转录因子调控AtTCP14拟南芥种子萌发过程中胚胎的增长潜力。植物杂志2008,53(1):42-52。
- 5.
Kieffer M,Master V,Wavees R,Davies B:TCP14和TCP15影响拟南芥中的emplodode长度和叶形。工厂J.2011,68(1):147-158。
- 6.
Herve C, Dabos P, Bardet C, Jauneau A, Auriac MC, Ramboer A, Lacout F, Tremousaygue D:在体内对AtTCP20功能的干扰会导致植物严重的生长改变,并使许多重要基因的表达失去调控。植物营养与肥料学报。2009,29(3):441 - 446。
- 7。
Danisman S,Van der Wal F,Dhondt S,Waites R,De Folter S,Bimbo A,Van Dijk广告,Muino JM,Cutri L,Dornelas MC,Angenent GC,Immink GH:拟南芥I和II类TCP转录因子调节茉莉酸代谢与叶片发育拮抗作用。植物理性。2012,159(4):1511-1523。
- 8。
Takeda T, Amano K, Ohto MA, Nakamura K, Sato S, Kato T, Tabata S, Ueguchi C: RNA干扰拟南芥假定的转录因子TCP16基因导致早期花粉发育的流产。植物mol biol。2006年,61(1-2):165-177。
- 9。
洛d,卡彭特R,文森特C,科普塞L,科恩E:在花不对称地金鱼草.自然科学学报。1996,383(6603):794-799。
- 10.
郭志强,李建军:TCP1通过调控拟南芥关键合成基因DWARF4的表达调控油菜素内酯的合成。植物学报。2010,22(4):1161-1173。
- 11.
DoebleyĴ,丝太克A,哈伯德L:在玉米顶端优势的演变。自然。1997年,386(6624):485-488。
- 12.
阿吉拉尔·马丁内斯JA,波萨-腐肉C,古巴,P:拟南芥支1作为腋芽内分支信号的积分器。植物细胞。2007,19(2):458-472。
- 13.
Martin-Trillo M,Grandio,例如,Serra F,Marcel F,Rodriguez-Buey ML,Schmitz G,Theres K,Bendahmane A,Dopazo H,古巴P:番茄分支1样基因在控制枝条的控制中的作用。工厂J.2011,67(4):701-714。
- 14.
Crawford BCW, Nath U, Carpenter R, Coen ES: cincinata控制抗鼻草花瓣裂片和叶片的细胞分化和生长。植物营养与肥料学报。2004,27(1):1 - 8。
- 15.
Ori N、Cohen AR、Etzioni A、品牌A、Yanai O、Shleizer S、Menda N、Amsellem Z、Efroni I、Pekker I、Alvarez JP、Blum E、Zamir D、Eshed Y:监管矛尖形的经过mir319.番茄中复合叶发育需要。NAT Genet。2007,39(6):787-791。
- 16.
Palatnik JF,阿伦E,吴XL,Schommer C,施瓦布R,卡林顿JC,威格尔d:由微小RNA叶形态的控制。自然。2003,425(6955):257-263。
- 17。
纳特U,克劳福德BC,卡彭特R,科恩E:表面曲率的遗传控制。科学。2003,299(5611):1404-1407。
- 18。
Palanik JF、Wollmann H、Schommer C、Schwab R、Boisbouvier J、Rodriguez R、Warthmann、Allen E、Dezulian T、Huson D、Carrington JC、Weigel D:序列和表达差异是基因功能专门化的基础拟南芥microRNA.miR159和mir319..系统工程理论与实践,2016,35(1):1 - 5。
- 19。
NAG A,King S,Jack T:MiR319A针对TCP4的靶向对于拟南芥的花瓣生长和发育至关重要。Proc Natl Acad Sci U S A. 2009,106(52):22534-22539。
- 20。
Schommer C,Palatnik JF,Aggarwal P,ChételatA,古巴P,Farmer EE,Nath U,Weigel D:MiR319目标控制茉莉酸盐生物合成和衰老。Plos Biol。2008,6(9):E230-
- 21。
Pruneda-Paz JL:一种功能基因组学方法揭示了CHE是拟南芥昼夜时钟的组成部分(vol 325, pg 1481, 2009)。中国科学:地球科学。2009,32(5):591 - 598。
- 22。
小山T,古谷男,田坂男,奥默-高木L:TCP转录因子经由的特定边界基因表达的负调节控制地上侧生器官的形态拟南芥.植物细胞。2007,19(2):473-484。
- 23。
Kosugi S,Ohashi Y:PCF1和PCF2特异性结合水稻增殖细胞核抗原基因中的顺式元素。植物细胞。1997,9(9):1607-1619。
- 24。
AGGARWAL P,达斯古普塔男,约瑟夫AP,Chatterjee的N,斯里尼瓦桑N,纳特U:在拟南芥转录因子的TCP家族特异性DNA结合的残基的鉴定。植物细胞。2010年,22(4):1174至1189年。
- 25。
Kosugi S,Ohashi Y:DNA结合和二聚化特异性和TCP蛋白家族的潜在靶标。工厂J.2002,30(3):337-348。
- 26。
Tremousaygue D,Garnier L,Bardet C,Dabos P,Herve C,睫毛B:内部端粒重复和'TCP域'蛋白结合位点合作,以调节拟南芥循环细胞中的基因表达。工厂J. 2003,33(6):957-966。
- 27。
李C,Potuschak T,科隆-Carmona的A,Gutierrez的RA,Doerner,P:拟南芥TCP20链接生长和细胞分裂控制途径的调节。Proc Natl Acad Sci U S A. 2005,102(36):12978-12983。
- 28。
关键词:番茄成熟抑制因子,MADS-box基因,果实成熟凛)基因座。科学。2002,296(5566):343-346。
- 29。
Manning K,Tor M,Poole M,Hong Y,Thompson AJ,King GJ,Giovannoni JJ,Seymour GB:编码SBP盒转录因子的基因中的一种自然发生的表观遗传突变抑制番茄果实成熟。纳特·吉内特。2006, 38 (8): 948-952.
- 30
Chung My,Vrebalov J,Alba R,Lee J,McQuinn R,Chung JD,Klein P,Giovannoni J:A番茄(Solanum Lycopersicum)Apetala2 / ERF基因,Slap2a,是果实成熟的负调节器。工厂J.2010,64(6):936-947。
- 31.
Reeves Pa,Olmstead Rg:Asteridae中TCP基因家族的演变:理解监管基因家庭多样化及其对形态学进化的影响。mol Biol Evol。2003,20(12):1997-2009。
- 32.
Lee Th,Tang H,Wang X,Paterson AH:PGDD:植物中基因和基因组重复数据库。核酸RES。2012,41(D1):D1152-D1158。
- 33.
姚鑫,马辉,王静,张德宝:拟南芥和水稻TCP基因家族的全基因组比较分析和表达模式。acta botanica sinica(云南植物学报),2007,49(6):885-897。
- 34.
Karlova R、van Haarst JC、Maliepaard C、van de Geest H、Bovy AG、Lammers M、Angent GC、de Maagd RA:利用高通量测序和降解分析鉴定番茄果实发育中的microRNA靶点。J Exp机器人。2013, 64 (7): 1863-1878.
- 35.
Danisman S, Van Dijk ADJ, Bimbo A, Van Der Wal F, Hennig L, De Folter S, Angenent GC, Immink RGH:拟南芥TCP转录因子家族的功能冗余分析。中国生物医学工程学报。2013,32(4):593 - 598。
- 36.
塔瓦A,函大AK:一个分子观点:番茄果实发育的激素调节。J工厂增长调节。2005年,24(2):67-82。
- 37.
Thompson AJ,Tor M,Barry CS,Vrebalov J,Orfila C,Jarvis MC,Giovannoni JJ,Grieron D,Seymour GB:一种新型抗嗜热番茄成熟突变体的分子和遗传表征。植物理性。1999年,120(2):383-390。
- 38.
Robinson Rw,Tomes ML:成熟抑制剂:一种具有多种熟练效果的基因。番茄群组合。1968,18:36-37。
- 39.
Tigchelaar EC,托姆斯ML,克尔EA,酒保RJ:一个新的果实成熟突变,非成熟(也不).Rep Tomato Genet Coop。1973年,23:33-34。
- 40。
卡尔洛娃R,松香FM,Busscher - 兰格Ĵ,Parapunova V,待办事项PT,芬妮AR,弗雷泽PD,巴克斯特C,Angenent介绍GC,德Maagd RA:转录组和代谢产物的分析表明,APETALA2a是番茄果实成熟的主要调节。植物细胞。2011年,23(3):923-941。
- 41。
casstrillo G, Turck F, Leveugle M, Lecharny A, Carbonero P, Coupland G, Paz-Ares J, Onate-Sanchez L:通过系统基因组分析和拟南芥转录因子阵列文库的筛选,加速顺反式调控的发现。公共科学学报。2011,6 (6):e21524-
- 42。
Tsutsui t,asaada y,sako k,sato t,sonoda y,Kidokoro s,yamaguchi-shinozaki k,Tamaoki m,Araakawa k,Iichikawa T,Nakazawa M,Seki M,Shinozaki K,Matsui M,Ikeda A,Yamaguchi J:Dear1,DREB蛋白的转录压缩机,介于拟南芥中介导植物防御和冷冻应激反应。j植物res。2009,122(6):633-643。
- 43。
Pajoro A, Madrigal P, Muiño JM, Matus JT, Jin J, Mecchia MA, Debernardi JM, Palatnik JF, Balazadeh S, Arif M, Maoiléidigh DS O, Wellmer F, Krajewski P, Riechmann JL, Angenent GC, Kaufmann K: MADS-domain转录因子在花发育中的调控机制。中国生物医学工程学报。2014,15 (3):R41-
- 44。
杨森BJ,威廉姆斯A,陈JJ,马瑟恩J,哈克S,辛哈N:从番茄中分离和鉴定两个打结状同源框基因。植物分子生物学。1998, 36 (3): 417-425.
- 45。
Ozaki S, Ogata Y, Suda K, Kurabayashi A, Suzuki T, Yamamoto N, Iijima Y, Tsugane T, Fujii T, Konishi C, Inai S, Bunsupa S, Yamazaki M, Shibata D, Aoki K:番茄基因的共表达分析和功能丰富的共表达模块中发现的基因的协调表达的实验验证。中国生物医学工程学报,2010,17(2):105-116。
- 46。
Lee Jh,Yoo Sj,Park Sh,Hwang I,Lee Js,Ahn JH:SVP在拟南芥中环境温度控制开花时间的作用。基因开发。2007,21(4):397-402。
- 47。
毛L,卡莉达d,庄HW,布迪曼MA,Szymkowiak EJ,爱尔兰EE,永RA:无缝是MADS-box基因控制番茄花蕾脱落区的发展。自然。2000,406(6798):910-913。
- 48。
acta botanica sinica(云南植物研究中心);acta botanica sinica(云南植物研究中心);植物营养与肥料学报,1996,13(3):207-209。
- 49。
Edgar RC:MUSCLE:具有高精度和高通量的多序列比对。《核酸研究》2004,32(5):1792-1797。
- 50.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S:MEGA5:使用最大似然、进化距离和最大简约方法的分子进化遗传学分析。摩尔生物进化。2011, 28 (10): 2731-2739.
- 51.
Saitou N,Nei M:邻居加入方法:重建系统发育树的新方法。mol Biol Evol。1987,4(4):406-425。
- 52
Livak KJ,Schmittgen TD:使用实时定量PCR和2-DDCT.方法。方法。2001,25(4):402-408。
- 53
Ramakers C,Ruijter JM,Deprez RH,穆尔曼AF:定量实时聚合酶链式反应(PCR)数据的假设 - 自由分析。Neurosci Lett。2003年,339(1):62-66。
- 54
詹姆斯P,Halladay J,Craig EA:基因组文库和宿主菌株,专为酵母中高效的双杂化选择。遗传学。1996,144(4):1425-1436。
- 55.
De Folter S,Immink RG,Kieffer M,Parenicova L,Henz SR,Weigel D,Busscher M,Kooiker M,Colombo L,Kater MM,Davies B,Angenent GC:拟南芥疯狂箱转录因子的综合交互映射。植物细胞。2005,17(5):1424-1433。
- 56.
克莱恩女士,斯穆特赛拉米E, Kuchinsky,兰迪N,工人C,圣诞节R, Avila-Campilo我,克里奇米,B,总值Hanspers K, Isserlin R,凯利R, Killcoyne年代,Lotia年代,Maere年代,莫里斯J,小野K, Pavlovic V, Pico AR, Vailaya,王PL,阿德勒,康克林BR,罩L,柯伊伯M,桑德C, Schmulevich我Schwikowski B,华纳GJ,等:利用Cytoscape整合生物网络和基因表达数据。Nat protocol . 2007,2(10): 2366-2382。
- 57.
Saito R,Smoot Me,Ono K,Ruscheinski J,Wang Pl,Lotia S,Pico Ar,Bader Gd,Ideker T:Cytoscape插件的旅行指南。NAT方法。2012,9(11):1069-1076。
致谢
我们感谢卢卡斯Patyk,Froukje范德沃尔玛和理查德Immink援助与酵母双杂交和酵母单杂交试验,而后者以及Selahattin Danisman的有益的讨论。太太露丝白色(博伊斯·汤普森研究所,纽约州伊萨卡)表示感谢向我们的番茄EST克隆。这项工作是部分由欧洲委员会资助的6th框架方案项目“通过探索自然生物多样性为消费者、加工商和生产者提供高质量茄科作物”(EU-SOL;合同编号:PL 016214-2),由荷兰农业、自然和食品质业部和荷兰科学研究组织NWO-ALW项目编号:828.08.005签订。
作者信息
隶属关系
相应的作者
附加信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
作者,为受孕,实验设计而制定了实质性贡献,获取数据,数据分析和解释:VP,RD,AB,RK。有助于执行实验的作者:VP,ML,MB,JB。参与起草稿件的作者:VP和RM。修改批判性的作者:vp,rm,rk,ga。获得最终批准的作者将发布的版本:全部。同意对确保与工作的准确性或完整性有关的问题来说,同意对工作的各个方面负责的作者是适当调查和解决的:所有。
电子补充材料
12870_2014_1567_moesm1_esm.pdf.
附加文件1:图S1:番茄TCP基因的染色体位置。”1a-d、“19a:”和“28a”描述了番茄参考基因组中各自基因的额外拷贝(PDF 12 KB)
表S4。
附加文件2:表S1:的附加(局部的)副本SLTCP1,-19,-28在番茄参考基因组中发现。表S4。番茄TCP基因和TCP样序列,相应的SGN- unigenes,(RE)测序EST克隆和进行的种族实验,以获得全长CDNA。表S5。用于扩增开放阅读框的引物序列。表S6。的引物的序列用于定量RT-PCR。表S7。用于TCP12,TCP15和TCP18促进扩增引物。表S8。用于扩增番茄候选基因的ORF的引物。(PDF 51 KB)
12870_2014_1567_MOESM3_ESM.xlsx
附加文件3:表S2:酵母双混合实验的计量表。如果在三个实验中的至少两种实验中的至少两种实验中发生一次,则每种实验一式三份进行,并且如果两种选择介质中的增长发生相互作用。(XLSX 46 KB)
12870 _2014_1567_moesm4_esm.xlsx
附加文件4:表S3:酵母单杂合物结果,表示拟南芥转录因子蛋白和克隆的相应番茄同源蛋白的结合独立地与番茄TCP12,-15和-18启动子元素。“ - ”表示没有绑定,“+”表示绑定。(XLSX 52 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Parapunova,V.,Busscher,M.,Busscher-兰格,J.等等。番茄TCP转录因子家族的鉴定,克隆与表征。BMC植物杂志14,157(2014)。https://doi.org/10.1186/1471-2229-14-157
收到了:
认可的:
发表:
关键词
- 转录因子
- 番茄
- 酵母单杂交
- 酵母2台混合动力