摘要
背景
Ca2+是,各种信号通路的多功能细胞内第二信使,起始许多涉及生长,防御和对生物和非生物胁迫的耐受性。内源性和外源性信号诱导细胞质CA2+([CA.2+]cyt.)海拔,对适当的下游响应负责。
结果
在这里,我们报道了一个乙基甲烷磺酸盐介导的拟南芥突变体,它不能诱导[Ca2+]cyt.对病原微生物渗出制剂的反应升高链格孢属brassicae,Rhizoctonia solani.,Phytophthora parasitica.var。尼古利亚人和根癌土壤杆菌.的CY.toplasmicCa2+海拔米犹(Cycam1.)易受感染答:brassicae,其毒素制备和对生物胁迫敏感,如干旱和盐。它累积高水平的反应性氧物质,并含有升高的水杨酸,脱落酸和生物活性茉莉酸异亮氨酸水平。反应性氧物种和植物激素相关基因更高答:brassicae处理的野生型和突变体幼苗。根据分析的反应,与国防有关的化合物水平升高要么是由苏察姆突变或由病原体促进,或主要是由于病原体感染或应用病原体相关的分子模式。此外,Cycam1.显示出对脱落酸处理的反应改变:激素抑制突变体的发芽和生长。
结论
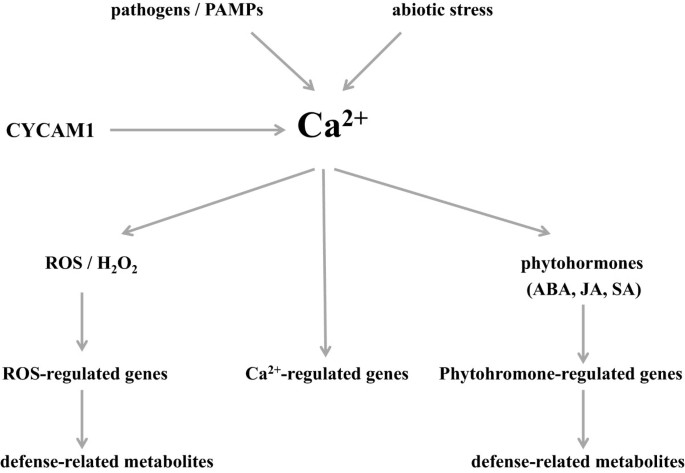
我们分离到一个拟南芥突变体,该突变体不能诱导[Ca2+]cyt.对各种微生物渗出液制剂的反应升高。该突变体对病原菌感染的敏感性较高,与较高的防御相关化合物积累有关,如植物激素、活性氧、防御相关mRNA水平和次级代谢产物。因此,CYCAM1对[Ca2+]cyt.提高生物、非生物和氧化应激反应。
背景
植物通过调节细胞溶质CA,植物已经进化了感知,转换和应对各种生物和非生物信号的有效机制2+水平([Ca2+]cyt.)(出口的。1- - - - - -7])。Ca2+在蜂窝隔室内是一个紧密的离子,其浓度的空间和时间控制使其成为植物中的多功能信号分量[5,8].在休息条件下,[CA2+]cyt.保持在100纳米以下,104少于妊娠液和10的时间4到105比液泡、内质网和叶绿体中的小1倍[2,5].加利福尼亚州2+信令系统由受体组成,一种用于产生[CA的瞬态增加的系统2+]cyt.通过Ca2+-pumps和-Channels响应刺激,识别特定的CA2+传感器蛋白质和对目标的信息转换,以及负责返回的蜂窝系统[CA2+]cyt.其预刺激水平[9,10].在植物中,[Ca2+]cyt.源自于钙的流入2+从质外体和/或从内部存储通过特定的通道,如环核苷酸门控通道,谷氨酸受体通道或两个孔Ca2+渠道(1,9- - - - - -11].H+/ Ca2+逆向转运和Ca2+- atp酶泵动Ca2+一旦受体不再被配体结合激活,离子就会回到质外体和/或细胞内储存[10].
[加利福尼亚州2+]cyt.升高是根和叶细胞对致病刺激的最早生理反应之一。通过感知病原真菌或/及其病原相关分子模式(PAMPs)的信号,[Ca2+]cyt.宿主细胞内的水平会在几秒钟内短暂增加[4,12- - - - - -15].植物会区分这些刺激的性质和强度,从而对它们的生存做出适当的快速适应反应[16].通过PAMPs或效应物诱导真菌病原体的识别和感知2+]cyt.升高,导致对试用病原体入侵的防御信号级联的激活[12,17,18].
在这里,我们报告了拟南芥突变体,该突变体由于其未诱导[CA而被孤立2+]cyt.响应渗出物组件的高度链格孢属brassicae(伯克。)SACC。答:brassicae是一种坏养殖氘核仪的真菌,导致霉眼症中的黑点疾病,包括答:芥.它是一种种子,空气和土壤传播的真菌,通过所有植物零件穿透,并导致叶子,茎,金属和根部的病变[19].病害进程最终导致植物死亡,主要由宿主特异性毒素(Tox)引起[19- - - - - -23].这些是不同化学类的低分子量次级代谢物,可以从液体培养或萌发孢子中分离出来[22- - - - - -25].两种已知的植物毒素解曲霉素B和西罗德斯敏PL答:brassicae在十字花科植物中诱导植物抗毒素和卡马抗毒素生物合成[23,26].
我们证明,除了这些毒素外,无毒的低分子量渗出成分答:brassicae也引起Ca2+]cyt.拟南芥的高度稳定表达CA2+报告蛋白AEQUORIN。我们已经孤立并表征了一个CY.tosolic加利福尼亚州lcium海拔米犹(Cycam1.),它不诱导[Ca2+]cyt.对无毒渗出物成分的反应升高。进一步描述Cycam1.证明它还未诱导[加利福尼亚州2+]cyt.对渗出液制剂的反应升高Rhizoctonia solani.,Phytophthora parasitica.var。尼古利亚人和根癌土壤杆菌.突变体易受感染的影响答:brassicae对ABA、干旱和盐胁迫敏感。因此,突变基因对[Ca2+]cyt.对生物和非生物应激反应的升高。
结果
渗出物组件答:brassicae诱导(Ca2+]cyt.海拔高度在拟南芥根
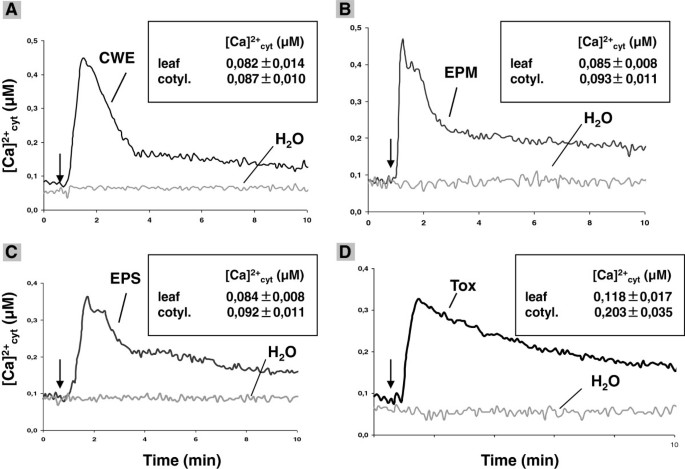
在休息条件下,18 D-Old转基因apoaequorin携带答:芥在Col-0背景(PMAQ2)中的根[27,28]给了[加利福尼亚州2+]cyt.值70±0.6 nm(n= 16)。在[Ca2+]cyt.在应用细胞壁提取物(CWE)、菌丝体(EPM)的水扩散渗出液制剂、发芽孢子(EPS)或毒素制剂40秒后观察答:芸苔属植物e到根源(图1).实验结束时的放电表明,在刺激后,重建的aequorin的消耗量小于5%,这保证了样品中aequorin的数量不受Ca的限制2+信号(16].在15-20秒的滞后阶段,[CA的水平2+]cyt.开始上升,并在40到70秒后达到~ 300 - 400 nM的峰值(图)1).随后Ca2+水平稳步下降。没有(Ca2+]cyt.通过水控制处理观察到的高程(图)1)勉强任何[加利福尼亚州2+]cyt.在18 d龄幼苗子叶中观察到CWE、EPM和EPS的升高,而Tox制剂诱导[Ca2+]cyt.子叶里的升级虽然率较低,但在根中较低(图1,插入)。对于所有刺激,[CA的大小2+]cyt.反应是剂量依赖的(附加文件1:图S1)。
答:brassicae-CWE、-EPM、-EPS和-Tox诱导2+]cyt.海拔高度在答:芥表达胞质aequorin的幼苗。将Col-0幼苗中的18天旧PMAQ2的ROOT分开并在7.5μm的Coelentazine中孵育过夜。用50μl的CWE挑战根源(一种),EPM.(B),每股收益(C)或托克斯(D)准备。[加利福尼亚州2+]cyt.在5秒的集成时间下从相对光单元(RLU)计算水平10分钟。箭头表示添加刺激/水的时间(60秒。插图显示[CA的平均峰值±SES2+]cyt.叶子和子叶(奇基)的升高,具有相同剂量的刺激。无菌水用作对照并给出背景读数。所有曲线和值代表每次实验中具有八种复制的五项独立实验的平均值。
的答:brassicae渗出液与毒素制剂表现出非常相似的特征2+]cyt.在热处理后没有改变的升高动力学(通过高压灭菌20分钟)表示组件是热稳定的(附加文件1:图S2)。乙酸乙酯萃取后,Ca2+在等体积蒸馏水中蒸发乙酸乙酯和溶解残馀物质后,几乎没有任何活性可测。这表明大部分活性仍然存在于水相。用甲醇提取CWE、EPM和EPS制剂后也得到了类似的结果,而用甲醇提取Tox制剂的上清液和沉淀馏分显示[Ca2+]cyt.诱导活动(附加文件1:图S2)。这表明[Ca2+]cyt.Tox制备诱导的活性与其他三种其他制剂诱导的活动不同。真菌组分的大小分离表明所有化合物都是<3 kda(附加文件1:图S2)。
一个加利福尼亚州2+基于筛选分离[Ca2+]cyt.上升到CWE
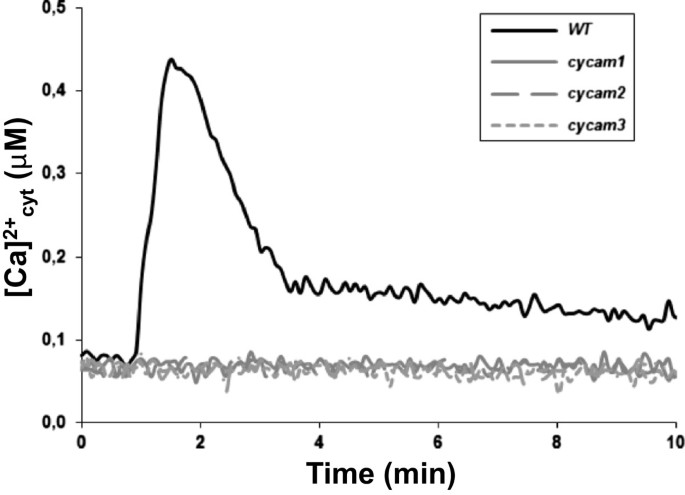
利用96孔板结合带有自动注射系统的读板光度计来筛选拟南芥突变体2+]cyt.响应的海拔答:brassicaeCWE。屏幕是由个体18天老的根源进行2甲基乙磺酸(EMS)诱变转载apoaequorin的M1Col-0背景中的种子[27,28].记录背景后[Ca2+]cyt.在1分钟的水平上,测量对CWE的反应10分钟2+]cyt.升高不是由apoaequorin基因突变引起的。筛查约150.000个个体M2植物鉴定出12个突变体完全不能诱导[Ca2+]cyt.响应CWE的高度;他们命名CY.toplasmic加利福尼亚州lcium海拔米ut(苏察姆)(图2).他们被转移到土壤中获得m3.和M.4种子。三种假定的突变体在土壤中无法存活。其他品系的表型均与M3.和M.4行。在我们的生长条件下,与野生型相比,它们都没有表现出明显的表型苏察姆突变体是等位基因的。他们两个人,cycam1-1和cycam1-2,并用于进一步的分析。当cycam1-1和cycam1-2回交WT (Col-0)或WT (La), [Ca2+]cyt.CWE的海拔恢复为〜25%的F.2这表明突变是隐性的。
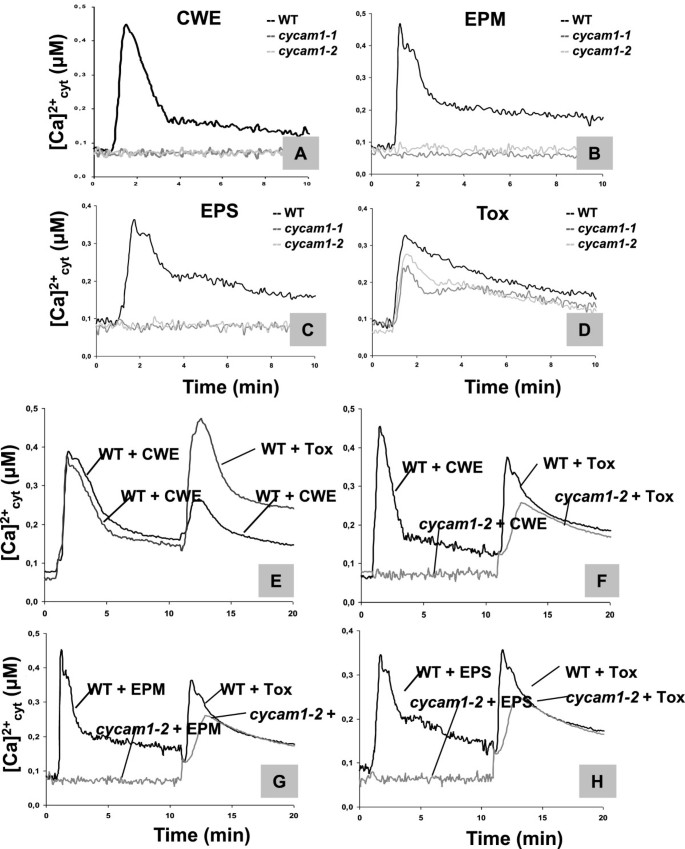
Cycam1.对EPM和EPS没有反应,但对Tox制剂有反应。
的cycam1-1和cycam1-2根对Ca无响应2+- 诱导EPM和EPS制剂答:brassicae,但显示了对Tox准备的WT反应(图3.广告)。测试是否[CA2+]cyt.CWE、EPM、EPS或Tox制剂诱导的反应表现出难治行为,是WT和两者的根源Cycam1.等位基因首先用CWE,EPM或EPS挑战,随后具有相同的刺激或其他两种刺激之一。第一次刺激后十分钟,当[加入2+]cyt.水平在下降,第二个刺激被应用。数字3.E表明,用CWH到WT植物的第二次刺激显示出较弱的反应。对于EPM或EPS,观察到相同的是,并且三种刺激CWE,EPM和EPS的任何组合(数据未显示)。可比[ca.2+]cyt.对三种刺激具有难解特征的反应表明CYCAM1参与了所有反应。因此,这三种制剂要么含有相同的化合物,要么都需要CYCAM1为[Ca2+]cyt.拟南芥根系的海拔。当Tox准备应用为第二次刺激时,强烈的[CA2+]cyt.无论CWE、EPM或EPS是第一刺激,WT根均观察到无难治特征的升高。毒性反应也发生在cycam1-1和cycam1-2幼苗(图3.F-H)。因此,Tox制备诱导的[Ca2+]cyt.响应与Cycam1无关。最后,我们使用FLG22刺激[加利福尼亚州2+]cyt.海拔Cycam1.根和叶子。观察到WT的差异(数据未显示)。
WT和Cycam1.对不同的答:brassicae派生的刺激。18日龄WT和Cycam1.将幼苗解剖并在7.5μm的Coelenterazine中孵育过夜。wt的根源,cycam1-1和cycam1-2用50 μl CWE(一种),EPM.(B),每股收益(C)或托克斯(D).突变体没有回应CWE,EPM和EPS(A-C)但对毒检有反应(D).以col0幼苗pMAQ2为对照。真菌刺激[Ca2+]cyt.WT和cycam1-2是由竞争分析确定的吗(e-h).WT和突变根首先用CWE、EPM或EPS处理,10分钟后再用CWE处理(E)或者托克斯(e-h).(Ca CWE-induced2+]cyt.连续应用CWE对WT根的变化是难治的,但对Tox的第二次治疗则不难治(E).CWE、EPM或EPS诱导[Ca2+]cyt.WT的变化,但不是cycam1-2而WT和突变体对随后的毒性处理都有反应(e-h).所有曲线都是4个独立实验的平均值,每个实验有8个重复。
我们应用Staurosporine,蛋白激酶抑制剂[29- - - - - -31,使WT根在[Ca2+]cyt.反应是由四种因素引起的答:brassicae派生的准备。采用5 μM staurosporine,因为[Ca2+]cyt.在这个浓度下,总磷离子流量没有变化[cf。32)。在用四种Ca中的一种处理前1小时应用2+-诱导刺激显著减少[Ca2+]cyt.海拔(附加文件1:表S1)。这提示CWE-、EPM-、EPS-和toxcinduced [Ca2+]cyt.升级需要激酶活性。
Cycam1.在[加利福尼亚州,也受到损害2+]cyt.回应其他微生物的渗出物制剂
自从Cycam1.被隔离在一个屏幕中[Ca2+]cyt.我们进一步检测了来自其他有可能与根相互作用的微生物的CWE和EPM制剂,例如来自拟南芥的Rhizoctonia solani.,一种坏死营养真菌,Phytophthora parasitica.var。尼古利亚人,半生物营养卵菌根癌土壤杆菌,肿瘤诱导细菌。有趣的是,Cycam1.没有响应来自这些真菌的CWE和EPM制剂,少于一扇A. Tumefaciens.,即使这些准备诱导[加利福尼亚州2+]cyt.WT中的提升(附加文件1:图S3A-E)。来自根殖民真菌的CWE制备Mortierella hyalina[33]诱发[CA.2+]cyt.在WT和Cycam1.突变(数据未显示)。因此,CYCAM1参与了[Ca2+]cyt.海拔对不同但不是所有微生物的反应。
测试是否[CA2+]cyt.来自这四种微生物的CWE和EPMS引起的反应显示了难治性行为,WT和两者的根源Cycam1.等位基因首先用CWE挑战答:brassicae随后与另一种微生物中的一个或来自另一种微生物的EPM。第二次刺激始终显示出较弱的反应。刺激的任何组合证实,Cycam1参与了所有反应。
Cycam1.非常容易受到影响答:brassicae及其毒性制剂
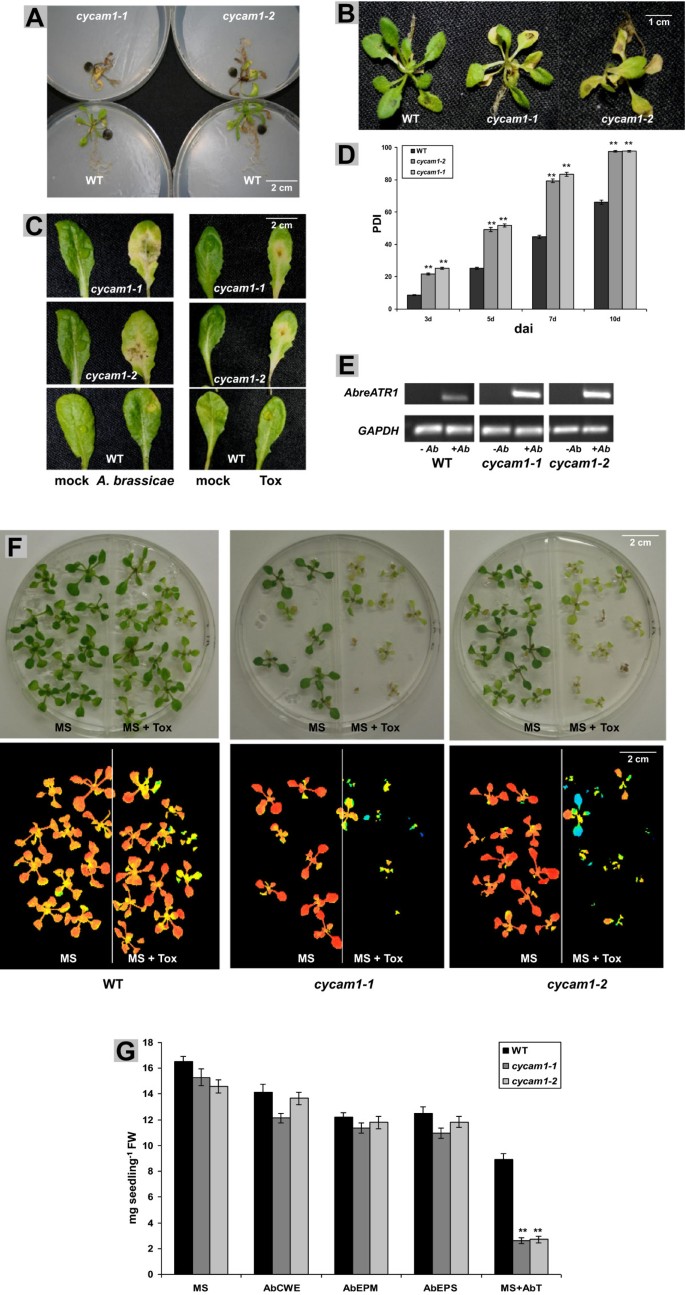
自Cycam1.通过对EMS突变的pMAQ2系进行筛选,获得突变体答:brassicaeCWE,我们测试了他们是否更容易答:brassicae14 d龄的幼苗或4周龄植株的叶片被感染答:brassicae.根被暴露在一个5毫米的真菌塞(cf.材料和方法,图4一种)。幼苗和成人植物的叶子被5μl孢子悬浮液感染(图4公元前)。测量的叶片中的疾病进展是在感染后3,5,7和10天测定的疾病指数(图4d)。实验表明cycam1-1和cycam1-2对答:brassicae(图4广告)。更高的转录水平A. Brassicae ATR1标记基因Cycam1.表明突变体无法有效地限制真菌生长(图4E)。当叶片被毒素制剂感染时得到了类似的结果(图4C).这也可以通过培养WT和Cycam1.在含有低浓度Tox制剂的培养基上培养幼苗(图4F).代表Fs/Fm值的假彩色图像板证实,WT幼苗在应用的Tox浓度下几乎没有受到影响,而cycam1-1和cycam1-2做(图4综上所述,CYCAM1对建立抗性是必不可少的答:brassicae感染及其毒性制剂。由于CWE、EPM和EPS组分诱导[Ca2+]cyt.而Tox制剂则诱导[Ca2+]cyt.海拔和毒性(图4G),他们的角色是不同的。
cycam1-1和cycam1-2非常容易受到答:brassicae及其托克斯。(一种)14天的根Cycam1.将LD条件下生长的WT幼苗暴露于真菌塞中7 d。(B)14天的叶子Cycam1.WT苗接种5 μl含104-10年5cfu毫升−1与成熟叶片分离后,用真菌孢子和毒素检测叶片(C).4周后叶片成熟Cycam1.解剖和WT植物,接种含有10μl的10μL孢子悬浮液4-10年5cfu毫升−1或10 μl Tox制剂,孵育5 d。(D)分别在染病后3、5、7和10 d测定叶片的病率指数(PDI),如图C图(左)所示。模拟处理用无菌水进行。条形图代表平均值±SEs,基于4 × 24叶片。星号表示学生确定的显着差异t- 最低(** p <0.01)。(E)A. Brassicae AbreaTr1转录水平在cycam1-1和cycam1-2比wt叶5戴。- - - - - -Ab,统一的控制,+Ab,答:brassicae来华的树叶。这种植物GAPDHC基因作为对照。凝胶图片代表了4个独立的实验,每个实验重复3次。(F)14天的旧版wt,cycam1-1和cam1-2分别在MS培养基(左)和MS培养基中添加答:brassicaeTOX准备(TOX,右)。底部图片显示顶部显示的幼苗的CHL荧光图像。(G)如在面板中展示的那样生长的幼苗的鲜重(F).除毒理检测外,还检测CWE、EPM或EPS制剂。数据为5个独立试验的平均值±标准差,每个试验每个处理40棵幼苗(** P < 0.01)。
测试Ca是否缺失2+回应病原体的渗出物制剂r .以上和p . parasiticavar。尼古利亚人对拟南芥的抵抗力有影响,14岁cycam1-1,cycam1-2WT幼苗暴露于这些病原菌的真菌堵塞中。突变体的疾病进展明显快于WT(附加文件)1:图S4)。这些数据支持这一观点Cycam1.更容易受病原体。
Cycam1.对ABA,盐和干旱胁迫敏感
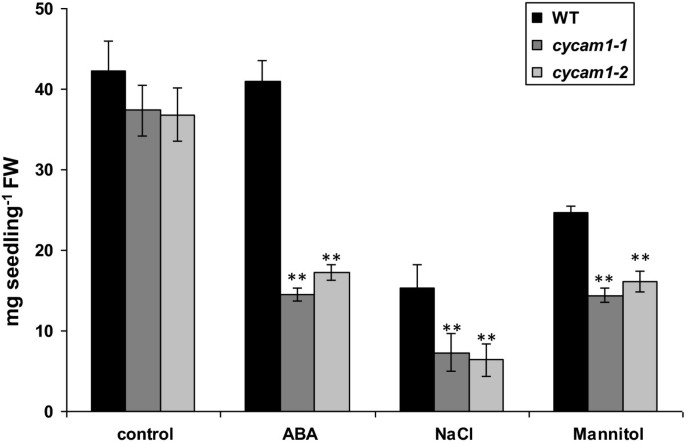
当WT,cycam1-1和cycam1-2植物在30nm ABA,100mM NaCl或350mM甘露醇中生长在3周的MS培养基上,与未暴露于应力的植物相比,它们的新鲜重量减少。然而,突变体的减少程度比wt更强烈(图5).突变体的适应度受损可以通过测量叶绿素(Chl)荧光参数来证明,这表明胁迫暴露的突变体比野生型植物的光合电子流效率受损更严重(附加文件)1:图S5)。这表明了cycam1-1和cycam1-2对ABA、盐和甘露醇胁迫比野生型更敏感。
Cycam1.累积反应性氧(ROS)
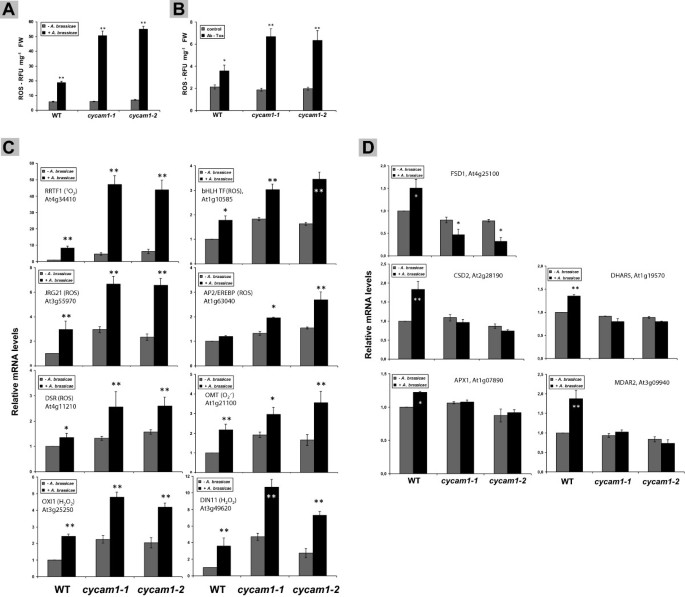
未充电的ROS的数量cyam1根的数量与WT根的数量相当。然而,暴露后答:brassicae孢子(图6a)2天或一个答:brassicae托克斯治疗(图6B),活性氧水平增加到显著较高的水平Cycam1.根与WT控制相比。刺激效果答:brassicae还观察到治疗用于不同ROS种类的标记基因的表达,尽管图案并不总是匹配所观察到的ROS种类的模式(图6C)。答:brassicae明显刺激了的表达REDOX-REGULATED转录因子1(RRTF1),用于单线氧积累的标记基因,氧化信号诱导1(Oxi1.),h的根特异性标记基因2O2积累,JASMONATE-REGULATED GENE21(JRG21),植物抗病反应(DSR.) 和DARK-INDUCIBLE11(DIN11.),代表一般ROS标记基因(图6C) [34- - - - - -37].也观察到较低但显著的反应吲哚硫代葡萄糖苷o -甲基转移1(OMT1),标记基因.图中显示的mRNA数据的比较分析6C表明一些基因已经在未经充电的情况下上调Cycam1.与野生型对照相比,这一效果被病原菌进一步促进。JRG21,Oxi1.,DIN11.),而在其他情况下,主要是病原体感染刺激突变幼苗中mrna的积累(最明显的是RRTF1).显然,ROS相关基因对ROS水平变化的反应不同,这可能是由于对不同ROS的反应调控不同。此外,较高的ROS水平后答:brassicae感染可能部分是由于活性氧清除效率较低造成的,因为在WT根中几种活性氧清除酶的mRNA水平上调答:brassicae感染后,则不会在根部上调Cycam1.突变体(图6d)。
cycam1-1和cycam1-2之后积累更多的活性氧物质(ROS)答:brassicae感染(a)或应用答:brassicaeTOX(B)。12天生的WT和Cycam1.幼苗接种量为5 μl答:brassicae含104到105cfu毫升−1(一种)或者与之与答:brassicae托克斯(B)2天后测定根内ROS水平。ROS标记基因的相对表达(C)或罗斯清除基因(D)在wt和Cycam1.根感染后2天答:brassicae孢子(一种).基因/蛋白的注释功能在括号中给出[H.2O2;单线态氧(1O2);超氧阴离子自由基,()]。对于基因缩写,CF.Tair(http://www.arabidopsis.org/).mock处理WT幼苗的mRNA水平取为1.0,其他值相对于其表达。所有值都是相对于根水平的平均值±SEsGAPDHCmRNA水平。基于3个独立实验,每个实验24种幼苗。星号表示具有重要差异,由学生的决定t-检验(* P < 0.05;** p < 0.01)。
植物激素水平在Cycam1.
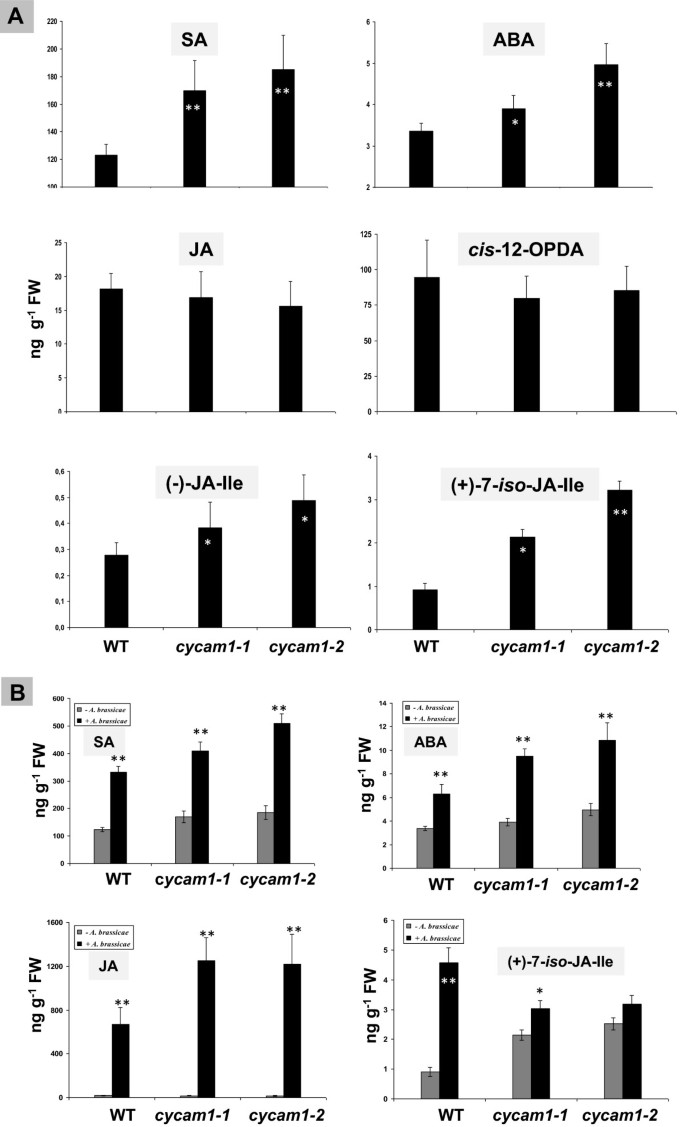
植物激素水杨酸(SA)、茉莉酸(JA)和ABA在调控植物生长发育和协调植物对生物和非生物胁迫的响应中起着关键作用[38- - - - - -40].SA-、JA-和aba -依赖的应激反应受[Ca2+]cyt.植物的含量[15,41- - - - - -46].为了检查突变体中SA、JA和ABA的水平是否发生改变,我们首先在14 d龄时测量了它们的水平Cycam1-1,Cycam1-2和MS培养基上生长的WT幼苗。SA和ABA水平略有,但显着高cycam1-1和cycam1-2与WT控制相比,幼苗未暴露于应力(图7A). JA水平及其前体的JA水平独联体12-oxo-phytodienoic酸(独联体-12-OPDA)不受突变影响(图7A).然而,茉莉酰异亮氨酸(JA-Ile)的非活性形式共轭,(-)-JA-Ile [47]和生物活性形式(+) - 7-ISO-JA-ILE [48]较高cycam1-1和cycam1-2与WT相比(图7一种)。这表明JA-Codify酶,但不是JA合成,是目标Cycam1.突变。综上所述,Ca中SA、ABA和生物活性(+)-7-iso-JA-Ile水平较高2+突变体,即使它们没有暴露于压力。
wt和phytohormone水平Cycam1.幼苗。WT,cycam1-1和cycam1-2幼苗在MS培养基上LD培养14 d。SA,阿坝,是的,独联体-opda,( - ) - ja-ile和(+) - 7-iso-ja-ile水平在总幼苗中确定。该值是指四个独立实验的±SES,每个实验中有五种复制(一种).12天生WT的叶片,cycam1-1和cycam1-2在LD条件下,用含104到105cfu毫升−1并在LD条件下孵育3天。SA,ABA,JA和(+) - 7-ISO-JA-ILE水平在总幼苗中确定。该值是指四个独立实验的±SES,每个实验中有五种复制(B).星号表示具有重要差异,由学生的决定t-检验(* P < 0.05;** p < 0.01)。
答:brassicae感染诱导野生型和野生型中SA、ABA和JA的积累Cycam1.幼苗(图7b)。植物激素水平的诱导在wt和植物中非常相似Cycam1.突变体,当考虑病原菌的%-刺激时,除了JA的生物活性形式(+)-7-iso-JA-Ile,在感染的WT中诱导更强烈Cycam1.幼苗(图7B). SA、ABA和JA在WT和突变体幼苗中的水平几乎相同,而(+)-7-的水平iso与WT控制相比,突变体中的两倍高(图7b)。Sa-诱导NPR1.和PR1(附加文件1:图S6a),aba-invucibleBG1,NCED3和TOC1(附加文件1:图S6B)和ja诱导JAZ1与未受挑战的WT对照相比,未受挑战的等位突变体中没有或没有显著的高表达,然而,可以观察到JA-inducibleMYC2,vsp2.,Thi2,PDF1.2和JASMONATE_REGULATED GENE21(JRG21额外的文件1:图S6C)。此外,在几乎所有的情况下,这些mRNA水平的诱导%答:brassicae,用孢子感染叶子3天,对WT和突变幼苗进行了可比性。因此,似乎越高的mRNA水平主要由病原体而不是突变引起的。无法检测到的显着差异ABA1.和ABA2mRNA水平。
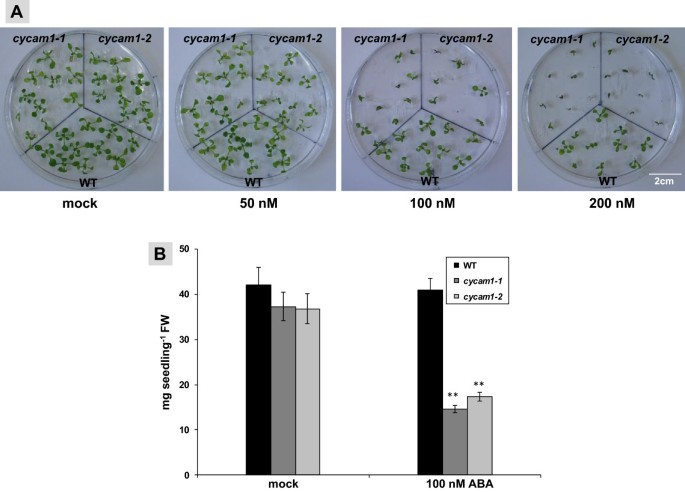
植物激素肺部水平升高cycam1-1和cycam1-2促使我们调查Ca的反应2+外源施用SA、茉莉酸甲酯(MeJA)和ABA的突变体。将植物激素以最佳浓度添加到MS培养基中。施用SA和MeJA(分别为5 μM和100 μM)对WT的生长无明显影响Cycam1.幼苗。而ABA (100 ~ 200 nM)则抑制了种子的萌发和生长cycam1-1和cycam1-2当ABA浓度为200 nM时,菌体的膨胀率明显高于野生型Cycam1.,但没有强烈抑制肾小球(图8A). 100 nm ABA处理3周后Cycam1.幼苗的生物量小于野生型幼苗的一半(图)8B).因此,突变体中已经存在的ABA水平升高,加上外源施用ABA,对突变体是有害的。有趣的是,同样在ABA存在的情况下,没有Ca2+在响应中观察到Cycam1.对真菌刺激的反应突变。
答:brassicae影响卡拉宾和葡糖苷水平
卡马毒素和硫代葡萄糖苷是拟南芥中参与植物防御的主要含硫次生代谢物[49,50].答:brassicae感染诱导了camalexin和吲哚硫代葡萄糖苷(iGLS)及其在WT和突变体中的生物合成基因(图)9a - c)。3-甲基硫代丁基- gls、4-甲基亚硫代丁基- gls、4-甲基亚硫代丁基- gls和8-甲基亚硫代辛基- gls(数据未显示)的诱导在WT和突变体幼苗之间没有显著差异,而在WT中aGLS的5-甲基亚砜基戊基- gls (5MSOP)和7-甲基亚砜基庚基- gls (7MSOH)水平高于突变体(图)9d)。表达MYB28,MYB29和BCAT4涉及AGLS生物合成[49]在WT中也上调,而在突变体中则不上调答:brassicae感染(图9E).这表明aGLS生物合成的诱导效率较低Cycam1..
camalexin、吲哚型硫代葡萄糖苷(iGLS)、脂肪族硫代葡萄糖苷(aGLS)及其生物合成相关基因的诱导Cycam1.后答:brassicae感染。12天生WT的叶片,cycam1-1和cycam1-2将LD条件下在MS上生长的幼苗转移到PNM培养基上,接种含有104到105cfu毫升−1并在LD条件下再孵育3天,然后测定卡马毒素(相对定量)(一种), iGLS(B)和agls.(D)的水平。iGLS分别为I3M(吲哚基-3-甲基- gls)、4MOI3M(4-甲氧基吲哚基-3-甲基- gls)和1MOI3M(1-甲氧基吲哚基-3-甲基- gls)。aGLS为5MSOP(5-甲基亚砜基戊基- gls)和7MSOH(7-甲基亚砜基庚基- gls)。camalexin和iGLS的mRNA水平(C)和agls.(E)WT叶片的生物合成基因,cycam1 -1和cycam1-22戴答:brassicae.用无菌水进行模拟处理。给出了该基因的简写和注释编号。每个cDNA的mRNA水平相对于植物是标准化的GAPDHC信息的水平。将模拟处理的WT幼苗的mRNA水平设定为1.0,另一种值称为1.0。该值是四种独立RT-PCR实验的±SES,每个实验中有三种复制。为(一种),(B)和(C),所有值(+答:brassicae)与值(-答:brassicae), P < 0.01。为(D)和(E),星号表示具有重要差异,由学生的决定t- 最低(* p> 0.1; ** p <0.01)。
讨论
渗出者的制剂答:brassicae,r .以上,p . parasitica,A. Tumefaciens.诱导(Ca2+]cyt.利用生物荧光Ca2+结合蛋白aequorin(图13、额外的文件1:数字S1和S3)。CA表征2+这些刺激引起的签名表明它们类似于来自各种植物物种的许多伴随的众所描述的那些:β-葡聚糖P. sojae.在大豆细胞培养中[51],Pep-13来自疫霉突变在欧芹细胞培养中[12),临时牵条从假单胞菌含油PV。phapleolina.在烟草[52,拟南芥酵母诱生剂和壳聚糖[18), cryptogein从P. Cryptogea.和烟草细胞培养中的寡糖[2,14],PEP-25来自P. sojae.拟南芥幼苗[15],INF1来自p . 5和Boehmerin从p . boehmeriae在烟草[53] Flg22从被鞭毛的细菌和ELF18从拟南芥幼苗中的伸长因子Tu [54,55].
在这里,我们描述了一个答:芥突变体不能诱导[Ca2+]cyt.拟南芥根对病原菌根系相互作用微生物的分泌物制剂的响应。诱导[Ca2+]cyt.升高要么存在于这些微生物的细胞壁制备中,要么从菌丝或萌发孢子释放到培养基中。虽然这些化学介质尚未确定,但它们的钙的形状2+签名,它们的剂量依赖和耐火性质证明它们需要Cycam1的功能(图3.).的Cycam1.突变体在对FLG22的反应中并非损害来自根殖民真菌的CWEm . hyalina这表明拟南芥对病原体分泌物的反应具有一定的特异性。比如flg22和Myc因子[31,56,57的活性成分答:brassicae渗出物制剂是热稳定的,亲水性,极性和低分子量(附加文件1:图S2)。
有趣的是,CWES,EPM和EPS制剂答:brassicae诱导(Ca2+]cyt.海拔(图1),但不是拟南芥真菌的典型疾病症状,而Tox制剂从答:brassicae诱发(Ca2+]cyt.海拔(图1),并且是有毒的(图4C, F).病原真菌的毒性包括答:brassicae会破坏细胞膜[21,22]这也可能有助于CA2+流入细胞质。这可能也解释了Ca恢复较慢的原因2+与应用CWE、EPM和EPS制剂相比,毒理处理后的信号更明显。加利福尼亚州2+无毒CWE、EPM或EPS诱导的反应可能会建立第一道防线,然后是由Tox诱导的第二个更强的反应。
Cycam1也在非生物压力中发挥作用,如增加的敏感性所示Cycam1.幼苗对ABA,盐和甘露醇的应用(图5).[加利福尼亚州2+]cyt.海拔高度是对干旱压力的反应[18,58,59].ABA和H2O2诱导(Ca2+]cyt.保卫细胞升高以调节气孔[1,18,60,61].持续(Ca2+]cyt.甘露醇诱导的植物诱导拟南芥的干旱和渗透胁迫所必需的升高[58,59].因此,Cycam1参与生物和非生物应激反应。看来较高的应力敏感性Cycam1.与氧化还原和ROS稳态失衡有关,因为突变体在答:brassicae感染比wt(图6一种)。由于这种响应也可以由TOX引起(图6b),不需要病原体。几种针对不同ROS种类的ROS标记基因是更强烈的上调的答:brassicae- 突变比在wt中(图6c)与在突变体中不能有效地压抑的概念一致。一个相当强烈的刺激作用答:brassicae在突变体中被观察到RRTF1,单线态氧积累的标记基因,而Oxi1.,响应H诱导的根特异性激酶的代码2O2治疗和H.2O2模型”刺激,JRG21,一般ROS标记,BHLH转录因子基因At1g10585和DIN11.在未受挑战的突变体中已经高于WT控制,并在答:brassicae-暴露的WT和突变体幼苗(图6C) [62].由于%的诱导在WT和突变体幼苗中是相似的,突变促进了表达,并且在病原菌感染后进一步刺激了这种效果。ROS积累增加的部分原因是突变体无法有效清除ROS积累,一些ROS清除酶基因在WT根中上调,但在突变体根中没有上调(图)6d)。
为了初步描述CYCAM1的作用,我们测量了未经处理的突变体幼苗和暴露于CYCAM1的突变体幼苗的ABA、SA和JA水平答:brassicae感染或毒素制剂。这三种激素在介导疾病对坏死营养和生物营养病原体的反应中发挥关键作用。Cycam1.与野生型相比,野生型积累了更高的ABA、SA和生物活性JA衍生物水平(图)7A).与生物营养、半生物营养和坏死营养病原体对ABA缺乏突变体的互作研究表明,ABA是植物防御的负调控因子[42,63- - - - - -65].过度的关注度Cycam1.来答:brassicae它的Tox和其他微生物测试证实了cycam1介导的[Ca2+]cyt.升高ABA和先天免疫ABA水平在两个等位基因中较高Cycam1.当他们没有暴露在压力下时,突变体(图7与野生型相比,这些突变体对外源施加ABA更加敏感(图1)8A). ABA生物合成基因BG1,NCED3和TOC1是高答:brassicae-裸露Cycam1.突变体比在wt中,而是ABA1.和ABA2mRNA水平没有显示出显著差异(附加文件1:图S6B)。BG1是一种β-葡萄糖苷酶,位于内质网,水解葡萄糖缀合的生物活性ABA,产生活性ABA [66].nced3,9-CI.s-环氧类胡萝卜素双加氧酶与CAB EXPRESSION1 (TOC1)时序相关德诺维ABA合成(64,67].因此,ABA水平升高答:brassicae-裸露Cycam1.变异可能是由更高的德诺维合成与活性ABA转化为活性形式。的接触Cycam1.在含ABA培养基上的萌发和生长实验表明,当ABA水平升高到外源施加更多ABA时,会导致更严重的损伤(图)8).
答:brassicae感染诱导SA(图7B)和sa反应基因革命制度党(附加文件1:图S6A)Cycam1.和WT幼苗。SA在植物防御真菌和细菌病原体中既有负作用也有正作用[40,68]和其中的参考文献]。的磷脂酶Dβ1(骑士β1)磷脂酸(PA)生物合成中受损的突变体和突变体更容易受到影响b .灰质与WT相比的感染,这与感染突变植物中的较高的SA水平相关[69],类似于我们的观察Cycam1..骑士β1结合Ca2+,水解磷脂生成PA,参与激素信号[53]和对疾病抵抗力的反应[69- - - - - -71].因此,在未受挑战的情况下,SA水平略有升高Cycam1.建议[加利福尼亚州2+]cyt.升高限制SA的积累,如果突变体暴露于刺激SA的生物和非生物胁迫下,SA的积累就变得有害。
JA、甲基JA和其他生物活性衍生物是调节坏死营养病原体感染诱导防御反应的重要分子[38,72].答:brassicae感染诱导更高的JA水平Cycam1.而未受激的WT和突变体幼苗的水平几乎相同(图)7B).因此,JA可能作为增强易感性的正调控因子答:brassicae在Cycam1..JA在疾病易感性中的作用答:alternataF。sp。Lycopersici.(AAL),其AAL- tox已被确定为番茄[73].此外,JA通过JA Insursite1(JAI1)受体依赖性JA信号传导促进AAL-Tox诱导的细胞死亡[74].JA响应基因的表达MYC2,vsp2.,JAZ1,Thi2.1和PDF1.2略高于答:brassicae受感染的苏察姆而不是wt苗(附加文件1:图S6C)。myc的标记基因的更高mRNA水平(vsp2.)和ERF(PDF1.2)的分支Cycam1.建议两个分支由Cycam1调节。另外,表达了JRG21,参与生物和非生物胁迫和JA信号转导的常见ROS标记基因[36,37,在unchallenge中更高Cycam1.和wt幼苗,以及存在答:brassicae导致WT和突变幼苗的mRNA水平相似的增量(附加文件1:图S6C)。这些结果表明CYCAM1参与了JA积累和信号转导的调控。此外,aGLS生物合成基因BCAT4(支链氨基酸氨基转移酶4),MYB28和MYB29[75]较高答:brassicae- 与幼苗相比答:brassicae-已感染Cycam1.幼苗(图9e)。这表明AGL合成基因在防御方面发挥着重要作用答:brassicae拟南芥感染通过CYCAM1.
结论
我们分离了一个不诱导[Ca2+]cyt.对不同致病性真菌渗出物的反应升高。CYCAM1参与[Ca2+]cyt.- 介导的非生物和生物应激反应(图10).的Cycam1.突变体积累了更高水平的生物活性植物活性植物SA,ABA和(+) - 7-iso-JA-ILE,对外源ABA应用敏感,并在后面累积比WT更多的RO答:brassicae感染,虽然未冒险的WT和突变幼苗的ROS水平是可比的。加利福尼亚州2+WT中的反应可以由无毒的CWE,EPM或EPS引起,这可能建立第一道防线,其次是由TOX引起的更强的防御反应。
方法
植物材料与生长
转基因拟南芥表达胞质apoaequorin (Aeqcyt.)在Col-0背景(PMAQ2)是Marc Knight教授的礼物[32].使用0.2%乙基 - 甲烷磺酸盐(W / V)进行诱变。个别M.2种子在含有1%琼脂(120×120×16mm)的Hoagland(HL)培养基上生长(120×120×16 mm; Nerbe加上GmbH德国)。在4℃下分层48小时后,将板垂直保持术,以在介质表面上生长根部,并在长期(LD)条件下(16h / 8h,光/暗;温度,20±1孵育18天°C;光强度,80μmolm−2秒−1) [32,76].
突变屏幕和[加利福尼亚州2+]cyt.测量
Aequorin基于发光测量的对象是16天龄的个体M2在霍格兰培养基中生长的植物[32,76].pMAQ2植物作为对照[30.].对于[加利福尼亚州2+]cyt.测量年代,approximately 70% of the roots per seedling were dissected and incubated overnight in 150 μl of 7.5 μM coelenterazine (native CTZ, P.J.K. GmbH, Germany, No 102171) in the dark at 20°C in a 96 well plate (Thermo Fischer Scientific, Finland, Cat. no. 9502887). For cotyledon assays, the same protocol was used except that the root material was replaced by 3 leaves of the seedlings grown under the same conditions. For the leaf assay, ~ 1/32 part of a fully developed leaf (without middle rib) of 4 week-old plants grown in pots under LD conditions were used. Bioluminescence counts from roots or cotyledons/leaves were recorded as relative light units (RLU) with a microplate luminometer (Luminoskan Ascent, version 2.4, Thermo Electro Corporation, Finland). The mutant screen was performed with the CWE from答:brassicae;假定的米2突变体被救出并转移到含有花园土壤和蛭石的盆,9:1(v / v)以进一步筛选和验证。在短的一天(SD)条件下(8h / 16h,光/暗;温度,20±1°C;光强度,80μmolm,在温度控制的生长室中生长在温度控制的生长室中−2秒−1) 4周后,Aracon试管内进行LD检查。这些种子是从M3.植物再次筛查以获得纯合蛋白突变体。
真菌的生长和维持
答:brassicae(FSU-3951)是从Jena Microbial Resource,德国耶拿获得的。在12/12H光/暗和75%相对湿度下的温度控制室中在20±1℃下在20±1℃下(pH6.5-6.7)在马铃薯葡萄糖琼脂(pH6.5-6.7)上生长。为了保持毒力,真菌被接种到拟南芥幼苗并定期从感染的组织重新分离[77].
的制备答:brassicae孢子悬液
答:brassicae马铃薯葡萄糖肉汤(PDB;pH值6.5 - -6.7)。将一个2周龄的真菌塞(直径5 mm)接种到PDB中,培养2周。培养基经4层无菌尼龙膜过滤去除,菌丝和孢子用无菌H2去除残留介质。用50 ml无菌H2o并通过四层灭菌的尼龙膜过滤。将孢子浓度调节至104-10年5菌落形成单位(CFU)ml−1通过连续稀释和血细胞计计数。为使孢子均匀分散,在100 ml孢子悬浮液中加入1-2滴Tween-20。
接种的答:brassicae到根,子叶和成熟的叶子
对于根部感染,用灭菌的尼龙膜转移到新鲜的PNM板中,将12天的幼苗转移到新鲜的PNM平板中[78].从两周大开始有一个5毫米的真菌塞答:brassicae距离根部距离1厘米。将板用Parafilm密封并在LD条件下在温度控制的生长室中孵育。将12-D幼苗转移到Pnm板后,在12-D幼苗后进行48小时进行叶感染。幼苗中间叶片中的六片叶子用5μl含有10的孢子悬浮液接种4-10年5cfu毫升−1.用分离的叶子进行成熟叶子的感染。从40°C和80μmolm下的SD条件下生长的4周龄植物中脱离了它们−2秒−1.无菌Whatmann滤纸被置于培养皿上,1毫升无菌H.2o被添加以浸泡滤纸。将五片脱落的叶子保持在浸泡滤纸上,并用10μl含有10μl的孢子悬浮液接种4到105cfu毫升−1直接进入叶子。用无菌H进行模拟处理2O.将板用Parafilm密封并如上所述在LD条件下孵育。使用标准疾病强度等级感染后3,5,7和10天的疾病发展的进展被确定为疾病指数(PDI)。对于Tox治疗,10μl答:brassicaeTOX准备直接施加在分离的叶子上;用无菌H进行模拟处理2O.
CWE的制备答:brassicae和A. Tumefaciens.
CWE是根据Anderson-Prouty和Albersheim的说法准备的[79]有修改[32,76].液体菌丝经4层尼龙膜(孔径70 μm;网眼数,92厘米−1;Sefar GmbH, Switzerland),用无菌H2O.菌丝体在无菌H中均质化2O(1:5; w / v)用受损搅拌器,通过四层尼龙膜过滤匀浆。收集残余物,并再次用无菌H洗涤三次2O;氯仿/甲醇(1:1)两次,丙酮两次。菌丝细胞壁(CW)在无菌条件下风干2 h。从干燥的菌丝CW中,将1 g CW材料悬浮在100 ml无菌H中制备CWE2冷却后,用4层尼龙膜过滤,再用2层Whatman滤纸过滤,最后用0.22 μm滤纸过滤,去除不溶解的物质。通过反相Supelclean LC-18 SPE (10 g床重;60毫升容量;60 A孔径;德国Taufkirchen的Sigma-Aldrich。57136号)。用[Ca2+]cyt.高程测量和组合[76,80].两天的血统A. Tumefaciens.在酵母提取液上生长,通过离心收获制备CWE。
菌丝体(EPM)和萌发孢子(EPS)水扩散渗出液制备
答:brassicae通过四层灭菌的尼龙膜过滤在PD汤上培养14天的菌丝体,并与无菌H集中洗涤七次2o除去介质和孢子。在空气干燥菌丝体1小时后,将其重新悬浮在无菌H中2o并在20°C的水平旋转振动器中孵育,60 rpm。48小时后,通过过滤通过4层无菌尼龙膜从水中除去菌丝体,然后通过2层滤纸,最后使用0.22微米孔径过滤器过滤灭菌。通过使其通过反相旋蛋白LC-18凹形进一步纯化粗水扩散级分,以获得如上所述的活性和部分纯的级分[76,80].从萌发孢子中制备水扩散渗出馏分,107-10年8cfu毫升−1将真菌在蒸馏水中温育48小时,在20℃下孵育48小时。在60 rpm摇晃期间,超过90%的孢子发芽。将它们过滤通过4层无菌尼龙膜,然后用0.22微米孔径过滤器过滤2层滤纸并过滤灭菌。最后通过使其通过反相旋转的相位旋转LC-18嵌入式来纯化滤液。
答:brassicae托克斯准备
一份来自答:brassicae如Vidhyasekaran等人所述产生培养滤液。[81]有修改。用100ml PDB的Erlenmeyer烧瓶(250ml)接种在PDA平板上生长的5mm盘,并在22℃,相对湿度75%和12H / 12H / 12H / 12H光/暗循环中孵育,具有光强度80μmolM.−2秒−1.4-5周后收集培养滤液,经8层无菌尼龙膜过滤,2层Whatman滤纸过滤。培养滤液浓缩至1/10th使用Rotavapor (Büchi Laboratoriums-Technik AG, Flawil, Switzerland)在40°C真空体积。加入等体积的甲醇(HPLC级),搅拌均匀,4℃保存过夜。沉淀通过4层尼龙膜过滤,然后再通过Whatman滤纸过滤。用等量的三氯甲烷、乙酸乙酯、正己烷和石油醚,用分离漏斗对水馏分进行三次萃取。水馏分经4层尼龙膜过滤后,10000 rpm离心10 min,上清液用0.22 μM滤器过滤消毒。通过Sephadex G100色谱柱进一步纯化,收集有效组分并冻干。将粉末重新悬浮在无菌H2O,并通过反相Supelclean LC-18 SPE cartridge进一步纯化。收集活性组分,作为钙离子的刺激剂2+]cyt.测量和生理学研究。
发芽、幼苗生长及根系测定
WT (pMAQ2)表面消毒种子Cycam1.突变体置于MS培养基上[82].对于干旱胁迫实验,在高压灭菌前加入不同浓度的甘露醇或NaCl。在高压灭菌后加入不同浓度的ABA。作为控制,wt和Cycam1.突变体在单独的MS培养基上生长。在4℃冷处处理48小时后,在LD条件下在20℃下温育板和80μmolm−2秒−1,如文中所述。在根检测中,将不同浓度的过滤器灭菌的甲基ja和SA溶液添加到灭菌的HL培养基中,以获得所需的最终浓度,并在其上镀种子[45].
光合作用参数的测量
如瓦格纳等人所述,获得代表板中幼苗FS / FM值的CHL荧光图像的假彩图片。[83].蓝色代表低F值年代/ F米高于阈值0.06和红色的值代表高f年代/ F米上阈值限制为0.17的值。
植物激素测定
将100 mg叶片材料在液氮中冷冻,-80℃保存。用研臼和杵研磨后,用含24 ng 9,10- d的甲醇提取叶材料2-9,10-二氢茉莉酸4-水杨酸(Sigma-Aldrich), 24ng D6-abscisic acid(圣克鲁斯生物技术,圣诞老人Cruz,U.s.a.)和4.8 ng的JA-13C6- 缀合物作为内标。JA-13C6如Kramell等人所述合成合成缀合物。[84] 使用13C6ile (Sigma-Aldrich)。匀浆混合30分钟,4℃14000 rpm离心20分钟。收集上清。匀浆用500 μl甲醇重新提取,混合均匀后离心,上清液汇集。复合萃取物在30°C快速真空蒸发,再溶于250 μl甲醇中。采用Agilent 1200高效液相色谱系统(Agilent Technologies)进行色谱分析。采用Zorbax Eclipse XDB-C18色谱柱(50 × 4.6 mm, 1.8 μm, Agilent)分离。以0.05%甲酸水溶液和乙腈为流动相。洗脱图谱为:0-0.5 min, 5% B;0.5-9.5 min, 5-42% B; 9.5-9.51 min 42-100% B; 9.51-12 min 100% B and 12.1-15 min 5% B. The mobile phase flow rate was 1.1 ml/min. The column temperature was maintained at 25°C. An API 3200 tandem mass spectrometer (Applied Biosystems) equipped with a Turbospray ion source was operated in negative ionization mode. The instrument parameters were optimized by infusion experiments with pure standards, where available. The ionspray voltage was maintained at -4500 eV. The turbo gas temperature was set at 700°C. Nebulizing gas was set at 60 psi, curtain gas at 25 psi, heating gas at 60 psi and collision gas at 7 psi. Multiple reaction monitoring (MRM) was used to monitor analyte parent ion → product ion: m/z 136.9 → 93.0 [collision energy (CE) - 22 V; declustering potential (DP) - 35 V] for SA; m/z 140.9 → 97.0 (CE - 22 V; DP - 35 V) for D4-SA; m/z 209.1 → 59.0 (CE - 24 V; DP - 35 V) for JA; m/z 213.1 → 56.0 (CE - 24 V; DP - 35 V) for 9,10-D2-9,10-dihydrojasmonic acid; m/z 263.0 → 153.2 (CE - 22 V; DP - 35 V) for ABA; m/z 269.0 → 159.2 (CE - 22 V; DP - 35 V) for D6-ABA; m/z 322.2 → 130.1 (CE - 30V; DP - 50V) for JA-Ile conjugate; m/z 328.2 → 136.1 (CE - 30V; DP - 50V) for JA-13C6- 缀合物。Q1和Q3四极杆保持在单位分辨率。分析师1.5软件(应用生物系统)用于数据采集和处理。通过分析稀释系列标准混合物来验证电离效率的线性度。相对于其相应的内标信号量化植物激素。用于量化12-苯二甲酸,独联体-OPDA 9 10 d2-9,10-二氢-JA用作应用实验确定的响应因子的内标。
LC-MS的量化Camalexin
样品被冷冻干燥直到恒重,并被磨成细粉。10 ~ 50mg的冻干粉末状物质用于卡马毒素的液相色谱-质谱分析。在硫代葡萄糖苷分析提取程序生成的流动样品中分析了卡马毒素(见下文)。在硫代葡萄糖苷提取过程中,将粗提物加载到DEAE Sephadex上,得到的流动液在96深井板中收集,并直接通过LC-MS/MS进行分析。采用Agilent 1200高效液相色谱系统(Agilent Technologies, Böblingen, Germany)进行色谱分析。采用Zorbax Eclipse XDB-C18色谱柱(50 × 4.6 mm, 1.8 μm,德国安捷伦)进行分离。以0.05%甲酸水溶液和乙腈为流动相。洗脱图谱为:0-0.5 min, 5% B;0.5-1 min, B在A中的5-100%;1-2分钟100% B和2.1-4。 5 min 5% B. The mobile phase flow rate was 0.8 ml/min. The column temperature was maintained at 25°C. An API 3200 tandem mass spectrometer (Applied Biosystems, Darmstadt, Germany) equipped with a Turbospray ion source was operated in positive ionization mode. The instrument parameters were optimized by infusion experiments. The ionspray voltage was maintained at 5500 V. The turbo gas temperature was set at 700°C. Nebulizing gas was set at 70 psi, curtain gas at 35 psi, heating gas at 70 psi and collision gas at 2 psi. Multiple reaction monitoring (MRM) was used to monitor analyte parent ion → product ion:m / z201.09→59.01[碰撞能量(CE) 45v;聚簇电位(DP) 51 V]。Q1和Q3四极杆保持在单位分辨率。数据采集和处理使用Analyst 1.5软件(Applied Biosystems, Darmstadt, Germany)。通过分析含卡马毒素样品的稀释系列,验证了电离效率的线性关系。camalexin的相对定量是通过计算每mg新鲜重量的峰面积来实现的。
硫代葡萄糖苷含量的测定
样品被冷冻干燥直到恒重,并被磨成细粉。每株10至50毫克冻干和粉碎的材料用于GLS分析。GLS用1ml 80%甲醇溶液提取,其中含有0.05 mM完整的4-羟基苄基GLS作为内标,并用芳基硫酸酯酶(Sigma-Aldrich)在DEAE Sephadex a 25色谱柱上进行脱硫。采用高效液相色谱(Agilent 1100 HPLC系统,德国Waldbronn, Agilent Technologies, Agilent 1100 HPLC系统)在反相柱(Nucleodur Sphinx RP, 250 × 4.6 mm, machery - nagel, Düren,德国)上用水-乙腈梯度(1.5%乙腈1分钟,1.5-5%乙腈1-6 min, 5-7%乙腈6-8 min, 7-21%乙腈8-18 min, 21-29%乙腈18-23 min,然后洗涤循环;流量1ml min−1).采用光电二极管阵列检测器进行检测,峰值集成在229 nm处。我们使用了以下响应因子:a-GLS 2.0, iGLS 0.5 [85]用于量化单个GLS。
定量ROS测量
根据制造商的说明,使用Amplex Red Moveroly氧化物/过氧化物酶测定试剂盒(Molecular Probes)进行定量ROS测量(http://tools.invitrogen.com/content/sfs/manuals/mp22188.pdf).使用基材羧基-H进行ROS测量2DFFDA(分子探针)根据制造商的说明书(https://tools.invitrogen.com/content/sfs/manuals/mp36103.pdf.).将植物材料在20μm羧基-H中孵育2DFFDA在KRPG缓冲液中准备30分钟。用荧光微孔板读卡器(Tecan Infinite 200)定量荧光强度,在485nm和530nm处发射的激发。没有基材和植物材料的反应混合物用作对照。
定量逆转录- pcr分析
使用RNEasy植物迷你试剂盒提取总RNA,用DNase I治疗(QIAGEN)。用OMNIScript cDNA合成试剂盒(QIAGEN)和1μgRNA合成cDNA。寡核苷酸引物在附加文件中给出1S2:表。每个cDNA探针的mRNA水平被归一化GAPDHC消息级别并相对于WT控制表示[71].实时定量RT-PCR采用icycle iQ实时PCR检测系统和icycle 2.2版软件(Bio-Rad)进行。PCR产物的扩增使用Bio-Rad (iQ SYBR Supermix),最终体积为23 μl。iCycler被编程为95°C 2 min, 32×(95°C 30 s, 56°C 30 s, 72°C 30 s), 72°C 10 min,然后是熔化曲线程序(55°C,以0.5°C递增)。所有反应重复两次。每个cDNA探针的mRNA水平被归一化GAPDHC信息的水平。折叠诱导值由Pfaffl的ΔΔCP方程计算[86].将处理过的样品与未处理的对照样品中靶基因的比例与内参基因进行比较。
缩写
- 阿巴:
-
脱盐酸
- 榴弹炮:
-
脂族葡萄糖苷
- [加利福尼亚州2+]cyt.:
-
胞质钙
- Cycam1.:
-
细胞溶质钙升高蛋白质1
- 排名:
-
叶绿素
- 独联体-12-opda.独联体:
-
-12-氧代植物酸
- CWE:
-
细胞壁提取物
- EMS:
-
乙甲烷磺酸盐
- EPM:
-
从菌丝中提取制剂
- EPS:
-
从孢子提取制备
- gl:
-
葡萄糖苷
- IGLS:
-
Indolic硫配糖体
- 是:
-
茉莉酸
- JA-Ile:
-
Jasmonyl-异亮氨酸
- PA:
-
磷脂酸
- PAMP:
-
其分子模式
- ROS:
-
活性氧
- SA:
-
水杨酸
- 托克斯:
-
毒素WT,野生型。
参考
- 1.
Sanders D, Pelloux J, Brownlee C, Harper JF:钙在信号传导的十字路口。acta botanica sinica(云南植物学报). 2002,14(4):491 - 497。
- 2.
LeCourieux D,Ranjeva R,Pugin A:植物防御信令途径的钙。新植物。2006,171:249-269。
- 3.
Boller T,Felix G:Elicitors的复兴:通过图案识别受体对微生物相关的分子模式和危险信号的感知。Annu Rev植物Biol。2009,60:379-406。
- 4.
王志强,王志强,王志强,等。钙信号转导的研究进展。植物营养与肥料学报。2010,31(6):593-620。
- 5.
钙信号:植物信息处理的先导货币。acta botanica sinica(云南植物研究),2010,22(4):541-563。
- 6.
Oldroyd Ge,Murray JD,Poole Ps,Downie Ja:豆科根茎共生中的参与规则。Annu Rev Genet。2011,45:119-144。
- 7.
Reddy As,Ali GS,Celesnik H,Day是:应对压力:钙和钙/钙调素调节基因表达的作用。植物细胞。2011年,23:2010-2032。
- 8.
Clapham de:钙信号传导。细胞。2007,131:1047-1058。
- 9.
Hethington Am,Brownlee C:CA的一代2+在植物的信号。植物营养与肥料学报,2004,31(4):427 - 434。
- 10.
Reddy VS,Reddy Asn:植物中钙信号组件的蛋白质组学。Phytochem。2004,65:1745-1776。
- 11.
Ward JM,MäserP,Schroeder Ji:植物离子渠道:基因家族,生理学和功能基因组学分析。Annu Rev Physiol。2009,71:59-82。
- 12.
Blume B, Nürnberger T, Nass N, Scheel D:在欧芹中激活病原体防御所需的细胞质游离钙的受体介导的增加。植物学报。2000,12:1425-1440。
- 13.
Müller J, Staehelin C, Xie Z-P, Neuhaus-Url G, Boller T: Nod因子和壳寡聚物诱导表达aequorin的大豆细胞胞质钙的增加。植物营养与肥料学报。2000,19(4):531 - 534。
- 14.
李志强,李志强,李志强,等。胞质游离钙对诱导子的影响尼古利亚娜朱姆比菲洛伐比亚细胞。acta botanica sinica(云南植物研究),2002,14(4):427 - 434。
- 15.
胡X,Neill Sj,杨Y,Cai W:真菌Elicitor Pep-25增加了细胞溶质钙离子,H2O2生产并激活十八烷盒途径拟南芥.Planta。2009,229:1201-1208。
- 16.
Mithöfer A, Mazars C:基于aequorin的细胞内钙的测量2+- 植物细胞中的令人核算。在线BIOL程序。2002,4:105-118。
- 17.
Nürnberger T, Scheel D:植物免疫反应中的信号传递。植物科学进展。2001,6:372-379。
- 18.
Klüsener B, Young JJ, Murata Y, Allen GJ, Mori IC, Hugouvieux V, Schroeder JI:拟南芥保卫细胞中致病诱导子和脱落酸钙信号通路的收敛性。植物营养与肥料学报。2002,30(4):492 - 498。
- 19.
BILE PS,TeWari JP:纯化,化学表征和毒素的宿主特异性链格孢属brassicae.physiol mol植物疗法。1987年,30:259-271。
- 20。
Nishimura S,Kohmoto K:来自alterararia物种的宿主特异性毒素和化学结构。Annu Rev phytopathol。1983年,21:87-116。
- 21。
沃尔顿·JD:宿主选择毒素:相容性因子。acta botanica sinica(云南植物研究). 1996,8(4):423 - 433。
- 22。
关键词:真菌,植物毒素,毒力植物生态学报。2009,12:390-398。
- 23。
destrxin B和sirodesmin PL与十字花科和谷类植物的分子相互作用:植物防御的代谢和诱导。植物营养与肥料学报,2012,29(6):751 - 756。
- 24。
Otani H, Kohnobe A, Kodama M, Kohmoto K:通过芽孢的萌发产生寄主特异性毒素alternaria brassicicola..植物营养与肥料学报。1998,22(4):429 - 434。
- 25.
Parada Ry,Sakuno E,Mori N,Oka K,Egusa M,Kodama M,Otani H:链格孢属brassicae从寄主叶上的萌发孢子中产生寄主特异性蛋白毒素。植物病理学杂志。2008,32(4):458-463。
- 26.
布赫华特L,格林H:去曲霉素B的植物毒性及其在发病中的可能作用链格孢属brassicae.植物病理学杂志。1992,41:55-63。
- 27.
Knight H,Trewavas Aj,Knight Mr:拟南芥中的冷钙信号涉及两个细胞库和钙签名后的变化。植物细胞。1996年,3:489-503。
- 28.
Knight MR, Campbell AK, Smith SM, Trewavas AJ:转基因植物aequorin报告了触摸和冷休克和激发子对细胞质钙的影响。自然。1991,352:524-526。
- 29。
Tamaoki, Nomoto H, Takahashi I, Kato Y, Morimoto M, Tomita F: Staurosporine,一种有效的磷脂/Ca抑制剂++依赖性蛋白激酶。Biochem Biophys Res Communce。1986,135:397-402。
- 30.
大村S, Sasaki Y, Iwai Y, Takeshima H: Staurosporine,一种来自微生物的潜在重要礼物。中国生物医学工程学报,2012,31(4):531 - 534。
- 31.
从丛枝菌根真菌的扩散信号诱导寄主植物细胞内短暂的胞质钙离子升高。植物营养与肥料学报。2007,33(4):457 - 461。
- 32.
Vadassery J,Ranf S,Drewiecki C,MithöferA,Mazars C,Scheel D,Lee J,Oelmüllerr:来自内参真菌的细胞壁提取物piriformospora indica.促进拟南芥幼苗的生长,并在根中诱导细胞内钙升高。工厂J. 2009,59:193-206。
- 33.
Gams W,Domsch Kh:Bemerkungen Zu Einigen Schwer Bestimmbaren Bodenpilzen。Nowa Hedwigia。1969,18:1-29。
- 34.
Wagner D,Przybyla D,Op Den Camp R,Kim C,Landgraf F,Lee Kp,Würschm,Laloi C,Nater M,HideG E,Apel K:单线氧诱导的应力反应的遗传基础拟南芥.科学。2004,306:1183-1185。
- 35.
Gadjev I, Vanderauwera S, Gechev TS, Laloi C, Minkov IN, Shulaev V, Apel K, Inzé D, Mittler R, Van Breusegem F:转录组足迹揭示拟南芥中活性氧信号的特异性。植物营养与肥料学报。2006,31(4):436- 442。
- 36.
Balazadeh S, Jaspert N, Arif M, Mueller-Roeber B, Maurino VG: H代谢形成后ros应答基因和转录因子的表达2O2在叶绿体。植物科学学报,2012,33(3):1-30。
- 37.
meterov N, Balazadeh S, Hille J, Toneva V, Müller-Röber B, Gechev T:氧化应激诱导不同的转录反应atr7和物loh2拟南芥多平行实时荧光定量PCR分析ROS标记物和抗氧化基因。植物营养与肥料学报。2012,29(4):429 - 434。
- 38.
植物激素在植物防御反应中的作用。植物生态学报。2009,29(4):483 -488。
- 39.
Koo AJ, Howe GA:伤口激素茉莉酸。植物营养与肥料学报,2009,30(4):531 - 534。
- 40.
杨志强,杨志强,杨志强:水杨酸在植物生长发育中的作用。中国生物医学工程学报。2011,32(4):489 - 494。
- 41.
拟南芥对热应激诱导的氧化损伤的保护涉及钙、脱落酸、乙烯和水杨酸。植物生理学报。2002,32(4):591 - 598。
- 42.
脱落酸在植物-病原互作中的作用。植物营养与肥料学报。2005,8:409-414。
- 43。
浏览J:茉莉酸是防御激素的受体和靶点。植物学报。2009,60:183-205。
- 44。
BOURSIAC Y,LEE SM,Romansky S,空白R,Sladek C,Chung WS,Harper JF:拟南芥中的真空钙 - ATP酶的破坏导致激活水杨酸依赖性编程细胞死亡途径。植物理性。2010,154:1158-1171。
- 45。
王志强,王志强,王志强,等。拟南芥中钙离子信号调控对Spodoptera草食和非生物胁迫的响应[J]。植物生理学报。2012,32(6):749 - 754。
- 46。
Yue Hy,Nie SJ,xing D:通过抑制MAP激酶6的激活,拟南芥BAX抑制剂-1的过表达延迟茉莉酸甲酯诱导的叶片衰老。2012,63:4463-4474。
- 47。
Thines B,Katsir L,Melotto M,Niu Y,Mandaokar A,Liu G,Nomura K,HE Sy,Howe Ga,浏览J:Jaz阻遏蛋白是茉莉酸盐信号传导期间的SCF(COI1)复合物的靶标。自然。2007,448:661-665。
- 48。
Fonseca S,Chini A,Hamberg M,Adie B,Porzel A,Kramell R,Miersch O,Wasternack C,Solano R:(+) - 7-iso-jasmonoyl-l-异亮氨酸是内源性生物活性的茉鲸酸盐。NAT CHEM BIOL。2009,5:344-350。
- 49.
杨志强,杨志强:硫代葡萄糖苷的生物化学性质。植物学报,2006,57:303-333。
- 50.
Bednarek P, pislewsk -Bednarek M, Svatos A, Schneider B, Doubsky J, Mansurova M, Humphry M, concenni C, Panstruga R, Sanchez-Vallet A, Molina A, Schulze-Lefert P:硫代葡萄糖苷代谢途径介导了广谱抗真菌防御。中国科学:地球科学。
- 51.
MithöferA,Ebel J,Bhagwat AA,Boller T,Neuhaus-URL G:转基因AEQUORIN在用β-葡聚糖或甲壳素诱导的大豆细胞中监测细胞溶质瞬变。Planta。1999年,207:566-574。
- 52.
li J, Klessig DF, Nürnberger T:烟草质膜中的一个harpin结合位点介导了致病相关基因HIN1的激活,该激活不依赖于细胞外钙,而依赖于丝裂原激活蛋白激酶的活性。植物学报。2001,13:1079-1093。
- 53.
张y,朱,张q,李米,闫m,王r,王l,welti r,张w,wan x:磷脂酶Dα1和磷脂酸调节NADPH氧化酶活性和在ABA介导的气孔中的反应性氧种类在拟南芥中关闭。植物细胞。2009,21:2357-2377。
- 54.
Jeworutzki E, Roelfsema MRG, Anschütz U, Krol E, Elzenga JTM, Felix G, Boller T, Hedrich R, Becker D:拟南芥模式识别受体FLS2和EFR的早期信号通路涉及Ca2+- 分配的等离子体膜阴离子通道的开口。工厂J.2010,62:367-378。
- 55.
Ranf S, Grimmera J, Pöschl Y, Pecher P, Chinchilla D, Scheel D, Lee J:防御相关钙信号突变体的发现通过一个定量的高通量屏幕拟南芥.莫尔植物。2011,5:115-130。
- 56.
Meindl T, Boller T, Felix G:细菌诱导因子鞭毛蛋白根据地址-信息的概念激活其受体在番茄细胞。植物营养学报。2000,12(3):483 - 494。
- 57.
关键词:丛枝菌根真菌,MtENOD11,共生体,表达Medicago truncatula.植物生理学报。2003,31(6):762 - 762。
- 58.
钙信号传导拟南芥对干旱和盐度的反应。植物学报1997,12:1067-1078。
- 59.
Pauly N, Knight MR, Thuleau P, Graziana A, Muto S, Ranjeva R, Mazars R:在烟草悬浮培养细胞中,细胞核与细胞质一起产生特定的细胞钙信号模式。中国生物医学工程学报。2001,30(4):413-421。
- 60.
保卫细胞钙振荡参数编码气孔运动。自然科学学报,2001,11:1053-1057。
- 61.
作者简介:王志强,王志强,王志强:植物保护细胞脱落酸信号转导与抗旱能力的研究。自然。2001,410:327-330。
- 62.
Rentel MC, lecourrieux D, Ouaked F, Usher SL, Petersen L, Okamoto H, Knight H, Peck SC, Grierson CS, Hirt H, Knight MR: ox1激酶在拟南芥氧化爆发介导的信号传导中是必要的。自然科学。2004,427:858-861。
- 63.
Adie BAT, Peréz-Peréz J, Pérez-Peréz M, Godoy M, Sánchez-Serrano JJ, Schmelz EA, Solano R: ABA是影响拟南芥JA生物合成和防御激活的植物抗性的重要信号。acta botanica sinica(云南植物研究),2007,19(4):457 - 461。
- 64.
Fan J, Hill L, Crooks C, Doerner P, Lamb C:脱落酸在调节多种植物病原互作中起关键作用。植物营养与肥料学报。2009,30(4):591 - 598。
- 65.
sánchez-vallet a,lópezg,ramos b,delgado-cerezo m,Riviere M-P,Liorente F,FernándezPV,Miedes E,Estevez JM,Grant M,Molina A:脱离酸信号的破坏组成思考拟南芥抗病性真菌的拟南芥抗性Plectosphaerella cucumerina.植物营养与肥料学报。2012,29(4):429 - 434。
- 66.
Lee Kh,Piao HL,Kim Hy,Choi Sm,Jiang F,Hartung W,Hwang I,Kwak JM,Lee Ij,Hwang I:通过应激诱导的聚合激活葡糖苷酶快速增加了积极皂酸的活性池。细胞。2006,126:1109-1120。
- 67。
吨J,Flors V,Mauch-Mani B:ABA在抗病性中的多方面作用。趋势植物SCI。2009,14:310-317。
- 68。
Vlot AC, Dempsey DA, Klessig DF:水杨酸,一种抗疾病的多层面激素。植物病理学杂志。2009,47:177-206。
- 69。
赵军,王超,李敏,王雪梅:拟南芥磷脂酶Dβ1调控对细菌和真菌的防御反应。植物营养学报,2013,30(4):514 - 514。
- 70。
Yamaguchi T, Kuroda M, Yamakawa H, Ashizawa T, Hirayae K, Kurimoto L, Shinya T, Shibuya N:抑制磷脂酶D基因OsPLDbeta1,激活水稻的防御反应并提高抗病能力。植物营养学报。2009,30(4):489 - 494。
- 71。
Camehl I, Drzewiecki C, Vadassery J, Shahollari B, Sherameti I, Forzani C, Munnik T, Hirt H, Oelmüller R: ox1激酶通路介导piriformospora indica.- 拟南芥的生长促进。PLOS PARCOG。2011,7:e1002051-
- 72。
《植物免疫的激素调节》。中国生物医学工程学报。2012,28:489-521。
- 73。
EGUSA M,Ozawa R,Takabayashi J,Otanih H,Kodama M:番茄中的茉莉酸己酸酯信号通路调节对毒素依赖性病原体的易感性。Planta。2009,229:965-976。
- 74.
张立会,贾cg,刘lh,张玉,李海,王qm:茉莉酸盐和乙烯的参与主产F。sp。Lycopersici.毒素诱导的番茄细胞死亡。J Exp Bot。2011,62:5405-5418。
- 75.
SønderbyIE,Burow M,Rowe HC,Kliebenstein DJ,Holkier BA:三个R2R3 MYB转录因子的复杂相互作用决定了拟南芥中脂族藻糖苷的概况。植物理性。2010,153:348-363。
- 76.
植物中钙信号传导和胞质钙的测定。植物营养与肥料学报。2011,21(4):457 - 462。
- 77.
Johnson JM, Sherameti, Nongbri PL, Oelmüller R:研究有益和无益性状的标准化条件piriformospora indica./拟南芥相互作用。piriformospora indica:sebacinales及其生物技术应用。土壤生物学卷33.编辑:Varma A,Kost G,OelmüllerR.2013,柏林海德堡德国:Springer,325-343。1
- 78.
Johnson JM, Sherameti I, Ludwig A, Nongbri PL, Sun C, Varma A, Oelmüller R:协议拟南芥和piriformospora indica.共栽培-研究植物有益性状的模式系统。植物营养与肥料学报。2011,21(4):451 - 457。
- 79.
宿主-病原体的相互作用:VIII:分离病原体合成的富含葡聚糖的组分,该组分在病原体宿主中引发防御反应。植物生理学报,2003,22(4):591 - 598。
- 80.
李永昌,庄士敏,钱连昌,孙晨,蔡东,娄斌,Oelmüller R,叶伟华:利用植物提取物促进大白菜和拟南芥生长piriformospora indica.不受菌丝合成生长素的刺激。植物营养与肥料学报,2011,24(4):421-431。
- 81.
Vidhyasekaran P, Ruby Ponmalar T, Samiyappan R, Velazhahan R, Vimala R, Ramanathan A, Paranidharan V, Muthukrishnan S:水稻纹枯病病原菌根核菌(Rhizoctonia solani)的寄主特异性毒素产生。植物病理学杂志。1997,17:1258-1263。
- 82.
利用烟草组织培养快速生长和生物测定的改良培养基。植物科学学报,1996,15:473-497。
- 83.
Wagner R, Dietzel L, Bräutigam K, Fischer W, Pfannschmidt T:对波动光质量的长期响应是一种重要而独特的光适应机制,支持植物的生存拟南芥在弱光条件下。植物营养学报。2008,28(6):593 - 597。
- 84.
王志强,王志强,王志强:n-(茉莉酸)-氨基酸缀合物的合成。四面体。1988,44:5791-5807。
- 85.
Burow M,MüllerR,Gershenzon J,Wittstock U:在遗传工程中改变了氨基葡萄糖水解拟南芥及其对幼虫发育的影响Spodoptera littoralis.中国化学学报。2006,32(6):649 - 654。
- 86.
Pfaffl MW:实时RT-PCR中相对定量的新数学模型。Nucl酸res。2001,29:E45-
确认
JMJ由耶拿的国际马克斯·普朗克研究学院和耶拿的弗里德里希·席勒大学资助。感谢Scheel教授提供flg22, Sarah Mußbach和Claudia Röppischer的优秀技术支持。
作者信息
隶属关系
相应的作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
JMJ和RO设计并策划了这项研究。JMJ进行了实验。MR测量了植物激素、卡马毒素和硫代葡萄糖苷。JMJ分析了数据。JV和JG对讨论做出了贡献。JMJ和RO写了这篇文章。RO监督了这项研究。所有作者阅读并批准了最终的手稿。
电子辅料
图S2。
附加文件1:图S1: [Ca2+]cyt.治疗后拟南芥根系的升高答:brassicaepamp或毒素。图S2。CWE,EPM,EPS和毒素(TOX)的物理和化学性质答:brassicae.图S3。WT和苏察姆到CWE和EPM来自Rhizoctonia solani.(A, B),Phytophthora parasitica.var。尼古利亚人(C, D)和CWE来自根癌土壤杆菌(E)。图S4。的cycam1-1和cycam1-2更容易受到Rhizoctonia solani.和Phytophthora parasitica.var。尼古利亚人感染。图S5。光合作用参数受损苏察姆对不同的非生物胁迫的反应。图S6。WT和植物激素调节基因苏察姆幼苗。表S1。抑制(Ca2+]cyt.引起的高度答:brassicae-衍生的CWE, EPM, EPS和Tox制备的staurosporine在WT根。表S2。RT-PCR引物列表。(医生10 MB)
作者为图像提交的原始文件
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
迈克尔约翰逊,Reichelt, M, Vadassery, J。et al。一个在细胞内钙离子升高受损的拟南芥突变体对生物和非生物胁迫敏感。BMC植物杂志14日,162(2014)。https://doi.org/10.1186/1471-2229-14-162
收到了:
接受:
发表:
关键字
- 非生物胁迫
- 生物应力
- 答:brassicae
- 卡拉宾
- 胞质钙海拔
- 葡萄糖苷
- 植物激素