摘要
背景
干旱是导致全球农业产量广泛损失的一个主要制约因素。潜在产量在很大程度上是由花序发育过程决定的。然而,迄今为止,大多数关于植物对干旱响应的研究都集中在植物的营养发育上。本研究描述了不同干旱条件下生殖发育的形态变化和转录组的比较。
结果
研究了在两种干旱条件下生长的植株:最低繁殖成功率(土壤含水量45-50%,中度干旱,MD)和存活率(30-35%,重度干旱,SD)。与井水植物相比,MD植株主茎的角果数量和每角果的种子数量相近。SD植物的情况比MD植物严重得多。利用微阵列技术在分子水平上进一步研究了花序的转录组。结果表明,重度干旱条件下差异表达基因超过4000个,中度干旱条件下差异表达基因不到2000个(变化2倍,q值< 0.01)。我们发现了一组随着干旱加剧而表达增加的基因,这表明它们对脱水有一定的适应能力。有趣的是,我们还发现了只有在中度干旱条件下才会发生变化的基因,而在重度干旱条件下不会发生变化,这表明存在不同的基因对不同水平的水可利用性做出反应。进一步独联体-元素分析提供了更多关于生殖响应干旱的潜在机制的信息,提出了可能的新的候选基因,保护这些在干旱胁迫下发育的花朵。
结论
在缺水胁迫下,植物生殖组织中可能会激活不同的途径来应对中度和重度干旱,从而可能帮助植物实现产量最大化,并在营养发育和生殖发育之间平衡资源消耗。
背景
不断增长的世界人口(2010年达到70亿)表明对作物生产的需求不断增长。农业生产力不可避免地受到环境压力的影响,如干旱、盐度、热和冷[1].其中许多非生物因素会导致作物减产,部分原因是植物细胞脱水。尽管地球上水资源丰富,但由于盐度的原因,大部分水资源都不能用于灌溉。因此,越来越多的研究集中在使植物适应脱水的机制上。抗脱水分为两大类:避免脱水或耐脱水[2].脱水避免被定义为植物在逆境下保持细胞水化的能力,植物可以通过保持土壤水分、限制水分利用(WU)和渗透调节(OA)来实现。脱水耐受性被定义为在(部分)脱水状态下维持正常功能的相对能力,也被视为对脱水的第二防御。这一机制除了在种子胚中观察到之外并不常见,唯一的例外是在干旱条件下灌浆的某些阶段[3.].
干旱是导致植物脱水的最直接原因,多年来人们一直在研究。它可在分子、细胞、生理和生化水平上影响植物,并可严重影响包括种子萌发在内的多个发育过程[4],幼苗生长[5],根发育[6]及后期叶片发育[7- - - - - -9].在许多开花植物中,花的出现恰逢夏季干旱胁迫。为了确保成功繁殖,开花植物必须具有保护花朵免受严重脱水的机制。然而,只有少数研究在分子水平上研究了干旱条件下的生殖发育[10,11].
研究干旱的科学家面临的另一个挑战是如何控制水资源的可用性。从农业经验和实验研究中都知道,不同程度的缺水会在不同程度上影响作物的发育和产量[12].一些研究试图计算某些地区的最低需水量,并提议利用水管理来提高应对干旱的能力[13,14].然而,由于以下原因,旱情的野外研究存在很大的局限性:1)难以准确控制土壤含水量;2)蒸发速率和土壤含量的变化延缓了干旱对植物的影响;3)由于土壤养分的变化,偏差较大。因此,很难从实地研究中估计植物生存或肥力所需的最低水分。
另一方面,实验室的研究可以相对准确地控制水量,以探索植物赖以生存的机制。通过减少水供应,许多基因被发现参与复杂的干旱响应,包括aba依赖和aba独立的干旱响应途径[1,15,16].进一步的研究揭示了这些通路中的其他关键成分,包括属于bZIP、AP2/ERF和MYB家族的转录因子[17- - - - - -19].在转录组分析的帮助下,越来越多的干旱响应基因被报道,尤其是在基因组信息已知的模式植物中,如拟南芥,稻米及玉米[1,20.,21].然而,这些研究往往集中在营养组织[20.,22].
我们实验室最近的一项研究显示了严重干旱对生殖发育的影响,比如花的数量和大小减少,以及种子减少[11].此外,详细的形态学分析表明,干旱影响了雄性和雌性生殖器官的发育,导致胚珠败育,花不能开放,花药发育异常,花丝和柱头乳头细胞伸长延迟。对充足水分和严重干旱条件下的花序转录组的进一步研究表明,在严重干旱处理期间,花的转录组经历了显著的重编程[11].然而,由于在之前的研究中只应用了严重的干旱,所以尚不清楚不同程度的干旱胁迫对生殖发育和转录组的影响。
在这里,为了了解不同程度的干旱胁迫对生殖发育的影响,我们处理拟南芥不同干旱程度的植物在抽苔期后不久(大约在第一朵花开放的时间)观察其形态变化。我们进一步研究了中度干旱条件下植株的花序转录组的变化。我们收集了中度干旱处理后不同时间的植株的花序,利用花序的mRNA样本进行芯片实验。差异基因表达模式与启动子相结合独联体-作用因子分析为进一步研究中重度干旱胁迫下的花发育提供依据。我们认为,在干旱胁迫下,许多与花发育有关的重要基因对干旱响应,在一定程度上保护了生殖成功。
结果
形态的变化拟南芥花卉对不同程度干旱的反应
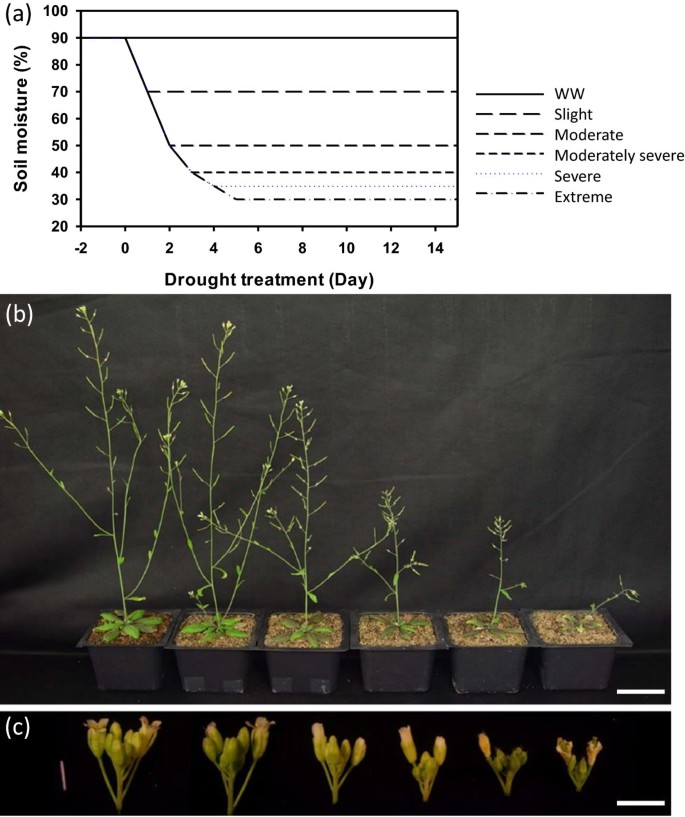
为了研究干旱处理对生殖发育的影响,我们在每盆播下一粒种子,让植株在水分充足(含水量90%)的条件下生长,直到抽苔期(种植后约24天),此时植株平均高度约1cm,莲座叶8-9片。为了研究不同干旱强度对植物花序的影响,我们将植物分为6组。其中一组(对照)在整个试验过程中每天浇水以保持土壤湿度在85-90%,其他5组同时停止浇水,直到土壤湿度分别达到70%、50%、40%、35%和30%。这五组在称重后,每天浇水适量,以保持土壤水分,分别为65-70%(轻微),45-50%(中度),35-40%(中度严重),30-35%(严重),25-30%(极端)(图1a).当土壤湿度低于25%时,植物无法存活。在初始干旱处理后10天,株高随干旱处理的严重程度呈现不同程度的下降,从极轻微到极严重(图2)1b)。
此外,干旱胁迫也导致树枝、花蕾和角果减少,尤其是在水位较低的时候(图1c).为了进一步研究不同干旱对生殖发育的影响,我们统计了不同干旱处理下主茎上的累积花数。如图所示2a,只要土壤含水量在45%以上,植株在主茎上开花的数量与浇水充足的对照相似,尽管水分在45-50%的植株由于茎伸长减少而高度较短(图1b).然而,当土壤湿度低于40%时,累积花数的增长较正常缓慢,在几天内停止增长,然后恢复缓慢增长(图2A),表明在这种干旱条件下,新花形成的速度较慢,并且只有几天的时间没有新花产生。这与我们之前观察到的严重干旱处理过的植物相似(土壤湿度为30-35%;[11]);然而,这一结果表明,更严重的干旱导致更大的减少新花产生的速度和更长的延迟恢复新花出现。同样令人惊讶的是,在严重干旱的情况下,植株仍然能够维持新花的产生,最终主茎上的总花数几乎与对照组相同,这表明植物在处理期间已经适应了干旱条件。
我们以前发现,繁殖产量对严重的干旱条件很敏感[11].为了了解中度干旱条件的影响,我们统计了每个种子荚的种子数,发现植物可以忍受轻度到中度干旱,主茎的种子数没有明显减少(图2b).与总花数变化趋势相似,土壤湿度在50%及以上的3组间差异不大。然而,当水分含量降低到40%时,产量下降明显,在土壤水分含量为25-30%和30-35%的条件下,损失更严重,低于控制极端干旱的1/5。此外,与中度或轻微干旱条件下(45-50%或以上;数字2c-2e),水分较少的植物会在几天内停止产生角果,在更严重的干旱下会更长时间(图2F-2h),与上述植物缺乏新花相一致。我们还注意到,一些极度干旱的植物直到最后才存活下来。
中度干旱条件下花序转录组分析综述
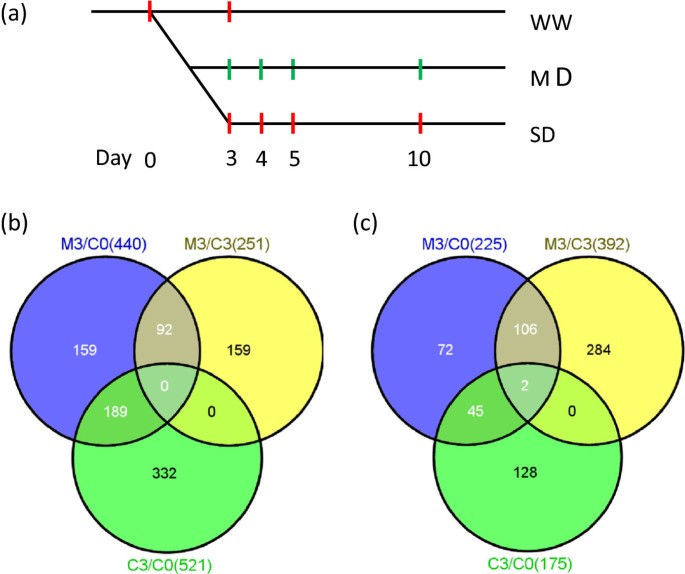
根据形态学观察,我们假设拟南芥植物可能采用不同的机制来应对中度和重度干旱条件。之前我们证明了严重的干旱导致了花序转录组的巨大变化[11].为了进一步在转录组水平上分析植物对干旱的响应,我们使用Affymetrix基因芯片分析了在土壤湿度最低的条件下生长并获得成功繁殖产量(45-50%)的植物,并将其与水分充足的对照以及此前在严重干旱条件下(30-35%)的结果进行了比较[11].为了了解其时间表达模式,我们从野生型花序中取样拟南芥在不同水分条件下(含水量占土壤总干重的50%和90%),在干旱胁迫0、3、4、5和10 d后的一系列时间点采集,对照组样品命名为C0、C3,中度干旱组样品命名为M3、M4、M5、M10(图2)3.a).之前分析的严重干旱样品为S3、S4、S5、S10(图4)3.) (11].
从第3天的花序收集样本和转录组来揭示植物对干旱的早期反应。(一)WW植株的样品采集点为C0、C3, MD植株的样品采集点为M3、M4、M5、M10。对比,DT植物的T3、T4、T5、T10均来自前期研究[11].(b)M3较C0、M3较C3、C3较C0上调基因的文氏图。(c)这是维恩图,在相同的比较中下调基因(b).
对于每种条件,我们在每个时间点至少有两个生物重复,所有结果都具有高度重复性(所有Pearson相关系数> 0.98;额外的文件1).为了重点研究干旱条件下与充足水分条件下相比发生显著变化的基因,我们只选择了那些表达有:1)2倍以上变化的基因;2) q值小于0.01。根据这些标准,中度干旱组在第3、4、5和10天的一个或多个时间点与对照组在C0时的差异表达(上调或下调)基因共1830个(附加文件)2).分别有665 (M3/C0)、1049 (M4/C0)、1455 (M5/C0)和659 (M10/C0)基因在各时间点表达差异显著(附加文件)3.).与C0相比,干旱处理组在干旱处理前期上调基因数呈增加趋势,从440(第3天)上升到757(第4天),在1025(第5天)达到最高,但随后下降到489(第10天)。干旱胁迫下基因数量也有显著下调的趋势,从第3天的225个下降到第4天的292个和第5天的430个,第10天下降到170个。我们的结果表明,适度干旱诱导了花发育过程中许多基因的表达改变,尽管这些花的形态在这种条件下看起来是正常的。
中度干旱早期应答基因在多种胁迫应答途径中起作用
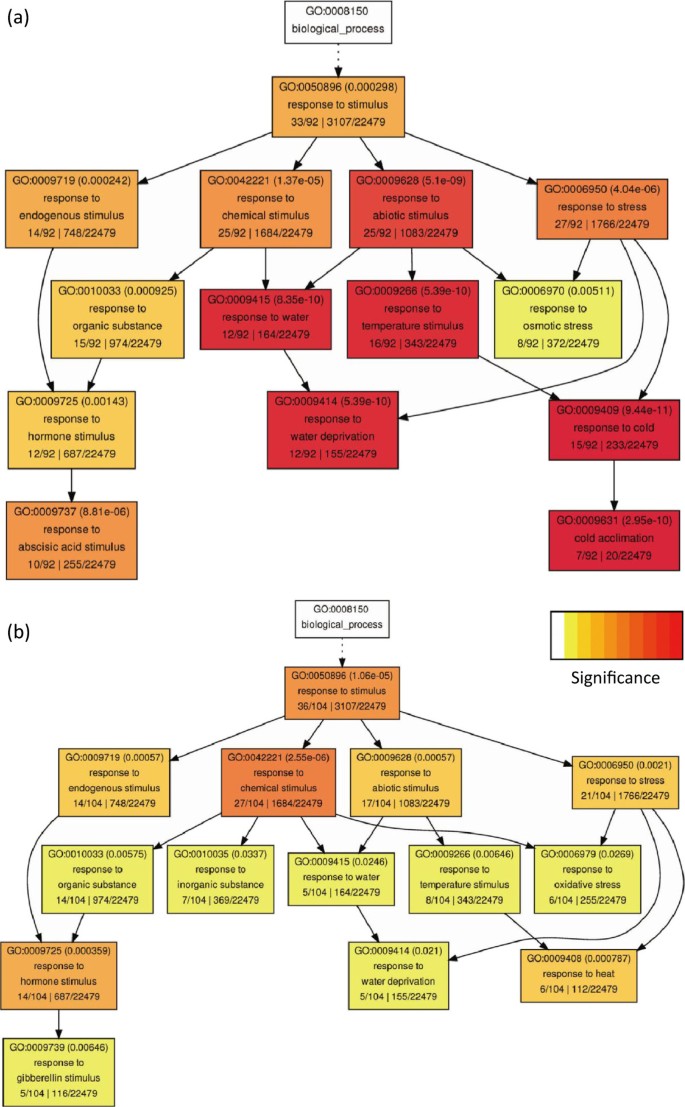
为了更好地了解植物对中度干旱的早期反应,我们进一步分析了第3天的转录组,此时土壤湿度达到45%-50%。由于干旱处理后植株继续生长,我们推断一些基因表达的变化是由于发育调控引起的,在中度干旱处理第3天(M3)和控制处理第0天(C0)之间,440和225个基因分别上调和下调(图3)3.b和e3c,附加文件4而且5).为了排除主要由于发育变化导致表达变化的基因,我们进一步比较了对照组(C3/C0)第3天和第0天的基因表达,发现440个上调基因中有189个表达差异,被确定为推定发育基因。我们进一步将干旱处理第3天的植株与对照C3进行比较,发现有251个基因显著上调。M3/C0和M3/C3比较中上调的两组基因中,两组中均有92个基因上调,认为是中度干旱诱导的基因。在第3天诱导的92个基因中,已知的基因与植物对缺水、冷、盐和ABA (ABA)刺激的反应有关(图1)4a),这与这些胁迫导致细胞水分损失和ABA对脱水反应的重要作用是一致的。我们还检测了在中度干旱条件下的前3天内被抑制的基因,发现有106个基因在两种比较中(M3/C0和M3/C3)都被下调,但在C3/C0比较中没有下调(图3.c,额外的文件5).GO分析显示,响应赤霉素、热、氧化应激和化学刺激的基因富集(图4b)。
对中重度干旱敏感基因的比较
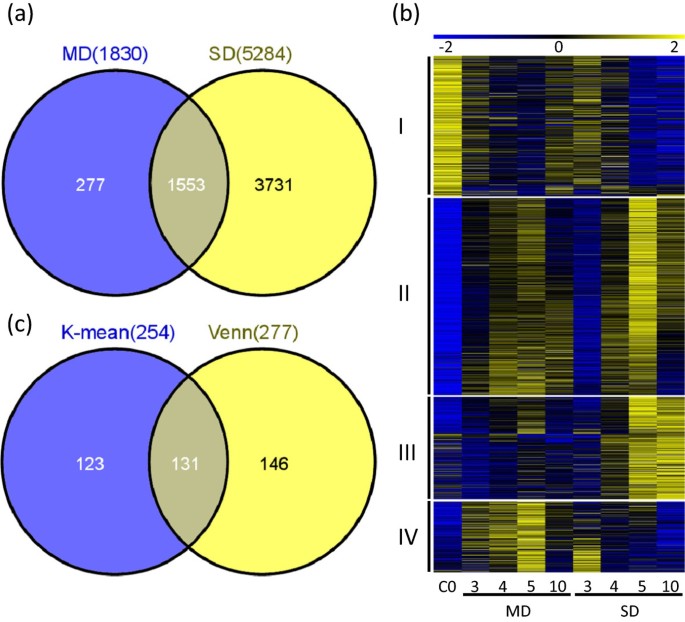
我们之前比较了严重干旱条件下(30-35%)的第3、4、5和10天的花序转录组与对照组[11,并发现了5284个基因显示差异表达(附加文件6).其中,1553个基因在两种干旱条件下均有差异表达,277个基因仅在中度干旱条件下有差异表达(图2)5一个额外的文件7).初步的层次聚类结果表明,有四个聚类;然后我们应用K-means方法将所有1830个基因聚类成4个簇(附加文件1).如图所示5B,每个簇中的基因都有不同的表达模式。cluster I在C0(未处理的第0天)表达量最高,表明它们在早期花序发育中发挥作用,但在两种干旱条件下均被抑制。集群II中的这些基因是由两种干旱胁迫诱导的,且在第5天的诱导程度更高,表明它们可能在两种强度的干旱胁迫下都发挥了作用。在严重干旱条件下,第5天较高的诱导水平进一步表明,在这种条件下,它们可能更活跃。此外,cluster III基因在重度干旱条件下表达量较高,而在中度干旱条件下表达量不明显,说明其功能在中度干旱条件下可能不活跃。有趣的是,最后一组基因的表达模式与cluster III相反:在中度干旱条件下表达水平相对较高。最后这两组基因强烈表明,对中度和重度干旱条件的分子和生理反应不仅在数量上不同,在表达变化水平上也不同,而且在质量上也不同,在基因组上也不同。中度干旱优先诱导的基因的存在,具体地指出了该植物用于应对中度缺水的不同程序。
为了比较这些集群之间假定的基因功能,我们检查了上述4个集群的GO类别。总的来说,响应刺激和花粉管生长的基因在所有簇中都富集,这与它们在严重干旱条件下的表达变化一致[11].在第I簇中,核小体组装的基因功能以及对GA和SA的响应被富集,这表明在中度干旱条件下观察到的茎伸长下降(图1)1b)可能是由于核小体组装减少,可能对转录产生影响,GA信号通路基因表达的减少与GA对茎伸长很重要这一事实相一致[23].SA信号基因数量的减少表明,中度干旱条件下的植物可能更容易患病。第二类基因在花粉管生长和缺水反应中富集,表明它们在两种干旱条件下的表达量升高都是重要的,可能是在中度干旱条件下几乎正常的生殖发育的原因。调控基因(包括调控转录的基因、ABA、GA、JA、ET、SA、IAA和缺水)在第3簇中富集,表明干旱越严重,转录组的变化就越大,部分原因是通过提高转录调控因子的活性和加强激素信号转导。有趣的是,与光合作用、色素合成和红光响应相关的基因在cluster IV中富集,它们在中度干旱条件下的表达量高于重度干旱条件。这表明,这些基因的功能增强可能促进了这些植物几乎正常的发育。
为了进一步研究在中度干旱条件下形态基本正常的最大繁殖产量可能与哪些基因有关,我们将在中度干旱条件下只有差异表达而重度干旱条件下没有差异表达的277个基因与K-means聚类分析的第IV类基因中的254个基因进行了比较。我们发现两组之间共有131个基因(图5c,额外的文件7),包括8个转录因子(表1).在这其中,NF-Y2,NF-Y8而且NF-Y10曾被报道为参与光合作用和干旱反应的调节因子[24- - - - - -26].另一种由中度干旱高度诱导的基因,SOC1,是下游开花的正向调控因子吗英国《金融时报》[27,28].MYB11它是R2R3基因家族的一员,主要作用于黄酮醇苷的积累[29中旱也有较大的诱发作用,而重旱则没有。这些基因表达量的增加表明,它们可能对开花和光合作用至关重要,从而确保在中等干旱条件下的繁殖成功。
浓缩的独联体-差异表达基因调控区域的元件
对应激反应基因的研究已经确定独联体-转录调控元件,如ABRE, MYBR和DRE基序[1,22,30.- - - - - -32].为了验证这些motif是否与应对中度干旱的差异表达基因相关,我们在所有1830个差异表达基因的启动子序列(起始密码子上游1 kb)中寻找已知的motif(附加文件)8).我们在启动子序列中发现了274个ABRE位点的基因(1639个为核心motif ACGT), 1220个为MYB结合位点(WAACCA), 242个为DRE motif (RCCGAC))。除了这些可能与干旱反应有关的已知结合基序外,我们还搜索了其他已知的结合基序独联体转录因子家族成员的作用调控元件:NAC家族(1378例核心结合基序为CACG)、MYC或bHLH家族(1776例典型E-box: CANNTG, 457例核心基序为G-box: CATGTG)和WRKY(346例结合位点为TGACY)。此外,在假定的序列中也发现了一些已知的与转录激活有关的共识,如TATA-box和CAAT-box。因为MYB, MYC, NAC和WRKY转录因子家族也包括一些成员,它们的功能与对环境胁迫的反应不同独联体-元素本身并不意味着调节压力信号。然而,结合应激诱导的表达与存在相关独联体——元素为此类监管提供了更有力的理由。
干旱对转录因子基因的诱导作用更大
结果表明,重度干旱对生殖发育的影响比中度干旱更明显。然而,目前还不清楚哪些基因以类似的方式被诱导,更多的是在严重干旱的情况下。通过比较重度干旱和中度干旱条件下的花序转录组,我们发现了在重度干旱条件下诱导程度更大的基因,尤其是在第2组中。从GO的结果中,我们了解到转录因子和转运体属于丰富的类别。我们重点研究了重度干旱条件下比中度干旱条件下表达量显著增加的基因,以及中度干旱条件下比充足水分条件下优先表达的基因(q < 0.01, 2倍变化)。在第3天,没有发现符合这些标准的基因,但在随后的时间点,发现了几个具有这种表达模式的基因(第4天14个基因,第5天62个基因和第10天26个基因)。这一趋势与我们的观察一致,即在最初干旱处理后短暂的停顿后,花的发育在第10天恢复1d)。
这一群体中的许多基因具有重要的分子功能,如转录调控(表2).例如,ATHB-7和ATHB-12基因是同一系统发育分支γ的成员,同源结构域与亮氨酸拉链基序紧密相连,在第4天表现出优先表达,这与之前的研究结果一致,即干旱或ABA在营养器官(根、叶和茎)中诱导表达[33].另外两个编码同源结构域因子的基因ATHB-2和ATHB-5也在这一集群中,利用同源结构域进行系统发育分析表明,它们属于δ类,与ATHB-7和ATHB-12接近[34].这四种蛋白质都属于同一类Ι HD zip蛋白质,并已被证明对ABA和盐胁迫在幼苗阶段的响应[34].因此,它们可能也参与了花发育过程中干旱胁迫的反应。
该集群中的几个转录因子基因是NAC家族的成员,共有102个基因拟南芥[35].干旱诱导了3个NAC基因,其中ANAC92属于NAM支。ANAC92在茎尖分生组织(SAM)的形成和发育中起作用,与CUC1冗余[36].另一项研究表明,ANAC92通过控制几个下游基因以阶段依赖的方式调控盐胁迫下的衰老[37,这与我们在这次干旱研究中观察到的情况类似。另外两个NAC成员是ANAC19和ANAC47,都是AtNAC3组的成员。以往的研究支持NAC蛋白在应激反应中的作用拟南芥和大米(11,25].
该集群中的其他转录因子包括HSF1、PLATZ、OZF1和OZF2。分区计划大纲与两个CCCH主题密切相关[38].两种OZF因子都是aba响应的,OZF2参与abi2介导的信号通路[39,40].这两个OZF可能是冗余的,以协助工厂应对各种压力。HSF1参与了对干旱和热胁迫的反应,但还需要更彻底的实验证实[41].
中度干旱诱导转运基因、aba依赖途径和繁殖
除转录因子外,许多其他基因也表现出对中度干旱敏感的表达变化。不出所料,许多基因编码转运蛋白表达水平升高(表3.).我们还发现,与雄性生殖、胚胎晚期发生和种子休眠相关的基因被激活。这组基因编码了四种保护其他蛋白质免受干旱影响的晚期胚胎发生丰富(LEA)蛋白,其中一些已知对干旱有反应(表)4) [41].有趣的是,一种叫做母效胚胎阻滞25(MEE25) udp -葡萄糖4-对映体酶编码也在这一组中,并被认为在男性生殖发育中起作用[42].在这组由中度干旱而非重度干旱诱导的基因中,还发现了另外两个雄性生殖基因,部分解释了之前在重度干旱下植物形态分析中观察到的干旱对开花的延迟影响[11].这些功能基因的鉴定表明,抗旱基因和抗旱基因都参与了花序对干旱胁迫不同程度的差异响应。
在许多关于植物发育的研究中,对不同胁迫做出反应的多条途径之间的相互作用已被证明[41].这并不奇怪,参与已知应激反应途径的已知基因也在这一组(表5).ABA信号通路是不同植物类群响应干旱胁迫的重要机制之一[16,43,44].在我们的研究中,我们还发现ABA信号通路中有8个基因的表达水平随着干旱程度的加剧而增加。此外,本研究还发现了响应低温和盐胁迫的基因,表明不同途径之间也存在串扰。
中度干旱而非重度干旱激活的基因
从形态分析中可以看出,中度干旱(50%)主茎产量下降不明显,重度干旱(35%)主茎产量下降明显(图3)1, (11])。这在一定程度上可能是由于一些基因是在中度而非重度干旱下诱导的。从我们的微阵列数据中,我们观察到第三簇中的基因具有相似的表达模式,在中度干旱下达到了最高的表达水平。按照严格的标准(2倍变化,q < 0.01),在MD中对照组和SD第5天表达升高的55个基因中,有4个编码核因子Y转录因子亚基的基因(NY-Fs,又称ccaat结合因子)(图5)6).在拟南芥有36个ccaat结合因子基因(10个NF-YA, 13个NF-YB和13个NF-YC),它们被认为是异质三聚体。在首次鉴定ccaat结合因子后拟南芥[45],少数研究报道了它们在发育过程中的作用,尤其是在开花过程中的作用[24,46];对各种胁迫的适应,包括干旱、渗透胁迫和营养剥夺[47,48];以及对植物激素(如ABA)的反应[49].我们进一步研究了NF-Y家族所有基因的表达情况,发现十个NF-YA中有七个在中度干旱条件下表达上调(图6).基于表达水平的层次聚类分析表明,NF-YA亚群对中度干旱更敏感。这可能是在适度的水分胁迫下,NF-YA (ccaat结合因子)被激活以维持生殖生长。
应对中度干旱和重度干旱的信号通路
如上所述,SD条件下有5284个基因被鉴定为差异表达,而MD条件下只有1830个基因被鉴定为差异表达。在这些基因中,两项研究都检测到了1553个基因。利用AgriGO软件,我们发现不同类别的GO被富集,包括转录调节子、转运体、酶和催化活性。与对照组相比,仅在SD条件下表达差异的组中也观察到类似类别的富集,除了“结合活性”的GO类别(图4).这一结果表明,植物应对不同程度脱水的机制可能是非常相似的。
85个转录因子在MD和SD条件下均有差异表达,包括DREB、NAC、AP2/ERF、MYB、bZIP、PLATZ、homeodomain、WRKY、zinc finger和HSF基因家族成员。除上述基因家族外,AGL和BEH家族中的基因也属于这一类。AGL家族普遍参与了花的发育过程,这与我们观察到的只有重度干旱而非中度干旱,显著影响了必要的发育过程并造成产量损失的结论一致。
为了寻找响应干旱的转录调控网络,我们研究了干旱条件下差异表达基因的启动子序列。我们在四个集群中搜索了超过100个已知的绑定图案(来自PLANTCARE)。有趣的是,ABRE和ABRE样结合基序在第2和第3簇中富集(均在前0.5 kb和1 kb内)。aba独立通路在中重度干旱响应中都非常重要,这并不奇怪。其他的结合基序,如E-box和G-box,也在这两个簇中富集,表明推测的转录因子,如bHLH家族中的转录因子,控制着两个簇中的一些基因。的浓缩独联体当我们在更长的序列(每个集群中3 KB的上游基因)中搜索时,-regulatory elements就不那么显著了。虽然NF-Y家族成员在第2簇中富集,但NF-Y的结合位点在任何使用不同长度的启动子序列的簇中都没有明显富集。然而,我们仍然在这一簇中发现了许多带有CCAAT基序的基因。
讨论
花序发育是影响植物产量的重要制约因素之一。在本研究中,我们采用中度干旱条件检测了植物的花序转录组,以识别植物应对干旱的基因活动,类似于最近关于重度干旱条件下转录组分析的研究[11].尽管此时干旱对生殖发育的影响还不能完全理解,甚至营养器官也可能在种子生成的成败中发挥重要作用,但两种不同水分亏缺条件下的转录组比较仍然可以让我们更好地了解花卉响应干旱胁迫的调控网络,以及植物适应不同干旱程度的不同策略。
生殖适应不同的干旱条件
中度干旱条件下,拟南芥在主茎上能获得正常的种子产量,与水分充足条件下的植株相似,但种子含量和萌发能力可能存在差异。主花序正常的繁殖能力,说明即使在不利的环境下,植株也能最大限度地利用有限的水资源,保证下一代的生产。在对。的研究中也做了类似的观察Allocasuarina luehmannii在中度干旱情况下植物的营养生长正常,但重度干旱情况下不正常[50].在天竺葵中,中度干旱对植株整体质量没有影响,但重度干旱导致单株花数减少[51].
在中度干旱、重度干旱和极端干旱条件下,植株主茎上的无菌角果可能是植株在极端不利环境下生存的重要策略。在这种极端的条件下,牺牲一部分繁殖结构将限制能源和水的使用,让宝贵的资源支持剩下的繁殖,生存到下一代。正如之前报道的那样,改变植物不同部位的氮和碳同化分布以维持生殖能力可能是对干旱的响应的一部分[52,53].
中度干旱条件下花序的转录重编程
虽然中度干旱在生殖发育过程中没有引起显著的形态变化,但与充足水分的植物相比,大量基因(1830)有差异表达。这可能是由于进化出的机制在不发生严重形态变化的情况下保护植物免受生物和非生物胁迫,特别是帮助植物应对温和的环境变化。其中包括响应刺激,尤其是ABA信号和水分剥夺的基因,以及在花粉管生长中起作用的基因,表明这两个方面的干旱响应对中等干旱条件下植物的生长至关重要。一种是通过激活那些参与花粉管伸长的基因来加速授粉和受精过程;另一个方面是促进和加强防御系统,以帮助植物更耐受干旱胁迫。因此,在中等干旱条件下,可能对花冠转录组的重编程至少在一定程度上对成功繁殖起着重要作用。
转录组对中度干旱和重度干旱的响应差异
转录组分析表明,中度和重度干旱都在花发育过程中诱导了显著的反应。核因子Y (NF-Y)由三个不同的亚基(NF-YA, NF-YB和NF-YC)组成。有趣的是,大多数编码NF-Ys的基因被发现在重度干旱下比中度干旱下诱导更多。而NF-YA亚家族的10个基因中有7个在中度干旱条件下被诱导,而在重度干旱条件下不被诱导,这表明它们可能在早期响应干旱胁迫和低强度干旱胁迫中发挥作用。例如,NF-YA 2、6、8和10在重度干旱条件下几乎没有被诱导,说明它们在中度干旱响应中具有特定的作用。在中度干旱条件下,NF-YA 3、5和9在3 d后诱导,而在重度干旱条件下诱导较晚(在第5 d后)(图2)6).nf - yb2和nf - yb3是水稻开花时间调节剂,在光周期依赖的开花调控网络中与花促蛋白CONSTANS (CO)互作,在水稻中也有报道称NF-YBs与MADS-box基因互作在体外分析(24,54].研究表明,NF-YA 5和nf - yb1具有促进水稻抗旱性的作用拟南芥[26,55].nf - yb6和nf - yb9调控早期胚胎发生和胚发育,并参与种子成熟拟南芥[49,56].在大豆(大豆l .)GmNFYA3是应对干旱的积极调节器[57].中nf - ya的附加实验拟南芥提出了它们通过正、负机制调节基因调控的作用[58].在仅由中度干旱引起的差异表达基因中,我们还发现SOC1 / AGL20中度干旱显著上调。这可能是由NF-Ys的诱导引起的,也表明SOC1可能是连接生殖发育和应激反应的重要节点。
与营养组织转录组的比较
为了了解生殖组织和其他组织之间受干旱影响的基因活动可能的相似性和差异性,我们将我们的结果与来自营养组织的其他转录组进行了比较。Harb等人研究了植物营养阶段对土壤干旱条件的早期响应的转录组拟南芥[59],发现2039个基因在应对中度干旱(Harb研究中30%的土壤容量)时差异表达,这与我们的研究中50%的土壤湿度时相似(附加文件9).在2039个基因中,有372个在我们的数据中也存在差异表达(1830个差异表达基因)(附加文件10),包括NF-Y2、NF-Y3、NF-Y5、NF-Y8和NF-Y10,表明NF-Y基因在水稻营养器官和生殖器官中对中度干旱的响应具有重要作用拟南芥.在Harb等人的研究中,仅在生殖转录组中存在差异表达的1458个基因中,与ABA、GA、缺水和ROS等刺激反应相关的基因高度富集(附加文件)9),这表明在不同的组织类型中可能也存在不同的调控途径或基因功能来应对干旱胁迫。需要进一步的努力来阐明不同组织类型对不同干旱程度反应的机制差异。
结论
总之,我们观察到,中度干旱不会导致繁殖产量的大幅下降,但会导致许多基因表达的改变,尽管比严重干旱下的情况下要少。通过对中度干旱和重度干旱转录组的比较,我们发现ccaat结合因子/NF-Ys是在中度干旱条件下特异诱导的,并可能在这种条件下具有特异功能。我们的结果表明,植物通过诱导许多基因来应对轻度水分胁迫,这些基因的功能可能在保护植物免受胁迫和确保在这种条件下的繁殖成功方面发挥重要作用。
方法
植物材料
本研究对Col-0进行了不同水分条件下的形态分析,已完成测序。按照我们之前研究的描述进行了干旱试验,并做了一些小改动[11].种子直接种植在含有100g土壤的花盆中,土壤由干土(Metro-Mix 360, Sun Gro Horticulture Canada Ltd)和绿色植物等级(Turface绿色植物等级,profile Products LLC)组成,体积比例为3:2。用称重法测量水分充足条件下90g持水量(定义为土壤含水量90%,田间持水量90%)。在混合土中分别添加70g、50g、40g、35g和30g水,以达到不同的水分亏缺状况。4℃黑暗分层2 d后,所有植株在正常生长条件(22℃,16 h/8 h,昼夜光周期~300 μmol m)的生长室中生长-2年代-1光子通量,60%的湿度),直到植株刚刚开始开花(可见抽苔,主花序茎约1cm,花蕾未开放),再经过不同类型的干旱处理,主茎约1cm高[11].然后观察用于形态分析的植株,直到几乎所有的角果成熟并准备收获(大约种植后50天)。
微阵列样品的制备方法如下:中度干旱(MD)和重度干旱(SD)处理从停水开始。在起始点(C0) 3 d后,土壤相对含水量降低到预期程度(MD: 50%, SD: 35%)。保持土壤水分状况(对照组30% ~ 35%、45% ~ 50%、85% ~ 90%)3、4、5、10 D(标记为D 3、D 4、D 5、D 10,从蓄水日开始)。然后从M和S干旱处理组和对照组采集未开放的花朵样本。每组在每个时间点从花序中收集2个生物重复。
我们的干旱试验条件是重要的,以获得重复性结果;不同的土壤条件或模拟渗透胁迫的化学处理可能导致不同的转录组变化。
微阵列实验
在Affymetrix基因芯片表达分析概述网站(http://www.affymetrix.com),合成cRNAas进行杂交,如所述[60].杂交、洗涤、染色、扫描和数据收集在宾夕法尼亚州立大学基因组学核心设施进行。
微阵列分析
RMA使用R中的Bioconductor包进行归一化处理,将所有表达值转换为以2为底的对数。然后我们用LIMMA软件包比较了对照花序和浇水充足花序的信号。以q值(FDR) < 0.01为统计标准,只选择2倍以上变化的基因。
MeV 4.9对共表达基因进行K-means聚类[61].利用log2中杂交信号归一化后的值进行K-means分析,根据每个基因值的均值的差值生成热图。为了鉴定差异表达基因的功能,我们从Affymetrix网站下载了ATH1芯片上的基因注释,使用了TAIR网站上的GO分类功能。为了验证某一类与全基因组相比是否富集,我们采用超几何检验,只有p值小于0.05的类别被称为统计富集组。
独联体-调控元素分析和GO分析
芯片上所有基因的可能启动子序列(起始密码子上游1kb)均来自TAIR网站。然后统计不同转录调控因子结合位点的数量。的识别独联体-规管结合位点由perl进行[62].结合基序来自Gene Regulation和PlantCARE [63].基因本体(GO)分析由agriGO软件完成[64].显著性条表示1 × 10的p值-1到1 × 10-10.
支持数据的可用性
支持本文结果的原始数据集可在基因表达综合库(GEO)中获得,该库的注册号为GSE55431 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE55431).服务干旱条件下转录组的数据和分析可以在GEO上找到,加入号为GSE40998 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE40998) [11].
缩写
- MD:
-
适度的干旱
- SD:
-
严重的干旱。
参考文献
- 1.
张建平,张建平,杨涛:植物抗旱性和耐盐性:胁迫调节转录因子及其在细胞转录网络中的功能意义。植物学报,2011,30(8):1383-1391。10.1007 / s00299 - 011 - 1068 - 0。
- 2.
抗旱性、水分利用效率和产量潜力——它们是相容的、不协调的还是相互排斥的?中国生物医学工程学报,2005,26(11):1159-1168。10.1071 / AR05069。
- 3.
利用茎干储备动员改善逆境下小麦籽粒灌浆。植物学报,1998,100(1-3):77-83。
- 4.
《种子和幼苗中脱落酸的信号传导》。植物细胞。2002,14:S15-S45。
- 5.
范德威勒CM,孢伦WG,夏普RE,巴斯金TI:生长拟南芥利用营养琼脂培养基控制水势研究水分亏缺条件下幼苗的生长。中国生物医学工程学报,2000,20(3):357 - 362。10.1093 / jexbot / 51.350.1555。
- 6.
熊玲,王瑞刚,毛刚,高山金美:利用遗传分析鉴定根系对干旱胁迫和脱落酸的耐旱性决定因素。植物生理学报,2006,42(3):1065-1074。10.1104 / pp.106.084632。
- 7.
Bohnert HJ, Nelson DE, Jensen RG:对环境压力的适应。植物细胞。1995,7(7):1099-1111。10.1105 / tpc.7.7.1099。
- 8.
Luan S:在保卫细胞中发出干旱信号。植物细胞环境。2002,25(2):229-237。10.1046 / j.1365-3040.2002.00758.x。
- 9.
刘志强,刘志强,刘志强:胁迫下植物开花时间调控的表观遗传过程。实验机器人。2011,62(11):3727-3735。10.1093 / jxb / err177。
- 10.
金勇,杨慧,魏泽,马慧,葛欣:干旱胁迫下水稻雄性发育的表型变化和阶段性依赖转录组重编程。Mol Plant. 2013, 6(5): 1630-1645。10.1093 / mp / sst067。
- 11.
苏智,马晓燕,郭辉,苏基兰,郭斌,苏志明,马慧:干旱胁迫下花的发育:植物的形态和转录组学分析揭示了干旱胁迫的急性响应和长期适应拟南芥.植物细胞。2013,25(10):3785-3807。10.1105 / tpc.113.115428。
- 12.
张志强,刘志强,张志强,等:土壤间断性干旱下根系信号传导和渗透调节对小麦产量的影响。农田作物学报,1999,62(1):35-52。10.1016 / s0378 - 4290(99) 00003 - 9。
- 13.
Gordon LJ, Finlayson CM, Falkenmark M:为粮食生产和其他生态系统服务管理农业用水。水资源管理,2010,97(4):512-519。10.1016 / j.agwat.2009.03.017。
- 14.
贾海峰,马HT,魏mj:城市水系最低生态需水量的计算及其配置——以北京中部地区为例。生态学报。2011,22(17):3271-3276。10.1016 / j.ecolmodel.2011.05.026。
- 15.
张建平,李建平,张志刚:干旱胁迫下植物代谢网络的研究进展。植物学报,2007,10(3):296-302。10.1016 / j.pbi.2007.04.014。
- 16.
张志刚,张志刚,张志刚:脱落酸合成及其信号传导机制的研究进展。中国生物医学工程学报,2011,21 (9):R346-R355。10.1016 / j.cub.2011.03.015。
- 17.
Lippold F, Sanchez DH, Musialak M, Schlereth A, Scheible WR, Hincha DK, Udvardi MK: AtMyb41调控拟南芥对渗透胁迫的转录和代谢反应。植物生理学报,2009,49(4):1761-1772。10.1104 / pp.108.134874。
- 18.
Hossain MA, Lee Y, Cho JI, Ahn CH, Lee SK, Jeon JS, Kang H, Lee CH, An G, Park PB: bZIP转录因子OsABF1是一个增强水稻非生物胁迫信号的ABA响应元件结合因子。植物生理学报,2010,30(4):547 - 551。
- 19.
Yoshida T、Fujita Y、Sayama H、Kidokoro S、Maruyama K、Mizoi J、Shinozaki K、Yamaguchi-Shinozaki K: AREB1、AREB2和ABF3是主转录因子,协同调控abre依赖的ABA信号,参与干旱胁迫耐受,需要ABA充分激活。植物学报,2010,61(4):672-685。10.1111 / j.1365 - 313 x.2009.04092.x。
- 20.
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D'Angelo C, Bornberg-Bauer E, Kudla J, Harter K: AtGenExpress全球胁迫表达数据集:UV-B光、干旱和寒冷胁迫响应的协议、评估和模型数据分析。植物学报,2007,50(2):347-363。10.1111 / j.1365 - 313 x.2007.03052.x。
- 21.
刘志强,刘志强,刘志强,等:阵列平台和生物信息学工具用于分析植物对非生物胁迫的响应转录组。方法生物医学杂志,2010,639:71-93。10.1007 / 978 - 1 - 60761 - 702 - 0 - _5。
- 22.
Rabbani MA, Maruyama K, Abe H, Khan MA, Katsura K, Ito Y, Yoshiwara K, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:利用cDNA微阵列和RNA凝胶印迹技术监测水稻基因在低温、干旱、高盐胁迫和aba胁迫下的表达谱。植物生理学报,2003,33(4):363 - 366。10.1104 / pp.103.025742。
- 23.
李松,程浩,王珂,王伟,何勇,何勇,罗军,王海波,张海波,彭军:赤霉素通过GAI/ rga样基因RGL2调控拟南芥种子萌发。中国生物医学工程学报,2002,16(5):646-658。10.1101 / gad.969002。
- 24.
Kumimoto RW, Adam L, Hymus GJ, Repetti PP, Reuber TL, Marion CM, Hempel FD, Ratcliffe OJ:核因子Y亚基NF-YB2和NF-YB3在拟南芥诱导长日光周期促进开花过程中发挥了附加作用。植物学报,2008,28(5):709-723。10.1007 / s00425 - 008 - 0773 - 6。
- 25.
Stephenson TJ, McIntyre CL, Collet C, Xue GP:TaNF-YC11是其中一个上调光的NF-YC成员小麦,与光合作用相关基因共同调控。浙江大学学报(自然科学版),2010,30(2):362 - 366。10.1007 / s10142 - 010 - 0158 - 3。
- 26.
李文霞,Oono Y,朱军,何晓军,吴建明,Iida K,卢晓阳,崔旭,金辉,朱克克:拟南芥NFYA5转录因子在转录和转录后调控下促进抗旱性。植物细胞。2008,20(8):2238-2251。10.1105 / tpc.108.059444。
- 27.
Searle I, He Y, Turck F, Vincent C, Fornara F, Krober S, Amasino RA RA, Coupland G:转录因子FLC通过抑制拟南芥分生组织能力和系统信号转导来响应春化开花。基因工程,2006,20(7):898-912。10.1101 / gad.373506。
- 28.
Immink RG, Pose D, Ferrario S, Ott F, Kaufmann K, Valentim FL, de Folter S, van der Wal F, van Dijk AD, Schmid M, Angenent GC:通过对SOC1上下行调控子的鉴定,表征SOC1在开花过程中的核心作用。植物生理学报,2012,30(1):353 - 356。10.1104 / pp.112.202614。
- 29.
Stracke R, Jahns O, Keck M, Tohge T, Niehaus K, Fernie AR, Weisshaar B:通过对拟南芥植物黄酮醇苷积累产物的分析,揭示了MYB11-、MYB12-和myb111 -不依赖的黄酮醇苷积累。叶绿醇,2010,188(4):985-1000。10.1111 / j.1469-8137.2010.03421.x。
- 30.
Seki M, Narusaka M, Ishida J, Nanjo T, Fujita M, Oono Y, Kamiya A, Nakajima M, Enju A, Sakurai T, Satou M, Akiyama K, Taji T, Yamaguchi-Shinozaki K, Carninci P, Kawai J, Hayashizaki Y, Shinozaki K:监测7000的表情谱拟南芥利用全长cDNA芯片分析干旱、寒冷和高盐度胁迫下的基因。植物学报,2002,31(3):279-292。10.1046 / j.1365 - 313 x.2002.01359.x。
- 31.
Shinozaki K, Yamaguchi-Shinozaki K, Seki M:干旱和低温胁迫下基因表达的调控网络。植物学报,2003,6(5):410-417。10.1016 / s1369 - 5266 (03) 00092 - x。
- 32.
黄光阁,马淑玲,白丽萍,张玲,马华,贾鹏,刘杰,钟明,郭志峰:植物在冷、盐和干旱胁迫下的信号转导。中国生物医学工程学报,2012,39(2):969-987。10.1007 / s11033 - 011 - 0823 - 1。
- 33.
李耀辉,春俊勇:一种新的同源结构域亮氨酸拉链基因拟南芥水分胁迫和脱落酸处理诱导的。植物化学学报,1997,37(2):377-384。10.1023 /: 1006084305012。
- 34.
H, Johannesson H, Johansson H, Hanson J, Engstrom P, Soderman E:拟南芥同源域亮氨酸zipper I类基因的表达模式和系统发育关系。植物生理学报,2005,30(1):349 - 356。10.1104 / pp.105.063461。
- 35.
Ooka H, Satoh K, Doi K, Nagata T, Otomo Y, Murakami K, Matsubara K, Osato N, Kawai J, Carninci P, Hayashizaki Y, Suzuki K, Kojima K, Takahara Y, Yamamoto K, Kikuchi S: NAC家族基因的综合分析栽培稻而且拟南芥.中国生物医学工程学报,2003,10(6):239-247。10.1093 / dnares / 10.6.239。
- 36.
高田S,平原K,石田T,田中M: The的杯状容器COTYLEDON1基因的拟南芥调节茎尖分生组织的形成。开发,2001,128(7):1127-1135。
- 37.
Balazadeh S, Siddiqui H, Allu AD, Matallana-Ramirez LP, Caldana C, Mehrnia M, Zanor MI, Kohler B, Mueller-Roeber B:盐促衰老过程中由NAC转录因子ANAC092/AtNAC2/ORE1控制的基因调控网络。植物学报,2010,62(2):250-264。10.1111 / j.1365 - 313 x.2010.04151.x。
- 38.
王东,郭勇,吴超,杨刚,李毅,郑灿:拟南芥和水稻中CCCH锌指家族的全基因组分析。中国生物医学工程学报,2008,29(4):449 - 456。
- 39.
Sanchez JP, Duque P, Chua NH: ABA激活ADPR环化酶,cADPR诱导ABA应答基因亚群拟南芥.植物学报,2004,38(3):381-395。10.1111 / j.1365 - 313 x.2004.02055.x。
- 40.
黄鹏,朱洪伟,闵建华,张欣,郑志刚,郑海生,金志刚:分子生物学和生理特性研究拟南芥锌指2是一种质膜蛋白,通过abi2介导的信号通路参与ABA和盐胁迫应答。植物生理学报,2012,53(1):193-203。10.1093 /卡式肺囊虫肺炎/ pcr162。
- 41.
L . Liang H, Shuman J, Shulaev V, Davletova S, Mittler R:当防御途径碰撞时:拟南芥对干旱和高温胁迫的反应。植物生理学报,2004,34(4):363 - 366。10.1104 / pp.103.033431。
- 42.
刘志强,刘志强,刘志强,刘志强,刘志强,刘志强Ds与雄性配子体发育和功能缺陷相关的插入突变体拟南芥.中国生物医学工程学报,2009,18(4):1369-1385。10.1534 / genetics.108.090852。
- 43.
Raghavendra AS, Gonugunta VK, Christmann A, Grill E: ABA的感知和信号。植物动态学报,2010,15(7):395-401。10.1016 / j.tplants.2010.04.006。
- 44.
Fujita Y, Fujita M, Shinozaki K, Yamaguchi-Shinozaki K: aba介导的植物对渗透胁迫的转录调控。植物学报,2011,24(4):509-525。10.1007 / s10265 - 011 - 0412 - 3。
- 45.
Edwards D, Murray JA, Smith AG:编码保守的CCAAT-box转录因子复合体的多个基因在拟南芥中表达。植物生理学报,1998,17(3):322 - 322。10.1104 / pp.117.3.1015。
- 46.
蔡晓霞,李志刚,陈德华,朱涛,吴勇:拟南芥中ccaat结合转录因子的表达及其调控机制研究进展。植物生理学报,2007,45(1):1 - 5。10.1104 / pp.107.102079。
- 47.
陈nz,张晓琴,魏鹏,陈庆军,任芳,陈杰,王晓春:AtHAP3b在花期调控中起着重要作用拟南芥在渗透压力。生物化学与分子生物学学报,2007,40(6):1083-1089。10.5483 / BMBRep.2007.40.6.1083。
- 48.
Nilsson L, Muller R, Nielsen TH:解剖植物转录组和磷酸盐剥夺的调节反应。植物生理学报。2010,39(2):129-143。10.1111 / j.1399-3054.2010.01356.x。
- 49.
Yamamoto A, Kagaya Y, Toyoshima R, Kagaya M, Takeda S, Hattori T:拟南芥NF-YB亚基LEC1和LEC1- like通过与种子特异性abre结合因子相互作用激活转录。植物学报,2009,58(5):843-856。10.1111 / j.1365 - 313 x.2009.03817.x。
- 50.
Posch S, Bennett LT:光合作用、光化学和抗氧化防御以应对两次严重干旱和重新浇水Allocasuarina luehmannii.植物生物(Stuttg)。2009,11(增刊1):83-93。
- 51.
张志强,张志强,张志强,等:不同灌溉条件下盆栽天竺葵叶片水分关系、气体交换、生长和开花品质的变化。植物生理学报,2009,16(5):467-476。10.1016 / j.jplph.2008.06.015。
- 52.
Chaves MM, Pereira JS, Maroco J, Rodrigues ML, Ricardo CP, Osorio ML, Carvalho I, Faria T, Pinheiro C:植物如何在田间应对水分胁迫:光合作用和生长。安机器人。2002,89规格号:907-916。
- 53.
张建平,王晓燕,王晓燕:水胁迫对羽扇豆茎叶碳氮代谢的影响[J] .植物生理学报,2004,19(3):393 - 397。10.1093 / jexbot / 52.358.1063。
- 54.
Masiero S, Imbriano C, Ravasio F, Favaro R, Pelucchi N, Gorla MS, Mantovani R, Colombo L, Kater MM: mmas -box转录因子和组蛋白折叠蛋白NF-YB之间的三元复合物形成。生物化学学报,2002,27(4):429- 429。10.1074 / jbc.M202546200。
- 55.
Nelson DE, Repetti PP, Adams TR, Creelman RA, Wu J, Warner DC, Anstrom DC, Bensen RJ, Castiglioni PP, Donnarummo MG, Hinchey BS, Kumimoto RW, Maszle DR, Canales RD, Krolikowski KA, Dotson SB, Gutterson N, Ratcliffe OJ, Heard JE:植物核因子Y (NF-Y) B亚单位赋予耐旱性,并导致在缺水的土地上提高玉米产量。中国科学:地球科学,2007,30(4):449 - 456。10.1073 / pnas.0707193104。
- 56.
朱克A,孟克G,吕滕T, Keilwagen J, Seifert M, Thi TM, Renou JP, Balzergue S, Viehover P, Hahnel U, ludwig1 - muller J, Altschmied L, Conrad U, Weisshaar B, Baumlein H:拟南芥叶子叶1发育过程中的延伸相关功能。植物学报,2012,71(3):427-442。
- 57.
倪震,胡震,蒋强,张洪:miR169的靶基因GmNFYA3是植物抗旱的正向调控因子。植物生理学报,2013,30(1):353 - 356。
- 58.
Leyva-Gonzalez MA, Ibarra-Laclette E, Cruz-Ramirez A, Herrera-Estrella L:转录组和功能分析揭示了拟南芥NF-YA家族成员介导的非生物胁迫耐受的适应策略。科学通报,2012,7 (10):e48138-10.1371/journal. One. 0048138。
- 59.
A:对拟南芥干旱胁迫的分子和生理分析揭示了植物生长适应的早期反应。植物生理学报,2010,34(3):349 - 356。10.1104 / pp.110.161752。
- 60.
张伟,刘伟,刘伟,张伟,赵丹,马红:拟南芥野生型和突变型花药基因的差异表达及其调控网络的研究。植物学报,2007,52(1):14-29。10.1111 / j.1365 - 313 x.2007.03217.x。
- 61.
杨超,徐智,宋杰,Conner K, Vizcay Barrena G, Wilson ZA:拟南芥MYB26/男性STERILE35调节花药内膜的次生增厚,对花药开裂至关重要。植物细胞。2007,19(2):534-548。10.1105 / tpc.106.046391。
- 62.
Jurgens G, El-Kasmi F, Pacher T, Strompen G, Stierhof YD, Muller LM, Koncz C, Mayer U:拟南芥SNARE蛋白SEC22是配子体发育和维持高尔基堆叠完整性所必需的。植物学报,2011,34(3):393 - 393。10.1111 / j.1365 - 313 x.2011.04487.x。
- 63.
潘瑞科(L)、德福尔特(S)、基弗尔(M)、霍纳(DS)、法alli C、Busscher J、Cook HE、Ingram RM、Kater MM、Davies B、Angenent GC、Colombo L:拟南芥MADS-box转录因子家族的分子和系统发育分析:MADS世界的新开放。植物细胞。2003,15:1538-1551。10.1105 / tpc.011544。
- 64.
杜智,周欣,凌宇,张智,苏中:agriGO:面向农业社区的GO分析工具。核酸。2010,38 (Web服务器版):W64-W70。
确认
我们非常感谢Craig Praul博士对我们进行微阵列杂交的帮助。感谢胡怡老师对植物的悉心照料和实验室的管理。我们感谢dr .的建议和评论。周晓帆,韩新伟,孙亚洲。微阵列数据分析。这项工作得到了美国能源部对H.M.的资助,以及生物系、哈克生命科学研究所、宾夕法尼亚州立大学和复旦大学的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
作者的贡献
HM和ZS设计了研究并监督了所有的实验。ZS和NLS进行了干旱试验。XM和ZS对微阵列数据进行分析,并对分析结果进行解释。XM, ZS和HM对结果进行了讨论并撰写了手稿。所有作者阅读并批准最终稿。
电子辅料
12870 _2014_1565_moesm2_esm.xlsx
附加文件2:中度条件下与对照组C0相比,在第3、4、5和10天任意4个时间点有差异表达的基因列表。(XLSX 717 KB)
12870 _2014_1565_moesm3_esm.xlsx
附加文件3:M3、C3、C0中上调基因的维恩图分析各组基因列表。(XLSX 19 KB)
12870 _2014_1565_moesm4_esm.xlsx
附加文件4:M3、C3、C0中下调基因的维恩图分析各组基因列表。(XLSX 15 KB)
12870 _2014_1565_moesm5_esm.xlsx
附加文件5:在严重干旱条件下,第3、4、5、10天4个时间点与对照组C0的差异表达基因列表。(XLSX 2 MB)
12870 _2014_1565_moesm6_esm.xlsx
附加文件6:中、重度干旱差异表达基因的维恩图分析各组基因列表。(XLSX 73 KB)
12870 _2014_1565_moesm7_esm.xlsx
附加文件7:中、重度干旱差异表达基因的维恩图分析各组基因列表。(XLSX 14 KB)
12870 _2014_1565_moesm8_esm.xlsx
附加文件8:差异表达转录因子1kb启动子区域顺式调控元件的统计分析。(XLSX 322 KB)
12870 _2014_1565_moesm9_esm.pdf
附加文件9:Harb等人对我们的差异表达基因与营养组织中DE基因比较的维恩图和GO富集分析(PDF 4 MB)
12870 _2014_1565_moesm10_esm.xlsx
附加文件10:中等干旱条件下营养转录组和生殖转录组中差异表达的372个基因的列表。(XLSX 217 KB)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇根据知识共享署名许可条款发布的开放获取文章(http://creativecommons.org/licenses/by/4.0),允许不受限制地在任何媒体上使用、分发和复制,前提是正确地注明原创作品。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
马,X,苏基兰,n.l.,马,H。et al。中度干旱导致显著的花转录组重编程,以确保成功的生殖发育拟南芥.BMC植物杂志14,164(2014)。https://doi.org/10.1186/1471-2229-14-164
收到了:
接受:
发表:
关键字
- 适度的干旱
- 严重的干旱
- 生殖发育
- 转录组
- 拟南芥