- 研究文章
- 开放访问
- 发表:
鉴定占优势基因Medicago Truncatula.制约结瘤Sinorhizobium Meliloti.菌株RM41
BMC植物生物学卷14.,物品编号:167(2014)
摘要
背景
豆科植物能够形成与固氮土壤细菌称为根瘤菌一个根瘤共生。这种共生显示特异性较高水平。除了豆类家族的特异性外,个体豆类物种/基因型只能与某些受限制的细菌种类或菌株进行相互作用。在这个系统中特异性是由两个共生的合作伙伴和可参与识别处理从而多个遗传机制之间复杂的信号交换调节。的分子机制控制共生特异性的知识可以使豆科植物固氮的遗传改良,并且还可以揭示限制非豆科植物根瘤共生的可能机制。
结果
我们筛选了一个核心集合Medicago Truncatula.几种菌株的基因型Sinorhizobium Meliloti.并确定了一个自然发生的显性基因,限制结瘤S. Meliloti.Rm41。我们将这个基因命名为Mt-NS1 (M。truncatulaN奥胺S.我们已经绘制了MT-NS1在上的一个小基因组区域内的基因座蒺藜苜蓿染色体8。这里报告的数据将有助于MT-NS1基因。
结论
共生特异性的进化涉及根瘤菌基因和寄主基因。从细菌方面来看,特异性决定因素包括Nod因子、表面多糖和分泌蛋白。然而,我们从主机方面知道的相对较少。最近,我们证明了大豆中这种特异性的一个组成部分是由植物NBS-LRR抗性定义的(R),其识别由根瘤菌共生体的III型分泌系统(T3SS)递送效应蛋白的基因。然而,在许多测序缺乏的T3SSS. Meliloti.菌株提出了一个问题,即特异性是如何在Medicago-Sinorhizobium系统超越了点头因素知觉。因此,克隆和表征MT-NS1这将为我们在豆科-根瘤菌共生中对结瘤特异性的遗传控制增加一个新的维度。
背景
豆科植物能够与固氮土壤细菌进入一种共生关系,统称根瘤菌。这种共生关系在根瘤形成时达到顶峰,根瘤为细菌提供了一个最佳的环境来固定大气中的氮供植物使用。据估计,豆科-根瘤菌共生可以固定一半以上的化肥工业产生的氮量[1].
豆科植物-根瘤菌的相互作用始于两个共生伙伴之间的分子对话[2].由豆科植物根部释放到根际黄酮类化合物吸引根瘤菌和诱导一组细菌基因的表达,被称为点头基因[3.- - - - - -5].酶是由点头基因使得已称为旋转染色剂(NOD)因子的细菌脂肪寡糖的合成和分泌[2,6].通过同源宿主受体对NOD因子的感知反过来激活了一套对细菌侵袭的适应性必不可少的主体反应[7- - - - - -10.].最早的一个植物反应的是根毛的卷曲,其捕获一个被称为定殖卷曲根毛[结构内根瘤菌11.,12.].它在这些陷阱部位内,发起和延伸的感染螺纹,通过该延伸,细菌通过该细菌被运输并最终释放到分开的皮质细胞被命名为结节原始的皮质细胞[5].在这些结节细胞内,细菌封闭在称为SymbioSomes的主膜结合室中并分化为氮气-固定菌体[13.,14.].在过去的十年中,许多植物基因已经在Medicago Truncatula.和Lotus对虾根瘤菌感染和结节发展所需的[15.,16.].这些基因的克隆和特性揭示了豆科植物中保守的结瘤信号通路[17.].
豆科毒细胞分解的重要特征是其高度特异性[5,18.- - - - - -20.].除了豆类家族的特异性外,个体豆类物种/基因型只能与某些受限制的细菌种类或菌株进行相互作用。该系统中的特异性可以在相互作用的多个阶段进行,从初始细菌感染和结节(Nodulation特异性)到与氮固定效率相关的后结节发育(氮固定特异性)[19.].理解共生特异性的分子机制将使主机或细菌的基因操作中,为了提高根瘤共生的农艺潜力。这可以通过延伸以高固氮效率或相反地细菌菌株的宿主范围,通过排除土著土壤菌株是高度竞争的结瘤,但具有低固氮能力来实现[20.].
根瘤共生关系的建立涉及植物和细菌之间一系列信号的交换。因此,共生特异性的遗传控制是复杂的,可能涉及多种机制[19.].人们普遍认为,宿主范围主要是由细菌Nod因子特异性识别由同源宿主受体测定(s)实施5,21.- - - - - -26.].然而,引起特异性改变的Nod因子受体的自然变异很少有文献记载。相比之下,在大豆和其他豆科植物中已经鉴定出了一些显性基因,它们利用特定的根瘤菌菌株限制结瘤[20.,27.- - - - - -30.].这些基因的显性性质类似于“基因对基因”对植物病原体的抗性[19.,20.,31.].我们已经证明,大豆中这种特异性的一个组成部分是由植物NBS-LRR抗性基因定义的,该基因识别由根瘤菌共生生物的III型分泌系统(T3SS)传递的效应蛋白[20.].然而,在许多测序缺乏的T3SSSinorhizobium Meliloti.菌株提出了一个问题,即特异性是如何在Medicago-Sinorhizobium系统超越了点头因素知觉。要解决这个问题,我们筛选了一个核心集合蒺藜苜蓿几种菌株的基因型S. Meliloti.并发现了一种自然产生的显性基因,MT-NS1,在蒺藜苜蓿制约结瘤S. Meliloti.Rm41。遗传映射实验表明MT-NS1是不是有可能是典型的R基因。因此,克隆和表征MT-NS1这将为我们在豆科-根瘤菌共生中对结瘤特异性的遗传控制增加一个新的维度。
结果与讨论
共生特异性的自然变化蒺藜苜蓿
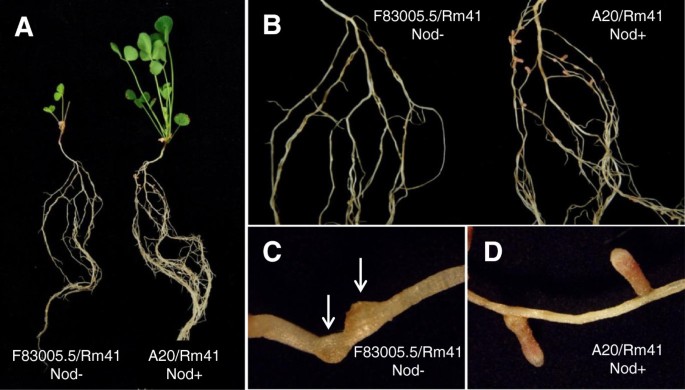
此前有报道称蒺藜苜蓿当具有不同根瘤菌[接种的植物显示出差固氮效率32.- - - - - -35.].然而,据我们所知,自然变异的结节特异性(即。,NOD +与Nod-表型)没有被良好记录。为了更好地了解遗传机制依赖于共生特异性的特异性蒺藜苜蓿-Sinorhizobium互动,我们筛选的31核心种质蒺藜苜蓿基因型使用这件S. Meliloti.菌株NGR34,NGR247,和RM41。这些植物基因型捕获宽范围的遗传多样性存在于天然群体蒺藜苜蓿[36.].本试验揭示了不同基因型-根瘤菌组合在结瘤能力和固氮特异性上的巨大差异1)。特别是,该筛选显示RM41无法授予植物基因型F83005.5和土耳其(图1),而相同植物的基因型与其他通常根瘤S. Meliloti.菌株。因此,我们假设存在宿主基因控制菌株特异性结瘤蒺藜苜蓿.为了对该系统的结瘤特异性进行遗传分析,我们选择了F83005.5,因为土耳其与其他几种杂交时不兼容蒺藜苜蓿基因型。
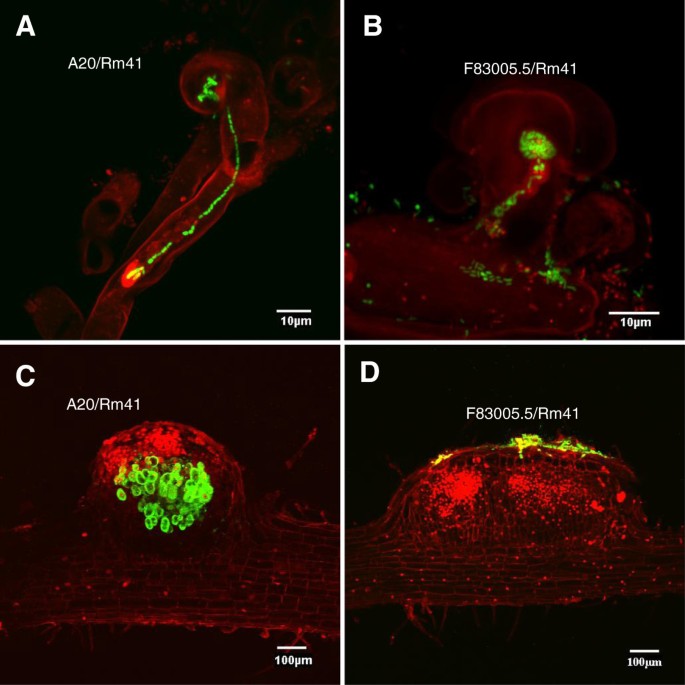
RM41诱导根毛卷曲和结节原基形成,但未能感染F83005.5的根源
S. Meliloti.Rm41是一种野生型菌株,最初从匈牙利紫花苜蓿根瘤中分离出来[37.].具体地,该菌株含有特异性的k抗原(也称为囊状多糖或KPS),其能够补偿缺乏缺失的含量(EPS)的产生,这通常是成功侵袭苜蓿根系上不确定的结节[12.,38.,39.].该RM41基因组最近已被测序,包括一个3.68-MB染色体的两个共生质粒(1.56-MB pSymA和1.66-MB pSymB),和一个246-kb的非共生质粒pRme41a [40].值得注意的是,类似于许多其他测序S. Meliloti.菌株,Rm41的基因组不具有编码III型分泌系统(T3SS)的基因,该系统将效应蛋白递送到宿主细胞[40]。检查感染过程,我们使用了来自稳定维持的质粒载体pHC60的组成型表达绿色荧光蛋白(GFP)的RM41菌株。虽然接种F83005.5的RM41未能诱导根结节形成,但无菌菌株能够诱导根毛卷发和结节原始地层(图2),提示点头因子知觉的早期反应未受影响。细菌可以正常地在卷曲的根毛上定植,偶尔,我们可以在F83005.5根上检测到流产的、异常的感染线(图)2B).然而,与Rm41和A20之间的兼容相互作用相反(图2a),在F83005.5的根部上从未观察到正常的感染线。与这些观察结果一致,尽管频繁存在细菌菌落对结节原金属的表皮表面(图形的表皮表面,但Nodule Primordia没有细菌含有细菌2D).由于没有感染,F83005.5根的皮层细胞分裂在早期就停止了,而在A20根上,感染根瘤原基在接种后4-5天内就很容易形成(图)2C).基于这些观察,我们得出结论,Rm41在F83005.5中限制结瘤是由于细菌感染阻断,而不是Nod因子感知失败。
胞外多糖的生产RM41的需要建立高效的互动共生蒺藜苜蓿
根瘤菌表面多糖,如胞外多糖(EPS)、荚膜多糖(KPS)、脂多糖(LPS)等,在菌-植物界面形成复杂的大分子结构,在建立宿主与细菌的共生关系中发挥重要作用[12.,19.,38.,41,42].特别地,这些多糖已经涉及在促进苜蓿中促进感染螺纹启动和延伸方面发挥关键作用S. Meliloti.互动[38.,43,44].尽管是符合符合符合符合符合符合的重要性,但是这些分子作为根瘤菌细菌的常见微生物相关分子图案(MAMPS),也可以在通过同源宿主模式识别受体(PRRS)上识别防御反应,因此可能与共生特异性相关。
我们接种了A20(NOD +),DZA045.5(NOD +)和F83005.5(NOD-)植物,RM41突变体在生产表面多糖的各种组分方面有缺陷。本研究中使用的突变体包括AK631,一个exoBEPS生产(EPS-)缺乏RM41的突变体;PP4709,A.rkp1突变体RM41在生产KPS (KPS-)和PP674的缺陷rkp1AK631突变体,同时缺乏EPS和KPS的生产(EPS-KPS-)(表2)。我们的数据显示PP4709(KPS-)表现得类似于野生型菌株RM41,并且通常可以促进A20和DZA045.5,表明kps生产RM41的核性标注蒺藜苜蓿基因型A20和DZA045.5。相比之下,AK631(ESP-)和PP674(EPS-KPS-)无法促使DZA045.5,AK631仅诱导了在A20 ROOS上的一些固定结节的形成,这表明EPS生产起着重要在建立高效共生的作用蒺藜苜蓿他们的角色不能由KPS来补充。我们的数据与Simesk等人的报告一致[35.].
无论是RM41的单也不是双突变体可以形成根瘤F83005.5,这似乎表明,F83005.5和RM41之间的不兼容性不与EPS和KPS生产相关。但是,我们不能排除EPS所需的结瘤在兼容的互动,而且在F83005.5背景引发的防御反应所必需的可能性。这种情况类似于致病菌的T3SS,为此T3SS需要在易感宿主引起疾病并用于引发在耐主机过敏反应,并在T3SS缺陷呈现的细菌是非致病性[45].
F83005.5中RM41的染色标注的限制由单个显性基因控制
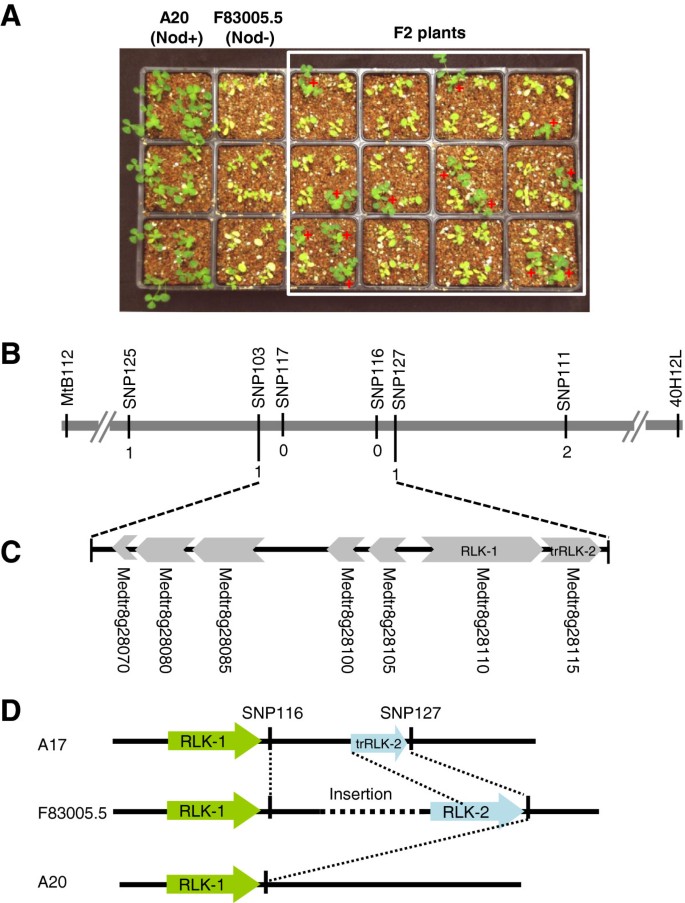
对于对瘤瘤特异性的遗传分析,我们使用了来自两者之间的交叉的F2群体蒺藜苜蓿基因型为A20和F83005.5。接种Rm41后,A20表现为Nod + Fix +表型。从总共2623个接种F2结瘤植物686株,符合3∶1(未结瘤与结瘤)的比例(χ2= 1.86,DF. = 1,P= 0.17;数字3.a),表明在F83005.5中通过单一显性基因来控制RM41的结节的限制。我们将这个基因命名为MT-NS1(for.蒺藜苜蓿1)与上述细胞学研究一致,该基因的显性性质表明,F83005.5的非结瘤表型不是由于Nod因子感知失败,而是类似于对病原体感染的“基因对基因”抗性。
的遗传作图MT-NS1.一个,A20的生长表型(NOD +,NS1 / NS1), F83005.5(点头,NS1 / NS1),和F2植物亚群后3周接种S. Meliloti.Rm41。在无氮条件下,结瘤植株呈绿色,健康状态,而非结瘤植株则表现出缺氮症状,叶片呈黄色。B,精细映射MT-NS1.当MT-NS1基因被分隔到标记SNP103和SNP127之间的基因组区域。数字表示重组断点的分离来自标记物的数目MT-NS1基于3900个F2植株的基因分型。C, Jemalong A17 50kb基因组DNA注释(Nod + Fix-,NS1 / NS1),覆盖候选基因区域,确定7个推定基因(Medtr8g28070-Metr8g28115)。D中,受体样Jemalong A17,A20,和F83005.5的基因组中激酶(Metr8g28110和Metr8g28115)的两个副本之间的插入/缺失多态性的鉴定。
的遗传作图MT-NS1
的遗传作图MT-NS1最初在A20和F83005.5之间的F2群体中进行,这使我们能够映射MT-NS1位点在8号染色体上,由侧翼标记MtB112和40H12L定义3.b)。然而,A20和F83005.5之间的极低水平的序列多态性阻止了我们使用该群体进行轨迹的精细映射。为了解决这个问题,我们开发了另一种来自DZA045.5(NOD + FIX +)和F83005.5的十字架的F2群体。
我们充分利用了蒺藜苜蓿基因组序列(46]开发高密度SNP(单核苷酸多态性)标志物的精细定位MT-NS1轨迹。SNP被通过转换为CAPS(酶切扩增多态性序列)标记物或通过直接测序任一基因型。表型分型,并使用SNP标记共3900种F2植物的基因分型使我们能够划定MT-NS1SNP103和SNP127之间的轨迹(图3.B),根据Jemalong A17 (Nod + Fix-)基因组序列,全长约50 kb。Jemalong A17的50 kb基因组序列包含至少6个预测基因Medicago Truncatula.基因组释放版本4.0(http://www.jcvi.org/medicago)(图3.c)。这些基因包括Medtr8g028070,三价铁螯合物还原酶样蛋白;Medtr8g028080,RNA酶T2家族蛋白;Medtr8g028085和Medtr8g028100,两个高度保守的蛋白与未知的功能;Medtr8g028105,一个A / G-特定腺嘌呤DNA糖基化酶样蛋白;和Medtr8g028110,富含亮氨酸重复受体激酶(LRR-RLK)。特别地,该LRR-RLK(Medtr8g028110;在这里,我们称其为RLK-1)在结构上类似于所述DMI2 / SYMRK直向同源物在所需要的两根瘤菌和菌根共生豆类,它由N末端信号肽的,胞外malectin样结构域包括三个富含亮氨酸的重复序列,跨膜结构域和细胞内蛋白激酶结构域[47,48].此外,存在串联复制- - - - - -RLK-1基因的截断(注释为Medtr8g028115;这里我们称之为trRLK-2)(图3.C).如下所述,存在一个大的插入/删除多态性围绕MT-NS1F83005.5与Jemalong A17之间的位点使候选基因的预测复杂化。
识别周围的插入/删除多态性MT-NS1座位
基于我们对致病和共生植物-微生物相互作用信号通路的了解,我们假设RLK-1是一个强大的候选基因MT-NS1.该基因可能作为一种受体,直接或间接地感知未知的细菌信号,进而触发宿主防御反应,阻止细菌感染。支持这一假设的另一个事实是该基因具有根特异性表达(数据未显示)。然而,我们没有检测到RLK-1的F83005.5和A20等位基因之间的任何表达和序列水平的多态性。由于参考基因型A17的表型为Nod + Fix- (NS1 / NS1),有可能ns1表示A17中的一个空等位基因。F83005.5的LRR-RLK基因有2个拷贝;一个对应于RLK-1,另一个匹配于A17中被截断的副本trRLK-2。这表明trRLK-2在A17中被截断,而在F83005.5中未被截断(图)3.d)。我们还发现,RLK-2在A20基因组缺失。两个串联拷贝之间的进一步的基因组测序揭示了三个基因组之间的插入/缺失多态性(图3.D). F83005.5插入的确切尺寸目前未知。我们正在对RLK-2等候选基因进行检测,但初步试验表明,转基因紫花苜蓿和蒺藜苜蓿含有RLK-2的根不能用Rm41抑制结瘤。因此,很可能NS1存在于F83005.5的插入中,身份未知。插入尺寸可能非常大,因为我们的长程PCR实验未能填补这一空白。为了解决这一问题,需要进一步的从其他基因型中提取序列。
结论
在豆科植物和根瘤菌之间建立成功的相互作用需要两个共生伙伴之间的信号识别。因此,共生特异性的进化涉及根瘤菌基因和寄主基因。从细菌方面来看,特异性决定因素包括Nod因子、表面多糖和分泌蛋白。然而,我们从主机方面知道的相对较少。对Nod因子信号的感知是通过与宿主Nod因子受体(NFRs)的直接结合介导的,NFRs是胞外域含有LysM基元的质膜定位受体激酶[49].通过转移来证明了NFR在调节宿主特异性方面的作用l .对虾版本的NFR.来蒺藜苜蓿,这使转基因蒺藜苜蓿根到具瘤l .对虾共生者慢生根瘤菌百脉[24.].然而,很少记录导致改变特异性的NFR的自然变化。相反,在大豆和其他豆类中鉴定了许多显性基因,这些豆类限制了具有特异性根瘤菌菌株的染色的豆类[20.,30.].我们最近克隆了两种大豆基因Rj2和RFG1.用特定的菌株来限制结瘤慢生根瘤菌和Sinorhizobium fredii分别[20.].我们证明了Rj2和RFG1.是编码植物抗性(R)蛋白toll -白介素受体/核苷酸结合位点/富亮氨酸重复序列(TIR-NBS-LRR)的一个等位基因。我们的发现与最近的报道一致,这些报道记录了根瘤菌T3SS向宿主细胞释放大量分泌的效应物,并表明根瘤共生关系的建立需要逃避根瘤菌效应物触发的植物免疫反应。
在这项研究中,我们已经确定了一种天然存在的显性基因,MT-NS1,在蒺藜苜蓿阻止染色S. Meliloti.并在克隆该基因方面取得了重大进展。Rm41基因组中t3ss编码基因的缺失提示MT-NS1不太可能编码一个R基因。与预测一致,我们没有确定典型R周围的基因同源MT-NS1轨迹。我们假设这一点MT-NS1可能编码了一种模式识别受体,介导了对根瘤菌MAMPs的特异性识别,从而导致宿主防御反应。因此,克隆和表征MT-NS1将提供新的见解结瘤特异性的在豆类的根瘤菌共生的遗传控制。
方法
菌株和生长培养基
本研究使用的根瘤菌包括野生型S. Meliloti.菌株Ngr34 [50],ngr247 [50],和RM41 [37.[几种RM41:AK631的几种突变株(exoB631, esp -), pp674 (exoB631/rpkA::Tn5, EPS-KPS-)和PP4409 (RPK1.:: TN5,KPS-)[51,52].用于荧光显微镜的RM41菌株含有PHC60 [42[稳定维持的质粒,其构成思考GFP。在28℃下在Ty琼脂培养基中生长菌株[53].抗生素以50μg/ ml用于露底霉素,200μg/ ml用于新霉素。
植物生长和结瘤试验
蒺藜苜蓿本研究使用的基因型列于表中1.开发了两个F2群体进行遗传定位MT-NS1;一个来自A20和F83005.5的杂交,另一个来自DZA045.5 x F83005.5的杂交。亲本和分离群体的幼苗在50-50的蛭石和土face混合物中生长,生长室设置22°C光照16 h, 20°C黑暗8 h。这些植物是在无氮条件下生长的。根瘤菌接种1周龄幼苗的根部进行结瘤试验;每个植株用1毫升光密度在600 nm处为0.1的细胞悬浮液浸种。接种3周后记录结瘤表型。
基因映射
用于遗传作图,我们首先使用SSR(简单序列重复)与已知的遗传位置标记来定位的近似位置MT-NS1.然后根据周围的基因组序列开发了其他标记MT-NS1轨迹。标记基于两个父母之间鉴定的SNPS(单核苷酸多态性)。为此目的,设计用于来自F2映射群的两个父母的基因组DNA的PCR扩增,然后测序PCR产物以鉴定序列多态性。可以在可能的情况下,转化为基因分型的盖子(切割的扩增多晶序列)标记物;否则,它们是通过直接测序的基因分型。
荧光显微镜
在荧光显微镜下,使用FV1000点扫描/点检测激光扫描共聚焦显微镜(Olympus)检测表达gfp的Rm41接种根后5-7天侵染线形成情况。显微镜分析前,用10mg /ml碘化丙啶复染1分钟。染色后,将根迅速浸入蒸馏水中冲洗,并将根固定在盖玻片下。荧光激发波长为488 nm,碘化丙啶为535 nm;通过GFP滤光片在520±15℃捕获和收集GFP排放;碘化丙啶发射在另一个通道使用520±15 nm的带通。图像采集分辨率为512 × 512像素,扫描速率为20 μs pixel-1。使用FLUOVIEW 1.5软件(Olympus)控制显微镜并输出图像。将结节或结节原基纵向切片至100-300 μm厚度,然后进行显微镜分析,观察细菌在皮层细胞中的定植情况。
参考资料
- 1。
福勒d,科伊尔男,斯基巴U,萨顿MA,普JN,雷斯S,谢泼德LJ,詹金斯A,Grizzetti B,加洛韦JN,Vitousek P,里奇A,Bouwman AF,Butterbach-巴尔K,Dentener楼史蒂文森d,阿曼男,沃斯L:在二十一世纪的全球氮循环。PHILOS反式 - [R志林斯顿乙生物科学。2013,368:20130164-10.1098 / rstb.2013.0164。
- 2。
费舍尔RF,龙SR:根序——厂房信号交换。《自然》1992,357:655-660。10.1038 / 357655 a0。
- 3.
长期SR:根序共生:点头因子的透视。植物细胞。1996年,8:1885年至1898年。10.1105 / tpc.8.10.1885。
- 4.
Peck MC,Fisher RF,Long SR:不同的黄酮类化合物刺激Nodd1结合点头基因启动子在Sinorhizobium Meliloti..中国微生物学杂志。2006,34(4):417- 427。10.1128 / JB.00376-06。
- 5.
王志强,王志强,王志强,等。共生性乱交的分子基础研究。微生物学报2000,64:180-201。10.1128 / mmbr.64.1.180 - 201.2000。
- 6.
Lerouge P, Roche P, Faucher C, Maillet F, Truchet G, Promé JC, Dénarié根瘤菌meliloti由磺化和酰化葡萄糖胺寡糖信号确定。自然科学。1999,344:781-784。10.1038 / 344781 a0。
- 7.
Amor BB,Shaw Sl,Oldroyd Ge,Maillet F,Penmetsa RV,Cook D,Long SR,DénariéJ,Gough C:NFP轨迹Medicago Truncatula.控制的Nod因子信号转导的早期步骤快速钙通量和根毛变形的上游。植物杂志2003,34:495-506。10.1046 / j.1365-313X.2003.01743.x。
- 8.
LysM结构域受体激酶调控根瘤菌Nod因子诱导的感染。中国科学:地球科学。10.1126 / science.1090074。
- 9。
Madsen EB,Madsen LH,Radutoiu S,Olbryt M,Rakwalska M,Szczyglowski K,Szczyglowski K,Sato S,Kaneko T,Tabata S,Sandal N,Stougaard J:Lysm类型的受体激酶基因涉及根瘤菌信号的豆科植物感知。自然。2003,425:637-640。10.1038 / Nature02045。
- 10。
Radutoiu S,Madsen LH,Madsen EB,Felle Hh,Umehara Y,Gronlund M,Sato S,Nakamura Y,Tabata S,Sandal N,Stougaard J:植物识别共生细菌需要两种Lysm受体样激酶。自然。2003,425:585-592。10.1038 / Nature02039。
- 11.
Esseling JJ, Lhuissier FG, Emons AM:点瘤因子诱导的根毛卷曲:向点瘤因子应用点的连续极性生长。植物生理学报。2003,32(4):492 - 498。10.1104 / pp.103.021634。
- 12.
Jones Km,Kobayashi H,Davies BW,Taga Me,Walker GC:Rhizobial Symbionts如何入侵植物:Sinorhizobium-Medicago模型。纳特冯微生物。2007年,5:619-633。10.1038 / nrmicro1705。
- 13。
植物细胞壁重构根序豆科植物共生关系。植物保护学报,2004,23(4):593 - 598。10.1080 / 07352680490480734。
- 14。
Limpens E,Mirabella R,Fedorova E,Franken C,Fransen H,Bisseling T,Geurts R:细胞器形成的n2豆科植物根瘤中固结共生体受DMI2控制。中国科学(d辑:地球科学),2005,32(5):591 - 598。10.1073 / pnas.0504284102。
- 15.
奥尔德罗伊德GE,哈里森MJ,Paszkowski U:重新编程的植物细胞内共生的。科学。2009年,324:753-754。10.1126 / science.1171644。
- 16.
Madsen的LH,Tirichine L,Jurkiewicz A,沙利文JT,AB的Heckmann,贝克AS,龙森CW,詹姆斯EK,Stougaard Y:管理模型中的豆科植物根瘤器官发生和感染的分子网络Lotus对虾.NAT Communce。2010,1:1-12。
- 17.
说,朋友,进入:促进植物有益共生关系的信号系统。微生物学报。2013,11:252-263。10.1038 / nrmicro2990。
- 18.
Broughton WJ,Jabbouri S,Perret X:对共生和谐的钥匙。Ĵ细菌学。2000,182:5641-5652。10.1128 / jb.182.20.5641-5652.2000。
- 19.
王栋,杨树华,唐飞,朱海峰:豆科植物-根瘤菌共生的共生特异性。微生物学进展。2012,32(4):434 - 442。10.1111 / j.1462-5822.2011.01736.x。
- 20.
杨S,唐˚F,高男,克里希南HB,朱H:R基因控制宿主特异性在豆科植物中共生。Proc Natl Acad Sci U S A. 2010,107:18735-18740。10.1073 / pnas.1011957107。
- 21。
Lewis-Henderson WR,Djordjevic Ma:培育品种特异性互动根瘤菌BV。三叶草和地下三叶草受到控制nodm.,其他细菌品种特异性基因和一个单隐性寄主基因。中国微生物学杂志,1998,16(4):427 - 434。
- 22。
Geurts R,Heidstra R,Hadri Ae,Downie Ja,Franssen H,Van Kammb A,Bisseling T:符号的豌豆参与一个结瘤因子感知机制,控制在表皮感染过程。植物理性。1997年,115:351-359。
- 23。
Spaink HP,Sheeley DM,Van Brussel AA,Glushka J,York Ws,Tak T,Geiger O,Kennedy EP,Reinholt VN,Lugtenberg BJ:一种新的高度不饱和脂肪酸部分的Lipo-Oligosachare信号确定宿主特异性根序.自然。1992年,354:125-130。
- 24。
Roche P, Debellé F, Maillet F, Lerouge P, Faucher C, Truchet G, Dénarié J, Promé JC:大肠杆菌共生宿主特异性的分子基础根瘤菌meliloti:nodH和nodPQ基因编码脂寡糖信号的硫酸化。细胞。1991,67:1131年至1143年。10.1016 / 0092-8674(91)90290-F。
- 25。
奥尔德罗伊德GE,唐尼JA:钙,激酶和豆类结瘤信令。NAT Rev Mol Cell Biol。2004年,5:566-576。10.1038 / nrm1424。
- 26。
Radutoiu S, Madsen LH, Madsen EB, Jurkiewicz A, Fukai E, Quistgaard EM, Albrektsen AS, James EK, Thirup S, Stougaard J: LysM结构域介导脂质寡糖识别,Nfr基因扩展了共生宿主的范围。中国海洋大学学报(自然科学版),2007,26:3923-3935。10.1038 / sj.emboj.7601826。
- 27.
考德威尔BE:大豆中菌株特异性无效结瘤的遗传。作物科学,1996,6:427-428。10.2135 / cropsci1966.0011183X000600050010x。
- 28.
Vest G, Caldwell BE:Rj4:大豆的基因调节无效结瘤。作物科学,2017,12:692-10.2135/作物科学,1972.0011183 x0012000500422x。
- 29.
TRESE:MCCALL Soybean中的单一主导基因可防止有效的染色Rhizobium Fredii.USDA257。中国科学:地球科学。10.1007 / BF00025618。
- 30.
帕克马:在豆类和根瘤菌的基础上的共同主义。我是nat。1999,153:S48-S60。10.1086 / 303211。
- 31.
Sadowsky MJ,Cregan PB,Rodriguez- Quinones F,keyser HH:微生物对基因对基因的影响 -根序昆虫。植物生态学报,1999,29(4):457 - 461。10.1007 / BF00011691。
- 32.
植物品系与品种的共生特性Medicago Truncatula.接种的菌株根瘤菌meliloti.植物营养学报,1998,12:173-176。
- 33。
Tirichine L, de Billy F, Huguet T:Mtsym6,一种基因调节Sinorhizobium菌株特异性固氮Medicago Truncatula..植物营养与肥料学报。2000,23(2):445 - 451。10.1104 / pp.123.3.845。
- 34。
Parra-Colmenares A, Kahn ML:氮固定效果的测定Medicago Truncatula.通过测量氮同位素掺入叶绿素分离。植物营养与肥料学报。2005,27(4):429 - 434。10.1007 / s11104 - 004 - 1308 - y。
- 35。
Simsek S, Ojanen-Reuhs T, Stephens SB, Reuhs BL:菌株生态型特异性Sinorhizobium Meliloti.-Medicago Truncatula.共生关系与琥珀聚糖寡糖结构有关。中国微生物学杂志。2007,29(6):733- 740。10.1128 / JB.00739-07。
- 36。
Stanton-Geddes J, Paape T,爱泼斯坦B, Briskine R,尤德J,玛吉J, Bharti AK,农民广告,周P,丹尼R, GD, Erlandson年代,Yakub M,同样是十六米,Sadowsky MJ,年轻的ND,午餐P:共生和农艺性状的候选基因和基因架构显示由全基因组序列关联遗传学Medicago Truncatula..公共科学图书馆。2013,8:e65688-10.1371/journal. pon. 0065688。
- 37。
Kondorosi A,Kiss GB,Forrai T,Vincze E,Banfalvi Z:循环连锁地图根瘤菌meliloti染色体。《自然》1977,268:525-527。10.1038 / 268525 a0。
- 38。
Pellock BJ,Cheng HP,Walker GC:苜蓿根Nodule入侵效率依赖于Sinorhizobium Meliloti.多糖。Ĵ细菌学。2000,182:4310-4318。10.1128 / JB.182.15.4310-4318.2000。
- 39.
Pálvölgyi A, Deák V, Poinsot V, Nagy T, Nagy E, Kerepesi I, Putnoky P:遗传分析RKP-3基因的地区Sinorhizobium Meliloti.41:rkpy.指导胶囊多糖的合成R5抗原生产。Mol植物微生物相互作用。2009,22:1422-1430。10.1094 / mpmi-22-11-1422。
- 40.
怀德S,Baumgarth B,Göttfert男,Jaenicke S,派勒A,Schneiker-Bekel S,塞拉尼亚Ĵ,Szczepanowski R,贝克尔答:基因组序列Sinorhizobium Meliloti.Rm41。基因组学通报。2013,1:e00013-12。
- 41.
生物信息学与生物信息学的关系。微生物学报,2009,7:312-320。
- 42.
Mathis的R,范Gijsegem楼德Rycke R,D'Haeze W,范Maelsaeke E,Anthonio E,凡蒙塔古男,枪套男,Vereecke d:脂多糖作为豆科植物内共生的进展的通信信号。国家科学院院刊美A. 2005年,102:2655至2660年。10.1073 / pnas.0409816102。
- 43.
一种新的胞外多糖可以替代钙氟结合胞外多糖在紫花苜蓿结瘤中的作用根瘤菌meliloti.牢房。1989,56:661-672。10.1016 / 0092 - 8674(89) 90588 - 6。
- 44.
Cheng HP,Walker GC:在苜蓿瘤的旋转中,感染螺纹的启动和伸长率需要琥珀酰胺根瘤菌meliloti.Ĵ细菌学。1998年,180:5183-5191。
- 45。
Büttnerd,他SY:植物病原细菌中III型蛋白质分泌。植物理性。2009,150:1656-1664。10.1104 / pp.109.139089。
- 46。
吉尔茨奥尔德罗伊德年轻ND Debelle F,通用电气,R,大炮某人,Udvardi可,Benedito VA,梅耶尔KF, Gouzy J, Schoof H, Van de同行Y, Proost年代,库克博士,迈耶斯公元前Spannagl M,张F, de Mita年代,克里斯V, Gundlach H,周年代,玛吉J, Bharti AK,默里JD, Naoumkina妈,罗森B,西尔弗斯坦KA,唐H, Rombauts年代,赵PX,周P等:Medicago基因组提供了深入了解根瘤菌共生的进化。《自然》,2011,48(4):521 -524。
- 47。
恩德雷G,Kereszt A,Kevei Z,Mihacea S,喀洛P,吻GB:A受体激酶基因调节共生根瘤发育。自然。2002年,417:962-966。10.1038 / nature00842。
- 48。
Stracke S,Kistner C,Yoshida S,Mulder L,Sato S,Kaneko T,Tabata S,Sandal N,Stougaard J,Szczyglowski K,Parniske M:细菌和真菌共生所需的植物受体样激酶。自然。2002,417:959-962。10.1038 / Nature00841。
- 49。
Broghammer A,Krusell的L,布莱斯男,绍尔Ĵ,沙利文JT,Maolanon N,Vinther男,的Lorentzen A,Madsen的EB,詹森KJ,Roepstorff P,Thirup S,龙森CW,Thygesen MB,Stougaard Y:豆科受体感知根瘤菌通过直接结合lipochitin寡糖信号分子。国家科学院院刊美A. 2012年,109:13859-13864。10.1073 / pnas.1205171109。
- 50.
Olsen P,Wright S,Collins M,Rice W:单克隆抗体面板之间的反应性模式根序菌株。申请环境微生物。1994年,60:654-661。
- 51.
Petrovics G, Putnoky P, Reuhs BL, Kim JS, Thorp TA, Noel D, Carlson RW, Kondorosi A:一种新型表面多糖的存在根瘤菌meliloti需要一个新的脂肪酸合成酶样基因簇参与共生结节的发育。微生物学报。1993,8:1093-1094。
- 52.
Putnoky P, Petrovics G, Kereszt A, Grosskopf E, Ha DTC, Banfalvi Z, Kondorosi A:根瘤菌meliloti脂多糖和胞外多糖在植物-细菌相互作用中具有相同的作用。中国微生物学杂志,1998,16(4):591 - 598。
- 53.
Beringer Je:R-Factor转移Remuminosarum..中华医学会微生物学分会微生物学分会。10.1099 / 00221287-84-1-188。
致谢
我们感谢博士。布拉德利L. Reuhs(普渡大学),凯瑟琳·M.·琼斯(佛罗里达州立大学),和彼得Putnoky(佩奇大学,匈牙利),用于提供S. Meliloti.本研究中使用的菌株。我们还感谢Jean-Marie Prossier博士(法国Inra)提供蒺藜苜蓿种子。这项研究是由来自肯塔基州科学与工程基金会以及来自农业部,美国农业部和食品研究计划(以HZ)授予的资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
赫兹构思了该项目。JL,SY和QZ进行了实验。Hz写了稿件。所有作者均阅读并批准最终手稿。
作者为图像提交的原始文件
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
刘,J.,杨,S.,郑,问:等等。鉴定占优势基因Medicago Truncatula.制约结瘤Sinorhizobium Meliloti.应变Rm41。BMC植物杂志14,167(2014)。https://doi.org/10.1186/1471-2229-14-167
收到了:
接受:
发表:
关键词
- 豆科植物
- Medicago Truncatula.
- 有节特异性
- 固氮作用