摘要
背景
在开花植物中,已经鉴定了许多基因,其控制从植物生成阶段的生成阶段的过渡。在代表陆地植物基底血管的苔藓中,几乎没有关于控制这种转变的机制的数据。来自苔藓苔藓的两种物种 - 苔藓Physcomitrella patens.和利物革Marchantia polymorpha.正在进行先进的分子和基因研究。本研究的目的是鉴定雌雄异株地叶植物中与雌配子体发育和颈卵器产生相关的基因Pellia endiviifolia物种B,其代表简单苯体肝曲线的最基谱系。
结果
RDA-cDNA技术的效用使我们能够鉴定在女性个人中特别表达的三种基因P.endiviifolia:PenB_CYSP半胱氨酸蛋白酶的编码,PenB_MT2和PenB_MT3编码神秘的抄本1和2orf分别为143和177个氨基酸残基。所有三个基因的外显子-内含子结构已经被描述,并对pre-mRNA的加工进行了研究。有趣的是,五种mRNA异构体是由PenB_MT2基因,由第二和第三外显子内的选择性剪接产生。所有观察到的剪接事件都发生在5'UTR内,不会干扰编码序列。这三种基因都只在雌性个体中表达,无论它们是在体外培养的还是从自然栖息地收集的。此外,我们观察到颈卵器组织中所有三个基因的转录本水平比生长在自然环境中的同一雌性菌体的营养部分增加了10倍,这表明它们与颈卵器的发育有关。
结论
我们已经确定了三种专门表达的基因P.endiviifoliaSP B雌性配子蛋白。此外,它们的表达与女性性器官分化相连,并且在发育中受到调节。所识别的基因的贡献对于成功的肝脏性繁殖可能是至关重要的。
背景
低等植物(如苔藓植物)的配子体是独立于孢子体进行分化和发育的自由生物,而开花植物的配子体是在孢子体的花器官内完成发育的[1].在开花植物中拟南芥蒂利亚纳,从孢子体相到配子蛋白酶的转变包括两个连续过程,孢子发生和配子发生。已经以几种高血管植物物种鉴定了许多基因,该物种在雄性和雌性配子体形成的许多不同步骤中起重要作用[2,3.].在土地植物的基础血统中,苔藓苔藓,苔藓Physcomitrella patens.已成为分子研究的模式生物,以了解其生命周期从营养阶段过渡到生殖阶段的关键时刻的控制机制。一些位点是多梳抑制复合物2 (polycomb repression complex 2, PRC2)的组成部分,已经被描述为与这些过程相关。冈野和同事已经证明了这一点PPCLF.(卷发叶)基因表达诱导繁殖器官的发展,同时抑制孢子素干细胞引发[4].也PPFIE.基因(施肥独立endosprem)已经涉及在配子体发育中。PPFIE蛋白在单倍体中的聚细胞中积聚在单倍体中的细胞中,并在配方化合物中的消费者期间经历命运过渡的细胞中。在缺少...之下PPFIE.,营商过度增殖并且无法发展植绒的配子体或达到生殖阶段[5].植物激素,植物素的重要性也据报道,触发了不同的生理反应,例如氯豆类转变为Caulonema转变[6,茎伸长[7]和生殖器官发展[8].苔藓2像Homeobox(knox2)转录因子一样打结的关键作用是为了防止Meiosis之前从二倍体胚胎的发育[9[表示在建立陆地植物中产生的交替方面的knox2演化的关键作用。
Liverworts被认为是目前生活的土地植物生物的最古老的血统[10.].由于它们在进化中的独特地位,利物套物可以作为调查性生殖涉及的机制的分子基础的模型。在迪西时期Marchantia polymorpha.,单倍体染色体组由8个常染色体和单一性染色体,女性和男性中的x x [11.- - - - - -13.].在这种脱衣性物种中对性繁殖的过渡是在环境控制下,并且可以通过暴露于远红光来引起的[14.]或按长日条件[15.].为了解马钱菊的性别决定和性别分化机制,对未成熟雌性和雄性性器官的ESTs进行了分析。在1059个非冗余ESTs中,选择了346个作为男性文库唯一的est, 713个作为女性文库唯一的est。在女性EST样本中,有5个与凝集素基因家族成员相似。在仅在男性收集物中发现的ESTs中,有两种cdna与其他生物体有性生殖相关的基因序列相似:变压器-2(Tra2.)基因,参与性别的决定果蝇黑胶基,以及vitellogenin来自鬣鳞蜥的基因安乐pulchellus[16.,17.].自从M.polymorphaESTs被发现是较差的RNA深度测序策略被应用于提供关于一系列组织和发育阶段的转录组的有价值的信息[18.]与转录因子家族表达剖面[19.].在马尔尚蒂亚,结合培养和显微镜技术,用于进行基因操作的分子工具已经出现m . polymorpha作为一种新的植物基因组测序系统[20.].m . polymorpha属于班级地钱纲,包含具有最复杂的Thalli和性器官组织的利物曲线动物[21.].与来自班级的利物枝相比,这种分类反映了它们相对较年轻的进化年龄Jungermanniopsida.系统发育研究表明,今天的祖先的祖先具有简单的Thalloid身体计划,其具有若干特征特征,包括楔形顶级细胞,没有米子,球形胶囊和大规模塞拉10.,22.].所有这些Plesiomorphic功能展示Pellia endiviifolia,属于课程的脱衣实物种Jungermanniopsida。雄性和雌性Thalli分别是表型相同,直到性器官分别分别分化,蚜和群。这些配子臂通过表皮细胞的去脱皮细胞外产生,并在单倍体雄性或雌性配子细胞的晶粒表面上发生[23.,24.].之前我们已经证明了四个基因在雄性叶苔的菌体中特异表达p . endiviifolia此外,其中两个基因的表达受发育和环境的调控[25.].在本文的论文中,我们继续研究参与该肝脏性繁殖的基因,主要研究与雌性配子体发育和颈卵器产生有关的基因。利用RDA-cDNA技术,我们鉴定了3个基因特异性表达的女性个体P.endiviifolia.此外,它们在轴颈组织中的表达高于在天然栖息地生长的同一女性植物的营养部分中的十倍,从而为所有三种基因表达水平展示了适当的archegonoIa发育的关键作用。
方法
植物材料
女性和雄性笨蛋P.endiviifolia收集并如[25.].
RDA-cDNA,表达谱分析,RACE和基因组行走实验
所有的实验都按照前面描述的那样进行[25.]有几种修改。产生archegonia的雌性配子体被用作作为驾驶员的测试仪和男性配子体产生蚜虫。使用以下定量测试仪进行四轮减去杂交/扩增,以驱动器比率:1:100用于第一轮,1:800,第二轮,第三轮和第四轮的1:400000。识别表达基因的片段(选择为DPIV.设计了4对正、逆寡核苷酸引物(附文件)1:表S1)。反应被标准化为P.endiviifoliasp BACTIN1表达级别(GenBank:DQ100290)[25.].扩增片段的引物Penb_tua1.采用RT-PCR和real-time PCR方法分析男性个体特异性表达的基因转录本(GenBank: HQ634388),作为男性特异性表达的标记物[25.].引物放大A片段p . endiviifolia组蛋白H4基因(FJ266087.1) [26.[转录物用于RT-PCR和实时PCR分析,以显示雌性的较稳定的RNA代谢水平。
替代拼接五个mRNA同种型PenB_MT2基因
从中分离出总RNAP.endivifolia在第三季(2008年)从自然栖息地采集的产颈卵器的雌性菌体。real-time PCR技术重复3次,检测特异性mRNA亚型PenB_MT2基因使用异形种类特异性引物(附加文件1:表S2)。以下热曲线用于实时PCR:95℃,10分钟;40个循环:15 s,95℃,62℃,1分钟。所有反应均具有等同的效率,可允许计算待计算的五种mRNA同种型的丰度[100×MT2_N /(MT2_1 + MT2_2 + MT2_3 + MT2_4 + MT2_5)](附加文件2:图S1)。
生物信息学分析
通过NCBI / Genbank / Blast搜索进行核苷酸和推导的氨基酸序列的数据库搜索[27.].为了确定所选基因编码的预测蛋白氨基酸序列的相似性,使用CLUSTALW2程序[28.].使用BOXSHADE 3.21程序可视化排列[29.].利用MotifScan搜索特定的氨基酸序列[30.], InterProScan [31.]和聪明[32.] 程式。预测氨基酸序列的亚细胞位置分配了YLOC [33.plantloc [34.].用Protparam工具评估各种物理和化学蛋白质性质的计算[35].利用FGENESH程序建立所选基因的外显子-内含子结构[36]使用cDNA和相应的基因组序列的对准。通过encesilico折叠识别元服务器分析由所选基因编码的预测蛋白质的氨基酸序列[37].PenB_CYSP蛋白的模型使用I-Tasser Server完成[38].使用Metadisorder预测内在疾病[39].
Genbank登录号码
将所选基因的全cDNA序列和基因组序列提交至GenBank: KF853593 - KF853600。
结果
雌性特异性表达基因的cDNA片段的分离P.endiviifolia使用RDA-cDNA方法的SP B B配子化合物
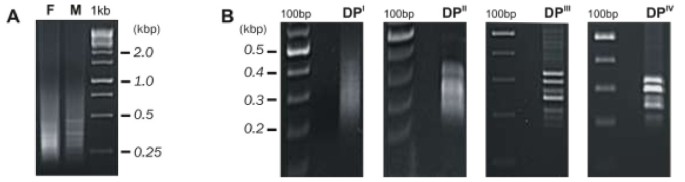
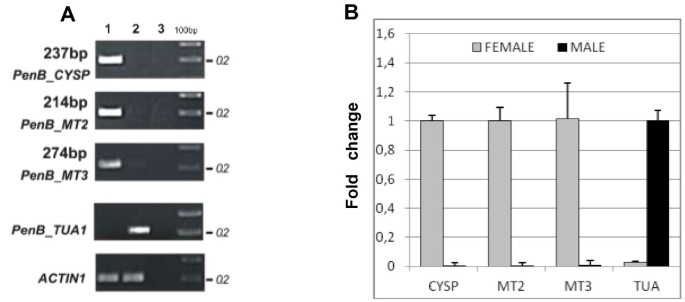
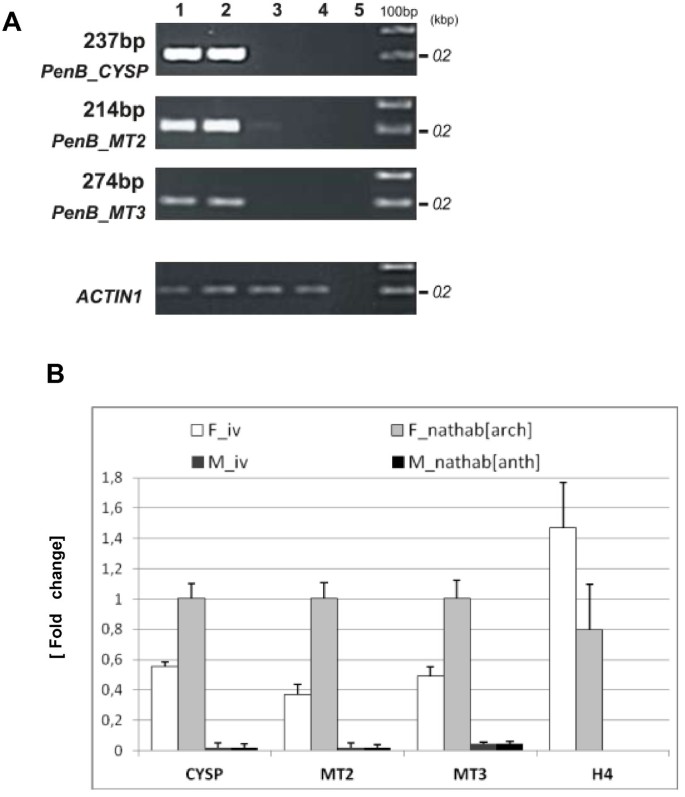
RDA-cDNA技术用于DIARECIOUSLIVERWORTP.endiviifoliaSP B识别涉及雌性的基因和Archegononia开发。在两个季节(2006和2007)期间,从自然环境中收集的Liverwort Thalli获得的CDNA用于四轮减肥杂交。从产生archegonia的雌性配子体中分离的RNA获得的cDNA用作从从阳性的雄性配子体中分离的RNA获得的测试仪和cDNA作为驱动器。虽然初始男性和女性扩增子(图1a)彼此目测难以区分,在每个连续的减毒杂交循环中逐步降低产品的复杂性(DP一世- DP.IV., 数字1B)当CDNA产物在1.5%琼脂糖凝胶中分离电cDNA产物时,观察到。DP.IV.获得产品的不同频带,范围为200至350磅(图)1B)。这些DP.IV.克隆并测序cDNA片段。最后,我们获得了四个编码不同转录本的个体序列。以确定这四个独立的cDNA片段是否代表四个基因P.endiviifoliaSP B在Liverwort雌性Thalli中特别表达,基于获得的DP设计了四个引物对IV.序列(附加文件1:表S1)。以RDA-cDNA实验所用RNA为模板,进行半定量RT-PCR分析。4株DP中有3株在雌配子体中表达IV.产品(图2cDNA序列分别为:237 bp、214 bp、274 bp。此外,这些片段在从雄性菌体中提取的cDNA中不存在(图2a,泳道2)另外通过实时PCR实验证明(图2B)。
在女性中特异性表达的基因的表征P.endiviifoliasp b paspetophytes及其成绩单
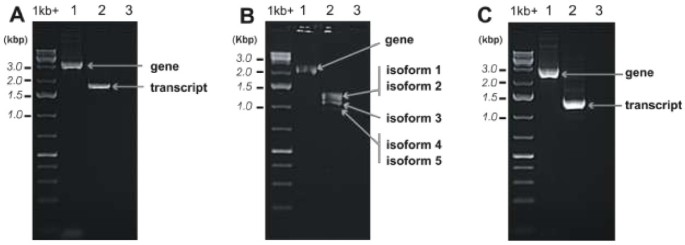
为了了解基因结构及其相应的三种选定的RDA-cDNA片段的转录物,进行5'/ 3'种族和基因组步行实验。我们鉴定了研究的三个转录物的5'和3'cDNA结束。在所有案例中,使用用于5'和3'族的引物根据RDA-cDNA实验中获得的三种选定的片段序列设计。为了证明最长的5'和3'转录物末端属于相同的转录分子,我们使用专为5'和3'端的最长赛产品的底漆进行所有三个转录物的RT-PCR(附加文件1:表S3)。对于所有转录物,我们获得了图中所示的预期产品3.(分别使用从产生achegegonia的雌性配子体中分离的RNA和没有产品时(附加文件)3.:使用从产生痰的雄性配子体中分离的RNA分离的RNA,图S2,通道A2,B2和C2。
最初使用根据三个选定的RDA-cDNA片段序列设计的引物进行基因组行走研究。在基因组序列中发现了连续的基因组步骤,直到远端5'和3'cDNA结束序列。为了证明所识别的基因组片段是相同基因的部分,我们使用从最长赛产品的5'和3'末端使用从雌性Thalli分离的基因组DNA作为模板来对所有三种基因进行PCCR。使用PCR扩增并分离电泳的全长基因如图所示3.(分别为A1、B1、C1道)。另外,以雄性菌体基因组DNA为模板进行PCR反应,发现这三个基因在两个雄性菌体中都存在(附加文件)1:表S3,附加文件3.:图S2)和雌性基因组(图S2)3.).
将cDNA核苷酸序列与相应的基因组序列进行比对,我们可以确定选定的三个基因结构,包括外显子/内含子连接和非翻译区(utr)位置。此外,利用blastx搜索技术将完整的cDNA序列与公共数据库中保存的序列进行比对,以确定与所鉴定基因最近的同源性。这些分析只揭示了其中一个的相似之处P.endiviifoliasp B基因与植物已知的C1 -木瓜蛋白酶家族编码半胱氨酸蛋白酶的基因(PenB_CYSP).两个基因,PenB_MT2和PenB_MT3,显示与在公共数据库中注册的序列没有相似性,这就是我们称之为这些基因的原因神秘的成绩单-公吨.三个cDNA片段,237bp,274 bp,214bp表示碎片PenB_CYSP,PenB_MT2和PenB_MT3基因分别。
分子和生物信息学特征PenB_CYSP
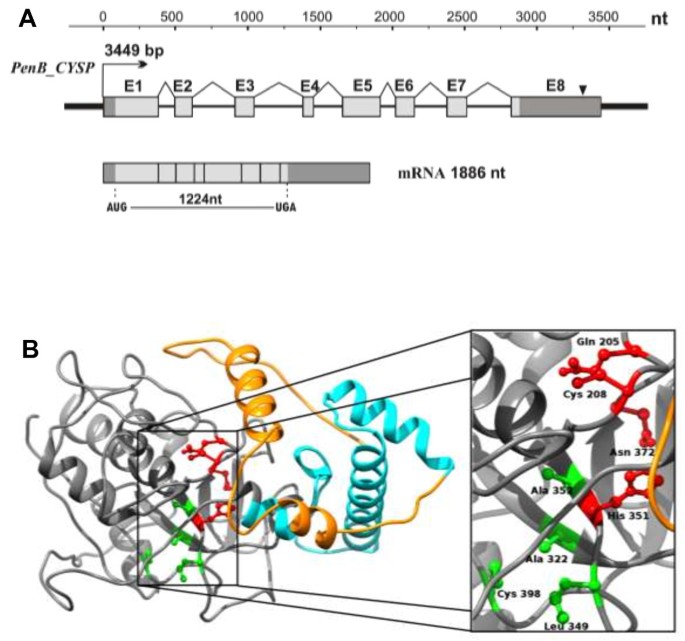
结构的结构PenB_CYSP基因及其成绩单总结在图中4A. mRNA是1886nt长,包括1224nt长ORF,73nt长5'UTR和586nt长3'UTR。在该基因内,我们预测了一种由AataAA序列组成的一种多腺苷酸化信号(从止芯沉积件,TGA下游318nt)。这PenB_CYSP基因是3449 bp长,含有八个外显子(387bp,122bp,134bp,74 bp,265 bp,132bp,139 bp,633 bp,七种内含子(117 bp,298 bp,339 bp,193 bp,95 bp,220 bp,301 bp)。的子PenB_CYSP编码408 AA长蛋白,其分子量为45.29kDa和4.97的预测pi。PENB_CYSP蛋白显示48-53%的身份(E-Value> 2E-105),以从中获得已知的植物半胱氨酸蛋白酶家庭成员Physcomitrella patens.,Platycodon grandiflorus,番茄茄,烟草,玉米,和A.Thaliana.(附加文件4:图S3)。MotifScan、InterProScan和SMART分析显示了一个双结构域结构,c端肽酶C1结构域[187-403 Aars, PF00112和SM00645]和n端组织蛋白酶前肽抑制剂I29结构域[99-155 Aars, PF08246和SM00848](图)4B).在肽酶C1结构域内,C1家族肽酶Cys和His的催化残基存在,形成催化二体[C208和H351]。另外两个残基在催化中起着重要作用:一个Gln [Q205]位于催化Cys之前,被认为有助于氧阴离子空穴的形成;和一个Asn残基[N372],它指向催化His的咪唑环。S2亚基是半胱氨酸蛋白酶(残基A322, L349, A352, C398)的主要底物特异性口袋。底物链上的大体积疏水或芳香残基优先占据S2亚位点[40].抑制剂I29结构域也发现在各种肽酶前体的N末端,其中它形成穿过基底结合位点的α-螺旋结构域,防止基板的进入。通过蛋白水解裂解除去该区域导致酶活化。在一个或多个拷贝中,还发现该域名在各种半胱氨酸肽酶抑制剂中,例如来自大西洋鲑鱼的雄素[41].基于同源性建模(图4b),似乎半胱氨酸蛋白酶的催化和S2亚基口袋在Penb_cysp中保存。另一方面,应该强调的是,需要通过进一步的生化实验来确认有关该蛋白质的功能作用。PENB_CYSP蛋白亚细胞定位的预测显示,在切割和激活之前,由于信号肽(位置1-38 AARS),该蛋白质最有可能与GOLGI设备,内质网或真空膜结合。与预测的亚细胞定位的相似性与预测的亚细胞定位一起可能表明PENB_CYSP可能负责在其合成或损坏或错误折叠蛋白质的合成或降解期间控制适当的蛋白质折叠。
PenB_CYSP基因及其转录本结构和PenB_CYSP蛋白同源性的基础模型。(一)的示意图PenB_CYSP基因及其转录本。外显子由盒子,内含子按线代表;深灰色盒子表示5'和3'UTRS;浅灰色盒子表示编码序列。黑色三角形表示生物信息鉴定的多腺苷酸化信号。(b)基于PenB_CYSP蛋白的同源模型。模型采用基于7PCK模板(左图)的I-Tasser服务器构建。前92个N末端残基(橙色)代表组织蛋白酶原可变区(因此这部分模型是最不可靠的,主要是基于二级结构和跨膜螺旋抑制)。这个区域包含假定的信号肽和跨膜结构域。接下来是肽前抑制剂结构域I29(青色),残基93-157。其余的蛋白组成组织蛋白酶肽酶C1结构域(灰色)。右边放大的C1结构域的盒状部分包含有重要残基(红色)和S2口袋残基(绿色),负责底物特异性结合。
分子和生物信息学特征PenB_MT2
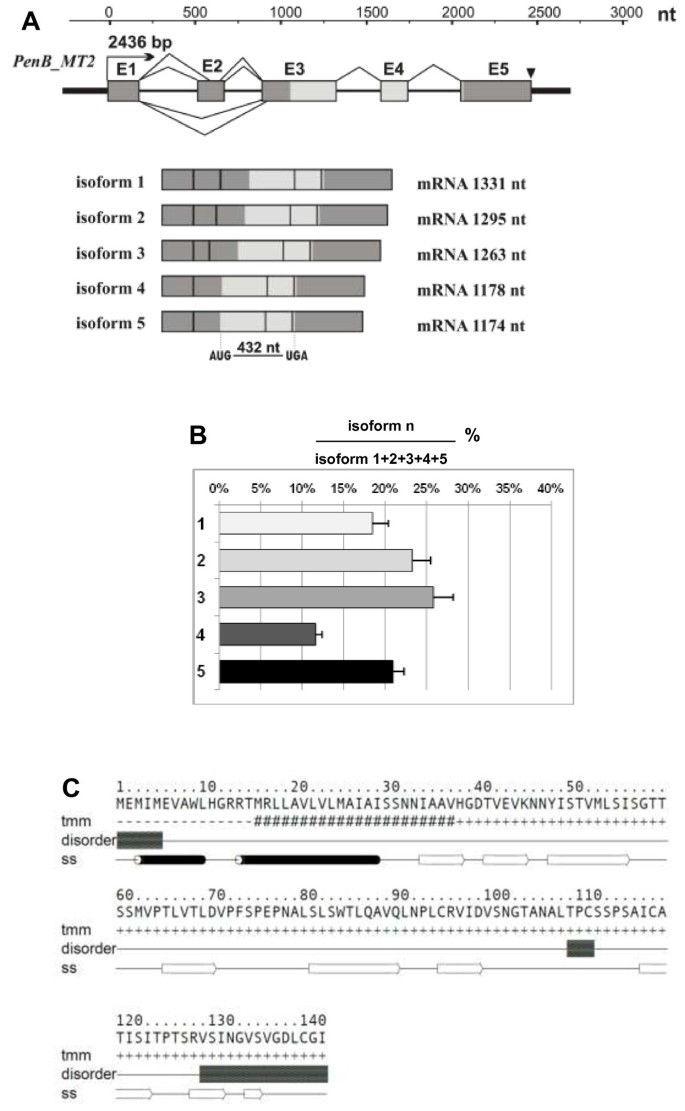
这PenB_MT2基因长度为2436 bp长,含有五个外显子(181bp,153bp,431bp,157bp,409bp)和4个U2型内含子(335bp,215 bp,255 bp,300 bp)。结构的结构PenB_MT2基因及其五个mRNA亚型的概述见图5A. 5个mRNA亚型与基因组序列的比较揭示了产生5个mRNA亚型的可变剪接事件。所有观察到的可变剪接事件都发生在5'UTR中,并且不干扰假定的编码序列,该序列有429 nt长。最长的亚型1是1331 nt长。第二个较短的亚型(1295 nt)是2外显子内部5 '供体位点选择的结果,从3 '端消除36 nt。相反,第三个亚型(1263 nt)是2外显子内部3 '受体位点选择的结果,从5 '端消除68 nt。第四个(1178 nt)和第五个亚型(1174 nt)是由外显子2的跳跃性产生的,其中,亚型5由于外显子3内额外的3 '受体位点选择而缩短了4 nt。所有亚型都有一个相同的3'UTR区域(398 nt),有一个预测的聚腺苷化信号ATTAA(终止密码子TGA下游184 nt)。采用qPCR方法检测5种mRNA亚型的相对表达量PenB_MT2轨迹。如图所示5B,主要同种型2和3代表23和25%,同种型1和5约18%和20%,而第四个同种型仅占11%的11%PenB_MT2分别转录物。基因5'UTR内的多样性使得表达的变化取决于每个替代5'UTR中包含的调节元件的性质,或在每个替代的5'UTR二级结构上。然而,使用不同的生物信息工具,我们无法识别所描述的替代5'UTR内的任何已知的调节区域或二次结构。
PenB_MT2基因,其mRNA同种型结构,RT-QPCR分析mRNA同种型丰度,以及PEN_MT2蛋白二级结构的模型。(一)的示意图PenB_MT2基因及其五个mRNA亚型。所有名称均与图中相同4.实时荧光定量PCR分析五种选择性剪接异构体PenB_MT2基因p . endiviifoliaSP B雌性Thalli生产的archegonia(b).材料是在第三季(2008年)从自然栖息地收集的。计算显示了三个技术重复的平均值±SD。(C)PenB_MT2蛋白的氨基酸序列。跨膜(tmm)和二级结构(ss)预测代表了来自GeneSilico metaserver的一致预测;黑色的桶代表α螺旋,白色的箭头代表β层。本质非结构残基(无序)是由GeneSilico metdisorder预测的。
的子PenB_MT2编码一个143 AA长推测蛋白,计算分子量为15.03 kDa,预测pI为5.49。通过检索不同的公共数据库,对推导出的氨基酸序列进行相似性评价,发现与已知氨基酸序列没有相似性。InterProScan程序分析显示,在预测蛋白的n端区域存在一个假定的真核信号肽[1-30 Aars]与跨膜结构域[15-35 Aars]重叠(图)5C)。尽管没有保守的结构域和主题,或者可以找到任何与已知结构的同源性,但二次结构预测程序反复预测该序列主要由β-股(除了含有跨膜螺旋的N-末端信号序列)组成。这与蛋白质障碍预测一致,在序列内没有找到重要的区域。通过使用ProtParam程序,确定最常见的氨基酸残基是丝氨酸(12.6%),缬氨酸(11.2%),亮氨酸(10.5%),苏氨酸(9.1%)和丙氨酸(每次8.4%).使用不同生物信息工具的细胞定位预测显示预测的蛋白质可能分泌到细胞外空间。占用,PenB_MT2最有可能代表具有未知折叠和功能的结构化蛋白质。
分子特征和生物信息学PenB_MT3
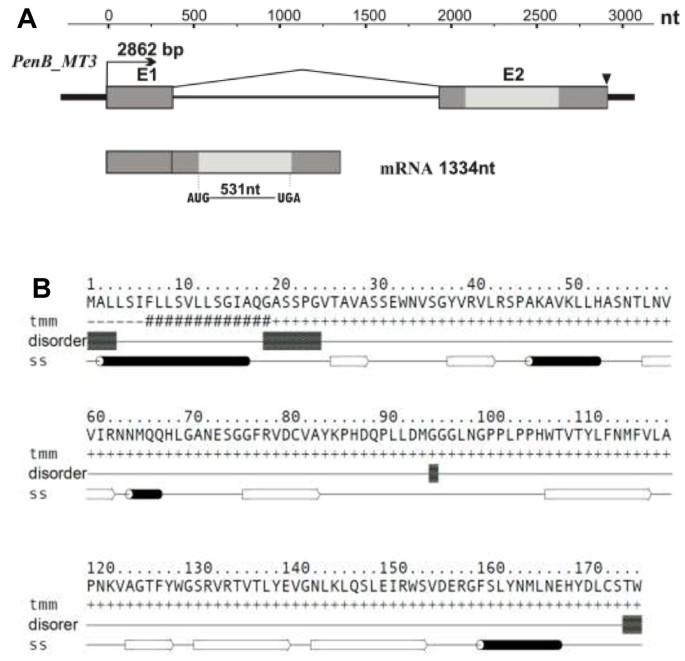
结构的结构PenB_MT3基因及其成绩单总结在图中6一个。PenB_MT3转录本全长1334 nt,包括一个长531 nt的ORF、一个长523 nt的5’utr和一个长277 nt的3’utr。在该基因内,我们预测了一个聚腺苷酸化信号ATAAA(终止密码子TGA下游250 nt)。这PenB_MT3基因长2862 bp,包含2个外显子(分别为376 bp和958 bp)和1个u2型内含子(1528 bp)。的子PenB_MT3编码177AA长蛋白,其计算分子量为19.51kDa和预测的8.5的pi。通过检索不同的公共数据库,对推导出的氨基酸序列进行相似性评价,发现与已知氨基酸序列没有相似性。另一方面,类似于PenB_MT2,二次结构预测程序预测由α-螺旋和β股(图中的β-股)构建的复杂的保守的二级结构元素图案(图6B). InterProScan程序分析显示,在预测蛋白的n端区域存在一个推定的真核信号肽序列[1-19 Aars]。利用ProtParam程序确定最常见的氨基酸残基为亮氨酸(13.6%)、缬氨酸(10.2%)、丝氨酸(9.0%)和甘氨酸(8.5%)。然而,对于富含亮氨酸、缬氨酸或丝氨酸的蛋白质来说,没有保守的结构域或基序。利用不同的生物信息学工具进行的细胞定位预测表明,所预测的蛋白含有靶向信号序列,且不偏好细胞间隔。
PenB_MT3基因,其mRNA结构和Pen_MT3蛋白二级结构模型。(一)的示意图PenB_MT3基因及其转录本。所有名称均与图中相同4.(b)预测PENB_MT3蛋白的氨基酸序列。跨膜(tmm)和二级结构(ss)预测代表了来自GeneSilico metaserver的一致预测;黑色的桶代表α螺旋,白色的箭头代表β层。本质非结构残基(无序)是由GeneSilico metdisorder预测的。
PenB_CYSP,PenB_MT2和PenB_MT3基因表达是雌性特异性的,并受生长条件调节
对于三个基因PENB_CYSP,PENB_MT2和PenB_MT3鉴定为在RDA-cDNA方法中产生性器官的女性和雄性个体之间鉴定为差异表达,通过半定量RT-PCR和实时PCR技术进行进一步的表达模式分析。女性和男性的几个发育阶段p . endiviifolia用不同条件下生长的sp B进行RNA分离:(1)体外培养无颈卵器的雌性菌体;(2)从自然生境采集产生颈卵器的雌性菌体;(3)体外培养无精子器的雄性菌体,(iv)从自然栖息地收集的雄性Thalli产生蚜虫(附加档案5:图S4)。因为在环境中生长的女性和雄性的配子体彼此无法区分,直到性器官区分,我们无法在我们的基因表达分析中使用这些发育阶段。
半定量RT-PCR分析表明,所有三种基因都在体外培养的雌性配子体中特异性地表达,并且在产生archegonia的雌性配子体和在自然栖息地生长(图7A,分别是1号和2号车道)。此外,这些转录本在雄性菌体中未被检测到(图)7实时荧光定量PCR实验显示,在自然环境中生长并产生颈卵器的雌性菌体中,所有研究的基因转录本都有更高的积累(图)7相比之下B)。PENB_CYSP,PENB_MT2和PenB_MT3在体外培养的雌性菌体中,基因表达降低了约50%,无颈卵器产生.该观察结果表明了定义的生长条件P.endiviifolia在特定基因表达水平中具有重要作用。成绩单水平的差异PENB_CYSP,PENB_MT2和PenB_MT3体内和体内生长的雌性配子素之间的基因可能反映其转录调节机制的一些破坏。体外培养的雌性配子体中的较低的转录物水平可能是缺乏来自在自然栖息地生长或后果中种植的配子体中观察到的水平的自然环境中的一些特异性药剂的结果缺乏archegonia。我们测试了任意选择的水平H4组蛋白基因表达p . endiviifolia雌性配子体既可在无菌条件下生长,也可在自然环境下生长。在这两种情况下,qPCR分析显示相同水平的H4转录物(图7B).因此,这三个基因转录本在体外培养的雌性菌体中表达水平较低并不反映RNA代谢的普遍下调。
转录水平PenB_CYSP,PenB_MT2和PenB_MT3基因受生长条件调节。(一)成绩单水平PenB_CYSP,PenB_MT2使用半定量RT-PCR分析。RNA在一个独立的实验中被分离出来:雌性Thalli在体外培养(泳道1),雌性Thalli从天然栖息地(泳道2)收集的群,雄性Thalli在没有植物体外培养(泳道3),和雄性Thalli从自然栖息地(泳道4)收集的蚜虫。通过半定量RT-PCR分析了雌性Thalli中三种鉴定基因的特异性表达。在泳道5中示出了负控制,100bp梯子位于凝胶的右侧。(b)通过RT-qPCR分析这3个基因在雌性菌体中的表达情况。所有的转录水平被归一化ACTIN1.所有的转录水平被归一化ACTIN1。作为对照基因表达的可比性,在测试的雌性菌体引物扩增组蛋白片段H4被使用。计算显示了三种技术复制的平均值±SD。
PenB_CYSP,PenB_MT2和PenB_MT3基因表达在自然栖息地生长的雌性配子体的初始部分中强烈升高
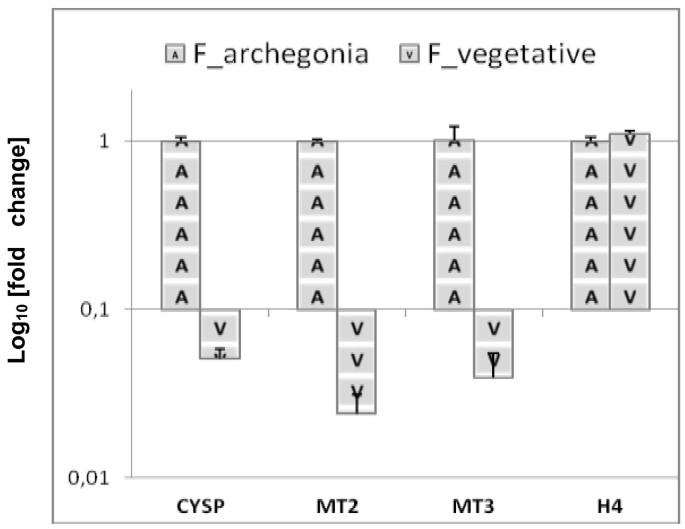
研究PenB_CYSP,PenB_MT2和Penbmt3.体内生长的雌性植物的基因具有与弓粒度发展的阳性相关性,进行定量实时PCR实验,以测试雌性配子体的营养和生殖部位中的三个基因转录物水平。轴承区域与避难区束[3 cm×3cm大小,附加文件5:从自然栖息地生长的大约50名女性个体中,将图S4分解了Zhalli的冻结营养部分。接下来,分别用于RNA分离的妊娠样品,生成和植物植物。RT-QPCR分析表明,所有三种基因都表现出在雌性炎雌性炎的轴颈部分中表达的优先表达,与营养培养物相比,较高的10倍以上(图8).雌性雌性植物部分中这三种基因的较低表达水平并未反映RNA代谢的一般下调作为组蛋白H4表达分析显示。结束观察到的PENB_CYSP,PENB_MT2和PenB_MT3基因转录模式表明它们的连接p . endiviifoliaArchegonia开发。
讨论
在植物的生命周期中,从植物生殖增长的过渡是一种关键的发展步骤,这取决于严格的遗传计划。这些两个阶段之间的开关的控制通过环境刺激与工厂的生理状态相协调[42,43].对不同被子植物开花时间的生物学研究表明,植物对各种外部和内部条件的响应是由一个复杂的基因调控网络整合而成的。大量的基因已经被描述为开花时间调节剂,它涉及许多不同的途径,如光接收、生长调节剂的合成和反应、染色质结构或对低温的反应[44,45].然而,在利物革动物的情况下,几乎没有关于从植物生成阶段的转变的基因调节的数据。我们使用了RDA-cDNA方法来研究雌性和雄性化学药物之间的基因表达的变化,这些雄性的植物胫斗的性器官P.endiviifoliasp B为最古老的陆生植物有性生殖的分子基础提供了新的见解。该技术独特的准确性和敏感性使我们能够选择3个基因在颈卵器产生的雌性菌体中特异表达p . endiviifoliasp B,以前从未被描述过的基因。
尽管这三个基因,PENB_CYSP,PENB_MT2和Penb_mt3,存在于男性(附加文件3.:图S2)和雌性基因组(图S2)3.) 的p . endiviifoliasp B,它们只在女性个体中表达。它们在雄性配子体中缺乏表达,表明它们参与了雌性菌体的生长和发育,特别是颈卵器的产生。在雌性颈卵器中,这三个基因的转录本水平比在自然环境中生长的同一菌体的营养部分高出近10倍,这可能反映了这些基因表达与颈卵器发育之间的联系。这三个基因在体外表达的下调可能是由于蛋白质产生的减少,导致由该蛋白质控制的特定过程(es)的扭曲,或类似于颈卵器的缺失。据我们所知,本研究首次报道了已鉴定基因在苔类雌性配子体发育中的贡献。
在体外条件下,在苔藓氏细胞中形成的Gametangia可以通过各种物理和化学因素来调节。m . polymorpha在漫长的一天条件下生产广泛的光强度的Gametangioophores [15.]虽然脱衣舞苔藓布鲁姆argenteum显示80 - 2000勒克利强度后文化后性器官诱导的第一个迹象。高于该限度的强度对于其植物生长而言更有利[46].如果是Lunularia cruciata,温度是控制Gametangia生产的主要因素。有趣的是,该物种的温度要求与高等植物中的含芳络条件相当。然而,大多数苔藓植物不需要对Gametangia形成的低温预处理。M. Polyrnorpha.在长期条件下,仅在21°C下肥沃而在21°C下饲养,在10°C下留下植物。与此相比,一位单一的肝脏Pellia Epiphylla.在长日条件下,10℃和21℃均显示了配子管的形成,但在较高温度下的响应更深刻[15.].因此,我们测试了几种生长条件p . endiviifoliasp B,包括长(16/ 8,24 /0)和短日(8/16)条件,并在15-18°C范围内降低温度。不幸的是,这些条件都没有给我们带来积极的结果p . endiviifolia性器官诱导(未发表的数据)。
在所有苔藓中,群型发育的过程涉及若干分裂的消化膜表皮细胞。成熟的archegonium由颈部和鸡蛋伴膜组成[47].伴随鸡蛋,腹侧管细胞与轴颈壁细胞分离,然后从下颈管细胞分离。在分离事件之前,这两种细胞类型都开始显示通过渐进的真空化和强烈的曲氏糖胺体活性表征的退化迹象,这导致这些细胞的完全崩解[48].这些退化细胞的产品产生了精子游泳到达鸡蛋的粘液[21.].该降解过程被认为是编程的细胞死亡(PCD)事件。类似地,在更高的植物中,PCD也与各种发育变化相连,如拟南芥中气管元素的分化[49],未加盖的豌豆卵巢的衰老[50或玉米绒毡层解体[51].所有这些过程与半胱氨酸蛋白酶的诱导有关[52].有可能的是p . endiviifolia雌性杂草类药物,所选半胱氨酸蛋白酶基因在群组发展的最后步骤中起重要作用。基准的适当发展取决于每个细胞的尺寸和形状的适当调节,这反过来取决于细胞分裂和细胞分化的空间和时间控制。在这两个过程中,PenB_CYSP可能在错误折叠或损坏蛋白质的降解中扮演一个管家基因,以及在蛋白质成熟或对不同外部刺激的反应中重建起重要作用。我们假设在细胞分化和增殖之间的平衡调节p . endiviifolia在体外培养条件下的生长是通过变化的干扰PENB_CYSP,PENB_MT2和PenB_MT3基因表达水平和/或缺乏特定的外源刺激植物不能将切换点与生命周期的生成阶段从植物中传递到生成阶段。尽管在预测的PENB_MT2和PENB_MT3蛋白内没有鉴定保守的蛋白质结构域,但它们最可能代表良好的结构化蛋白质,如预测的二级结构所示,其折叠模式尚未表征。在动物或植物基因组中,只有小百分比的编码蛋白质是充分的特征。对于这些蛋白质的大约40%,它们的结构和功能仍然是完全未知的或仅部分地理解[53,54].例如,在高粱近94%的基因中有其他服药培养物的原因,而剩下的7%似乎是高粱独有的[55].同样地,评估近40 000个基因的马铃薯基因组,收益率为3 372(8,6%)富含未知功能基因的特异性基因[56].惊人的,在p .金属盘,第一个测序的苔藓植物基因组,48%的位点属于小Physcomitrella-only簇[57与分析结果一致的是52%的人p .金属盘基因没有pfam结构域[58].除了所有的Physcometrella中,只有Loci〜22%(7169)没有可检测的同源物,而至少〜13%(4 157)没有同源物,但成绩证据。这些基因可能代表真正的孤儿基因,代表物种或血统特定适应性创新[57].所确定的PenB_MT2和PenB_MT3基因可能属于蛋白质家族,其中肝脏编码的未知功能 - 或甚至用于沉默的特异性基因。进一步详细分析这些蛋白质的结构和生物学功能将是未来调查的问题。
结论
在这项研究中,我们为发展规定提供了实验证据p . endiviifoliaSP B基因涉及雌性杂草的发育和性器官分化。我们的研究表明,鉴定基因的转录水平的波动可能对利物曲线性繁殖成功至关重要。
缩写
- Nt:
-
核苷酸
- BP:
-
基对
- SP:
-
物种
- AA:
-
氨基酸(s)
- AARS:
-
氨基酸残基。
参考
- 1。
杨Wc,ye d,xu j,sundaresan v:theSporocyteless基因拟南芥启动孢子发生并编码新型核蛋白所必需的。基因开发。1999年,13:2108-2117。
- 2。
杨春:植物配子发生与发育的关系。繁殖学报,2004,128(5):483-492。
- 3.
Brukhin V,Curtis Md,Grossniklaus U:Ageniosperm Meancor Pametophyte:不再被遗忘的一代。Curr SCI。2005,89(11):1844-1852。
- 4.
Okano Y,Aonoa N,Hiwatashia Y,Murata T,Nishiyama T,Ishikawa T,Kuboc M,Hasebe M:Polycomb压抑复合体2基因调节佛罗里达州,并为早期陆地植物演变提供进化洞察力。Proc Natl Acad Sci USA。2009,106(38):16321-16326。
- 5.
moquna A, Katz A, Decker EL, Rensing SA, Reski R, Ohad N:在陆地植物进化过程中,Polycomb protein FIE对干细胞维持的调控已经被保守。发展。2009,136:2433-2444。
- 6。
生长素对苔藓原丝粒形成的调控。Nat New Biol. 1973, 245: 223-224。
- 7。
Fujita T, Sakaguchi H, Hiwatashi Y, Wagstaff SJI, Ito M, Deguchi H, Sato T, Hasebe M:陆生植物芽的趋同进化:苔藓芽中生长素缺乏极性运输。生态学报。2008,10:176-186。
- 8。
Landberg K, Pederson ERA, Viaene T, Bozorg B, Friml J, Jonsson H, Thelander M, Sundberg E:小Physcomitrella patens的生殖器官发育是高度组织化的,受这两个因素的影响施/斯蒂基因和活性养羊酸水平施/斯蒂域表达式。植物营养与肥料学报,2013,32(6):591 - 598。
- 9.
Sakakibara K, Ando S, Yip HK, Tamanada Y, Hiwatashi Y, Murata T, Deguchi H, Hasebe M, Bowman JL: KNOX2基因调控陆生植物的单倍体到二倍体形态转变。中国科学:地球科学。
- 10。
He-nygren X,Juslen A,Ahonen I,Glenny D,Piippo S:照亮Liverworts(Marchantiophyta)的进化史 - 迈向自然分类。克莱斯。2006,22:1-31。
- 11.
牛顿ME:苔藓植物的细胞遗传学。苔藓植物的实验生物学。编辑:Dyer AF, Duckett JG。伦敦:学术出版社,1984:65-96。
- 12.
Bischler H:Marchantia Polymorpha L.S.拉特。核型分析。J Hattori Bot Lab。1986,604:105-117。
- 13。
Nakayama S,Fujishita M,Sone T,Ohyama K:rDNA序列的额外轨迹,特异于Liverwort的X染色体,Marchantia polymorpha..染色体res。2001,9:469-473。
- 14.
Marchantia Motormorpha的科学交流。[http://synbio.org.uk/marchantias/www-marchantia-org/why-marchantia.html.]
- 15.
12 K:苔藓植物中性繁殖的生理学。苔原。1964,67:431-445。
- 16.
Nagai J,Yamato Kt,Sakaida M,Yoda H,Fukuzawa H,Ohyama K:来自Markantia Motormorpha的Liverwort的未成熟女性性器官的表达序列标签。DNA Res。1999年,6:1-11。
- 17。
Nishiyama R, Yamato KT, Miura K, Sakaida M, Okada S, Kono K, Takahama M, Sone T, Takenaka M, Fukuzawa H, Ohyama K: Marchantia polymorpha雄性和雌性性器官表达序列标签的比较。DNA资源学报2000,7:165-174。
- 18。
acta botanica sinica(云南植物研究);acta botanica sinica(云南植物研究)Marchantia polymorpha。国家自然科学基金青年项目,2015 - 2015
- 19.
一种苔类植物中转录因子家族的全转录组分析和表达分析。Marchantia polymorpha。中国生物医学工程学报。2013,14:915-
- 20。
能源部联合基因组研究所。[http://jgi.doe.gov/why-sequence-a-liverwort/]
- 21。
Bell Pr,Hemsley Ar:次名胚胎胚胎:晶粒(苔藓和Liverworts)。绿色植物:他们的起源和多样性。第2版。剑状:剑状大学出版社,2000:102-115。
- 22。
王志强,王志强,王志强,等。苔藓植物生物学。编辑:Shaw AJ, Goffinet B.剑桥:剑桥大学出版社,2000:21-70。
- 23。
舒斯特:北美洲的肝苔和花苔。芝加哥:菲尔德自然历史博物馆,1992。
- 24。
《不列颠群岛的苔类植物群》。科尔切斯特:哈利图书,1999:525-530。
- 25。
Sierocka I, Rojek A, Bielewicz D, Karlowski W, Jarmolowski A, Szweykowska-Kulinska Z:雌雄异株地叶藻(Pellia endiviifolia)雄体和精子体发育过程中特异表达的新基因。基因工程。2011,485(1):53-62。
- 26.
Rojek A,Pasternak I,Szweykowska-Kulinska Z:Liverwort Pellia Endiviifolia亚种B(Pelliaceae)的雄性和女性杂种物中的差异表达基因。新千禧年的博语学,世界博罗学会议的诉讼程序2007年昆拉Lumpur马来西亚。编辑:Mohamed H,Baki BB,Nasrulhaq-Boyce A,Lee Picky。吉隆坡:马拉雅大学,2008年:277-289。
- 27.
Blast Altschul SF,Gish W,Miller W,Myers EW,Lipman DJ:基本的本地对齐搜索工具。J Mol Biol。1990年,215:403-410。
- 28.
Larkin Ma,Blackshield G,Brown NP,Chenna R,McGettigan Pa,McWilliam H,Valentin F,Wallace IM,Wilm A,Lopez R,Thompson JD,Gibson TJ,Higgins DG,Clustalw2:Clustalw和Clustalx版本2.生物信息学。2007,23(21):2947-2948。
- 29。
ExPASy生物信息学资源门户,BoxShade服务器。http://embnet.vital-it.ch/software/BOX_form.html,
- 30.
扩展生物信息学资源门户,MyHits数据库,图案扫描工具。http://myhits.isb-sib.ch/cgi-bin/motif_scan.,
- 31。
Apweiler R: InterProScan - InterPro签名识别方法的集成平台。生物信息学。2001,17(9):847-8。http://www.ebi.ac.uk/interpro/search/sequence-search,
- 32。
LeetUnic I,Deerks T,Bork P:Smart 7:蛋白质域注释资源最近的更新。核酸RES。2012,40(数据库问题):D302-D305。http://smart.embl.de/,
- 33。
Briesemeister S,RahnenführerJ,Kohlbacher O:Yloc - 一种用于预测亚细胞定位的可解释的Web服务器。核酸RES。2010,38:W497-W502。
- 34。
PlantLoc:植物蛋白亚细胞定位预测服务器。http://cal.tongji.edu.cn/PlantLoc,
- 35。
ExPASy生物信息学资源门户,ProtParam工具。http://expasy.org/tools/protparam.html.,
- 36。
fgenesh程序。http://linux1.softberry.com/berry.phtml?topic=fgenesh&group=programs&subgroup=gfind,
- 37。
Kurowski Ma,Bujnicki JM:Genesilico蛋白质结构预测元服务器。核酸RES。2003,31:3305-3307。
- 38.
张勇:用于蛋白质三维结构预测的I-TASSER服务器。生物信息学。2008,23 (9):40-
- 39.
Kozlowski LP, Bujnicki JM:元失调:预测蛋白质内在失调的元服务器。生物信息学。2012,13 (1):111-
- 40。
Wiederanders B:Ca1类半胱氨酸肽酶的结构功能关系肽肽。Acta Biochim Pol。2003,50(3):691-713。
- 41。
Olonen A,Kalkkinen N,Paulin L:一种新型的半胱氨酸蛋白酶抑制剂 - 来自大西洋鲑鱼(Salmo Salar L.)和北极Charr(Salvelinus Alpinus)的雄性基因。生物chimie。2003,85(7):677-681。
- 42。
Weller F,Riechmann JL:基因网络控制开花发育的启动。趋势类型。2010,26(12):519-527。
- 43。
李志刚,李志刚:植物发育阶段转变的调控机制。发展。2011,138:417 -4129。
- 44。
王志强,王志强,王志强,等。植物开花时间的相互作用机制及其多样性研究进展。植物学报。2002,19(4):489 - 494。
- 45。
开花的季节和发育时机。植物学报,2010,61(6):1001-1013。
- 46。
Chopra RN,Bathla Sc:物理因素对体外苔藓青苔植物在沙黄诱导和孢子体发育的影响。新植物。1981,89:439-447。
- 47。
Renzaglia Ks,Duff RJ,Nickrent DL,Garbary DJ:早期植物的植物和生殖创新:对统一系统发育的影响。Philos T Roy SoC B.2000,355:769-793。
- 48。
Zinsmeister DD,Carothers ZB:Marchantia多晶型oferyesis的细结构。我是J机器人。1974,61:499-512。
- 49。
Funk v,Kositsup B,Zhao C,BEERS EP:拟南芥蛋白肽酶XCP1是一种气管性元素真空蛋白,可能是木瓜蛋白石。植物理性。2002,128:84-94。
- 50.
Cercos M,Harris N,Carbonell J:在未加压的豌豆卵巢衰老期间诱导硫醇蛋白酶的免疫悬垂性。physiol platararum。1993年,88:275-80。
- 51。
李恩,张DS,刘HS,尹cs,李xx,梁wq,袁z,徐b,楚hw,王j,文tq,黄鹤,罗d,ma h,张db:稻瘟病退化延迟Tapetum降解和花药需要需要基因。植物细胞。2006,18:2999-3014。
- 52。
Grudkowska M,Zagdanska B:植物半胱氨酸蛋白酶的多功能作用。Acta Biochim Pol。2004,51(3):609-624。
- 53。
Gollery M,Harper J,Cushman J,Mittler T,Girke T,Zhu JK,Bailey-Serres J,Mittler R:什么使物种独特?蛋白质与模糊特征的贡献。基因组Biol。2006,7(7):R57-
- 54。
Gollery M,Harper J,Cushman J,Mittler T,Mittler R:Pofs:我们不知道的是什么可以伤害我们。趋势植物SCI。2007,12(11):492-496。
- 55。
帕特森啊,鲍德·杰,Bruggmann R,Dubchak I,Grimwood J,Gundlach H,Halherer G,Hellsten U,Mitros T,Poliakov A,Schmutz J,Spannagl M,Tang H,Wang X,柳条T,Bharti Ak,Chapman J,Feltus FA, Gowik U, Grigoriev IV, Lyons E, Maher CA, Martis M, Narechania A, Otillar RP, Penning BW, Salamov AA, Wang Y, Zhang L, Carpita NC, et al: The Sorghum bicolor genome and the diversification of grasses. Nature. 2008, 457: 551-556.
- 56。
马铃薯基因组测序联盟:基因组序列和块茎作物马铃薯分析。自然。2011,475:189-195。
- 57。
Zimmer Ad,Lang D,Buchta K,Rombauts S,Nishiyama T,Hasebe M,Van de Peer Y,Rensing SA,Reski R:reannotation和非种子植物Physcomitrella Genome的基因组的延长社区资源为演变提供了洞察力植物基因结构与功能。BMC基因组学。2013,14:498-
- 58。
Kersting Ar,Bornberg-Bauer E,Moore Ad,Grath S:蛋白质领域的动态和适应性益处,植物基因组进化期间的出现和安排。基因组Biol Evol。2012,4:316-329。
确认
这项工作得到了波兰高等教育和科学授权书的支持[n n303 815040]。
作者信息
隶属关系
相应的作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
ZSK提供了工作的想法。是和Zsk设计了实验。进行所有实验部分的工作,参与生物信息学分析并准备了稿件。LPK,JMB进行了蛋白质结构预测的分析。AJ,ZSK参与了对结果的解释,并参与了对稿件的批判性审查。所有作者阅读并认可的终稿。
电子辅料
表S1-S3具有用于PCR反应的寡核苷酸引物。
附加文件1:表S1。专为RT-PCR分析的寡核苷酸引物,基于所获得的DPIV.序列。表S2。设计用于定量五转录物同种型水平的寡核苷酸引物PenB_MT2基因。表S3。寡核苷酸引物专为扩增全长基因及其转录物而设计。(Doc 50 KB)
12870_2014_1577_moesm2_esm.doc.
附加文件2:图S1:评估旨在确定5个拼接同种型的相对丰度的实时PCR反应PenB_MT2基因转录。连续稀释cDNA作为模板,以确定两种PCR反应的效率。校准曲线表明,效率非常相似,因此可以直接比较和估计剪接异构体丰度。(医生738 KB)
A-C.
附加文件3:图S2:全长女性特异性表达基因(面板中的第1道),在从男性分离的DNA模板上用1%琼脂糖凝胶分析p . endiviifolia孢子体。(一)PenB_CYSP,(b)PenB_MT2和(C)PenB_MT3.分析结果显示,从雄鼠身上分离的RNA未扩增出全长转录本p . endiviifolia配子蛋白酶(平道2在面板中A-C.).(D)男性的放大具体表达Penb_tua1.基因(泳道1)及其转录物(泳道2)分析在1%琼脂糖凝胶上。没有模板的PCR反应显示在泳道3. 1kb +梯子位于凝胶的右侧。(Doc 290 KB)
12870_2014_1577_moesm4_esm.doc.
图S3:不同植物物种半胱氨酸蛋白酶的氨基酸序列比对:Z.Mays.(ZM),A.Thaliana.(在),P.patens(PP),S.lycopersicum.(SL),N.tabacum(NT)(Genbank Acc.NOS。Q10717.1,AAN31820.1和NP_568921.1,XP_001775992.1,XP_004243708.1分别,ABW71226.1,ABW71226.1)和P.endiviifoliasp B (PeB)。黑色-氨基酸残基高度保守,灰色-氨基酸残基取代保守,白色-氨基酸残基不保守。线条表示某一特定氨基酸的缺失。氨基酸序列上方的哈希号(#)表示C1家族半胱氨酸蛋白酶的4个AA催化残基。三角形标记(▼)上方,氨基酸序列表示S2袋的AA,其负责底物特异性结合。(Doc 44 KB)
(一)
附加文件5:图S4:男性和女性(b)苔类植物的菌体Pellia endiviifoliaSP B在科帕利娜,波兹南,波兰和男性的自然栖息地生长(C)和女性(D)Thalli在体外培养中生长。箭头指向雄性彩色锦绣物的不规则行(一)雌性配子体上含有10 ~ 12个颈卵器的总苞(b).(柯尼卡美能达Dynax5D)。(医生558 KB)
作者为图像提交的原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativeCommons.org/licenses/by/2.0.)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Sierocka, I., Kozlowski, l.p., Bujnicki, J.M.et al。在脱髂肝囊薄层末端肝脏的雌性特异性基因表达在发育中调节并与archegonia生产相连。BMC植物杂志14,168(2014)。https://doi.org/10.1186/1471-2229-14-168
已收到:
接受:
发表:
关键字
- Liverwort.
- 佩利亚
- Archegonia发展
- 有性生殖
- diocious pametophytes.
- 基因表达