摘要
背景
藏红花(番红花),新的球茎从母球茎(一个球状的地下贮藏茎)发育而来。由于芽芽的萌发程度影响新球茎的数量和大小,而直脚金内酯(SLs)抑制已形成的腋芽的生长,因此研究SL在藏红花生理和分子生物学中的作用是合适的。我们专注于SL途径中的两个基因,CCD7而且CCD8,编码产生SLs所需的类胡萝卜素裂解酶。
结果
的CsCCD7而且CsCCD8基因是第一个从非草单子叶植物中分离和鉴定的基因。CsCCD7而且CsCCD8虽然不完全相同,但表情上有一些重叠。CsCCD8在静止的腋芽中高度表达,而斩首后其表达水平显著降低,提示其参与抑制腋芽生长。此外,体外实验还表明,生长素、细胞分裂素和茉莉酸对去除根尖芽的球茎腋芽的萌发有影响。此外,CsCCD8表达,但不是CsCCD7,腋芽新生维管组织高于根尖维管组织。
结论
我们发现,藏红花球茎生长素的产生和运输可以与SLs协同作用,以抑制腋芽的生长,类似于控制地上芽的分枝。此外,茉莉酸似乎在藏红花的芽休眠中起着突出的作用。而来自根的细胞分裂素促进芽的生长。的表达结果CsCCD8表明SLs可以积极调节原形成层活性以及连接叶片和母球茎的新维管组织的发育。
背景
c .巨大成功是一种经济上重要的单子叶作物,生产藏红花,世界上价格最高的香料[1].此外,这些柱头在世界各地被用于治疗不同的疾病[2].在过去的5000年里,农民们选择了c .巨大成功因其柱头以类罗汉素积累为特征[3.].c .巨大成功是一种三倍体多年生不育植物,以地下球茎的形式克服干燥的休眠期。球茎从干燥季节开始(4 - 5月)至夏季开始(7月)保持休眠状态,其特征是形成叶原基[4].不久之后,花的形态发生发生,到8月底,所有的花都已分化[4].随着10月底开始发芽,球茎成为支持球茎生长的源器官。充足的球茎生产的重要性在藏红花不育类群中是不言而喻的,它已经通过每年替换球茎进行了几千年的营养繁殖。由于几乎每一个发芽的芽产生球茎,影响发芽的因素是非常重要的球茎和花的生产。传统方法在一个生长季节中,每个母球茎只能产出一至三个球茎[4].从最初的球茎到播种一公顷所需的球茎,需要9-10年的时间[5].因此,低繁殖率和球茎真菌感染降低了生产力和质量,从而限制了种植材料的可用性。一个球茎只能存活一个季节,通过分裂繁殖成球茎,最终产生新的植株,因此球茎是藏红花繁殖不可缺少的。
尽管其重要性,藏红花的发芽过程还没有被精确地描述。与在其他植物中一样,人们认为这一过程应该是由植物激素和糖信号的复杂相互作用来协调的。6].脱落酸(ABA)与球茎休眠的开始和维持有关[7].赤霉素(GAs)似乎参与了停止休眠后根尖芽的生长,但与维持休眠无关[8].到目前为止,还没有其他激素参与藏红花的发芽过程或顶端优势的数据。此外,尚不清楚球茎是否像其他高等植物的茎一样,并在顶端优势方面遵循相同的行为。在高等植物中,并不是所有的腋芽都发育出来,每个芽都要决定是继续生长还是休眠。9].植物激素是控制腋芽生长的主要因素。长期以来,人们已经知道有两种激素,特别是生长素和细胞分裂素,参与了这种控制。生长素由顶端芽提供,间接抑制腋芽的生长,而细胞分裂素直接诱导分枝[10].在过去的二十年里,豌豆的遗传和生理分析,拟南芥大米和佩妮预测了一种额外的新激素参与控制芽分枝:SLs作为第二信使抑制腋芽生长[11].生长素与SLs在调控侧枝中的相互作用是复杂的。SLs可能通过抑制生长素的转运而起作用[12- - - - - -14],作用于生长素下游[15],或独立于茎生长素的地位[16来调节横向分支。
长期以来,人们都知道SLs是根系寄生植物的发芽促进剂[17]和丛枝菌根真菌的共生前分支因子[18].在开花植物中,SLs也与发育有关[19]作为抑制预先形成的腋芽生长的新激素参与者[20.,21],在根系结构、不定根、二次生长和生殖发育方面[22- - - - - -25].它们也与植物对非生物和生物胁迫的反应有关[26- - - - - -30.].然而,正是在其对枝条分枝的影响上,SL途径中的一些生物合成和响应基因才首次被发现[31,32].
多项证据表明,SLs来源于类胡萝卜素,并提出了一种假定的生物合成途径[33].两种类胡萝卜素裂解双加氧酶CCD7和CCD8参与SL生物合成。CCD7催化9-顺式-β-胡萝卜素9,10裂解生成10 ' -apo-β-胡萝卜素和β-欧诺酮。然后,10 ' -apo-β-胡萝卜素被CCD8裂解生成c18 -酮β-apo-13-胡萝卜素。这种化合物立即被CCD8转化为卡拉内酯,经过一系列不同的反应[33].卡拉内酯可能是MAX1酶的底物,该酶催化自然界中不同形式的SLs的产生[34,35].
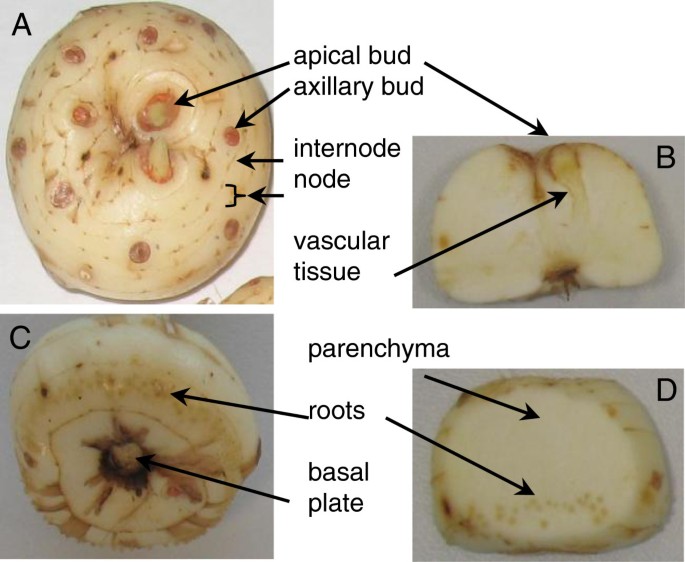
Orthologues的CCD7而且CCD8已在拟南芥、豌豆、矮牵牛、水稻、菊花、猕猴桃和番茄等植物中发现[14,25,32,36- - - - - -40].此外,aCCD8同源物已从苔藓中分离出来Physcomitrella金属盘[41].的saffron corm is a stem-derived organ formed by shortened nodes and internodes. Mature saffron corms usually show one to three apical dominant buds which will sprout in the following season plus many axillary dormant buds (Figure1).每个腋芽都具有与初级茎尖分生组织相同的发育潜力,因为它可以产生一个生长的茎轴。然而,腋芽只形成几片叶子后就进入休眠状态。球茎系统中大量的腋芽使植物能够迅速从损害中恢复,并根据环境输入调整其生长。顶端优势是植物的生存机制,它提供了一个分生组织库,可以取代受损的初级茎。当主要的嫩枝因疾病、食草动物的放牧或修剪而受损或被移除时,这种机制就会起作用。在一些植物中,顶端优势也可以根据发育过程而释放。休眠的腋芽在初生芽分化成确定的器官(如花)后开始生长。这些额外的嫩枝对于增加叶子或花的总数很重要,从而使果实更丰硕。然而,这不是藏红花的情况下,没有激活额外的腋芽被诱导。
鉴于藏红花发芽的重要性以及顶端优势对球茎数量的潜在影响,研究SLs在这一过程中的作用,包括对腋窝分枝的控制,可以推广到其他由球茎繁殖的植物。在这项研究中,我们已经确定了两个藏红花SL生物合成所需的基因,以及这一过程中关键的生长调节剂的参与。
结果
藏红花腋芽萌发特性的研究
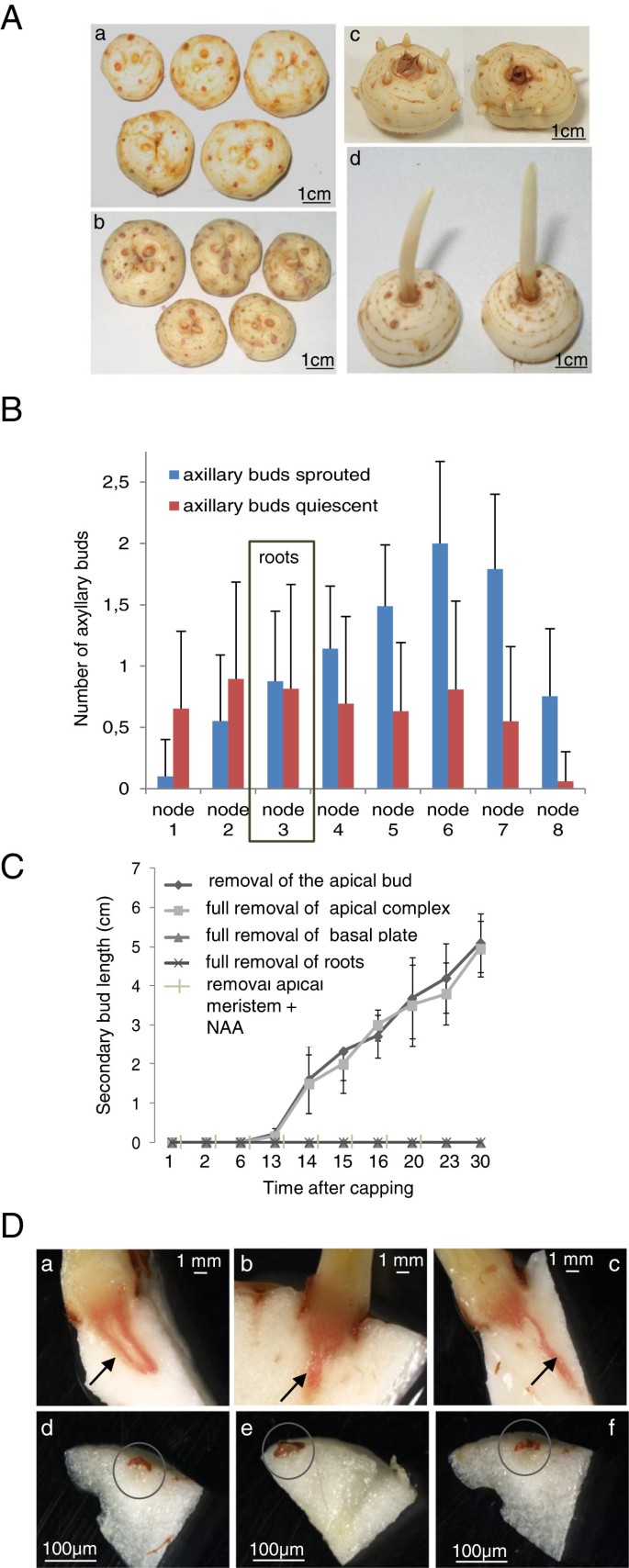
腋芽通常处于休眠状态,并被顶端分生组织产生的生长素所抑制。我们检查了藏红花球茎是否表现出经典的茎状行为,并研究了芽顶端优势在决定侧芽休眠、释放和发芽中的作用。根尖芽的切断导致根尖优势的丧失,15天后,所有的腋芽都发芽了(图2A).我们测定了每个节点上萌发的腋芽数量,以及主芽斩首后35天保持静止的腋芽数量(图2B).第一个节点设为底板所占据的节点。每个节的腋芽总数从底部到顶端分生组织逐渐增加,在节6处达到最大值(图2)2B).第1节和第2节发芽率分别为13.5和38%。98%的球茎在第3节生根,该节腋芽萌发率为51.8%。从这个节点开始,发芽的模式发生了变化,每个节点中发芽的芽数与保持静止的芽数相比越来越多,从第四个节点的62%上升到第八个节点的92.7%(图2B).实际上所有这些发芽的腋芽都会形成一个新的替代球茎,导致球茎数量的增加(补充文件)1:图S1)。为了更深入地描述这一过程,对球茎进行了以下处理:(i)根尖芽的切断;(ii)完全切除根尖复合体;(iii)完全去除次生静止芽;(iv)完全切除基底复合体,同时或不摘除根尖芽;和(v)完全切除不定根,同时或不摘除根尖芽。发芽期30 d。根尖芽的断头导致根尖优势的加速丧失,影响腋芽的生长。15天后,所有腋芽均开始发芽(图2C).当根尖复合体(根尖芽加上下面的组织)被移除时,观察到相同的模式。正如预期的那样,当生长素施用于断头顶点时,腋芽发芽受到抑制(图2C和附加文件2:图S2)。有趣的是,基底板的去除抑制了根尖和腋芽的生长。当去除不定根时,也得到了相同的结果2C).然而,在这种情况下,当球茎被转移到一个允许根再生的潮湿表面时,根尖芽的生长重新开始,当根尖芽被移除时,次生芽在球茎中萌发。这些实验强调了根尖芽的存在和活力在控制腋芽生长中的重要性,同时也强调了根对芽萌发的影响。根被认为是细胞分裂素的来源,细胞分裂素可以诱导去头球茎腋芽的快速生长(附加文件)2:图S2)。
顶端分生组织在非休眠状态下的优势番红花球茎。(一)根尖芽的去除使腋芽萌发。一)球茎具顶端分生组织除去。b)完整的生长情况。c)根尖分生组织去除后13天球茎具萌发的次生腋生芽。d)在开始斩首实验13天后,以完整的球茎为对照。(B)根尖分生组织切去后,每个节中萌发或静止的腋芽数。在每个处理中,25个球茎被砍掉。误差柱表示25个重复的SD。(C)带或不带其他球茎部分的顶端芽的去除并导致腋芽的萌发。在每个处理中,25个球茎被砍掉。误差柱表示25个重复的SD。(D)藏红花球茎萌发的腋芽的血管化(两者).在静止的腋芽中没有脉管系统(d-f).用手切芽,用间苯三酚-盐酸染色木质素。木质素染色呈红色。照片在解剖显微镜下拍摄。
一些著作指出,在斩首后,腋芽需要形成血管连接才能生长。我们研究了藏红花的腋芽中是否已经存在血管连接。藏红花的腋芽被几片叶子所覆盖,因此这些腋芽可能会长出几片叶子,然后由于顶芽抑制它们的生长而发育停滞或休眠。这些休眠的腋芽需要事先发展出血管连接才能生长,这一过程相对缓慢(图2D,与其他研究过的系统相比[D]。32].藏红花处于静止状态的腋芽没有与母球茎形成维管连接(图2D),但一旦这些腋芽的发芽被诱导,脉管系统的发展开始(图2D)。
藏红花花蕾中的激素
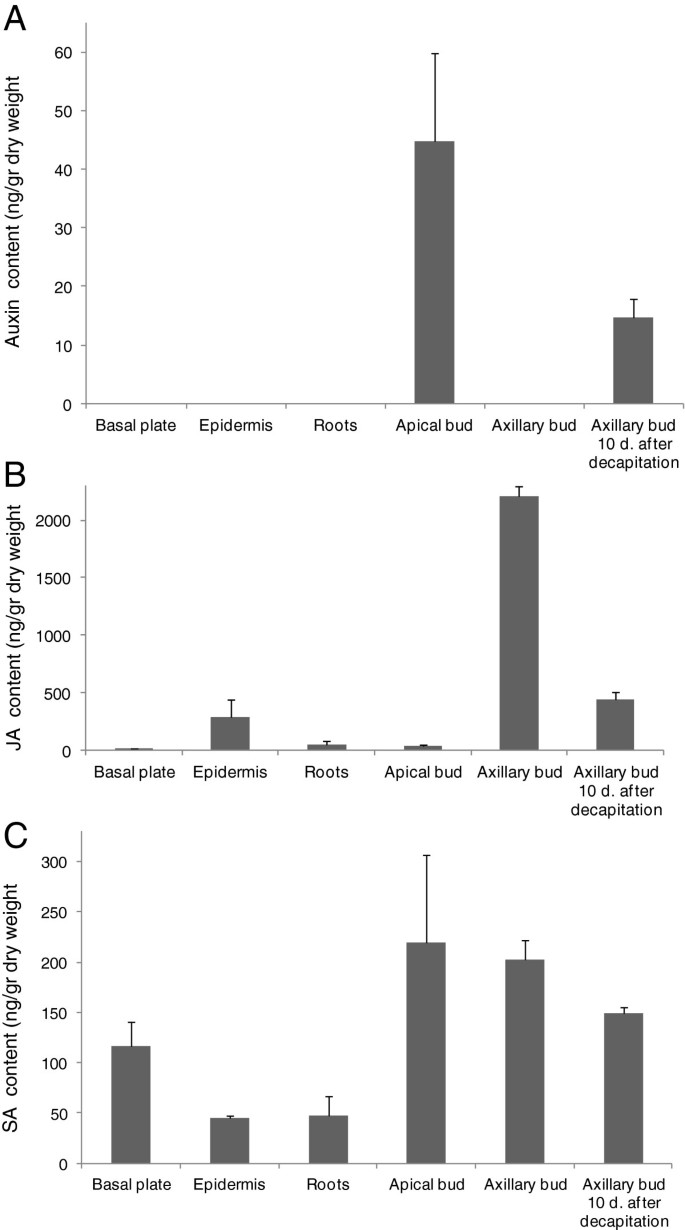
顶端优势是最早发现的受植物激素调节的发育现象之一。来源于根尖芽的生长素主要通过极性生长素运输流在茎中移动,抑制腋芽的生长,而主要来源于根的细胞分裂素则促进外生[42,43].为了表征藏红花球茎腋芽发芽的激素调节,在球茎不同部位测量了生长素和其他几种激素的水平(图3.).在根尖芽中检测到高水平的生长素,而在其他组织中未检测到生长素,包括腋芽(图3.A)。有趣的是,去除顶端分生组织后,腋芽中生长素含量显著增加(图3.A),建议在斩首后重新组织统治。相比之下,在静默的腋芽中检测到茉莉酸(JA)的最高水平,在根尖芽斩首后10天下降(图3.B).水杨酸(salycilic acid, SA)含量最高的是在根尖和腋芽,其次是基板(图3.C)。
藏红花球茎中的SLs
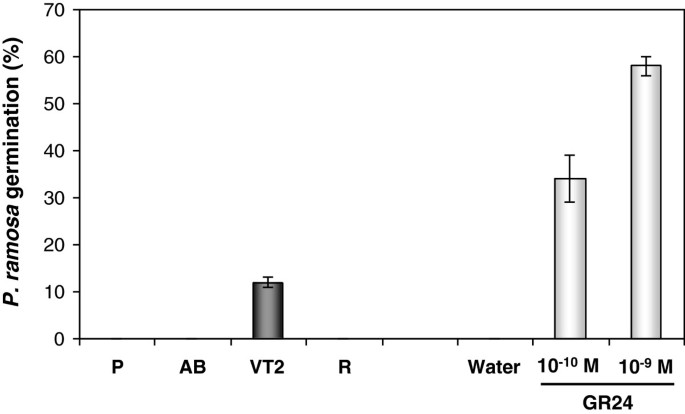
为了评估藏红花中SLs的存在,我们对藏红花的几个部分进行了解剖和测试,以诱导其萌发Phelipanche ramosa种子(图4).应用于根尖芽、腋下潜芽和萌发的腋下芽、外覆盖物(不含芽的球茎外表面)、根、基底和根尖芽、去头芽和腋下芽提取物的维管组织p . ramosa根尖芽主维管组织提取物对种子萌发的诱导率为11.5%,其他组织提取物对种子萌发无诱导作用。合成SL GR24 (109到10-10M)作为阳性对照,分别诱导58%和34%的萌发,而水(阴性对照)不诱导萌发(图4).
第一批藏红花CCD7和CCD8基因的鉴定
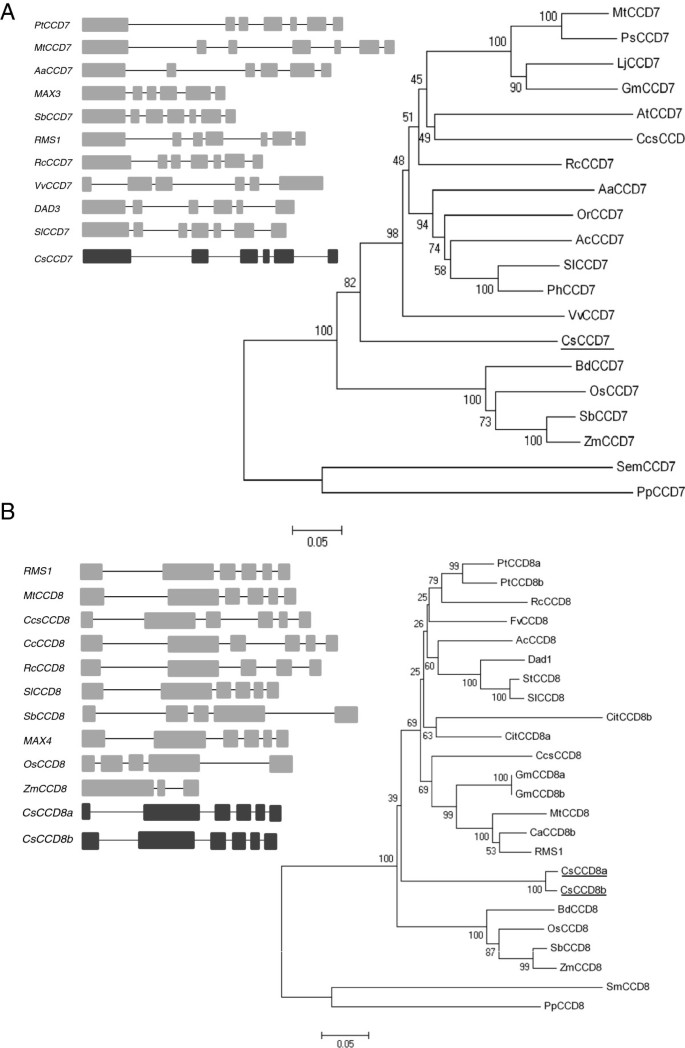
SLs是一类新的植物激素,已被证明参与调节预成型的腋芽的生长。为了研究藏红花根尖优势度与SLs的关系CCD7而且CCD8采用简并引物PCR和基因行走相结合的方法分离基因。藏红花CCD7,以下简称为CsCCD7,包含5个内含子(图5A),编码序列的1912 bp编码了一个含有591个氨基酸的蛋白,预测pI分别为6.6和66.17 kDa (GenBank登录号KJ361477)。ChloroP 1.1程序预测了一个50个氨基酸的n端转运肽,与CCD7质体定位一致[44].与CsCCD7同源性最高茄属植物lycopersicumCCD7蛋白(67%相同)。在的情况下CCD8,两个。1pt?从藏红花中分离出>个不同的基因,命名为CsCCD8a而且CsCCD8b,它们的第一个外显子和内含子的序列不同。CsCCD8a被预测有6个外显子(图5B), 3151个核苷酸和1533个核苷酸的编码序列,编码511个氨基酸的蛋白质,预测pI为6.6和57.17 kDa (GenBank登录号KJ361478)。CsCCD8b预测该基因有6个外显子,3195个核苷酸,编码1671个核苷酸,编码557个氨基酸,预测pI为6.1,62.03 kDa (GenBank登录号KJ361479)。两种CsCCD8蛋白与DAD1蛋白的同源性均为83% (CCD8来自佩妮矮牵牛)和76%到D10 (CCD8从栽培稻),并通过ChloroP 1.1程序预测其在质体中的定位,与CCD8的质体定位一致[45].
基因结构CsCCD7而且CsCCD8以及与其他植物物种的CsCCD7和CsCCD8同源体的系统发育关系。(一)的假设内含子/外显子结构CsCCD7以及内含子在同源体中的位置CsCCD7如图左侧所示。右侧显示了来自不同植物物种的CCD7蛋白的代表性系统发育树。(B)的假设内含子/外显子结构CsCCD8以及内含子在同源体中的位置CsCCD8显示在左边。右侧显示了来自不同植物物种的CCD8蛋白的代表性系统发育树。外显子和内含子分别以框和线表示。利用ClustalW对全长CCDs序列进行比对,并采用邻域连接法聚类,得到现有的树。加入编号如下:SlCCD7 (ACY39882.1), PhCCD7 (ACY01408.1), AcCCD7 (ADP37985.1), ZmCCD7 (NP_001183928.1), RcCCD7 (XP_002511629.1), VvCCD7 (XP_002274198.1), VvCCD7 (ADB64459.1), pscd7 (adk67496.2), AtCCD7 (NP_182026.4), CcsCCD7 (ADM18968.1), SmCCD7 (xp_00294696.1), OsCCD7 (EAY95081.1), LjCCD7 (ADM88552.1), MtCCD7 (XP_003622555.1), BdCCD7 (XP_003581501.1), PpCCD7 (ADK36680.1), PtCCD8a (XP002309543), PtCCD8b (XP002324797), AcCCD8 (GU206812.1), AtCCD8 (AT4G32810), BdCCD8 (LOC100831734),MtCCD8 (Medtr3 g127920), OsCCD8 (Os01 g0746400), Dad1 (AY743219), RMS1 (AY557342), SbCCD8 (Sb03 g034400), ZmCCD8 (GRMZM2G446858), RcCCD8, SlCCD8 (NP_001266276.1), StCCD8 (XP_006359761.1), CitCCD8a (KD079823), CitCCD8b (XP_006476130, CaCCD8b (XP_004501157), PpCCD8 (ADK36681.1), SmCCD8 (XP_002972693.1), GmCCD8b (XP_003522713), Gm CCD8a (XP_003522713.2)。分支支持低于5000个引导副本。
作为CsCCD7、CsCCD8a和CsCCD8b特征的一部分,进行了氨基酸序列比对,以便使用来自各种植物物种的CCD7和CCD8蛋白质序列构建系统发育树(图2)5这一分析表明CsCCD7更接近于eudicot序列而不是grass序列(图5A),而CsCCD8a和CsCCD8b在与eudicots分开的一个簇中(图5B和附加文件3.:图S3)。
csccd7和CsCCD8的基因表达
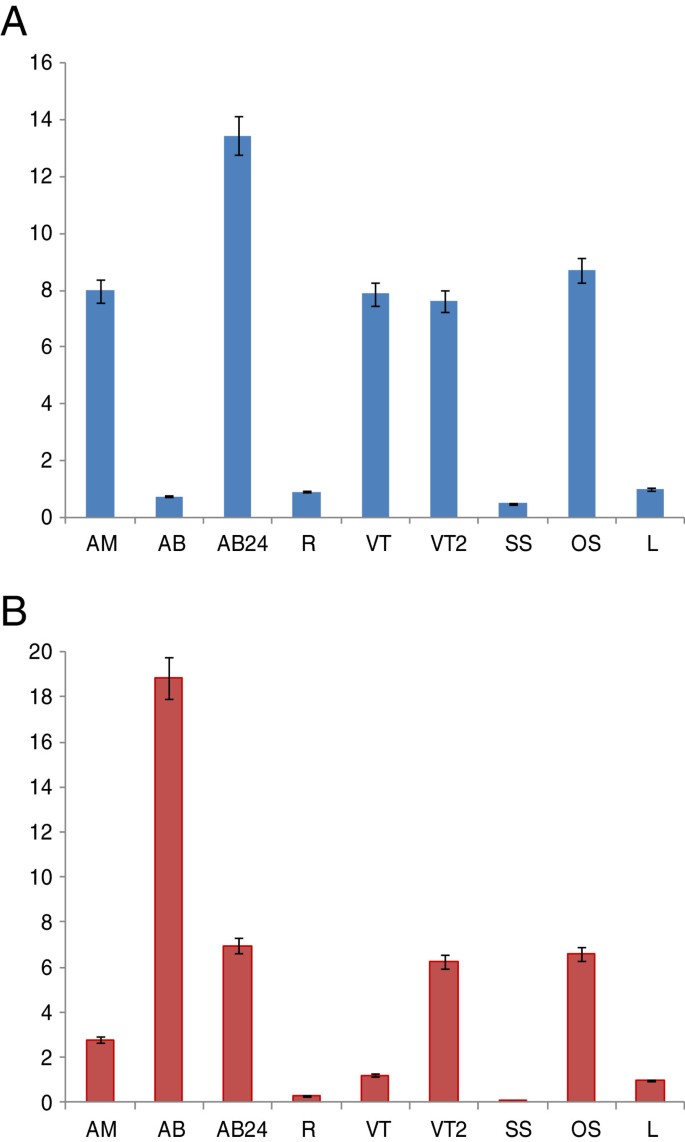
来确定CsCCD7而且CsCCD8表示,模式CsCCD7而且CsCCD8采用实时定量RT-PCR (qPCR)方法测定不同组织中转录物丰度。CsCCD7在所有被分析组织中均可检测到表达,但表达水平不同。在芽水平上,根尖芽切除24 h后腋芽的表达量最高,其次是根尖芽的表达量(图6A).根尖芽和萌发的腋芽的维管组织的水平相似(图6A).有趣的是,在橙色柱头中观察到高表达水平,而在衰老柱头中检测到低表达水平。在叶片和不定根中表达量也较低(图6A)两者的综合水平CsCCD8从不同组织中提取的mRNA转录本使用引物进行检测,引物不区分两种不同的拷贝/等位基因。在静止的腋芽中检测到最高水平(图6B).然而,在去除根尖芽24小时后,这些水平在腋芽中急剧降低。根尖芽的表达水平明显低于静止腋芽的表达水平CsCCD8在发芽过程中减少(图6B)CsCCD8根尖芽的维管组织含量低于新生腋芽的维管组织含量,但高于不定根的维管组织含量(图2)6B)CsCCD7的表达相对较高CsCCD8在橙色柱头中检测到,而在衰老柱头中这种表达减少(图6B)。
讨论
几乎所有球茎植物都是单子叶植物,包括藏红花、郁金香、洋葱、大蒜和百合等重要经济植物。它们的无性繁殖是农艺改进以显著增加球茎潜在数量的最相关过程,而控制休眠对于解决与这些作物的储存和分配有关的许多问题至关重要。SLs在两个过程中都起着关键作用,即新芽的发育和通过抑制芽的生长而抑制发芽[20.,21,46,47]和一些涉及SLs生物合成和信号传递的基因已从不同种类的物种中鉴定出来[48],尽管不包括球茎植物。在本文中,我们通过分离和鉴定两个SL生物合成的关键基因,描述和分析了藏红花脱头诱导的发芽过程,以及SLs在这一过程中的参与。CsCCD7而且CsCCD8.
藏红花CCD7和CCD8基因的分离
到目前为止发现的控制分支的基因在物种之间经常是保守的。特别是两个类胡萝卜素裂解双加氧酶基因,CCD7(MAX3 / RMS5 DAD3 / D17-HTD1),CCD8(MAX4 / RMS1 DAD1 / D10),参与SLs生物合成,似乎在所研究的植物物种中得到了很好的保守。为了描述藏红花中的SL通路,研究了藏红花的同源物CCD7而且CCD8被分离出来,通过系统发育分析证实了它们的同源性。对几种植物的基因组分析表明CCD7是单拷贝基因,这似乎也是藏红花的情况,在这项研究中分析。然而,在大多数被分析的基因组中CCD8是一种多复制基因[49](附加文件3.:图S3)。在藏红花中,我们的结果表明至少有两个基因座编码CCD8.
尽管有很高的功能守恒CCD7而且CCD8物种间的基因,在表达模式上有有趣的差异。CsCCD7而且CsCCD8在所有组织和器官中均有表达,在不定根中表达量极低。在拟南芥[45],矮牵牛花[38],豌豆[50]、猕猴桃[40]和番茄[25的词根表达式CCD8至少比拍摄时高10倍。相比之下,在水稻中[51]和菊花,芽的表达量大于根的表达量[14],而玫瑰的根中没有检测到任何表达[52].在拟南芥,CCD7根表达量高,[37]尽管最近在种子和茎维管组织中检测到最高表达[53].在水稻CCD7在芽和根组织中均有表达,主要在整个植物的维管束组织中表达[54].在矮牵牛中,其在节点和节点间表达较高[55]在番茄中,CCD7在绿色组织中的表达远低于在茎和根中检测到的[39].这些差异可能反映了根和梢在不同物种中对梢部分枝的sl调节的不同贡献。
藏红花顶端优势与激素含量及腋芽发芽位置效应的关系
顶端优势被认为是生长素导致侧芽发育停滞的结果,生长素基本上是从芽的顶端分生组织运输而来的[56].这一观点是由这样一个事实所支持的,即如果一个被切除的顶点被外源生长素所取代,顶点的优势地位就能保持。从茎尖提取的生长素可能通过SLs的作用来控制侧芽的生长,将抑制信号从主茎传递到芽中[15].这一过程此前尚未在藏红花中得到深入研究。正如在其他植物系统中观察到的那样,在藏红花中,根尖芽是生长素在被测器官和组织中的主要来源,根尖芽被切除后,根尖优势得以释放,相反,在被切掉的球茎切面上应用生长素则保持了根尖优势。
此外,根的重要性已被证明,可能是根尖芽和次生芽发芽的细胞分裂素的来源,在后者中,根尖优势已丧失(附加文件)2:图S2)。
离根尖芽越近的芽萌发越活跃,表明每个腋芽的生长潜力与其在球茎中的位置有关。哪个芽先被激活取决于当地芽的竞争力,这可能是由当地的环境和芽的发育状态决定的[57].另一方面,光敏色素B感知到光质量的改变,特别是红光与远红光(R/FR)比值的降低,在这一过程中起着关键作用,诱导抑制芽的生长[58- - - - - -60].然而,在我们的实验系统中,考虑到球茎是一个地下器官,不清楚靠近顶端的芽是否暴露在一些阳光下。然而,这种位置效应已经在其他植物中观察到,如豌豆,当通过断头促进分枝时,每个腋下只有一个芽在上部节点释放[61,62],似乎是由几种激素之间的平衡所决定的[63].
我们还测定了藏红花几种组织中JA的含量。JA及其衍生物与胁迫诱导反应有关,也被证明能抑制植物生长和有丝分裂[64].在静卧的腋芽中检测到JA含量最高,但在根尖芽断头后,JA含量降低,根尖芽中检测不到JA。这些数据表明,JA在藏红花的芽休眠中起着重要作用。类似地,JA最近被证明参与了杏的芽休眠[65]和兰花[66].观察到的JA模式与生长素相反。植物生长所需的细胞伸长和分生组织活性受生长素的调节。有趣的是,JA与生长素有广泛的串扰,并下调PIN1和PIN2蛋白水平[67],提示该激素可能在PIN蛋白转运和生长素转运中发挥作用,这与SLs的研究结果一致[48].与这一观察结果相一致的是,它显示了在功能上的增益突变IAA8通过降低JA水平诱导出更多的侧枝和降低梢尖优势[68].
内源性细胞分裂素(ks)可通过促进细胞周期进入腋芽,促进腋芽生长。CKs在整个植物中都有合成,但CKs在芽调控中的起源仍有争议[69].研究表明,根中产生的ck通过木质部运输[70,71]并在不同的组织上发挥作用。去除藏红花的根会中断花芽的生长,新根的发育会重新启动发芽过程。由于CKs参与了外生长芽的促进(附加文件2:图S2),在藏红花中,根部产生的CKs很可能是这一过程的原因,正如在其他植物系统中所示[72].
已经证明,在休眠和清醒的藏红花球茎之间,SA水平会发生变化。73],表明它有打破休眠的能力。因此,我们测定了根尖芽、腋芽和根尖芽摘除后10 d的腋芽中SA的含量。然而,我们没有检测到样品间的显著差异,这表明芽内SA的内源性水平与异常的控制无关。
藏红花球茎中的SLs以及CsCCD8和csccd7在发芽和维管组织形成中的作用
另一个控制射击分支的主要玩家是SLs [74],最初被认为是根系寄生植物的发芽促进剂[75].SLs和生长素已被证明对芽分枝有抑制作用[20.].生长素转运自抑制假说[76]提出,器官之所以保持休眠状态,是因为它们不能将自己的生长素输出到茎极生长素流中。一旦腋芽休眠被打破,芽的生长可能依赖于生长素从芽中通过管道化过程运输的建立,该过程受生长素极性运输流的强度控制,也可能需要生长素调节的第二信使[16].SLs被认为是通过降低生长素转运蛋白的表达和/或质膜定位来调节生长素转运的[77,78].
在本工作中,研究了黄芩的发芽促进活性p . ramosa对不同提取物的种子进行了测试,发现其刺激活性较低,但仅在从根尖芽发育而来的维管组织中检测到,表明该组织中存在SLs。其他组织提取物中缺乏活性很可能是由于存在极低水平的SLs。在几个物种中进行的嫁接研究表明,野生型砧木嫁接到任何一种ccd7或ccd8突变接穗能够恢复野生型的分支模式,这表明在根中产生了SL [31,79].然而,突变株上的野生型枝条也有接近野生型的分枝模式[31,32,79].此外,野生型上胚轴插枝成rms1和下胚轴的移植拟南芥max3也能减少分支[80],表明SLs的生物合成并不局限于根系。的表达式CsCCD7而且CsCCD8表明在藏红花茎维管系统中也合成了SLs。此外,在番茄根分泌物中发现的SL剖面与在木质部液中发现的不同[81],这表明不同的SLs可以在不同的组织中产生,它们具有不同的生物学功能。
的表达模式CsCCD7而且CsCCD8对不同发育阶段的顶芽和腋芽进行了分析,分别为静止期和去除主顶芽后24 h。这两种基因在根尖芽中的表达量均高于根或叶。但在腋芽中,这两种基因的表达模式存在明显差异。虽然CsCCD8在静止的腋芽中表达量最高,表达量为CsCCD7在这个组织中含量很低。在拟南芥,表示CCD8据报道,在靠近芽的节组织中也相对较高,而在水稻中,CCD7主要见于茎节,即腋窝分生组织起始的地方[54].事实上,CsCCD8根尖芽切断后,腋芽中的转录水平迅速下降,尽管CsCCD7上调,如在马铃薯中观察到的[82].以往数据CCD7而且CCD8其他植物系统的表达模式显示,断头导致这些基因在茎和腋芽中的表达减少[14,15,32,51,83].尽管这是事实CsCCD8,CsCCD7表现出相反的行为。这一结果表明,与花蕾休眠有关的SL的产生很可能是受控于CsCCD8的水平。
此外,芽生长素输出也是受抑制芽与茎脉管系统形成血管连接的前提条件[16,84].藏红花静止腋芽的脉管系统不发达,发芽过程中也伴随着脉管系统的发育。这些静止的腋芽的叶原基不是生长素的来源。然而,一旦芽开始生长,芽就会合成生长素,正如在其他植物中观察到的那样[85],其输出可增强维管连接和养分流动,进一步刺激芽的生长。有趣的是,正是在腋芽的脉管系统中CsCCD8与顶端芽的脉管系统相比,表达水平有所提高CsCCD7水平几乎没有变化,但很高。最近[86],为SLs积极调节形成层活动提供了证据。所研究基因的表达模式表明,该维管组织中SL或卡拉内酯的产生很可能受控于的水平CsCCD8但不是CsCCD7.与此一致的是,一些报告指出CCD7参与了其他类人素的形成[87,88].CCD4和CCD7目前都是交付C的候选27CCD1的中间体,已被建议优先于类胡萝卜素[89].与CCD7的这种额外作用相一致的是,CCD7的水平明显升高CCD7可在绿色番茄果实中发现,但尚未从中检测到SLs [39]在稻穗中[51].有趣的是,D27, β-胡萝卜素异构酶,转化所有-反式-β-胡萝卜素转化为9-独联体被CCD7裂解的-β-胡萝卜素在穗中含量高,在根中含量低[90].
CsCCD7的参与而且在柱头发育中的CsCCD8
出乎意料,CsCCD7而且CsCCD8在柱头组织中检测到较高水平的转录本。在未成熟的橙子柱头中,这两种转录本的丰度都超过了维管组织、叶和根。CsCCD7而且CsCCD8在发育中的柱头中的表达表明这些酶和SLs可能具有有趣的新功能。女性器官c .巨大成功由一个三房子房,一个很长的花柱和3个红色花柱分枝组成的柱头折叠成喇叭状结构[91].这种结构已经出现在柱头的早期发育阶段,柱头长度约为2毫米[4],细胞不断伸长,直至柱头完全发育,最终长度为30毫米[92].生长素参与了花管的伸长番红花属[93]并且它们可能与风格延伸有关。伴随着细胞伸长,柱头脉管系统的发育发生,SLs可能积极参与这一过程,解释了蛋白的表达CsCCD7而且CsCCD8在病耻感的发展过程中。一旦柱头发育,衰老的柱头中基因的表达和SLs的产生可能都会下降。SLs在花发育中的一个假定功能已经被预期为矮牵牛ccd8 / dad1据报道,突变体的花更小[38在…时SlCCD8击倒系萼片、花瓣和花药比野生型植物小[25],表明SL缺乏会影响花的发育。
结论
在球茎植物中,分子和激素对芽萌发的调控在很大程度上是未知的,但这是球茎植物繁殖的基础。我们已经确定,球茎的行为与其他高等植物的茎相同,并且在顶端优势方面遵循相同的行为。在本研究中,茉莉酸、生长素和SLs对藏红花腋芽生长有负向调控作用,而细胞分裂素对藏红花腋芽生长有正向调控作用。SLs生物合成中的两个关键基因,CCD7而且CCD8,都是从藏红花中克隆出来的CsCCD8可能在控制根尖优势中起重要作用,但也在控制维管和柱头发育中起重要作用。随着其他植物对SLs通路的感知和信号传导机制的逐渐了解,需要做更多的工作来了解藏红花发芽过程的调控机制。
方法
化学品及植物材料
除非另有说明,化学品和试剂均来自Sigma-Aldrich。不同的器官和植物组织c .巨大成功在西班牙Tarazona de La Mancha的野外条件下生长的,在整个实验中都被使用。采集不同发育阶段的球茎、柱头、芽和叶片进行实验。所有组织冷冻在液氮中,并保存在-80°C,直到需要。
芽释放试验
9月采集15-20克藏红花球茎进行发芽实验。用无菌手术刀片切除根尖芽和其他植物组织,并在30天内每天记录每个球茎中腋芽的生长情况。1-萘乙酸(NAA)的浓度为50 μM。
木质素的组织化学染色
手工切取球茎切片,用间苯三酚染色检测木质素。将2体积2% (w/v)间苯三酚与1体积浓缩HCl混合在95%乙醇中制备间苯三酚-HCl试剂。所有照片均在染色后30分钟内拍摄。
激素水平
9月采集的藏红花球茎进行不同部位解剖。获得根尖芽、次芽或腋芽、根、基板、节、节、外表面和薄壁组织(图1),立即放入液氮冷冻并冻干。激素提取和分析如下:冷冻干燥植物材料经100 ng二氢茉莉酸加穗后,在蒸馏水中提取,[2H4水杨酸的酸。4℃4000 × g离心,回收上清液,30%醋酸调整pH为3.0。酸化水提取物与3毫升二乙醚分开两次。有机层在离心浓缩器(Speed Vac, Jouan, Saint Herblain Cedex,法国)中回收并在真空下蒸发。然后用温和的超声波将干燥的残渣重新悬浮在10%的MeOH溶液中。生成的溶液通过再生纤维素0.22 μm膜注射器过滤器(Albet s.a.,巴塞罗那,西班牙)过滤,并直接注入UPLC系统(Acquity SDS, Waters Corp.,米尔福德,马萨诸塞州,美国)。在C18色谱柱(machery - nagel, 1.8 μm粒径,50 × 2.1 mm, Scharlab, Barcelona, Spain)上使用MeOH:H进行分离2O(均添加0.1%醋酸)梯度,流速为300 μl min-1.激素定量使用Quattro LC三重四极质谱仪(Micromass, Manchester, UK),通过正交Z-spray电喷雾离子源在线连接到色谱柱的输出。
苎麻种子的萌发生物测定
如上所述,SLs是根系寄生植物种子的发芽促进剂。由于这种萌发活性,基于根寄生植物种子萌发的生物测定可以作为一种可靠的间接方法来量化植物根产生的SLs水平,特别是在它们尚未被表征的植物中,如藏红花。从不同藏红花球茎组织中提取SLs,如所述[94].简单地说,每个球茎组织取0.3 g,用液氮在砂浆中研磨,用0.3 mL 50%的丙酮在2 mL eppendorf管中提取两次。试管涡旋2分钟,在台式离心机中以8000 g在4ºC下离心5分钟。有机相小心地转移到2毫升的玻璃瓶中,并在-20°C保存直到使用。萌发生物测定p . ramosa种子(由Mauricio wurro博士提供,意大利巴里的食品生产科学研究所)在21ºC条件下预处理12 d。然后,将50 μl萃取液等分加入约100颗预处理种子的两个圆盘上,在25°C下孵育。生物测定以合成发芽促进剂GR24和脱盐水为阳性和阴性对照。7 d后,用双目显微镜计数发芽种子和未发芽种子。
克隆CsCCD7和CsCCD8
为了促进对藏红花SL功能的遗传分析,我们重点研究了藏红花SL生物合成途径中的步骤。藏红花部分编码序列CCD7而且CCD8被从c .巨大成功gDNA使用简并引物(表1)对应于的保守蛋白序列域答:芥,栽培稻,玉米梅斯CCD7而且CCD8orthologues。的CCD7而且CCD8使用GenomeWalker通用试剂盒(Clontech,http://www.clontech.com),并使用特定的寡核苷酸(表1).完整的CCD7而且CCD8利用特异性寡核苷酸从维管组织cDNA中扩增出编码序列(表1)和高保真DNA聚合酶(NEB)。从琼脂糖凝胶中提取DNA片段,用Promega Gel Extraction Kit分离,并连接到pGEM-T载体(Promega,http://www.promega.com).使用Macrogen公司(首尔,韩国)的自动DNA测序仪(ABI PRISM 3730xl, Perkin Elmer)对含有插入物的质粒进行测序。计算机辅助序列相似性搜索是用国家生物技术信息中心(NCBI;http://www.ncbi.nlm.nih.gov) Motif搜索使用PROSITE (http://expasy.hcuge.ch/sprot/prosite.html), tmpred (http://www.isrec.isb-sib.ch/sofware/sofware.html),讯号p (http://www.cbs.dtu.dk/services/SignalP)及PSORT II (http://psort.nibb.ac.jp).
系统发育分析
为了构建系统发育树,使用BLOSUM62矩阵与ClustalW (http://www.clustal.org)来自MEGA Version 5.0的基于算法的AlignX模块(http://www.megasoftware.net/mega.html).通过MEGA Version 5.0保存并执行对齐,生成带有自举(5000个重复)分析的邻居连接树,并处理成对删除的间隙。
实时定量RT-PCR (qPCR)
根据制造商的方案,从根尖芽、次生芽、根尖芽的维管组织、次生芽的维管组织、根、柱头和叶中分离总RNA,方法是将组织在液氮中研磨成细粉,每100 mg组织鲜重用1 ml Trizol试剂(Gibco-BRL)提取。RNA在100 μl无rnase水中重悬,用RQ1 RNase-free DNase (Promega)处理。对每个分析组织的10个生物样本的cDNA进行定量RT-PCR;反应是在GoTaq中建立的®qPCR Master Mix (Promega),按照厂家说明书,使用基因特异性引物(0.125 μM),最终体积为25 μl。引物采用Primer3程序设计(http://frodo.wi.mit.edu/).引物序列列于表中1.本构表达基因18SrRNA作为内参基因。qPCR的循环参数为94°C初始变性5 min;其后40个循环,94℃变性20 s, 58℃退火20 s, 72℃延伸20 s;最后在72℃下延长5分钟。使用StepOne™热循环仪(美国加州应用生物系统公司)进行分析,并使用StepOne软件v2.0(美国加州应用生物系统公司)进行分析。在反应之后,为每个引物组合创建DNA融化曲线,以确认单个产物的存在。
统计分析
使用GenStat for Windows对所有数据集进行单向方差分析(ANOVA)。当需要时,数据也受制于学生的t以及。
缩写
- 阿坝:
-
脱落酸
- CCD:
-
类胡萝卜素裂解双加氧酶
- 气体:
-
赤霉素
- 国际宇航科学院:
-
吲哚乙酸
- 聚合酶链反应:
-
聚合酶链反应
- SLs:
-
Strigolactones
- qPCR:
-
实时定量RT-PCR。
参考文献
- 1.
Rubio-Moraga A, Trapero A, Ahrazem O, Gomez-Gomez L:藏红花中Crocins的运输:从衰老的柱头到新生球茎的漫长道路。植物化学学报,2010,31(3):344 - 344。
- 2.
Hosseinzadeh, Nassiri-Asl M:阿维森纳(伊本·西那)的医学经典和藏红花(番红花):综述。植物学报,2013,27(4):475-483。
- 3.
Moraga AR, Rambla JL, Ahrazem O, Granell A, Gomez-Gomez L:藏红花柱头发育过程中的代谢产物和靶转录物分析。植物化学,2009,70(8):1009-1016。
- 4.
杨晓明,杨晓明,杨晓明,杨晓明,等,García-Luis A:温度对藏红花花形成的影响(藏红花学报,2005,29 (1):67 - 67
- 5.
Renau-Morata B, Moyá L, Nebauer SG, Seguí-Simarro JM, Parra-Vega V, Gómez MD, Molina RV:使用低温储存下生产的球茎作为藏红花离体繁殖的外植体来源,降低了污染水平,增加了繁殖工业。作物学报,2013,46:7-
- 6.
营养植物繁殖体休眠调控的概念综述。环境实验学报,1992,32 (4):9-
- 7.
Ahrazem O, Rubio-Moraga A, Trapero A, Gomez-Gomez L: Crocus sativus stimas 9-顺式环氧类胡萝卜素双加氧酶CstNCED基因表达的发育和胁迫调控。实验研究学报,2012,32(2):681-694。
- 8.
Farooq S, Koul KK:藏红花植物(Crocus sativus L.)球茎在休眠和发芽期间赤霉素样活性的变化。生物化学与物理学报,2003,26 (3):344 - 344
- 9.
Aguilar-Martinez JA, Poza-Carrion C,古巴P:拟南芥BRANCHED1作为腋芽内分支信号的积分器。植物细胞学报,2007,19(2):458-472。
- 10.
Shimizu-Sato S, Mori H:腋芽生长和休眠的控制。中国植物学报,2001,27(4):344 - 344。
- 11.
Brewer PB, Koltai H, Beveridge CA:独脚金内酯在植物发育中的不同作用。植物学报,2013,6(1):18-28。
- 12.
Bennett T, Sieberer T, Willett B, Booker J, Luschnig C, Leyser O:拟南芥MAX通路通过调控生长素转运控制枝条分枝。动物学报,2006,16(6):553-563。
- 13.
Stirnberg P, van De Sande K, Leyser HM:拟南芥MAX1和MAX2对照产生横向分支。发展,2002,129(5):1131-1141。
- 14.
梁娟,赵玲,Challis R, Leyser O:独脚金内酯对菊花茎部分枝的调控。实验学报,2010,61(11):3069-3078。
- 15.
Brewer PB, Dun EA, Ferguson BJ, Rameau C, Beveridge CA:直脚金内酯通过生长素下游调控豌豆和拟南芥芽的生长。植物营养学报,2009,30(1):482-493。
- 16.
Ferguson BJ, Beveridge CA:生长素,细胞分裂素和独脚金内酯在调节枝条分枝中的作用。植物科学进展,2009,29(4):344 - 344。
- 17.
Cook C, Coggon P, McPhail A, Wall M, whit hard L, Egley G, Luhan P:发芽刺激剂。2.独脚金种子发芽剂独脚金酚的结构。化学学报。2002,19 (2):1 - 2
- 18.
Akiyama K, Matsuzaki K, Hayashi H:植物倍半萜烯诱导丛枝菌根真菌菌丝分枝。自然科学学报,2005,35(6):344 - 344。
- 19.
叶山,谢霞,竹内勇:独脚金内酯的结构与生物活性。害虫防治学报,2009,65(5):467-470。
- 20.
Gomez-Roldan V, Fermas S, Brewer PB, Puech-Pages V, Dun EA, pilejp, Letisse F, Matusova R, Danoun S, Portais JC, Bouwmeester H, Bécard G, Beveridge CA, Rameau C, Rochange SF:直脚金内酯对枝条分枝的抑制。自然科学,2008,455(7210):189-194。
- 21.
Umehara M, Hanada A, Yoshida S, Akiyama K, Arite T, Takeda-Kamiya N, Magome H, Kamiya Y, Shirasu K, Yoneyama K, Kyozuka J, Yamaguchi S:新型萜类植物激素对枝条分枝的抑制作用。自然科学,2008,455(7210):195-200。
- 22.
Ruyter-Spira C, Al-Babili S, van der Krol S, Bouwmeester H:独脚金内酯的生物学。植物科学进展,2013,18(2):72-83。
- 23.
Kapulnik Y, Delaux PM, Resnick N, mayzish - gati E, Wininger S, Bhattacharya C, Sejalon-Delmas N, Combier JP, Becard G, Belausov E, Beeckman T, Dor E, Hershenhorn J, Koltai H:直脚金内酯影响拟南芥侧根形成和根毛伸长。植物学报,2011,33(1):379 - 379。
- 24.
Rasmussen A, Mason MG, De Cuyper C, Brewer PB, Herold S, Agusti J, Geelen D, Greb T, Goormachtig S, Beeckman T, Beveridge CA:直脚金内酯抑制拟南芥和豌豆的不定根。中国农业科学,2012,29(4):379 - 379。
- 25.
Kohlen W, Charnikhova T, Lammers M, Pollina T, Toth P, Haider I, Pozo MJ, de Maagd RA, Ruyter-Spira C, Bouwmeester HJ, López-Ráez JA:番茄类胡萝卜素切割蛋白DIOXYGENASE8 (SlCCD8)通过直龙果内酯生物合成调节根际信号、植物结构和影响生殖发育。植物学报,2012,36(2):339 - 344。
- 26.
Yoneyama K, Takeuchi Y, Sekimoto H:红三叶草缺磷促进了菌根共生体和根寄生虫萌发的信号—orobanchol的分泌。植物学报,2007,25(4):344 - 344。
- 27.
Lopez-Raez JA, Bouwmeester H:磷酸饥饿下独脚金内酯生物合成的微调调控。植物信号与行为学报,2008,3(11):963-965。
- 28.
Ha CV, Leyva-Gonzalez MA, Osakabe Y, Tran UT, Nishiyama R, Watanabe Y, Tanaka M, Seki M, Yamaguchi S, Dong NV, Yamaguchi-Shinozaki K, Shinozaki K, Herrera-Estrella L, Tran LS:直尾金内酯在植物干旱和盐胁迫响应中的正向调节作用。中国科学:自然科学,2013,26(2):349 - 349。
- 29.
Aroca R, Ruiz-Lozano JM, Zamarreno AM, Paz JA, Garcia-Mina JM, Pozo MJ, Lopez-Raez JA:盐胁迫下丛枝菌根共生影响莴苣产量并缓解盐胁迫。中国生物医学工程学报,2013,30(1):457 - 457。
- 30.
Torres-Vera R, Garcia JM, Pozo MJ, Lopez-Raez JA:独脚金内酯有助于植物防御吗?中国植物病理学杂志,2013,15(2):211-216。
- 31.
Beveridge CA, Ross JJ, Murfet IC: Pisum sativum分枝突变rms-2(嫁接研究和内源性吲哚-3-乙酸水平)。植物营养学报,2004,27(3):344 - 344。
- 32.
Sorefan K, Booker J, Haurogne K, Goussot M, Bainbridge K, Foo E, Chatfield S, Ward S, Beveridge C, Rameau C, Leyser O: MAX4和RMS1是调节拟南芥和豌豆芽分枝的同源双氧合酶样基因。基因开发,2003,17(12):1469-1474。
- 33.
Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P, Ghisla S, Bouwmeester H, Beyer P, Al-Babili S:从-胡萝卜素到卡拉内酯的路径,一种类似于直脚内酯的植物激素。科学通报,2012,29(3):344 - 344。
- 34.
Challis RJ, Hepworth J, Mouchel C, Waites R, Leyser O:更多的腋窝生长1 (MAX1)在直尾内酯信号上游进化多样性中的作用。中国生物医学工程学报,2013,26(4):379 - 379。
- 35.
濑户Y,佐藤A,麻美K,花田A,梅原M,秋山K,山口S:卡拉内酯是独脚金内酯的内源性生物合成前体。中国科学:自然科学,2014,29(4):344 - 344。
- 36.
Morris SE, Turnbull CG, Murfet IC, Beveridge CA:豌豆分枝的突变分析。Rms1和Rms5调节同一种新信号的证据。植物学报,2001,26(3):344 - 344。
- 37.
Booker J, Auldridge M, Wills S, McCarty D, Klee H, Leyser O: MAX3/CCD7是一种新型植物信号分子合成所需的类胡萝卜素切割双加氧酶。动物学报,2004,14(14):1232-1238。
- 38.
Snowden KC, Simkin AJ, Janssen BJ, Templeton KR, Loucas HM, Simons JL, Karunairetnam S, Gleave AP, Clark DG, Klee HJ:矮牵牛根尖显性降低基因1/矮牵牛类胡萝卜素切割基因DIOXYGENASE8影响分枝生成,并在叶片衰老、根系生长和花朵发育中发挥作用。植物细胞学报,2005,17(3):746-759。
- 39.
Vogel JT, Walter MH, Giavalisco P, Lytovchenko A, Kohlen W, Charnikhova T, Simkin AJ, Goulet C, Strack D, Bouwmeester HJ, Fernie AR, Klee HJ: SlCCD7控制番茄中单脚金内酯的生物合成、芽分枝和菌根诱导的类赤素的形成。植物学报,2010,36(2):344 - 344。
- 40.
王涛,王晓峰,王晓峰,王晓峰,王晓峰。猕猴桃类胡萝卜素切割蛋白DIOXYGENASE8的表达与猕猴桃分枝改变的相关性研究。植物保护学报,2010,38(3):344 - 344。
- 41.
Proust H, Hoffmann B, Xie X, Yoneyama K, Schaefer DG, Nogue F, Rameau C:直尾金内酯在苔藓小绒蚧中调节原丝体分支并作为群体感应信号。发展,2011,138(8):1531-1539。
- 42.
Kepinski S, Leyser O:植物发育:生长素轴。自然科学学报,2003,26(6):528 - 528。
- 43.
Leyser O:生长素对枝条分枝的调控。植物科学进展,2003,8(11):541-545。
- 44.
王志刚,李志刚,李志刚:植物类胡萝卜素解理加氧酶及其类胡萝卜素产物。植物学报,2006,9(3):315-321。
- 45.
Auldridge ME, Block A, Vogel JT, Dabney-Smith C, Mila I, Bouzayen M, magallane - lundback M, DellaPenna D, McCarty DR, Klee HJ:拟南芥类胡萝卜素切割双加氧酶家族的三个成员的特征表明了这个多功能酶家族的不同作用。植物学报,2006,45(6):982-993。
- 46.
梅原M,花田A,马美梅H,武田神谷N,山口S:独脚金内酯对缺磷水稻分蘖芽生长的抑制作用。植物生理学报,2010,51(7):1118-1126。
- 47.
Tsuchiya Y, Vidaurre D, Toh S, Hanada A, Nambara E, Kamiya Y, Yamaguchi S, McCourt P:一种小分子筛选识别植物激素单脚金内酯的新功能。化学与生物学报,2010,6(10):741-749。
- 48.
程x, Ruyter-Spira C, Bouwmeester H:独脚金内酯与其他植物激素在植物发育调控中的相互作用。植物科学学报,2013,4:199-
- 49.
Vallabhaneni R, Bradbury LM, Wurtzel ET:玉米,高粱和水稻中的类胡萝卜素双加氧酶基因家族。中国生物医学工程学报,2010,36(1):1 - 4。
- 50.
Foo E, Bullier E, Goussot M, Foucher F, Rameau C, Beveridge CA:分枝基因RAMOSUS1介导两种新信号与豌豆生长素的相互作用。植物细胞学报,2005,17(2):464-474。
- 51.
Arite T, Iwata H, Ohshima K, Maekawa M, Nakajima M, Kojima M, Sakakibara H, Kyozuka J: RMS1/MAX4/DAD1同源基因DWARF10控制水稻侧芽生长。植物学报,2007,26(6):357 - 357。
- 52.
Djennane S, hibrandt - saint Oyant L, Kawamura K, Lalanne D, Laffaire M, Thouroude T, Chalain S, Sakr S, Boumaza R, Foucher F, Leduc N:光温对月季枝条分枝梯度及直龙果内酯合成及信号基因表达的影响。植物细胞环境,2013,37(3):742-757。
- 53.
梁玉生,全雅,林sh, Kim JK, Lee JY, Kim YM, Lee YH, Ha SH:拟南芥类胡萝卜素裂解双加氧酶7基因启动子的血管特异性活性。植物细胞学报,2011,30(6):973-980。
- 54.
李张邹J,张年代,W, G,陈Z,翟W,赵X, X锅,谢问,朱镕基李:大米HIGH-TILLERING矮人1编码直接同源的拟南芥MAX3需要负调控产物的腋窝味蕾。植物学报,2006,48(5):687-698。
- 55.
Drummond RS, Martinez-Sanchez NM, Janssen BJ, Templeton KR, Simons JL, Quinn BD, Karunairetnam S, Snowden KC:矮牵牛花类胡萝卜素裂解DIOXYGENASE7参与矮牵牛花负和正分支信号的产生。植物科学进展,2009,29(4):379 - 379。
- 56.
Thimann KV, Skoog F:植物生长激素的研究:生长物质对芽发育的抑制作用。中国科学院学报,2003,19(7):714-716。
- 57.
马晓明,李志强,李志强。信号集成在枝条分枝控制中的应用。中国生物医学工程学报,2011,12(4):211-221。
- 58.
富兰克林KA:植物发育中的光和温度信号串扰。植物学报,2009,12(1):63-68。
- 59.
Kebrom TH, Burson BL, Finlayson SA:光敏色素B抑制Teosinte Branched1表达,诱导高粱腋芽生长响应光信号。植物科学进展,2006,30(3):379 - 379。
- 60.
刘志刚,刘志刚,刘志刚,刘志刚:光敏色素对拟南芥分枝的调控。中国生物医学工程学报,2010,29(4):344 - 344。
- 61.
Arumingtyas E, Floyd R, Gregory M, Murfet I: Pisum的分支:17个ramossus突变体的遗传和等位基因试验。植物学报,1992,24:14-
- 62.
贝弗里奇CA,罗斯JJ, Murfet IC:豌豆分枝(基因rm3和rm4的作用)。植物营养学报,2004,27(3):344 - 344。
- 63.
Sussex IM, Kerk NM:植物建筑的进化。植物学报,2001,4(1):33-37。
- 64.
Wasternack C, Hause B:茉莉酸酯:生物合成,感知,信号转导和在植物应激反应,生长发育中的作用。植物保护学报,2013,36 (6):337 -
- 65.
钟伟,高震,庄伟,史涛,张震,倪震:日本杏季节性芽休眠四个关键阶段的全基因组表达谱。中国生物医学工程学报,2013,29(3):344 - 344。
- 66.
秦青,Kaas Q,张春,周玲,罗霞,周敏,孙霞,张玲,白k -Y,崔勇:多梨南芥“小嫩兰”花的冷唤醒:叶片在冷诱导芽休眠释放中的作用。植物生长规律,2012,31(2):139-155。
- 67.
孙娟,陈强,齐琳,姜红,李松,徐勇,刘峰,周伟,潘杰,李霞,Palme K,李春:茉莉酸调节拟南芥PIN2蛋白的内吞作用和质膜积累。植物学报,2011,19(2):366 - 366。
- 68.
王娟,闫德伟,袁婷婷,高鑫,陆宜涛:IAA8基因功能获得性突变通过茉莉酸水平的变化改变拟南芥花器官发育。中国生物医学工程学报,2013,32(1):1- 3。
- 69.
Muller D, Leyser O:生长素,细胞分裂素与枝条分枝的控制。学报学报,2011,107(7):1203-1212。
- 70.
哈东W, Sauter A, Hose E:木质部中的脱落酸:它从哪里来,到哪里去?应用物理学报,2002,32(3):344 - 344。
- 71.
Sakakibara H, taki K, Hirose N:氮与细胞分裂素在代谢和发育调控中的相互作用。植物科学进展,2006,11(9):440-448。
- 72.
田中平,李志刚,李志刚。生长素与细胞分裂素的相互作用对枝条分枝的影响。植物分子生物学,2009,69(4):429-435。
- 73.
王晓明,王晓明,王晓明,王晓明。番红花中酚类化合物的含量测定及其抗氧化活性研究。中国药理学杂志,2011,7(25):74-80。
- 74.
Hayward A, Stirnberg P, Beveridge C, Leyser O:生长素与直脚金内酯在枝分枝控制中的相互作用。植物营养学报,2009,31(1):344 - 344。
- 75.
李志刚,李志刚,李志刚,李志刚。寄主-寄生植物相互作用中次生代谢产物信号的研究进展。植物学报,2003,6(4):358-364。
- 76.
李佳杰,刘建平,刘建平,等:双枝豌豆幼苗吲哚乙酸转运的自抑制及其与相关优势的关系。植物化学学报,1999,16 (3):344 - 344
- 77.
盾EA,布鲁尔PB,贝弗里奇CA:独脚金内酯:难以捉摸的枝分枝激素的发现。植物科学进展,2009,14(7):364-372。
- 78.
Shinohara N, Taylor C, Leyser O:单脚金内酯可以通过触发生长素外排蛋白PIN1从质膜上快速消耗来促进或抑制枝条分枝。公共科学图书馆,2013,11 (1):e1001474-
- 79.
Napoli CA, Beveridge CA, Snowden KC:重新评价顶端优势和腋芽生长控制的概念。中国生物医学工程学报,1999,44:127-169。
- 80.
福E,特恩布尔CG,贝弗里奇CA:豌豆rm1突变体的远程信号和分枝控制。植物学报,2001,26(3):344 - 344。
- 81.
Kohlen W, Charnikhova T, Liu Q, Bours R, Domagalska MA, Beguerie S, Verstappen F, Leyser O, Bouwmeester H, Ruyter-Spira C:在非丛枝菌根寄主拟南芥中,直脚金内酯通过木质部运输,并在幼苗对磷酸盐缺乏的结构反应中起关键作用。中国生物医学工程学报,2011,27(2):344 - 344。
- 82.
Pasare SA, Ducreux LJ, Morris WL, Campbell R, Sharma SK, Roumeliotis E, Kohlen W, van der Krol S, Bramley PM, Roberts AG, Fraser PD, Taylor MA:马铃薯CCD8基因在匍杆和块茎发育中的作用。植物学报,2013,198(4):1108-1120。
- 83.
Johnson X, Brcich T, Dun EA, Goussot M, Haurogne K, Beveridge CA, Rameau C:在豌豆中控制一种新信号的基因被其他长距离信号共同调节。植物科学进展,2006,26(3):344 - 344。
- 84.
Thimann KV: 50年的植物激素研究。植物营养学报,2004,27(4):457 - 457。
- 85.
Gocal GF, Pharis RP, Yeung EC, Pearce D:嫩绿菜豆大腋芽中吲哚-3-乙酸和脱落酸浓度的变化。植物营养学报,2001,26(2):349 - 349。
- 86.
Agusti J, Herold S, Schwarz M, Sanchez P, Ljung K, Dun EA, Brewer PB, Beveridge CA, Sieberer T, Sehr EM, Greb T:单脚金内酮信号在植物生长素依赖性刺激中的作用中国科学:自然科学,2011,29(3):349 - 349。
- 87.
Walter MH, Floss DS, Strack D:类夹心素:激素,菌根代谢物和芳香挥发物。植物学报,2010,32(1):1-17。
- 88.
Floss DS, Walter MH:类胡萝卜素裂解双加氧酶1 (CCD1)在类胡萝卜素生物发生中的作用。植物信号行为学报,2009,4(3):172-175。
- 89.
Ilg A, Yu Q, Schaub P, Beyer P, Al-Babili S:水稻类胡萝卜素裂解双加氧酶1基因在水稻胚乳中的过表达提示类胡萝卜素是植物的底物。植物学报,2010,32(3):691-699。
- 90.
林华,王蓉,钱强,闫敏,孟x,付震,闫超,姜波,苏忠,李娟,王艳:矮秆内酯生物合成必需的含铁蛋白DWARF27调控水稻分蘖芽生长。植物细胞学报,2009,21(5):1512-1525。
- 91.
M:藏红花繁殖生物学。园艺学报,2004,30 (6):529 - 531
- 92.
Rubio A, Rambla JL, Santaella M, Gomez MD, Orzaez D, Granell A, Gomez-Gomez L: Crocus sativus的胞质和质体蛋白靶向类胡萝卜素双加氧酶都参与β -ionone的释放。中国生物医学工程学报,2008,29(3):344 - 344。
- 93.
Crocus vernus iriridaceae花管伸长的解剖学和生理学研究。学报学报,2002,26(3):379 - 379。
- 94.
Lopez-Raez JA, Charnikhova T, Gomez-Roldan V, Matusova R, Kohlen W, De Vos R, Verstappen F, Puech-Pages V, Becard G, Mulder P, Bouwmeester H:番茄单脚金内酯来源于类胡萝卜素,其生物合成由磷酸盐饥饿促进。生态学报,2008,34(4):863-874。
确认
我们感谢J. Argandoña (Instituto Botánico, universversidad de Castilla-La Mancha, Albacete, Spain)的优秀技术支持,以及K.A. Walsh的语言修订。该实验室由西班牙科学部长Innovación (BIO2009-07803)资助,并参与了IBERCAROT网络(112RT0445)。Ahrazem博士由FPCYTA通过increcycle计划资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有利益竞争。
作者的贡献
ARM进行了生理学研究并起草了手稿。OA进行了实时PCR实验,并帮助起草了手稿。RMCP和AGC测定激素水平。KY和JALR进行了独脚金内酯的测定,并帮助起草了手稿。RVM参与了研究的设计、统计分析和数据解释。LGG构想了这项研究,参与了设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2014_1578_moesm1_esm.ppt
附加文件1:图S1:每个发芽的腋芽将形成一个新的替代球茎。A)发育的新球茎由顶端芽形成。B)发育的新球茎由腋窝芽形成,根尖芽去冠后萌发发育。(ppt 3mb)
12870 _2014_1578_moesm2_esm.ppt
附加文件2:图S2:激素处理对藏红花球茎发芽的不同影响。信号+指根尖芽切除。信号-指完整的球茎及其顶端芽。GA3,赤霉素酸;NAA, 1-萘乙酸;软面包卷,benzylaminopurine。表面消毒球茎在含或不含不同激素的MS培养基中生长,终浓度为100 μM。治疗后10天拍摄。该表显示了发芽的腋芽的平均长度。(ppt 2 mb)
12870 _2014_1578_moesm3_esm.pptx
附加文件3:图S3:利用Phytozome v9.1数据库中的CsCCD8a和b氨基酸序列获得的CCD8基因在不同植物物种中的同源物。显示每个基因的共时性以及外显子的分布。蓝框为外显子,灰线为内含子。(pptx765 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Rubio-Moraga, A., Ahrazem, O., Pérez-Clemente, R.M.et al。藏红花的顶端优势和分枝酶CCD7和CCD8在芽发芽控制中的参与。BMC植物生物学14,171(2014)。https://doi.org/10.1186/1471-2229-14-171
收到了:
接受:
发表:
关键字
- 生长素
- 味蕾
- 类胡萝卜素裂解加氧酶
- 球茎
- 藏红花
- Strigolactones