- 研究文章
- 开放获取
- 发布:
挥发性排放Eurosta solidaginis.引发草食病诱导的挥发性生产一枝黄花altissima并不能直接阻止昆虫进食
BMC植物生物学体积14文章编号:173(2014)
摘要
背景
植物防御对草食反应的诱导是有充分文献记载的。此外,许多植物在暴露于与随后攻击风险增加相关的环境线索(包括由食草动物受损的植物组织诱导的挥发性排放)后,启动了它们的抗食草动物防御。最近,我们在野外和实验室环境中发现,高大的黄花植物(一枝黄花altissima)暴露于一种专门致瘿蝇的假定性引诱物(Eurosta solidaginis.)比未暴露的植物更少的食草性。此外,我们观察到,与对照相比,暴露的植物对防御激素茉莉酸的诱导更强。这些发现证明了一类由植物直接感知昆虫嗅觉线索介导的植物-昆虫相互作用。然而,我们之前的研究并不排除苍蝇的排放物(或其残留物)也可能通过对食草动物的直接影响而阻止昆虫进食的可能性。
结果
这里我们展示了大肠solidaginis排放并不能(直接)阻止食草动物捕食葫芦塔辣椒要么Symphyotrichum sultfliflorum植物-哪些与之没有共同进化关系大肠solidaginis因此不会对苍蝇的发射表现出启动反应。我们也证实了更强的植物挥发物(HIPV)的诱导美国altissima植物以前暴露于相对于未曝光控制的苍蝇发射。玉米植物中没有观察到类似的效果(Zea Mays.),这没有与之共同的关系大肠solidaginis。
结论
结合我们之前的发现,这些结果提供了令人信服的证据,减少了食草动物美国altissima植物暴露于雄性的排放物中大肠solidaginis反映了与其专业食草动物相关的嗅觉线索的进化植物反应,并不涉及飞行发射对食草动物喂养行为的直接影响。我们进一步讨论了在此记录的HIPV响应的启动可能有助于增强的机制美国altissima防御难堪的。
背景
尽管他们久坐了生活方式,但植物积极地感知并响应广泛的环境线索,包括昆虫食草动物攻击的人。昆虫草食后诱导植物防御性很好的表征[1-4.].最近的工作表明,在进食前,许多植物物种也表达或赋予食草相关环境提示的抗草食性防御,包括与食草病或其卵的身体存在有关的物理和生化线索[5.-7.].进一步的研究表明,防御启动发生在对空气中的化学信号的反应中,特别是由邻近的植物(或同一植物的远处部分)排放的损害诱导的挥发性有机化合物,这些植物已经经历了食草性[8.-14].
最近,我们在黄花中发现了一个明显的类似防御启动的例子(一枝黄花altissima)暴露在一种直接来自昆虫食草动物的嗅觉线索下——一种专门诱瘿的苍蝇推定的性信息素Eurosta solidaginis.[15].具体而言,我们观察到在对雄性苍蝇挥发排放的植物中显着减少了草食性和现场研究,以及增强植物在昆虫喂养损伤的排放植物中的关键防御植物血管族茉莉酸的诱导。根据这项工作,目前的研究阐明了暴露在飞行排放的额外影响美国altissima防御反应,以及排放本身对昆虫喂养的直接影响。
众所周知,植物能对空气中的化学物质作出反应。例如,气体植物激素乙烯的不同和关键功能已经被记录和阐明了几十年[16-19].近期的研究阐明了植物对环境衍生的嗅觉线索的反应性。属的寄生植物cuscuta.,例如,已经被证明朝着宿主植物衍生的挥发物生长[20.],并且如上所述,植物可以对昆虫进食引起的植物气味作出反应[9.-13那21-23].
我们的演示美国altissima对假定的性引诱物的反应大肠solidaginis[15文献记载了一类新的植物-昆虫相互作用,这种相互作用是由植物对直接来自昆虫拮抗剂的嗅觉线索的感知介导的。在该研究中,我们还提出了两个可能会影响我们研究结果的解释的替代假设:(i)观察到的效应可能反映了苍蝇对宿主植物的生化操纵(而不是植物对表明苍蝇存在的线索的适应性反应),以及(ii)存在于植物组织上的一些苍蝇排放的残留物本身可能阻止后续的食草性。这些假设中的第一个很难与我们之前的发现相一致大肠solidaginis在野外歧视暴露于排放的植物,这强烈表明这些植物作为果蝇后代宿主的质量受到了损害,而不是提高[15].第二种假说也被我们之前的发现所反驳,特别是观察到暴露的植物对随后的草食的JA反应显著增强,表明观察到的效应确实是由植物对暴露的生理反应介导的。然而,这种增强的存在并不排除这样一种可能性,即苍蝇的排放也可能对昆虫的摄食产生直接的威慑作用,从而导致随后食草动物的减少。因此,目前的研究试图提供更多的证据,暴露于大肠solidaginis发射引起美国altissima并直接测试其对昆虫摄食的影响。
进一步探索美国altissima防御反应,我们分析了挥发性的生产美国altissima植物暴露于大肠solidaginis在食草动物损坏之前和之后的排放和未曝光控制。除了为邻近植物提供嗅觉线索之外,如上所述,植物挥发排放的草食物诱导的变化是通过提供招募喂养食草动物的自然敌人的提示来赋予防御利益[24-29通过额外的食草动物抑制喂养或产卵[30.-33.].此外,已知挥发性诱导由JA介导[34.那35.[因此,可能反映先前我们记录的JA归纳的下游影响。除了检查效果大肠solidaginis排放在美国altissima挥发性反应,我们在玉米(Z. Mays.).因为玉米没有明显的共同进化或生态关系大肠solidaginis我们之前没有观察到昆虫对暴露玉米的摄食减少[15],我们预测接触到了大肠solidaginis排放不会引起该植物挥发性诱导的变化。
探索潜在的直接影响大肠solidaginis我们用条纹黄瓜甲虫(Acalymma vittatum)喂大肠solidaginis暴露的壁球植物(葫芦塔辣椒var。texana)或未暴露的对照和使用GoldenRod叶甲虫进行类似的测定(Trirhabda virgata)取食受辐射的花斑紫菀(Symphyotrichum sultfliflorum)或控制。还是因为两者之间没有任何明显的联系大肠solidaginis苍蝇和壁球或卡里科·艾斯特植物我们没有指望南瓜或卡里科艾斯特表现出任何生理反应大肠solidaginis因此,观察到的喂养损害的任何减少都可能归因于排放的直接威慑作用。
结果
不稳定的集合
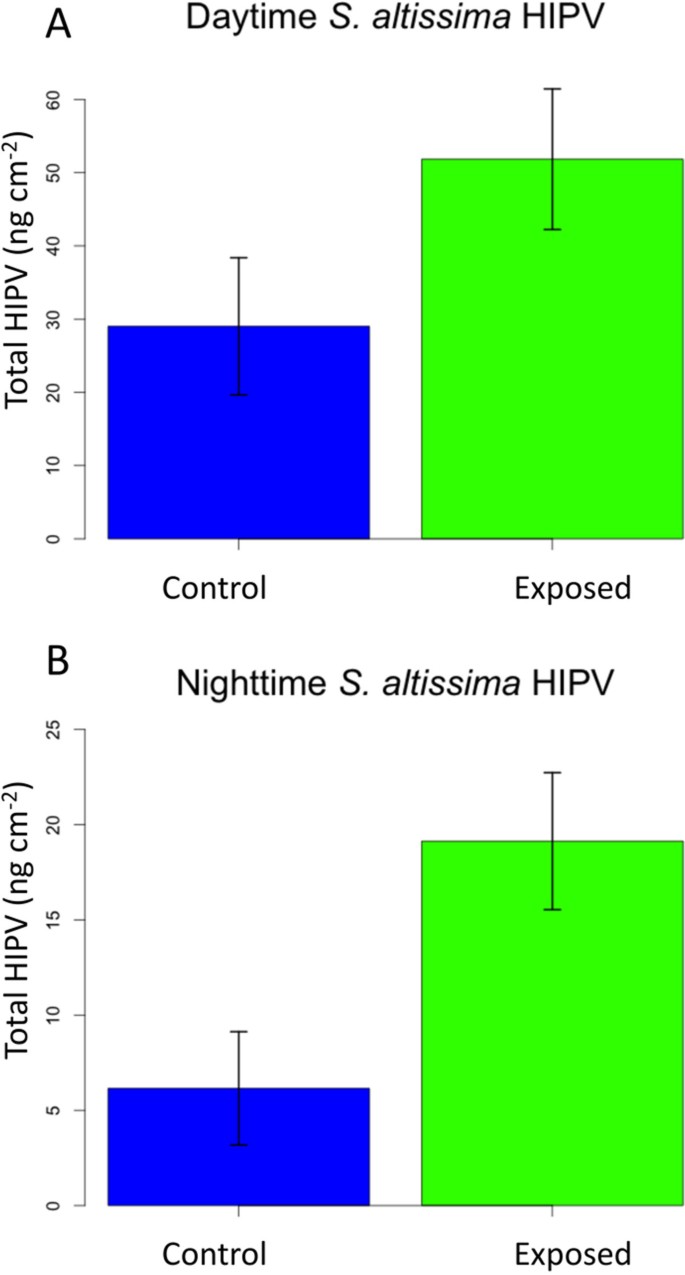
来确定是否暴露于大肠solidaginis排放启动的草食动物诱导的挥发性生产美国altissima植物,我们分析了由此产生的挥发物美国altissima在喂养伤害之前和之后暴露于发射和未曝光植物的植物Heliothis virescens毛毛虫。这种通用毛虫物种用于代替大肠solidaginis对于挥发性诱导测定,因为它触发了强烈的挥发性反应美国altissima因为苍蝇令人讨厌的习性使它们难以用于此类化验[36.].此外,通过替换一个通才的嚼叶草食动物,我们能够比较相同的草食动物在玉米和黄花中的挥发诱导。在食草动物出现之前,我们发现在挥发性物质的产生上没有区别美国altissima以前暴露于发射和未曝光的控制植物的植物(附加文件1:表S1)。喂食后h . virescens然而,我们发现,暴露于排放的植物在白天(29.0 ng cm)都产生了更多的草食动物诱导的植物挥发物(HIPV)-251.8 ng cm-2对未暴露和暴露的植物,分别)和夜间(6.2 ng cm-2和19.1 ng cm-2),表明对昆虫损害的更加蓬勃的反应(图1,一天:两面T.-测试,T. = −1.93, df = 18,P.= 0.069;数字1B,夜晚:双面T.-测试,T.=−3.00,df = 18,P.= 0.0078)。我们在光期和暗期收集挥发物,因为以前的研究记录了在这些阶段释放的挥发物的大量变化,白天或夜间活动的昆虫可以对它们活动高峰期释放的挥发物更敏感[31.那33.].
我们还对日间和夜间的HIPV进行了主成分分析,并绘制了每个成分的前两个成分,以可视化混合物中哪些化合物可能导致处理之间的差异(附加文件)2:图S1A,S1B)。对于白天HIPV,前两个主要成分占差异的96.3%。对于夜间HIPV,前两个主要成分占差异的96.4%。总共测量并确定了二十三种化合物美国altissima挥发性混合。与对照或比较受损和未损坏的植物的混合物相比,我们发现没有在发射植物的HIPV混合物中的新化合物;然而,我们在白天和夜间共混物中鉴定了几种特定的化合物,该化合物被诱导的发射植物(表1).大量释放的化合物(P.α-蒎烯、β-蒎烯和柠檬烯。三种化合物也有轻微的显著性差异,包括乙酸龙脑酯(P.= 0.09)和单萜莰烯(P. = 0.09) and myrcene (P.= 0.06)。在夜间混合,辐射暴露美国altissima在明显更高的量中发出以下化合物(P.≤0.05);单萜α-蒎烯、β-蒎烯、月桂烯、柠檬烯;倍半萜石竹烯、α-腐竹烯、β-法尔烯、大戟烯D;4种化合物均有极显著性差异,包括绿叶挥发物(GLV) (Z.)-3-hexen-1-ol(P. = 0.07) and (Z.) 3-hexenyl异丁酸盐(P.= 0.07)、萜醇芳樟醇(P. = 0.09) and (Z.)茉莉酮(P.= 0.06)。未经曝光的对照植物没有含量显着较高的化合物。
测试是否观察到接触后的HIPV生产增加大肠solidaginis发射代表了来自共进进化的宿主植物物种或通用植物对化合物的一般植物反应的特定反应,我们还研究了暴露的影响大肠solidaginis玉米植物中挥发性生产的排放(Z. Mays.).至于美国altissima,我们发现未受污染的玉米植株的挥发分总量与未受污染的对照植株的挥发分总量没有差异;然而,在这里我们也发现挥发性共混物之间没有差异h . virescens对暴露或对照植株的取食损害,表明玉米植株没有反应大肠solidaginis通过提高HIPV生产(附加文件3.:表S2)。草食病损坏的玉米植物暴露于Eurosta发射产生89.2±80.3 ng cm-2在白天和未暴露的对照组产生143.9±42.9 ng cm-2.夜间HIPV生产从Eurosta- 散装植物为21.2±8.3 ng cm-213.1±6.6 ng cm-2来自未暴露的控制植物。(日:双面T.-测试,T.= 0.60, df = 14,P.= 0.56;晚上:两面T.-测试,T. = −0.77, df = 14,P.= 0.46)。
喂养分析
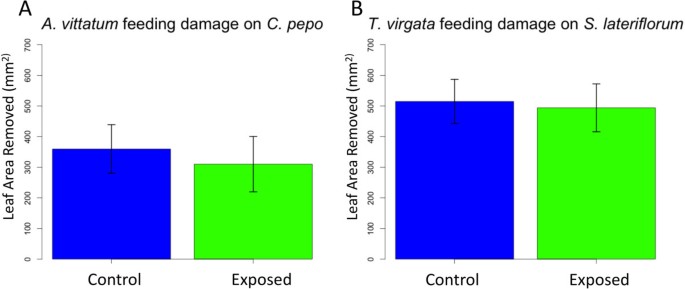
测试存在的假设大肠solidaginis发射可能直接阻止在暴露的植物上喂养昆虫,我们用专业甲虫食草动物进行喂养测定答:vittatum以暴露和未暴露的食物为食C. Pepo.植物。葫芦塔辣椒只是远亲美国altissima并没有明显的联系大肠solidaginis.我们还进行了类似的喂养测定T.Virgata.以暴露和未暴露的食物为食Symphyotrichum lateriflorum。Trirhabda virgata我们以前的植物反应研究过大肠solidaginis发射并被发现消耗较少的叶片曝光叶片美国altissima[15].这个物种天生以SOINAGO.和一些密切相关的属,包括Symphyotrichum[37.-39.].Symphyotrichum sultfliflorum适宜的寄主植物种类是什么T.Virgata.但不是大肠solidaginis;因此,我们预测大肠solidaginis排放不会增加Symphyotrichum sultfliflorum防御或阻止T.Virgata.喂食。结果表明,两种植物对叶组织的总消耗量无显著差异答:vittatum暴露或控制甲虫C. Pepo.(数字2,双面T.-测试,T.18= 0.41,P.= 0.69)或T.Virgata.喂食或控制Symphyotrichum sultfliflorum(数字2b,双面T.-测试,T.12= 0.16,P.=0.87),表明这些植物物种似乎没有共同的进化史大肠solidaginis,没有改变他们的防御,以应对其排放,排放不直接阻止食草动物喂养。
讨论
我们之前报道过美国altissima植物能感知雄性的挥发性排放物大肠solidaginis并通过增强它们的抗草食防御来做出反应[15].这里提出的发现为这一现象提供了额外的生理学证据,并揭示了一种特定的下游抗草食动物防御——草食动物诱导的挥发性产物——是由暴露在排放物中启动的。虽然HIPV在这一系统中的生态意义尚未被探索,但很可能美国altissima挥发性排放在植物防御中发挥着对抗昆虫食草动物的作用[36.],正如众多植物物种都已发现[24-33.那40].
暴露于男性的排放大肠solidaginis增加了日间草食动物诱导的挥发性产量约44%,夜间产量约68%。HIPV产生的这些实质性差异似乎为相关节肢动物群落的成员提供了一个强烈的信号,可能包括觅食捕食者和寄生性动物。Eurytoma.寄生虫大肠solidaginis在白天活跃(个人观察,[41.),但我们不知道有人试图描述它们在夜间的活动水平。鉴于对夜间波动的强烈感应,我们有理由假设夜间活动的天敌可能会利用这些线索。
先前的研究发现,与未提升的对照植物相比,引发玉米植物优先吸引了天然敌人的浓缩HIPV排放[42.].一些浓度损坏的一些化合物,大肠solidaginis-emission-exposed美国altissima以前已与其他系统中的昆虫食草毒物联系起来。例如,绿叶挥发物(GLV)和Terpenes为寄生虫和捕食者吸引力,食草动物驱动和降低食草动物性能提供重要信号[30.那31.那40那43.-45.].另外,在本研究中提出的一些辛特萜烯,包括β-法兰烯,β-亚芳烯烯烯和生殖酮D,也通过暴露于HIPV的灌注杨树和/或玉米植物以较高的量发出[11那46.].
与之相反美国altissimaHIPV响应后h . virescens攻击,当相同的通用毛虫物种袭击排放玉米植物时,我们观察到HIPV生产没有类似的增加。这些对比结果支持我们的假设美国altissima植物表现出一种感知和响应其密切相关的食草动物的排放能力的进化能力大肠solidaginis.似乎其他植物物种也可能进化了检测其食草动物的信息素的能力,但我们假设这种适应性最有可能在密切地共同进化的植物 - 昆虫相互作用中发展,这可能具有单噬或狭窄的食草食草对主机植物健身产生强烈影响的物种[15].
在我们之前的工作中,我们观察到的幼虫和成虫T.Virgata.消耗更少的叶子组织美国altissima植物暴露于大肠solidaginis与对照植物相比发射[15].在同一研究中,我们还观察到在我们的野外实验中,排放暴露植物的食草性普遍减少,这些结果与我们对排放暴露植物的摄食减少的假设是一致的美国altissima植物是进化反应的结果美国altissima对它的专业食草动物大肠solidaginis.在目前的研究中,我们观察到喂养没有差异答:vittatum在他们优选的宿主植物种类上C. Pepo,(像玉米那样没有明显的关系大肠solidaginis)随着和不接触飞行的挥发性排放。我们也发现喂养伤害没有差异T.Virgata.在排放暴露或控制上S. sultriflorum。后一种结果是特别感兴趣的,因为Symphyotrichum sultfliflorum是一个紧密的相对美国altissima这是一个合适的宿主工厂T.Virgata.但不是大肠solidaginis[37.-39.].因此,这些结果强烈地表明,昆虫食草动物,在这种情况下,两种食草甲鱼,并没有直接被大肠solidaginis排放。
结论
这里提出的调查结果为我们的假设提供了进一步的支持美国altissima植物能感知并对假定的性引诱物作出反应大肠solidaginis。相反,我们没有发现证据表明大肠solidaginis排放直接阻止昆虫喂养。此外,在发射暴露中提高HIPV诱导美国altissima这里观察到的植物补充了我们之前的发现,草食植物的JA诱导增强美国altissima先前受蝇类排放物污染的植物[15,提供了更多的证据,以减少食草动物美国altissima植物暴露于挥发性排放物大肠solidaginis实际上,从其密切相关的食草动物中反映了这种植物物种对嗅觉提示的演变的适应性反应。因此,我们可以在更确定的情况下得出结论,该系统提供了由植物衍生的嗅觉线索的植物感知介导的新型植物 - 昆虫相互作用的第一个例子。
方法
研究制度
成人大肠solidaginis在宾夕法尼亚州,苍蝇通常在5月中旬出现,雄苍蝇在黄花植物上寻找栖身之处,以此来吸引配偶。41.那47.].我们发现,在栖息植物的同时,雄性蝇散发出大量推定的性能信息素,对女性苍蝇有吸引力(平均〜70±20μg24小时-1;[15])。交配后,雌性开始寻找合适的产卵地点,通常产卵在同一或附近的植物茎。生殖的输出美国altissima植物显着遭受陷阱大肠solidaginis[41.];因此,探测与即将发生的攻击有关的可靠线索,如雄蝇的排放物,可以为植物提供防御优势大肠solidaginis攻击 [15].大肠solidaginis在5-8天内孵化,幼虫诱导的疾病通常在3周内变得可见[41.].
植物
我们宣传了高大的金石(一枝黄花altissima),在无虫、气候控制的生长室内(16 h光照:8 h黑暗;22°C: 20°C;相对湿度(RH) 65%)。本实验的根状茎是从美国altissima最初采集自美国宾夕法尼亚州州立学院附近的田地,种植前清洗并储存在4°C。我们将直径相近的根茎切成5厘米的段,并将其种植在泥炭为基础的盆栽土壤(Pro-Mix BX;Premier Horticulture公司,Quakertown, PA, USA)。种植两周后,我们用相同的土壤将发芽的分株移栽到单独的花盆(16厘米直径,16.5厘米高),并在每个花盆中添加0.5茶匙的Osmocote肥料(8-45-14 N-P-K, Scotts, Marysville, OH, USA)。美国altissima实验中使用的植物是8周龄,高35厘米。
我们种玉米(Zea Mays.简历。在无虫、气候控制的生长室内(16小时光照:8小时黑暗;25°C: 25°C;65% RH)。我们将种子在泥炭基质的盆栽土壤中发芽,并在种子发芽大约1周后将幼苗移栽到单个盆栽中。在这个时候,植物收到了0.5茶匙的渗透科肥料。Z. Mays.实验所用植株为三叶期。
我们生长野生葫芦(葫芦塔辣椒var。texana)从种子中种子,无昆虫,气候控制的生长室(16小时光:8小时暗; 23°C:21°C; 65%RH)。我们用0.5茶匙Osmocote肥料种植泥炭灌木土壤中的种子。C. Pepo.本试验使用的植株为3.5周龄(4片完全展开的叶片)。
我们长大了Calico Aster(Symphyotrichum sultfliflorum)从无昆虫,气候控制的生长室中的根茎植物(16小时光:8小时暗; 23°C:21°C; 65%RH)。在这些相同条件下,从种子(草原月亮苗圃,Winona,Mn,USA)生长的植物中收获了该实验的根茎。重要的是,这种种子来源在自然范围内大肠solidaginis及其SOINAGO.寄主植物种类[41.].收获根茎,在种植之前洗涤并在4℃下储存并储存。我们在泥炭型灌封土壤中种植了2厘米的根茎,0.5茶匙Osmocote肥料。美国lateriflorum本试验采用4周龄的植株,叶基生莲座,茎长约20厘米。
昆虫
我们收集了成年男性Eurosta solidaginis.我们在美国宾夕法尼亚州州立学院附近收集了越冬虫瘿,并在−20°C下储存。为了诱导虫瘿羽化,我们将虫瘿置于气候控制的培养箱中(16 h光照:8 h黑暗;22°C, 20°C;65% RH)约3周。
我们养烟芽虫(Heliothis virescens)在气候控制的培养箱(16小时光照:8小时黑暗;22°C, 20°C;65% RH),从购买的鸡蛋(Bio-Serv, Frenchtown, NJ, USA)中喂食人工酪蛋白为主的饲料。h . virescens实验用四龄幼虫,在室温下饥饿24 h。喂,h . virescens之前发现毛虫会引起强烈的挥发性物质美国altissima植物(36.].
我们饲养条纹黄瓜甲虫(Acalymma vittatum)在一个实验室的群体中,从美国宾夕法尼亚州州立学院附近采集的成虫,并喂养它们生长室培育的黄瓜植株。试验用黄瓜甲虫为成年成虫,室温饥饿24 h后进行试验。
我们收集黄花金龟子(Trirhabda virgata)来自美国宾夕法尼亚州州立大学附近的自然种群。我们给甲虫喂食,让它们在室内生长美国altissima实验前将其置于室温下冷藏24 h。实验中,每株植物分别接受2只成年雌株和1只成年雄株T.Virgata.甲虫。
收藏E solidaginis发射
遵循我们之前描述的方法,我们收集了男性大肠solidaginis通过在小玻璃室中曝气的新出现的成年雄性苍蝇24小时发射[15].我们以0.6 L·min的速度将经过过滤的室内空气推入室中-1在0.5升·分钟的含有45毫克Super-Q(Alltech Associates,Deerfield,IL,USA)的吸附过滤器上,将空气从腔室中拔出。-1.我们使用150 μL的二氯甲烷洗脱过滤器,并将单个样品汇集,以确保暴露处理的排放浓度一致。
辐射暴露疗法
在各个玻璃室(4-L体积)内,我们暴露S. Altissima,Z.Mays,C. Pepo,和美国lateriflorum植物对雄性提取物大肠solidaginis排放或二氯甲烷溶剂控制24小时[15].花盆的边缘支撑着两件铝和特氟隆基座。植物的茎穿过铝基上的一个洞,用棉花包裹住茎和茎基之间的空隙。防止凝结物的积累和不现实的集中大肠solidaginis经过过滤的空气以3.0 L·min的速度被推入腔室-1并在1.0 L·min中拔出-1.在开始曝光处理之前,我们允许植物适应腔室1小时。我们应用了12-h男性等效(40μl)大肠solidaginis向每个橡胶隔片排放粗萃取物或二氯甲烷,并向每个玻璃室添加两个隔片。12小时后,我们在每个室中添加了两个新的含溶剂的隔膜。
不稳定的集合
我们使用自动推拉式挥发性化合物收集系统(分析研究系统,Gainsville, FL, USA)从暴露物中收集植物产生的挥发性化合物美国altissima和Z. Mays.植物前后食草性损伤。挥发性的收集是在一个气候控制的生长室内进行的(16 h光照:8 h黑暗;22°C, 20°C;65% RH)。在收集过程中,经过滤的空气以3.0 L·min的速度进入每个室-1并通过吸附过滤器(含有45毫克Super-Q [Alltech Associates,Deerfield,IL,USA])以1.0 L·Min拔出-1.我们在光期(06:00-22:00)收集挥发物16小时,在暗期(22:00-06:00)用一套单独的过滤器收集挥发物8小时。在收集未受损植物24小时后,我们引入两个4TH.龄h . virescens在这段时间里,我们按照同样的时间表收集损害诱导的挥发物。24 h后,去除昆虫,收获植株,扫描叶片,计算叶面积。
我们用150 μL二氯甲烷洗脱挥发性阱过滤器,并在每个样品中加入5 μL含有乙酸壬酯(80 ng/μL)的标准品N辛烷(40 ng /μL)。我们使用装有火焰离子化检测器的安捷伦7890A型气相色谱仪,在220°C下使用不分离注射器,对样品中的化合物数量进行了定量。色谱柱(hp - 5,15 m × 0.25 mm × 0.25 μm膜厚;J&W Scientific, Folsom, CA)维持在35°C 30 s,然后升高2°C min-1至130°C,并在20°C min时再次上升-1到220°C。我们鉴定了具有气相色谱(Agilent Model 7890A)的挥发性组分,其在电子电离模式中与质谱仪(Agilent Model 5975C)相耦合,比较纯化合物的保留时间和光谱。定量后,通过该植物的总叶面积校正每种植物的挥发性产量(Ng cm-2).我们用总叶面积(cm)修正了挥发性产量(ng)2)考虑可能影响挥发性生产的植物中的大小变化。为了获得叶面积,我们在收集后立即破坏性地采样植物。因此,我们使用了相同的叶面积值来纠正日夜挥发物(在收集期间忽略限量叶面积增长)。
喂养分析
我们使用的是昆虫食草喂养测定C. Pepo.和美国lateriflorum暴露于大肠solidaginis排放或溶剂控制。我们按照上述程序将植物暴露于排放的粗提取物或二氯甲烷溶剂控制中。暴露24小时后,我们引入三个答:vittatum给每一位C. Pepo.和三T.Virgata.给每一位Symphyotrichum sultfliflorum让它们以植物为食。饲喂24 h后,采集植株,扫描叶片,测定叶片组织消耗的总面积。
统计分析
我们通过计算草食动物伤害引起的挥发性物质(ng cm)来分析植物挥发性物质-2)在给定的时间段内由每株植物(草食性损伤植物挥发物 - 未损坏的植物挥发物)产生。我们计算了挥发性混合物中各化合物的诱导值,并总结了值以获得每种植物的总诱导的挥发物。为了考虑由于植物大小差异导致的挥发性产量的潜在差异,我们纠正了总叶面积的诱导挥发值(CM2)植物。我们改变了这一点美国altissima挥发物使用平方根变换来满足正态性和等方差的假设。然后,我们比较了来自排放暴露和未暴露的植物的草食诱导挥发性物质T.- 两者都是最低的美国altissima和Z. Mays..我们对白天和夜晚的个体化合物进行了一个原则分析分析美国altissima并构建了双图结果。基于这些双图以及每个化合物的标准误差,我们选择单个化合物使用两两比较进行测试。一个双边T.-试验比较了紫花苜蓿对叶组织的消耗C. Pepo.和Symphyotrichum sultfliflorum喂养化验。
参考文献
- 1.
对草食动物的诱导反应。生态学报,1989,20:331-348。10.1146 / annurev.es.20.110189.001555。
- 2.
Alborn HT, Turlings TCJ, Jones TH, Stenhagen G, Loughrin JH, Tumlinson JH:甜菜粘虫口腔分泌物中植物挥发物的激发子。中国科学:地球科学。10.1126 / science.276.5314.945。
- 3.
今天李华学到了两个常用语。植物生长规律学报,2000,19:195-216。
- 4。
Karban R:植物防御的进化生态学。对食草动物诱导抗性的生态与演化。Funct Ecol。2011,25:339-347。10.1111 / J.1365-2435.2010101789.x。
- 5。
Hall de,MacGregor KB,Nijsse J,Bown Aw:来自昆虫幼虫的脚步伤害叶面,并开始快速反应。EUR J植物途径。2004,110:441-447。
- 6。
植物的早期预警:腺状毛作为昆虫食草动物的传感器。新植物学报,2009,34(4):457 - 462。10.1111 / j.1469-8137.2009.03002.x。
- 7.
昆虫虫卵可增强植物的创伤反应:一个番茄的研究系统茄属植物lycopersicum L.和Helicoverpa Zea Boddie.Plos一个。2012,7:e37420-10.1371 / journal.pone.0037420。
- 8.
DOLCH R,TSCHARNTKE T:桤木脱落(赤杨皮需)通过在未造成的邻居身上通过叶甲虫来影响草食病。oecologia。2000,125:504-511。10.1007 / S004420000482。
- 9.
Karban R, Baldwin IT, Baxter KJ, Laue G, Felton GW:植物间的交流:刈割邻近山艾树后野生烟草植株的诱导抗性。生态学报。2000,31(4):457 - 461。10.1007 / PL00008892。
- 10。
Engelberth J, Alborn HT, Schmelz EA, Tumlinson JH:空气信号是植物对抗昆虫食草性攻击的主要信号。中国科学(d辑:地球科学),2004,31(4):591 - 598。10.1073 / pnas.0308037100。
- 11.
Frost CJ, Appel HM, Carlson JE, De Moraes CM, Mescher MC, Schultz JC:通过挥发物的植物内部信号传递克服了血管对系统信号的限制,启动了对草食动物的反应。王志强。2007,10:490-498。10.1111 / j.1461-0248.2007.01043.x。
- 12.
Heil M,Silva Bueno JC:由挥发物的植物内信号传导导致自然界间接植物防御的诱导和启动。Proc Natl Acad Sci U S A. 2007,104:5467-5472。10.1073 / PNAS.0610266104。
- 13.
Frost CJ,Mescher MC,Davinis C,Davis JM,Carlson Je,De Moraes CM:绿叶挥发物杂交杨树的起始防御基因和代谢物CIS.3-hexenyl醋酸。植物生态学报,2008,29(6):734 - 742。10.1111 / j.1469-8137.2008.02599.x。
- 14。
Ali M,Sugimoto K,Ramadan A,Arimura G:植物通信的记忆,用于引发抗草食性反应。SCI REP。2013,3:1872-
- 15.
赫尔姆斯am,de moraes cm,服用jf,mescher mc:曝光一枝黄花altissima植物对昆虫拮抗剂的挥发性排放(Eurosta solidaginis.)阻止随后的食草性。中国科学(d辑:地球科学),2013,32(5):514 - 514。10.1073 / pnas.1218606110。
- 16。
Burg SP,Burg EA:乙烯作用和果实的成熟:乙烯影响植物的生长和发育,是引发果实成熟的激素。科学。1965,148:1190-1196。10.1126 / Science.148.3674.1190。
- 17.
乙烯气体信号转导途径:一个分子的观点。《安徽文学》1984,32:227-254。
- 18.
Ecker JR:植物中的乙烯信号转导途径。科学。1995年,268:667-675。10.1126 / Science.7732375。
- 19.
陈志强,陈志强,陈志强:乙烯和赤霉素在烟草光敏色素诱导的避光反应中的相互作用。植物营养与肥料学报。2004,29(4):429 - 434。10.1104 / pp.104.045120。
- 20。
Runyon JB,Mescher MC,De Moraes CM:挥发性化学提示指导寄生植物的主机位置和主机选择。科学。2006,313:1964-1967。10.1126 / science.1131371。
- 21。
Heil M,Kost C:间接防御的启动。ECOL LETT。2006,9:813-817。10.1111 / J.1461-0248.2006.00932.x。
- 22。
Kost C, Heil M:草食动物诱导的植物挥发物诱导邻近植物的间接防御。中国科学:地球科学,2006,33(4):457 - 461。10.1111 / j.1365-2745.2006.01120.x。
- 23.
rodrigues - saona CR, rodrigues - saona LE:多年生灌木中草食动物诱导的挥发物;Vaccinium corymbosum,以及在分支间信令中的作用。化学学报。2009,35:163-175。10.1007 / s10886 - 008 - 9579 - z。
- 24.
Turlings TCJ,Tumlinson Jh,Lewis WJ:通过寻找寄生黄蜂来利用草食虫诱导的植物气味。科学。1990,250:1251-1253。10.1126 / science.250.4985.1251。
- 25.
De Moraes CM, Lewis WJ, Pare PW, Alborn HT, Tumlinson JH:植食性植物选择性地吸引寄生蜂。自然科学。1998,393:570-573。10.1038/31219。
- 26。
Pare pw,tumlinson jh:植物挥发物作为对抗昆虫食草动物的防御。植物理性。1999,121:325-331。10.1104 / pp.121.2.325。
- 27。
黄志强,王志强,王志强,等:植物挥发物诱导青豆叶片抗病基因的表达。自然科学。2000,406:512-515。10.1038 / 35020072。
- 28。
Mäntyläe,alessio ga,Blande Jd,Heijari J,Holopainen JK,Laaksonen T,Piirtola P,Klemola T:从植物到鸟类:昆虫草食物的树木中的较高航空捕食率。Plos一个。2008,3:e2832-10.1371 / journal.pone.0002832。DOI:10.1371 / journal.pone.0002832
- 29.
Amo L,Jansen JJ,Van Dam Nm,Dicke M,Visser Me:鸟类利用草食虫诱导的植物挥发物定位食草猎物。ECOL LETT。2013,16:1348-1355。10.1111 / ELE.12177。
- 30。
Bernasconi Ml,Turlings Tc,Ambrosetti L,Bassetti P,Dorn S:草食物诱导的玉米挥发物排放玉米叶蚜虫,rhopalosiphum maidis..entomol exp appl。1998,87:133-142。10.1046 / J.1570-7458.1998.00315.x。
- 31。
De Moraes CM, Mescher MC, Tumlinson JH:毛毛虫诱导的夜间植物挥发物排斥同种雌性。自然。2001,410:577-580。10.1038 / 35069058。
- 32。
Sánchez-hernándezc,隆普Mg,Délano-Frier jp:茉莉酸缺乏的Spr2番茄突变体中挥发排放量降低,有利于昆虫食草动物的产卵。植物细胞环境。2006,29:546-557。10.1111 / J.1365-3040.2005.01431.x。
- 33。
Kariyat RR, Mauck KE, Balogh CM, Stephenson AG, Mescher MC, De Moraes CM:马尾草的近亲繁殖(茄属植物carolinense)改变了引导产卵的夜间挥发性排放物Manduca sexta飞蛾。Proc Biol Sci。2013,280:20130020-10.1098 / RSPB.2013.0020。
- 34。
Schmelz ea,Alborn Ht,Banchio E,Tumlinson JH:诱导茉莉酸水平与挥发性排放之间的定量关系Zea Mays.在Spodoptera exigua草食病。Planta。2003,216:665-673。
- 35.
Ament K, Kant MR, Sabelis MW, Haring MA, Schuurink RC:茉莉酸是蜘蛛螨诱导番茄挥发性萜类和水杨酸甲酯释放的关键调控因子。植物营养与肥料学报。2004,29(4):429 - 434。
- 36.
takker JF, Rohr JR, Abrahamson WG, De Moraes CM:瘿虫可以避免和改变植物的间接防御。新植物学报,2008,33(6):657-671。10.1111 / j.1469-8137.2008.02392.x。
- 37.
梅丽娜FJ:Goldenrod叶甲虫的比较生物学,Trirhabda virgata和T. Borealis.布莱克(鞘翅目:叶甲科)。《植物学报》1982,36:255-269。
- 38。
墨西拿FJ:两只甲基甲虫之间的食物植物选择:与植物质量有关。oecologia。1982年,55:342-354。10.1007 / BF00376922。
- 39。
Blate Se,Schindel Am,Harmsen R:表现Trirhabda virgataColeoptera chrysomelidae在三个潜在的宿主上。可以entomol。1999,1316:801-811。
- 40.
Aharoni A,Girip,Deuerlein S,Griepink F,De Kogel WJ,Verstappen FWA,Verhoeven Ha,Jongsma Ma,Schwab W,Bouwmeester HJ:野生型和转基因的Terpenoid新陈代谢拟南芥植物。acta botanica sinica(云南植物学报),2003,30(5):593 - 598。10.1105 / tpc.016253。
- 41.
《三个营养层次的进化生态学》,1997,普林斯顿:普林斯顿大学出版社
- 42。
Ton J,D'Alessandro M,Jourdie V,Jakab G,Karlen D,Hold M,Mauch-Mani B,Turlings Tc:气流信号引发促进玉米的直接和间接抵抗。工厂J. 2007,49:16-26。
- 43。
Vancanneyt G,Sanz C,Farmaki T,Paneque M,Ortego F,Castanera P,Sanchez-Serrano JJ:转基因马铃薯植物中的氢过氧化物裂解裂解导致蚜虫性能的增加。Proc Natl Acad Sci U S A. 2001,98:8139-8144。10.1073 / pnas.141079498。
- 44。
保护性香水:营养挥发物在植物防御食草动物中的作用。植物生态学报。2009,12:479-485。10.1016 / j.pbi.2009.04.001。
- 45。
Wei J,Kang L:角色(Z)-3-己烯醇在植物 - 昆虫相互作用中。植物信号表现。2011,3:369-371。
- 46。
奥路瓦米,Dewhirst SY, Veyrat N, Powers S, Bruce TJA, Caulfield JC, Pickett JA, Birkett MA:启动生产挥发性有机防御化合物的天然植物激活剂顺茉莉酮玉米。公共科学图书馆。2013,8:e62299-10.1371/journal. pon. 0062299。doi: 10.1371 / journal.pone.0062299
- 47.
黄花瘿蝇的生物学和生态学Eurosta solidaginis.(Fitch)。康奈尔大学农业专家,1951,300:1-51。
致谢
我们感谢E Smyers,J Saunders,Aschwanden,H BETZ和R SOWERS提供的研究辅助和技术支持。我们感谢E Smyers和D Roberts为我们提供答:vittatumA斯蒂芬森和J哈思C. Pepo.种子。本研究由美国国家科学基金会资助。DGE1255832。本材料中表达的任何意见、发现、结论或建议都是作者的观点,并不一定反映美国国家科学基金会的观点。
作者信息
隶属关系
通讯作者
额外的信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
AMH、CMDM、JFT和MCM设计研究;AMH和JFT进行了研究;AMH、CMDM、JFT和MCM分析数据;AMH、CMDM、JFT、MCM撰写了论文。所有作者阅读并批准了最终的手稿。
电子辅料
12870 _2014_1571_moesm1_esm.docx
附加文件1:表S1:未损坏排放的挥发性有机化合物一枝黄花altissima植物。表显示构成未损坏的挥发性混合物的单个化合物美国altissima植物。(VOC;指±标准错误;显示未转化的数据)。(docx 21 kb)
12870_2014_1571_moesm2_esm.pdf.
附加文件2:图S1A, S1B:主成分分析的双图一枝黄花altissima草食虫诱导的挥发物。(a)前两种原理组分的前两种原理成分的寄生酶诱导的挥发物大肠solidaginis排放暴露和未曝光美国altissima。箭头表示给单个化合物的重量。并非所有复合标签都显示出可易读。单个植物用代表治疗的角色标记(C =对照,E =暴露)。(b)前两种原理组分的察觉异常诱导的挥发物大肠solidaginis排放暴露和未曝光美国altissima。(PDF 66 KB)
12870_2014_1571_moesm3_esm.docx.
附加文件3:表S2:日夜Zea Mays.个体草食虫诱导的挥发性有机化合物。表现出构成食草动物损坏的挥发性混合物的单独化合物Z. Mays.植物。(VOC;指±标准错误;显示未转化的数据)。食草动物诱导的挥发物通过从食草动物损伤的挥发物产量中减去未损伤的挥发物产量(损伤VOC-未损伤VOC)来计算。负值表示这些化合物在食草动物捕食破坏后排放量较低。(多克斯20 KB)
作者的原始提交的图像文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
赫尔姆斯,a.m., De Moraes, c.m., Mescher, M.C.等等。挥发性排放Eurosta solidaginis.引发草食病诱导的挥发性生产一枝黄花altissima并且不直接阻止昆虫喂养。BMC植物BIOL.14,173(2014)。https://doi.org/10.1186/1471-2229-14-173
已收到:
公认:
发表:
关键词
- 一枝黄花altissima
- Eurosta solidaginis.
- 启动
- 草食虫诱导的植物挥发物