摘要
背景
籽粒和淀粉分别是植物光合作用和能量储存的主要功能结构。两者都表现出高度有序的分子结构,并在叶绿体内以微米大小的颗粒出现。为了区分颗粒和淀粉,我们使用了多光子显微镜,同时采集了双光子荧光(2PF)和二次谐波产生(SHG)信号。SHG对结晶结构敏感,而2PF则选择性地揭示叶绿素的分布。
结果
观察到“SHG为主”、“2PF为主”和“SHG与2PF搭配”三种不同对比的微观结构。我们知道,淀粉和颗粒由于其高度结晶的结构都会发出SHG,而淀粉不会发出自身荧光,所以“SHG占主导地位”的对比应该对应淀粉。“SHG与2PF搭配”的对比被指定为颗粒状,具有自荧光叶绿素的结晶结构。“2PF占优”的对比应该对应于基质类囊体,这是一种含叶绿素的非填充膜结构。荧光寿命测量进一步支持对比度分配。
结论
我们已经证明了一种直接和非侵入性的方法来识别完整叶片内颗粒和淀粉的分布。通过合并2PF和SHG图像,可以直观区分颗粒、淀粉和间质类囊体。这种方法可以扩展到观察活体植物的三维颗粒分布及其动态。
背景
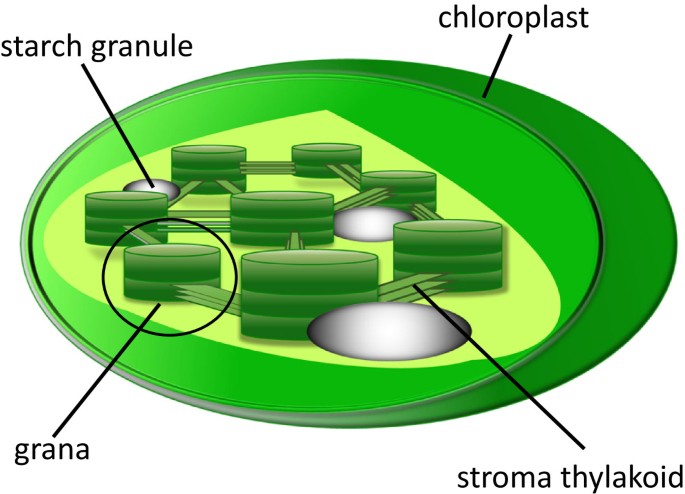
光合作用是世界上最重要的化学反应之一。基于叶绿素的光化学作用,它可以将光转化为化学能并将其储存在糖的化学键中。在植物光合作用过程中,光反应发生在类囊体中,类囊体中含有叶绿素一个、叶绿素b和类胡萝卜素进行光化学相互作用。在叶绿体内部,类囊体有两种结构形式。一类是基质类囊体(基质片),它是一种嵌入叶绿体基质中的膜结合结构。另一种是颗粒,它是一堆包装良好的类囊体(见图)1)。颗粒是光合作用的主要功能结构,由基质类囊体相互连接,而类囊体不具有结晶结构。光合作用的产物随后转化为多糖储存。多糖的主要储存形式是淀粉,它由成堆的结晶支链淀粉和无定形直链淀粉组成。
用透射电子显微镜(TEM)和扫描电子显微镜(SEM)观察了叶绿体中颗粒和淀粉颗粒的三维排列。1- - - - - -6]。正如预期的那样,TEM和SEM提供了非常高的空间分辨率到纳米尺度。然而,TEM和SEM都需要复杂的样品制备。透射电镜样品的厚度不能超过几百纳米,因此用透射电镜进行全叶观察是不现实的。对于扫描电镜来说,由于腔室处于高真空状态,植物标本通常需要通过化学固定完全脱水,这可能会导致分子变性和结构伪影。扫描电镜样品处理的冷冻断裂方法可以真实地显示叶绿体的精细结构,但它不能用于活细胞应用。
另一方面,光学显微镜的空间分辨率要低得多(约为可见波长的一半),但它可以用来观察活的和有功能的细胞。传统的复合显微镜不能在厚的生物组织中产生清晰的三维视图。通过将共聚焦针孔与激光扫描显微镜相结合,共聚焦显微镜提供了出色的光学切片能力。20世纪80年代末,利用共聚焦显微镜技术,利用叶绿素的自身荧光来研究活体和完整植物叶绿体的内部结构[7,8]。然而,由于颗粒和基质类囊体都含有叶绿素,因此仅通过荧光强度很难区分它们,除非使用复杂的光谱成像显微镜[9,10]。由于颗粒是致密的类囊体,对结晶敏感的造影剂将有助于区分颗粒和间质类囊体。一种可能的解决方案是二次谐波产生,这是一种非线性光学过程,只允许在非中心对称结构中发生[11]。
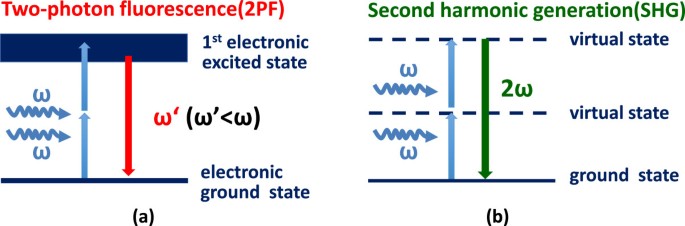
非线性光学显微镜已成为生物样品成像的重要工具[12- - - - - -14]。在非线性光学显微镜家族中有几种不同的对比机制,包括双光子荧光(2PF)、二次谐波产生(SHG)、相干反斯托克斯拉曼散射(CARS)等。由于信号与激励之间的非线性相关性,非线性光学显微镜的主要优点之一在于其固有的光学切片能力。由于不需要针孔,大大提高了检测效率。此外,通常采用红外激光作为激发源,由于减少了生物组织中的散射,大大增加了穿透深度。在我们的研究中,我们重点研究了对叶绿素自身荧光敏感的2PF和对结晶敏感的SHG来识别颗粒。双光子激发是指荧光团被同时吸收的两个光子所激发的过程。如果两个光子的能量之和与分子的基态和激发态之间的能隙相匹配,这种非线性过程就会发生。与传统荧光显微镜的激发波长大于发射波长不同,两个长波激发光子的能量之和会产生更短的发射波长,如图所示2(a).与传统的单光子荧光相比,2PF显微镜的优点主要是增加了穿透深度和固有光学切片。但无论是2PF荧光还是单光子荧光都需要实态跃迁,这意味着部分激发能不可避免地沉积在样品内部。
在SHG的情况下,激光聚焦在样品上产生倍频光。在SHG过程中,两个入射光子被湮灭,并产生一个新的光子。由于能量守恒,新光子的能量和频率是湮灭光子的两倍,如图所示2(b). SHG的一个优点是只涉及虚态转变,因此不会发生光损伤和光子漂白,因为在这种转变过程中没有能量沉积[15]。另一方面,SHG也表现出对入射强度的平方依赖,因此SHG成像提供了类似于2PF成像的出色光学切片能力。原则上,SHG对非中心对称的结晶介质敏感,例如两个中心对称介质之间的界面[16],以及结晶结构,如堆积良好的生物结构,包括动物中的胶原蛋白和肌球蛋白,以及植物中的淀粉和颗粒[11,16- - - - - -27]。在叶绿体内部,淀粉和颗粒都表现出SHG,所以在之前的研究中[28],作者通过将植物置于黑暗中约3周以消除植物中的淀粉含量来鉴定谷物的SHG。然而,这一过程可能会严重影响植物生理,并且这种方法阻碍了正常光照条件下光合作用的研究。
本文的目的是证明非线性光学显微镜是一种非侵入性的方法来识别颗粒,基质类囊体和淀粉颗粒在活的完整叶片内的分布。不需要复杂的样品制备或暗室过程。通过同时采集2PF和SHG信号,可以直观地识别这些细胞器。这种新方法可以应用于植物进化领域,并为植物生长提供动态成像观察。
结果
数字3.显示了活叶叶绿体中2PF(红色)和SHG(绿色)图像的分布。使用多光子扫描显微镜同时记录反向2PF和正向SHG信号(见方法)。粗略地说,可以通过2PF信号勾勒出单个叶绿体的轮廓,但很明显,2PF和SHG在叶绿体内的分布并不均匀。在图3.(a), 2PF填充了叶绿体的大部分,而SHG则显示出离散的斑点。通过重叠两幅图像并绘制线条轮廓,可以清楚地看到这些SHG点与2PF并置,在图像中显示黄色。因此黄色部分表示叶绿素自身荧光和堆叠结构共存,对应于颗粒。对于那些有2PF但没有SHG的区域,它们呈现红色,应该对应于基质类囊体,它们具有自身荧光,但没有堆叠结构。SHG和2PF沿虚线的详细强度分布如图右面板所示3.(一)。
在图3.(b) SHG和2PF的分布是互补的。在2PF图像中可以看到,每个叶绿体中都有空腔。在SHG图像中,有多个亮点显示了结晶结构的位置。在合并后的图像中,以及在线形图中,我们可以看到2PF腔中充满了明亮的SHG斑点。同样,红色的区域代表基质类囊体。另一方面,对于那些有SHG但没有2PF的区域,它们呈现绿色,应该对应于叶绿体中没有自身荧光的结晶结构,即淀粉[11,23]。在图3.(三)一些SHG点与2PF重合,而另一些则没有。根据前面的讨论,绿色斑点(SHG占主导地位)表示淀粉颗粒的位置;黄色(SHG与2PF配色)为颗粒分布,红色(2PF为主)为基质类囊体分布。有趣的是,典型的叶绿体呈圆形到椭圆形,但这里的2PF图像显示出不规则的轮廓。从电镜研究可知,基质类囊体在叶绿体内部分布不均匀,因此在某些区域2PF较弱反映了基质类囊体浓度较低。
此外,还有轴向图像系列(参见附加文件)1),证明了非线性光学显微镜在植物叶片上具有优异的光学切片能力。综上所述,颗粒、淀粉和基质类囊体的分布可以分别用黄色、绿色和红色来识别。
讨论
叶绿体是光合作用的主要细胞器。在叶绿体内部,颗粒和基质类囊体是将光能转化为化学能的关键生物结构,化学能以淀粉颗粒的形式储存。在这里,我们展示了基于多光子激光扫描显微镜在完整叶片中单个叶绿体中的颗粒、基质类囊体和淀粉颗粒的可视化分布,该显微镜提供了三维亚微米分辨率。从我们的研究来看,由于颗粒和基质类囊体都含有叶绿素,它们表现出强烈的2PF信号。另一方面,多光子成像的SHG对比度对堆叠(结晶)结构很敏感,因此SHG图像显示了叶绿体内仅有的两种发射SHG的细胞器颗粒和淀粉颗粒的分布。通过结合2PF和SHG两种方式,可以从视觉上很好地分离来自颗粒、淀粉和基质类囊体的信号,如表所示1。
一个可能的歧义在于对重叠的SHG和2PF的解释。我们目前的解释是,重叠反映了叶绿素自身荧光和堆叠结构,即颗粒共存。然而,我们指定为颗粒的结构可能是淀粉颗粒被基质类囊体包围。在这里,我们描述了后一种解释更不可能的原因。让我们来看看图3.(a)更接近。在我们的实验条件下(物镜和波长),横向和轴向分辨率分别优于0.5 μm和1 μm。在我们的样品中,颗粒和淀粉颗粒的大小应该在1 μm左右,因为我们使用了遮荫植物(见方法)。图中SHG光斑尺寸均大于1 μm3.(a).如果这些SHG点是被基质类囊体包围的大淀粉颗粒(即大于1 μm),则SHG点中心的2PF信号应显著下降。然而,我们在图中没有观察到这一点3.(a)另一方面,它可能是一个非常微小的淀粉颗粒产生SHG,但与周围基质类囊体的2PF重叠。然而,这也不太可能,因为我们在图中观察到的SHG斑点3.(a)宽度大于1 μm,超过了我们的多光子系统的分辨率极限。很明显,我们可以区分图中选择的两个SHG微粒的取向3.(a),作为光学分辨率优于微粒尺寸的证明。实际上,从强度分布图中可以看出3.(a)荧光信号实际上随着颗粒中SHG的增加而增加。因此我们得出,图中所选择的SHG粒子3.(a)应对应于颗粒,而不是淀粉颗粒。另一方面,对于我们指定为淀粉颗粒的结构,它会是颗粒吗?首先要注意的是,荧光强度反映了叶绿素的局部密度,颗粒中叶绿素的体积密度高于周围基质类囊体。因此颗粒的荧光强度应不低于基质类囊体的荧光强度。如图所示3.(b)如果SHG点对应于颗粒,则SHG点所在位置的2PF强度应该更强或至少等于周围的2PF强度。然而,我们在图3.(b)为强SHG和2PF信号减弱的粒子。所以它们应该是淀粉颗粒,而不是谷物。SHG点残留的微弱2PF信号可能来自淀粉颗粒轴向邻近的基质类囊体。从图3.(c)颗粒区2PF和SHG均较周围增大;而在淀粉区,有很强的SHG峰,2PF显著降低。这有力地证明了我们的技术确实可以分离淀粉和谷物。
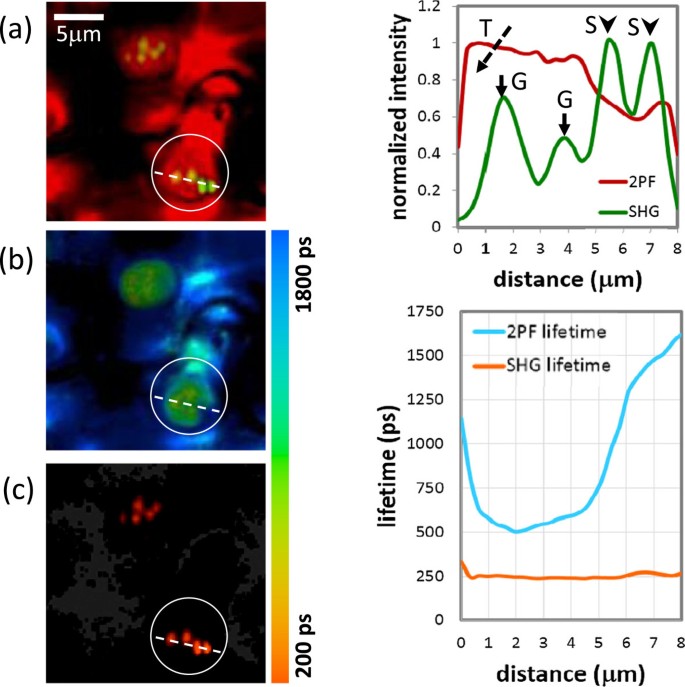
为了确认基质类囊体、颗粒和淀粉颗粒之间的区别,我们进行了额外的荧光寿命成像测量。已知叶绿体的荧光主要来自光系统(PS),包括PSI和PSII。约85%的PSII位于颗粒中,而PSI在基质类囊体中占主导地位[29,30.]。然而,由于PSI和PSII的荧光光谱在很大程度上相互重叠,通过简单的光谱滤波很难区分它们。在荧光寿命方面,PSI和PSII的主要成分约为500 ps [31,32]及1400ps [29,30.],因此可以通过寿命测量来区分颗粒和基质类囊体。另一方面,由于SHG的虚转变性质,其寿命极短,因此通过寿命测量来识别结晶结构(即颗粒和淀粉)也是可行的。寿命测量如图所示4。数字4(a)为2PF和SHG信号强度的合并图像。如前几段所述,基质类囊体、淀粉和颗粒分别对应红色、绿色和黄色。在图中,大部分区域为红色,而在高亮区域(白色圆圈)中,可以找到两个颗粒(圆圈中间)和两个淀粉颗粒(圆圈右下方)。图的右侧提供了与虚线对应的线条轮廓4(a),再次显示2PF/SHG信号的变化及其与不同结构的对应关系。数字4(b)和(c)分别是同一地区2PF和SHG的寿命测量结果。同样,图右侧给出了沿虚线显示2PF和SHG寿命分布的线形图4(b)和(c)。乍一看,图像和寿命配置文件不匹配可能令人惊讶。例如,图中沿着折线的四个SHG发射器4(c),包括颗粒和淀粉颗粒,在成像模式下可以清楚地识别,但在寿命曲线(橙色线)中无法识别。这是因为在寿命图像中,颜色表示寿命,亮度对应信号强度。然而,在生命周期配置文件的右侧,只显示生命周期的信息。在图4(b),可以明显看出,在大多数区域,荧光寿命都大于1200ps,而在高亮区域,荧光寿命明显短于1000ps。从图中强度和寿命的线形图的详细对比中可以看出4可见,在颗粒区(强度分布图中标记为G),对应的2PF寿命(蓝线)接近500 ps,表明PSII浓度较高。颗粒外2PF寿命显著增加,表明PSI占主导地位,反映基质类囊体的存在。为SHG信号的寿命,如图所示4(c)和寿命剖面中的橙色线,它确实像预期的那样非常短,并且受到我们荧光寿命成像系统的~ 240 ps仪器响应函数(IRF)的限制。在淀粉颗粒区域(在强度分布图中标记为S),观察到强SHG和弱2PF。在生命信息的支持下,现在我们知道该区域的2PF对应于基质类囊体。因此,对淀粉粒的分配有了更大的信心。在图的上部4(a)另一个叶绿体,内有若干粒。同样,在图的相应区域4(b) PSII浓度升高,荧光寿命变短。在图的相应区域4(c)观测到寿命极短的SHG斑点,表明颗粒的存在。总之,荧光寿命测量提供了强有力的支持证据,证明我们的多光子方法(2PF + SHG)确实可以区分基质类囊体、颗粒和淀粉颗粒。
结论
我们已经证明了一种非侵入性的方法来识别颗粒和淀粉在活叶肉细胞内的分布,而不需要任何特殊的标本标记或处理。该方法是基于多光子显微镜中SHG和2PF对比度的结合。在植物细胞的叶绿体中有两种SHG结构。一种与强2PF搭配,另一种与2PF互补。前者对应于谷物,后者对应于淀粉。对于那些只有2PF而没有SHG的区域,它们代表了间质类囊体的分布。通过合并2PF和SHG图像,颗粒、淀粉颗粒和间质类囊体可以分别通过黄(绿+红)、绿、红的不同颜色进行视觉区分。荧光寿命测量进一步证实了结构的识别。多光子过程的非线性特性提供了有用的内在光学切片能力,并且不太可能对活样品造成损害,从而可以观察植物生长过程中的细胞器动力学。我们的技术将有助于研究不同植物物种间颗粒结构的变化[33],并可用于植物进化论领域。
方法
我们这里用的叶子是从新鲜的蕨类植物上取下来的,大褐蝽(高德)京,属于大颗粒的遮荫植物[33- - - - - -37]。叶子被装在水里,夹在盖子和玻璃片之间。盖子的边缘用指甲油封住了。将玻片放在显微镜台上观察。
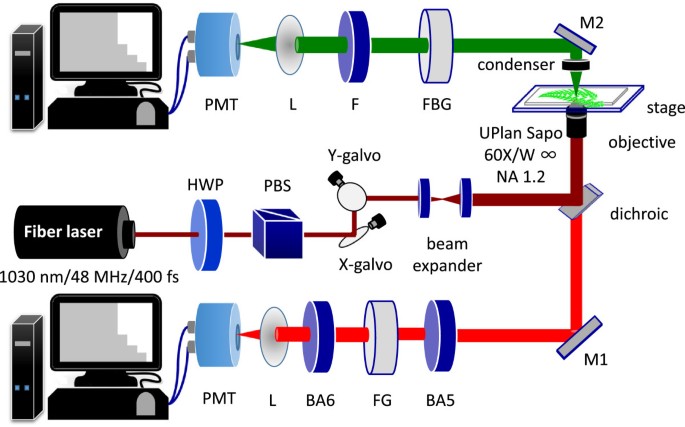
实验设置如图所示5,这与我们之前的报告相似[23,38]。这种设置允许同时测量向前和向后方向的SHG和2PF。激光源为锁模Yb光纤激光器,中心波长为1030nm。脉冲宽度为400fs,重复频率为48mhz,最大平均功率为5w。激发光被引导到奥林巴斯FV300系统与一对X-Y振镜实现光栅扫描。像素停留时间为9 × 106每张图像(256 × 256像素)的采集时间约为0.6秒。激发光通过显微镜物镜聚焦到样品上(UPlanSApo 60×W, NA = 1.20, Olympus, Japan)。样品位置的平均激光功率约为60 - 70毫瓦。2PF信号由同一物镜外接采集,SHG信号由电容正向采集。两个相同的光电倍增管(pmt, R9110, Hamamatsu, Japan)分别放置在正向和反向路径上检测SHG和2PF信号。FV300内部有一个二色镜(DM-BG, Olympus, Japan)来反射IR并允许传输2PF信号。在每个PMT前面放置额外的滤色器(FBG39和FGS600, Thorlabs, NJ, USA),以确保激光被适当阻挡。在相应的pmt之前插入SHG (FF01-520/15-25, Semrock, NY)和2PF (BA565IF和BA610IF, Olympus, Japan)滤波器,以确保仅记录SHG和2PF信号。
对于荧光寿命测量,激发和扫描系统与上述相同,但检测部分在前进方向上变成光子计数PMT (PMC-100-1, Becker & Hickl,德国),配备时间相关单光子计数系统(TCSPC-150, Becker and Hickl,德国)。高速光电探测器将激光重复率与光子计数系统同步。在寿命测量期间,相应的滤波器被放置在光子计数PMT的前面,以允许无串扰的2PF或SHG检测。
参考文献
- 1.
何志强,王志强,王志强,等。植物叶绿体叶片和颗粒的超微结构玉蜀黍L。[J] .中国生物医学工程学报,2009,31(6):559 - 563。10.1083 / jcb.1.6.605。
- 2.
哈里森JH:非天然嘧啶诱导叶绿体超微结构的短暂和持久修饰。植物学报,2002,28(3):379 - 379。10.1007 / BF01894668。
- 3.
魏尔东,汤姆逊WW:无淀粉叶绿体的颗粒黄花烟草。中国生物医学工程学报,2002,18(3):389 - 398。10.1083 / jcb.13.1.89。
- 4.
Pýankov VI, Voznesenskaya EV, Kondratschuk AV, Black CC:有和没有Kranz型叶片解剖的Salsola (Chenopodiaceae)物种的比较解剖和生化分析:C-4到C-3光合作用的可能逆转。[J] .中国生物医学工程学报,1997,18(5):597-606。10.2307 / 2445895。
- 5.
Barnes SH, Blackmore S:叶绿体超微结构的扫描电子显微镜。光子学报,1984,15(3):187-194。10.1016 / 0739 - 6260(84) 90051 - 0。
- 6.
Rumak I, Mazur R, Gieczewska K, Koziol-Lipińska J, Kierdaszuk B, Michalski WP, Shiell BJ, Venema JH, Vredenberg WJ, Mostowska A, Garstka M:豌豆和豆类类囊体膜空间结构与叶绿素-蛋白质复合物排列的相关性。植物生态学报,2012,32(2):559 - 564。
- 7.
Brakenhoff GJ, van der Voort HTM, Vanspronsen EA, Linnemans WAM, Nanninga N:共聚焦扫描激光显微镜下神经母细胞瘤细胞核的三维染色质分布。自然,1985,317(6039):748-749。10.1038 / 317748 a0。
- 8.
Brakenhoff GJ, Van Spronsen EA, Van Der Voort HTM, Nanninga N:共聚焦扫描激光显微镜在神经母细胞瘤细胞核中的三维染色质分布。细胞生物学方法。卷30。编著:泰勒DL,王玉林。1989,英国,379-397。
- 9.
Vácha F, Vácha M, Bumba L, Hashizume K, Tani T:低温激光扫描显微镜观察完整叶绿体内部结构。草业学报,2009,38(4):493-496。10.1023 /: 1012492919852。
- 10.
谷川M, Shiina T, Terazima M, Kumazaki S:近红外激光荧光光谱显微镜观察植物叶片叶绿体光系统的选择性激发。植物生理学报,2010,51(2):225-238。10.1093 /卡式肺囊虫肺炎/ pcp182。
- 11.
朱士文,陈爱华,刘天明,孙国强,李培平,林宝玲,程平平,郭明明,林德杰,刘海龙:多模态非线性显微镜研究非线性生物光子晶体效应。中国生物医学工程学报,2002,26(3):391 - 391。10.1046 / j.1365-2818.2002.01081.x。
- 12.
张建军,张建军,张建军,等。多光子显微技术在生物科学中的应用。生物工程学报,2003,21(11):1369-1377。10.1038 / nbt899。
- 13.
König K:生命科学中的多光子显微镜。中国生物医学工程学报,2009,30(2):393 - 394。
- 14.
张建军,张建军,张建军:多光子显微技术在生物研究中的应用。生物化学学报,2001,5(5):603-608。10.1016 / s1367 - 5931(00) 00241 - 6。
- 15.
刘天明,褚文生,孙国强,林宝玲,程永平,Johnson I:飞秒Cr: forsterite激光的多光子共聚焦显微镜。扫描,2001,23(4):249-254。
- 16.
沈彦宏:界面光二次谐波的产生。物理学报,1989,40:327-350。10.1146 / annurev.pc.40.100189.001551。
- 17.
罗思等,Freund I:胶原蛋白的二次谐波生成。化学与工程学报,1999,19(4):344 - 344。10.1063/1.437677。
- 18.
李建军,李建军,李建军,等。基于二次谐波成像显微镜的生物分子成像技术。生物工程学报,2003,21(11):1356-1360。10.1038 / nbt894。
- 19.
张建军,张建军,张建军,张建军:ⅰ型胶原原纤维的二次谐波成像。中国生物医学工程学报,2009,35(2):444 - 444。10.1529 / biophysj.104.047308。
- 20.
苏鹏军,陈文伟,陈云峰,董云云:利用二阶敏感性张量分析法测定胶原纳米结构。中国生物医学工程学报,2011,31(8):559 - 563。10.1016 / j.bpj.2011.02.015。
- 21.
廖春春,卓志勇,于建勇,曾云云,褚文生,于顺生,晁鹏光:原位二次谐波成像揭示胶原热变性的第一阶段。应用物理学报,2011,38 (5):397 - 397
- 22.
刘建军,刘建军,刘建军,刘建军。肌肉组织中肌球蛋白的研究进展。中国生物医学工程学报,2006,31(2):693- 693。10.1529 / biophysj.105.071555。
- 23.
卓志勇,廖春春,黄超,于建勇,曾云云,罗伟,董云云,崔慧慧,黄玉春,赖明明,褚文生:二次谐波成像-一种揭示淀粉分子信息的新方法。中国生物医学工程学报,2010,31(1):394 - 394。10.1016 / j.jsb.2010.02.020。
- 24.
杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,等。利用光学二次谐波显微镜对植物淀粉颗粒的检测。[J] .生态学杂志,2000,37(9):824-826。
- 25.
王志强,王志强,Feijó J:植物多糖的二次谐波成像。[J] .生物医学工程学报,2005,10 (2):6-
- 26.
cariles R, Schafer DN, Sheetz KE, Field JJ, Cisek R, Barzda V, Sylvester AW, Squier JA:谐波和多光子吸收荧光显微镜成像技术。仪器仪表学报,2009,80(8):1-23。
- 27.
Reshak AH, Sheue CR:利用多功能双光子激光扫描显微镜研究深荫植物卷柏的二次谐波成像。中国生物医学工程学报,2012,35(3):344 - 344。10.1111 / j.1365-2818.2012.03668.x。
- 28.
杨建军,杨建军,李建军,等。激光扫描显微镜下叶绿体的二次谐波成像。光子学报,2009,40(3):378-385。10.1016 / j.micron.2008.09.007。
- 29.
Passarini F, Wientjes E, Van Amerongen H, Croce R:光系统I捕光配合物Lhca4具有多种构象:红色形态和激发态猝灭相互排斥。生物化学学报,2010,17(4):501-508。10.1016 / j.bbabio.2010.01.015。
- 30.
状态转换——控制叶绿体能量流动的光合超复合体的分子重塑。生物化学,2011,1807(8):897-905。10.1016 / j.bbabio.2010.11.005。
- 31.
Krieger A, Moya I, Ncis E:叶绿素A荧光的能量依赖猝灭:pH对类囊体膜和光系统制备中固定荧光和皮秒弛豫动力学的影响。生物化学学报,1992,12(2):167-176。10.1016 / 0005 - 2728 (92) 90097 - l。
- 32.
陈建军,陈建军,李建军,等。叶绿素荧光光谱的时间分辨分析。遥感环境,1994,47(1):72-76。10.1016 / 0034 - 4257(94) 90130 - 9。
- 33.
Sarafis V:叶绿体:一种结构方法。植物生理学报,2002,26(2):559 - 564。
- 34.
A, Duckett JG:一种极阴热带蕨类植物Teratophyllum routundifoliatum叶片的二态表皮细胞叶绿体(R. Bonap.)Holtt。:一个light and electron microscope study. New Phytol. 1991, 119 (3): 433-444. 10.1111/j.1469-8137.1991.tb00044.x.
- 35.
安德森JM:维管植物类囊体膜颗粒堆积的后果:个人观点。植物生理学报,1999,26(7):625-639。10.1071 / PP99070。
- 36.
周卫生,Anderson JM, Hope AB:光系统II到光系统I反应中心的可变化学计量学。光化学学报,1998,17(3):779 - 781。10.1007 / BF00035454。
- 37.
王晓明,王晓明,王晓明,等。热带雨林植物叶绿体超微结构、叶片解剖结构及叶绿素和可溶性蛋白含量。B年卡内基研究所,华盛顿,1972,71:102-107。
- 38.
余建勇,廖春春,卓志勇,黄超,崔慧慧,褚文生:一种提供宽光谱范围激光扫描显微镜的衍射限制扫描系统。仪器仪表学报,2009,80(11):113704-10.1063/1.3254021。
致谢
本研究由中华民国科技部资助,合约编号:NSC-102-2112- m -002- 018 - my3和NSC- 101-2923-M-002-001-MY3
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
MYC, GYZ, KCC, PCW, TYH进行实验。MYC用SWC对数据进行分析并撰写稿件。TML和SWC监督项目和仪器。所有作者都阅读并批准了最终的手稿。
电子补充资料
的z堆栈合并图像
附加文件1:大褐蝽(高德)京叶子。叶绿体充满2PF(红色)和离散SHG(绿色)点重叠。(avi 2mb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
陈,我。,Zhuo, GY., Chen, KC.et al。多光子成像识别完整叶片内的颗粒、基质类囊体和淀粉。BMC Plant Biol14日,175(2014)。https://doi.org/10.1186/1471-2229-14-175
收到了:
接受:
发表:
关键字
- 基粒
- 淀粉
- 双光子荧光
- 二次谐波产生