摘要
背景
模型草Brachypodium distachyon越来越多地用于研究牧草生物学的各个方面。一个大的和基因典型不同的集合b . distachyon种质资源已经被研究界收集起来。在这个集合的自然变化可以作为一个强大的实验工具,为许多领域的调查,包括调查生物量特征。
结果
我们调查了大量自交系的表型多样性,然后选择了一组核心系进行更详细的分析,重点分析了与草作为生物燃料和粮食作物相关的性状。表型性状包括株高、生长习性、茎密度、开花时间和种子重量。我们还使用近红外光谱(NIR)和综合微阵列聚合物谱(CoMPP)研究了细胞壁组成的差异。在所有情况下,我们观察到广泛的自然变异,包括茎密度的2倍变异,阿魏酸与半纤维素结合的4倍变异,以及种子质量的1.7倍变异。
结论
这些特征可以为今后研究观察到的表型变异的遗传基础提供选择不同品系的标准。
背景
自然变异的研究可以说是现代生物学中最古老的领域之一,通过研究各种各样的生物体,已经有了无数的发现。下一代全基因组测序技术的出现和强大的基因分型技术的发展(例如,通过测序进行基因分型)使研究人员能够用遗传标记饱和任何生物体的基因组。这些新工具在将自然表型变异与特定DNA序列联系起来方面尤其强大,并导致人们对自然多样性的兴趣增加。
小麦,燕麦和大麦的近亲,Brachypodium distachyon在2001年被建议作为草的模型[1]。在随后的几年里,在开发这种小型一年生草的研究工具方面取得了迅速进展,包括有效的转化方法[2- - - - - -4];高质量的全基因组序列[5];大量种质资源收藏[4,6- - - - - -8];T-DNA突变体资源[9,10];和更多。(最近的评论见[11])。此外,54种不同的基因已被重新测序(未发表)。在此基础上,本研究的目标是获得现有自然多样性的概述b . distachyon为进一步研究生物能源和籽粒性状奠定基础。
作为一种遗传上易于处理的模型,Brachypodium可以用来增加我们对控制草生长和细胞壁组成的基因的理解。生物量产量是包括株高在内的许多因素的函数,而株高往往与生物量积累呈正相关[12,13],以及生长习惯,这影响了田间植株之间所需的间距。植物材料的密度也是一个考虑因素,因为密度更大的生物质可以更有效地运输到生物精炼厂[14并可能导致更高的生物量产量。植物生物量的大部分由细胞壁组成,而细胞壁的组成决定了生物量转化为生物燃料的效率[15]。
尽管我们对细胞壁的大部分知识来自于对苦子叶植物的研究拟南芥[16],草细胞壁的组成与双科植物细胞壁的组成有很大的不同[17,18]。初生细胞壁的碳水化合物聚合物的主要差异包括半纤维素的类型(禾本科植物中的阿拉伯木聚糖和双果植物中的木葡聚糖),果胶的水平(禾本科植物中低,双果植物中高),以及混合链接葡聚糖的存在(禾本科植物中存在,双果植物中不存在)。此外,禾本科初生细胞壁含有大量的酚类化合物,其中一些是交联碳水化合物聚合物,而大多数薯类初生细胞壁含有很少或不含酚类化合物。同样,草次生细胞壁含有相对较高水平的酚类化合物阿魏酸和ρ-香豆酸[14]。为了说明这些组成差异,从成熟茎中提取的非纤维素单糖的定量分析显示,草,包括Brachypodium还有生物能源物种芒草在美国,阿拉伯糖的含量较高,但半乳糖醛酸和鼠李糖的含量较低拟南芥[19]。除了与生物燃料生产和动物饲料相关外,草细胞壁还在人类营养中发挥重要作用,因为它们可以是谷物的主要组成部分,并且作为燕麦和小麦等谷物的纤维部分具有健康益处[20.]。
尽管植物细胞壁具有重要的生物学和商业意义,但很难精确确定其组成[21,22]。这种困难很大程度上是由于细胞壁极其复杂的复合聚合物性质[15]。细胞壁组成的大空间和时间变化进一步复杂化了我们可重复表征该性状的能力。在这种情况下,光谱技术对于测量细胞壁组成的差异是有用的,因为细胞壁中包含的许多键和化学基团有助于净信号。近红外(NIR)光谱学特别有用,因为它速度快,几乎不需要或不需要样品制备[23,24]。近红外分析的一个重要限制是,没有已知成分的样品作为校准标准,不可能确定样品之间的具体成分差异。然而,近红外光谱可以很容易地用于确定未知样品的组成是否不同,而无需确定确切的化学差异。因此,近红外光谱已被用于鉴定植物细胞壁突变体和预测牧草的消化率[25- - - - - -27]。另一种评估细胞壁组成的方法是测量识别细胞壁聚合物内特定表位的抗体与细胞壁样品结合的强度。通过将单克隆抗体(mab)的特异性与微阵列的高通量能力相结合,可以快速分析大量细胞壁样品。这种方法被称为综合微阵列聚合物分析或CoMPP,已经成功地应用于许多不同的植物,包括草[28- - - - - -30.]。该技术的主要局限性是它是半定量的,并且单克隆抗体不能用于研究所有的表位。然而,对于大量细胞壁样品的高通量比较分析,CoMPP是一个强大的工具
在本文中,我们描述了几个表型在一个大的集合b . distachyon然后选择17个不同品系的核心集合进行更广泛的鉴定。我们观察到植株高度、生长习性、开花时间、细胞壁组成和种子大小有显著差异。我们的研究结果表明,当前的表型多样性b . distachyon种质收集足以使研究人员更好地了解与优良作物发育有关的性状的遗传基础。
方法
植物行
完整的选集包括来自土耳其的166行、来自伊拉克的4行和来自西班牙的1行。自交系Bd1-1、Bd2-3、Bd3-1、Bd18-1、Bd21、Bd21-3和土耳其系已在前面介绍过[3.,4,6,7]。Bd30-1系由David Garvin博士(USDA-ARS, St. Paul, MN, USA)从Antonio Manzaneda博士(西班牙贾文森大学)在西班牙收集的材料中开发而成。
植物生长条件
2008-2009年冬季室外种植的植物(试验1,表1)种植在Supersoil盆栽混合物(Rod McLellan Co., Marysville, OH)中,并在种植时使用含有微量营养素的缓释肥料(Osmocote Plus 15-9-12, Scotts Co., Marysville, OH)施肥一次。每行种植大约30颗种子,在直径20厘米的塑料罐中播种。花盆放在没有遮阳或防雨的金属长凳上。必要时补充水分以保持土壤水分均匀,直到植物开始自然衰老。
植物在生长室中生长,如前所述[9(实验2、4、5,表1)1).简单地说,盆栽土壤由1:2:3:3的砂壤土、沙子、泥炭苔藓和3号蛭石混合而成,再加上含有微量营养素的缓释肥料(Osmocote plus 15-9-12, Scotts Co., Marysville, OH)。生长室光照20小时(150 μEm)2年代-1)被荧光灯照射白天温度为24°C,晚上温度为18°C。
2010-2011年冬季室外种植植株(试验3,表1)与室内生长的植物生长在相同的土壤中。2010-2011年室外试验的天气数据来自奥克兰国际机场气象站,该气象站位于距离实验室22公里的类似小气候(http://www.wunderground.com/history/airport/KOAK/2008/12/10/MonthlyHistory.html).
春化是通过将吸收的种子在4°C下孵育所需的时间来进行的。最初,将种子种在潮湿的土壤中,并将花盆放在寒冷的地方(实验1、2、4;表格1).在注意到一些品系,特别是BdTR2g、BdTR5i和BdTR11i的发芽率较低后,我们开始从种子中去除外稃并对种子进行灭菌。灭菌方法:用15%漂白剂加0.1% Triton-X 100 (Sigma-Aldrich, St. Louis, MO, USA)洗涤种子4分钟,然后用水冲洗两次(实验3,5;表格1).在转移到土壤中之前,将经过消毒的种子放在潮湿的纸巾上冷藏。这种处理提高了总体发芽率。春化期超过3周时,由于幼苗大约在3周后才发芽,因此将花盆置于持续弱荧光照明下。
植物形态测量
对于2008-2009年冬季在室外种植的植物,从土壤到种头顶部测量每个花盆中最长茎的长度,不包括外稃毛。在生长室中生长的植物的高度是通过将植物连根拔起并测量从土壤到种头顶部的最长茎的长度来测量的,不包括外稃毛。生长室生长的植物的平均高度是基于每行3到24个个体的测量,平均样本量为16。3个品系萌发较差,分别为3个(BdTR2g和BdTR5i)或5个(BdTR11i)。所有的高度测量都是在收获种子时通过拉直茎来确定的。
茎密度是用植株最长的、完整的、未损坏的节间(通常是主分蘖的最上面的节间)的质量除以其体积来确定的。对节间进行拍照,利用ImageJ软件沿节间长度在6点处测量宽度[31]。用平均宽度计算柱状节间的体积。
近红外光谱学
我们使用近红外光谱来帮助我们选择细胞壁组成不同的细胞系。从完全衰老的植物中收获茎的最上面的两个节间(不包括种子头、叶鞘或节),切成约5毫米长的片段,放入2毫升抗冲击管中(#1420-9600,USA Scientific, Ocala, FL),其中包含一个6.2毫米和两个3.2毫米的铬钢研磨珠。较大的珠子被放置在较小的珠子之间,以确保彻底研磨。不使用非常小的茎(<5厘米)。管子只装满了大约四分之三,以允许钢球自由移动。在开放的管中,茎段在70°C下烘干过夜。干燥后,立即将管盖上并置于球磨机(MM400, Retsch, Haan, Germany)中,以每秒30个循环的速度研磨12分钟。然后将地面茎材料转移到一个玻璃载玻片上,另一个玻璃载玻片放在上面,这样粉末就散布在载玻片之间的薄层上。然后使用配备植物探针附件的Field Spec Pro光谱仪(ASD, Boulder, CO)从35个读数获得平均光谱。然后将光谱转换为。dx格式。 Principal component analysis (PCA) was conducted using Win-DAS software [32]。光谱经过基线校正,仅使用1000 ~ 2400 nm区域进行主成分分析。
种子的测量
四组种子,每组25粒,分别称重,质量除以25,确定平均种子质量。拍摄种子,使用ImageJ软件测量种子长度和宽度[31]。每个参数测量10粒种子。
CoMPP分析
我们分析了在生长室中生长的核心收集的茎样本,并进行了交错春化(实验4,表4)1).然而,由于材料不足,BdTR2g和BdTR5i在CoMPP分析中被省略。CoMPP分析按上文所述进行[29]。简单地说,在用乙醇和丙酮提取之前,将茎样品在液氮中研磨成细粉末制备醇不溶性残基。初步试验使用三种以前使用过的多糖提取溶剂(环己基二腈四乙酸酯(CDTA)、NaOH和cad公牛[29])表明,在NaOH提取后,牛步并没有导致明显的额外细胞壁物质的释放(未显示)。因此,后续实验只使用CDTA和NaOH提取物。这些提取液以三种稀释(2倍、5倍和25倍)进行印刷。然后用单克隆抗体(mab)单独探测微阵列;所产生的斑点信号被量化,如[29]。所有样品进行4次生物重复和3次稀释。
为了避免信号饱和和零值造成的伪影,每种提取方法对每种抗体选择一种稀释度。通过检查原始数据并找到对大多数样品给出强烈但不饱和信号的稀释度来选择适当的稀释度。原始数据乘以适当的稀释系数,并为每个点计算平均值。然后,通过将最高的个人读数赋值为1,000并将所有负值设置为零,将这些值规范化。
结果
全集的形态特征
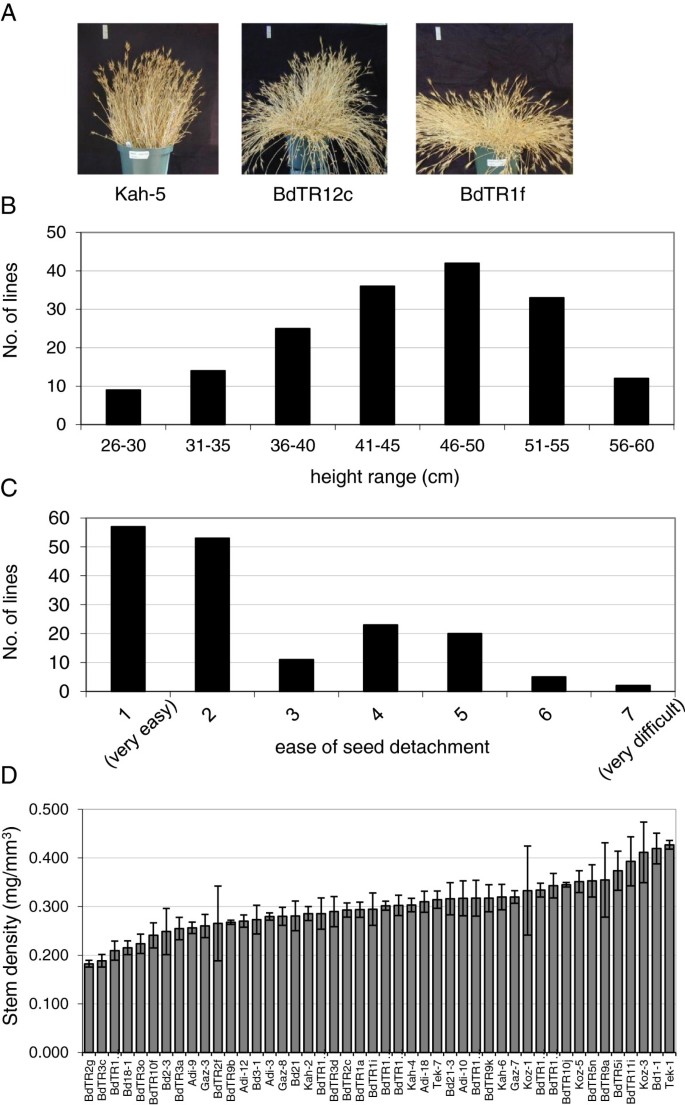
为了获得概述Brachypodium表型多样性、形态参数包括生长习性、茎长(高)、种子脱落难易程度和茎密度。草的生长习性很难从生长室中生长的单株植物中观察出来。因此,我们只从种植在室外的大盆栽中获得生长习惯,周围有足够的空间,使它们具有自然形态(实验1,表1)1).生长习性从高度直立到近匍匐(图1)1A、附加文件1:表S1和附加文件2:图S1)。最匍匐的茎(如。BdTR1f)从一开始就几乎是水平生长的,而不是简单地被自身的重量压倒(图1)1A)一些线路(如。BdTR12c)有长而灵活的茎,茎长起来,然后下垂,形成喷泉般的效果,而其他(如。ka -5)在整个生命周期中保持直立状态(图2)1A).常用参考品系Bd21和Bd21-3的生长习性为中等,分别为平展型和半直立型。本试验的最大高度变化超过两倍,从Bd21的28 cm到Adi-6和BdTR3e的60 cm,所有品系的平均高度为45 cm(图2)1B、附加文件1:表1)。与Bd21一样,Bd21-3相对较矮,最大高度为32厘米。种子容易从茎上脱落(破碎)是谷物的一个关键特性;防止碎裂的突变在所有主要粮食作物的驯化中都是至关重要的[33]。所检查的品系在这一基本特征上表现出相当大的差异,从轻轻触摸时种子脱落的品系到Koz-3和Tek-11这两种品系,它们的种子保留得很紧,不能轻易用手剥离(图2)1C、附加文件1:表1)。基于这些结果和先前发现的形态学、SSR基因型和地理起源的相似性[6,7,我们可以开始缩小线的集合。接下来,我们在46个品系的子集中测量了茎密度,这是生物燃料的一个关键特性。茎密度从0.18 mg/mm增加了两倍以上3.BdTR2g为0.43 mg/mm3.为Tek-1(图1)1D,表2).茎密度分别为0.28和0.32 mg/mm3.Bd21和Bd21-3的平均茎密度均接近于0.30 mg/mm3.。
在没有控制春化的情况下生长的植物的表型。多株植物(每行大约30株)在室外20厘米的花盆中种植,间距很大,这样相邻花盆中的植物在生长过程中就不会相互接触。(一)植物的结构变化很大,从直立的像kah5,到中间或下垂的像BdTR12c,再到几乎匍匐的像BdTR1f。每个图像左上角的垂直白色条代表5厘米。(B)记录每个花盆中最高植株的高度,并将高度分类成分布图。(C)定性测定种子从茎上剥离的难易程度,并以1(易剥离)至7(难剥离)的等级进行记录。给出了类的分布。(D)测定了46个品系的茎密度。平均茎密度,测量从3至10株每行节间,显示。管线按茎密度从低到高排列。误差条表示标准差。参见附加文件1:各行数据见表S1。
近红外光谱学
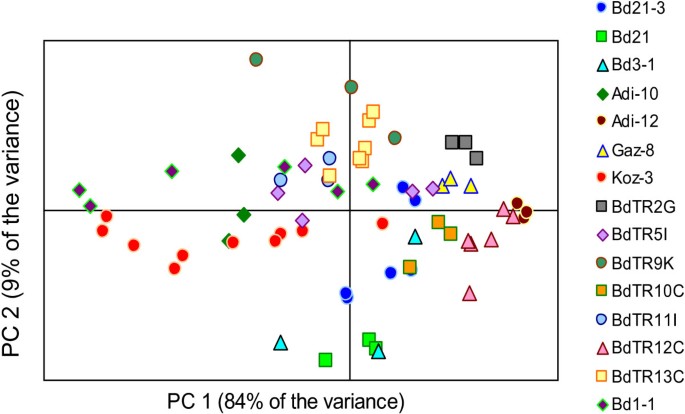
为了确保核心收集包含细胞壁组成不同的品系,我们使用近红外分析了第一次实验中生长在室外的39个品系的地面茎(表1)1).我们进行了主成分分析(PCA),以可视化的细胞壁组成的差异,然后使用这些信息来告知我们的最终核心集合的选择。核心集合中17行中15行的PCA结果如图所示2。BdTR3c和Bd30-1两条核心采集系由于是后期加入核心采集系,未进行近红外分析,故未纳入。虽然近红外测试的品系表现出不同数量的组内变异性,但来自同一品系的样本通常聚集在一起。总体而言,主成分分析表明,不同谱线的近红外光谱沿前两个主成分pc1和pc2发散,这解释了该数据集中84%和9%的方差(图2)2).例如,Bd21-3样品沿pc1轴相对位于中心位置,Koz-3和Adi-12线沿该轴分开。在另一个比较中,线BdTR12c和BdTR13c沿着pc1和pc2轴分开。有趣的是,PC2区分了Bd21和Bd21-3的光谱。这一结果强调了这样一个事实,即尽管Bd21和Bd21-3是从伊拉克同一地点收集的种子中提取的[3.,4],这两条线既具有表现性,也具有基因典型性[7),不同的。
核心集合的选择
对于许多应用程序来说,使用171行的完整集合是不切实际的。因此,最好选择一个小的、高度多样化的核心集合。我们使用了上述表型数据,以及先前发表的基因型和地理数据[7],选择17条线的核心集合。根据附加文件中总结的表型信息选择了12个土耳其系3.表S2。BdTR3c被包括在内,尽管我们没有通过近红外光谱分析它,因为它的最大高度为59厘米——远远高于171个谱线的平均高度45厘米。Bd30-1是一种西班牙自交系,在初步调查完成后可用;加入Bd30-1是为了扩大收藏的地理分布。来自伊拉克的bd3 -1、Bd21和Bd21-3以及来自土耳其的Bd1-1这四条特征良好的品系完成了核心系列。Bd3-1通常用于绘制地图,而Bd1-1则代表晚花系的一个独特分支[7]。尽管Bd21和Bd21-3在许多方面相似,但它们都被包括在内,因为Bd21是参考基因组的来源,是几个重组自交系(RIL)群体的亲本,而Bd21-3是超过20,000个T-DNA系的亲本[9];http://brachypodium.pw.usda.gov/TDNA/。
核心采集区开花时间的同步
b . distachyon在相同条件下生长的品种在开花时间上差别很大[6,34]。在没有春化控制的情况下在室外种植,最早开花的品系(Bd3-1、Bd21和Bd21-3)比最晚开花的品系(如。Bd1-1和Tek线)。由于两个原因,这些差异使对完全成熟植物的实验的解释复杂化。首先,开花晚的植物通常获得更大的生物量,因为在延长的幼年期生长了许多额外的叶子、分蘖和根。其次,由于大部分生命周期将在不同时间完成,盆栽植物成为盆栽,不同开花时间的植物在发育过程中可能受到明显不同的环境条件的影响。
幸运的是,b . distachyon在苗期通过加速开花来响应春化。在创建自交系时进行的初步春化实验将系分为三大类[7]。第一组由来自伊拉克的4个品系(Bd21、Bd21-3、Bd2-3和Bd3-1)组成,它们需要3周或更短的春化,在长日照条件下(>16小时)根本不需要春化。光)(4]。第二组系需要3-5周的春化,即使在长白天也需要春化。第三类是需要很长春化期(≥6周)才能开花的品系。大多数这些晚花系基于SSR标记形成一个基因典型的不同群体[7]。
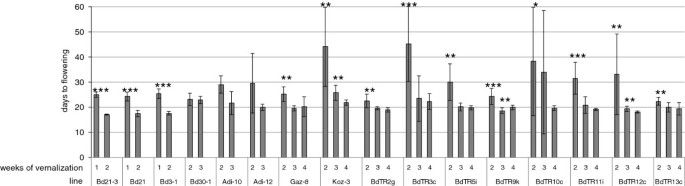
为了确定促进核心采集区同步开花的春化时期,我们对每个品系进行了不同时期的冷处理,并在转入生长室后每20小时测量开花时间(实验2,表2)1,图3.).我们将分层(用冷处理被吸收的种子)和春化结合起来,将种子种在土壤中或将种子吸在纸巾上,然后将它们放置在一个光线持续微弱的寒冷房间中。在这些条件下,幼苗大约在两到三周后出现,但很少发生营养生长。因此,当植物转移到生长条件时,幼苗大小的差异可以忽略不计。冷处理1周后,Bd21-3、Bd21和Bd3-1在24 ~ 25天内开花;经过2周的冷处理,它们在17至18天内开花(图2)3.).另外三个品系,Bd30-1, Gaz-8和BdTR13c,两周的低温处理足以在大约24天触发开花。对于adi -10、BdTR2g、BdTR5i、BdTR9k和BdTR12c, 3周的冷处理在19至22天内就能开花,但在某些情况下-如。对于BdTR2g, 2周和3周的冷处理几乎没有差异。对于品系Adi-12、Koz-3、BdTR3c、BdTR10c和BdTR11i,在低温条件下放置4周,在转入长日照生长条件后约3周就可以可靠地开花。对于后一组品系,春化不足不仅延长了营养期,而且显著增加了开花时间转变的可变性。这种可变性在图中某些线的较大误差条中表现得很明显3.。以Koz-3型植株为例,冷处理4周平均开花时间为21.9天,标准差为1.1天。相比之下,Koz-3型冷处理2周后开花时间为44.1天±15.7天。事实上,这个范围包括两株Koz-3植物在31天开花,一株在73天开花,还有一株在81天实验结束时没有开花。
经过过度春化的植物在从冷室移到生长室后几乎立即开花,并且产生非常短的植株,对于大多数实验来说太小了。因此,除了同步开花时间外,我们还选择了一个能产生合理大小植株的春化时间(表1)3.).这种方法在两组需要5周或更短时间春化的系中效果良好。在实践中,这些线条都在一周内开始开花。这种方法并不适用于需要很长时间春化的植物,因为确定一个春化期来可靠地产生合理大小的植物是困难的。因此,我们在一些实验中排除了Bd1-1。
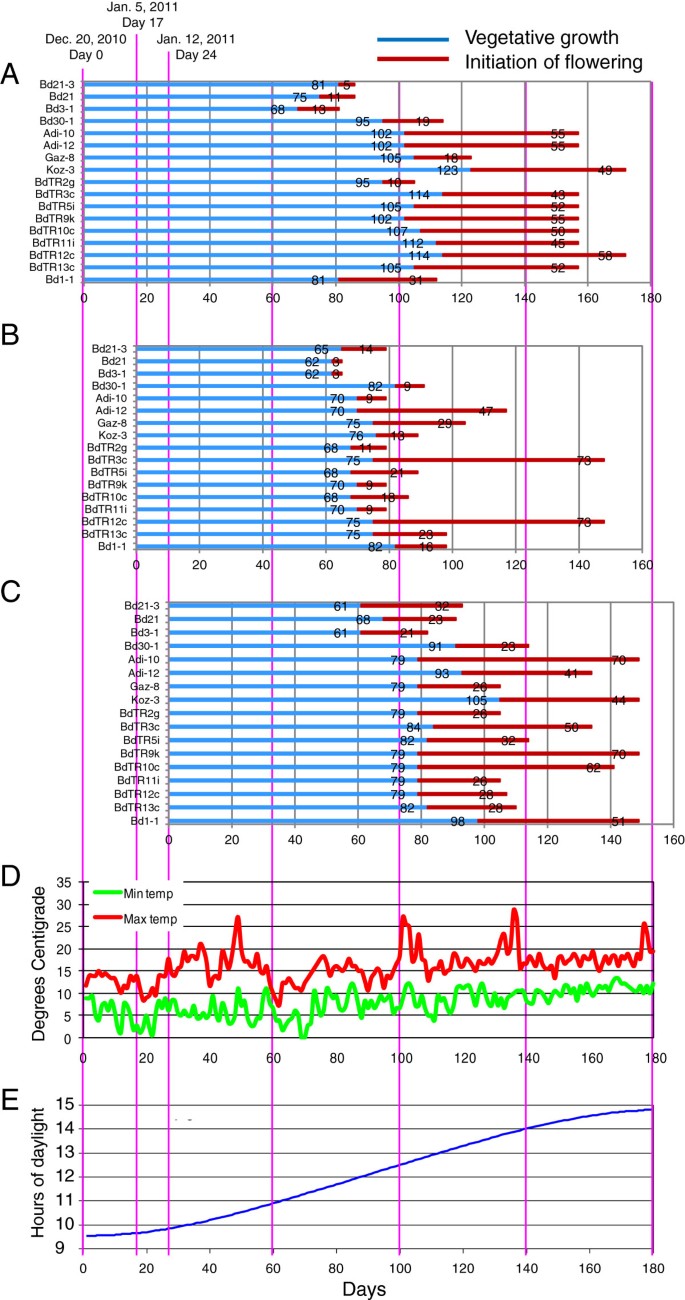
为了进一步探索更自然条件下的开花时间,我们将核心采集物在室外盆栽中生长,重复实验1的条件(表1)1).实验3(表11),我们进行了为期24天的三次试验。我们所在地区的气候(纬度:38.048996,经度:122.140252)与大部分线条采集地地中海气候相似[6,7]。典型的冬季气温略高于冰点,并伴有罕见的轻度霜冻(图1)4D)。4A-C表示植物的生命周期分为营养阶段和生殖阶段。不同品系之间的开花时间差异很大,但在所有三个试验中,大多数品系都遵循相似的趋势。在室外试验中,三个早花的Bd品系,特别是Bd3-1,再次提前开花。那些在户外晚些时候开始和/或结束开花的植物(如。Adi-10、Adi-12、Koz-3和BdTR12c)往往是之前需要三到四周的冷处理才能在生长室内同步开花的品系。如图所示,开花起始的一些线内变异可能是由于春化不足造成的3.。有趣的是,第一次试验中的大多数品系在17天后种植的第二次试验后开花。这一结果表明,最初的17天温度相对较低,日照较短,使植物进入了较长的营养阶段(图2)4).
环境对核心采集区株高和茎密度的影响
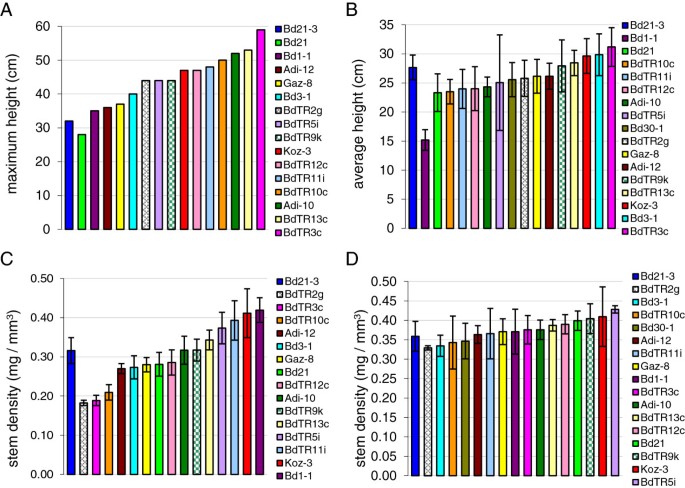
观察到在室外生长的植物有很大的表型差异(图1和2),并确定通过改变冷处理的长度可以使开花时间同步(图1)3.和表3.),我们感兴趣的是调查在开花时间匹配的株系中表型变异持续的程度。如上所述,对于生长在室外的植物,较早开花系的茎受到的环境条件与较晚开花系的茎受到的环境条件截然不同。因此,观察到的巨大表型差异可能是遗传和环境因素共同作用的结果。因此,在错开春化处理后,我们在生长室中培养核心收集,使所有系在大约一周的时间内开花(实验4,表4)1).将得到的株高和茎密度与最初在室外生长的植株进行比较(实验1,表1)1),没有控制春化(图5).总体而言,在生长室中生长的株系之间茎长和密度的变化较小;尽管如此,仍然存在显著的变化,并且在两种条件下,极端情况下的几条线往往处于极端情况(图2)5).
植物株高和茎密度的自然变异和环境影响。(一)室外种植植物的最大高度。(B)在生长室中生长的植物的平均高度,具有交错的春化以同步开花。方差分析p-value = 1 × 10-17年各组之间的差异。(C)室外生长植物的平均茎密度。方差分析p-value = 1 × 10-22年。(D)在生长室中生长的植物的平均茎密度,具有交错春化以同步开花。方差分析p-value = 1 × 104。以Bd21-3为参照,先按高度由小到大排列(A, B)或者说茎密度(C, D)。Bd30-1是在完成对在室外生长的品种的初步调查后提供的(一个,C,实验1),并添加到后面的表征中(B,D(实验4).键上显示颜色编码,四个面板上的每条线都是相同的。误差条B,C,D表示标准差。
在没有控制春化的情况下,植株实际上更高:核心系的外部高度达到28至59厘米,而在生长室中错开春化和培养后,平均高度为15至31厘米(图2)5A, B).因此,春化加速开花缩短了营养生长期,导致坐种前茎伸长减少。Bd1-1为这种总体趋势提供了一个清晰的例子。虽然在室外生长时Bd1-1比Bd21-3高几厘米,但在同步开花时,Bd1-1比Bd21-3矮45%。这一结果表明,晚花系Bd1-1的生长速度相对较慢,在室外,与早花系Bd21-3相比,晚花系Bd1-1通过长时间的茎伸长获得了稍高的高度。Bd21、Bd21-3和Bd3-1在不同条件下花期相似(图2)3.和4), Bd21始终是3个品系中最矮的,Bd21-3的高度居中,Bd3-1最高。无论是春化控制还是春化控制,BdTR3c都是核心系中最高的,这表明这种高度差异至少部分受遗传调控,而不仅仅是开花时间或环境差异的次要影响。
从高度上看,花期匹配株系的茎密度也有变化,但在对照条件下变化幅度较小(图2)5对于花期同步的植株,茎密度最大(0.43 mg/mm)3.密度最小的茎(0.33 mg/mm)只比最小的茎(0.33 mg/mm)高30%左右3.),而户外种植的植物则相差230%。然而,重要的是,在两种条件下,一些线显示出相似的趋势。例如,无论春化是否交错,BdTR2g系密度最小,Koz-3系密度次之。
核心集合中的综合微阵列聚合物分析
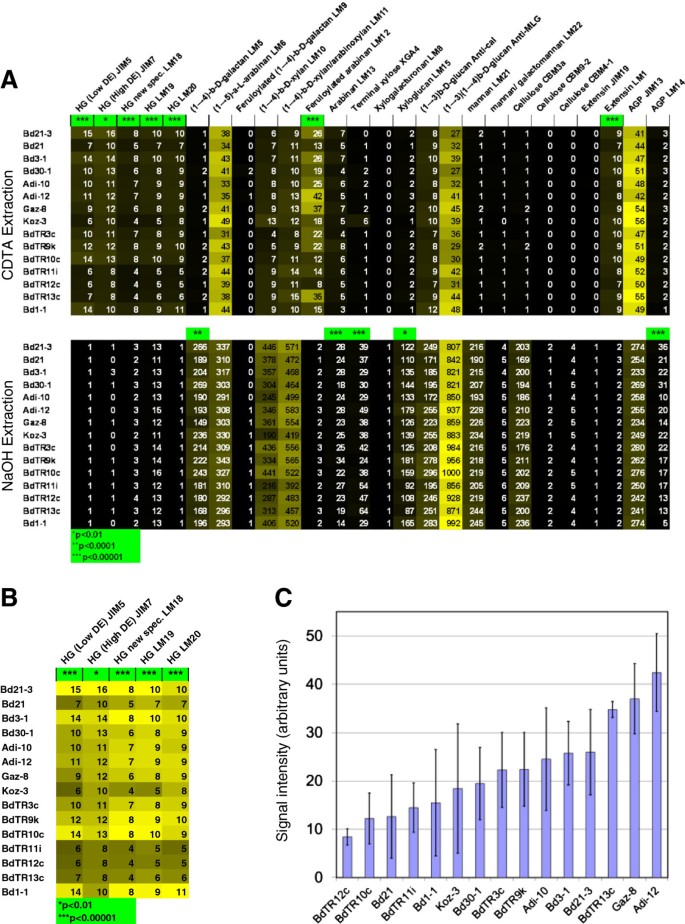
为了获得更多的分子信息关于我们的核心系茎之间的差异,我们进行了全面的微阵列聚合物分析(CoMPP)。CoMPP技术提供了植物样品组中多糖表位相对丰度的信息。与糖苷键和近红外光谱不同,表位几乎总是可以确定地分配给特定的多糖结构。然而,值得注意的是,CoMPP点信号值不一定反映存在的表位的绝对数量,因为多糖的可提取性可能在不同的样品中有所不同。
所有抗体的平均信号强度热图如图所示6。方差分析结果表明,26个表位中有12个具有显著性差异,10个表位具有显著性差异p-值<0.0001和两个p-value <0.01(图26).有趣的是,所有五种识别果胶中发现的表位的抗体都遵循相同的模式,并识别出不同系之间的显著差异。为了使果胶的差异更容易可视化,仅创建了五个果胶表位的热图(图1)6B).另一种查看数据的方法是单个抗体信号强度的条形图。例如,针对阿魏酸化阿拉伯糖提出的抗体LM12的数据如图所示6在这种格式中,四倍的变化是很明显的。由于该抗体识别阿魏酸片段,观察到的变化反映了整体阿魏酸化,而不仅仅是阿魏酸化的阿拉伯人。
核心集的CoMPP分析。(一)从CDTA和NaOH提取的平均抗体信号强度热图。对于每次提取,最高强度(CDTA为56,NaOH为1000)信号设置为黄色,最低为黑色。实际值显示在每个单元格中(使用任意单位)。星号表示行之间的显著差异,基于p-每个抗体的方差分析值。1、2和3个星号表示p-值分别低于0.01,0.0001和0.00001。(B)从CDTA提取的所有识别果胶中所含表位的抗体的信号强度。这里黄色被设置为每个抗体的最高信号强度。请注意,类似的趋势被观察到所有的果胶表位为每条线。(C)用抗体LM12探测CDTA提取的信号强度,该抗体是针对阿魏酸化的阿拉伯糖提出的,绘制为柱状图。每条线显示平均信号强度,误差条表示标准差。方差分析,p< 0.00001。
核心馆藏的颗粒特征
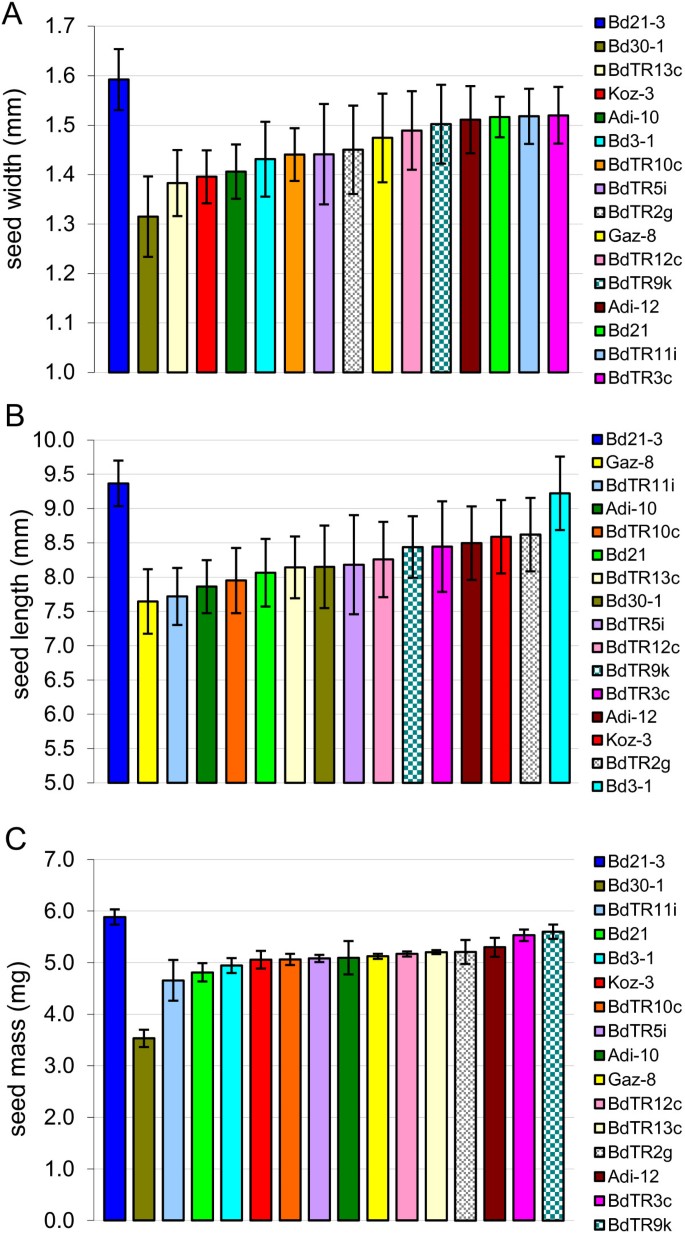
由于种子是粮食作物植物最重要的部分,我们还在开花时间匹配的核心收集集中表征了种子宽度、长度和质量的多样性(实验5,表5)1).在所有三个种子性状中均观察到极显著的变异(图2)7).种子宽度在1.3 ~ 1.6 mm之间,长度在7.6 ~ 9.4 mm之间,质量在3.5 ~ 5.9 mg/粒之间。有趣的是,最轻的种子质量低,如。Bd30-1,似乎是由于它们狭窄的宽度。最长、最宽、最重的种子属于我们用于转化和诱变的品系Bd21-3。3.]。
天然植物春化同步开花的种子宽度、长度和质量测量。平均值和标准差是基于10个种子一个和B还有四套25粒种子C。请注意,为了清晰起见,y轴从1毫米开始(一)5毫米深(B)。为了帮助可视化,每个图中的每条线都用相同的颜色表示,并且线的顺序反映在右侧的图例中。颜色编码与图中相同5。我们的标准线Bd21-3总是放在左边,其他线从最小到最大的平均值排序。P-方差分析检验线间差异的值为(一)1 × 10-15年,(B)1 × 10-12年,(C)1 × 10-19年。
讨论
作为表征表型变异的一步b . distachyon,我们研究了不同人种的几个特征b . distachyon种质资源收集。我们对171个自交系的生长习性、高度和落粒情况进行了初步调查(图2)1).我们还检查了茎的密度,并使用近红外光谱来推断细胞壁的差异在较小的细胞系子集(图2)2和3.).所有被检查的性状都存在相当大的变异。利用这些结果和先前的基因型数据[7我们选择了17条线的核心集合进行更详细的表征。值得注意的是,我们已经对核心收集的所有品系的基因组进行了重新排序,这些序列加上更多的序列将很快发布。
为了对核心收集的品系进行稳健的表型比较,我们确定了春化时间,触发品系几乎同时开花(图2)3.和表3.).这使我们能够消除开花时间作为一个变量,并最小化环境差异对表型差异的贡献。使用开花时间匹配的植株(实验4,表1)1),我们再次检测到所有特征的显著差异。我们对衰老后的高度和茎密度的评估与用于专用生物燃料草和秸秆的季末收获有关。通过识别又高又密的线条,如。Koz-3,我们正朝着确定导致这些关键性状有利组合的基因型迈出第一步。
种子大小是粮食作物的一项重要性状。最大平均种子质量比最小平均种子质量大70%(图2)7).这种种子大小的差异小于先前报道的2.4倍[7],因为我们没有包括任何已知种子大小较小的品系(如。Bd1-1),因为它们需要长时间的春化[7]。事实上,Bd21-3和Bd30-1代表了核心集合中种子质量的极端,而春化要求只是略有不同,这使这两个品系成为杂交以绘制种子大小遗传基础的良好候选者。
此外,使用近红外光谱成功地使我们能够在选择核心品系时捕获细胞壁多样性:在CoMPP分析中,通过抗体结合测量,开花时间匹配的植物在细胞壁组成上表现出许多差异(图2)6).CoMPP检测到的差异包括与果胶中不同表位结合的所有五种抗体的信号强度变化高达两倍。而果胶是草细胞壁的一小部分[17,18],它们存在于中间片层,在细胞粘附和分裂中起关键作用[35,36]。因此,这些观察到的成分差异可能导致发育差异。同样地,我们观察到在识别阿魏酸结合到半纤维素的抗体信号中有四倍的变化。由于阿魏酸有助于生物质抵抗糖化和发酵成乙醇[37],这种变化可能有助于定制用作生物质原料的细胞壁。
在室外生长的植物的外观与在温室或生长室内生长的植物有很大的不同。这并不奇怪,因为在室外生长的植物受到更高的光照强度、风和更大的环境变化的影响。事实上,在温室和生长室中生长的植物很难观察到生长习惯的差异。因此,我们在室外种植的植物中观察到的生长习惯与之前关于温室植物生长习惯的报告不同,这并不奇怪[6]。虽然外部表型的评分可能与农业更相关,但环境的可变性也会使识别控制特定性状的基因的努力复杂化。因此,表型在不同环境条件下保持不变的系是特别感兴趣的。我们在两种不同的条件下测量了茎高和茎密度:室外不受春化控制和生长室内春化交错以同步开花时间。虽然在生长室中生长的植物的表型差异不那么明显,但在两种条件下,有几个品系遵循相同的趋势。例如,BdTR3c一直很高;在两种条件下,BdTR2g茎密度最小,Koz-3茎密度次之。总的来说,对表型进行分类,特别是鉴定具有不同表型的品系,为进一步研究调节这些表型的遗传因素提供了基础。无论性状是生长习性、开花时间、种子大小,还是细胞壁表位的丰度,这里展示的表型数据都可以为RIL群体的选择、基因组重测序和全基因组关联研究提供信息。
结论
综上所述,我们观察到大量的野草自然变异b . distachyon与粮食和生物质作物有关的性状。自b . distachyon易于实验操作和遗传分析,相对快速地鉴定控制这种变异的基因是可行的。然后,这些基因可以用来通过生物技术改善作物,也可以通过指导挖掘和利用作物本身的自然变异来改善作物。在这方面,必须指出b . distachyon在其驯化过程中,没有经历过作为粮食种植的物种的种群瓶颈。因此,除了更快地识别基因之外,b . distachyon可能含有驯化谷物中根本不存在的基因和自然变异。虽然人口瓶颈不是问题,因为大多数禾草可能被部署为第一批大规模生物量作物(如。柳枝稷),它们的大尺寸,复杂的遗传和长世代使得识别负责基因极其困难。因此,对于谷物和生物质作物,控制自然多样性的基因的鉴定b . distachyon可能会非常有用。
参考文献
Draper J, Mur LAJ, Jenkins G, Ghosh-Biswas GC, Bablak P, Hasterok R, Routledge APM:Brachypodium distachyon:牧草功能基因组学的新模式系统。植物生理学报,2001,27(4):1539-1555。10.1104 / pp.010196。
Vain P, Worland B, Thole V, McKenzie N, Alves SC, Opanowicz M, Fish LJ, Bevan MW, Snape JW:农杆菌属-介导的温带草的转化Brachypodium distachyon(基因型Bd21)用于T-DNA插入突变。植物学报,2008,6(6):564 - 564。10.1111 / j.1467-7652.2007.00308.x。
沃格尔J,希尔T:高效率农杆菌属的-介导变换Brachypodium distachyon自交系Bd21-3。植物学报,2008,27(3):471-478。10.1007 / s00299 - 007 - 0472 - y。
Vogel JP, Garvin DF, Leong OM, Hayden DM:农杆菌属在模式草中介导的转化和自交系发育Brachypodium distachyon。植物学报,2006,25(5):591 - 591。
IBI:模式草的基因组测序和分析Brachypodium distachyon。自然科学,2010,36(3):763-768。10.1038 / nature08747。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军Brachypodium distachyon自交系。中国生物医学工程学报,2009,32(10):876-890。10.1139 / g09 - 062。
引用本文:Vogel JP, Tuna M, Budak H,霍宁,谷玉青,Steinwand MA: SSR标记的开发及土耳其人群体多样性分析Brachypodium distachyon。植物生态学报,2009,29(9):888 - 8186 /1471-2229-9-88。
Mur LAJ, Allainguillaume J, CatalÃ’P, Hasterok R, Jenkins G, Lesniewska K, Thomas I, Vogel J:短柄植物工具箱在谷物和牧草研究中的应用。植物学报,2011,19(1):334-347。10.1111 / j.1469-8137.2011.03748.x。
Bragg JN, Wu J, Gordon SP, Guttman ME, Thilmony R, Lazo GR,顾玉青,Vogel JP:西部地区研究中心短茅T-DNA插入突变体的产生和鉴定。科学通报,2012,7 (9):e41916-10.1371/journal.pone.0041916。
李建军,李建军,李建军,等。水稻基因组T-DNA标记的研究进展Brachypodium distachyon社区标准行Bd21。植物学报,2012,8(6):734-747。
Brkljacic J, Grotewold E, Scholl S, Mockler T, Garvin D, Vain P, Brutnell T, Sibout R, Bevan M, Budak H,等:草本植物的模型:今天和未来。植物生理学报,2011,37(4):391 - 391。10.1104 / pp.111.179531。
Salas Fernandez MG, Becraft PW, Yin Y, lbberstedt T:从矮人到巨人?植物高度调控对生物量产量的影响。植物科学进展,2009,14(8):454-461。10.1016 / j.tplants.2009.06.005。
李建军,李建军,李建军,李建军,李建军。高粱茎叶结构碳水化合物的QTL分析。作物科学,2008,48(6):2180-2193。10.2135 / cropsci2008.01.0068。
Richard TL:扩大生物燃料基础设施的挑战。科学通报,2012,29(5):793-796。
张建军,张建军,张建军,张建军,张建军,等。植物细胞壁的研究进展。科学通报,2004,36(5):2206-2211。10.1126 / science.1102765。
Liepman AH, Wightman R, Geshi N, Turner SR, Scheller HV:拟南芥细胞壁研究的一个强大模型系统。植物学报,2010,61(6):1107-1121。10.1111 / j.1365 - 313 x.2010.04161.x。
草类细胞壁的结构与生物发生。植物物理学报,1994,17(4):445-476。10.1146 / annurev.arplant.47.1.445。
Vogel J:草细胞壁的独特之处。植物学报,2008,11(3):301-307。10.1016 / j.pbi.2008.03.002。
Gomez LD, Bristow JK, Statham ER, McQueen-Mason SJ:糖化分析Brachypodium distachyon茎在温和条件下水解。生物技术在生物燃料中的应用。2008,1:15-10.1186/1754-6834-1-15。
Anderson JW, Baird P, Davis RH, Ferreri S, Knudtson M, Koraym A, Waters V, Williams CL:膳食纤维对健康的益处。植物学报,2009,67(4):188-205。10.1111 / j.1753-4887.2009.00189.x。
福斯特CE,马丁TM,保利M:植物细胞壁的综合成分分析(木质纤维素生物质)第二部分:碳水化合物。光学学报,2010,37(3):10521577。
Brinkmann K, Blaschke L, Polle A:木质素近红外光谱测定方法的比较及其对木质素蛋白的影响。化学学报,2002,28(12):2483-2501。10.1023 /: 1021484002582。
王海涛,王海涛。亚麻(linum usitatissimum L.)茎的近红外光谱研究。农业食品化学,1998,46(3):991-998。10.1021 / jf970656k。
陈立明,Carpita NC, Reiter WD, Wilson RH, Jeffries C, McCann MC:利用傅里叶变换红外光谱判别分析快速筛选细胞壁突变体的方法。植物学报,1998,16(3):385-392。10.1046 / j.1365 - 313 x.1998.00301.x。
Penning BW, Hunter CT, Tayengwa R, Eveland AL, Dugard CK, Olek AT, Vermerris W, Koch KE, McCarty DR, Davis MF,等:玉米细胞壁生物学的遗传资源。植物生理学报,2009,31(4):773 - 778。10.1104 / pp.109.136804。
李建军,李建军,李建军,等。利用近红外光谱技术预测黄芩细胞壁碳水化合物及其品质。作物科学,1988,28:348-353。10.2135 / cropsci1988.0011183X002800020035x。
Casler MD:表型循环选择方法降低平滑雀麦草纤维浓度。作物科学,1999,39(3):381-390。10.2135 / cropsci1999.0011183X0039000200014x。
Moller e, Pettolino FA, Hart C, Lampugnani ER, Willats WG, Bacic A:植物细胞壁聚合物的微阵列分析。[J] .光学学报,2012,37。
Moller I, Sørensen I, Bernal AJ, Blaukopf C, Lee K, Øbro J, Pettolino F, Roberts A, Mikkelsen JD, Knox JP,等:基于微阵列的植物细胞壁聚合物高通量定位。植物学报,2007,35(6):1128 -1128。10.1111 / j.1365 - 313 x.2007.03114.x。
Alonso-Simón A, Kristensen JB, Øbro J, Felby C, Willats WGT, Jørgensen H:小麦秸秆水热预处理过程中细胞壁聚合物的高通量芯片分析。生物工程学报,2010,35(3):559 - 564。10.1002 / bit.22546。
Schneider C, Rasband W, Eliceiri K: NIH图像到图像J: 25年的图像分析。地理学报,2012,(9):671-675。10.1038 / nmeth.2089。
Kemsley EK:光谱数据的判别分析和类建模。纽约:John Wiley & Sons;1998.
[王志强,王志强。种子传播与作物驯化:在栽培条件下的破碎、萌发和季节性进化。]植物学报,2009,38:238-232。
李春华,李春华,李春华,李春华,李春华。植物开花时间与春化响应的自然变异Brachypodium distachyon。《生物能源》,2010年出版
植物细胞壁果胶多糖的结构、功能和生物合成。碳水化合物学报,2009,34(4):379 - 391。10.1016 / j.carres.2009.05.021。
张丽娟,张丽娟。果胶在植物形态发生中的作用。中国生物医学工程学报,2012,31(3):397-402。10.1016 / j.biosystems.2012.04.006。
植物细胞壁芳烃:对生物量降解的影响。生物质化学工程,2008,29(4):394 - 394。10.1002 / bbb.76。
致谢
我们要感谢Matthew De La Housaye提供的技术援助。这项工作得到了美国能源部科学办公室(BER)和USDA CRIS项目5325-21000-017-00的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
LT设计并进行形态学和近红外实验,起草稿件;JUF, ADF和WGTW设计并进行了CoMPP实验;MAS和TKR开发了近红外方法并解释了数据;JPV构思了这个项目,帮助设计实验,解释数据并帮助起草手稿。所有作者都阅读并批准了最终的手稿。
电子补充资料
12870 _2013_1757_moesm1_esm.xlsx
附加文件1:表S1: 171的生长习性、高度和种子剥离表型的初步调查b . distachyon无春化控制的外生系,试验1。(xlsx18kb)
12870 _2013_1757_moesm2_esm.pptx
附加文件2:图S1:实验1,在没有控制春化的情况下在室外生长的细胞系图像。(pptx17mb)
12870 _2013_1757_moesm3_esm.xlsx
附加文件3:表S2:实验1,在室外无控制春化生长的核心自然材料的表型总结。(xlsx11kb)
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
泰勒,L.,弗兰格尔,J.U, Fagerström, A.D.et al。一个核心植物群的选择和表型特征Brachypodium distachyon自交系。BMC Plant Biol14日,25(2014)。https://doi.org/10.1186/1471-2229-14-25
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-25
关键字
- Brachypodium distachyon
- 细胞壁
- 近红外光谱
- 种子
- 生物燃料