- 研究文章
- 开放获取
- 发表:
Ectoparasitic增长Magnaporthe.在大麦上触发假定大麦蜡生物合成基因的表达CYP96B22什么与穿透阻力有关
BMC植物生物学体积14, 文章编号:26(2014年)
摘要
背景
真菌植物病原体引起的头部爆炸Magnaporthe oryzae是小麦和大麦种植即将面临的威胁。我们研究了大麦对该菌株的非宿主反应Magnaporthe.致病的物种复合体狼尾草SPP。作为新型抵抗性状的潜在来源。
结果
阵列实验鉴定了编码推定的细胞色素P450单氧化酶的大麦基因,其转录物与宿主相互作用相比,其转录物在非形状中的较高浓度上积聚。P450植物基因家族CYP96疏水内的基因簇,并指定为CYP96B22。表达式CYP96B22是病原菌在叶片外部寄生生长时触发的。使用杀菌剂处理和Magnaporthe.突变体证实,这种早期激活是没有必要的渗透CYP96B22。转录沉默的CYP96B22使用大麦条纹花叶病毒导致大麦植株的渗透抗性降低Magnaporthe.主机和非主机隔离。这种表型似乎对大麦特定 -Magnaporthe.相互作用,因为在类似处理的植物中没有改变适应的大麦粉状霉菌真菌的渗透。
结论
综上所述,我们的结果表明大麦和Magnaporthe.在植物表面分离。由于已知植物CYP96家族成员参与表皮蜡的合成,这些物质或其衍生物可能作为信号成分。我们建议功能重叠CYP96B22在大麦的基础和非形状电阻期间执行渗透性阻力Magnaporthe.物种。
背景
Magnaporthe oryzae是一种真菌植物病原体,导致几种草地上的毁灭性疾病,包括谷物米饭,小麦和大麦[1].在水稻上,疾病被称为“稻瘟病”,它导致全世界水稻种植中最重要的经济损失。最近,真菌吸引了更多的关注,因为它已成为大麦和小麦种植的主要问题,特别是在南美洲,疾病被命名为小麦或头部爆炸[2,3.].因此,迫切需要将新的抗性性状转化为现代优质大麦和小麦品种。作为这些性状的潜在来源,我们研究了大麦对非适应的非宿主反应Magnaporthe.隔离。这种已被充分理解的现象可以保护所有大麦品种免受感染Magnaporthe.在其他草类上致病的物种数字基础要么狼尾草[4].一般认为,非宿主抗性在野生环境下是持久的,对病原体物种的所有遗传变异都有效[5].
大麦感染Magnaporthe.当三细胞分生孢子附着在大麦叶表面时,寄主或非寄主分离开始,这是由孢子顶端粘液的形成促进的(回顾见[6- - - - - -8])。随后形成的胚管的粘附性也伴随着细胞外基质的分泌。在生物管的尖端处,形成称为膜的专用细胞,其中产生高压戈尔,其支持底层表皮组织的机械渗透。下一个感染阶段之间是不同的Magnaporthe.主机和非主机隔离。宿主病原体侵入表皮细胞与球茎菌丝引发结肠化的短营养相。其次是在该过程中,在该病原体上饲喂积极杀死的宿主细胞[9].在感染叶片上可见的病变发生孢子形成后,疾病周期完成。相比之下,非宿主菌株对大麦叶片的渗透通常会受到主动防御反应的反击,从而阻止病原体生命周期的完成[4].这些反应可以在渗透期间或之后起作用,因此分别为渗透率和渗透后防御曲目贡献。对于大麦,典型的植物反应与渗透抗性相关的植物反应Magnaporthe.菌种是在真菌附着胞下试图穿透的一侧积累的自体荧光物质,它与细胞壁附着体的形成有关,即所谓的乳头[4,10].通过干扰肌动蛋白细胞骨架或使用大麦突变体,降低穿透抗性的有效性,揭示了受攻击表皮细胞的超敏反应作为第二道防线的功能,类似于后备策略[11].后者穿透后抗性反应的动力学表明,它在真菌将其生活方式转变为坏死之前起作用。
虽然宿主和病原体在渗透过程中和渗透后的信号交换已经有了很多了解,但信号是否在渗透前就已经在表面发生仍然不确定。对于大麦来说,新mrna的积累显示在接种小麦白粉病真菌后4小时[12].在这种感染阶段,大麦非体病原体尚未形成胚胎管,但是初级生殖器管不能排除渗透尝试。据报道,米米为接种后16小时发生基因的转录上调。M. Oryzae.,真菌形成芽管和附着胞的时间范围[1].在感染的早期阶段期间可以释放的信号分量的潜在来源是表示通过病原体首先感应的叶片表面层的角质层[13].角质层主要由角质组成,这是一种由C16和C18脂肪酸单元构建的聚合物。角质层内蜡和表角质层外蜡分别包埋在角质层聚合物基质中或沉积在其外表面[14].一般来说,角质层蜡是由链长为26 ~ 34个c原子的长链脂肪脂、三萜和其他环状化合物组成的复杂混合物,都可以通过溶剂萃取释放出来[14,15].极长链脂肪酸(VLCF, C26至C34)在表皮ER中被拉长,从C16和C18脂肪酸开始。这种伸长是由一种由四种不同的酶组成的伸长酶复合物催化的[13].然后将VLFC加工为丙基还原途径中的伯醇和蜡酯,或者在脱氧羰基化途径中还原成烷烃([13],见附加文件1:图S1)。然后,烷烃可能进一步氧化成仲醇和酮的活性的中间链烷烃羟化酶(MAH)。在拟南芥中发现CYP96基因家族的细胞色素P450蛋白,即CYP96A15,具有马哈酶活性[16].有趣的是,所有拟南芥的花序茎Mah1.突变株表面覆盖着视觉上正常的蜡表面,尽管与野生型相比,它们缺乏仲醇和酮,这表明在蜡层的形成方面具有较高的可塑性。
在这里,我们报告了大麦细胞色素P450基因,其对CYP96家族成员最大的同源性。在大型转录组分析中鉴定了基因,以在接受大麦植物之后明确调节Magnaporthe.nonhost隔离(17].结果表明,该基因在叶表面表达是响应病原菌体外寄生生长的,功能基因沉默分析表明该基因参与了病原菌的穿透抗性。
结果
大麦感染Magnaporthe.非宿主分离物诱导表达CYP96B22
在之前的一项基于宏阵列的研究中,我们已经鉴定出大麦IPK CR-EST克隆HO07G08是大麦中差异转录丰度最高的三个基因之一Magnaporthe.与主机交互相比,非主机交互[17].对最近发表的大麦基因组的高可信度序列进行BLASTN搜索,发现HO07G08是MLOC_15925.1 cDNA的一部分([18],见附加文件1:图S2)。从HO07G08中推导出的氨基酸序列与MLOC_15925.1蛋白的c端几乎一致。差异导致推导的蛋白质中三个单一氨基酸的变化,这可能是由于所使用的品种之间的差异。MLOC_15925.1蛋白被注释为细胞色素P450 (CYP)家族蛋白。在MLOC_15925.1推导的整个61.3 kDa蛋白中,对保守结构域进行搜索发现了一个跨膜区域和一个中链羟化酶CYP结构域。位于细胞色素P450主页的水稻CYP序列的蛋白质系统发育分析[19[CYP86氏族的CYP96系列中的蛋白质分组(图1).序列与CYP96B13共享67%的身份Brachypodium distachyon而59%的人对CYP96B6有鉴别性。com。d . Nelson)。如Bak所示et al。[20.之后,序列被送到了CYP命名委员会的大卫·纳尔逊(David Nelson)那里,他将其命名为CYP96B22。
Ectoparasitic增长Magnaporthe.对大麦诱导表达CYP96B22
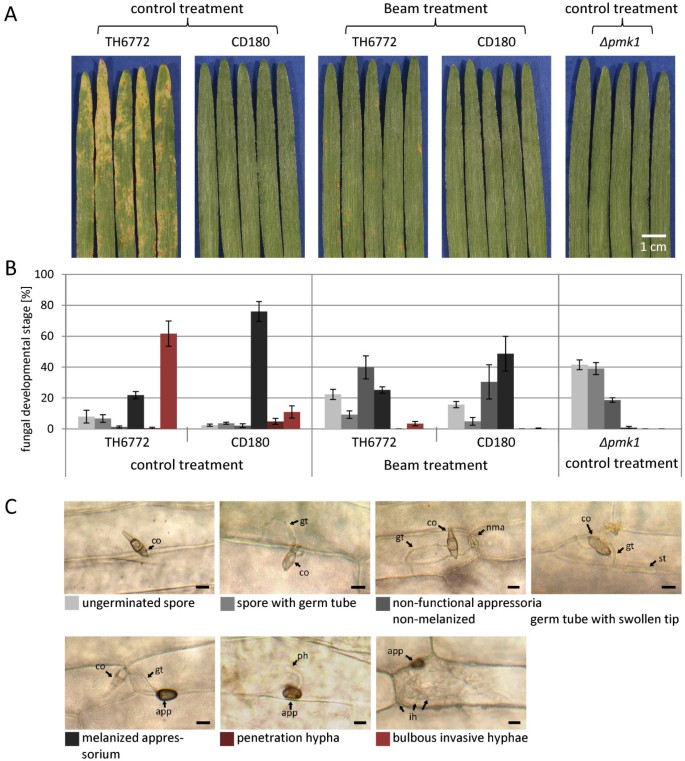
首先,我们确认了在宏阵列研究中所获得的结果CYP96B22对感染的反应不同Magnaporthe.在独立实验中分离。因此,对大麦品种Vada进行了接种M. Oryzae.宿主分离物(TH6772)在接种后五天导致原发性叶片明显可见的疾病症状(图2一种)。与此同时,叶子被接种狼尾草-感染非宿主分离物(CD180),如预期的那样,即使在延长潜伏期后也没有显示任何疾病症状(图)2根据泽勒霍夫的说法et al。[4)和Faivre-Rampantet al。[1这两个分离体很可能是不同的成员Magnaporthe.物种。为了进行RT-qPCR分析,我们将同样实验的染病叶片的表皮剥去(图)3.).CYP96B22模拟处理样品的表达在早期的时间点,即在6和12 h时更高,随后降低(图)3.一种)。基本上是成绩单概况CYP96B22接种寄主或非寄主分离物后,其模式相同。然而,在每小时6小时,宿主的表达量显著高于模拟情况,在非宿主相互作用中甚至更高(图)3.因此,我们的数据完全类似于先前发表的关于的差异表达的结果CYP96B22[17].
大麦接种后的宏观和微观表型Magnaporthe.宿主(TH6772)或非宿主(CD180)分离株。一)大麦品种初生叶的肉眼病徵。接种分离株TH6772、CD180或突变体后5 d Vada∆pmk1如..所示。在接种分离物TH6772或CD180之前,用杀真菌剂束处理一些植物。B)在同一实验中,处理植株的初生叶在每小时96小时收获,以进行显微分析。根据真菌侵染结构的发展情况,将植物上的相互作用位点分为6类(C)。的∆pmk1突变体在其胚胎管的尖端显示肿胀的结构,其分类,类似于束治疗后的非黑色化映射,作为非功能性映射。从每处理至少三片叶片,检查100个相互作用部位。该图显示了每个类别的平均频率和一个代表实验的标准错误。结果在另外两种进一步的生物重复中得到了证实。秤栏:10μm;CO:藜;GT:胚管;NMA:非黑色化膜;ST:生物管末端肿胀的结构;app:appressorium; ph: penetration hypha; ih: invasive hyphae.
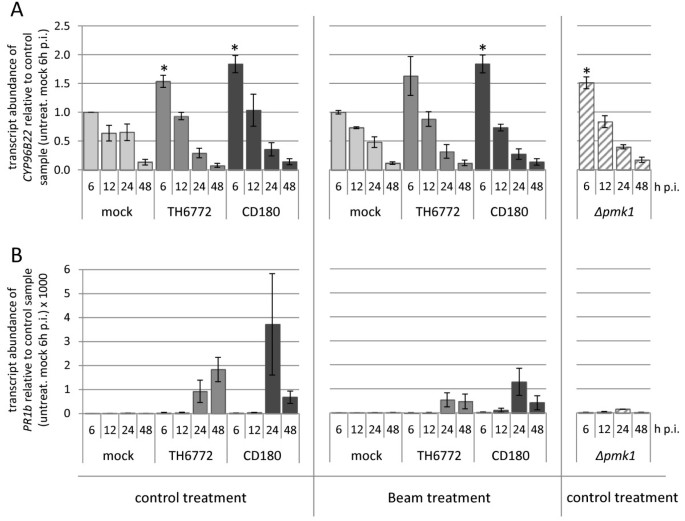
不同接种量的大麦转录本积累Magnaporthe.分离物并用杀真菌剂束预处理。采用RT-qPCR方法测定了该菌株的相对转录本丰度CYP96B22(一)和PR1B.(B)在大麦表皮带菌接种后6、12、24和48 hMagnaporthe.宿主(TH6772)或非宿主分离物(CD180)或突变体(∆pmk1)确定。一组植物在接种前用杀菌剂Beam处理,另一组用水处理(对照处理)。计算每个样本相对于内参基因的转录本丰度EF1α并且被显示为三个独立生物重复的平均值和标准误差。为了归一化生物重复之间的绝对值的差异,在每次实验中计算表达值,相对于6小时P.I,在每个实验中计算出拟型样品(对照处理)。这设定为1.0。统计分析CYP96B22通过配对t检验,与对照处理的模拟接种样品进行比较,仅在6小时pi时间点进行表达。当P < 0.05差异显著时,以星号表示。
观察到的早期诱导CYP96B22表达后Magnaporthe.接种提出了引起这种反应的刺激因素的问题。以辨别早期大麦发生的细胞事件Magnaporthe.转基因的交互,使Magnaporthe.为宿主和非体性分离物产生分离物并接种到大麦植物上。使用ePiforEcencic显微镜的分析显示,在6小时P.I.大多数Conidiospores都在发芽的阶段,同时只有少数人已经形成了Appressoria(附加档案1:图S3)。24 h前,无论是在寄主还是非寄主相互作用中,均未观察到被侵染表皮细胞内的渗透钉或侵染菌丝。因此,我们得出结论,在我们的实验条件下,渗透发生在12到24 h / i之间CYP96B22转录物累积在6小时P.I.在异位遗传学生长期间被触发Magnaporthe.在大麦叶片表面,可能在渗透之前。
CYP96B22表达引起的M. Oryzae.不需要穿透
进一步测试假设CYP96B22在大麦中表达是在渗透前触发的,我们使用了杀菌剂处理和渗透不足M. Oryzae.分别在附着胞形成后或之前阻止病原体入侵的突变体。
杀菌剂Beam含有活性成分三环唑,可抑制黑色素生物合成途径中1,3,8-三羟基萘转化为vermelone的还原[21].黑色素的缺失会导致Magnaporthe.附着体不能渗透,因此在水稻栽培中广泛应用于防治稻瘟病。在这里,我们在大麦植株上施用Beam土淋,然后接种Magnaporthe.主机或非主机隔离。接种后,光束处理的植物显着较低疾病症状M. Oryzae.宿主分离atthth6772与指示杀菌剂的有效性的相应控制相比(图2一种)。显微镜分析显示,宿主和非体性分离均在薄层处理的植物的叶片表面上发育的感染结构,直至灌注的阶段(图2B, C)。在此之后,如预期的,光束治疗导致隐性色素沉着的缺失,即黑化,在所有发病率中约有一半发现隐性色素沉着。束处理后的植物表皮细胞中几乎未发现渗透钉或侵染菌丝。因此,我们得出结论,即使在附着胞深色色素沉着的情况下,真菌也大多无法穿透(图)2b)。在宿主相互作用中检测到寄生菌丝未检测到侵袭性菌丝的少量细胞与在梁处理植物上观察到的罕见疾病症状(图2并表明在我们的实验中使用的杀菌剂浓度并没有介导100%的保护。尽管beam处理的工厂无法渗透,CYP96B22转录物仍然在6小时内积累。响应于主机或非波强分离的接种,与相应的控制相比(图3.一种)。为了进一步证实这一观察,我们使用了M. Oryzae.突变体Δpmk1它缺乏一个功能保守的丝裂原活化蛋白激酶[22].该突变体不能形成正常的抗胰蛋白,因此不能穿透米或大麦叶。由于突变体在遗传背景下产生M. Oryzae.我们首先验证了菌株Guy11在大麦cv上的侵染表型与菌株TH6772相似。Vada(数据未显示)。徐和哈默同意[22],Δpmk1被发现在大麦上是原因的(图2同样,显微镜下的评估证实了这些作者的结果,显示突变体只在它们的芽管顶端形成了缺乏黑色素的肿胀结构,而不是成熟的附着体(图)2C)大麦表皮接种Δpmk1和RT-qPCR实验显示CYP96B22每小时6小时(图3.一种)。用梁和梁和的实验Δpmk1突变体无疑揭示了Magnaporthe.触发器CYP96B22大麦中独立于附着胞形成或在寄主和非寄主相互作用中成功渗透的表达。
比较表达PR1B.在同一套RT-qPCR样本中监测。根据雅洛施发表的结果et al。[23],PR1B.在大麦叶片中大量积累转录本Magnaporthe.主机隔离(图3.B)PR1B.转录物积累既不在光束处理的植物中看到也不是响应接种的Δpmk1突变体(图3.B),表示诱导PR1B.表达取决于成熟附着体的形成和/或成功的渗透。
混战的CYP96B22表达导致渗透阻力
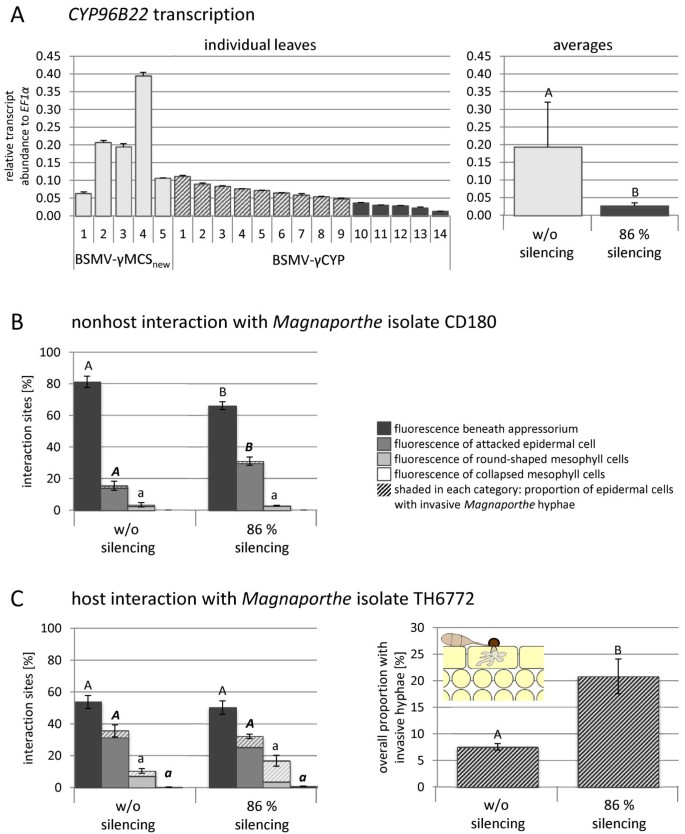
我们的下一个目标是从功能上评估是否CYP96B22在保护大麦免受不同Magnaporthe.隔离。为此,我们使用了暂态大麦条纹花叶病毒(BSMV)诱导的基因沉默试验最早由Holzberg描述et al。[24]我们已经改编了Magnaporthe.感染测定[25].我们插入一个234 bp的片段CYP96B22编码序列进入BSMV的γ-亚基。使用Si-Fi软件,预计该构建体将导致有效降低CYP96B22mRNA而不是靶向其他大麦基因的转录物(所谓的离目标)(附加文件1:图S4)。BSMV的大麦植物感染展示沉默构建体(BSMV-γcyp)或没有它(BSMV-γMCS新)在初生叶上进行。在接种BSMV后10-14天,两组中有10-30%的个体出现典型的马赛克状病毒病症状,表明病毒感染成功。出现病毒症状的植物的第三片叶子被切掉,并分成三等长片(有关实验设计,请参阅附加文件)1:图S5)。其中两个人接种了Magnaporthe.将CD180和Th6772分离在分离的叶片测定中。由于以前的研究表明,BSMV-Vigs实验中基因表达的倒闭可以在不同的植物之间变化,通过使用非健康分离物接种后,通过RT-QPCR通过RT-QPCR监测沉默效率(图4A).平均而言,表达水平CYP96B22植物较低,植物接种了BSMV-γcyp的BSMV-γMCs新来华的控制植物。
BSMV-mediated沉默的CYP96B22在大麦的感染期间Magnaporthe.。大麦植物的主要叶子感染了BSMV(BSMV-γMC新)或用一个沉默结构来反对CYP96B22(BSMV -γCYP)。有病毒症状的植株两周后在第三片叶片上接种Magnaporthe.分离分离的叶片测定中的CD180或TH6772。一)大量的记录CYP96B22利用分离株CD180,采用RT-qPCR对植株进行检测。显示的值是两个技术重复的平均值和标准偏差,并计算相对于内参基因EF1α(2(Ct (EF1α) - - - Ct (CYP96B22)))).为了进行显微分析,建立了两组植株,一组由接种BSMV-γMCS的5株植株组成新另一层围绕着五种植物,显示最高CYP96B22转录本减少(平均86%,根据配对t检验显著性)。在非宿主中进行了细胞学评估(B)和主机(C)相互作用分别为96和48小时。因此,每个感染部位被划分为不同种类的植物防御反应,这些反应与自动荧光物质的沉积有关(详情见[4])。对于两组植物,在5个叶片上分别评估了100个相互作用位点(显示了平均值和标准误差)。各组植物防御反应差异采用t检验(P < 0.05)。显著差异用不同的字母表示。此外,每一个被攻击的表皮细胞被调查是否有侵袭菌丝存在,频率以阴影条显示。为清晰起见,我们分别描述了表皮细胞与侵入菌丝的相互作用频率。用于非主机交互(B)结果在两个独立实验中复制。在一个生物学复制中证实了沉默植物中宿主分离物的肠胃分离物的较高侵袭性生长(C)。
对于显微评价,将植物分组(图4A,右图),因此一组由5株接种BSMV而不沉默构建体(BSMV-γMCS)的植株组成新)另一个包括那些显示最低的植物CYP96B22接种沉默载体BSMV (BSMV-γCYP)后的转录本丰度。与第一组相比,后一组的转录丰度降低了86%(图)4一个,右图)。从两组的每株植物筛查至少100种感染部位,并分配到反映典型的植物防御反应的类别(详见Zellerhoffet al。[4])。以上,记录攻击表皮细胞中的侵袭性菌丝的存在,用于每个感染部位。在与分离CD180的非和解相互作用中,在没有沉默的植物组中绝大多数攻击表皮细胞显示出与组成乳头形成细胞壁环保的映射下的自发荧光材料的局部积累(图4B).在这些细胞中从未观察到入侵菌丝表明有效的防御反应。沉默的CYP96B22导致了这类感染部位的显著减少。相反,在两个独立的重复实验中发现,表皮细胞被攻击的频率明显更高,表现出整个细胞壁的自身荧光。根据Zellerhoffet al。[4这种相互作用可以解释为植物穿透后的防御反应。这是通过时间过程实验得出的结论,作者表明,在成功穿透无效乳头后,侵入的菌丝Magnaporthe.非宿主菌株最终在表皮细胞中被捕获,显示出自身荧光细胞壁。其他两类植物感染位点的频率在两组植物之间没有显著差异(图)4b)。
在寄主情况下,不同种类植物的有效和无效频率之间没有显著差异CYP96B22沉默(图4C)然而,监测入侵的成功,CYP96B22-沉默导致在真菌成功穿透乳头的感染部位侵入菌丝的频率更高(图)4C,对图)。在生物复制中,我们观察到宿主相互作用CYP96B22-沉默也影响了真菌从表皮组织向叶肉组织的转变。这在显微镜下的侵染阶段得到了证实,在侵染阶段真菌已经在超过35%的被侵染的表皮细胞中建立了侵染菌丝,这与植物的叶肉组织严重萎缩有关CYP96B22- 与对照工厂相比(数据未显示)相比。叶肉组织的崩溃是先进的指示M. Oryzae.殖民(4].
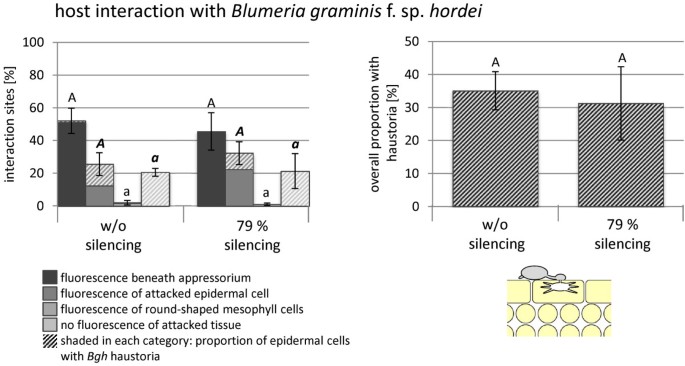
来研究是否CYP96B22- 对增强的渗透成功也适用于其他病原体,Vigs的实验是用大麦粉状霉菌的真菌进行Blumeria Graminis.f . sp。Hordei(BGH)。在这种情况下,为微观评估选择的植物组显示出79%的转录性丰富CYP96B22与没有沉默构建的BSMV接种的植物组(图5).然而,在不同类别的植物防御反应中没有观察到显着差异,也不是成功形成的Haustoria的频率。
的影响CYP96B22-沉默在大麦-BGH.相互作用。将植株接种BSMV,分成两组表达水平不同的植株CYP96B22如图所描述的那样完成4。在这种情况下,平均静音效率是79%。两个池塘的植物都接种了Blumeria Graminis.f . sp。hordei(BGH.)在分离的叶子测定中。根据与自发荧光材料沉积相关的防御反应,对感染部位进行分类。对于每种叶片100,在接种后,在接种后48小时评估感染部位,并提出了四片叶的平均值和标准误差。进一步研究了攻击的表皮细胞用于存在成熟的Haustoria(参见右下角的示意图),并且频率通过杆遮荫显示。如右上角的单独图所示,总结了用Haustoria发现的细胞。测试每种植物防御反应的植物防御反应对于使用T检验而无沉默的植物之间的显着差异(P <0.05),这显示出没有显着差异。它在一个独立的实验中得到了确认CYP96B22沉默对吸器的频率没有影响。
讨论
近年来,大型转录组分析已成为植物对非生物和生物应激的植物反应研究的常规分析,并且被认为是提高作物表现的途中的有希望的工具[26].在这里,我们报告大麦的细胞色素P450基因,其在基于大草原的研究中鉴定为差异调节的差异和宿主与真菌分离物相互作用Magnaporthe.物种复杂。我们提供的证据表明,该基因参与了作为对病原菌在叶表面外寄生生长的早期响应的穿透抗性的执行。
从2000年开始,位于Gatersleben的Leibniz植物遗传学和作物植物研究(IPK)在表达序列标签(ESTs)的基础上开发了一个宏阵列,并将其作为一种资源提供给大麦群落,以研究不同处理下的基因表达[27].利用该序列,我们鉴定了一组大麦基因,这些基因的转录本在接种a后积累到更高的剂量或更早的时间点Magnaporthe.与a相比Magnaporthe.宿主孤立[17].这些基因之间的突出成员是与大麦MLOC_15925 cDNA相同的EST克隆,其具有细胞色素P450酶的结构域特征(附加文件1:图S2)。植物p450参与初级和二级代谢过程,并催化不同的单加氧和羟基化反应[28].P450S以植物物种的宽分布特定的方式意味着它们受到高进化压力,导致多样化,最后是新的代谢途径和具有所获得的新生物功能的产品。在植物P450中搜索同源性,将MLOC_15925蛋白放入CYP96系列(指定为CYP96B22,图1),并提出一种酶的功能为中链烷烃羟化酶(MAH)。CYP96B22最接近的拟南芥同源物是CYP96A10 (At4g39490),它是一个单顺反子转录本的剪接变体,与CYP96A9形成二聚体[29,30.].有人认为疏水底物的修饰需要二聚作用[29].在拟南芥中CYP96A10成绩单比少于丰富CYP96A9成绩单(30.),占CYP96A10浓度作为一个速率限制因子至少在转录调控水平。假设大麦的情况类似,这可以解释为CYP96B22在大麦对Magnaporthe.nonhost隔离物。在这种情况下,转录的上调CYP96B22将导致具有对CYP96A9同源的推定大麦蛋白的异二聚体的形成,最后更加产生疏水产品。
到目前为止,唯一详细表征的唯一CYP96酶是拟南芥MAH1,其将二次醇和酮作为所属蜡层的构建块(附加文件1:图S1;[16,31])。这种最外面的表面层是植物病原体在感染期间必须应对的第一屏障[13].此外,角质层还可能是释放信号分子的水库,这些信号分子可能被被攻击的植物自身感知为损伤相关的分子模式(DAMP, [32])导致执行防御响应。或者,可通过病原体使用皮肤成分作为宿主识别因子,其示出为例如例如。在大麦 - 粉末状霉菌中对C26-醛的相互作用[33].表皮成分也可能在细菌致病性中起作用,例如拟南芥CYP86A2,诱导细菌III分泌系统所需的植物P450参与角质层开发[34].另一方面,真菌衍生角质酶活性释放的游离角质单体可能作为内源性DAMPs,诱导植物防御反应[35].在拟南芥中,主要的表皮蜡质成分是链长为C29的烷烃、仲醇和酮类,它们都是通过mah1依赖的途径合成的[36].然而,大麦角质层主要含有一种c26 -伯醇,即正六醇,其合成不需要MAH1酶转化[33].因此,可能大麦中mah1衍生的蜡成分作为结构屏障对病原体的攻击不那么重要,而是起到信号传导的作用。
我们讨论了…的生物学功能CYP96B22在使用BSMV作为工具敲除基因表达的瞬时试验中(图4).bsmv介导的VIGS对小麦和大麦功能基因组学的有用性已在最近的几篇论文中得到证实[37,38我们已经在大麦的研究中采用了这种方法Magnaporthe.相互作用(25].由于对小麦的研究表明,bsmv在接种前感染M. Oryzae.宿主分离物可能导致渗透减少[39,我们在所有的vigs实验中使用了接种BSMV的植物,而没有沉默结构作为内部控制(图)4).这样做,并将这些控制植物与那些显示出最高减少CYP96B22转录丰富度,乳头的频率显著下降,在试图渗透的部位Magnaporthe.观察到非质监分离液CD180(图4).由于后一种结果伴随着更多的表皮细胞显示在整个细胞壁上沉积了自体荧光物质,这表明乳头不能阻断无效Magnaporthe.渗透(11,23,40].在大麦与宿主的相互作用中,真菌侵入细胞壁的转变更加明显M. Oryzae.隔离TH6772哪里CYP96B22沉默导致被攻击表皮细胞中侵入性菌丝的增加。在拟南芥中也发现了类似的发现,即穿透防御能力下降,病原体进入表皮细胞的频率增加笔- 归零(审查见[41])。鉴于这种发现CYP96B22能算是大麦吗钢笔-基因。但是,既不是拟南芥笔- 我的实验也没有CYP96B22-VIGS,非宿主病原体能够产生孢子,表明有效的穿透后抗性机制。通过阻断EDS1-PAD4-SAG101信号复合物使这第二道防线失效,使得拟南芥对甚至非适应的病原体也完全敏感[42].在大麦中,自荧光物质的沉积似乎是这种相互作用的后备策略的细胞学标记Magnaporthe.。
非宿主抗性通常被认为是由几个数量性状位点决定的,所有这些位点必须共同作用,以防止潜在病原体的感染[43].只有对BSMv-Vigs经过的大麦植物进行微细胞变化的详细监测,使我们能够在渗透抗性上分配函数Magnaporthe.大麦基因的非宿主分离株CYP96B22。因此,建议避免在敲除或敲除候选基因表达后进行非宿主分析的宏观评估。自适应白粉病真菌在大麦植株上侵染的过程中CYP96B22表达没有改变(图5),我们可以排除这些植物中整个渗透性抗渗透性的可能性。找到CYP96B22可能在大麦白粉病和。Magnaporthe.相互作用并不令人吃惊,因为以前也曾对大麦进行过类似的观察枣疯病要么罗基因(10,44].这种基因调控的矛盾被解释为大麦对生物营养或半生物营养病原体的专门反应的一部分。有趣的是,CYP96B22在大麦中接种PUCCINIA TRITICINA和柄锈菌hordei[17].然而,该结果的功能验证,如BSMV-VIGS检测,尚未报道。
本研究的一个意外发现是对体外寄生生长的感知Magnaporthe.大麦植株叶片表面的芽管。使用M. Oryzae.突变体Δpmk1,我们无疑证实了渗透是没有必要触发的CYP96B22表达式(图3.).我们也展示了Magnaporthe.非主题隔离,没有Δpmk1突变体的存在,他们能够通过使用杀菌剂导致非功能性附着体,从而阻止渗透产生相同的表型(图)2和3.).其他研究也表明病原体和植物在渗透前会发生信号交换,但信号本身的化学性质一直没有被阐明[45- - - - - -47].最近,它显示为拟南芥的效果炭疽菌higginsianum在渗透前分泌[48].CYP96B22至MAH1酶的同源性及其在合成中蜡的合成的含义导致我们推测MAH1依赖性蜡质组分可能在粘液促进的孢子和生物管附件到叶片表面期间刻心。此后,它们被称为潮湿,并导致与渗透性抗性相关的防御反应增加,如例如,形成有效的乳头。在主机情况下,M. Oryzae.分离物可能会分泌效应分子来否定这些防御反应[49].
结论
本研究结果为大麦细胞色素P450基因的表达提供了功能证据CYP96B22在大麦对病原菌的非宿主反应中起着至关重要的作用Magnaporthe.物种复杂。根据头部爆炸在大麦和小麦栽培中成为一种更普遍的疾病,我们的研究可能提供进一步育种策略的有用信息。然而,需要更多的研究来确定推导的蛋白质是否能够强化对病原体攻击或产生信号分子的结构屏障。
方法
生物材料和接种
大麦芽Paul Schulze Lefert(Max-Planck植物育种研究所,科隆,德国),Rusty Niks(Wageningen大学,荷兰)和Patrick Schweizer(Ipk Gatersleben,德国)的兰德·普拉德和Morex提供品种。在24小时后,在湿滤纸上发芽后,将种质转移到标准土壤中(ED73型,Balster Einheitserdewerk GmbH,Froendenberg,德国)。用于分析表皮转录物,7×7×8cm3.塑料瓶中培养10个菌种,在光照16 h (200-250 μmol s)的培养室内培养-1米-2)和8小时黑色节奏,18°C和65%的相对湿度。对于Vigs实验,10×10×10厘米3.每盆4个菌种保存在生长箱中,26°C光照16 h, 23°C黑暗8 h。
的Magnaporthe.分离attates th6772,cd180和∆pmk1分别由Tamagawa大学(Machida-shi, Tokyo, Japan)、D. Tharreau (CIRAD Montpellier, France)和N. J. Talbot (University of Exeter, UK)生物化学研究所提供。转基因Magnaporthe.分离出含有DsRed (TH6772)或GFP (CD180)荧光蛋白的菌株农杆菌属使用标准协议如rho中所述的转换et al。[50)和塔克et al。[51].真菌培养在燕麦琼脂(20 g l-1琼脂,2 g l-1酵母提取物10 g l-1淀粉,30克-1燕麦片)在黑暗中在23°C。通过在22℃下在黑光下在16小时光/ 8小时暗状态下培养真菌培养物诱导孢子。对于孢子花液分离的CD180被转移到新的燕麦琼脂平板上并分离attate TH6772和∆pmk1突变体在水稻叶片琼脂(每升大米叶片水提液50 g, 2 g l)上培养-1Feex Medicinales [酵母提取物;Biolabor,Bremen,德国],10 G L.-1水溶性淀粉15克-1琼脂)。2周后用清水冲洗平板,用三层纱布过滤,收获分生孢子。接种时,分生孢子悬浮在2 g l的喷淋液中-1明胶,1 ml l-1Tween)的浓度为200,000分生孢子毫升-1并喷洒在大麦叶上。接种后的植株在24-26°C和100%相对湿度的黑暗中孵育24小时后,用塑料罩盖住,保持在上述生长条件下。
Blumeria Graminis.f . sp。hordei从德国科隆max - planck植物育种研究所获得的分离株K1在大麦cv上繁殖。英格丽在上述生长条件下。有白粉病脓疱的植株在收获接种物前一天摇除老分生孢子。在接种过程中,将新出的分生孢子吹过沉淀塔中的叶状物质。30分钟后,用标准的托马计数室(约为30分钟)监测接种密度。孢子10毫米-2),接种植株移入生长箱。
大麦表皮的取样和RNA提取
锯切后7天用模拟液或不同溶液接种VadaMagnaporthe.隔离。在接种前三天,用100ppm的Beam溶液(来自德国蒙海姆BayerCropScience公司)浸湿植株,使土壤体积饱和,对照组用等量的水处理植株。在接种后6、12、24和48小时,将至少20个初生叶片的下表皮剥皮,直接在液氮中冷冻。采用PeqGold RNApure (Peqlab, Erlangen, Germany)提取RNA。
转录本丰度测定
为了去除基因组DNA,用DNase I处理1 μg RNA,用引物HindAnchorT逆转录为cDNA(附加文件)2表S1)使用RevertAid逆转录酶。用RNase A和RNase H酶切bsmv感染植物的cDNA,去除病毒RNA,然后用Gene Jet纯化试剂盒(试剂盒和酶购自德国Schwerte的Thermo Fisher Scientific Bioscience GmbH)。采用SYBR Green qPCR SuperMix-UDG与ROX (Invitrogen公司,美国卡尔斯bad公司)和基因特异性引物进行反转录定量PCR (RT-qPCR)(附加文件)2:表S1)。CYP96B22- ,PR1B.- 和泛素-特异性引物序列用Primer3Plus设计[52];引物序列EF1α和GAPDH来自McGrannet al。[53].通过测序所得的RT-QPCR产品来证实各基因的所有引物的特异性。RT-QPCR在ABI棱镜7300序列检测系统(应用生物系统,Life Technologies,Darmstadt,德国)进行。在50℃下活化循环后2分钟。在95℃下10分钟,将样品暴露于95℃和1分钟的40个15℃。在60°C时。然后,对每个样品进行熔融曲线分析。为了分析相对转录物丰度,仅评估具有靶序列特异性熔点的CT值。吉达和施密格的说法54计算靶基因相对于内参基因的转录本积累量(2(Ct(参考)- Ct(目标))).对于这项研究大麦EF1α选择作为参考基因,因为它显示与其他测试的参考基因相比最稳定的表达(泛素,Gapdh.和EF1α).
微观研究
为了进行植物与病原体互作的细胞学分析,收集大麦叶片并在14%乙酸乙醇(v/v)中染色。为了研究真菌的早期发育阶段,接种后的叶片放置在Whatman纸上,用25%乙酸乙醇(v/v)浸泡,直到漂白。这种方法首先由Carver和Ingerson-Morris描述[55]并防止在染色程序期间去除真菌感染结构。通过BrightField和荧光显微镜(DMBRE,Leica Microsystems,Wetzlar,Germany)分析漂白叶片在水中分析了水。结构的结构BGH.在显微镜之前,在叶片表面染色10%乙酸(v / v)染色。每叶评估至少100个单独的感染网站(图2c)如Zellerhoff中所述et al。[4].与气孔或维管束接触的相互作用位点不在评价范围内。
数据库分析
HO07G08基因序列取自IPK作物EST数据库(http://pgrc.ipk-gatersleben.de/cr-est/),用于BLASTN查询国际大麦测序联盟公布的转录本序列[18].使用InterProScan进行保守域搜索[56]及NCBI [57].从细胞色素P450主页获得水稻中鉴定的CYPs的蛋白质序列[19].在系统发育平台上对CYP96B22和选择的水稻序列进行系统发育分析[58,并与MUSCLE (v3.7,默认设置)组成序列对齐。利用PhyML程序(v3.0 aLRT)中实现的最大似然法重建系统发生树。选择WAG替代模型时,假设不变位点的估计比例(为0.015)和4个伽马分布的速率类别,以解释不同位点的速率异质性。gamma形状参数直接从数据估计(gamma = 2.977)。采用aLRT试验(SH-Like)评估内部分支的可靠性。用TreeDyn (v198.3)对系统发生树进行图形表示和编辑。
大麦条纹花叶病毒-病毒诱导基因沉默(VIGS)
用于VIGS研究的DNA质粒携带BSMV分离ND18成分的全长克隆(pT7-BSMV-α, pT7-BSMV-βΔCP, pT7-BSMV-γMCS和pT7-BSMV-γHvPDS400)由Merete Albrechtsen (University of Aarhus, Frederiksberg, Denmark)提供。pT7-BSMV-γMCS通过插入一个更大的多个克隆位点(MCSnew,附加文件)进行修饰2:表S1)进入BamH我限制的网站。一个234 bp的基因片段CYP96B22是用附加文件中给出的引物序列扩增的吗2:表S1并以反义方向插入生态ri和美国心理学协会I限制性pT7-BSMV-γMCSnew位点形成pT7-BSMV-γCYP。利用si-Fi软件(3.1版,http://labtools.ipk-gatersleben.de/).质粒线性化并作为模板在体外如所述的转录[59].将病毒RNA亚基(α、β和γ)均匀混合,组装成感染病毒。加入4个体积的FES缓冲液(0.1 M甘氨酸,0.06 M K2HPO4, 1%的绒毛4(w / v),2%膨润土(w / v),1%硅藻土(w / v);PH 8.5-9.0),病毒被接种到五天的大麦CV的初级叶片上。MoreX(25μl足以接种3-4株植物),随后用水洗涤。接种植物的第三片植物的两周显示病毒症状被置于Kinetin琼脂(1 mg L.-1),并接种分离株Magnaporthe.要么Blumeria Graminis.f . sp。hordei,分别。通过采集一部分接种过的叶片,将其冷冻在液氮中,来监测每一株植物的沉默效率(见附加文件)1:图S5)。根据voegele分离RNAet al。[60].因此,该材料在砂浆中研磨,悬浮在600 μl细胞裂解缓冲液(20 g l-1SDS超纯,68 mM柠檬酸钠,132 mM柠檬酸,10 mM EDTA, pH 3.5)。蛋白和DNA在200 μl沉淀缓冲液(4 M氯化钠,17 mM柠檬酸钠,33 mM柠檬酸,pH 3.5)中沉淀5分钟后,用异丙醇从上清液中沉淀RNA, 70%乙醇洗涤,双蒸馏水溶解。RT-qPCR检测转录本丰度。
缩写
- BSMV:
-
大麦条纹花叶病毒
- 伟大的人:
-
病毒诱导基因沉默
- CYP:
-
细胞色素p 450酶
- siRNA:
-
小干扰RNA
- 绿色荧光蛋白:
-
绿色荧光蛋白
- DSRED:
-
轻体状红色荧光蛋白
- RT-QPCR:
-
逆转录定量PCR
- BGH:
-
Blumeria Graminis.f . sp。hordei。
参考
- 1.
Faivre-Rampant O, Thomas J, Allegre M, Morel JB, Tharreau D, Notteghem JL, Lebrun MH, Schaffrath U, Piffanelli P:模型系统稻米-Magnaporthe.谷物中抗性的研究。新植物。2008,180(4):899-910。10.1111 / J.1469-8137.2008.02621.x。
- 2.
Lima Mipm,Minella E:大麦头发的发生。Fitopatologia brasileira。2003,28(2):207-10.1590 / S0100-41582003000200020。
- 3.
urashima as,lowent na,goulart acp,metha yr:小麦品种的阻力谱和毒力多样性Magnaporthe Grisea.在巴西的分离物。Fitopatologia brasileira。2004,29:511-518。10.1590 / s0100-4158200400050000007
- 4.
Zellerhoff N, Jarosch B, Groenewald JZ, Crous PW, Schaffrath U:成功地表现出了大麦的非寄主抗性Magnaporthe Grisea.与之密切相关的狼尾草-感染血统,但被克服Magnaporthe oryzae。植物营养与肥料学报,2006,19(9):1014-1022。10.1094 / mpmi - 19 - 1014。
- 5.
非寄主抗性:我们知道多少?植物科学进展,2004,9(2):97-104。10.1016 / j.tplants.2003.12.005。
- 6.
在压力下:研究植物侵染生物学Magnaporthe oryzae。NAT Rev Micro。2009,7(3):185-195。10.1038 / nrmicro2032。
- 7.
ebbole dj:Magnaporthe.作为理解宿主-病原体相互作用的模型。植物病理学杂志。2007,45:437-456。10.1146 / annurev.phyto.45.062806.094346。
- 8.
Galhano R,Talbot NJ:Blast的生物学:了解如何Magnaporthe oryzae入侵水稻植物。真菌BIOL REV.2011,25(1):61-67。10.1016 / J.FBR.2011.01.006。
- 9.
Rizot C,Hirsch J,Balzergue S,Tharrau D,NottéghemJ-L,勒布伦M-H,莫雷尔J-B:大米对爆炸真菌,Magnaporthe Grisea的易感性。J植物理性。2008,165(1):114-124。10.1016 / j.jplph.2007.06.013。
- 10。
Jarosch B, Kogel KH, Schaffrath U:大麦的矛盾心理枣疯病基因座:具有白粉病抗性的突变(Blumeria Graminis.f . sp。hordei)增强对稻瘟病菌的敏感性Magnaporthe Grisea.。植物营养与肥料学报,1999,12(6):508-514。10.1094 / MPMI.1999.12.6.508。
- 11.
Jarosch B, Collins NC, Zellerhoff N, Schaffrath U:RAR1.,ROR1,而肌动蛋白细胞骨架则参与了对Magnaporthe Grisea.在大麦。植物营养与肥料学报,2005,18(5):397-404。10.1094 / mpmi - 18 - 0397。
- 12.
麦类病原菌对新mrna的早期诱导与抗性反应,白粉菌属茎f.sp。Tritici.。植物营养与肥料学报,2000,19(3):481 -481。10.1016 / 0885 - 5765 (90) 90020 - x。
- 13.
Raffaele S,Leger A,Roby D:非常长的链脂肪酸和植物对病原体的反应中的脂质信号传导。植物信号表现。2009,4(2):94-99。10.4161 / psb.4.2.7580。
- 14.
Buschhaus C, Jetter R:表皮和表皮内蜡质亚结构的组成差异:植物是如何封闭表皮表面的?中国生物医学工程学报。2011,32(3):841-853。10.1093 / jxb / erq366。
- 15.
Pascal S, Bernard A, Sorel M, Pervent M, Vile D, Haslam RP, Napier JA, Lessire R, Domergue F, Joubès J: The拟南芥cer26突变体,如cer2突变体,特别在很长链脂肪酸伸长过程中受到影响。植物学报,2013,73(5):733-746。10.1111 / tpj.12060。
- 16.
细胞色素P450酶CYP96A15是茎表皮蜡中生成仲醇和酮的中链烷烃羟化酶拟南芥。植物生理学报。2007,45(3):653-667。10.1104 / pp.107.107300。
- 17.
关键词:大麦,非寄主抗性,病原真菌,转录反应植物营养与肥料学报。2010,29(4):453 - 457。10.1104 / pp.109.151829。
- 18.
Mayer KFX, Waugh R, Brown JWS, Schulman A, Langridge P, Platzer M, Fincher GB, Muehlbauer GJ, Sato K, Close TJ,等:大麦基因组物理、遗传和功能序列组装。自然科学进展。2012,421(4):421 - 427。
- 19.
Nelson D:细胞色素P450主页。基因组学。2009,4(1):59-65。
- 20.
Bak S, Beisson F, Bishop G, Hamberger B, Höfer R, Paquette S, Werck-Reichhart D:细胞色素P450。《拟南芥丛书》,2011,美国植物生物学学会,e0144-DOI:http://dx.doi.org/10.1199/tab.0144.网址:http://www.bioone.org/doi/full/10.1199/tab.0144.
- 21.
惠勒MH:黑色素的生物合成黄萎病dahliae:无脱水和无细胞匀浆中的还原反应。Exp Mycol。1982,6(2):171-179。10.1016 / 0147-5975(82)90091-3。
- 22.
mapk和cAMP信号通路调控稻瘟病菌侵染结构的形成和病原菌的生长Magnaporthe Grisea.。基因工程学报,1996,10:2696-2706。10.1101 / gad.10.21.2696。
- 23.
Jansen M, Schaffrath U:获得性抗性函数枣疯病大麦,这是非常敏感的Magnaporthe Grisea.。植物营养与肥料学报,2003,16(2):107-114。10.1094 / MPMI.2003.16.2.107。
- 24.
Holzberg S, Brosio P, Gross C, Pogue GP:大麦条纹花叶病毒-诱导的单子叶植物的基因沉默。植物学报,2002,30(3):315-327。10.1046 / j.1365 - 313 x.2002.01291.x。
- 25.
大麦条纹花叶病毒诱导的基因沉默(BSMV-IGS)是一种用于分析大麦非寄主抗性基因的工具。植物信号学报,2011,6(6):867-869。10.4161 / psb.6.6.15240。
- 26.
转录组分析与作物改良(综述)。中国生物医学工程学报,2001,34:153-164。
- 27.
张H,Sreenivasulu N,Weschke W,Stein N,Rudd S,Radchuk V,Potokina E,Scholz U,Schweizer P,Zierold U等:基于表达的序列标签的大麦转录组大规模分析。工厂J. 2004,40(2):276-290。10.1111 / J.1365-313x.2004.02209.x。
- 28.
李志强,王志强,王志强,等。陆地植物P450基因的进化过程。植物营养与肥料学报,2010,31(1):1- 8。10.1146 / annurev - arplant - 042809 - 112305。
- 29.
张晓梅,段海峰,张晓梅,李晓峰:拟南芥细胞色素p450透过镜子:植物生物化学的窗口。植物营养与肥料学报,2006,20(3):427 - 434。
- 30。
刘丽萍,刘丽萍,马晓燕:双反子转录本和融合的单反子转录本来自于邻近的基因座拟南芥基因组。RNA。2005,11(2): 128-138。10.1261 / rna.7114505。
- 31。
Nelson D, Werck-Reichhart D: p450中心的植物进化观点。植物学报,2011,66(1):194-211。10.1111 / j.1365 - 313 x.2011.04529.x。
- 32。
激发子的复兴:模式识别受体对微生物相关分子模式和危险信号的感知。植物营养与肥料学报。2009,30(1):1 -4。10.1146 / annurev.arplant.57.032905.105346。
- 33。
Hansjakob A,Bischof S,Grandmann G,Riederer M,Hildebrandt U:非常长链醛促进在体外prepenetration过程Blumeria Graminis.以剂量和链长相关的方式。植物生态学报,2010,33(4):549 - 554。10.1111 / j.1469-8137.2010.03419.x。
- 34。
Xiao F, Mark Goodwin S, Xiao Y, Sun Z, Baker D, Tang X, Jenks MA, Zhou jim:拟南芥CYP86A2压制两III型基因,是角质层发育所必需的。机械工程学报,2004,23(14):2903-2913。10.1038 / sj.emboj.7600290。
- 35.
陈志强,陈志强,陈志强,等:植物细胞对游离角质蛋白单体的感知。植物学报,1996,10(2):331-341。10.1046 / j.1365 - 313 x.1996.10020331.x。
- 36.
陈志强,陈志强,陈志强,等。不同生态型植物表皮蜡质变异的研究进展拟南芥蒂利亚纳。植物化学。1997,45(2):251-255。10.1016 / s0031 - 9422(96) 00792 - 3。
- 37.
Cakir C, Gillespie ME, Scofield SR:利用病毒诱导的基因沉默快速测定小麦和大麦的基因功能。作物科学,2010,50(增刊1):S-77-S-84。
- 38.
Lee W-S,Hammond-Kosack Ke,Kanyuka K:大麦条纹花叶病毒介导的工具,用于研究谷物植物的基因功能及其病原体:病毒诱导的基因沉默,宿主介导的基因沉默和异源蛋白的病毒介导的过度表达。植物理性。2012,160(2):582-590。10.1104 / pp.112.203489。
- 39.
Tufan HA, Stefanato FL, McGrann GRD, MacCormack R, Boyd LA: The大麦条纹花叶病毒在谷物中使用的病毒诱导基因沉默系统不同程度地影响小麦对真菌病原体的敏感性。植物营养与肥料学报,2011,27(9):927 - 934。10.1016 / j.jplph.2010.11.019。
- 40.
Zellerhoff N, Jansen M, Schaffrath U:大麦ROM1.拮抗Rar1函数Magnaporthe oryzae通过增强表皮和减少叶肉防御。植物生态学报,2008,29(3):489 - 498。10.1111 / j.1469-8137.2008.02597.x。
- 41.
Lipka U,Fuchs R,Lipka V:拟南芥对白粉病的非宿主抗性。植物生态学报。2008,11(4):404-411。10.1016 / j.pbi.2008.04.004。
- 42.
Lipka V, Dittgen J, Bednarek P, Bhat R, Wiermer M, Stein M, Landtag J, Brandt W, Rosahl S, Scheel D,等:入侵前和入侵后的防御都有助于非宿主抗性拟南芥。中国科学(d辑):地球科学(d辑)。10.1126 / science.1119409。
- 43.
非宿主和基础抗性:如何解释特异性?acta botanica sinica(云南植物学报),2009,34(4):417 - 428。10.1111 / j.1469-8137.2009.02849.x。
- 44.
Pathuri IP, Zellerhoff N, Schaffrath U, Hensel G, Kumlehn J, Kogel KH, Eichmann R, Huckelhoven R:组成型激活大麦ROPs调节表皮细胞大小,防御反应和与真菌叶片病原体的相互作用。植物学报,2008,27(12):1877-1887。10.1007 / s00299 - 008 - 0607 - 9。
- 45.
Koh S, André A, Edwards H, Ehrhardt D, Somerville S:拟南芥蒂利亚纳亚细胞对相容的反应白粉菌属cichoracearum感染。工厂J. 2005,44(3):516-529。10.1111 / J.1365-313x.2005.02545.x。
- 46.
陈晓东,陈晓东,陈晓东,陈晓东。茎锈病孢子诱导RPG1快速磷酸化的研究进展。植物营养与肥料学报。2010,23(12):1635-1642。10.1094 / mpmi - 06 - 10 - 0136。
- 47.
Campos-Soriano L,Valèg,Lupotto E,San Segundo B:使用A的易感和耐水稻品种稻瘟病的调查绿色荧光蛋白表达Magnaporthe oryzae隔离。植物学报。2013,62(5):1030-1037。10.1111 / ppa.12023。
- 48.
Kleemann J, Rincon-Rivera LJ, Takahara H, Neumann U, van Themaat EVL, van der Does HC, Hacquard S, Stüber K, Will I, Schmalenbach W,等:寄主诱导的毒力效应物通过附着菌和细胞内菌丝连续传递炭疽菌higginsianum。PLOS PARCOG。2012,8(4):E1002643-10.1371 / journal.ppat.1002643。
- 49.
价B:作用中的丝状植物病原效应器。微信学报。2013,11(11):800-814。10.1038 / nrmicro3119。
- 50。
rho hs,kang s,lee yh:根癌土壤杆菌-介导的植物病原真菌稻瘟病菌的转化。中国生物医学工程学报。2001,12(3):407-411。
- 51。
Tucker SL,Orbach MJ:农杆菌介导的Magnaporthe Grisea中的Creactean插入图书馆的转化。在植物病原体相互作用中。第354版。由Ronald P.Manaa Press编辑;2007年:57-68。
- 52。
JAM: Primer3Plus,一个增强的Primer3 web界面。核酸学报2007,35(增刊2):W71-W74。
- 53。
McGrann Gd,Townsend B,Antoniw J,Asher MC,Mutasa-GöttgensE:大麦在主机和非主机交互期间引发了类似的早期基础防御响应Polymyxa根寄生虫。EUR J植物途径。2009,123(1):5-15。10.1007 / s10658-008-9332-z。
- 54。
利用实时荧光定量PCR技术对相关基因表达数据进行分析-它δC方法。方法。2001,25(4):402-408。10.1006 / meth.2001.1262。
- 55。
Carver TLW,Ingerson-Morris SM:接种密度对萌发发育的影响白粉菌属茎f . sp。avenae燕麦细胞对贴壁渗透的诱导抗性。陈志强,陈志强,陈志强,等。10.1016 / s0953 - 7562(89) 80090 - 5。
- 56。
Apweiler R: InterProScan - InterPro签名识别方法的集成平台。生物信息学。2001,17(9):847-848。10.1093 /生物信息学/ 17.9.847。
- 57。
Marchler-Bauer A, Anderson JB, dewees - scott C, Fedorova ND, Geer LY, He S, Hurwitz DI, Jackson JD, Jacobs AR, Lanczycki CJ等:CDD:一个保守域对准的curated Entrez数据库。核酸学报2003,31(1):383-387。10.1093 / nar / gkg087。
- 58。
Dereeper A, Guignon V, Blanc G, Audic S, Buffet S, Chevenet F, Dufayard J-F, Guindon S, Lefort V, Lescot M, et al:系统发育学。fr:非专家的健壮系统发育分析。核酸学报2008,36(增刊2):W465-W469。
- 59.
brun- rasmussen M, Madsen CT, jessis, Albrechtsen M:稳定性大麦条纹花叶病毒- 诱导大麦的基因沉默。Mol植物微生物相互作用。2007,20(11):1323-1331。10.1094 / mpmi-20-11-1323。
- 60.
Voegele RT, Schmid A: RT实时pcr定量植物中的蚕豆尿菌。微生物学通报。2011,2:131-137。
- 61.
Samuels L, Kunst L, Jetter R:封闭植物表面:表皮细胞形成的角质层蜡。植物营养与肥料学报。2008,32(1):1 - 8。10.1146 / annurev.arplant.59.103006.093219。
确认
作者要感谢Verena Knorst在BSMV-γ亚基中产生了一个新的多克隆位点,并感谢Denise Weidenbach创造了DsRed和GFP标记Magnaporthe.分别为宿主和非宿主分离株。这些贡献是在亚琛工业大学的学士/文凭论文框架内完成的。作者感谢尼古拉斯·塔尔博特分享了m . oryzae∆pmk1在基因表达研究和富有成果的讨论中寻求帮助。研发由DFG在ERA-PG项目“TritNONHOST”框架下资助。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
RD进行了大部分实验工作,参与了研究的设计并起草了手稿。NZ建立了BSMV-Vigs并建议遵循CYP96B22作为非宿主抗性的候选基因。CF生成BSMV-CYP沉默构建物,并作为RS参与VIGS实验的生物复制。美国构思了这项研究,参与了实验的设计和协调,起草并定稿。所有作者都认可了最终的手稿。
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上不受限制地使用、分发和复制,但须注明原作的出处。创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Delventhal R., Falter C., Strugala R.et al。Ectoparasitic增长Magnaporthe.在大麦上触发假定大麦蜡生物合成基因的表达CYP96B22这与渗透阻力有关。BMC植物杂志14日,26日(2014年)。https://doi.org/10.1186/1471-2229-14-26
已收到:
接受:
发表:
关键字
- Nonhost阻力
- Magnaporthe oryzae
- 爆炸头
- 细胞色素p450.
- 蜡
- 表皮
- 渗透
- BSMV-VIGS