摘要
背景
细胞分裂素控制着许多植物的发育过程,包括分生组织的形成和活性,营养物质的分布,衰老时间和对非生物和生物环境的响应。细胞分裂素信号导致b型反应调控因子(RRBs)的激活,这是一种myb样转录因子,可被其反应受体域中保守的天冬氨酸残基磷酸化激活。与此相一致的是,RRBs的过表达不会显著改变植物的发育,而是导致细胞分裂素过敏。
结果
在这里,我们对过表达拟南芥RRB 1 (ARR1)或磷酸化ARR1的植物进行了比较分析D94E在突变体中,保守的天冬氨酸-94 (D94)被磷酸残基谷氨酸(E)取代。D94E的取代导致反应激活增加100倍,并引发发育和生理变化,这些变化体现了用细胞分裂素处理过的野生型植物或细胞分裂素含量增加的转基因植物的特征。
结论
目前的细胞分裂素信号传递模型强调RRBs的保守天冬氨酸残基磷酸化在促进细胞分裂素反应中的重要作用。我们对ARR1和ARR1发育和生理特性的比较分析D94E过表达的植物显示ARR1D94E蛋白质的确是一种组成性的广谱细胞分裂素反应激活剂。
背景
细胞分裂素是一类在植物发育和植物对环境的反应中发挥重要作用的激素[1- - - - - -5].细胞分裂素反应途径类似于酵母和细菌的双组分信号机制[6].拟南芥中核心的细胞分裂素信号通路涉及四种成分的作用:组氨酸激酶(CHKs)、组氨酸磷转移蛋白(HPTs)和两种拮抗作用的反应调控因子(RRs),它们控制该通路的基因表达输出[6- - - - - -10].信号级联始于细胞分裂素与CHK受体结合,导致其在保守组氨酸处的自磷酸化[6,11- - - - - -14].然后将磷酸基转移到受体受体结构域的保守天门冬氨酸残基上,然后从受体结构域转移到HPT中的组氨酸残基上[6,15- - - - - -17].磷酸化的HPT将磷酸盐传递到b型RR (RRB)受体结构域的天冬氨酸残基上。RRBs的磷酸化被认为可以激活它们,并通过上调细胞分裂素反应基因的表达来促进细胞分裂素的作用[6,18,19].一类被激活的RRBs的转录靶标是a型RR(基本)基因[20.- - - - - -23].RRAs也被HPTs磷酸化,这增加了它们的活性,至少对某些成员来说,降低了它们的降解率[24].由于RRAs作为细胞分裂素反应抑制剂,其细胞分裂素诱导的转录结合细胞分裂素依赖的激活和稳定导致细胞分裂素作用的抑制,从而限制了细胞分裂素反应的强度和持续时间[20.,25,26].
除了核心信号元件外,拟南芥中的细胞分裂素反应途径还涉及其他正、负调控因子。例如,拟南芥HPT6 (AHP6)在序列上与其他HPTs相似,但缺乏磷酸中继所需的保守组氨酸。因此,AHP6作为细胞分裂素反应的抑制剂,可能是通过与CHKs、RRBs或两者结合引起竞争性抑制[27].另一个例子是AXR1(生长素抗性1),它是蛋白质修饰相关泛素(RUB)通路中的关键酶,通过抑制RRA成员ARR5的积累来促进细胞分裂素反应[28].GeBP (GL1增强子结合蛋白)和GeBP样蛋白是亮氨酸拉链转录因子,通过限制细胞分裂素的诱导来促进细胞分裂素反应基本基因(29].细胞分裂素响应因子(CRFs)属于转录因子中的APETALA2/乙烯响应因子类,在控制细胞分裂素响应基因方面与RRBs平行起作用[30.].
由于编码所有四个核心信号成分的多基因家族的存在,细胞分裂素信号通路的复杂性进一步增加[15,21,31- - - - - -34].尽管目前的数据显示,这些基因家族中的功能冗余相当广泛,但也有令人信服的证据表明,在某种程度上功能多样化[18,19,23,35,36].迄今为止,已经描述了两种类型的职能多样化。首先,在所有四个基因家族中,成员在组织特异性和信号特异性以及相对丰度方面都有差异转录[37- - - - - -40].第二,尽管每个家族中的蛋白质具有高度的同一性,但它们的分化区域具有足够的多样性,可以提供特定的配体结合亲和力或参与不同的细胞反应[40- - - - - -43].
拟南芥RRB家族包含11个成员,属于三个系统发育组[19].所有的RRBs都有一个n端受体结构域,其中包括一个磷酸中继所需的保守的天冬氨酸,一个位于中心位置的myb样DNA结合结构域,以及一个位于c端的可变结构域,该结构域被认为负责该家族的功能专门化[33,41,43].单次、双次和更高阶突变体的功能缺失研究不仅揭示了高水平的功能冗余,而且还揭示了Arr1, ar10, ar11而且ARR12控制大部分细胞分裂素反应[23,35,44,45].其他RRBs被认为控制特定组织或特定发育阶段的细胞分裂素反应。例如,加勒比海盗2主要在花粉中表达[46].
RRBs的过表达导致细胞分裂素过敏,但导致植物发育的微小变化[6,18,47].基于与细菌双组分系统的类比,这些观察结果导致了RRBs以非活性形式表达的假设,细胞分裂素通过保守的天冬氨酸残基的磷酸化促进RRBs的激活。事实上,表达野生型ARR2和ARR2的原生质体的比较分析D80N磷酸化缺失突变体显示细胞分裂素依赖性诱导基本基因ARR6表达ARR2D80N在ARR2中检测不到与其磷酸化相一致的ARR2蛋白的凝胶迁移转移D80N表达原生质体[42].对细菌、酵母和植物中双组分信号系统的研究表明,如果保守的天门冬氨酸突变为磷酸残基谷氨酸,则可以使一个响应调控因子具有组成性活性[42,48- - - - - -51].的确,当一个35 s: ARR2D80E转基因基因在拟南芥中表达,植株矮化基本基因的组成性上调[51].一项关于ARR18家族成员的研究也描述了保守的天冬氨酸在RRBs激活中的关键作用[52].磷化取代ARR18D70E也引起了与初级细胞分裂素反应基因的转录诱导相关的构成性细胞分裂素反应。磷酸化的ARR18或ARR2突变对细胞分裂素调节的发育和生理过程的影响未被分析[51,52].
因此,目前的数据提供的信息很少,关于过表达活性的磷酸化RRBs对完整植物的影响,我们仍然缺乏最终的证据,证明磷酸化RRBs足以促进细胞分裂素反应的所有发育和生理过程。为了解决这一问题,我们在拟南芥主要RRBs之一ARR1中引入磷酸化氨基酸取代D94E,并在ARR1中异位表达该突变蛋白arr1-1突变体植物。我们发现了表达ARR1的拟南芥幼苗D94E,但不是未经修饰的ARR1,类似于细胞分裂素处理的野生型植物在转基因剂量依赖的方式。此外,我们的分析显示,所有测试的细胞分裂素反应都是组成性上调35 s: ARR1D94E植物。总之,我们的结果表明ARR1D94E蛋白质是一种广谱细胞分裂素反应激活剂。
结果与讨论
磷酸化的D94E取代促进ARR1活性增加100倍
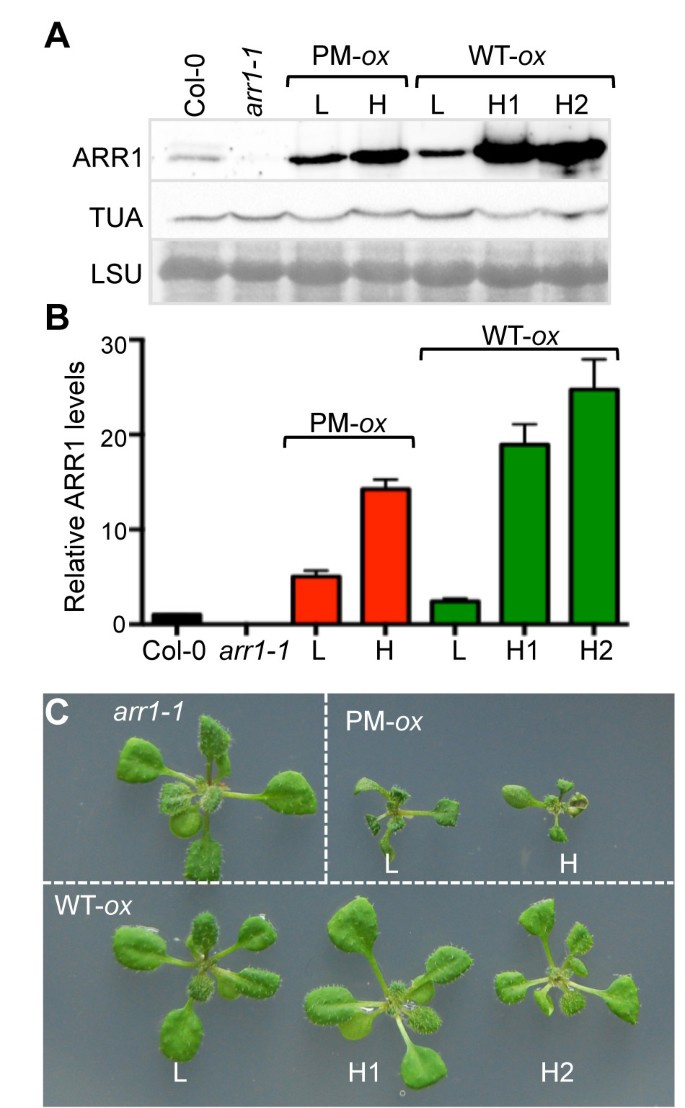
为了比较不同版本的ARR1在没有细胞分裂素处理的情况下促进细胞分裂素反应的能力,我们生成了表达野生型ARR1和磷化ARR1的植物D94E在arr1-1背景(图1).根据转基因株系的免疫印迹筛选结果,我们选择了两个35 s: ARR1D94E和三个35 s: ARR1用于进一步分析的行。与同年龄的col0植株相比,这两个磷酸化系的ARR1含量分别多出~5±1和~14±2,在这里称为低(L)和高(H)表达子(图)1A, B)。表达野生型ARR1的3条株系比Col-0多约2.5±0.5、18±4和24±4,分别称为低表达(L)和高表达(H1和H2)株系(图)1A, B)。尽管在H系中磷酸化ARR1和野生型ARR1表达水平相似,但只有表达磷酸化ARR1的转基因植物莲座小于Col-0和arr1-1(图1C).莲座丛大小减小是与外源性细胞分裂素处理和细胞分裂素生产过剩相关的特征性发育表型之一[18,53].
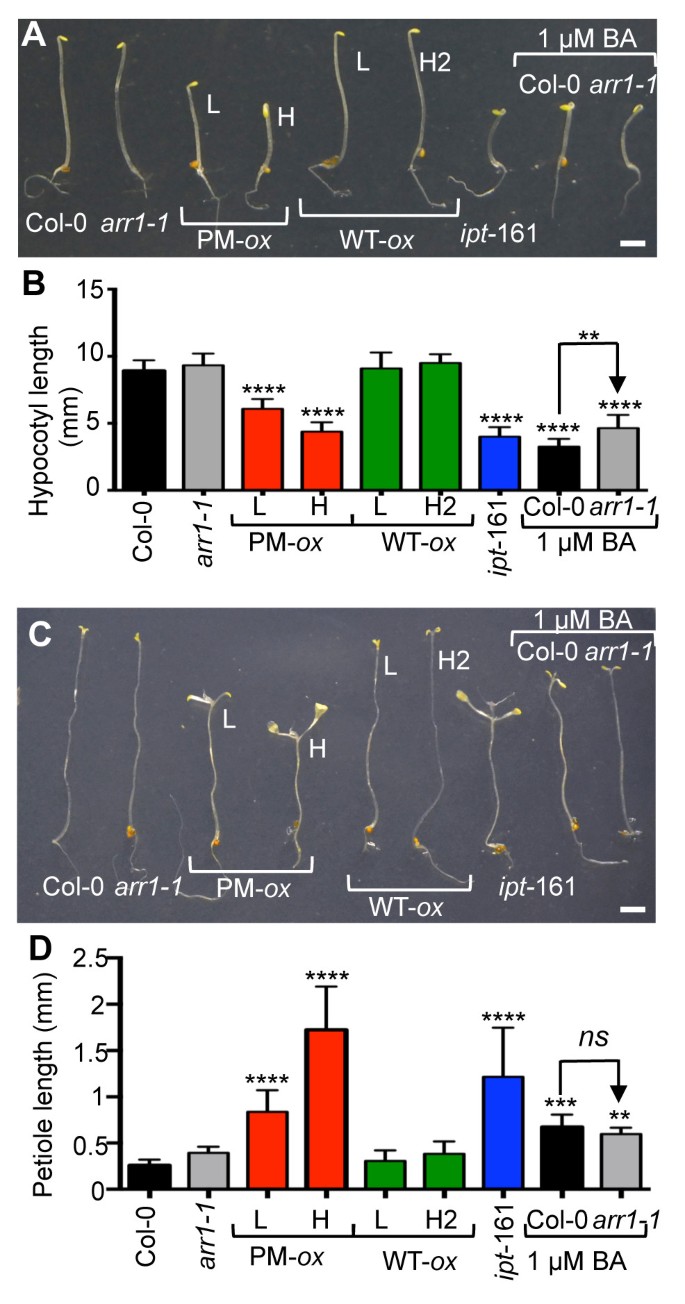
ARR1在磷化细胞中的表达水平分析35 s: ARR1D94E(PM牛),35 s: ARR1 (WT -牛)系和矮化表型的特征35 s: ARR1D94E植物。(一)col0野生型的ARR1水平arr1-1突变体和过表达线在arr1-1背景用抗arr1抗体测定。抗α-微管蛋白(TUA)抗体免疫印迹分析和大RuBisCO亚基(LSU)周围的Ponceau s染色膜区域图像显示为对照。L低和H高表达水平。(B)ARR1表达水平的量化。化学发光ARR1信号归一化为TUA,结果表示为与Col-0相比增加了一倍,Col-0被赋值为1。数据以两个独立实验的平均值±SEM表示。(C)在MS/2培养基上生长的代表性两周龄植株的莲座。
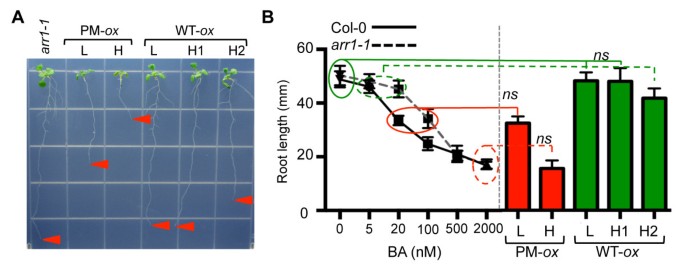
抑制根系生长是对细胞分裂素最敏感的生物反应之一[4,54].与转基因对莲座丛大小的影响一致的是,表达ARR1的植株的根比表达ARR1的植株的根短arr1-1植物(图2A).我们还观察到含磷ARR1转基因的剂量依赖性效应:L系的根比H幼苗的根长约2倍。表达野生型ARR1的植物根长只在最强表达系(即H2)中受到影响,且与表达磷化ARR1的株系相比,影响程度较小(图2一个)。
ARR1过表达系细胞分裂素反应强度的定量分析。(一)代表ten-day-oldarr1-1 35 s: ARR1(WT -牛)一个nd35 s: ARR1D94E(PM牛)在MS/2培养基上生长。箭头指向根尖。(B)根系伸长生长的量化。将在MS/2板上生长的转基因幼苗移栽到新鲜MS/2板上。平行的,三天前的col0和arr1-1幼苗转移到含有指示浓度BA的MS/2平板上。每根幼苗在移栽时(初始长度)和在试验培养基上生长7天后(最终长度)进行标记。每一行30株幼苗的根伸长(最终根长和初始根长之差)表示为Col-0和arr1-1以bar(平均值±SD)表示转基因系。结果采用单因素方差分析(ANOVA)和Tukey多重比较检验进行分析。col0和arr1-1根长不显著(ns)与根长不同的转基因株系被包围。
接下来,我们通过比较转基因根长与野生型和磷化ARR1的根长,估计了野生型和磷化ARR1异位表达引起的细胞分裂素效应的强度arr1-1植株生长在MS/2培养基上,添加了一系列的苄拉登碱(BA)剂量(图1)2B)。35 s: ARR1D94EL系和H系分别与20 nM BA和0.5 ~ 2 μM BA处理的野生型幼苗相似,表现出细胞分裂素响应的本构表型2B).与观察到的细胞分裂素敏感性降低一致arr1-1突变体(18结果表明,BA浓度对根系生长的抑制作用较高(100 nM vs 20 nM)arr1-1和col0分别;数字2B).对表达野生型ARR1的株系的分析表明,只有最高表达的H2具有弱的细胞分裂素响应表型,与生长在5 nM和野生型植株相似arr1-1植株生长在20 nM BA上(图1B).获得ARR1和ARR1之间响应激活差异的估计值D94E我们比较了BA剂量对H磷酸化ARR1和H2野生型ARR1根长度的表型复制。因为野生型表达株H2中的ARR1水平高于磷酸化的H株(图1A, B),该比较表示对含磷ARR1的最小相对响应激活强度的估计D94E.由于含磷ARR1 H苗与生长在0.5 μM BA上的野生型植株相似,而野生型ARR1 H2苗与生长在5 nM BA上的野生型植株相似,我们认为ARR1D94E蛋白质在促进这种细胞分裂素反应方面至少有100倍的效力。
ARR1异位表达D94E促进广泛的构成性细胞分裂素反应
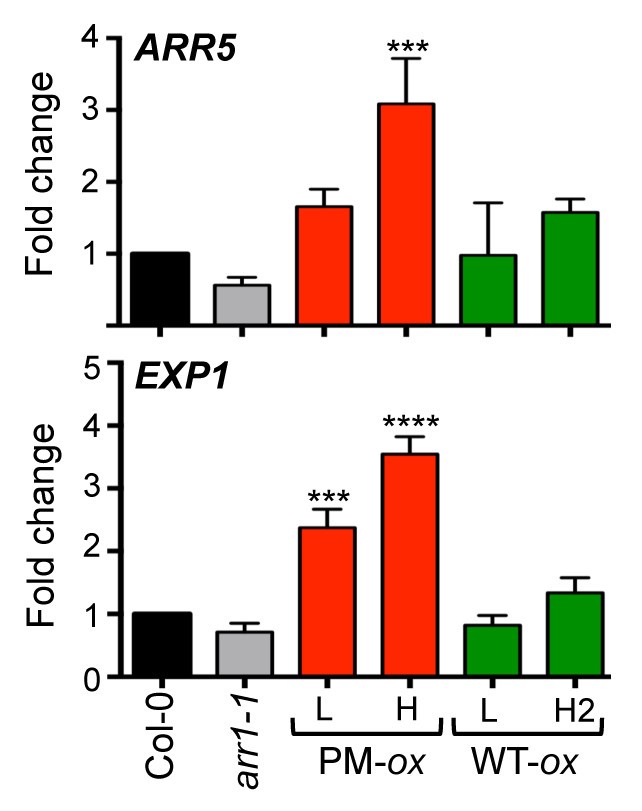
为了记录磷化系本构响应的程度,我们接下来分析了野生型ARR1和磷化ARR1表达系中细胞分裂素调节的其他性状。首先,我们测定了两种细胞分裂素诱导基因的稳态mRNA水平。的基本基因ARR5是细胞分裂素反应的主要基因,并编码细胞分裂素反应的抑制剂[20.,25,26].的cytokinin-inducibleEXP1基因被认为在细胞分裂素反应途径的更下游起作用,它编码细胞壁松动蛋白扩展蛋白1 [55].与构成型细胞分裂素反应表型一致,两者的稳态水平ARR5而且EXP1被磷化酶上调了ARR1转基因(图3.).我们观察到ARR5在ARR1 H系中含量较高,而ARR1 H系中含量较低EXP1两个磷酸化ARR1系的转录水平都较高。相比之下,在野生型ARR1表达系中,两种细胞分裂素诱导基因的表达均未增加(图3.).
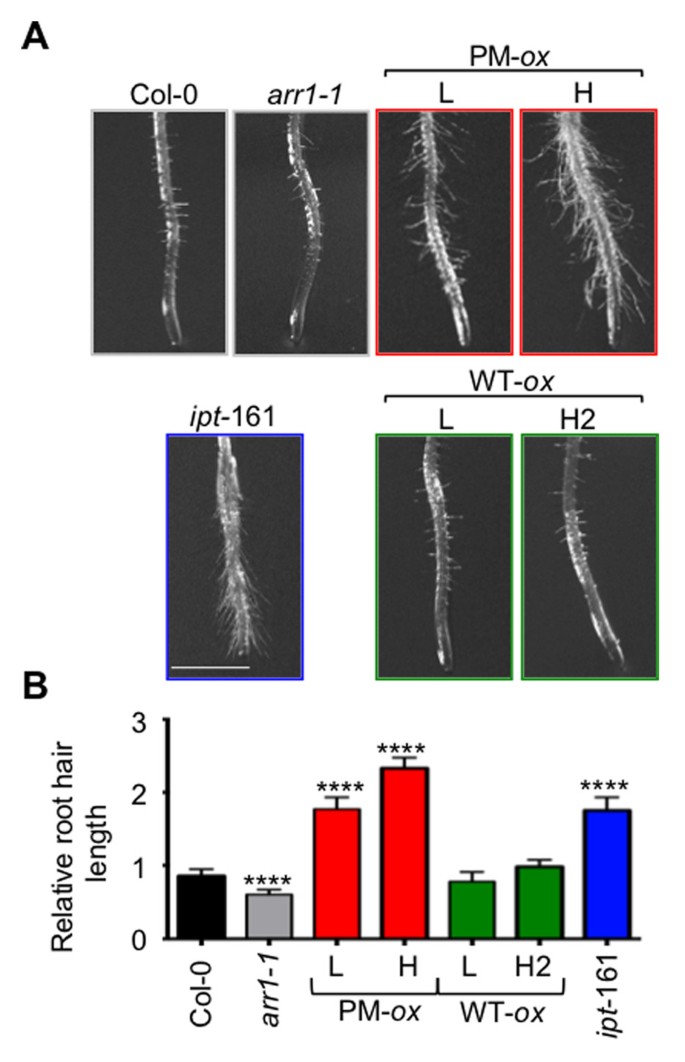
其次,我们测试了已知由外源性细胞分裂素促进的根毛伸长反应[54,并在细胞分裂素过度产生系中增加ipt-161年(28].两种含磷ARR1系均有本构根毛伸长反应,这是转基因剂量依赖性的(图4).相比之下,在表达ARR1的细胞系中没有观察到根毛伸长的增加。与观察到的细胞分裂素敏感性降低相一致arr1-1突变体(18],根毛长度在arr1-1与野生型相比,突变型减少了(图4).
接下来,我们测试了在黑暗中生长的转基因系的细胞分裂素反应。以前的研究已经确定了黄化幼苗中两种类型的细胞分裂素生长反应[56].在黄化生长的早期阶段(3至5天的暗培养),细胞分裂素处理过的幼苗下胚轴较短,顶端钩状弯曲增加,而在后期阶段(如4周后),细胞分裂素处理过的幼苗下胚轴上部区域肿胀,子叶扩大,并发育出真叶[56,57].未经处理的野生型和arr1-1幼苗彼此之间没有差异,并显示出预期的黄化发展,其特征是伸长的下胚轴和小的黄色未打开的子叶(图5A)35 s: ARR1D94E当植物在黑暗中生长时,再次表现出细胞分裂素反应的组成表型(图5).在黑暗中生长了4天,两者都35 s: ARR1D94E线有较短的下胚轴和夸张的顶端钩弯曲,并类似于细胞分裂素处理的野生型和ipt-161苗(图5A, B)在黑暗中生长4周后,两者都35 s: ARR1D94E而且ipt-161苗的子叶扩大,上下胚轴区域肿胀,形成真叶,再次类似于细胞分裂素处理过的野生型(图5C, D)。与外源细胞分裂素对野生型的影响相反,我们没有观察到任何黄化幼苗的根伸长减少,包括细胞分裂素过量产生的幼苗ipt-161(图5A).表达野生型ARR1的细胞系在黄化发育的早期或晚期均未表现出任何本构反应表型(图5).
表达磷化ARR1的黄化幼苗的细胞分裂素本构反应。(一)Four-day-old35 s: ARR1overexpressing (WT -牛)一个nd35 s: ARR1D94Eoverexpressing (PM - - - - - -牛)显示黄化的幼苗。比例尺= 2毫米。(B)4日龄幼苗下胚轴长度用ImageJ照片测量,用均值±SD (n≥20)表示。除非标记不同,否则使用单因素方差分析和Tukey多重比较检验与Col-0进行比较。**P< 0.01, ****,P< 0.0001。(C)四周大黄化苗。比例尺= 2毫米。(D)用ImageJ软件测量子叶叶柄长度,用均值±SD (n≥12)表示。**P< 0.01, ***,P< 0.001, ****,P< 0.0001为单因素方差分析与Tukey多重比较检验。ns,统计上不显著(P> 0.05)。
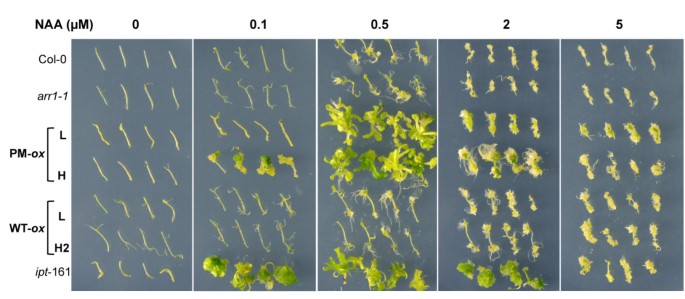
我们进行的第四个测试是分析下胚轴和根外植体对生长素的反应(图6).已知外植体在添加特定浓度比例的生长素和细胞分裂素的培养基上培养可促进愈伤组织或芽的形成[58].通常情况下,较高的细胞分裂素与生长素比值会促进绿色愈伤组织的形成和偶尔的芽的发育。相比之下,较低的细胞分裂素与生长素的比值只会促进白色愈伤组织的生长,或者如果该比值低于一个临界阈值,则完全没有细胞增殖。理论上,细胞分裂素反应突变体或细胞分裂素过度产生体在愈伤组织或芽形成过程中不需要培养基中的细胞分裂素。事实上,在仅含0.1 μM NAA的培养基上孵育28天后,下胚轴被切除35 s: ARR1D94E(H)和ipt -161株幼苗发育出绿色愈伤组织6).较高浓度的NAA (0.5 μM)可促进磷化系和植株的绿色愈伤组织和芽的形成ipt -161(图6).与预期的一样,野生型和野生型未观察到细胞增殖arr1-1测试任何生长素浓度的下胚轴。我们也没有在野生型ARR1过表达系中观察到任何愈伤组织或芽诱导反应,证实这些系没有构成性细胞分裂素反应(图6).因此,细胞对生长素的增殖反应需要增加内源性细胞分裂素或本构性上调ARR1的作用。因为细胞增殖和分化在强者中更为明显35 s: ARR1D94E与弱者相比35 s: ARR1D94E我们得出结论,相对反应强度反映了ARR1的差异D94E表达水平。早前研究表明,在组织培养中,过表达未修饰的ARR1形式促进了超敏感的细胞分裂素反应,即使在缺乏外源性细胞分裂素的情况下,也会导致绿色愈伤组织的形成[18].通过比较相似表达的野生型和磷化型ARR1的效果,我们表明ARR1D94E在促进这种不依赖细胞分裂素的组织培养反应方面更有效。
细胞分裂素治疗已被证明可以提高编码类黄酮生物合成酶的若干基因的转录水平[59].部分类黄酮生物合成基因(例如查尔酮合成酶(CHS)编码类黄酮生物合成途径CHS关键酶的基因[60,61或二氢黄酮醇还原酶基因)被BA转录诱导,而其他基因(如查尔酮异构酶)的稳态mRNA水平则通过转录后机制提高[59].与细胞分裂素对花青素产生的影响一致,我们发现花青素积累到较高的水平35 s: ARR1D94E幼苗与35 s: ARR1行、野式和arr1-1其中含有统计上相同数量的花青素(图7A).这些增加的幅度与在ipt-161苗和1 μM BA处理的col0苗。的35 s: ARR1D94E(H)植物积累的花青素比植物多35 s: ARR1D94E(L)植物,证实转基因以剂量依赖性的方式促进细胞分裂素反应。CHS水平仅在35 s: ARR1D94E(H)和ipt-161苗,与这些品系花青素含量高的情况相一致(图7A、B)。
细胞分裂素的本构反应35 s: ARR1D94(PM - - - - - -牛)的花青素积累,衰老时间和分生组织大小。(一)花青素含量以每10株幼苗520 nm的吸光度值表示,在6日龄幼苗中测定。三个生物重复的平均值±SD显示出来。col0加BA治疗16 h。采用单因素方差分析结合Tukey检验对数据进行分析。**P< 0.01;* * * *,P< 0.0001。(B)8日龄苗木查尔酮合成酶(CHS)水平的免疫印迹分析。(C)PM-的延迟衰老牛植物。野生型的幼苗,arr1-1,PM牛WT -牛而且ipt-161株在MS/2培养基上培养5 d后用于子叶解剖。子叶被放在培养皿中潮湿的滤纸上,转移到黑暗中。照片是在指定的时间拍摄的。(D)在指示时间内在黑暗中孵化的子叶的相对叶绿素水平。每个品系第1天叶绿素含量赋值为1。显示了两个独立样本(每个有15个子叶)的平均值±SD。(E)6日龄幼苗茎尖分生组织(SAM)大小的分析。显微照片测量的SAM直径表示为平均值±SEM (n= 25)。结果与Col-0进行单因素方差分析与Tukey 's检验比较*,P< 0.05;***,P< 0.001。(F)分析了在垂直定位板上生长的7天大的幼苗的根顶分生组织(RAM)的大小。显微照片测定的RAM皮层细胞数表示为平均值±SEM (n= 25)。显示了与Col-0差异的显著性。*,P< 0.05;**P< 0.01(单因素方差分析与Tukey 's检验)。
细胞分裂素可抑制叶片衰老及其标志性症状叶绿素分解[62- - - - - -64].据报道,离体叶片在黑暗中孵育引起的人工诱导叶绿素损失与衰老诱导的叶绿素损失是由相同的机制介导的[65].为了确定在受控条件下的衰老进程,我们进行了离体叶衰老试验,并使用了野生型和转基因系发育年龄相同的子叶。我们观察到明显的衰老延迟35 s: ARR1D94E而且ipt-161行相比野生类型和arr1-1突变体(图7C, D)。对于所有三种细胞系,衰老延迟在治疗第5天至第7天尤为明显(图7C, D)。然而,对于这种细胞分裂素反应,我们观察到细胞分裂素表型强度与ARR1之间没有相关性D94E表达水平:与其他分析的细胞分裂素反应相比35 s: ARR1D94E(L)系一贯具有较弱的细胞分裂素表型35 s: ARR1D94E(L)线显示衰老延迟最强(图7C, D)。在任何野生型ARR1过表达系或在植株中均未观察到衰老诱导的叶绿素损失变化arr1-1突变体。
最后,研究表明细胞分裂素在分生组织发育的调节中发挥作用[66].细胞分裂素敏感度或含量的降低会导致茎尖分生组织(SAM)大小的减少,而细胞分裂素作用的增加则会促进茎尖分生组织(SAM)大小的增加[31,32,67- - - - - -70].对6日龄幼苗的分析表明,在幼苗生长过程中,SAM的大小显著增加35 s: ARR1D94E(H)线和在ipt -161苗(图7E).过表达野生型ARR1的幼苗和过表达野生型ARR1的幼苗均未检测到SAM大小的变化arr1-1突变体(图7E).另一方面,细胞分裂素敏感性或含量的降低之前已被证明可促进根尖分生组织(RAM)大小的增加,而细胞分裂素作用的增加则可促进RAM大小的减小[71- - - - - -73].与它们增加的细胞分裂素作用一致,我们观察到两者的RAM尺寸减小35 s: ARR1D94E行,而ARR1过表达的行与野生型没有显著差异(图7F).与以前的报告一致[72,我们观察到RAM尺寸的增加arr1-1苗(图7F).总的来说,这些分析证实了构成的细胞分裂素反应表型35 s: ARR1D94E行。
35S:ARR1中乙烯依赖性的细胞分裂素反应D94Eoverexpressing行
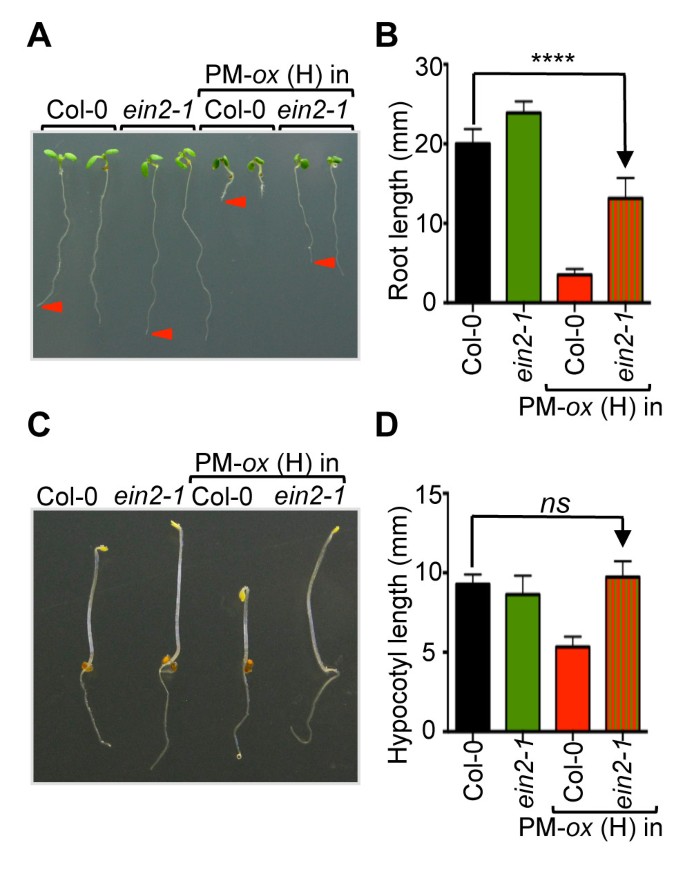
细胞分裂素对植物发育的一些影响是由乙烯生物合成的增加介导的,乙烯生物合成的增加是由关键的乙烯生物合成酶ACC合成酶的稳定和活性的提高引起的。56,74,75].在深色生长的幼苗中,细胞分裂素促进了一种三重反应,包括顶端钩曲率的增加和下胚轴和根伸长的抑制[56].在光生长的幼苗中,细胞分裂素对根系伸长的抑制作用也部分由乙烯产生的增加介导[74].测定暗生植物的下胚轴伸长是否减少35 s: ARR1D94E幼苗是乙烯作用增加的结果,我们渗入了35 s: ARR1D94E(H)线转入乙烯不敏感突变体ein2-1它在乙烯反应途径的一个关键步骤上有缺陷[76].在光生幼苗中,EIN2功能的缺失部分抑制了短根表型35 s: ARR1D94E(H)幼苗(图8A, B)相反,ein2-1完全抑制了黄化的短下胚轴表型35 s: ARR1D94E(H)幼苗(图8C, D).细胞分裂素对幼苗根系和下胚轴伸长生长的抑制作用的很大一部分是通过细胞分裂素诱导的乙烯生物合成增加所引起的乙烯作用的增加而介导的[75].早期研究表明,这种细胞分裂素诱导的乙烯生物合成涉及细胞分裂素的主要反应途径[77].我们的结果证实了这一顺序的事件表明,增加的ARR1作用对伸长的抑制作用在乙烯不敏感的背景下被抑制。然而,尽管在黄化幼苗中对下胚轴生长抑制的抑制是完全的,但我们在光生长的幼苗中只观察到根伸长生长的部分逆转。考虑到ein2-1突变导致几乎完全的乙烯抗性[78],光生长幼苗的部分逆转不太可能是由残留的乙烯作用引起的。相反,细胞分裂素的作用可能通过乙烯无关的途径控制根的伸长。事实上,早前研究表明,细胞分裂素通过控制生长素的分布来调节根的生长,生长素影响根分生组织的活性和大小[79].
乙烯依赖性的细胞分裂素反应35 s: ARR1D94E(PM - - - - - -牛)幼苗。(一)代表性的7天大的col0,ein2-1,PM牛(H)和PM-牛(H)ein2-1植物生长在垂直MS/2平板上。(B)7日龄幼苗的根长由照片测量。数据以平均值±SD (n= 20)。采用单因素方差分析结合Tukey多重比较检验分析结果的统计学显著性。只有col0与PM-差异的显著性牛(H)ein2-1显示。* * * *,P< 0.0001。(C)具有代表性的4天大幼苗在MS/2培养基上黑暗萌发生长。(D)4天大黄化苗的下胚轴长度。数据以平均值±SD (n= 20)。只有col0与PM-差异的显著性牛(H)ein2-1显示。ns,不显著(单因素方差分析与Tukey多重比较检验)。
我们的结果是35 s: ARR1D94E与植物表达的结果进行对比35 s: ARR2804 e, ARR2的磷酸化版本[51].本研究认为ARR2在乙烯反应途径中发挥作用,因为幼苗的本构三重反应表型表达35 s: ARR2804 e未被乙烯生物合成抑制所抑制[51].相反,我们观察到黄化表型35 s: ARR1D94EEIN2乙烯信号元件功能的丧失完全抑制了幼苗的生长8的本构三重响应35 s: ARR1D94E是由乙烯生物合成的增加引起的,这与细胞分裂素对ACC合酶活性的已证实的刺激作用是一致的[56,74,75].综上所述,这可能是另一个例子,表明ARR2与ARR1等其他RRBs相比具有特定的功能[41,42,51,80,81].
成人35S:ARR1发育变化D94E植物
这两个35 s: ARR1D94E而且ipt-161植株在成体发育的早期阶段仍然比野生型植株小(图9A, B)。然而,经过44天的生长,莲座大小35 s: ARR1D94E(L)植株较野生型增加arr1-1(图9A, B)。这些较大的莲座也明显更绿,这与用子叶分析法观察到的衰老延迟一致(图7C, D). ARR1过表达线和arr1-1突变体具有野生型大小的莲座。的ipt-161种植物需要较长的生长周期才能达到最终大小,但在土壤上长时间生长后,植株的体积仍大为缩小(图9A、B)。
莲座和花序在35 s: ARR1D94E行。(一)具有代表性的20天和44天土壤生长植物。比例尺= 0.5 cm(上面板),2 cm(下面板)。(B)每行莲座直径≥12株,用平均值±标准差表示。显示了col0与转基因系之间差异的显著性。**P< 0.01;***,P< 0.001;* * * *,P< 0.0001(单因素方差分析与Tukey多重比较检验)。(C)野生型的花序,35 s: ARR1D94E(PM - - - - - -牛),35 s: ARR1(WT -牛)行及ipt在土壤上长时间生长(44天)后-161。照片的干燥,植物标本室标本显示。(D)c所示植物的主花序长度。数据表示为平均值±SD (n= 12)。只有与Col-0差异的显著性被标记出来。**P< 0.01;***,P< 0.001(单因素方差分析与Tukey多重比较检验)。
细胞分裂素被认为参与了芽分枝的调节。尽管在几十年前就已经发现了芽枝的激素调节,但影响这一过程的新激素和相关效应器的身份仍在被发现[82- - - - - -86].由于细胞分裂素增加了芽的顶端分生组织的大小,并且由于它们被认为在直接应用于侧芽时促进了顶端优势的释放,人们通常认为细胞分裂素增加了芽的分枝[67,82,87].然而,花序35 s: ARR1D94E植物的分枝并不明显多于野生型的花序arr1-1(图9C)。初生花序茎长显著增加35 s: ARR1D94E(L)线(图9C, D),这可能是在这些植物中观察到的延迟衰老表型的结果(图7C, D和9A, B)ipt -与其他株系相比,161株植株的长度明显较短,分枝并不多9C, D),这与之前报道的该转基因系的C24生态型版本的结果一致[53].一个意想不到的特点35 s: ARR1D94E花序表型是没有任何明显的分枝增加伴随枝尖优势的损失。考虑细胞分裂素在促进根尖优势释放中的经典作用[5,67,82,87],人们会认为细胞分裂素作用的增加会导致花序结构更浓密。然而,最近的研究表明,下调细胞分裂素生物合成和抑制RRBs功能会增加花序分枝[88,89].这些研究结合我们的数据表明,细胞分裂素在这一发育过程中发挥着更复杂的作用。然而,也有可能的影响35 s: ARR1D94E转基因在这一发育后期受到抑制,因此我们没有观察到对花序发育的任何影响。
结论
本研究表明,异位表达ARR1磷酸化版本的幼苗与细胞分裂素处理过的野生型相似,并且大多数细胞分裂素相关表型的相对强度与ARR1相关D94E丰富。此外,我们还表明,在过表达ARR1的植物中未观察到的构成性细胞分裂素反应表型,是在没有外源细胞分裂素应用的情况下,促进细胞分裂素反应能力显著增加的结果。
由于我们使用的是本构CaMV 35S启动子,所以我们的结果并没有解释其功能ARR1拟南芥发育中的基因。相反,它们使我们能够得出关于ARR1蛋白的两个重要结论。首先,由于磷酸化取代在分子、生理和发育水平上都激活了细胞分裂素反应,我们得出结论,ARR1在D94处的磷酸化确实是细胞分裂素信号传递的关键步骤。D94E替代将ARR1从潜伏转录因子转化为活性转录因子,其活性是野生型转录因子的100倍。第二个结论是,磷酸化的(可能是磷酸化的)ARR1有能力促进目前已知的大多数细胞分裂素反应。然而,ARR1D94E不促进本研究未分析的细胞分裂素反应。
我们的结果表明35 s: ARR1D94E转基因模拟了细胞分裂素处理的效果,因此验证了当前的细胞分裂素信号模型,该模型强调了RRBs在其保守的天冬氨酸残基上的磷酸化在促进广谱细胞分裂素反应方面的重要作用。虽然我们的结果提供了ARR1蛋白和细胞分裂素反应途径的一般信息,但观察到ARR1的磷化版本可以用作广谱细胞分裂素反应激活剂,这也与生物技术和农业有关。细胞分裂素调节许多对作物产量具有重要意义的发育过程和环境反应[90,91].到目前为止,细胞分裂素控制的农业重要性状的工程主要集中在通过改变生物合成或代谢来改变细胞分裂素的积累[90].另一种方法可能是使用组成活性信号蛋白与组织或发育阶段特异性启动子结合。基于高等植物中细胞分裂素反应途径的高度保守[92],我们有理由假设,相应的ARR1版本的磷化版本将有助于细胞分裂素相关性状的工程。
方法
植物材料和生长条件
对于所有的实验,拟南芥野生型、转基因和突变株(均为Col-0背景)在无菌条件下萌发和生长。将表面灭菌的种子分层2天,在半强度的Murashige和Skoog培养基(MS/2;0.5x Murashige和Skoog盐,1%蔗糖,pH 5.7)。植物生长在22°C的生长室内,光照16小时(80 μmol m)-2年代-1)/8小时暗周期。为了在土壤上生长,无菌幼苗被转移到盆栽混合土(肥力土)和蛭石珍珠岩(Therm-o-Rock East Inc.)的1:1混合物中。的arr1-1而且ein2-1变种人与IPT: IPT转基因线ipt -前面描述了Col-0背景的161 [18,28,78].
为了产生野生型和磷酸化ARR1过表达的植物ARR1(ARR1;用attB引物从拟南芥cDNA文库中pcr扩增At3g16857) cDNA,用BP克隆酶混合酶(Invitrogen)将其克隆到pDONR221中。得到的pENTR-ARR1用正向引物和反向引物5 ' -GATGTTCAT ATGCCTGAGATGGACGGTTTCAAG-3 '进行位点定向突变,引入c到g突变,从而在94号位置实现D到E的替换。野生型和ARR1D94E片段重组为pEarlyGate100二进制向量[93使用LR克隆酶混合酶(Invitrogen)。该结构被引入到C58C1Rif中根癌土壤杆菌用于花浸转化的品系[94].转基因植株在含1%蔗糖和10 μg/ml磷菊素(GoldBio)的MS/2固体培养基上选择。
蛋白质分离和免疫印迹分析
免疫印迹法:将总蛋白在2X SDS-PAGE加载缓冲液中分离,用SDS-PAGE分离,按所述转移到硝化纤维素膜上[95].商用抗体为单克隆抗-α微管蛋白抗体(稀释1:10 000;克隆b5-1-2, Sigma)和抗查尔酮合成酶抗体(稀释1:1000;圣克鲁斯生物技术)。为了产生arr1特异性抗体,选择一个55个氨基酸长的肽(氨基酸348到402)作为抗原。该肽有47%的氨基酸序列与ARR1同源ARR2一致。在ARR1和ARR2的这个区域,相同氨基酸的最长连续延伸是6个。抗血清在兔体内产生,使用前对抗原进行亲和纯化(战略诊断)。亲和纯化抗血清经1:10 000稀释后使用。使用ChemiDoc XRS捕获信号,并使用Quantity One软件(Bio-Rad)确定信号强度。
细胞分裂素反应测定
抑制根伸长
将垂直生长的幼苗移栽到对照MS/2板和含苄ladenine (BA)的MS/2板上,标记初始根长。幼苗垂直生长7天。用ImageJ (http://rsb.info.nih.gov/ij/).
细胞分裂素反应基因的诱导
用TRIzol试剂(Invitrogen)从MS/2液体培养基中生长7天的植物中分离RNA。qRT-PCR分析和序列分析ARR5描述了引物[28].用于分析的引物EXP1水平为5 ' -CAACGCATCGCTCAATACAG-3 '和5 ' -CTCCGACGTTAGTGATCAGAAC-3 '。
根和下胚轴外植体的愈伤组织和芽的诱导
将在黑暗中生长4天,然后在光明中生长2天的植物下胚轴切除,转移到添加2%蔗糖和萘-1-乙酸(NAA)的全强度MS培养基上。每一种NAA浓度下,每一行至少检测40个下胚轴。试验板放置在连续光照、温度22°C的可控环境室中,每日随访。
花青素积累
采集在MS/2培养基上生长6天的幼苗(每个样品10个),浸入500 μl酸性甲醇(1% HCl)中,在4℃黑暗中摇晃12小时。使用氯仿相分离提取花青素部分,如所述[60].用DTX 880多模检测器(Beckman Coulter)和520/8 nm吸光度滤波器测定花青素含量。
子叶衰老
5天生的轻生幼苗的子叶被切除,转移到用蒸馏水浸湿滤纸的培养皿中。样品在黑暗中培养。在指定的时间间隔内,对子叶进行拍照,每行至少15个子叶冷冻在液氮中进行叶绿素提取。为了提取叶绿素,将冷冻的子叶在4℃(v/v)的丙酮中孵育12小时。在647和664 nm处的吸光度用ultrspec 2000 (Pharmacia)测量,叶绿素含量根据Graan和Ort [96].
SAM尺寸测量
茎尖分生组织的大小分析如所述[97].简单地说,用霍耶氏溶液清除6天大的幼苗24到48小时。采用Zeiss Axioplan2和Axiovision软件,采用40×物镜/1× optivar对切片进行观察。
根分生组织细胞数量测定
根分生组织大小分析如所述[98].简单地说,在垂直板上生长的7天大的幼苗用霍耶氏溶液清除12小时,安装在使用霍耶氏溶液的载玻片上,用配备差分干涉对比技术和DP70数码相机的奥林巴斯BX51显微镜(40×物镜)观察。
生物识别技术
描述性统计、绘图和统计分析使用Prism 6 (GraphPad)完成。用于分析数据的统计检验、被测试样本集的大小和生物重复的数量在结果和讨论部分或图图例中说明。
参考文献
Mok DW, Mok MC:细胞分裂素的代谢与作用。植物生理学报,2001,27(3):369 - 369。10.1146 / annurev.arplant.52.1.89。
细胞分裂素在植物发育调控中的作用。植物发育生物学-生物技术视角,第2版。Davey E-CPaMR编辑。柏林海德堡:Springer-Verlag; 2010:237-254。
Argueso CT, Ferreira FJ, Kieber JJ:环境感知途径:细胞分裂素与环境反应途径的相互作用。植物学报,2009,32:1147-1160。10.1111 / j.1365-3040.2009.01940.x。
Werner T, Schmülling T:细胞分裂素在植物发育中的作用。植物学报,2009,12:527-538。10.1016 / j.pbi.2009.07.002。
王晓燕,王晓燕,王晓燕,等。植物生长发育中的激素信号通路。植物生物学杂志,2012,15:92-96。10.1016 / j.pbi.2011.12.004。
黄丽娟,王晓燕,王晓燕:拟南芥细胞分裂素信号转导的双组分电路。自然学报,2001,413:383-389。10.1038 / 35096500。
拟南芥中的细胞分裂素信号转导。植物学报,2002,14(增刊):S47-S59。
Müller B, Sheen J:拟南芥细胞分裂素信号通路。Sci抽烟可以。2007, 2007: cm5。
黄毅,陈洪昌,陈世荣:拟南芥的双组分信号转导途径。植物生理学报,2004,25(3):366 - 366。10.1104 / pp.005504。
Heyl A, Brault M, Frugier F, Kuderova A, Lindner AC, Motyka V, Rashotte AM, Schwartzenberg KV, Vankova R, Schaller GE:植物双组分信号通路成员的命名法。植物生理学报,2013,29(3):366 - 366。10.1104 / pp.112.213207。
Inoue T, Higuchi M, Hashimoto Y, Seki M, Kobayashi M, Kato T, Tabata S, Shinozaki K, Kakimoto T:拟南芥中细胞分裂素受体CRE1的鉴定。自然学报,2001,409:1060-1063。10.1038 / 35059117。
铃木T,美和K,石川K,山田H,爱叶H,水野T: The拟南芥传感器his激酶AHK4可对细胞分裂素产生反应。植物生理学报,2001,32(4):381 - 381。10.1093 /卡式肺囊虫肺炎/ pce037。
Yamada H, Suzuki T, Terada K, Takei K, Ishikawa K, Miwa K, Yamashino T, Mizuno T:拟南芥AHK4组氨酸激酶是一种细胞分裂素结合受体,可跨膜转导细胞分裂素信号。植物生理学报,2001,42:1017-1023。10.1093 /卡式肺囊虫肺炎/ pce127。
Miwa K, Ishikawa K, Terada K, Yamada H, Suzuki T, Yamashino T, Mizuno T:使拟南芥细胞分裂素受体组氨酸激酶AHK4组成活性的氨基酸取代的鉴定。植物生理学报,2007,38(4):359 - 361。10.1093 /卡式肺囊虫肺炎/ pcm145。
Miyata S, Urao T, Yamaguchi-Shinozaki K, Shinozaki K:含单一HPt结构域的双组分磷传递介质基因的表征拟南芥.中国科学(d辑)。10.1016 / s0014 - 5793(98) 01188 - 0。
Hutchison CE, Li J, Argueso C, Gonzalez M, Lee E, Lewis MW, Maxwell BB, Perdue TD, Schaller GE, Alonso JM,等:拟南芥组氨酸磷转移蛋白是细胞分裂素信号的冗余正调控因子。植物学报,2006,18:3073-3087。10.1105 / tpc.106.045674。
Suzuki T, Ishikawa K, Yamashino T, Mizuno T:一种参与磷酸化信号转导的拟南芥组氨酸磷转移(HPt)因子:植物中AHP2过表达导致细胞分裂素过敏。植物生理学报,2002,29(4):369 - 369。10.1093 /卡式肺囊虫肺炎/ pcf007。
Sakai H, Honma T, Aoyama T, Sato S, Kato T, Tabata S, Oka A: ARR1,对细胞分裂素立即反应的基因转录因子。科学通报,2001,29(4):519- 521。10.1126 / science.1065201。
Mason MG, Li J, Mathews DE, Kieber JJ, Schaller GE: b型反应调控子在拟南芥中表达模式重叠。植物生理学报,2004,25(3):327 - 327。10.1104 / pp.103.038109。
细胞分裂素信号转导中的磷酸化和转录控制。科学通报,2002,29(5):557 - 557。10.1126 / science.1071883。
D'Agostino I, Deruère J, Kieber J:拟南芥的反应特征加勒比海盗细胞分裂素基因家族。植物生理学报,2004,24(4):447 - 447。10.1104 / pp.124.4.1706。
Taniguchi M, Sasaki N, Tsuge T, Aoyama T, Oka A: ARR1直接激活细胞分裂素响应基因,编码具有多种调节功能的蛋白质。植物生理学报,2007,32(4):366 - 366。
Ishida K, Yamashino T, Yokoyama A, Mizuno T:三种b型反应调控因子ARR1, ARR10和ARR12在细胞分裂素信号转导中起着重要但多余的作用拟南芥.植物生理学报,2008,29(4):347 - 357。10.1093 /卡式肺囊虫肺炎/ pcm165。
对JPC、Deruere J、Maxwell BB、Morris VF、Hutchison CE、Ferreira FJ、Schaller GE、Kieber JJ:细胞分裂素通过双组分磷酸化调控拟南芥a型反应调控活性和蛋白稳定性。植物工程学报,2007,29(4):369 - 369。10.1105 / tpc.107.052662。
Kakimoto T:细胞分裂素的感知和信号转导。植物学报,2003,23(3):366 - 366。10.1146 / annurev.arplant.54.031902.134802。
Argueso CT, Raines T, Kieber JJ:细胞分裂素信号通路与转录网络。植物学报,2010,13:533-539。10.1016 / j.pbi.2010.08.006。
Mähönen AP, Bishopp A, Higuchi M, Nieminen KM, Kinoshita K, Törmäkangas K, Ikeda Y, Oka A, Kakimoto T, Helariutta Y:细胞分裂素信号及其抑制剂AHP6在血管发育过程中调节细胞命运。科学通报,2006,31(4):394 - 398。10.1126 / science.1118875。
Li Y, Kurepa J, small J: AXR1通过促进ARR5蛋白水解促进拟南芥细胞分裂素反应。植物生态学报,2013,34(4):447 - 447。10.1111 / tpj.12098。
Chevalier F, Perazza D, Laporte F, Le Hénaff G, Hornitschek P, Bonneville J-M, Herzog M, Vachon G: GeBP和GeBP样蛋白是调节拟南芥细胞分裂素反应的非典型亮氨酸-拉链转录因子。植物生理学报,2008,29(4):347 - 347。10.1104 / pp.107.110270。
Rashotte AM, Mason MG, Hutchison CE, Ferreira FJ, Schaller GE, Kieber JJ:拟南芥AP2转录因子的一个亚群通过双组分途径介导细胞分裂素反应。中国生物工程学报,2006,29(5):561 - 561。10.1073 / pnas.0602038103。
东口M, Pischke MS, Mähönen AP, Miyawaki K,桥本Y, Seki M,小林M, Shinozaki K, Kato T, Tabata S,等:在足底政府的职能拟南芥细胞分裂素受体家族。中国环境科学,2004,29(4):369 - 369。10.1073 / pnas.0402887101。
西村C, Ohashi Y, Sato S, Kato T, Tabata S, Ueguchi C:作为细胞分裂素受体的组氨酸激酶同源物在调控植物芽和根生长中具有重叠功能拟南芥.植物学报,2004,16:1365-1377。10.1105 / tpc.021477。
Imamura A, Hanaki N, Nakamura A, Suzuki T,谷口M, Kiba T,上口C,杉山T,水野T:编纂与表征拟南芥参与His-Asp磷酸化信号转导的反应调控因子。植物生理学报,1999,29(4):369 - 369。10.1093 / oxfordjournals.pcp.a029600。
Brandstatter I, Kieber JJ:在拟南芥中,两个与细菌反应调控因子相似的基因被细胞分裂素快速特异性地诱导。植物学报,1998,29(4):359 - 361。
Mason MG, Mathews DE, Argyros DA, Maxwell BB, Kieber JJ, Alonso JM, Ecker JR, Schaller GE:多种b型反应调控因子介导细胞分裂素信号转导拟南芥.植物学报,2005,17:3007-3018。10.1105 / tpc.105.035451。
里弗勒M,诺瓦克O,斯特纳德M, Schmülling拟南芥细胞分裂素受体突变体在芽生长、叶衰老、种子大小、萌发、根系发育和细胞分裂素代谢中发挥作用。植物学报,2006,18:40-54。10.1105 / tpc.105.037796。
Hradilová J, Brzobohatý B:表达模式层次分析法基因家族来自拟南芥和特定器官的替代剪接AHP5基因。植物工程学报,2007,29(5):557 - 557。10.1007 / s10535 - 007 - 0051 - 7。
Osakabe Y, Miyata S, Urao T, Seki M, Shinozaki K, yamaguchi Shinozaki K:拟南芥反应调控因子ARR4/ATRR1/IBC7和ARR8/ATRR3的过表达改变了芽和愈伤组织形成过程中的细胞分裂素反应。生物化学学报,2002,29(3):369 - 369。10.1016 / s0006 - 291 x(02) 00286 - 3。
田岛Y, Imamura A, Kiba T, Amano Y, Yamashino T, Mizuno T:揭示其在His-to-Asp磷酸化信号转导中独特特性的b型反应调控因子的比较研究拟南芥.植物生理学报,2004,25(4):326 - 326。10.1093 /卡式肺囊虫肺炎/ pcg154。
Stolz A, Riefler M, Lomin SN, Achazi K, Romanov GA, Schmülling T:细胞分裂素信号在拟南芥是由不同的配体亲和力和受体的表达谱介导的。植物学报。2011,doi:10.1111/ J. 1365- 313x .2011.04584.x
崔娇,许苏,小岛M, Sakakibara H,白凯,黄毅:拟南芥细胞分裂素激活转录因子ARR2通过TGA3/ npr1依赖的水杨酸信号通路促进植物免疫。开发学报,2010,19:284-295。10.1016 / j.devcel.2010.07.011。
Kim HJ, Ryu H, Hong SH, Woo HR, Lim PO, Lee IC, Sheen J, Nam HG, Hwang I:细胞分裂素介导的AHK3通过ARR2磷酸化控制叶片寿命拟南芥.中国生物工程学报,2006,29(5):563 - 566。10.1073 / pnas.0505150103。
Müller B:一般的信号特异性反应:细胞分裂素和环境依赖性细胞反应。中国生物医学工程学报,2011,29(3):379 - 379。10.1093 / jxb / erq420。
横山A, Yamashino T,天野Y- i,田岛Y, Imamura A, Sakakibara H, Mizuno T: b型ARR转录因子ARR10和ARR12参与了细胞分裂素介导的植物根系原生木质部分化调控拟南芥.植物生理学报,2007,32(4):394 - 394。
Argyros RD、Mathews DE、Chiang YH、Palmer CM、Thibault DM、Etheridge N、Argyros DA、Mason MG、Kieber JJ、Schaller GE:拟南芥B型反应调控因子在细胞分裂素信号转导和植物发育中发挥关键作用。植物科学学报,2008,29(4):381 - 381。10.1105 / tpc.108.059584。
Lohrmann J, Sweere U, Zabaleta E, Bäurle I, Keitel C, Kozma-Bognar L, Brennicke A, Schäfer E, Kudla J, Harter K:响应调控因子ARR2:参与拟南芥线粒体复合体I部分核基因表达的花粉特异性转录因子。中国生物医学工程学报,2001,29(5):561 - 562。10.1007 / s004380000400。
Hill K, Mathews DE, Kim HJ, Street IH, Wildes SL, Chiang YH, Mason MG, Alonso JM, Ecker JR, Kieber JJ,等:拟南芥细胞分裂素反应中b型反应调控因子的功能表征。植物生理学报,2013,32(4):369 - 369。10.1104 / pp.112.208736。
Klose KE, Weiss DS, Kustu S:氮调节蛋白NTRC磷酸化位点的谷氨酸模拟天冬氨酸-磷酸并激活该蛋白。中华分子生物学杂志,1997,32(3):394 - 394。10.1006 / jmbi.1993.1370。
Stock AM, Robinson VL, Goudreau PN:双组分信号转导。生物化学学报,2000,29(4):394 - 394。10.1146 / annurev.biochem.69.1.183。
Brown JL, Bussey H, Stewart RC:酵母Skn7p在真核双组分调控通路中的作用。中国科学(d辑:自然科学版),2004,25(4):366 - 366。
Hass C, Lohrmann J, Albrecht V, Sweere U, Hummel F, Yoo SD, Hwang I, Zhu T, Schäfer E, Kudla J,等:反应调控因子2介导乙烯信号和激素信号整合拟南芥.中国生物医学工程学报,2004,29(4):369 - 371。10.1038 / sj.emboj.7600337。
Veerabagu M, Elgass K, Kirchler T, Huppenberger P, Harter K, Chaban C, Mira-Rodado V:拟南芥b型反应调控因子18同源化并正向调控细胞分裂素反应。植物学报,2012,32(4):371 - 371。10.1111 / j.1365 - 313 x.2012.05101.x。
van der Graaff EE, Hooykaas PJJ, Auer CA:发育改变拟南芥带着农杆菌基因的部分原因是乙烯效应。植物生长学报,2001,34:305-315。10.1023 /: 1013351502643。
Su W, Howell SH:单基因位点,Ckrl,定义了根系生长对低浓度细胞分裂素具有抗性的拟南芥突变体。植物生理学报,1999,19(4):369 - 371。10.1104 / pp.99.4.1569。
李晓峰,李晓峰,李晓峰,Schmülling T:拟南芥细胞分裂素对基因的调控作用。植物科学进展,2012,3:8。
Vogel JP, Schuerman P, Woeste K, Brandstatter I, Kieber JJ:拟南芥细胞分裂素诱导乙烯生物合成缺陷突变体的分离与鉴定。中国生物医学工程学报,2004,19(4):417-427。
乔利J, Reinecke D, Sim S, Washburn T, Brenner M:细胞分裂素在去黄化过程中的作用拟南芥(依据突变体对细胞分裂素的反应发生改变)。植物生理学报,2004,25(4):339-347。
街AH:植物组织和细胞培养。牛津大学:布莱克威尔科学出版社;1977.
细胞分裂素诱导植物花青素积累拟南芥.植物学报,2004,24(3):366 - 366。
Kubasek WL, Shirley BW, McKillop A, Goodman HM, Briggs W, Ausubel FM:种子萌发过程中类黄酮生物合成基因的调控拟南芥幼苗。植物科学学报,1994,4:1229-1236。
Pelletier M, Burbulis I, Winkel-Shirley B:特定类黄酮基因的破坏增强了拟南芥幼苗类黄酮酶和终产物的积累。植物生物学杂志,1999,40:45-54。10.1023 /: 1026414301100。
Richmond AE, Lang A:激动素对离体细胞蛋白质含量和存活的影响苍耳子叶子。科学通报,1999,29(5):557 - 557。
Smart CM, Scofield SR, Bevan MW, Dyer TA:用农杆菌中产生细胞分裂素的基因tmr转化烟草植株,延缓叶片衰老。植物科学学报,1998,23(3):347 - 356。
甘雪梅,张晓燕,张晓燕,等。细胞分裂素分泌对植物叶片衰老的抑制作用。科学,1995,270:1986-1988。10.1126 / science.270.5244.1986。
吴莎,朴志华,李基,白赫,朴sk,南HG:水稻叶片衰老控制基因座的鉴定拟南芥.植物学报,1998,15(4):527- 527。10.1046 / j.1365 - 313 x.1997.00527.x。
细胞分裂素信号通路对分生组织大小的调控。植物工程学报,2011,32(4):366 - 366。10.1111 / j.1744-7909.2011.01045.x。
朱利尼,王杰,杰克逊D:细胞分裂素诱导的响应调控同源物ABPHYL1对叶状生殖的调控作用。自然学报,2004,43:1031-1034。10.1038 / nature02778。
Miyawaki K, Matsumoto-Kitano M, Kakimoto T:细胞分裂素生物合成异戊烯基转移酶基因在拟南芥:组织特异性和生长素、细胞分裂素和硝酸盐的调节作用。植物学报,2004,37(4):388 - 388。10.1046 / j.1365 - 313 x.2003.01945.x。
Werner T, Motyka V, Laucou V, Smets R, Van Onckelen H, Schmülling T:细胞分裂素缺陷转基因拟南芥植物表现出多种发育变化,表明细胞分裂素在调节茎和根分生组织活性方面具有相反的功能。植物学报,2003,26(4):359 - 359。10.1105 / tpc.014928。
赵卓,苏安生,刘荣凯,赵志刚,王晓燕,王晓燕,王晓燕:激素对芽干细胞生态位的调控作用。自然学报,2010,465:1089-1092。10.1038 / nature09126。
李海涛,李海涛。细胞分裂素在细胞分化调节中的作用。植物学报,2008,11:23-27。10.1016 / j.pbi.2007.10.006。
Dello Ioio R, Linhares FS, Scacchi E, Casamitjana-Martinez E, Heidstra R, Costantino P, Sabatini S:细胞分裂素通过控制细胞分化决定拟南芥根分生组织大小。中华微生物学杂志,2007,17:678-682。10.1016 / j.cub.2007.02.047。
库德罗瓦A, Urbankova I, Valkova M, Malbeck J, Brzobohaty B, Nemethova D, Hejatko J:条件ipt依赖性细胞分裂素过剩对拟南芥幼苗根系构型的影响。植物生理学报,2008,29(4):359 - 359。10.1093 /卡式肺囊虫肺炎/ pcn029。
Cary AJ, Liu W, Howell SH:细胞分裂素与乙烯耦合作用抑制植物根和下胚轴伸长拟南芥幼苗。植物生理学报,2003,24(3):366 - 366。10.1104 / pp.107.4.1075。
李勇,Hagen G, Guilfoyle TJ:转基因烟草在特定组织和器官中过度产生细胞分裂素的形态改变。中国生物技术学报,1999,19(3):376 - 376。10.1016 / 0012 - 1606 (92) 90123 - x。
阿隆so JM, Hirayama T, Roman G, Nourizadeh S, Ecker JR:拟南芥乙烯和胁迫响应的双功能传感器EIN2。科学通报,1999,38(4):447 - 447。10.1126 / science.284.5423.2148。
细胞分裂素和油菜素内酯对ACS蛋白稳定性的调节作用。植物学报,2009,29(3):366 - 366。10.1111 / j.1365 - 313 x.2008.03711.x。
Roman G, Lubarsky B, Kieber JJ, Rothenberg M, Ecker JR:植物乙烯信号转导的遗传分析拟南芥: 5个新的突变位点整合到一个应激反应通路。中国生物医学工程学报,2004,25(3):369 - 369。
Ruzicka K, Simaskova M, Duclercq J, Petrasek J, Zazimalova E, Simon S, Friml J, Van Montagu MC, Benkova E:细胞分裂素通过调节生长素极性运输调节根分生组织活性。中国生物工程学报,2009,29(4):379 - 379。10.1073 / pnas.0900060106。
Kim K, Ryu H, Cho YH, Scacchi E, Sabatini S, Hwang I:细胞分裂素促进的拟南芥RESPONSE REGULATOR 2蛋白水解减弱双组分电路中的信号输出。植物学报,2012,29(4):447 - 447。10.1111 / j.1365 - 313 x.2011.04843.x。
高桥N, Kajihara T, Okamura C, Kim Y, Katagiri Y, Okushima Y, Matsunaga S, Hwang I, Umeda M:细胞分裂素通过促进APC/C激活子的表达控制拟南芥根系内环启动植物生物学杂志,2013,23:1812-1817。10.1016 / j.cub.2013.07.051。
Müller D, Leyser O:生长素、细胞分裂素与嫩枝分枝控制。中国生物工程学报,2011,29(4):447 - 447。10.1093 / aob / mcr069。
Domagalska MA, Leyser O:信号集成在枝条分枝控制中的应用。细胞生物学杂志,2011,12:211-221。10.1038 / nrm3088。
芽枝的控制:植物信息处理的一个例子。植物细胞环境学报,2009,32:694-703。10.1111 / j.1365-3040.2009.01930.x。
Ongaro V, Leyser O:激素对芽分枝的控制。中国机械工程学报,2008,29(4):447 - 447。
顶端优势的下降和上升。中华医学杂志,2005,15:468-471。10.1016 / j.gde.2005.06.010。
Pillay I, Railton ID:在完整的,轻生长的幼苗的顶端优势完全释放腋芽Pisum一L.在少量应用细胞分裂素后。植物生理学报,2003,21(3):366 - 366。10.1104 / pp.71.4.972。
Bartrina I, Otto E, Strnad M, Werner T, Schmülling T:细胞分裂素调节生殖分生组织活性、花器官大小、胚珠形成和种子产量拟南芥.植物学报,2011,23:69-80。10.1105 / tpc.110.079079。
Heyl A, Ramireddy E, Brenner WG, Riefler M, Allemeersch J, Schmülling T:转录抑制因子ARR1-SRDX抑制拟南芥多效性细胞分裂素活性。植物生理学报,2008,37(4):378 - 378。10.1104 / pp.107.115436。
Alvarez JM, Vidal EA, Gutierrez RA:植物N反应的局部和系统信号通路的整合。植物生态学报,2012,15:185-191。10.1016 / j.pbi.2012.03.009。
王晓燕,王晓燕,王晓燕,等。松木不定芽形成过程中A型反应调控因子的克隆与表达分析。中国植物学报,2010,29(2):326 - 326。10.1016 / j.jplph.2010.02.012。
蔡永春,Weir NR, Hill K,张伟,Kim HJ, Shiu SH, Schaller GE, Kieber JJ:水稻细胞分裂素信号通路和代谢相关基因的鉴定。植物生理学报,2012,29(4):366 - 366。10.1104 / pp.111.192765。
王晓燕,王晓燕,王晓燕,王晓燕。植物功能基因组学和蛋白质组学中基因通路兼容载体的研究。植物学报,2006,29(4):366 - 366。10.1111 / j.1365 - 313 x.2005.02617.x。
Clough SJ, Bent AF:花浸渍:农杆菌介导的转化的简化方法拟南芥.植物学报,1998,16:735-743。10.1046 / j.1365 - 313 x.1998.00343.x。
转录因子稳定性的研究。方法中华分子生物学杂志2011,754:219-234。10.1007 / 978 - 1 - 61779 - 154 - 3 _12。
Graan T, Ort DR:菠菜叶绿体中P700快速电子供体的定量、功能质体醌池和光系统的比例。中国生物医学工程学报,2004,29(3):354 - 354。
Harding EW, Tang W, Nichols KW, Fernandez DE, Perry SE:通过本构表达增强胚性潜能的表达和维持AGAMOUS-Like 15.植物生理学报,2004,24(3):366 - 366。10.1104 / pp.103.023499。
Casamitjana-Martínez E, Hofhuis HF,许娟,刘春明,Heidstra R, Scheres B:根特异性CLE19过表达和sol1/2抑制子暗示在控制的clv样途径拟南芥根分生组织的维持。中华微生物学杂志,2003,13:1435-1441。10.1016 / s0960 - 9822(03) 00533 - 5。
确认
本研究得到了美国国家烟草研究所(NIFA/NRI(2005-35304-16043)、美国国家烟草研究所/HATCH (KY006073)国家科学基金会(0919991)和肯塔基烟草研究与发展中心的资助。我们感谢冈Atsuhiro提供arr1-1突变系和ABRC (Columbus, OH)ein2-1变种人和ipt-161转基因系在C24背景。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称没有任何经济利益的竞争。
作者的贡献
JK和JAS设计了实验装置,进行了大部分的实验和分析,并撰写了手稿。YL进行qPCR分析,分析花青素和CHS水平。SEP分析了SAM的尺寸。YL和SEP参与了稿件的编辑。所有作者都认可了这个手稿。
权利与权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
库雷帕,J.,李,Y.,佩里,S.E.et al。拟南芥响应调控因子1的磷酸化突变体异位表达促进了细胞分裂素响应表型的形成。植物生物学14日,28(2014)。https://doi.org/10.1186/1471-2229-14-28
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-28
关键字
- 拟南芥
- 细胞分裂素信号
- b型响应调节器
- Phosphomimic突变
- 构成性激素反应