摘要
背景
在单单元C模型中4.植物Bienertia sinuspersici在kranz型C中,叶绿体和核编码的光合酶的特征局限于束鞘或叶肉细胞4.叶,所有的发生在单个叶绿组织细胞内。细胞内的二形叶绿体和关键酶的分离在中央和周围的室允许C4.碳固定类似于NAD-苹果酶(NAD-ME)Kranz型物种。使用几种方法来研究二晶叶绿体分化B. Sinuspersici..
结果
共焦分析表明,中央室中含有含有丙酮酸,Pi Dikinease(PPDK)的外周叶片叶片(PCC),含有更多的光系统II蛋白质(CCC),含有更多的光系统II蛋白质(PCC),PI Dikinase(PPDK),一种类似于细胞类型特异性叶绿体的图案许多克兰兹型NAD-ME物种。使用含有各种长度的GFP融合构建体的瞬态表达分析B. Sinuspersici.Rubisco小亚基(RBCS.)基因和PPDK转运肽的导入结果表明,它们的导入并不特异于任何一种叶绿体类型。Immunolocalization显示,:特异性mRNA结合蛋白RLSB被选择性地定位于在CCCB. Sinuspersici.,以及在密切相关的Kranz种中含有rubisco的BS叶绿体Suaeda Taxifolia。使用氧化还原敏感型和不敏感型GFP进行荧光分析,并使用过氧化物酶指示剂3,3-二氨基联苯胺(DAB)进行比较染色,结果显示基质氧化还原电位存在差异,CCC比PCC具有更大的负电位。
结论
CCC RLSB定位和叶绿体氧化还原状态的差异都可能在转录后发挥作用:表达。
背景
C4.光合作用结合了两套不同的羧化反应,作为一种生化一氧化碳2泵,以提高CO的效率2核酮糖1,5二磷酸羧化酶加氧酶(Rubisco)的固定[1-3.].C的第一组4.反应开始于丙酮酸,Pi二激酶(PPDK)最初生成磷酸烯醇丙酮酸(PEP)。然后,PEP被用于磷酸烯醇丙酮酸羧化酶(PEPC)的羧化作用,介导大气CO的同化2进入c.4.酸(苹果酸或天冬氨酸)。第二组反应发生在C4.酸被运输到内化的含氧化物的细胞或隔室,随后通过NADP苹果酶(NADP-ME),NAD苹果酶(NAD-ME)或PEP羧基酶(PEPCK)脱羧,这取决于C4.物种。C4.光合作用通常是通过被称为“克兰兹解剖学”的双细胞系统进行的4.酸首先在叶肉(M)细胞中产生,然后转运到束鞘(BS)细胞中进行脱羧和CO的重新固定2二磷酸核酮糖羧化酶。C4.光合作用研究是理解二晶叶绿体形成的过程以及叶绿体彼此分化的程度,以便支持C.4.生物化学。
C4.分化,包括形态学和功能性二晶叶绿体的形成,在单子叶和二孔C的叶片发育过程中发生4.物种。全C的发展4.由于编码各种光合酶的基因的结构特征和表达模式在两种细胞类型之间发生了差异,能力从早期发育阶段发展到成熟阶段。不同植物叶绿体结构和功能分化的发育模式4.物种既有相似之处也有不同之处[4.].例如,在苋属hypochondriacus(NAD-ME类型eudicot)和玉米Rubisco最初存在于M和BS细胞的叶绿体中,在非c细胞中4.模式,直到发育线索或光信号导致其仅限于BS细胞的积累[5.-7.].M细胞和BS细胞的完全生化和结构分化以及特征性的二态性C4.在叶片形成期间最终确定叶绿体。除了在Rubisco积累中的两种叶绿体类型之间的差异之外,该过程的显着表现是在Grana开发中的分化,并且在成熟的叶子中相对的照片I(PS I)的分量与光束II(PS II)的相对水平[7.-10].NADP-ME种的BS叶绿体由于核编码PS II组分的耗尽而在基粒堆积中缺乏[11],而NAD-ME种的BS叶绿体比M叶绿体具有更多的基粒发育和PS II含量[9.那12].虽然认为紫花板分化是由M和BS细胞中的能量要求(ATP和NADPH)来调节,以支持C的形式4.,负责C4.- 分配的差异仍然是一个非常活跃的研究领域[2那13-16].
C细胞类型特异性差异的控制4.长期以来一直认为具有Kranz解剖学的物种主要是在不同M和BS细胞的细胞核内选择光合作用基因的相反的转录激活/失活。因此,当二晶叶绿体表演全C时令人惊讶4.在一些非常独特的C的单个绿组织细胞中发现了光合作用4.物种(见[17])。在7500摄氏度4.目前已知存在的物种[18),与Bienertia sinuspersici,在家庭chenopodiaceae中,只有四种已知的陆地物种中的一种,可以执行单细胞c4.[19那20.].Bienertia类似于Kranz C的功能4.物种,其二晶的叶绿体一起使用浓缩CO2在Rubisco的网站;然而,它通过它们在单个氯化细胞内的两种细胞质结构域之间的空间分离来实现这一点。生物化学,Bienertia被归类为nad-me type c4.,与C4.C中的酸4.周期中被称为中央室(CC)一个胞质域在线粒体中发生,其中所述含的Rubisco-叶绿体也位于[21那22].单细胞c4.因此,系统是独特的,因为只有一个核来转录编码在仅在一个细胞室中特别内积聚的光合蛋白质的基因,并且最特别地,在两个划分的叶绿体类型中仅为一个。因此,通过必要性地,转录后的方法是选择性积累这些蛋白质的产生,以开发C的二晶,分隔络合物化叶绿体。4.在这些植物中的功能。
Rubisco是一种异源十聚体,由相同数量的在叶绿体中转录和翻译的大亚基(rbcL)和在细胞核中转录、在细胞质中翻译并导入到叶绿体中的小亚基(RbcS)组成[23].如在某些kranz种类中观察到的,在单细胞c中4.物种Suaeda Aralocaspica和Bienertia cycloptera, Rubisco最初存在于两种叶绿体中,在发育早期[22那24].有许多研究探索Rubisco的组装,表明rbcL和RbcS亚基在叶绿体基质中积累的数量相等,任何一种肽的丢失都会导致其他亚基肽的减少[25].最近,已显示称为RLSB的RNA结合蛋白与单子叶和二孔C的Rubisco的Bs特异性定位相关联4.植物物种。RLSB被假设为:MRNA成熟和在C中的翻译3.和c4.植物 [26].Rubisco通过多种方式选择性地积累到叶绿体中Bienertia可以控制;例如选择性叶绿体核编码的蛋白质的靶向,如红细胞本身,伴侣蛋白例如Rubisco的相关作为Raf1的[27]或RLSB。其他机制可包括选择性转录或翻译:在CCC中,调节组装,选择性降解必要的组装伴侣,或这些机制的某些组合。
原位利用分离的叶绿体进行免疫定位和western blot研究表明,Rubisco在红叶成熟叶片的CCC中有选择性积累Bienertia[21那22].这些方法也显示PPDK在外周室(PC)内选择性地向其他叶绿体类型区隔。除了这些在这两个叶绿体之间选择性靶向的蛋白质,还有其他核编码蛋白质在这两种类型的叶绿体中具有生化作用,需要被双重靶向。这一组包括焦磷酸酶[在CCC中淀粉合成和PCC中丙酮酸生成磷酸烯醇丙酮酸(PEP)所需要的],以及C的还原相的酶3.周期(磷酸甘油酸激酶和甘油醛-P脱氢酶)[21].本研究的目的是研究植物叶绿体的二形性BienertiaRubisco和PPDK是两种不同类型的叶绿体所特有的酶,位于不同的结构域。具体来说,我们研究了rbc对CCC和PPDK对PCC的可能选择性靶向,通过使用包含不同长度的结构体RBCS.通过使用生物质和原生质体制转化,融合到GFP的转录物,以及PPDK的过渡肽Bienertia绿色组织细胞。将RLSB蛋白的细胞定位被确定为RBCL合成的另一种可能的控制机制。为了评估每种叶绿体类型的潜在控制机制的氧化还原状态,测量来自氧化还原敏感GFP(ROGFP2)的荧光,并且在活的有机体内过氧化物酶活性和过氧化氢(H2O.2)染色定量。我们讨论的证据,重叠调节过程可以作为决定形成和功能的二形叶绿体在这个单细胞C4.系统。
结果
绿色荧光蛋白表达分析
GFP构建概述.通过放置制造的GFP融合构建体集Bienertiac-DNA(除了AGPase结构[28])在GFP蛋白的n端(RbcS的3'UTR除外)。使用的结构和结果的列表总结在附加文件中1S1:表。简单地说,puc18 spGFP是一个缺乏靶向信号的阳性对照。PPDK结构体包含前180或273个蛋白编码核苷酸(PPDK-180 spGFP和PPDK 273 spGFP),而PPDK-CDS spGFP则包含整个PPDK编码序列(CDS)。RbcS结构包含三个中最丰富的前252或273个蛋白编码核苷酸(RbcS-252 spGFP和RbcS-273 spGFP)Bienertia RBCS.成绩单(29] (R. Sharpe,未发表),而RbcS-CDS spGFP拥有整个RbcS CDS。额外的RBCS.用含有整个的RBCS-F1 SPGFP构建体以各种组合添加UTR序列。包含整个的RBCS-FL SPGFP构建体Bienertia RBCS.成绩单。包括使用具有内含子(PSU RBCS-FL SPGFP)的超泛素启动子(PSU)的替代RBCS-FL SPGFP构建体并用ROGFP2蛋白重新将SPGFP蛋白质重新置于ROGFP2蛋白(RBCS-FL ROGFP2)。包含整个CD的构造BienertiaRLSB c-DNA在框架内融合到GFP蛋白的n端(RLSB CDS spGFP)。
生物转化。最初用生物学转化来检测GFP的表达和质体靶向性Bienertia叶与洋葱表皮细胞(见与其他文件基因枪法结果进行比较2那3.那4.那5.).在洋葱中,各种结构在表皮细胞中表达,并且在许多情况下观察到导入原质体。在Bienertia大多数构建体在氯中的细胞中表达;但是,只有在观察到叶绿体中只有进口(即,通过构造PPDK-180 SPGFP和RBCS-273 SPGFP,请参阅进口到PCC和CCC的证据,附加文件3.和4.:图S2和S3)。由于有限的发生的进口Bienertia利用生物体,为了进一步评估表达和使用这些构建体的靶向,使用原生质体制转化。
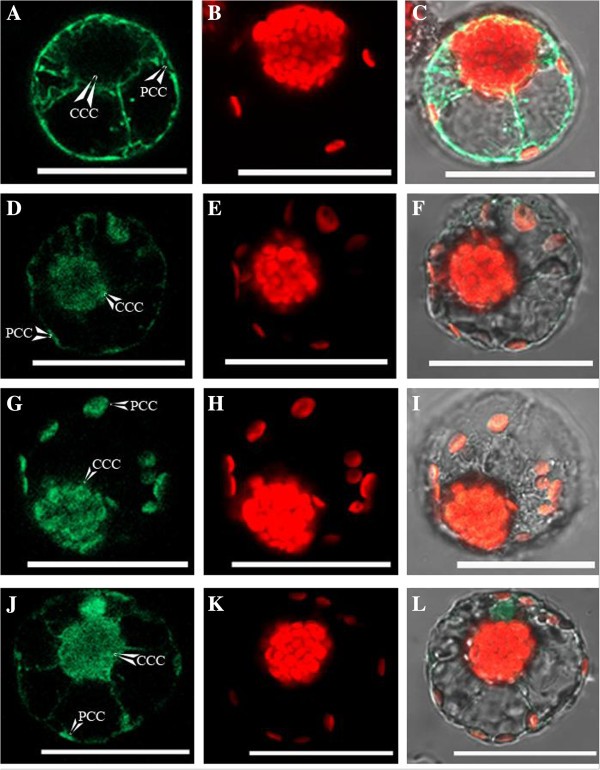
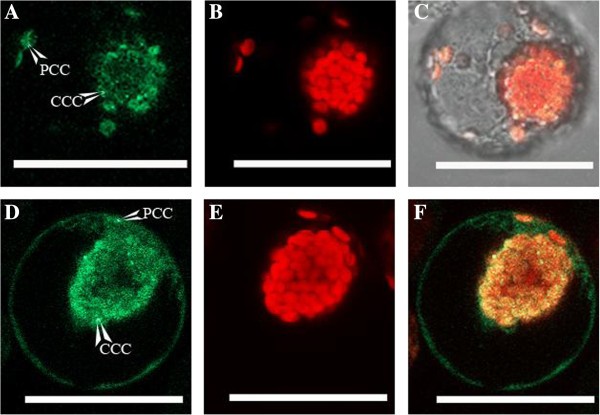
使用原生质体变换的GFP构建体的体积靶向。具有瞬态表达的结果概述Bienertia紫霉素原生质体显示出一致的高型进口,具有通过生物理处理(附加文件)洋葱发生的1:表S1)。所述的pUC18-spGFP阳性对照表明在整个细胞质中的GFP表达Bienertia,在叶绿体中没有观察到GFP荧光(图1,A-C),也与洋葱和洋葱的生物方法观察Bienertia.PPDK180-SPGFP构建体在PCC和CCC中显示出显着的GFP表达(图1D-F)。此外,RbcS273-spGFP结构在PCC和CCC中都产生了清晰可见的GFP表达(图)1,g-i)。PSU-RBCS全长-SPGFP构建体在PCC和CCC中显示出GFP表达,并在核内观察到一些GFP积累(图1(在某种程度上,GFP易位进入细胞核[30.])。结果RLSB-SPGFP构建体Bienertia由于GFP表达水平极低,原生质体不确定。未显示从PCC和CCC具有类似GFP荧光的构建体的定量测量。
由于GFP表达检测和靶向检测灵敏度高,且导入到任何一种叶绿体中都缺乏选择性,因此采用原生质体转化方法来测定二态叶绿体的相对氧化还原状态Bienertia.为此,利用与spGFP(氧化还原不敏感)或roGFP2(氧化还原敏感)报告蛋白连接的RbcS-FL构建的原生质体进行转化(图)2).共聚焦定量GFP荧光的代表性数据从二形叶绿体Bienertia原生质体显示在附加文件中6.:图S5。两种构建体,其仅在其附GFP蛋白的氧化还原敏感性不同,正确地靶向GFP两者叶绿体类型(图2比较分析两种叶绿体类型间的GFP荧光,发现spGFP蛋白在两种叶绿体类型间的荧光强度相似,而roGFP2蛋白在CCC内产生的GFP荧光强度高于PCC内。共聚焦显微镜对转化GFP荧光的定量研究综述Bienertia使用Lambda模式的原生质体,其量化来自多个位置的荧光强度,如表所示1.结果表明,使用氧化还原不敏感SPGFP蛋白的GFP荧光的平均CCC / PCC比为1.028±0.024,而使用氧化还原敏感rogfp2蛋白的两种叶绿体类型之间的GFP荧光的平均比为1.439±。005。rogfp2蛋白的荧光,当已知其环境的氧化还原潜力减少时,已知腐败时腐蚀,以488nm兴奋地减少[31].通过使荧光测量测量测量来确定两种叶绿体类型的精确中间点电位。然而,由于对系统的校准通过具有还原和氧化溶液的原生质体的额外洗涤来校准系统的要求,原生质体的脆性性质不适用于这种测量。
免疫组化
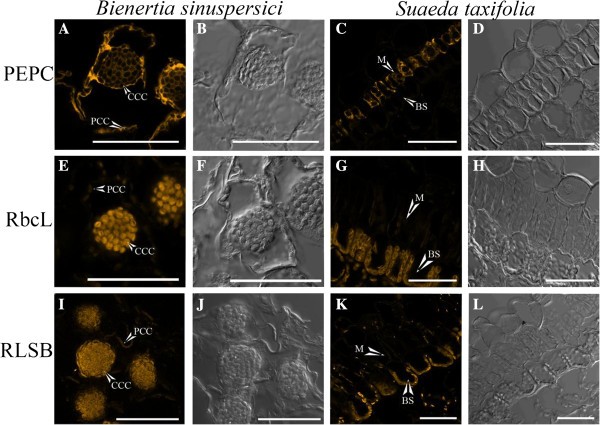
免疫定位法测定C4.-相关蛋白PEPC, rbcL和RLSB内的调节蛋白Bienertia叶chloroenchyma细胞,和,为了比较,在密切相关的克兰兹型物种S. Taxifolia.(数字3.).使用共聚焦显微镜检测来自Alexa Flul 546标记的二抗的荧光,与原发性抗血清反应。该分析证明Pepc如预期的是在整个细胞质中分布Bienertia并选择性地定位于M细胞S. Taxifolia.叶(图3.模拟)。rbcL表现出选择性定位Bienertia叶绿体,非常高的强度只发生在CCC内。相比之下,rbcL蛋白对BS叶绿体具有较高的特异性S. Taxifolia.(数字3., E-H),以克兰茨叶子的特征模式。最重要的是,调控RLSB蛋白,就像它被提议调控的rbcL蛋白一样,选择性地只定位于细胞的CCCBienertia绿色组织细胞。在与先前发现[26]的一致中,观察到RLSB积累对Kranz叶片的BS叶绿体具有高度特异性S. Taxifolia.(数字3.,I-L)。
Immunolocalization C4.单细胞类型中的蛋白质Bienertia和克兰兹类型Suaeda Taxifolia.Alexa Fluor 546标记的二抗的共聚焦显微镜检测,反应于所示的一抗,显示磷孔的位置烯醇丙酮酸羧化酶(PEPC广告),Rubisco大亚基(RBCL,E-H.)和rubisco大亚基mRNA结合蛋白(RLSB, I-L)Bienertia(a,b,e,f,i和j)和Suaeda Taxifolia(c,d,g,h,k和l).图片一种那C那E.那G那一世, 和K.是alexa fluro 546检测。图片B.那D.那F那H那j, 和L.是明亮的田野视图。CCC =中央隔室叶绿体,PCC =外周腔室叶绿体,M =叶片细胞,BS =束鞘细胞。秤条=50μm。
应该指出的是Bienertia绿色组织细胞中,rbcL基因和RLSB蛋白显示检测的非常轻微的水平PCC内,可能是由于非常低的水平的积累,或这些叶绿体内反应的可能的背景水平。两者合计,这些结果清楚地表明RLSB的强特异性定位至含的Rubisco-CCCBienertia叶绿体与BS细胞的叶绿体关系密切,但在结构上截然不同4.物种。
DAB染色测试CCC和PCC相对氧化还原状态bienertia
采用扫描电子显微镜(SEM)背向散射量化DAB颗粒的沉淀Bienertia组织被证明比光学显微镜或透射电子显微镜(TEM)图像(图像未显示)的重复性更准确。这可以归因于扫描电镜样品制备的有限处理要求,以及由于光学显微镜和透射电镜所需的切片和染色协议而降低了可变性。扫描电镜上的后向散射模式产生的图像与当前电子粒子的密度紧密对应。一个区域的电子越多,该区域在图像中就越亮。相反,在电子少的地方(即只有水存在的地方,如液泡),电子密度低,区域呈黑色。测试了不同的染色时间和光照强度,并使用维持细胞形态和优化的可视化/定量染色水平的条件进行分析。
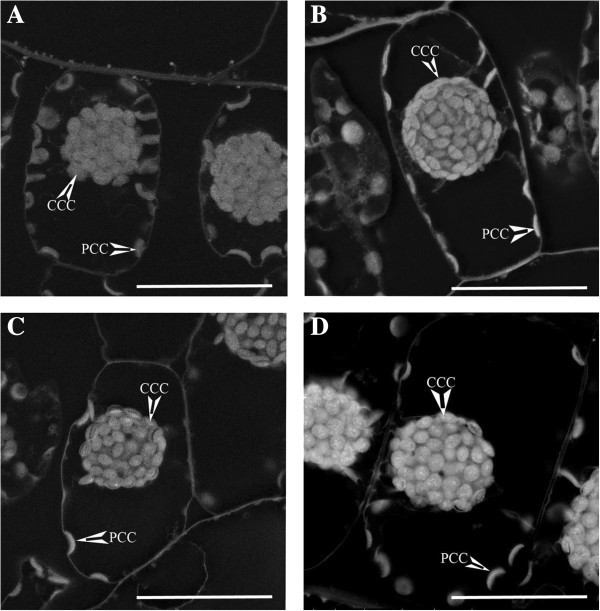
探讨H的相对稳态水平2O.2代在光的二态的叶绿体,Bienertia在100 PPFD(此低光强度用于避免损伤细胞)下,在DAB (H2O.2染色)与没有DAB(对照)。电子密度定量显示,在没有DAB(阴性对照)的情况下,CCC比PCC更亮,平均密度比为1.658±0.128(图)4.-一张桌子2).当DAB包含在染色反应中以检测H时2O.2production, the PCC became brighter relative to the CCC, with the average density ratio dropping to 1.265 ± 0.097 (Figure4.- b、表2).定量比较CCC与PCC综合密度比,H染色后颗粒密度比降低2O.2,这表明更DAB是在PCC沉淀比在CCC。这表明H的更高水平的2O.2相对于CCC,在这些稳态条件下,与DAB相互作用并析出DAB。
代表性图像来自SEM背向散射检测DAB染色Bienertia氯中的细胞(用于定量结果表明表2).图片一种是H的控制吗2O.2检测(包括DAB)。图片B.这是H的污渍吗2O.2,DAB被允许反应在活的有机体内生产H.2O.2.图片C是过氧化物酶活性的对照(没有H.2O.2加入)。图片D.是过氧化物酶活性的染色,其中H2O.2提供超过的。CCC =中央室叶绿体,PCC =外围室叶绿体。比例尺= 50 μm。
试验两种叶绿体以清除和减少H的能力差异2O.2,通过添加H2O.2到DAB染色解决方案。在没有h的情况下,切除切除的叶子被置于DAB染色溶液中2O.2(过氧化物酶控制,其中在活的有机体内H20.2是限制性的),或者在DAB染色溶液中,7毫米H.2O.2(过氧化物酶染色)加入。图像分析表明两种叶绿体类型与控制有类似的外观(H.2O.2-)过氧化物酶染色。在这一对照中,CCC仅比PCC略亮,平均密度比为1.196±0.058(图4.-C,表格2).当H2O.2被包含在染色中以检测过氧化物酶活性,CCC变得明显比PCC更明亮,使平均密度比升至1.965±0.239(图4.- d、表2).在仔细观察过氧化物酶染色图像时,与PCC或对照图像相比,CCC有更多可见的沉淀点。定量和比较CCC和PCC的综合密度比表明,过氧化物酶活性染色的密度比显著增加。结果表明,在稳定状态下,相对于PCC, CCC中有更多的过氧化物酶活性。
两种叶绿体类型间PSII含量的估算
定量测定叶绿体荧光是一种快速、有效的方法,可用于评价不同类型叶绿体中PSII含量的差异4.物种(32].将这种分析应用于Bienertia原生质体表明,与PCC相比,CCC具有更大的荧光强度强度(图5.a),表明在CCC中PSII含量较高。作为对照,同样的分析是使用一个新鲜的横截面玉米叶子,克兰兹型c4.已知在BS叶绿体中具有低psii含量的物种(图5.- b)。如预期的那样,在该物种中,含有PSII的M叶绿体的PSII相关荧光大于BS (PSII还原)叶绿体。
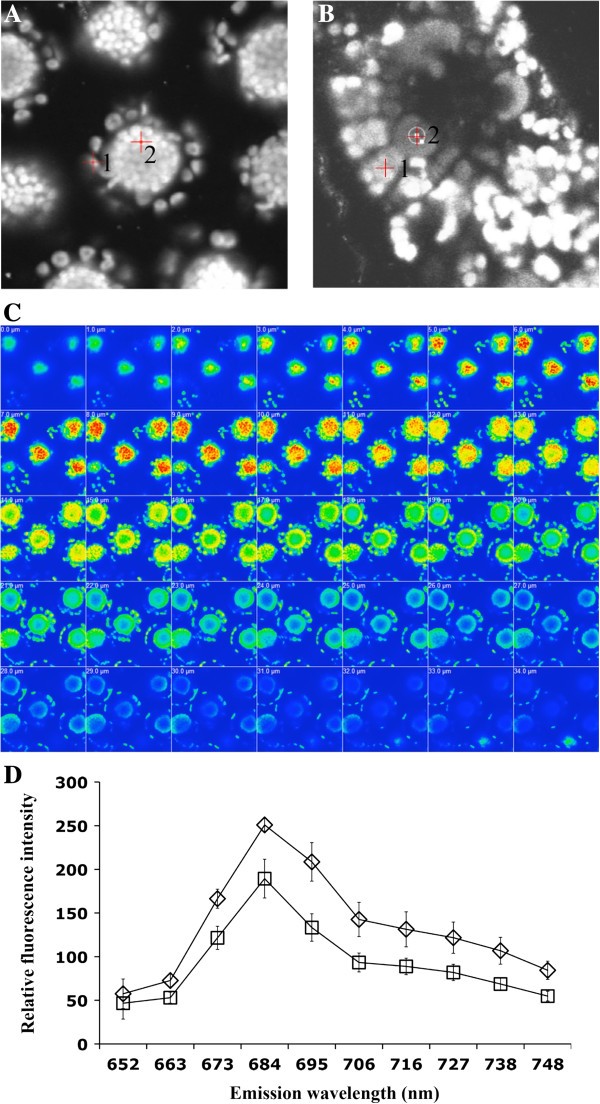
估计PSII内容Bienertia绿色组织细胞,利用共聚焦显微镜。用633nm的光激发细胞,以及图像中更亮的区域一种那B., 和C具有较大的荧光强度,对应于更PSII内容。一种)λ模式图像显示两种叶绿体类型的荧光Bienertia.将光标1置于一个外围叶绿体上,同时将光标两块放在一个中央室叶绿体上。b)λ模式图像显示两种叶绿体类型的荧光玉米.游标1放置在叶肉叶绿体上,游标2放置在束鞘上。C)z堆叠(串行图像)系列的热图Bienertia在1μm切片的原生质体,强度代表684nm的发射,使用633nm激发。D)两种类型的发射光谱的定量分析Bienertia叶绿体;方形是外围隔间的叶绿体,菱形是中央隔间的叶绿体。误差柱代表8种不同原生质体的标准差。
从整个完整的完整Z扫描Z扫描Bienertia原生质体如图所示5.-C,其中热信号的强度(最高)对应于684nm的荧光。在每个原生质体框架内,可以看出,从CCC发出的所有可检测荧光的强度比从PCC发射的强度要高得多。当在8种原生质体上平均时,与PCC相比,从CCC发出的PSII相关荧光有1.3倍,与PCC相比(图5.-D)。
讨论
光系统II在中心和外围叶绿体中的含量及其与C4.生物化学in.Bienertia
比较共焦定量是用于确定C的M和BS细胞中的相对ps II含量的建立技术4.物种(32那33].将这种方法应用于二晶叶绿体Bienertia表明,PSII的密度在CCC,这表明了用于除了所述PCC线性电子流更高的容量显着更高。这些相对量是可比较的,以在单电池C二形叶绿体的现有的定量分析4.Bienertia cycloptera,这被证明具有CCC肉凸形指数(贴覆的囊体膜的百分比)比PCC高1.5倍[34].这是具有NAD-ME生物化学的Kranz型物种的典型特征,有些物种在BS中叶绿体颗粒度比M细胞高2倍[9.那33].这些结果与NAD-ME型植物中相对于M叶绿体而言,BS叶绿体中PSII富集的一般评价一致。
在成熟细胞阶段观察到叶绿体超微结构分化Bienertia可能是逐步建立C4.叶本体在生物化学,因为在开发早期有两个叶绿体的类囊体膜[相差不大22].对于其他C也是如此4.种,不同叶绿体类型的颗粒指数的差异只有在发育后期才能观察到[35].在Kranz-型NAD-ME的成熟叶片中,物种C的唯一能量要求4.循环是每CO 2 ATP2交付给BS细胞。对于单细胞C.4.物种如Bienertia在PCC中,需要ATP来支持丙酮酸转化为PEP。因此,在CCC中有更大的能量需求(如在NAD-ME Kranz物种的BS叶绿体中),NADPH需要通过PSII依赖的电子运输产生来支持C3.循环 [4.].作为C.4.C4.PCC和CCC的生化学差异较大,PCC对NADPH的需求减少,CCC对NADPH的需求增加。在成熟叶片细胞中,PCC中NADPH利用率的降低可能会导致PSII活性衍生的电子的受体限制,导致PSII因单线态氧的生成而失活,并相应增加PSI生成ATP的循环电子流[36那37].这种类型的PSII含量的生化调节也在转基因水稻(a C3.植物)通过表达玉米NADP-ME中,导致基粒和传递活动的减少发展的叶绿体。这个建议被通过增加吸收和苹果酸的脱羧而引起NADP-ME在其产生还原功率从而减少需要经由PSII光合生产NADPH的叶绿体[38].这些研究以及这里提出的调查结果一起支持一种模型,其中本身可以成为能源产生的基本要求可能是调节PS I和PS II开发的决定因素。这种动态调节最终可以根据每种叶绿体类型的需要最终平衡两款光系统的生产/积累。
核编码蛋白选择性叶绿体积累的机制
独特的单细胞C4.系统的Bienertia与更典型的克兰兹种的双细胞系统有显著差异。必然地,这个系统主要是由转录后控制过程调控的,该过程实现酶在二态叶绿体中的选择性积累。最近,人们对该系统中不同的蛋白质定位提出了几种假设,包括选择性叶绿体蛋白导入、mRNA转运到特定区域进行翻译,以及/或蛋白导入后的选择性蛋白质水解[39].
本研究中使用了各种RBC和PPDK GFP融合构建体的分析,以测试选择性叶绿体进口。结果表明,两种叶绿体类型中的GFP摄取水平相似Bienertia氯化血细胞(图1和额外的文件3.和4.).在早期的研究中,也对红细胞进行了类似的观察,其中一个未定义的红细胞序列被证明可以直接将GFP导入到两种叶绿体中Bienertia原生质体(40].综上所述,在活的有机体内本前研究的生物化和原生质体分析清楚地表明PPDK或各种长度最丰富的RBCS蛋白的过渡肽能够引导至少一定程度的GFP融合摄取,这取决于所用的植物系统。然而,从这些构建体表达的蛋白质显示出没有任何一种选择性的证据Bienertia叶绿体的类型。GFP靶向缺乏选择性也可能表明,在选择性的叶绿体靶向中可能需要额外的序列信息,而这些序列信息没有包含在结构中。这可能包括额外的mRNA序列(内含子或更多的UTR),替代基因家族成员的情况下RBCS.或GFP CD的差分放置。还可以存在实验效果,例如天然肽的识别和进口差异与肽片段的差异,或者在原生质体中破坏的完整叶片中的调节。例如,在原生质体隔离和过夜孵育期间,选择性导入/靶向可能会破坏。然而,通过光学显微镜观察显示,维持两种细胞质结构域(这取决于细胞骨架的完整性[41])。
一种选择性靶向蛋白质的潜在机制Bienertia叶绿体细胞是mRNA结合蛋白(RBP)复合物促进的信使rna运输。而细胞质mrna通常与rbp相关联,以控制其稳定性或启动和维持游离核糖体上的翻译[42[还有一些RBP可以沿着细胞骨架在特定亚细胞结构域内的目的地移动选择的mRNA。作为一个例子,在植物细胞中的一些限制性商业惯例可以介导贩卖至内质网(ER)的限定区域。最研究的例子是奥司氏葡萄球菌核酸酶(Sn)RBP,其促进了肌肽长丝的促脯氨酸细丝的运动在水稻胚乳中的皮质沸器中[43].然而,迄今为止没有关于本地化核编码的光合成绩单的RBP的报告,例如RBCS.或C3.循环酶,到光合细胞的特定区域(即更接近叶绿体,以更有效地针对叶绿体)。
至少有一些地区RBCS.调节发生在mRNA UTR中。在水稻叶中,显示用于发生mRNA营业额,需要既有5'和3'UTRRBCS.展示 [44].在C4.植物玉米和奇妙的康德拉,在那里RBCS.基因上游的UTR或部分(1.0 kBZMRBCS&38 kb的CGRBCS.基因区域)足以赋予BS特异性RBC或β-葡糖醛酸酶积累[45-47].就其本身而言,是异种的5 '和3 ' utrRBCS.信使rna从苋菜,既定的表达F. Bidentis.β-葡萄糖醛酸酶融合的部分BS细胞特异性[45].总之,这些结果意味着在双细胞克兰茨系统中,具有特异性RBP的UTR的相互作用可能增强BS细胞中的翻译/稳定性,或者可能降低M细胞中的稳定性/翻译。需要进一步的实验来解决是否RBCS.细胞质中的调节类似于:调控叶绿体,即是否一个RBP,如叶绿体RLSB [26]可能能够在细胞质中与RBCS转录稳定性/翻译相互作用和中介。虽然这似乎是一个合理的机制,但没有RBC.已经鉴定了任何类型的mRNA相互作用蛋白。在这项研究中,增加了PSU内含子的上游RBCS.5'UTR,与PSU植物启动子一起没有改变二晶叶绿体的非选择性GFP荧光的结果(图1).因此,即使使用带有上游RNA序列和内含子的植物启动子,也没有证据表明转录介导的单细胞型分隔的选择性体内。
与我们的发现一致,最近的分析叶绿体外包膜(TOC)转位Bienertia利用各种针对TOC-GFP结构的叶绿体废话TOC159,废话TOC132,和废话TOC34抗体表明,叶绿体类型均外核编码的TOC蛋白与其他植物相似[40那48].目前对基质蛋白和TOC蛋白导入的了解表明,胞质靶向因子/伴侣在叶绿体定位中的主要作用是通过维持肽识别能力来提高靶向效率和摄取率[49那50].唯一被确定对基质进行适当分类所必需的因素是一种过境肽,它与基质HSP70伴侣和外包膜相互作用[49那51那52].叶绿体蛋白质进口的一个有趣方面是由氧化还原调节的TiC62蛋白发生的调节,这改变了其位置基于基质NADP+/ NADPH比率(53那54].kranz c没有报告4.调节在叶绿体进口水平上发生的物种。
综上所述,本文的研究结果,以及之前的研究结果,没有证据表明叶绿体导入机制、选择性信使rna运输或核编码光合信使rna的室选择性激活/翻译,具有直接作用的选择性蛋白质积累的二形叶绿体Bienertia.因此,C4.单细胞系统中的调控必须包括附加的调控过程,或独立作用,或与上述一种或多种机制协同作用。
Rubisco的合成,组装和选择性定位的相关性Bienertia二晶叶绿体
转录后调控(翻译和稳定性)是调控质体编码蛋白(如rbcL)的主要水平。与核编码的转录本相似,质体编码mrna的utr在其调控中起关键作用。许多研究表明,这种调控质体RNA代谢是通过与核编码的叶绿体rbp群相互作用而发生的。这些蛋白质分为几类,分子质量从38-60 kDa不等[55-58].其中一些已被证明可以在5'UTR组合psbA, psbC, 和:,以及其他可塑性转录本[56那57].对于许多这些蛋白质,它们的产生、结合或活性通常是由光或氧化还原电位决定的,例如在激活条件下与5 ' UTR结合可能会增强mRNA的翻译、加工或稳定性[58那59].
在…的情况下:MRNA,已经表明RBCL蛋白本身具有N-末端RNA结合结构域,其可以通过结合其自己的5'UTR来介绍自己的翻译逮捕作用[60].迄今为止,MRL1和RSLB是仅有的两个直接参与调控的核编码蛋白:通过与其5 '区相互作用的mRNA代谢[26那61].Rubisco正确组装所需的叶绿体调节因子的数量继续增加,RLSB和RAF 1 & 2是最近添加的[26那27].BSD2和RAF1已被鉴定为rbcL组装因子,它们是C4.植物 [27那62].在玉米,RAF1特异于BS叶绿体,而BSD2在M和BS叶绿体中局部地定位那对这些功能相关的蛋白质进行不同的调节作用。因此,Rubisco全酶的选择性积累在Bienertia可能涉及到两种情况的区隔选择性增加:mRNA结合蛋白或RBCL组装伴侣。这些机制不是排他性的,两者都可以共同努力,以实现成熟的差分鲁比克积累Bienertia叶细胞。
研究结果表明,RLSB对土壤中CCC具有较高的特异性Bienertia细胞,在这种相同的叶绿体中与RBCL共定,这明显不同于Pepc的细胞溶质定位(图3.).为rbcL基因和PEPC所示的细胞定位是一样的先前针对报告Bienertia[22那34].RLSB在含rubisco的叶绿体中的共定位为rbcL在这个单细胞系统中的选择性区室化合成提供了调控作用的证据。作为比较,RLSB还被发现专门定位于相关Kranz型含有rbcl的BS叶绿体S. Taxifolia.,同意其特定于BS的本地化,并在Kranz C中提出的监管作用4.物种Flaveria Bidenis.那玉米和Setaria冬青[26].RLSB的选择性本地化到CCCBienertia这表明玉米,该蛋白可能在转录后调控rbcL的合成,结合:以增强其在这些叶绿体中的翻译/稳定性。
和其他c一样4.蛋白在这个独特的单细胞系统中,负责RLSB在CCC内选择性积累的机制尚不清楚。可能性包括选择性进口到CCC,或者如果RLSB不能与目标结合,则可能在PCC中选择性降解RBC.L mRNA。当RLSB与GFP融合时,试图确定RLSB是否可以选择性地靶向CCC,这是不确定的Bienertia原生质体转化,由于该构建体的低水平的GFP表达。一些衣藻reinhardtii已显示负责RBCL翻译的蛋白质从中解离:5 ' UTR随氧化谷胱甘肽浓度的增加而变化;这些随后通过rbcL蛋白与它自己的mRNA结合而被取代[60].一个类似的过程有人建议在高等植物发生Populus deltoides.[63].如果发生这种自我调节BienertiaPCC,然后可能预期将始终存在RBCL蛋白的基础水平,作为防止其自己的翻译的一种方式。事实上,通过免疫循环化在PCC中检测到低水平的RBCL,尽管它是不确定的是否是自由大亚基,Rubisco全酶,或可能是由于原代抗体的非特异性相互作用(图3.,N. Koteyeva和E. Vozensskaya,未发表的观察)。
在尼科尼亚塔哈瓦姆和玉米之前的研究表明,在没有红细胞的情况下,rbcL通过未组装的rbcL与其编码的相互作用而受到翻译抑制:转录物[通过Epistasy(CES)进行控制],后期调节机制[25那64].如果C中存在CES4.植物,通过转型限制Rubisco组装的RBC的可用性(也许是Bienertia通过选择性叶绿体靶向),比RBCL的翻译将被压抑,从而阻碍了Rubisco组装。然而,GFP融合构建体具有不同长度的丰富RBCS.转录物不支持这一假设的选择性运输方面。将GFP融合到RBCS过渡肽的C末端,RBCS CD,甚至整个RBCS.成绩单(RBCS.3'UTR序列连接到GFP的C-末端),表明RBCS蛋白可以进口到两种叶绿体类型中,没有鉴定进口选择性(图1).这些结果与最近的分析一致玉米, rbcL在M细胞中的异位表达,单独或联合靶向叶绿体的核编码rbcL肽的表达,不会导致Rubisco在M细胞中的显著积累[64].综上所述,这些结果表明,选择性RbcS靶向,以及在一个叶绿体类型中无法组装Rubisco,本身并不负责Rubisco在叶绿体中的选择性区分隔Bienertia树叶。
已经显示出改变叶绿体内间质氧化还原状态影响:翻译以及Rubisco酶功能[65那66].还发现RBCL的合成与ROS生产,解毒和GSH / GSSG的比例相关的相关性[67那68].完整的Rubisco酶本身对H2O.2.低浓度导致酶失活;浓度增加可导致二级和三级结构的展开和丧失,最终导致蛋白酶敏感性增加[65那69].因此,两种叶绿体类型中的差分Rubisco积聚的另一个假设基于基质氧化还原条件。如果CCC与PCC相比具有较高的GSH / GSSG比率,则会发生这种情况,并且CCC具有较低的H.2O.2浓度和更大的排毒能力。基质的氧化还原状态的差异是通过观察结果支持的,该观察结果最直接反映GSH / GSSG的比例,在两者中改变了荧光Bienertia叶绿体类型。DAB染色的结果还表明PCC有更高的在活的有机体内H2O.2浓度,与具有更过氧化物酶活性的CCC。H的水平2O.2在叶绿体和GSH / GSSG的氧化还原状态取决于许多因素,包括用于线性电子流量的叶绿体的容量,NADPH对碳同化的需求,Mehller反应的程度(电子转移到PSI到O.2导致H20.2合成),以及清除H的能力2O.2使用抗坏血酸和谷胱甘肽的抗氧化剂。
在本研究中,负责在成熟的二晶叶绿体中选择性Rubisco积累的机制Bienertia结果表明,C4.生物化学。发展Bienertia叶子发生了脚步。在杨的两种细胞质结构域的开发期间BienertiaUrlenchyma,一些Rubisco最初存在于PCC和CCC中,而成熟的肺细胞仅在CCC中只有强烈的Rubisco积累[22].这些观察结果与较年轻的绿藻组织相吻合:转录本在两个叶绿体中都有表达,而在成熟的绿藻组织中转录本在CCC中有选择性地表达(N. Koteyeva和E. Voznesenskaya,未发表的结果)。这项研究的发现支持了一个模型,在这个模型中,RLSB的转录后调节活性,以及质体氧化还原状态的变化,可以协同作用来激活/稳定RBC.l MRNA以及CCC中的Rubisco。抑制/退化的PCC在PCC中会发生相反的效果RBC.L mRNA和Rubisco的不稳定将阻止其积累(见图中的模型细节)6.).在Bienertia、控制RBC.L翻译可能与增加的转录稳定性协同发生,可能是由RLSB介导的玉米[26].在这种情况下Bienertia细胞成熟,RLSB丰度可能变得逐渐变得更加叶绿体特异性,因此RBC.L mRNA及其编码蛋白在CCC中含量增加,而在PCC中含量减少,与光合电子传递和氧化还原状态的变化相互协调。在PCC氧化还原条件改变的情况下,rbcL可能结合:,并防止稳定性的RBPS(如MRL1和RLSB)的结合导致降低:记录。此外,高H2O.2在PCC中的浓度,可能会干扰Rubisco的组装或导致降解导致Rubisco的减少。
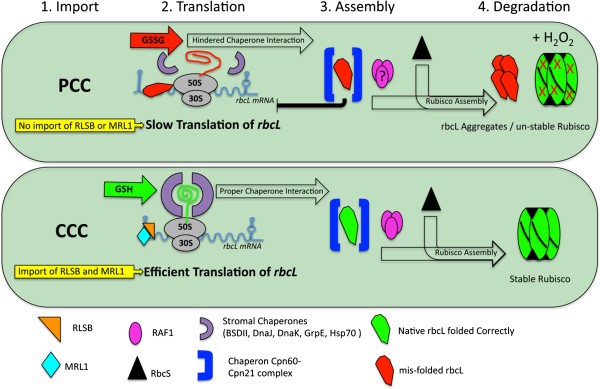
为的Rubisco变得如何选择性地定位于的中央室叶绿体(CCC)的监管假说Bienertia绿色组织细胞。监管点,(黄色框)是选择性瞄准或进口:mRNA结合蛋白(RBP),如RLSB,或Rubisco组装所需的其他蛋白。监管点二,就是翻译:,在减少条件下的CCC(GSH,Green Box)的地方:rbp会增加翻译:,而在高氧化谷胱甘肽条件下的外周室叶绿体(PCC) (GSSG,红框),:rbps不会绑定:,由于折叠不正确的RBCL结合:放缓的翻译。调控点三,是rbcL与基质伴侣蛋白的相互作用和Rubisco的组装,PCC中由于缺少像RAF1这样的伴侣蛋白或叶绿体的氧化还原状态,Rubisco的组装可能受到阻碍。调控点四,是Rubisco的稳定性或降解,这可能在PCC中由于H升高而增加2O.2浓度。数字改编自[23那27那66].
结论
这里提出的证据提供了背景,使我们能够在单细胞C的单个绿组织细胞中构建一个选择性Rubisco区室化的初始模型4.植物Bienertia(数字6.).这个模型解释了一个事实,即核编码基因的转录差异不能对单个细胞内的光合作用或调节蛋白的选择性区域化负责。该模型提出:转录后调控因子RLSB(以及可能其它),和二形叶绿体的差分氧化还原状态,一起工作以限制的Rubisco积累到只有两个叶绿体类型中的一种Bienertia绿色组织细胞。这个模型与许多研究的发现是一致的[27那70那71展示了Cu的选择性积累了C4.系统主要由转录后机制完成。在这个水平上对基因表达的控制是实现C的不同Rubisco积累模式的绝对要求4.光合作用比伦蒂利亚。
方法
植物材料
Bienertia sinuspersici(此后称为Bienertia)植物在受控环境室(Econair GC-16; Bio Chambers)中生长。在低光下开始幼苗或营养切割[100ppfd(μmolquanta m-2年代-1)温度和温度条件,每天/夜温度为25 /22˚C和14/10小时的光纤维。植物被移动到高光和温度条件(1000 ppfd,每天/夜间温度为35/25℃和14/10h的光周期),一旦存在几个分支。成熟的叶子(〜3厘米长)从2到6个月的植物常常用于生物化和原生质体制转化。
构建汇编
利用限制性内切酶将感兴趣的DNA片段亚克隆到35S:puc18-spGFP6载体中,构建融合蛋白Bamhi./NheIn端GFP添加和限制性内切酶XbaI/spei.的c端加成RBCS.3 '未翻译区域(UTR) (M. Tegeder,未发表数据)(New England BioLabs, Ipswich, MA)。DNA片段的RBCS., 和BADH根据制造方案(山景,CA)使用CloneTech Smarter PCR cDNA合成试剂盒制备的cDNA文库获得。这PPDK.片段从以前的c-DNA文库制备中扩增[29].使用基因特异性引物扩增DNA片段,所述基因特异性引物与CDS片段添加的限制酶切割位点,或用智能寡头底漆,具有一种基因特异性底漆(附加文件1:表S2)。使用T4 DNA连接酶(新英格兰Biolabs,Ipswich,MA)消化并将PCR片段消化并连接到PUC18载体中。使用Zymo研究质粒DNA Miniprep试剂盒(Irvine,Ca)纯化所有构建体的质粒DNA,并通过在转化之前通过测序(WSU测序核心)进行验证(构造中使用的DNA片段的序列如附加文件所示7.:图S6)。对于roGFP2的CDS插入pUC18载体,通过PCR从pRSETB载体扩增roGFP2片段[31,利用引物将限制性内切酶切位点NheI和XbaI添加到PCR片段(附加文件1:表S2)。用NHEI和XBAI消化PCR片段和PUC18载体,使用T4 DNA连接酶连接在一起,并通过测序验证。添加植物超级遍突素启动子(PSU)和PSU内含子,全长RBCS.-GFP片段首先剪切全长RBCS.-GFP片段Bamhi.和HindIII并连接到Tegeder载体656 (M. Tegeder,未发表数据)。随后,利用来自Tegeder载体655的SacII和BamHI酶将pSU启动子和内含子添加到载体656中(M. Tegeder,未发表数据)。由AGPase过渡肽融合到GFP的结构来源于[28],以检测AGPase大亚基的靶向性。
生物转化
将构建体引入洋葱表皮细胞,菠菜叶,和Bienertia根据[72和生产规程(Bio-Rad)。为Bienertia在轰击下,首先用钳子抓住叶子的顶端,然后用一个小塑料杵轻轻地挤压出绿色组织和内部的叶子细胞,这样就形成了一个没有表皮的叶子。用1 μm质粒包覆的金微载体轰击细胞,在距停止筛6 cm处使用1100 p.s.i.破裂盘。轰打后,表皮游离叶在缓冲液(meses - naoh, pH 5.8)中培养过夜,该缓冲液用甜菜碱进行渗透调节,以匹配叶的渗透性(用Wescor 5500蒸汽压渗透计测定)。将轰击过的洋葱表皮细胞和菠菜叶片放在湿润的滤纸上室温孵育过夜。
原生质体分离
使用类似于[的协议,从机械分离的氯中学细胞获得完整的原生质体。21]和[40].简而言之,在分离之前测量植物材料的叶片渗透压,随后将所有缓冲剂渗透地调节到测量值。使用剃刀叶片,在光周期的早期除去大约150个成熟的叶子(长于1cm)。使用电动机和杵将氯化血细胞轻轻地压出8ml原生质体缓冲液(Pb)(5mm Mes-NaOH,pH 5.8,10mM CaCl2,0.7米蔗糖,1%葡聚糖和匹配的甘氨酸甜菜碱浓度)。将分离的细胞通过具有1mm孔径的尼龙网过滤,以去除大叶片颗粒。离心后通过从15mL管的顶部除去细胞(5分钟,在Damon IEC HN-Sii离心机中的3.5g)中除去细胞,用Pb洗涤细胞两次。将1ml细胞与1ml消化缓冲液混合(Pb加2%[w / V] umizyme c [shin-nihon chemical],0.25%[w / v] macerase [calbiochem]和匹配甘氨酸甜菜碱浓度)一个2毫升圆底离心管。在65rpm的65rpm下在65℃下在35℃下在35℃下在35℃下孵育40分钟,从100W电灯泡中照射,得到原生质体。将酶/细胞混合物在台式离心机中以100g离心2分钟,并收集原生质体的浮体并用Pb洗涤两次。
原生质体转化
最初使用的程序是根据[73],随后使用[40].简而言之,在W5溶液(5mM MES-NaOH,pH 5.8,154mM NaCl,125mM CaCl,125mM CaCl,在冰上孵育分离的原生质盒30分钟。2和5毫米氯化钾)。约1.5 × 104.将原生质体重悬于冷却 - 原生质体缓冲液(5mM MES-NaOH pH 5.8和匹配甘氨酸甜菜碱浓度)中并与5μg质粒DNA混合。将原生质体/ DNA混合物用PEG(Sigma-Aldrich,St.Louis,Mo,USA)溶液(Pb中40%[W / V])混合,以在室温下引发5分钟的转染。将转染原生质体与5体积的原生质体缓冲液混合,在15g以15g离心1分悬浮在100μl原生质体缓冲液中,随后在25℃下培养过夜,光强度为25μmolm-2年代-1.
蛋白免疫原位定位
制备组织并根据[35].叶样品Bienertia和S. Eltonica.在FAA(50%乙醇,5%冰醋酸,10%福尔马林)固定液中室温过夜。样品用增加浓度的乙醇脱水,用CitriSolv洗涤,并嵌入Paraplast Plus中。石蜡包埋的样品使用旋转切片机切片(厚度约7.5 μm),安装在聚l -赖氨酸涂层的载玻片上(电子显微镜科学,PA),并在室温下干燥过夜。用CitriSolv脱烯烃后,再用乙醇系列复水,用H2o两次。用PBS缓冲液洗涤载玻片两次,随后在室温下用山羊血清孵育30分钟。用含有0.1%BSA的PBS缓冲液洗涤载玻片两次。将样品与稀释抗体一起温育,用于Pepc和Rbcl,或用于RLSB的过夜,在含有0.1%BSA的PBS缓冲液中(Pepc稀释1:500;来源[6.],RBCL被稀释1:1000;来源 [74],RLSB被稀释1:250;来源 [26].载玻片用含0.1% BSA的PBS缓冲液洗涤3次,用Alexafluor 546结合的二抗(Invitrogen, Grand Island, NY)孵育1小时,用含0.1% BSA的PBS缓冲液1:400稀释。样品在含0.1% BSA的PBS缓冲液中冲洗三次,随后在PBS缓冲液中冲洗三次。载玻片用矢量防护板(Vector Laboratories, CA)安装,用盖片和指甲油密封,然后在Ziess 710LSM共聚焦显微镜(成像设备,布法罗大学生物科学系)上显示。
共聚焦显微镜
PSII荧光的定量-此程序改编自[33].使用激光扫描显微镜LSM 510反转(Carl Zeiss,Oberkochen,Germany)进行新鲜原生质体的显微镜。叶绿素自发荧光的激发波长是来自HENE激光的544nm,并且为图像捕获的发射波长是654nm(Carl Zeiss)的长带通滤波器。通过在帧模式下平均8测量来获得图像。在这种模式下,重复扫描帧,并且信号平均。为了量化来自中央和周边隔室的单个叶绿体上叶绿素荧光的相对强度,使用λ模式。
绿色荧光蛋白表达分析-使用Zeiss 510 LSM在覆盖玻片上对大约100 μl的原生质体进行成像。采用63×水浸透镜,以1024 × 1024的数字分辨率,每隔1 μm获取序列Z-stack图像。叶绿素自荧光激发波长为544 nm,图像捕捉到的发射波长为654 nm的长波段通滤波器。用488 nm的波长激发GFP,在505的波段路径检测到发射-530海里。所有图像都使用adobephotoshopcs5 (Adobe Systems Incorporated, Seattle, USA)进行进一步处理和合成。所有实验至少重复三次,结果相似。对于表达的定性分析,lambda模式用于评估从每个转化的GFP荧光强度Bienertia原生质盒。使用488nm的激发波长获得荧光强度值,并在513nm的波长下检测发射。在分析的每种细胞中,测定GFP荧光强度(CCC / PCC)与单个叶绿体的测量的比率。比率在量化细胞的数量上进行平均值,并且所呈现的结果来自7个生物学重复。使用STASTACTA 7软件(Statsoft Inc.,Tulsa,OK,USA)使用独立的T检验进行统计分析。
DAB染色
成熟的叶子用超级锋利的刀片切成3-4毫米的薄片。将叶片切片放入玻璃瓶中染色。四个污渍(H2O.2控制、H2O.2使用在25℃下在25℃下进行的Sigma Fast 3,3' - 二氨基苯甲酰(DAB)片剂(Sigma Aldrich,St.Louis Mo)进行检测,过氧化物酶对照和过氧化物酶检测。将片剂溶解在含有甘氨酸甜菜碱浓度的水中,其渗透地匹配叶子(DAB 0.7mg ml-1, 7毫米H2O.2,60 mm tris缓冲液pH = 7.5)。用于检测H的产生2O.2将组织在100 ppfd下孵育4小时(对照没有DAB)。对于过氧化物酶检测,在DAB存在下孵育叶片45分钟,加入7毫米H.2O.2低于10 ppfd(控制没有h2O.2).染色后,将叶片固定在[75].在嵌入切割叶面的平面后,切断了Reichert Ultracut R UltramicRotome(Reichert-Jung GmbH,Heidelberg,德国)。将样品超胶(原始超级胶水)在铝样品安装(TED PELLE)上,并在高真空模式下在30kV加速电压下使用背散射检测器进行成像,使用Quanta 200 F环境场发射枪扫描电子显微镜(费用;现场排放工具)。使用图像J软件在等数量的PC和CC上使用图像J软件进行图像量化,通常根据存在的PC的数量为每个电池为5-7个叶绿体。每次重复量化3个细胞,具有两个技术复制,并定量两个生物学复制。使用STASTACTA 7软件(Statsoft Inc.,Tulsa,OK,USA)使用独立的T检验完成统计分析。
缩写
- AMP:
-
腺苷一磷酸盐
- ATP:
-
的腺苷三磷酸
- BS:
-
维管束鞘细胞
- CC:
-
中央室
- CCC:
-
中央室叶绿体
- cd:
-
编码序列
- CES上:
-
通过合成的前叙述控制
- 轻拍:
-
3,3-二氨基苯胺
- M:
-
叶肉细胞
- NAD-ME:
-
NAD-苹果酶
- 铅:
-
原生质体缓冲器
- PC:
-
周边室
- PCC:
-
外周腔室叶绿体
- PEP:
-
磷丙酮酸
- PEPC:
-
磷酸酞甲酚羧化酶
- 皮:
-
正磷酸盐
- PPDK:
-
丙酮酸,πdikinase
- PPFD:
-
光合光子通量密度,μmol量子m-2年代-1
- PPi:
-
焦磷酸
- PS I:
-
照相我
- PS II:
-
光系统II
- ::
-
Rubisco大亚基mRNA
- ::
-
Rubisco大亚基蛋白
- 红细胞表面:
-
Rubisco小亚基mRNA
- 红细胞表面:
-
Rubisco小亚基蛋白
- RLSB:
-
:RNA S1结合结构域蛋白质
- 二磷酸核酮糖羧化酶:
-
二磷酸核酮糖羧化加氧酶
- TRX:
-
硫氧还蛋白。
参考文献
- 1.
von Caemmerer S, Furbank RT: The C4.途径:高效的CO2泵。Photosynth Res。2003,77:191-207。10.1023 /答:1025830019591。
- 2.
Sage RF, Sage TL, Kocacinar F:光呼吸与C4.光合作用。Annu Rev植物植物植物Mol Biol。2012,63:19-47。10.1146 / annurev-arplant-042811-105511。
- 3.
Edwards G,Walker D:C3,C4:机制和细胞和环保调整,光合作用。伦敦:Blackwell科学出版物;1983年。
- 4.
C4光合作用:Kranz形成和陆生植物的单细胞C4。C4光合作用及相关的co2浓缩机制。光合作用和呼吸作用的研究进展。体积32。Raghavendra AS, Sage RF编辑。荷兰:SpringerDordrecht;2011:29 - 61。
- 5.
Langdale Ja:C4.循环:C的过去、现在和未来研究4.光合作用。acta botanica sinica, 2011, 32(6): 693 - 698。10.1105 / tpc.111.092098。
- 6.
Wang J-L, Long JJ, Hotchkiss T, Berry4.光环和深色的苋菜中的光合基因表达。植物理性。1993,102:1085-1093。
- 7.
马吉兰·W, Friso G, Ponnala L, Connolly B, Huang M, Reidel E, Zhang C, Asakura Y, Bhuiyan NH, Sun Q, et al .: C4.玉米叶片发育和分化的显微和定量蛋白质组学研究。acta botanica sinica(云南植物研究),2010,22(4):489 - 494。10.1105 / tpc.110.079764。
- 8.
叶肉原生质体和不同类型叶肉鞘细胞的光合作用4.植物。III。荧光发射光谱,延迟发光和P700含量。z pflanzenphysiol。1974,74:275-291。
- 9.
Ueno O,Yoshimura Y,Sentoku n:在C中的一些酶的活动变异4.草。Ann Bot。2005年,96:863-869。10.1093 / AOB / mci238。
- 10。
黄敏,孙强,黄敏:玉米管束鞘和叶肉叶绿体代谢途径、蛋白质表达和体内平衡机制的重建:基于玉米基因组组装的大规模定量蛋白质组学研究。植物营养与肥料学报。2010,27(5):719 - 724。
- 11.
光系统II水分分解复合物10- kda、16- kda和23-kDa外周组分在双子叶植物C的叶肉和束鞘叶绿体中的差异积累4.植物Flaveria Trinervia(Spreng。)C. Mohr Planta。1992,186:304-312。
- 12.
作者简介:王志刚,男,博士,主要研究方向为植物叶片和子叶的叶绿体结构和酶区系。中国生物医学工程学报,1999,30(4):427 - 434。
- 13.
Hibberd JM,CoVShoff S:C需要C的基因表达4.光合作用。Annu Rev植物植物植物Mol Biol。2010,61:181-207。10.1146 / Annurev-Arplant-042809-112238。
- 14.
威廉姆斯BP,奥布里S,Hibberd JM:基因的分子进化招募为C4.光合作用。趋势植物SCI。2012,17:213-220。10.1016 / j.tplants.2012.01.008。
- 15.
Schulze S, Mallmann J, Burscheidt J, Koczor M, Streubel M, Bauwe H, Gowik U, Westhoff P: C4.光合作用属Flaveria:建立光致潮流的公司2泵。植物细胞。2013,25:2522-2535。10.1105 / TPC.113.114520。
- 16.
APM:玉米叶片发育梯度的系统分析重新定义了当前的C4.模型,并为监管提供候选者。acta botanica sinica, 2011, 32(4): 489 - 494。10.1105 / tpc.111.090324。
- 17.
Edwards Ge,Franceschi VR,Voznesskaya EV:单细胞C.4.光合作用与双电池(Kranz)范式。Annu Rev植物植物植物Mol Biol。2004年,55:173-196。10.1146 / annurev.arplant.55.031903.141725。
- 18.
鼠尾草RF,克里斯廷P-A,爱德华兹EJ:在C4.地球的植物谱系。中国生物医学工程学报,2011,32(6):691 - 698。10.1093 / jxb / err048。
- 19.
Akhani H, Chatrenoor T, Dehghani M, Khoshravesh R, Mahdavi P, Matinzadeh Z:一新种Bienertia产于伊朗盐沙漠的藜科植物:该属的第三种和第4种陆地藜科植物的发现4.没有克兰兹解剖学的植物。植物生物系统 - 一个处理植物生物学各个方面的国际期刊:官方博纳尼亚伊利亚尼亚州的官方期刊。2012年。
- 20。
Freitag H,Stichler W:一种卓越的新叶片类型,具有异常的Chenopodiaceae的中央亚洲属的光合组织。植物BIOL。2000,2:154-160。10.1055 / s-2000-9462。
- 21.
优惠曼S,okita TW,Edwards Ge:解决C的隔间和功能4.C4.物种Bienertia sinuspersici.植物营养与肥料学报,2011,29(4):429 - 434。10.1104 / pp.110.170381。
- 22.
Voznesenskaya EV, Koteyeva NK, Chuong SDX, Akhani H, Edwards GE, Franceschi VR:单细胞C的细胞分化和生化特征4.叶片发展中的综合征Bienertia cycloptera(藜科)。中国生物医学工程学报,2005,31(4):489 - 494。
- 23.
Whitney Sm,Houtz RL,Alonso H:推进我们对工程师自然的合作的理解和能力2截存酶,Rubisco的。植物理性。2011,155:27-35。10.1104 / pp.110.164814。
- 24.
Voznesskaya EV,Edwards Ge,Kiirats O,Artyusheva,例如FranceChi VR:在单细胞C中的生化专业化和细胞器分配的开发4.叶状系统Borszczowia aralocaspica(藜科)。我是J机器人。2003,90:1669-1680。10.3732 / AJB.90.12.1669。
- 25。
WOSTRIKOFF K,Stern D:Rubisco大亚基翻译是响应于烟草叶绿体中的装配状态而自动加工。PROC NATL ACAD SCI。2007,104:6466-6471。10.1073 / PNAS.0610586104。
- 26。
Bowman Sm,Patel M,Yerrametty P,Mure Cm,Zielinski Am,Bruenn Ja,Berry Jo:一种新的RNA结合蛋白影响:基因表达,并特异于管束鞘叶绿体4.植物。BMC植物BIOL。2013,13:138-162。10.1186 / 1471-2229-13-138。
- 27。
Feiz L,Williams-Carrier R,Wostrikoff K,Belcher S,Barkan A,Stern DB:玉米的全酶组装需要核糖瘤组件所需的核酸胺 - 1,5-双磷酸羧基酶/氧气累积因子。植物细胞。2012,24:3435-3446。10.1105 / TPC.112.102012。
- 28。
Choi S-B,Kim K-H,Kavakli Ih,Lee S-K,okita Tw:油植物中ADP-葡萄糖酸化酶的转录表达特征和亚细胞定位Perilla frutescens..植物细胞生理学。2001年,42:146-153。10.1093 / PCP / pce019。
- 29。
Park J,Okita TW,Edwards Ge:非克兰斯C隔离光合细胞的表达分析和蛋白质组学分析4.物种Bienertia sinuspersici.植物生态学报。2010,37:1-13。10.1071 / FP09074。
- 30.
关键词:增强型绿色荧光蛋白同源聚合物核定位生物化学。2007,368:95-99。10.1016 / j.ab.2007.05.025。
- 31。
Hanson GT,Aggeler R,Oglesbee D,Cannon M,Capaldi Ra,Tsien Ry,Remington SJ:研究用氧化还原敏感的绿色荧光蛋白指示剂的线粒体氧化还原电位。J Biol Chem。2004,279:13044-13053。
- 32。
Furbank RT,Von Caemmerer S,Sheehy J,Edwards G:C4.水稻:植物表型学的挑战。植物营养与肥料学报。2009,36:845-856。10.1071 / FP09185。
- 33。
Pfundel E, Neubohn B:评价C .叶片光系统I和II的分布4.植物使用共聚焦激光扫描显微镜。植物细胞环境。1999年,22:1569-1577。10.1046 / J.1365-3040.19999.00521.x。
- 34。
Voznesenskaya EV, Franceschi VR, Kiirats O, Artyusheva EG, Freitag H, Edwards GE: C的证明4.没有Kranz解剖学的光合作用Bienertia cycloptera(藜科)。植物学报,2002,31:649-662。10.1046 / j.1365 - 313 x.2002.01385.x。
- 35。
Koteyeva NK,Voznesskaya Ev,Berry Jo,Chuong Sdx,FrancesChi VR,Edwards Ge:开发C的结构和生化特征4.两种类型的克兰茨解剖学中的光合作用碱蓬(家庭Chenopodiaeae)。中国生物医学工程学报。2011,32(4):457 - 461。10.1093 / jxb / err021。
- 36.
门廊CH, Shigeru S:了解氧化应激和抗氧化功能增强光合作用。植物营养与肥料学报,2011,29(4):531 - 534。10.1104 / pp.110.166181。
- 37.
Krieger-Liszkay A, Fufezan C, Trebst A:光系统II的单线态产氧及其保护机制。中国科学院影像科学与光化学研究所。10.1007 / s11120 - 008 - 9349 - 3。
- 38.
Takeuchi Y, Akagi H, Kamasawa N, Osumi M, Honda H:转基因水稻植株中表达高水平玉米nadp依赖苹果酶的叶绿体异常。植物营养学报。2000,21(2):265-274。10.1007 / s004250000282。
- 39.
优惠曼德,okita Tw,Edwards Ge:单细胞c如何4.种形成二形叶绿体?。植物学报。2011,6:762-765。10.4161 / psb.6.5.15426。
- 40。
肺S-C,yanagisawa m,chuong sdx:单细胞c中的原生质体隔离和瞬态基因表达4.物种,Bienertia sinuspersici.植物细胞批准。2010,30:473-484。
- 41。
Chuong SDX, Franceschi VR, Edwards GE:细胞骨架维持单细胞C所需的细胞器分配4.藜古氏菌物种的光合作用。植物细胞。2006,18:2207-2223。10.1105 / TPC.105.036186。
- 42。
杨志强,王俊涛,王志强,等:细胞质核蛋白复合物的研究进展。植物科学进展。2009,14:443-454。10.1016 / j.tplants.2009.05.004。
- 43。
Washida H,Sugino A,Doroshenk Ka,Satoh-Cruz M,Nagamine A,Katsube-Tanaka T,Ogawa M,Kumamaru T,Satoh H,Okita TW:有效的运输和包装需要针对特定ER子域的RNAα-球蛋白在发展水稻胚乳中蛋白质储液。工厂J. 2012,70:471-479。10.1111 / J.1365-313x.2011.04880.x。
- 44。
Park S-H, Chung PJ, Juntawong P, Bailey-Serres J, Kim YS, Jung H, Bang SW, Kim Y-K, Choi YD, Kim J-K: Posttranscriptional control of photosynthetic mRNA decay under stress conditions requires 3′ and 5′ untranslated regions and correlates with differential polysome association in rice. Plant Physiol. 2012, 159: 1111-1124. 10.1104/pp.112.194928.
- 45.
Patel M,Coryy Ac,Yin L-P,Ali S,Taylor Wc,Berry Jo:来自C的未转换地区4.Amanth AHRBCS1 MRNAS在转基因C中赋予翻译增强和优先束鞘细胞表达4.Flaveria bidentis。植物营养与肥料学报。2004,31(4):457 - 461。10.1104 / pp.104.051508。
- 46.
Newell Ca,Brown NJ,Liu Z,Pflug A,Gowik U,Westhoff P,Hibberd JM:农杆菌肿瘤术- 介导的转型奇妙的康德拉L, C4.与之密切相关的二榫拟南芥蒂利亚纳.J Exp Bot。2010,61:1311-1319。10.1093 / JXB / ERQ009。
- 47.
许T,赛尔男,祖奇P,Helentjaris T,Bogorad L:TRM1,一个YY1状的抑制rbcS-m3玉米叶肉细胞的表达。中国科学(d辑:地球科学),2001,23(6):591 - 598。10.1073 / pnas.041610098。
- 48.
肺S-C,Chuong SDX:C末端的过渡肽样分类信号指示Bienertia sinuspersici前蛋白受体Toc159叶绿体外膜。植物细胞。2012,24:1560至1578年。10.1105 / tpc.112.096248。
- 49.
Kriechbaumer V,Abell BM:叶绿体包膜蛋白靶向保真度与双细胞器测定中的细胞溶质组分无关。边疆植物科学。2012,3:1-11。
- 50.
Chotewutmontri P,Reddick Le,McWilliams Dr,Campbell Im,Bruce BD:预蛋白结合和易位过程中的差分过渡肽识别到开花植物塑料中。植物细胞。2012,24:3040-3059。10.1105 / TPC.112.098327。
- 51.
核编码蛋白在植物叶绿体中的靶向作用。新植物学报,2008,33(6):513 - 514。10.1111 / j.1469-8137.2008.02452.x。
- 52.
H-M L,Chiu C-C:蛋白质输送到叶绿体中。Annu Rev植物植物植物Mol Biol。2010,61:157-180。10.1146 / Annurev-Arplant-042809-112222。
- 53.
Stengel A,Benz PJ,Buchanan BB,Soll J,Bolter B:通过TOC和TIC复合物进口到叶绿体中的预蛋白质被氧化还原信号调节Pisum一.莫尔植物。2009,2:1181-1197。10.1093 / MP / SSP043。
- 54.
Stengel A,Benz P,Balsera M,Soll J,Bolter B:TiC62氧化还原氧化杆状音调组成和动力学。J Biol Chem。2008,283:6656-6667。10.1074 / JBC.M706719200。
- 55。
Barnes D, Cohen A, Bruick RK, Kantardjieff K, Fowler S, Efuet E, Mayfield SP:一种与叶绿体5 '非翻译区域相关的新型RNA结合蛋白的鉴定和特性psbAmRNA。生物化学。2004,43:8541-8550。10.1021 / bi035909j。
- 56。
McCormac DJ,绞合H,王阶,Gollnick PD,浆果JO:光相关联,并且处理依赖性蛋白在C的叶绿体结合至5'rbcL基因mRNA的区域4.植物。J Biol Chem。2001,276:3476-3483。10.1074 / JBC.M009236200。
- 57。
Zerges W,Rochaiz J-D:低密度膜与RNA结合蛋白和叶片中的叶片中的囊体相关联衣藻reinhardtii.中国生物医学工程杂志。1998,14:101-110。10.1083 / jcb.140.1.101。
- 58。
Berry Jo,Yerrametty P,Zielinski Am,Mure CM:高等植物中的光合基因表达。Photosynth Res。2013,117:91-120。10.1007 / s11120-013-9880-8。
- 59。
质体基因的表达:在原核生物支架上的细胞器特异性修饰。植物营养与肥料学报。2011,32(4):429 - 434。10.1104 / pp.110.171231。
- 60。
Yosef I, Irihimovitch V, Knopf JA, Cohen I, Orr-Dahan I, Nahum E, Keasar C, Shapira M:核酮糖-1,5-二磷酸羧化酶/加氧酶大亚基的RNA结合活性衣藻reinhardtii.中国生物医学工程学报。2004,27(3):457 - 461。
- 61。
Johnson X, Wostrikoff K, Finzaai G, Kuras R, Schwarz C, Bujaldon S, Nickelsen J, Stern DB, Woollman F-A, Vallon O: MRL1,一种保守的五五肽重复蛋白,是稳定的必需:信使rna在衣藻和Arabidospsis.acta botanica sinica(云南植物研究),2010,22(4):489 - 494。10.1105 / tpc.109.066266。
- 62。
Brutnell TP,Sawers RJH,Mant A,Langdale JA:捆绑鞘缺陷2,转换后调节所需的新蛋白质:玉米的基因。植物细胞。1999年,11:849-864。
- 63。
Mehrotra S,Trivedi Pk,Sethuraman A,Mehrotra R::基因Populus deltoides.有多个转录本并受氧化还原调控体外.J植物理性。2011,168:466-473。10.1016 / J.JPLPH.2010.08.001。
- 64。
Wostrikoff K, Clark A, Sato S, Clemente T, Stern D: Rubisco亚基在玉米叶肉细胞中的异位表达并不克服细胞类型特异性积累的障碍。植物营养与肥料学报。2012,32(4):429 - 434。10.1104 / pp.112.195677。
- 65。
莫雷诺Ĵ,加西亚 - Murria MJ,马林-纳瓦罗Y:通过其半胱氨酸残基rubisco的构象和活性的氧化还原调节。J Exp Bot。2008年,59:1605至1614年。
- 66。
科恩我,萨皮尔Y,夏皮拉L:在不同的光合生物的Rubisco大亚基的保守机制控制的翻译。植物理性。2006年,141:1089年至1097年。10.1104 / pp.106.079046。
- 67。
Shapira M, Lers A, Heifetz PB, Irihimovitch V, Osmond CB, Gillham NW, Boynton JE:叶绿体基因表达的差异调控衣藻reinhardtii在光处理期间:轻应力瞬时抑制Rubisco LSU蛋白的合成,同时增强PS II D1蛋白的合成。植物mol biol。1997,33:1001-1011。10.1023 /答:1005814800641。
- 68。
Irihimovitch V,夏皮拉L:谷胱甘肽氧化还原电势由活性氧监管在叶绿体的Rubisco大亚基的翻译调制。J Biol Chem。2000,275:16289-16295。10.1074 / jbc.275.21.16289。
- 69.
李S,Lu W,Li G-F,龚Y-D,Zhao N-M,张R-X,周H-M:氢氧化氢与水稻氢氧化酶/氧酶的相互作用。Biochem Mosc。2004,69:1136-1142。
- 70.
Patel M,Berry Jo:CuRuisco基因表达式4.植物。J Exp Bot。2008,59:1625-1634。
- 71.
4基因在叶肉细胞和束鞘细胞中的表达。C4光合作用及相关CO2浓缩机制。光合作用和呼吸作用的研究进展。体积32。由RaghavendraAS编辑,Sage RF。荷兰:施普林格Dordrecht;2011:221 - 250。
- 72.
赵W-l, Niwa Y, Zeng W, Hirano T, Kobayashi H, Shenn J:转基因GFP在植物中的重要报道。《中国生物医学工程学报》,1996,6:6:325-330。
- 73.
王志强,王志强,王志强。peg介导的原生质体转化与裸DNA的研究进展。Totowa: Humana出版社;2005.
- 74.
Berry Jo,Nikolau Bj,Carr JP,Klessig DF:在轻质和深色的苋菜中,核苷酸1,5-二磷酸羧化酶基因表达的转录和转录调控。Mol细胞Biol。1985年,5:2238-2246。
- 75.
ROSNOM J,优惠曼,Park J,Okita TW,Tarlyn N,Dinghra A,Edwards Ge:体外培养和再生Bienertia sinuspersici(Chenopodiaceae)在增加浓度的氯化钠和二氧化碳中。植物细胞代表2011,30:1541-1553。10.1007 / s00299-011-1067-1。
致谢
该材料基于国家科学基金会在资金MCB的国家科学基金会支持的工作基于GEE,以及USDA / NRI授予2008-01070至J.O.B.额外的感谢Ray Collier在Comperss,Michael Knoblauch,Valerie Lynch-Holm,Christine Davitt在FrancesChi显微镜中的讨论和协助中,为Parafin样本进行了讨论和协助,以及用于植物生长管理的Chuck Cody。纽约纽约大学的JR旅行支持 - Buffalo由WSU的生物科学学院提供Betty Higginbotham Grant。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
•在过去5年或未来,没有作者收到或将收到任何机构的报销、费用、资金或工资,可能会因本手稿的出版而获得或失去经济上的利益。没有组织资助这份手稿。
•任何作者都不持有任何组织的股票或股份,无论是现在或将来,可能会因本手稿的出版而获得或失去经济上的利益。
•目前没有作者目前正在申请与手稿内容有关的任何专利。没有提交人从持有或已申请与手稿内容有关的专利的组织中收到了报销,费用,资金或薪水。
•无作者有任何财务或非财务利益争夺与本稿件声明。
作者的贡献
JR进行了构建体的组装、生物和原生质体转化,参与了免疫定位分析和RLSB序列分析,进行了DAB组织化学分析并起草了手稿。PY进行免疫定位分析,协助进行RLSB序列分析和手稿编辑。JB参与了设计和协调,协助免疫定位分析,并帮助撰写了手稿。参与本研究的设计。GE公司构思了研究,参与了设计和协调,并帮助起草了文稿。所有作者都已阅读并批准了最终稿。
电子辅料
12870 _2013_1456_moesm1_esm.docx
附加文件1:表S1:GFP表达式结果的构造列表和摘要。表S2。用于本研究的引物序列列表。(docx 61 kb)
12870 _2013_1456_moesm6_esm.docx
附加文件6:图S5:用于量化来自RBCS-FL SPGFP和RBCS-FL ROGFP2的GFP荧光的代表性图像。(DocX 5 MB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.)如果原始工作正确记入,则允许在任何媒体中进行无限制使用,分发和再现。Creative Commons公共领域奉献豁免(https://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
罗斯诺,耶拉姆塞蒂,P,贝瑞,J.O.等等。探索与单细胞中二态叶绿体的分化和功能有关的机制4.物种Bienertia sinuspersici.BMC植物杂志14,34(2014)。https://doi.org/10.1186/1471-2229-14-34
已收到:
公认:
发表:
关键词
- 单细胞c4.光合作用
- Bienertia sinuspersici
- 二晶叶绿体
- 叶绿体分化