摘要
背景
植物促生菌(PGPR)是天然存在的土壤细菌,能提高植物的生产力和免疫力,对植物有益。这些过程涉及的机制包括调节植物激素水平,如乙烯和脱落酸(ABA)。本研究的目的是确定是否活性芽孢杆菌megateriumPGPR受寄主植物内源ABA含量的影响。缺乏aba的番茄突变体flacca而且sitiens并使用了它们的近等基因野生型亲本系。研究了番茄根尖的生长、气孔导度、笋激素浓度、定植竞争试验,以及预计受ABA和PGPR调控的植物基因的根表达。
结果
与PGPR刺激生长速率的野生型植物相反,PGPR导致aba缺乏突变植物的生长抑制。PGPR还在aba缺乏的植物中引发乙烯的过度积累,这与致病相关基因的高表达相关Sl-PR1b.
结论
乙烯的过度积累与较高的表达呈正相关Sl-PR1b这表明维持正常的植物内源ABA含量可能对ABA的生长促进作用至关重要b . megaterium通过保持低水平的乙烯生产。
背景
有许多关于有益土壤微生物促进植物生长和产量的报道[1- - - - - -4].生活在土壤中的各种微生物都能与其寄主植物建立共生和非共生关系[5].这些微生物在土壤中发挥着重要的作用,包括:(1)控制病原菌对植物生长的不利影响,(2)缓解土壤胁迫对植物生长和产量的负面影响,(3)生物施肥,(4)促进根系生长,(5)根根修复[6- - - - - -9].
促进植物生长的根际细菌(PGPR)是最有效和研究最好的土壤微生物之一,可以促进植物生长。PGPR可分为胞外细菌(存在于根际、根表面或细胞间隙)和胞内细菌(主要为N2固定细菌)[5].PGPR的作用机制也可分为直接作用机制和间接作用机制。生物肥力、根系生长刺激、根尖修复和植物胁迫控制是其直接机制。另一方面,根际细菌通过降低病害水平间接促进植物生长的生物防治机制包括抗菌作用、诱导系统抗性和争夺营养物质和生态位[8].激素如生长素、乙烯、赤霉素、(+)-脱落酸(ABA)和细胞分裂素调节植物的生长发育[10,11].植物激素是影响植物对环境反应能力的化学信使。它们是有机化合物,在很低的浓度下是有效的,通常在植物的一个部分合成,然后运输到另一个地方。植物的每一种反应通常是两种或两种以上激素共同作用的结果。由于激素刺激或抑制植物生长,它们也被称为植物生长调节剂。含有1-氨基环丙烷-1-羧酸脱氨酶(ACC)的促生长细菌通过降低植物乙烯水平来促进植物的生长和发育。ACC是乙烯生产的前体,其数量在胁迫下增加,对植物生长和产量产生不利影响。因此,乙烯是调节植物在不同条件下生长的激素之一,包括胁迫[8].乙烯是一种植物生长调节剂,对植物的正常生长发育至关重要。然而,除了这一关键功能外,乙烯还在植物暴露于盐度、干旱、内涝、重金属或病原体时发挥应激激素的作用[12].
ABA在植物的许多生理过程中起着重要作用。这种激素对于调节种子发育后期的几个事件是必要的,并且对干旱、盐和寒冷等环境压力的反应至关重要。脱落酸可控制植物生长及抑制根伸长[13],即植物生长与内源ABA含量呈负相关[14].尽管如此,缺乏aba的植物通常比野生型(wt)植物要小[15].据报道,一些细菌与植物相互作用或生活在土壤中,合成ABA和其他植物激素,如吲哚-3-乙酸(IAA)、赤霉素、玉米素(细胞分裂素)和乙烯[16- - - - - -18].属中的一些种芽孢杆菌已被描述为不仅是植物生长促进剂,而且是疾病的生物控制剂[19,20.].到目前为止,虽然一个特定的PGPR对ABA关系的影响Pisum一已经被研究过[21],目前还没有研究解释内源性ABA水平如何影响PGPR的功能芽孢杆菌.本研究以番茄为寄主植物。番茄具有许多已知的ABA途径突变体,为研究内源ABA在植物对PGPR反应中的作用提供了一个合适的模型。缺乏aba的番茄突变体flacca而且sitiens本研究采用近等基因野生型亲本系。先前的研究表明,这些突变体具有ABA残留水平(不超过野生型植物的8%)[22]当植物受到胁迫时,它们无法增加ABA水平[23].
来自西班牙南部退化土壤的PGPR被我们小组分离并鉴定为芽孢杆菌megaterium[24在这项研究中使用了。马鲁兰达等人[25]分析了这种PGPR菌株如何影响玉米植株的根系水力特性和水通道蛋白调节等植物耐盐性的两个关键组成部分。接种的玉米植株芽孢杆菌megaterium在盐胁迫下,与未接种对照植物相比,表现出较高的生物量产量、较低的坏死叶面积和较高的根系水导率[25].在之前由同一小组进行的研究中,已经表明这芽孢杆菌megaterium菌株能够提高在缺水条件下生长的植物的抗旱性[26]以及在营养缺乏的条件下促进植物生长[24].本研究的目的是确定是否活性芽孢杆菌megateriumPGPR受寄主植物内源脱落酸(ABA)含量的影响。
方法
实验设计
试验采用随机完全区组设计,接种处理为(1)未接种对照植株和(2)接种PGPR植株芽孢杆菌megaterium该菌株由Marulanda-Aguirre等人分离。[24],以及两种植物ABA系处理:野生型和ABA缺乏型(flacca或sitiens).每个处理重复10株(每盆1株)。在整个实验过程中,这些植物都是在良好的浇水条件下种植的。进行了两组不同的实验:一组是野生型(cv Rheinlands Ruhm)和sitiens植物(1月至3月)和第二野生型(cv Ailsa Craig)和flacca植物(从三月到五月)。所有的测定(生物量产量除外,从两个实验中采集的样品)都是在第二组实验中采集的样品上进行的。
土壤和生物材料
泥炭和蛭石混合物(1:1,v/v)灭菌(120°C 20分钟)。番茄种子(茄属植物lycopersicum)sitiens(LA0574)及其亲本等基因cv Rheinlands Ruhmflacca(LA3613)和相应的亲本等基因株系Ailsa Craig从美国加州大学戴维斯分校的番茄遗传资源中心(TGRC)获得。种子在70%乙醇溶液中消毒2分钟,然后在50%次氯酸钠溶液中消毒8分钟,最后用无菌水清洗几次,以去除任何可能影响种子发芽的化学物质。种子被放置在25°C的无菌蛭石上发芽,10 d龄的幼苗被转移到装有500 g泥炭苔藓/蛭石混合物(1:1,v/v)的塑料盆中。一种悬液(每粒种子0.5毫升)芽孢杆菌megaterium(109细胞毫升-1)用Luria-Bertani培养基(LB)在种植后1天和7天喷洒在每棵幼苗上。未接种的对照植株在相同数量的无菌培养基上接受了相同数量的施用。
生长条件
在受控气候条件下(18 - 24°C,光照/暗期18小时/6小时,相对湿度50-60%)的温室中种植番茄植株两个月。在光合光子通量密度为600 μmol m时,光周期为16 h-2年代-1,以光计测量(型号LI-188B;Licor公司,Lincoln, NE, USA),在整个实验过程中保持。在整个试验过程中,每天供水以保持土壤含水量恒定,接近持水能力。
生物质生产
在收获时(种植后60 d),将6个样品的根系与茎部分离,测定鲜重。在强制通风箱中70°C干燥2 d后,测量茎干和根干重,并测定株高。
气孔导度
在黎明后2小时,用porometer系统(porometer AP4, Delta-T Devices Ltd., Cambridge, UK)在每个处理的6株植物的最后一片完全展开的叶片中记录气孔导度。每个测量在每个叶片上重复三次,并且考虑三次测量的平均值,以减少该参数的可变性。
番茄根尖定殖竞争试验
为了检查所检测的PGPR菌株在野生型和突变型植物中的定殖能力,并确认其在根内的存在,进行了定殖竞争试验。试验由一个随机的完全区组设计组成,有三种植物ABA系处理:野生型、sitiens而且flacca2种接种处理:(1)对照株单独接种LB培养基,(2)接种芽孢杆菌megaterium压力。每组6个重复,共36个。消毒后的番茄种子在黑暗的MS培养皿中发芽,直到植株长出1厘米长的根。10天大的幼苗转移到装有无菌泥炭和蛭石混合物(1:1,v/v)的玻璃瓶中。1 mL苗-1LB培养基(对照植物)或悬液(1ml幼苗)-1)芽孢杆菌megaterium(接种植物)在转移到瓶子时洒在每颗种子上。芽孢杆菌megaterium在添加庆大霉素50 μg mL-1直到OD600= 1.9-2,对应细胞密度约为109细胞毫升-1.玻璃瓶在气候控制的生长室(18-24°C,相对湿度50-60%,日光16小时)中保存7天,根系平均长度达到12厘米。根据Marulanda等人的描述,测定根内细菌的生长情况。[26].切开1 cm长的远端根段,清洗并表面消毒(30% [v:v] H消毒20 min)2O2然后用蒸馏水清洗五次)。磨碎后,取100 μL,悬于10ml无菌水中(稀释10-2),取1 mL,依次稀释至10-2- 107.稀释后置于8 g L的琼脂营养肉汤培养基中-1)添加庆大霉素50 μg mL-1在28℃下培养48 h。定植实验重复进行两次。
内源性ABA分析
采用高效液相色谱-电喷雾-质谱联用(HPLC-ESI-MS/MS)技术分析了茎叶提取物中ABA的含量。采用Bacaicoa等描述的方法提取和纯化ABA。[27有一些变化。冷冻0.5 g植物组织样本(之前在N液砂浆中研磨成粉末),用5 mL预冷(-20°C)甲醇:水(80:20,v/v)和2.5 mM二乙基二硫代氨基甲酸钠(DDTC)均质。氘标记的内标准[2H6] (+)-cis,反式脱落酸,(来自Olchemim, Olomouc,捷克共和国)加入(100 μL 400 ng mL的原液)-1的标准甲醇)到萃取介质。在-20°C提取过夜后,固体在4°C以12000 × g离心分离10分钟,使用centrkon T-124转子A8.24离心机(Kontron Instruments, Cumbernauld, United Kingdom),再提取1小时,加入额外的4 mL提取混合物。上清液通过Strata C18-E滤筒(3 cm3, 200 mg) (Phenomenex, Torrance, CA;参考文献8B-S001-FBJ),用4 mL甲醇预处理,然后用2 mL萃取介质。使用Labconco漩涡蒸发器(Labconco Co., Kansas City, MO)在40°C的水相蒸发后,加入0.5 mL的1 M甲酸。然后用5 mL和4 mL乙醚两份提取ABA,有机相蒸发至干燥。用250 μL甲醇:0.5%乙酸(40:60,v/v)再溶。在HPLC-ESI-MS/MS系统中注射前,8000 × g离心5 min。
ABA通过HPLC- esi -MS/MS定量,使用高效液相色谱设备(2795 Alliance HT;Waters Co., Milford, MA)连接到3200 Q TRAP LC/MS/MS系统(Applied Biosystems/MDS Sciex, Ontario, Canada),配备电喷雾接口。反相色谱柱(Synergi 4 μm Hydro-RP 80A, 150 × 2 mm;使用了Phenomenex, Torrance, CA)。采用甲醇(A)和0.5%乙酸在水中(B)的线性梯度:35% A 1分钟,35%至95% A 9分钟,95% A 4分钟,95%至35% A 1分钟,稳定时间5分钟。流量为0.20 mL min-1,进样量为40 μL,柱温和样品温度为20℃。采用负离子模式下的多重反应监测(MRM),以氘化激素为内标,采用多级校准曲线进行ABA的检测和定量。更多细节见Bacaicoa等人。[27].
内源性ACC含量分析
采用Mora等的方法对ACC(1-氨基环丙烷-1-羧酸)进行了提取纯化。[28].冷冻植物组织(0.25 g)用液氮砂浆和杵磨碎,用20 μL d均质4ACC (3 μg/mL乙腈/乙酸0.2%(90/10))和3ml MeOH/H2O/HCOOH (15/4/1, v/v/v)在-20°C。将混合物旋转(2000 rpm) 10分钟。在-20°C下过夜提取后,通过离心(12000 rpm, 10 min, 4°C)分离固体。使用Strata C18-E滤芯(Ref 8B-S001-FBJ, Phenomenex, Torrance, CA, USA)预处理4 mL甲醇和2 mL MeOH/H纯化上清液2O/HCOOH (15/4/1, v/v/v)。洗脱液在40°C下蒸发,直到甲醇被除去(美国密苏里州堪萨斯城Labconco公司的Vortex蒸发器mod. 432-2100)。用2 mL MeOH/H重新溶解残渣2O/HCOOH(15/4/1),保存在-20°C。1 h后,重新离心(12000 rpm, 10 min, 4°C)。使用相同的Strata C18-E滤筒纯化上清液。蒸发至接近干燥后,将残渣再次溶解在2 mL甲酸1 M中,并应用于Oasis MCK色谱柱(Ref. 186000254, Waters Co., Milford, MA),用4 mL甲醇和2 mL甲酸1 M预处理。色谱柱依次用1 mL甲酸1 M和1 mL甲醇洗涤。ACC用1 mL 0.35 M nhh洗脱4哦。洗脱液在涡旋蒸发器中蒸发至干燥后,以500 μL乙腈/ 0.2%醋酸(90:10)溶液重新溶解。最后将洗脱部分离心(10000 rpm, 8 min)并注入LC/MS/MS系统。
ACC通过与3200 QTRAP LC/MS/MS系统(Applied Biosystems/ MDS Sciex, Ontario, Canada)连接的高效液相色谱(HPLC)进行定量,该系统配备涡轮离子喷雾接口。在正离子模式下采用多重反应监测(MRM)进行检测和定量,采用氘化d的多级校准图4ACC作为内部标准。更多细节见Mora等人。[28].
植物组织中乙烯产生的分析
将完整的植物装入密封的醋酸气瓶中,在室温下孵育24小时。用注射器从每个醋酸气瓶中提取500 μL样品,用配备Poropak-R柱和氢火焰电离检测器的惠普5890型气相色谱仪定量乙烯含量,如Porcel等人所述。[29].
RNA的分离和第一链cDNA的合成
采用苯酚/氯仿萃取法从3个不同处理的番茄叶片中分离总RNA [30.].根据Qiagen公司的方案(quantitative Reverse Transcription KIT Cat#205311, Qiagen, CA)对总RNA和cDNA合成进行DNase处理。
定量实时RT-PCR
的表达式茄属植物lycopersicum1-氨基环丙烷-1-羧酸氧化酶(Sl-ACO4), 1-氨基环丙烷-1-羧酸合酶(Sl-ACS7),发病相关1b (Sl-PR1b), 9 -独联体-环氧类胡萝卜素双加氧酶(Sl-NCED),而且SlLE16基因采用iCycler (Bio-Rad, Hercules, California, USA)实时PCR检测。
用于扩增合成cdna中每个分析基因的引物集如表所示1.
每23 μL反应含有3 μL 1:10稀释的cDNA、10.5 μL Master Mix (Bio-Rad Laboratories S.A, Madrid)、8.6 μL去离子水和每对引物0.45 μxL。PCR程序是在95℃孵育3 min,激活热启动重组Taq DNA聚合酶,然后在95℃孵育30 s, 58℃孵育30 s, 72℃孵育30 s,进行32个循环,并在此循环中测量荧光信号。PCR扩增过程的特异性在PCR的最后一个循环后用热解离方案(从70-100°C)进行检查。
采用4个独立的生物学重复,每个实时PCR反应分为3个重复。然后使用阈值周期(CT)对番茄家庭基因的价值Sl-actin。相对转录水平用2——∆Ct方法(31].所有PCR反应均采用无cDNA的阴性对照。
统计分析
以PGPR接种和植物基因型为变异源,采用SPSS 12.0统计软件包(SPSS Inc., Chicago, IL, USA)对数据进行双向方差分析(ANOVA)。LSD试验后,认为均数有显著性差异(P <0.05)。基因表达数据用Student 's unpaired进行分析t(P < 0.05),以比较接种与未接种对照。为分析番茄根尖定殖竞争试验结果,采用Duncan 's诚实显著性差异检验。
结果
生物质生产
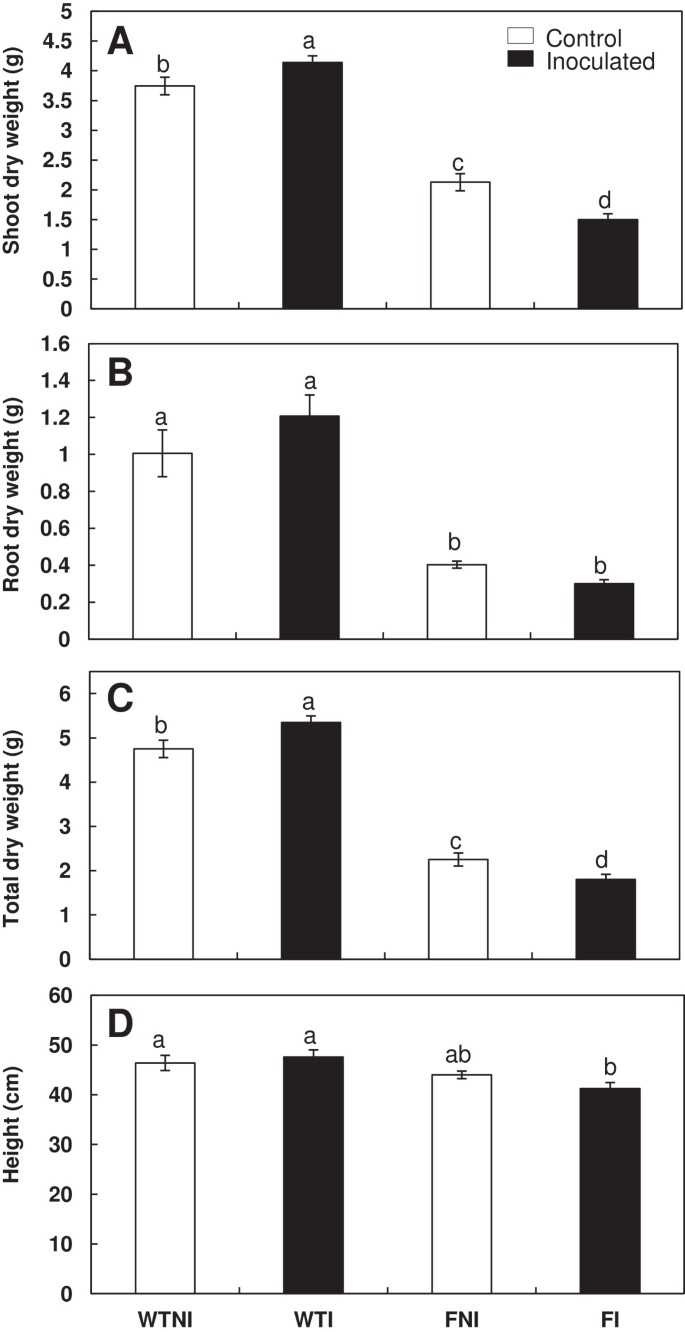
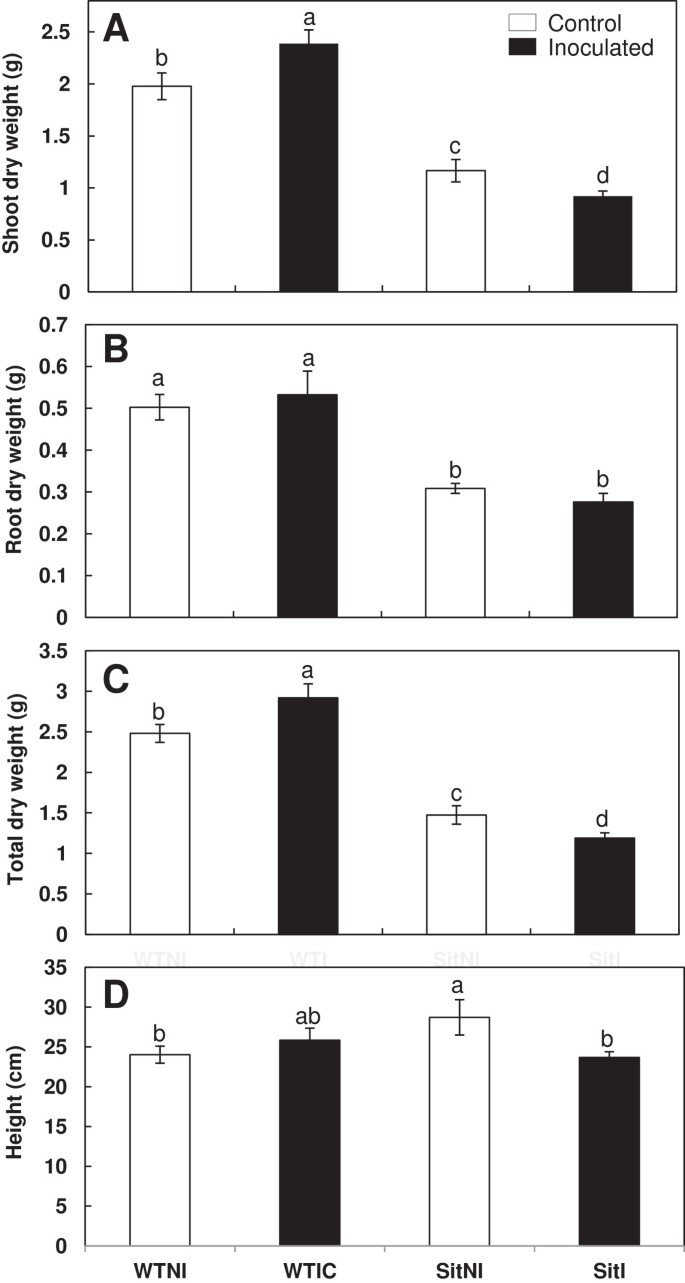
两者的茎干重和根干重flacca而且sitiens接种后的突变株表现出相同的模式b . megaterium与野生型(wt)植物相比。接种wt株的茎干重高于相应的未接种株(Ailsa Craig 11%, Rheinlands Ruhm 20%)。而突变株的茎干重因接种而降低(30%)flacca植物和20%sitiens植物)。野生型和突变型植株的茎干重差异显著(flacca而且sitiens),而不考虑微生物处理(图1一个,2A). wt植株(接种和未接种)的根系干重比aba缺失突变体植株高得多。在任何株系中,接种PGPR均未观察到根干重的显著差异(wt、flacca而且sitiens);(数据1B,2B)。
的影响芽孢杆菌megateriumWT接种和Flacca植物生物量。干重(一),根干重(B),总干重(C)和高度(D)在野生型cv Ailsa Craig (WT)和flacca(F)突变番茄植株。处理设计为未接种对照(NI,开放柱)或接种植物(I,黑柱)。数据为平均值±标准差(n = 6)。不同字母后的均值在LSD的HSD检验中有显著性差异(P < 0.05)。双向方差分析的P值见表2.
最后,接种wt的植株总干重高于相应的未接种的植株(Ailsa Craig 13%, Rheinlands Ruhm 20%)。相反,在突变植物中观察到相反的效果。接种对总干重均有负影响flacca而且sitiens植物(数据1C,2C)。
各处理株高相似。在用野生型cv进行的第二次实验中,Ailsa Craig和flacca植物,只接种flacca与野生型相比,植株高度显著降低,但与未接种型相比没有显著降低flacca植物(图1D)在第一个实验中sitiens在其他季节种植的植物及其亲本等基因野生型莱茵兰,差异显著。在野生型植物中,接种后无显著变化sitiens接种对植株的影响显著降低芽孢杆菌megaterium(图2D).因此,当接种时b . megateriumwt植物生物量增加,在sitiens而在flacca植物的情况正好相反。
的影响芽孢杆菌megateriumWT接种和Sitiens植物生物量。干重(一),根干重(B),总干重(C)和高度(D)在野生型cv莱茵兰氏(WT)和sitiens(Sit)突变番茄植株。处理设计为未接种对照(NI,开放柱)或接种植物(I,黑柱)。数据为平均值±标准差(n = 6)。不同字母后的均值在LSD的HSD检验中有显著性差异(P < 0.05)。双向方差分析的P值见表2.
方差分析显示,基因型对新梢、根、总干重和高度的影响极显著(P < 0.001),基因型× PGPR互作对新梢和总干重的影响均显著(P < 0.05)flacca而且sitiens植物(表2).
气孔导度
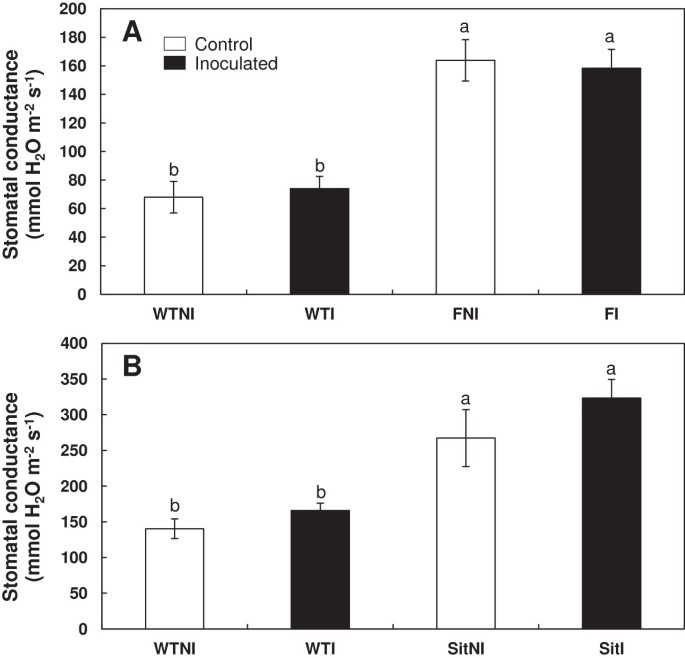
添加PGPR对气孔导度无影响。然而,flacca而且sitiens突变体植株的气孔导度远高于野生型植株(图3.一个,3.B).方差分析显示基因型影响极显著(P < 0.001),而接种影响不显著(表2)2).
的影响芽孢杆菌megaterium接种对气孔导度的影响。野生型cv艾尔萨克雷格(WT) vs。flacca(F)(一)野生型cv莱茵兰氏(WT) vssitiens(坐)(B)对番茄突变株进行了分析。处理设计为未接种对照(NI,开放柱)或接种植物(I,黑柱)。数据为平均值±标准差(n = 6)。不同字母后的均值在LSD的HSD检验中有显著性差异(P < 0.05)。双向方差分析的P值见表2.
番茄根尖定殖竞争试验
我们进行了定植竞争试验,以检查存在芽孢杆菌megaterium以及它在根野生型和aba缺乏突变植物上定植的能力。正如预期的那样,在未接种的对照植物中,我们证实没有出现芽孢杆菌在根。然而,在接种的植物中,尽管它存在于所有植物中(野生型,sitiens而且flacca),的存在b . megaterium显著降低了sitiens植物。根sitiens植株为3.0,wt为7.4flacca植物9.5 cfu 106厘米1根。由于有关生物量生产和气孔导度的结果相似,而且定植率较低b . megaterium在sitiens植物,从现在起,以下的测定只在flacca接种导致生物量减少较为明显的植物。
ABA和ACC浓度及乙烯产率
因为我们研究了芽孢杆菌megateriumPGPR受寄主植株内源ABA浓度的影响,分析了ABA和ACC浓度及叶片乙烯生成速率。
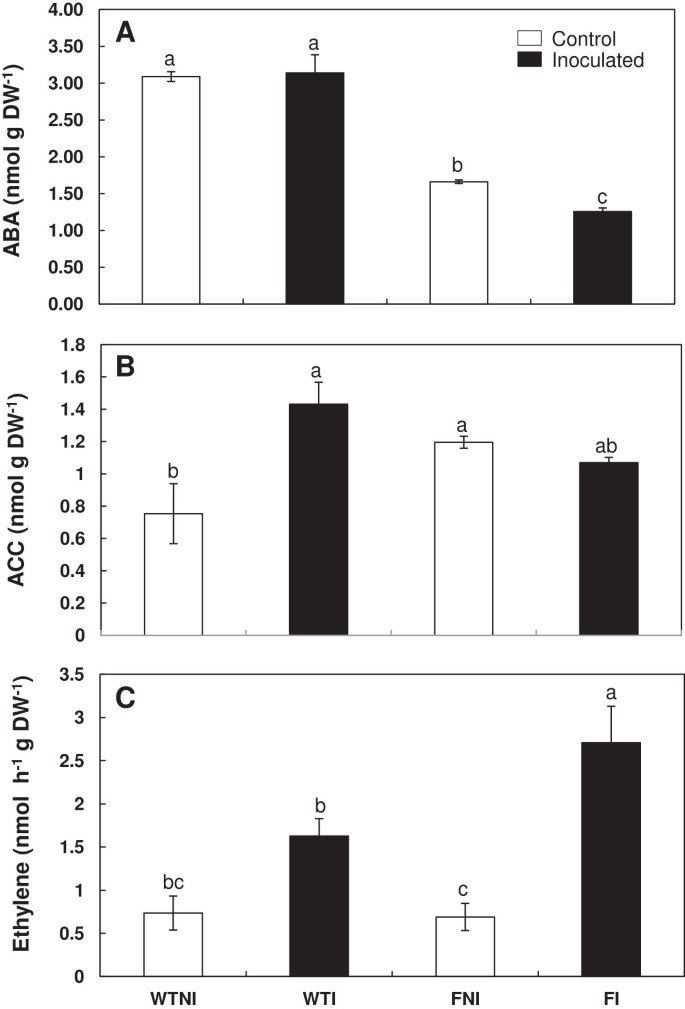
突变株叶片内源ABA浓度低于野生株。然而,在ABA缺乏的突变体中,由于PGPR的存在,ABA减少了24%(图4A).方差分析显示基因型的影响极显著(P < 0.001)2).
的影响芽孢杆菌megaterium接种激素。芽叶ABA浓度(一)和ACC(B)乙烯的生产速度(C)在野生型cv Ailsa Craig (WT)和flacca(F)确定了番茄突变株。处理设计为未接种对照(NI,开放柱)或接种植物(I,黑柱)。数据为平均值±标准差(n = 6)。不同字母后的均值在LSD的HSD检验中有显著性差异(P < 0.05)。双向方差分析的P值见表2.
在wt植物叶片中,接种后ACC浓度提高了90%芽孢杆菌megaterium而在突变株的叶片上,接种后无显著差异。然而,叶子flacca植物表现出比wt植物更高的内在ACC浓度(图4B).方差分析显示,基因型和基因型× PGPR互作对番茄叶片ACC浓度的影响均极显著(P < 0.01)2).
叶片乙烯产率提高近300%flacca突变体接种PGPR。接种PGPR对wt叶片乙烯产率无显著影响。两株系未接种叶片的乙烯产量无显著差异(图4C).方差分析也显示PGPR接种对乙烯产率的影响极显著(P < 0.001)2).
定量实时RT-PCR
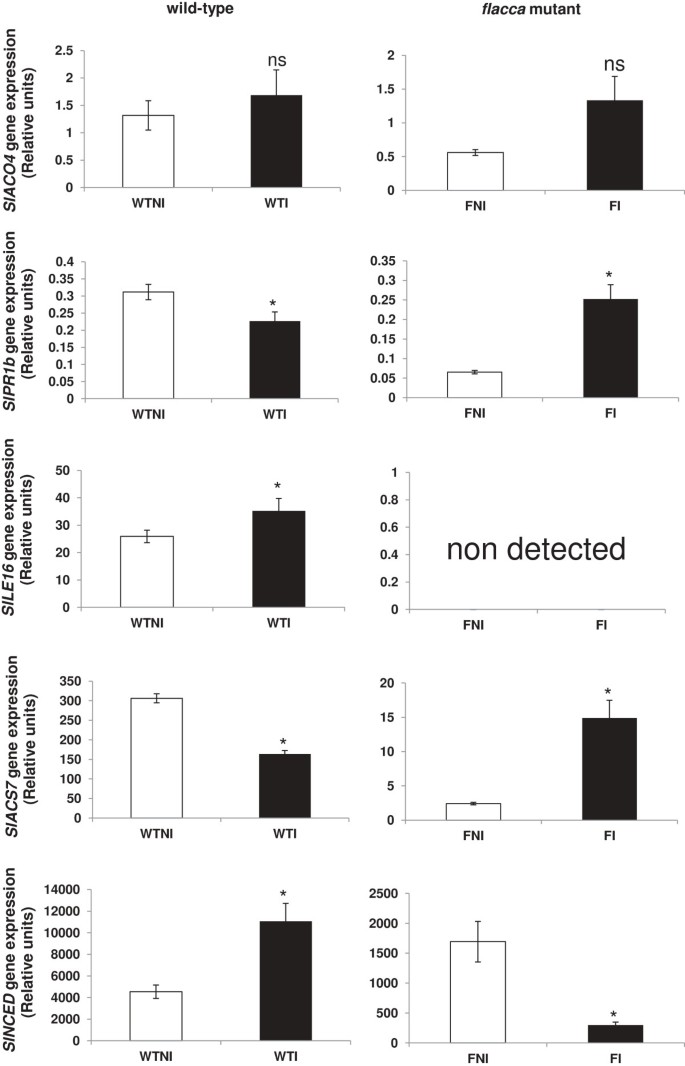
的表达式Sl-PR1b, Sl-ACO4, Sl-ACS7,Sl-NCED而且Sl-LE16分析了各处理(wt和flacca植物)。Sl-PR1b而且Sl-ACS7PGPR存在时aba缺失突变植株叶片中基因表达增加,而wt叶片中基因表达下降(图5).Sl-NCED与未接种的植株相比,PGPR接种的aba缺陷突变植株的基因表达被抑制,而接种的wt植株与未接种的wt植株相比,观察到基因表达的重要诱导(图5).关于Sl-NCED获得的基因表达flacca突变体植株证实了这些植株的aba缺失表型,因为接种和未接种的突变体植株的相对基因表达均低于野生型植株(图5).在野生型植物中Sl-LE16接种后基因表达量增加flacca植株未观察到基因表达。因此,表达式响应Sl-PR1b,Sl-ACS7而且Sl-NCED野生型和野生型对PGPR接种的影响相反flacca叶子。
的影响芽孢杆菌megaterium接种对基因表达的影响。分析Sl-PR1b, Sl-ACO4, Sl-ACS7, Sl-NCED而且Sl-LE16基因在野生型和突变型番茄叶片中的实时定量RT-PCR表达flacca接种芽孢杆菌megaterium.处理设计为未接种的植物(白色条)或接种野生型或flacca植物(黑条)。数据为四个独立生物重复的平均值±SE。t-student检验显示,与相应的未接种对照组相比,带星号的均值有显著差异(P < 0.05)。双向方差分析的P值见表2.
方差分析显示,基因型和基因型× PGPR互作对PGPR的影响均极显著(P < 0.001)Sl-PR1b,Sl-ACS7而且Sl-NCED基因表达(表2).
讨论
促进植物生长的根际细菌存在于土壤中,当它们与植物根系结合时,可以刺激宿主的生长[32].这种效应的机制之一是调节植物生长发育的激素的产生或降解。已知PGPR影响根激素浓度,也可改变根-茎的长距离信号传递,以调节茎激素状态[33].几种根际细菌在培养基中产生ABA或调节植物的ABA状态[17].事实上,虽然产生ABA的生化机制在足底已经很好地描述了[33],目前还没有关于植物内源ABA对PGPR活性的作用的研究。Herrera-Medina等人。[34]对两株aba缺失的番茄突变株进行了比较分析,结果表明丛枝菌根定殖模式存在定量和定性差异。ABA缺乏诱导乙烯产生,这表明ABA决定真菌感染易感性的机制之一是通过负调控乙烯途径。
在这项研究中,我们使用了缺乏aba的番茄突变体(flacca而且sitiens)和它们的近等基因wt亲本一起研究内源性ABA如何干扰PGPR功能。Sitiens而且flacca在ABA生物合成途径的最后一步被阻断,在这个过程中酶AAO催化脱落醛氧化为ABA [35,36].Sitiens已知AAO酶发生突变,突变叶片中ABA含量仅为野生型ABA水平的约11% [35,37].突变flaccaAAO活性所需的MoCo辅因子发生突变,突变叶片含有约33%的野生型ABA水平[37,38].番茄突变体生长差,叶片偏上性强notabilis,以及flacca而且sitiens已证明即使在非萎蔫条件下也会发生,并至少部分归因于过量的乙烯[39].然而,我们的研究结果表明,aba缺失突变体与其近等基因wt亲本之间乙烯产率没有显著差异。马鲁兰达等人[26显示了同样的结果芽孢杆菌megaterium在这里使用的菌株,对三叶草被增长。在本研究中,这种积极作用在wt植物中观察到,但在flacca或sitiens的人。如前所述,缺乏aba的植物生物量产量显著下降[40],表明内源ABA可能对维持植物生长有重要作用。以同样的方式,接种flacca而且sitiens突变株株高比接种wt株株低。因此,低水平的ABA在这些突变植物中切换的作用b . megaterium这里使用的菌株从促进植物生长的根瘤菌到抑制植物生长的根瘤菌。
虽然b . megaterium存在于所有植物(野生型,sitiens而且flacca),该PGPR的存在显著降低sitiens植物。低ABA水平可能抑制了根定殖。因此,应要求ABA的最低含量b . megaterium殖民。在丛枝菌根共生中也发现了类似的结果[34].
有人提出,限制乙烯的生产可能是ABA的广泛功能。事实上,众所周知,乙烯和ABA在调节发育过程中起拮抗作用[41],生长[39]和植物的抗病能力[42].此外,有一些证据表明ABA和乙烯拮抗作用可以干扰丛枝菌根的形成[43].因此,似乎b . megaterium本研究中使用的菌株可以增加寄主植物的乙烯产量。自flacca植物的ABA含量较低,接种PGPR会加剧乙烯的产生,甚至会降低ABA水平。
植物生长与内源ABA浓度呈负相关[14]但不是在压力条件下[44].如我们所料,ABA缺乏突变体植株的ABA浓度明显低于wt植株,但接种PGPR后叶片中ABA浓度显著降低,这与ABA生物合成基因表达的降低有关Sl-NCED.我们观察到生长与内源ABA含量之间有直接的相关性flacca突变体植物。激素反应flacca植物对PGPR接种的反应类似于植物对病原体的反应,乙烯含量急剧增加[45].
的PR1b基因被认为是植物对病原体反应的指标[46].植物系统性获得性抗性(SAR)的诱导与致病相关基因(PR)的表达相关[47- - - - - -49].PR基因中,PR1的表达是SAR期间PR基因共同调控的范式[50].ABA和乙烯在植物病原体反应中的相互作用尚不清楚。尽管一些报告已经显示了ABA水平与几种植物对不同生活方式的病原体的抗性之间的负相关关系,但另一些报告则表明该激素在激活防御基因表达和病原体抗性方面具有积极作用[51].在缺乏ABA的番茄和玉米ABA生物合成突变体中,外源ABA的施用抑制了乙烯的产生[41,52,53].与此一致的是,Anderson等人。42]在营养组织中发现乙烯和ABA信号突变体之间的拮抗相互作用。在这里,我们发现flacca在ABA水平较低的植物中,乙烯含量显著增加,与致病相关基因的表达也随之增加Sl-PR1b.这项研究的结果与最近的研究结果一致,这些研究表明有益微生物也可以充当病原体。这不仅被报道用于诱导系统性获得性耐药(SAR)的微生物,也被报道用于诱导系统性耐药(ISR)诱导剂(见[54,55])。由于一些研究表明ABA和水杨酸(SA)信号之间存在很强的拮抗作用[56,57],对PGPR生长减少的其他解释flacca可能是aba缺陷突变体可以识别的植物芽孢杆菌通过一种可能的微生物相关分子模式(MAMP),并可能引发强烈的sa依赖防御,导致生长迟缓。
在野生型植物中,接种PGPR后ACC浓度显著增加,而在野生型植物中未见显著差异flacca这很可能是因为几乎所有的ACC分子都转化为乙烯flacca植物。事实上,只有aba缺失的突变体植株表现出显著的增加(6倍)Sl-ACS7,编码一种参与乙烯合成的酶[58当他们接种PGPR时。
结论
在野生型植株中,ABA和乙烯含量与未接种的植株相比无显著差异。ABA生物合成相关酶NCED基因表达增加,乙烯生物合成相关酶ACS基因表达减少。在ABA缺乏的突变植株中,ABA浓度降低,参与ABA生物合成的酶基因表达降低。相反,乙烯和ACS基因表达量均较未接种的植株增加。Sl-PR1b两种植物的基因表达相反。而在野生型Sl-PR1b基因表达下降,在aba缺失突变株中显著升高。总之,芽孢杆菌megaterium刺激野生型植物的生长,但抑制aba缺乏突变型植物的生长(图6).
乙烯的过度积累与较高的表达呈正相关Sl-PR1b这表明植物内源ABA可能是PGPR通过维持低乙烯生产水平来促进生长的必要条件。
参考文献
Adesemoye AO, Torbert HA, Kloepper JW:综合养分管理系统中PGPR和AMF提高植物养分利用效率。中华微生物学杂志,2008,54:876-886。10.1139 / w08 - 081。
Adesemoye AO, Torbert HA, Kloepper JW:促进植物生长的根瘤菌可以降低化肥的施用量。中华微生物学杂志,2009,29(3):344 - 344。10.1007 / s00248 - 009 - 9531 - y。
王志强,王志强,王志强,等。植物-微生物相互作用对提高肥料利用效率的影响。中华微生物学杂志,2009,44(1):1-12。10.1007 / s00253 - 009 - 2196 - 0。
促进植物生长和健康的植物-微生物相互作用:微生物在农业中控制使用的前景。中国生物医学工程学报,2009,34(2):344 - 344。10.1007 / s00253 - 009 - 2092 - 7。
陈志强,陈志强,陈志强:植物-细菌信号通路中的胞内和胞外PGPR的共性和区别。土壤生物化学,2005,37:395-412。10.1016 / j.soilbio.2004.08.030。
Emmerling C, Schloter M, Hartmann A, Kandeler E:德国土壤生物功能多样性研究进展。植物营养与土壤学报,2002,29(4):344 - 344。10.1002 / 1522 - 2624 (200208) 165:4 < 408:: AID-JPLN408 > 3.0.CO; 2 - 3。
Böhme L, Böhme F:植物生长和不同长期施肥对土壤微生物生化特性的影响。土壤学报,2006,42:1-12。10.1016 / j.ejsobi.2005.08.001。
Lugtenberg B, Kamilova F:促进植物生长的根状细菌。微生物学通报,2009,29(3):344 - 344。10.1146 / annurev.micro.62.081307.162918。
Arzanesh MH, Alikhani HA, Khavazi K, Rahimian HA, Miransari M: Wheat (小麦l)偶氮螺旋菌对干旱胁迫下生长的促进作用。世界微生物学杂志,2011,27:197-205。10.1007 / s11274 - 010 - 0444 - 1。
Kende H, Zeevaart JAD:五种“经典”植物激素。植物科学学报,1997,26(3):379 - 379。10.1105 / tpc.9.7.1197。
蔡格尔E:《植物生理学》第二版。马萨诸塞州桑德兰:SinauerAssociates;1998.
Babaloa OO:农业上重要的有益细菌。生物技术通报,2010,32:1559-1570。10.1007 / s10529 - 010 - 0347 - 0。
脱落酸对玉米根系生长的影响:关键检验。植物科学,1981,21:99-106。10.1016 / 0304 - 4211(81) 90175 - 9。
pilepe, Saugy M:内源和外源IAA和ABA对根系生长的影响:一项关键的再检验。中国农业科学,1987,33(3):344 - 344。10.1104 / pp.83.1.33。
在生理和发育研究中使用内源性脱落酸水平不同的基因型。激素在植物发育中的作用——一个关键性的评价。编辑Hoad GV, Lenton JR,Jackson MB, Atkin RK。伦敦:巴特沃斯;1987:89 - 105。
Tuomi T, Rosenquist H:植物和微生物中脱落菌、赤霉素和吲哚-3-乙酸的检测。植物化学学报,2004,27(3):344 - 344。
Karadeniz A, Topcuoglu SF, Inan S:一些细菌生长素,赤霉素,细胞分裂素和脱落酸的产生。中国生物医学工程学报,2006,26(3):344 - 344。10.1007 / s11274 - 005 - 4561 - 1。
Martellet C, Fett-Neto A:生长素及其调节剂在不同顽固性桉树不定根中的作用。植物学报,2005,45:1-10。10.1007 / s10725 - 004 - 6547 - 7。
Nakayama T, Homma Y, Hashidoko Y, Mitzutani J, Tahara S:窄食单胞菌sB-K88产生的黄芽孢杆菌素在抑制甜菜衰枯病中的作用。环境科学学报,1999,29(3):344 - 344。
Vespermann A, Kai M, Piechulla B:根际细菌挥发物对真菌和拟南芥生长的影响。环境科学与技术,2007,29(3):344 - 344。10.1128 / AEM.01078-07。
蒋峰,陈l, Belimov AA, Shaposhnikov AI, Gong F,孟X, Hartung W, Jeschke DW, Davies WJ, Dodd IC:促进植物生长的根际细菌Variovorax paradoxus 5C-2对Pisum sativum养分和ABA关系的多重影响。应用物理学报,2012,29(3):344 - 344。10.1093 / jxb / ers301。
Netting AG, Theobald JC, Dodd IC:木质部液液收集和提取方法的确定在活的有机体内气相色谱-质谱(GC-MS)分析ABA浓度及其结合形式。植物学报,2012,8:11-10.1186/1746-4811-8-11。
黄志刚,黄志刚,黄志刚,李志刚:野生型和ABA缺乏型番茄对茉莉酸、亚麻酸和脱落酸的气孔响应。环境科学与技术,1997,26(3):366 - 366。10.1046 / j.1365 3040.1997.d01 - 11. x。
marulda - aguirre A, Azcon R, Ruiz-Lozano JM, Aroca R:基于丛枝菌根真菌来源的大芽孢杆菌菌株对莴苣植物生长的差异影响:生理和生化特性。植物生长学报,2008,27:10-18。10.1007 / s00344 - 007 - 9024 - 5。
Marulanda A, Azcón R, Chaumont F, Ruiz-Lozano JM, Aroca R:接种对质膜水通道蛋白的调控芽孢杆菌megaterium在非胁迫和盐胁迫条件下的玉米(Zea mays L.)植株中的菌株。植物学报,2010,32(3):533-543。10.1007 / s00425 - 010 - 1196 - 8。
Marulanda A, Barea JM, Azcón R:干燥环境中原生微生物(AM真菌和细菌)对植物生长和耐旱性的刺激:与细菌有效性相关的机制。植物生长学报,2009,28:115-124。10.1007 / s00344 - 009 - 9079 - 6。
Bacaicoa E, Mora V, Zamarreño AM, Fuentes M, Casanova E, García-Mina JM:生长素:黄瓜根系铁胁迫生理反应的主要参与者。植物化学学报,2011,29(4):344 - 344。10.1016 / j.plaphy.2011.02.018。
Mora V, Baigorri R, Bacaicoa E, Zamarreño AM, García-Mina JM:腐殖酸诱导的根内一氧化氮、IAA和乙烯浓度的变化不能解释腐殖酸引起的黄瓜根结构的变化。环境科学学报,2012,37(3):344 - 344。
波赛尔R, Barea JM, Ruiz-Lozano JM:干旱胁迫下菌根大豆抗氧化活性及其与根瘤衰老过程的关系。环境科学学报,2003,29(3):344 - 344。10.1046 / j.1469-8137.2003.00658.x。
杨凯,周洲A,戴利M: CaMV 35S启动子序列的复制可以产生一种强增强子。科学通报,1997,27(3):344 - 344。10.1126 / science.236.4806.1299。
Livak KJ, Schmittgen TD:利用实时定量PCR技术分析相关基因表达数据——∆∆Ct方法。方法,2001,25:402-408。10.1006 / meth.2001.1262。
巴塔查里亚·PN, Jha DK:植物促生长根际细菌(PGPR)在农业中的出现。世界微生物学杂志,2012,28:1327-1350。10.1007 / s11274 - 011 - 0979 - 9。
Dodd IC, Zinovkina NY, Safronova VI, Belimov AA:根际细菌对植物激素状态的调节。中国生物医学工程学报,2010,27(3):366 - 366。10.1111 / j.1744-7348.2010.00439.x。
Herrera-Medina MJ, Steinkellner S, Vierheilig H, Ocampo Bote JA, García Garrido JM:脱落酸决定番茄丛枝菌根中的丛枝发育和功能。环境科学学报,2007,29(3):344 - 344。10.1111 / j.1469-8137.2007.02107.x。
Taylor IB, Linforth RS, Al-Naieb RJ, Bowman WR, Marples BA:番茄突变体flacca和sitiens在ABA-醛氧化生成ABA过程中受到损伤。环境科学与技术,1998,18(4):349 - 349。10.1111 / j.1365-3040.1988.tb01158.x。
覃晓霞,薛晓华,蔡华。脱落酸生物合成的突变体、基因和酶的间接途径。中国生物医学工程学报,2003,29(3):344 - 344。10.1104 / pp.102.017921。
Cornish K, Zeevaart JAD:野生型番茄和三个wilty突变体的表型表达与互惠移植物根和小叶脱落酸积累的关系。中国农业科学,2004,27(4):489 - 497。10.1104 / pp.87.1.190。
刘志刚,张志刚,张志刚,等。钼辅助因子的缺乏是引起硫酸化的主要原因flacca番茄植株表型。植物学报,2002,31(3):344 - 344。10.1046 / j.1365 - 313 x.2002.01363.x。
Sharp RE, lenble ME, Else MA, Thorne ET, Gherardi F:内源ABA维持番茄幼苗生长独立于对植物水分平衡的影响:与乙烯相互作用的证据。应用物理学报,2000,29(3):344 - 344。10.1093 / jexbot / 51.350.1575。
Munns R, Cramer GR:叶片和根的生长协调是由脱落酸介导的吗?的意见。土壤学报,1998,18(3):344 - 344。10.1007 / BF02257563。
杨晓明,王晓明,王晓明,等。脱落酸与乙烯信号级联的相互作用。中国生物医学工程学报,2000,29(3):344 - 344。
Anderson JP, Badruzsaufari E, Schenk PM, Manners JM, Desmond OJ, Ehlert C, Maclean DJ, Ebert PR, Kazan K: aba和茉莉酸-乙烯信号通路的拮抗相互作用调节拟南芥防御基因表达和抗病性。中国生物医学工程学报,2004,26(3):349 - 349。10.1105 / tpc.104.025833。
Martín-Rodríguez JA, León-Morcillo R, Vierheilig H, Ocampo JA, Ludwig-Müller J, García-Garrido JM:番茄丛枝菌根真菌定殖对乙烯依赖/乙烯不依赖ABA的调控。环境科学学报,2011,29(3):344 - 344。10.1111 / j.1469-8137.2010.03610.x。
熊林,朱建科:脱落酸生物合成的调控。植物科学学报,2003,33(3):344 - 344。10.1104 / pp.103.025395。
Robert-Seilaniantz A, Grant M, Jones JDG, Jonathan DG:植物疾病和防御中的激素串扰:不仅仅是茉莉酸-水杨酸拮抗作用。植物科学进展,2011,29(4):344 - 344。10.1146 / annurev -发朵- 073009 - 114447。
Ward ER, Uknes SJ, Williams SC, Dincher SS, Wiederhold DL, Alexander DC, Ahlgoy P, Metraux JP, Ryals JA:协调基因活性对诱导系统性获得性耐药的药物的反应。植物科学学报,1997,33(3):366 - 366。
Ryals JA, Neuenschwander UH, Willits MG, Molina A, Steiner HY, Hunt MD:系统性获得性耐药。植物科学学报,1996,8:379 - 379。
杜伦,董霞:系统性获得性耐药。植物学报,2004,(2):366 - 366。
Eulgem T:拟南芥防御转录组的调控。植物科学进展,2005,10:71-78。
Van de Mortel JE, de Vos RCH, Dekkers E, Pineda A, Guillod L, Bouwmeester K, Van Loon JJA, Dicke M, Raaijmakers JM:荧光假单胞菌SS101诱导拟南芥代谢和转录组的变化。植物学报。2012,doi:10.1104/pp.112.207324。
Mauch- mani B, Mauch F:脱落酸在植物-病原体相互作用中的作用。中国植物学报,2005,30(4):349 - 349。10.1016 / j.pbi.2005.05.015。
lennoble ME, Spollen WG, Sharp RE:内源ABA对幼苗生长的维持:参与乙烯抑制的遗传评估。应用物理学报,2004,29(3):357 - 357。
Spollen WG, lenble ME, Samuels TD, Bernstein N, Sharp RE:脱落酸的积累通过限制乙烯的产生在低水势下维持玉米初根伸长。植物学报,2000,3:967-976。
Van Loon LC, Van Strien EA:致病相关蛋白家族及其活性,以及PR-1型蛋白的比较分析。植物病理学杂志,1999,29(3):344 - 344。10.1006 / pmpp.1999.0213。
Zamioudis C, Pieterse CM:有益微生物对宿主免疫的调节。植物生态学报,2012,26(3):349 - 349。10.1094 / mpmi - 06 - 11 - 0179。
De Torres ZM, Bennett MH, Truman WH, Grant MR:水杨酸和脱落酸之间的拮抗反应反映了早期寄主-病原菌冲突和植物防御反应。植物学报,2009,29(3):344 - 344。10.1111 / j.1365 - 313 x.2009.03875.x。
范杰,Hill L, Crooks C, Doerner P, Lamb C:脱落酸在调节植物-病原菌相互作用中的关键作用。植物科学学报,2009,30(3):357 - 357。10.1104 / pp.109.137943。
李玲,朱斌,杨萍,付东,朱艳,罗艳:番茄果实中RIN转录因子参与乙烯生物合成的调控模式。中国农业科学,2011,29(3):344 - 344。10.1002 / jsfa.4390。
确认
这项工作得到了西班牙经济和竞争力部项目AGL2011-25403的支持。我们感谢Janusz J Zwiazek(加拿大阿尔伯塔大学)对最终文本的修改。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
RP进行了生理和基因表达研究。RP还进行了统计分析,并起草了手稿。AMZ和JMGM进行激素含量分析。RA和RP构思了这项研究,RA还帮助起草了手稿。所有作者都阅读并批准了手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
波塞尔,R, Zamarreño, Á.M。, García-Mina, J.M.et al。植物内源ABA的参与芽孢杆菌megateriumPGPR在番茄植株中的活性。BMC植物生物学14日,36(2014)。https://doi.org/10.1186/1471-2229-14-36
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-14-36
关键字
- 脱落酸
- 芽孢杆菌megaterium
- 乙烯
- 激素
- PGPR
- 茄属植物lycopersicum
- Rhizobacteria