摘要
背景
根茎是陆地植物的原始茎,使物种能够入侵新的领土,是多年生的重要组成部分,尤其是在草类中。红米(选用longistaminata)是一种多年生野生水稻品种,具有许多有价值的性状,可用于改良栽培水稻品种,包括根茎性、抗病性和耐旱性。尽管有这些特征,但对这种植物根茎生长、发育和功能的分子机制知之甚少。
结果
我们采用综合方法比较了红米根茎的转录组、蛋白质组和代谢组与其他组织的差异。从不同组织中获得了116 Gb的转录组序列,用于鉴定根状茎特异性和优先表达的基因,包括转录因子和激素代谢和应激反应相关基因。蛋白质组学和代谢组学方法鉴定出41种蛋白质和100多种主要代谢产物和植物激素具有根状茎优先积累。特别令人感兴趣的是对大量基因转录本的鉴定Magnaportha oryzae这种真菌会在栽培水稻中引起稻瘟病,尽管红水稻植株没有表现出疾病迹象。
结论
一组重要的基因、蛋白质和代谢物似乎在根状茎中特异性或优先表达o . longistaminata.存在m . oryzae在明显健康的植株中,高水平的基因转录表明红米对稻瘟病具有抗性,并可能为栽培水稻提供能够抵抗稻瘟病的基因。
背景
水稻是世界上最重要的经济作物,也是人类饮食中的主要谷物,为人类提供23%的卡路里,其次是小麦(17%)和玉米(10%)[1].属选用由两个栽培品种组成,o .漂白亚麻纤维卷(亚洲栽培水稻)和o . glaberrima(非洲栽培水稻)和20多种野生物种,其中许多在世界某些地区的人类饮食中被食用。野生种选用,分别代表AA、BB、CC、BBCC、CCDD、DD(EE)、FF、GG、HHJJ和HHKK基因组,为水稻改良提供了重要的有用基因库[2,3.].
红米,选用longistaminata它是一种根状多年生野生水稻,原产于非洲,在美国被认为是一种有毒杂草。它被认为是野生的祖先o . glabberrima.基因组o . longistaminata是AA型,类似于o .漂白亚麻纤维卷.本种具有许多可用于改良水稻品种的有价值的性状,包括长花药[4],大生物量[5],氮利用效率高[6]、抗病虫害[7]和根状性状。阐明根状茎性状的遗传起源可能有助于培育一种多年生栽培水稻,这将有助于减少与年耕有关的土壤侵蚀。
根状茎是许多多年生植物的重要器官,可用于越冬和在下一个生长季节开始时快速生长[8].从根状茎再生的植物比传统的再生根系统生长的植物具有更大的活力和更快的早期生长[9].o . longistaminata它是栽培水稻最合理的多年生供体,因为它具有很强的根茎特征和相对较高的花粉育性,与其他野生水稻品种相比。然而,杂种不育是目前制约杂种快速发展的一个相当大的障碍O . longistaminata / O。漂白亚麻纤维卷十字架(10,11].
它是栽培高粱和多年生草的杂交品种,高粱propinquum,是为了绘制根茎发育的基因图谱[12].在植物中鉴定了一些根状茎富集表达的基因高粱根茎种江氏(美国halepense, 2n = 2x = 40)和美国propinquum(2n = 2x = 20) [13,14],用竹制(早) [15],尤其是红米(o . longistaminata) [16,17].综合这些研究结果表明,根茎发育和生长可能存在一个复杂的基因调控网络。
尽管根状茎在红水稻中具有重要意义,但人们对该物种根状茎生长、发育和功能的分子基础知之甚少。拓宽我们对全球基因表达谱的理解o . longistaminata为了鉴定与根茎发育和功能相关的基因和蛋白质,我们利用下一代高通量测序平台Illumina GAII和HiSeq 2000分别对根茎转录组进行测序,并将根茎与其他组织的基因表达谱进行比较。同时,我们采用无标签定量蛋白质组学技术,利用凝胶电泳和液相色谱-串联质谱(GeLC-MS/MS)对根茎和根组织的蛋白质组进行了全球查询。我们还研究了根茎和其他植物组织中的初级代谢物和激素水平。然后,我们比较了转录组、蛋白质组和代谢组的结果,以研究根茎的特异性,并确定在根茎发育和功能中起重要作用的基因、蛋白质和代谢物。数据和结果可在http://www.plantrhizome.org.
结果与讨论
转录组学和差异表达分析
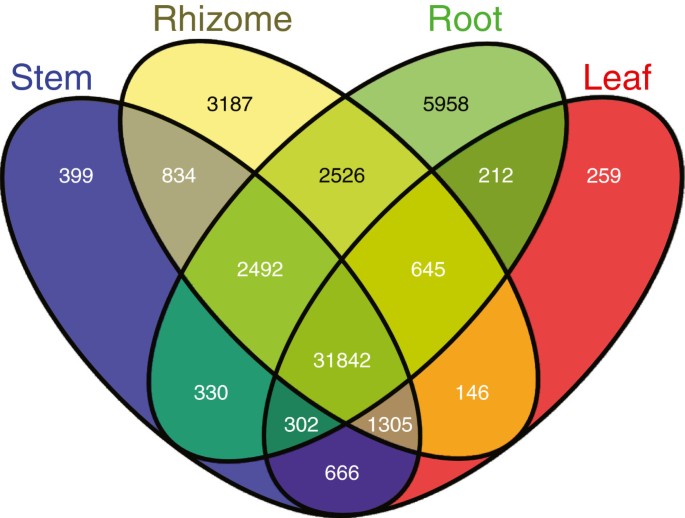
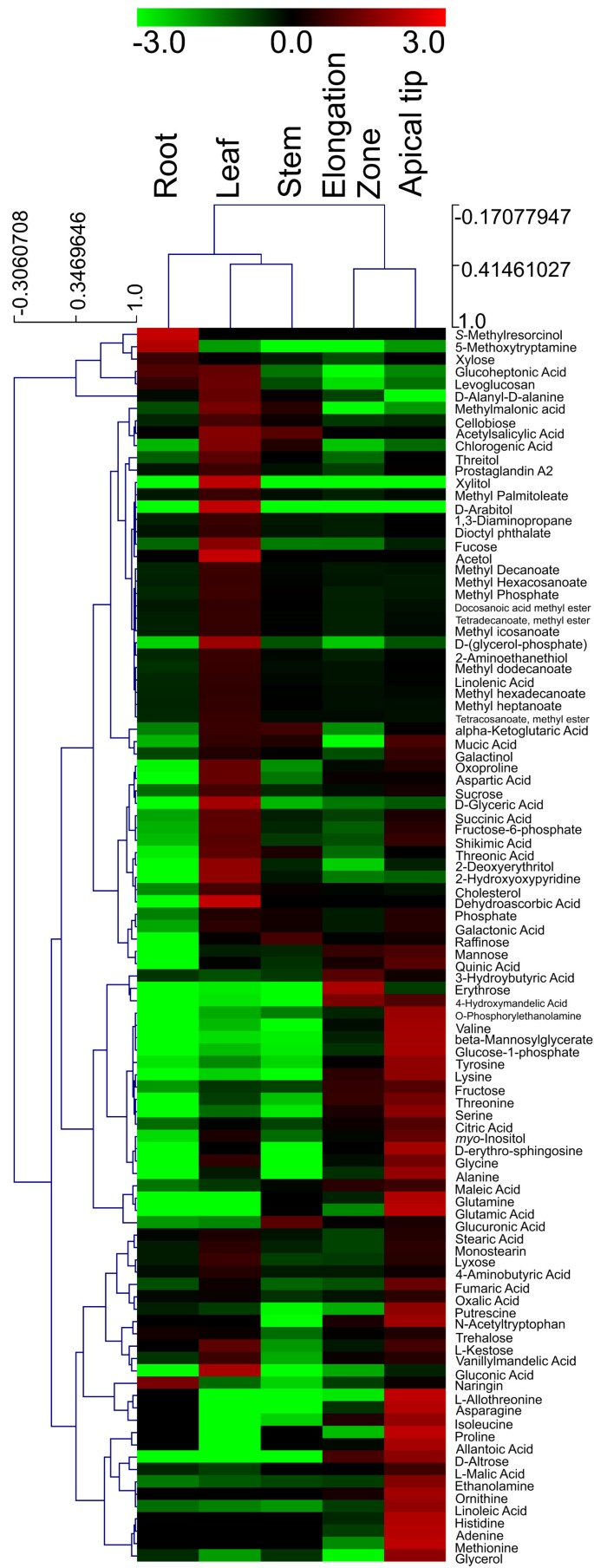
采集了根茎尖端(含分生区,简称“尖”)、相邻延伸区(简称“带”)、整个根茎(包括根尖和带)及其他组织样本(根、茎、叶)o . longistaminata分蘖活跃期的植株(图1).根茎延伸区和根尖组织的总转录组以及其他组织的RNA-seq数据,采用illumina的下一代测序技术(见方法)获得,从根尖和根茎区分别获得超过4.65亿个100 bp reads和4.5亿个100 bp reads,从整个根茎、根、叶和茎组织样本分别获得1.35亿个、129个、1.51亿个和1.43亿个50 bp reads。我们总共获得了116 Gb的转录组数据,有超过14.76亿个清洗reads,其中12.84亿个reads按照方法部分所述进行组装,生成143,625个unigenes(组装的cDNA序列)。组装的转录组数据量为101 Mb(约为基因组大小的四分之一),平均GC含量为45%,每个单基因的GC含量从11到84%不等(表2)1).
在来自“OlR”的143,625个unigenes中(o . longistaminata在UniProt或PlantTFDB数据库中,56,232个unigenes(39%)被注释为与已知基因匹配。56232个unigenes中大部分同源于植物基因(46454个或83%),5985个(11%)unigenes与真菌基因匹配,这些基因主要分布在根茎组织中(见下表)2)和1,923个(4%)匹配无脊椎动物、脊椎动物和病毒基因。
大多数基因的表达水平至少为0.1 RPKM。其中42977个基因在任意根茎组织中表达,36231个基因在所有根茎组织中表达,44307个基因在根中表达,38170个基因在茎中表达,35377个基因在叶中表达。一小部分基因仅在一种组织中特异表达,其中一种组织的RPKM值至少为0.1,而其他组织的RPKM值为0:根茎组织中有3187个unigenes,根中有5958个unigenes,茎中有399个unigenes,叶中有259个unigenes。以0.1 RPKM的表达水平为临界值,所有组织共有31842个unigenes2).
共鉴定出5985个unigenes,归属于103个真菌种,其中unigenes数量最多(3705,62%)Magnaporthe oryzae.在前20个最丰富表达的真菌unigenes(附加文件1), 5个unigenes来自Magnaporthe oryzae其余的15个unigenes来自12种不同的真菌。这些unigenes大多在根茎和根中表达量高于在叶和茎中表达量。其中一个单基因OlR_137032在根中表达量比根中高20倍,另一个单基因OlR_121956在根中表达量比根中高20倍。其中单基因(OlR_051552)含量最高黑粉菌属maydis各组织均有较高的表达水平(叶366 RPKM,茎197 RPKM,根631 RPKM,根茎531 RPKM)。
在根茎特异性表达的3187个unigenes中,有1831个(57%)与真菌基因同源,其中1184个(37%)来自真菌m . oryzae引起稻瘟病的半生物真菌病原体。其余根状茎特异性基因包括植物(37%)、无脊椎动物(5%)、脊椎动物(1%)和其他真菌的基因m . oryzae(20%)。在剩下的20%的真菌基因中,大部分是同源的刺盘孢属相对丰度最高的基因(6%,100个unigenes)。Thielavia(4%, 69个unigenes)是第二丰富的类群,其次是脉孢菌(66 unigenes),毛壳菌属(60 unigenes),Hypocrea /木霉属(43 unigenes),柄孢壳菌属(43 unigenes),Grosmannia(30 unigenes),丛赤壳属(30 unigenes),镰刀菌素(25 unigenes),绿僵菌属(17个unigenes)和曲霉属真菌(16个unigenes)等(见附加文件2).
其中一些真菌物种能够抵抗非生物胁迫,如高温或极端环境。例如,Thielavia是一种嗜热真菌,可能在生物质转化中发挥作用[18].毛壳菌属thermophilum也是嗜热的。嗜热真菌的unigenes在根茎组织中的表达量相对高于其他组织(附加文件)2).有些真菌是内生的,例如毛壳菌属globosum.这些内生真菌产生抗真菌代谢产物,并用于水稻稻瘟病的生物防治[19]、小麦叶锈病[19]、马铃薯晚疫病[20.]和玉米叶枯病[21].的种类Hypocrea /木霉属也被充分研究为生物防治剂,具有与植物根/根状茎相互作用的能力,并作为植物共生体产生细胞壁水解酶和拮抗次级代谢产物,以对抗土壤传播的病原体[22,23].属的成员绿僵菌属包括对昆虫致病的真菌,产生杀虫活性化合物[24]并在农业和病媒控制项目中用于开发化学杀虫剂的生物控制替代品[25].尽管属柄孢壳菌属,Grosmannia,丛赤壳属,镰刀菌素而且刺盘孢属含有植物病原体并引起严重的植物病害,其中一些如刺盘孢属这些物种也经常被鉴定为内生植物,通常从健康植物中分离出来,包括药用植物和根状植物[26,27].m . oryzae作为许多植物物种的病原体,特别是栽培水稻,但它可能作为内生菌存在于红水稻中。它在根茎组织中占主导地位,根据环境和植物寄主的不同,可以作为有益的内生菌或病原体发挥作用。
嗜热真菌、昆虫病原真菌和内生真菌的基因在根状茎组织中占主导地位,部分表达量较高,表明这些真菌基因可能在根状茎组织中发挥重要作用。越来越多的证据表明,许多真菌在植物中起内生菌的作用,特别是在草中[28,29],它们可能参与植物对病原体和害虫的防御[30.].此外,真菌内共生体可能在赋予植物非生物胁迫耐受性方面发挥作用[31]或可能影响生物活性代谢物的生物合成和积累[30.,32].近年来,内生植物,特别是来自药用植物、根茎种和入侵种的内生植物已成为鉴定生物活性化合物的研究热点[26,33],以促进入侵植物管理及植物群落的生物多样性[34- - - - - -37].
另一方面,5,958个根特异性注释unigenes中只有227个似乎是真菌基因,其中13个来自真菌基因m . oryzae还有四个来自刺盘孢属.其他人包括曲霉属真菌(19 unigenes),毛壳菌属(13 unigenes),Hypocrea /木霉属(11 unigenes),Thielavia(8个unigenes)等。有趣的是,有12个同源的unigenesCoprinopsis灰质,其中部分基因表现出高表达水平,但只有一个单基因来自Coprinopsis灰质在根茎中有特异性表达。此外,一个单基因,OlR_050405,编码一个纤维生物水解酶Irpex lacteus显示非常高的表达水平(64 RPKM),并在根组织中特异性表达(附加文件3.).鸟氨酸脱羧酶基因血管球intraradices根中也检测到。血管球intraradices是一种丛枝菌根(AM)真菌,在农业和园艺中用作土壤接种剂。这些结果表明,红米的根和根茎组织中存在不同的真菌种类,它们表达的一些基因水平超过了寄主植物。值得注意的是,根茎组织支持更丰富和多样化的真菌种群,并似乎特别宿主Magnaporthe oryzae.
来自真菌内生菌/共生体或病原菌/污染物的5,985个unigenes的平均表达量(RPKM)分别为:叶片0.06、茎0.13、根0.31、根尖0.33、根茎伸长区0.822).相比之下,植物基因的RPKM值更为一致且较高,叶片RPKM值平均为13.0,茎部RPKM值平均为12.5,根RPKM值平均为12.8,叶尖和区均为12.82).这些结果表明,与其他组织相比,真菌相关基因在根茎组织中表达量较高,尤其是在根茎伸长区。例如,单基因(OlR_100675)分配给酒精氧化酶m . oryzae在根茎组织中特异性表达(附加文件2).据报道,该基因在凤梨的附着孢和分生孢子/菌丝中均有高表达m . oryzae[38],是植物源信号和碳饥饿诱导的致病因子基因,但氮饥饿抑制[39].此外,使用特定的引物m . oryzae我们从健康根茎组织中诱导和纯化的分生孢子/菌丝中检测了酒精氧化酶基因(图3.G),表明m . oryzae存在于红米根状茎中。
的细胞学和分子分析m . oryzae在根茎组织中。(一)根茎组织切片用甲苯胺蓝染色,光镜观察。在单个表皮细胞中观察到棕色沉积/稻瘟病病变(箭头),但未显示病变在根茎组织表面扩散。Bar = 200 μm。(b)扫描电镜观察根茎表面(箭头)有真菌分生孢子。Bar = 50 μm。(c)红米叶片组织未检出真菌分生孢子和感染菌丝。Bar = 100 μm。(d)温室里的红米植株没有任何典型的稻瘟病症状m . oryzae.(e)真菌菌丝(箭头)从根茎组织中扩散到培养皿中,在马铃薯右糖琼脂(PDA)上培养三天。(f)真菌菌丝和孢子(箭头)从根茎组织在培养皿上生长,在PDA上培养8天。(g)一个m . oryzae -RT-PCR检测到特异性基因片段,在菌丝/菌丝(1车道)和根茎(2车道)中扩增了预测的特异性基因序列156 bp片段,而在根(3车道)和叶(4车道)中未扩增。
那么多的鉴定m . oryzae红米基因的发现有点令人惊讶,因为本研究中使用的植物没有表现出稻瘟病的症状(图3.d).事实上,过去几年在我们温室里种植的红米都没有表现出稻瘟病的症状。然而,细胞学和分子分析表明,分生孢子和菌丝m . oryzae确实存在于健康的根茎组织中(图3.).综合来看,细胞学、转录组学和蛋白质组学数据(见下文)表明,红米(o . longistaminata),就像在其他野生水稻品种和一些栽培水稻品种中发现的那样,可能会产生抗性m . oryzae甚至可能在根茎内以非致病关系的内生菌的形式藏匿真菌。红米是稻瘟病的潜在载体,因此必须掌握控制稻瘟病株内传播的手段m . oryzae(本文概述的转录组数据表明情况就是这样),并且可能具有可以转移到栽培水稻的基因,使后者具有相同的抗性特征。这些基因的鉴定将是未来对这两个物种进行基于基因组学的比较研究的关键组成部分。在这种情况下o . rhizomatis作为另一根状野生水稻品种(但分布有限,斯里兰卡),一个独特的包含锌指结构域的NBS-LRR基因已被鉴定出来,称为Pi54rh,该基因可能赋予水稻稻瘟病抗性,并在响应感染启动时显著上调[40].在我们的数据集中,该基因在所有红米组织中都有一个密切的同源基因(在核苷酸水平上约91%相同),以单基因OlR_092835为代表,这可能是红米抗性的部分原因。但在根茎中,其表达水平较其他部位略有上调,与大比例的表达水平相关性不高m . oryzae在根茎中发现转录本。
除了根茎特异性基因外,我们还对识别与其他组织相比优先在根茎中表达的基因感兴趣。利用edgeR将三个根茎组织的序列数据进行组合,并与非根茎组织进行比较[41].p值< 0.01时,与根相比,有19,259个DE(差异表达/差异表达,即显著变化)单基因,与茎相比,有18,009个,与叶相比,有21,555个。根状茎组织与所有非根状茎组织(即与根、茎、叶相结合的根状茎组织)间DE单基因数为5539个。结果表明,根尖与非根状组织间有1013个差异基因,带区与非根状组织间有1265个差异基因,全根与非根状组织间有7582个差异基因。
以上关于根茎中真菌基因检测的结果得到了以下DE结果的支持。OlR数据库对植物有372 k个独特的点击率,对真菌有155 k个独特的点击率,其中对真菌的e值最高的有3522个,其中1499个是m . oryzae.在5539种根状根状植物中,125种对真菌的杀伤效果最好,其中55种来自真菌m . oryzae.相比之下,根有6958个DE基因,而其他所有文库中98个来自真菌,4个来自真菌m . oryzae.因此,m . oryzae根据基因表达数据,似乎主要局限于根茎。
运用GOseq对GO类别进行差异表达分析[42],将组合的根茎组织与根、茎和叶进行比较。在该分析中确定的前两个生物过程类别是“刺激反应”和“多生物过程”。排在前三位的细胞成分类别是“细胞外区域”、“膜”和“细胞连接”。最主要的分子功能是“抗氧化活性”和“电子载体活性”。这些数据被用于重点鉴定可能在决定红水稻根状茎的生长、发育、分化和功能方面发挥重要作用的特定基因,如下所述。
Rhizome-enriched基因
在根茎中被鉴定为与其他组织(根、茎和叶)相比差异表达的基因中,有3795个在根茎中表达量高2倍。我们进一步鉴定了119个在根茎(尤其是根茎尖)中特异性表达或高度富集的unigenes/基因(图4),其中40%(119个中48个)与已知转录因子有关,包括YABBY、TALE、AP2和bHLH等4).这一结果与前文报道中鉴定出58个根茎尖特异性表达基因(基于微阵列杂交)一致,其中15个与转录调控相关的基因[17].在根茎生长发育中发挥重要作用的其他类型的基因也被鉴定出来,其中一些在根尖或伸长区优先表达。
重要的是,某些类型的植物激素(如生长素和赤霉素)和胁迫响应相关基因可能在根茎发育和环境响应的调控中发挥关键作用[43].事实上,在红米转录组数据集中,我们发现了144个与植物激素相关的unigenes/基因,包括生长素(78个unigenes)、细胞分裂素(24个unigenes)、乙烯(18个unigenes)、油菜素类固醇(BRs, 11个unigenes)、赤霉素(GAs, 8个unigenes)和脱落酸(ABA, 5个unigenes)的产生、感知和代谢相关的基因(附加文件)5).其中,根茎中表达上调的基因包括赤霉素刺激转录相关蛋白2 (OlR_126102)、烯受体样蛋白2 (OlR_035191和OlR_111522)、生长素反应蛋白IAA14 (OlR_061172)和生长素反应因子11 (OlR_065461)。其他与植物激素相关的基因,如生长素反应蛋白IAA8 (OlR_133718和OlR_078134)、生长素诱导蛋白样蛋白(OlR_069872和OlR_015268)和细胞分裂素脱氢酶10 (OlR_028085和OlR_118428)在根状茎中均被下调。之前的研究亦有类似的结果[17],比较了来自o . longistaminata到o .漂白亚麻纤维卷通过使用Affymetrix芯片杂交基因组。然而,由于这些基因在我们的研究中是从头测序的,因此在之前的研究中可能发生的交叉或非特异性杂交的可能性被排除了,这为这些基因参与根状茎特异性过程提供了更有力的证据。因此,这些基因可能在红水稻根茎发育和环境响应的调控中发挥重要作用。
此外,扩张素家族基因、生长调节因子基因和其他胁迫相关基因,如β-葡萄糖苷酶、热休克基因、干旱诱导的s样核糖核酸酶基因、抗病基因、LRR受体样丝氨酸/苏氨酸蛋白激酶和含NB-ARC结构域蛋白,似乎优先表达于根状茎组织中。例如,Expansin-A2可能在植物细胞壁的松动和延伸中起作用,并可能参与水稻浸水过程中节间的伸长[44],或者在这种情况下用红米。β-葡萄糖苷酶与植物重要的生理过程有关,如对生物和非生物胁迫的反应,以及植物激素和化学防御化合物的激活[45].这些酶在红米根茎中所起的确切作用还有待确定。LRR受体样蛋白激酶基因在其他植物细胞分裂和伸长的区域高度表达,并被赤霉素诱导[46].大多数被鉴定为参与植物防御的受体样激酶(rlk)属于LRR-RLK类,包括水稻Xa21蛋白[47].NB-ARC (APAF-1、R蛋白和CED-4共享的核苷酸结合适配器)结构域通常与植物中的抗性(R)蛋白相关,赋予先天免疫系统的特异性[48].这些基因/蛋白质的进一步鉴定可能揭示红水稻在入侵、地下防御和根茎发育中的作用。
与根茎生长发育相关的27个基因与其他组织相比在根茎中表达量最高和特异性最高(表2)3.).其中8个是转录因子,分别属于YABBY、Bzip、TALE和bHLH基因家族。其他包括倍半萜合酶,脯氨酸丰富的蛋白质,木瓜样半胱氨酸蛋白酶和一种O甲基转移酶。
植物O已知-甲基转移酶(OMTs)参与植物特化代谢物的甲基化,特别是苯丙类化合物和类黄酮,它们可能参与抵御病原体或害虫[49].富脯氨酸蛋白(PRP)是植物细胞壁蛋白,其表达受生物和非生物胁迫相关因素的影响。然而,越来越多的证据表明,PRP蛋白可能在正常发育中发挥重要作用,并在植物发育过程中决定细胞类型特异性的壁结构,影响耐寒性[50]或抗病能力[51]在大米里。这些基因可能在红米根茎组织中发挥类似的作用。木瓜样半胱氨酸蛋白酶(PLCPs)在植物-病原体/害虫相互作用中发挥重要作用[52].由于根状茎是一种地下茎,可能会持续受到生物(细菌、真菌、线虫、昆虫和其他病原体)和非生物(干旱、温度和盐)胁迫的挑战,这些胁迫和抗性相关基因在根状茎组织中的高表达有助于其在环境中的竞争能力,并可能使其具有入侵性。
共鉴定出1870个(3%)基因与已知植物转录因子(TFs)有显著同源性[53].转录因子(TF)在调控包括根茎发育在内的各种生理和发育过程中的基因表达中起着至关重要的作用。事实上,许多TF基因在根茎中被特异性表达或高度富集(图4、表3.和附加文件4),尤其是YABBY和bHLH家族的成员。YABBY家族成员已被证明优先表达在包含分生组织和器官原始的未成熟器官中,该TF家族似乎参与调节器官形成的各种功能[54- - - - - -56]和赤霉素代谢[57].它们在红米根茎尖端的高表达支持这些功能。因此,这个家族的基因可能对根茎的生长和发育非常重要。bHLH超家族在植物的基本生理发育过程中起着重要的作用。例如,在拟南芥, bHLH基因已被证明参与调节毛状体的分化[58], bHLH转录因子UPBEAT1 (UPB1)通过直接调控根部一组过氧化物酶的表达,调节细胞增殖与分化之间的平衡[59].在玉米中,一种已知的bHLH转录因子大刍草分枝1 (TB1)参与了侧分支,部分解释了玉米和大刍草腋下分支的形态差异[60].水稻TB1基因(OsTB1)在水稻横向分枝中起负调控作用[61].由此可见,红米根尖和伸长区bHLH和YABBY基因可能在红米根尖优势的建立和维持以及红米根尖快速线性入侵生长中发挥重要作用。
一种推测的低聚糖转移酶在根状茎生产物种Johnsongrass (高粱halepense) [13].在我们的数据集中,我们还发现了一个低聚糖转移酶基因,该基因在根茎组织中表达水平相对较高,但在其他组织(根、茎和叶)中也表现出较高的表达水平3.).该基因在红米和强生草中起什么作用尚不清楚,但它可能在决定细胞壁组成方面起作用,因此与参与根状茎分化和生长的调节基因相比,它可能是一种下游蛋白质。
相比之下,我们在根茎中发现了4个高特异表达的倍半萜烯合成酶基因,其中3个(OlR_061631、OlR_000238和OlR_080975)在根尖、根区和根茎全根组织中表达量极高(>1200 RPKM),而在根、茎和叶中表达量极低(<0.5 RPKM)(表2)3.).这类酶将类异戊二烯途径中间体法尼基二磷酸转化为数百种不同的倍半萜类化合物,这对植物抵御食草动物以及吸引传粉者很重要[62],以及其他功能。一些倍半萜合酶基因已从玉米中克隆和鉴定,如stc1[63),tps10[64].这些基因产生化学防御信号来吸引食草动物的天敌。此外,植物萜类化合物的形成不仅对环境(生物和非生物)线索有反应,而且还与发育过程有关[65].例如,上调倍半萜合酶基因拟南芥花的器官当然与花的发育有关[66].花挥发性萜烯在吸引多种传粉者方面也起着重要作用,因此对植物繁殖具有重要意义[67].根茎是红水稻等根状植物的主要能量储存和繁殖器官。
本研究表明,倍半萜合酶基因在红米根茎中高表达,这可能支持了根状萜类化合物在根茎发育和繁殖中也发挥重要作用的假设,可能是作为信号分子,接近激素功能,或者是根茎化学防御武器库的主要参与者。在拟南芥MYC2是一种基本的bHLH转录因子,直接结合到倍半萜合酶基因的启动子上TPS21而且TPS11激活他们的表情。MYC2也通过调节GA反应基因的子集与GA信号相连[68].有趣的是,在本研究中,我们还发现一些bHLH转录因子基因在根茎组织中高度特异性表达(见上文),同时这些倍半萜烯合成酶基因也高表达(表2)3.).进一步研究根茎组织中bHLH家族特定成员、萜类合成酶基因/基因产物和植物激素之间的分子机制和相互作用,将为我们理解根茎的发育和功能提供有价值的数据。与其他根状植物的比较将使我们能够确定这些作用在植物王国中是保守的,还是特定于单个物种。
o . longistaminata根茎和根蛋白质组
采用无标记GeLC-MS/MS方法鉴定和测定了根状茎组织(根尖和延伸区)和根中蛋白质的相对丰度o . longistaminata.使用这种方法,我们能够在每个生物重复中识别近30,000个质谱和12,194个非冗余肽,在蛋白质水平上的错误发现率(FDR)小于1%。
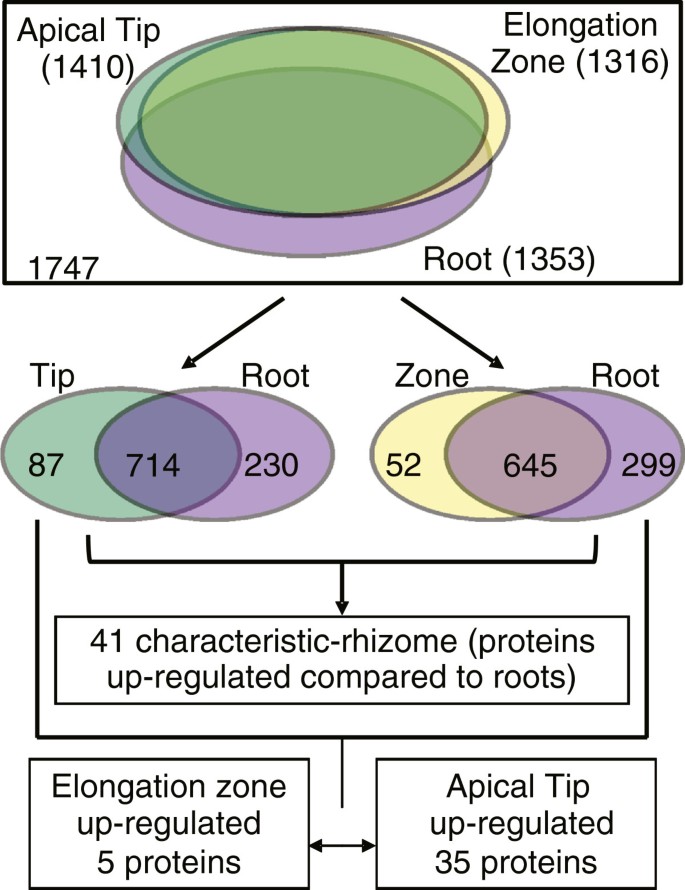
总共有2921个非冗余蛋白组(附加文件6)在5个生物重复中鉴定。只有在至少3个生物重复中检测到的蛋白质才被考虑用于根状茎(尖端和区)和根组织之间差异调控蛋白的下游分析。在生物重复中共重复检测到1747种蛋白质。在顶端发现的蛋白质数量最多(1410个),其次是根部(1353个),最后是延伸区(1316个)(图5).
红米根茎特征蛋白的鉴定及根尖与延伸区蛋白的差异调控。比例维恩图,表示每种蛋白质的总数选用longistaminata根茎组织光谱计数前后定量分析。在根茎根尖、根茎伸长区和根组织中共鉴定出1747种蛋白质,并被认为是可复制的(至少在3个生物重复中检测到)。其中,在叶尖、叶带和根组织中分别检测到74、15和288个蛋白质。差异表达采用TFold检验p值为0.05。同时满足折叠标准和统计标准的鉴定被认为是不同的规范。经统计分析,与根部相比,叶尖和叶带分别上调了87个和52个蛋白。将在根尖和延伸区均被发现上调的蛋白质组合起来,形成一个非冗余的上调特征蛋白列表。去除与根部表达水平相同或较低的表达水平,确定尖端和区之间的差异。
在2921个非冗余蛋白中,有207个来自真菌。有趣的是,其中123个(59%)来自Magnaporthe oryzae,部分在根茎尖部和/或根茎伸长区高度表达(见附加文件)7).例如,一种依赖于atp的RNA解旋酶FAL1 (OlR_047156)在根茎组织中检测到的水平远高于根,尤其是在根茎尖。根状茎组织中其他上调的真菌蛋白包括gtp结合核蛋白GSP1、60S核糖体蛋白L12、小COPII涂层GTPase SAR1和t复合物蛋白1亚基α(附加文件)7).其余84个真菌蛋白来自该属脉孢菌蛋白质(17),刺盘孢属蛋白质(6),柄孢壳菌属蛋白质(6),毛壳菌属(5种蛋白质)和Thielavia(5种蛋白质)等。这一结果与转录组分析一致m . oryzaeUnigenes被检测到,特别是在根茎组织中(见上文),并证实了这种真菌在红米组织中的存在。
为了检测根茎特征蛋白(与根相比,根尖和区均上调的蛋白),进行了两两比较和GO分析:根尖与根和区与根。从这一分析中,我们检测到41种上调的根茎蛋白,称为根茎特征蛋白(图2)6和附加文件8).为了确定根茎组织(尖端和区)内部的差异,我们将根茎尖端和延伸区与根相比鉴定出的上调蛋白进行两两比较,从而检测到仅在一个根茎组织中与根相关的高度富集蛋白,而不包括在先前列出的41个根茎特征蛋白中。共有40种蛋白质在根茎组织之间表现出不同的调控(图5和附加文件9).
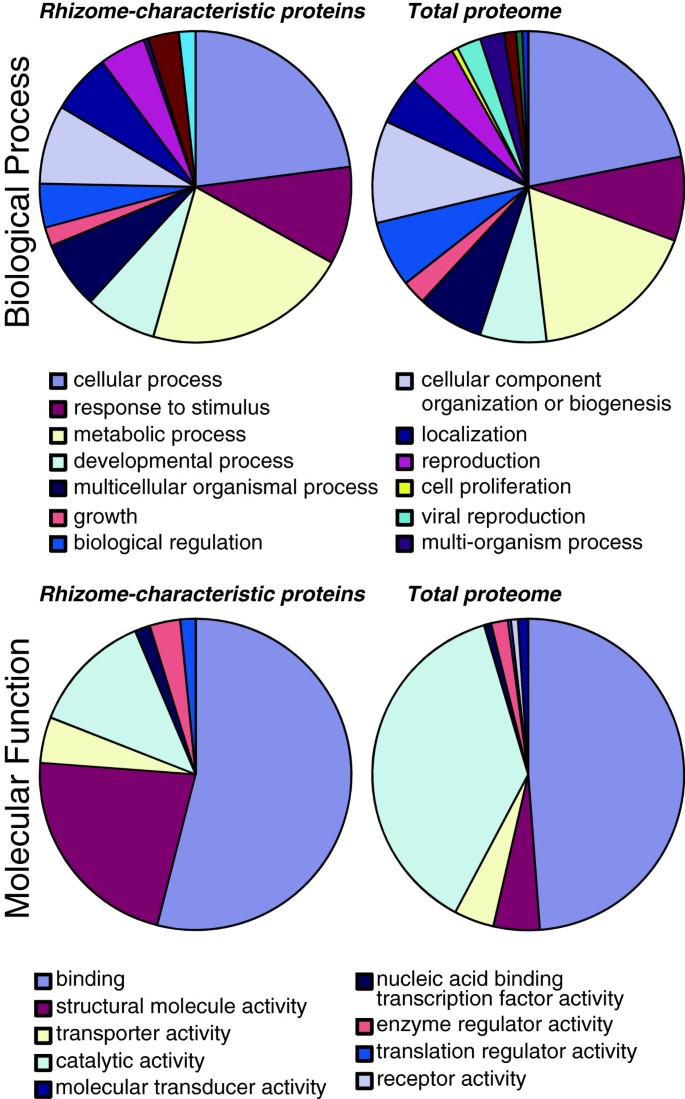
此外,我们绘制了红米根茎蛋白质在GO类别、生物过程和分子功能中的分布(图7).分析结果显示,在生物过程类中,亚类“细胞过程”最多,其次是“代谢过程”和“刺激反应”;在分子功能类中,亚类“结合”最多,其次是“催化活性”和“结构分子活性”(图)7).考虑到在这个比较中使用的组织的活跃生长状态,这些结果并不令人惊讶。
蛋白质组学结果与转录组学结果基本一致,特别是那些在根茎组织中具有高表达水平的unigenes/蛋白质(附加文件)10),如蔗糖合酶1 (OlR_068383)、微管蛋白α -3链(OlR_005131)、热休克蛋白(OlR_074205)、翻译控制肿瘤蛋白同源物(OlR_123383)和甘油醛-3-磷酸脱氢酶(OlR_135779)。然而,对于一些高表达的unigenes,没有检测到相关的肽/蛋白,如细胞色素P450如TBP (OlR_135247)和衰老相关蛋白(OlR_101485)。这可以用生物学过程和检测方法固有的技术限制以及相关蛋白质的性质来解释[69].在以前对腺毛体的研究中,一些基因也得到了类似的结果[70,71]和正在发育的种子[72].我们之前对普通芦苇根茎的研究也表明,稳态转录本和蛋白质水平往往不成比例。
检测那些与转录水平不一致的蛋白质有助于揭示转录后调节的例子。事实上,我们在某些组织中检测到一些蛋白质,其转录水平与蛋白质表达水平不一致。越来越多的证据表明,尽管在许多情况下蛋白质水平是由转录控制决定的,但在其他情况下,mRNA转录谱不能很好地预测蛋白质水平,因为大量的转录后调节活动和翻译后事件会产生蛋白质的高度多样性[73].在某些情况下,蛋白质丰度比mRNA丰度更为保守[74].因此,本研究中使用的两种互补方法(转录组分析和蛋白质组分析)很可能会提供更全面的机制,以确定和控制类似物种的根状性o . longistaminata.
10种根茎特征蛋白为40S和60S核糖体蛋白,在根尖和延伸区表达水平相似(附加文件)8).另外6个核糖体蛋白在尖端与延伸区相比上调(附加文件)9).这些蛋白与分生组织中的细胞分化有关[75],最近也发现它们富集于Equisentum根状茎(76].人类增殖相关蛋白2 g4 (Q9UQ80,附加文件)的同源蛋白8),参与拟南芥核糖体的生物发生和器官生长[77],在根茎组织中含量也较高,尤其是根尖内。另一种在根茎组织中表达上调的蛋白是t复合体蛋白1 (TCP1)。发现该蛋白有3个位点,每个位点都包含一个不同的亚基(α、θ和eta;额外的文件8),且与延伸区相比,尖端的表达量更高。TCP1参与细胞质中新翻译蛋白的折叠,包括小管蛋白和肌动蛋白[78,79].与这一发现一致,一个肌动蛋白-1和两个小管蛋白(α和β链)也被发现在两个根茎组织中以相似的水平富集。据报道,肌动蛋白和微管蛋白在分生组织中积累[80]并参与细胞延伸[81,82].此外,一种参与调控肌动蛋白丝的形成和稳定性的绒毛蛋白-3 [83],与尖端相比,在延伸区表达上调,这加强了与细胞骨架相关的蛋白质可能在根茎生长发育过程中发挥重要作用的观点。根状茎尖与伸长区相比蛋白水平上调(附加文件)9)主要与蛋白质命运(热休克蛋白、配偶蛋白、26S蛋白酶体)、蛋白质合成(核糖体蛋白、延伸因子、翻译因子)和RNA加工(转录延伸因子、核糖核酸酶、肽酰脯氨酸顺反异构酶、精氨酸- trna)有关,由于该组织细胞分裂和转录水平较高,这是可以预期的。因此,蛋白质组学数据描绘了参与细胞分裂、分化和生长的蛋白质在根茎顶端和延伸区积极表达的情况,并支持了转录组学结果。
红米代谢物分析
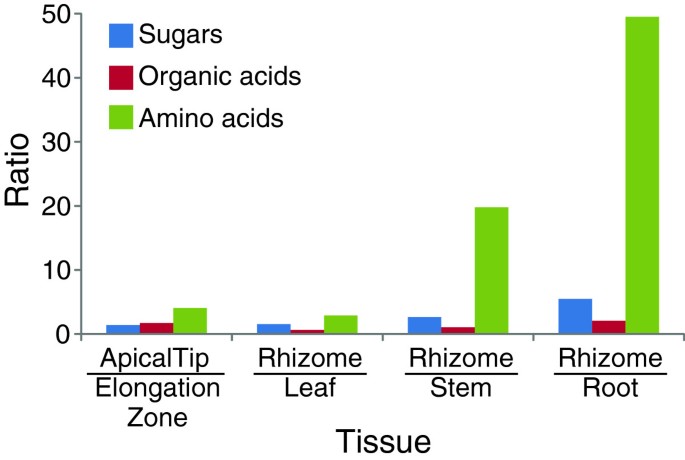
采用标准代谢物谱分析方法,通过GC-TOFMS鉴定和定量,我们从红米根尖、根茎伸长区、茎、叶和根组织中检测和定量了100种初级代谢物,包括24种糖、32种有机酸、20种氨基酸等(图8,附加文件11).如图所示8,所有组织的整体代谢产物分布都是独特的,即使是根茎的两个组织,根尖和延伸区也是如此。总的来说,根状茎组织的平均糖含量高于叶、茎和根。在根茎尖端和根茎带中,果糖和蔗糖分别是含量最高和次之的糖类,其次是根茎尖端的葡萄糖-1-磷酸和根茎带中的甘露糖(见表1)4).这些也是其他组织中最丰富的糖。与其他组织(叶、茎和根)相比,根茎组织中3种糖(d -戊糖、红糖和葡萄糖-1-磷酸)的浓度高于10倍以上。有趣的是,尽管甘油在根茎组织中不是特别丰富,但在根茎尖端发现的甘油含量是根茎区域的24.6倍(附加文件)11).这些结果表明,参与细胞分裂和扩张的关键代谢产物靶向于顶端和延伸区。
在32种有机酸中,l -苹果酸、柠檬酸和quinate含量最高4),尤其在根茎组织中。此外,根茎组织中4-羟基扁桃酸和尿囊酸的浓度比其他组织高15倍以上。先前的研究表明,大豆植物氮从结瘤的根部向新梢运输的主要形式是尿囊酸和尿囊素,而尿囊素的合成部位是结瘤[84].还需要更多的实验来确定这两种化合物在红米根茎中所起的作用,但目前的证据表明,它们在提供根茎生长和分化所需的氮,特别是支持氨基酸生物合成方面发挥了作用。红米不具有结节,这就提出了在这种物种中这些化合物是在哪里产生的问题。
与其他组织相比,根茎组织中氨基酸含量最高,尤其是根茎尖9).例如,九种氨基酸(天冬酰胺、谷氨酰胺、组氨酸、谷氨酸、脯氨酸、n -乙酰色氨酸、l -异苏氨酸、鸟氨酸和蛋氨酸)的浓度;见表4)被观察到比根、叶和茎至少高20倍。在根茎组织中,天冬酰胺、谷氨酰胺和氧脯氨酸含量最高。3种氨基酸(l -异苏氨酸、脯氨酸和谷氨酸)在根茎尖部富集程度高于根茎伸长区11).非蛋白质氨基酸在该组织中的作用尚不清楚。
这些结果表明根状茎与其他组织存在显著的代谢差异,尤其是根状茎的根尖,根尖上有分生组织区。与根、叶和茎等其他组织相比,该组织含有许多重要的初级代谢产物。这一结果可能表明,与细胞分裂和生长有关的代谢需求升高发生在这一区域。也有可能,在许多初级代谢物的绝对定量中观察到的一些巨大差异可能是由于根状茎尖端和延伸区的平均细胞尺寸较小,相比于从叶、根和茎分析的更成熟的组织,后者包含更大的液泡和纤维细胞。然而,细胞大小的差异并不能解释这些不同组织中不同化合物和不同类别化合物之间相对丰度的差异,这支持了与根茎生长和分化有关的代谢过程与其他评估组织的代谢过程显著不同的假设。这些结果进一步支持了根状茎与根有很大不同的假设,不仅在解剖学(恒星结构)和基因表达上,而且在代谢上也有很大不同。上述三大类中的14种化合物在根茎组织中含量最高(见表1)4和附加文件11)对根茎的发育可能特别重要。
如前所述,通过转录组测序鉴定了许多植物激素相关基因。我们还研究了12种植物激素/生长调节剂在不同组织中的分布(见表2)5),包括赤霉素(GA)、脱落酸(ABA)反式玉米素,独联体-玉米素,异戊烯基腺嘌呤(ip),吲哚-3-乙酸(IAA),水杨酸(SA),茉莉酸(JA), D-SA, D-ip, D-反式-玉米素和D-ABA。其中四种化合物,ABA, IAA, JA和SA,存在于所有组织中,而其他化合物要么没有检测到,要么存在于如此低的浓度,以至于无法在本分析可用的组织样本中定量。SA在叶片和茎中非常丰富,这是有道理的,因为这些地方是它被合成的地方。另一方面,ABA在根茎组织中含量最高,在根尖最高,这支持了生长调节剂控制根茎发育的模型[43].根茎尖3种激素(ABA、JA和SA)浓度均高于区域。一般来说,ABA介导垂直茎尖分生组织和花序的变化,导致芽和种子休眠。ABA也是植物抵抗病原体的重要信号,影响JA的生物合成[85].它在根茎顶端分生组织中的作用仍有待阐明,但基于用于分析的组织正在快速生长的事实,它似乎在根状茎中发挥的作用不同于在直立茎中发挥的作用。
结论
全面探测非模式植物物种的转录组、蛋白质组和代谢组的能力,导致发现了许多基因和蛋白质,这些基因和蛋白质特异性地表达在红水稻的根茎组织中,选用longistaminata.其中转录因子、激素代谢和胁迫反应相关基因可能在根茎分化和生长中起调控作用。一个非常有趣的发现是发现了一大批m . oryzae(真菌)基因优先在根茎中表达,即使这些植物没有表现出稻瘟病的症状。这些基因与红米基因的相互作用可能导致该物种具有抵抗这种疾病的能力。此外,我们还发现了红米中存在大量内生真菌的证据,特别是在根茎组织中。内生菌已被用作抗菌剂和其他具有药理和农业化学应用的生物活性特化代谢物的来源,它们是植物微生物群的重要组成部分[30.].由于测序技术的新改进,植物微生物组的研究已在近年来开展拟南芥根(86,87],尽管这些研究主要集中在宿主特异性细菌内生菌群落上。根与根是地下器官,具有相似的土壤/根际环境。更详细地研究根状茎物种的微生物群落,特别是根状茎组织中的真菌内生菌,可能会使我们对植物共生的理解取得重大进展[88],生长,防御,抗压力,侵略性和生产力。最后,代谢物剖面实验进一步证明,红米的根状茎组织与其他组织,特别是根有显著差异,支持了根状茎确实更像茎而不是根的假设,不同物种的根状茎可能是类似的植物器官。
方法
植物材料,样品采集和组织分析
红米(o . longistaminata)的植物,最初从国际水稻研究所获得,在3加仑的花盆中种植,并在华盛顿州立大学生物化学研究所的温室中进行无性繁殖(图1a).分蘖活跃期,根茎根尖(含分生区)及其邻近伸长区(图1b)从刚挖出的根状茎中快速解剖,并在N液中快速冷冻2.其他植物组织,包括叶、茎、根和整个根茎,也同样是从同一时期的同一植物中收集的。样本组织保存在-80°C,直到进一步加工。总共取样了5个复制植物(每种类型的组织有5个独立的生物重复)。所有程序都使用完全相同的组织样本(来自普通研磨机)进行RNA和蛋白质分离,以确保可以对RNA和蛋白质数据进行直接比较。用于组织学分析,根茎节和节间(图1c)切割(~1毫米)并固定在pH 7.0的磷酸盐缓冲液中,4°c。切片用甲苯胺蓝染色10s,在尼康4500数码相机下观察。
Illumina库的构建和测序
从各种组织中获得总RNA和mRNA (100 mg),并如前所述用于Illumina测序文库构建[89].
对于根茎根尖和延伸区样品,我们在不同的Illumina测序平台上生成了配对端文库进行测序:GAII上的2 × 54 bp格式和HiSeq 2000上的2 × 100 bp格式。对于叶、茎、根和整个根茎组织样本,为每种组织类型生成5个单独的复制文库,然后根据制造商的说明使用50 bp单读格式在单个Illumina流细胞通道上对每种组织类型进行多重测序。
通过Illumina数据处理管道执行基调用和质量值计算,各种质量控制,包括删除包含引物/适配器序列的读取,修剪读取长度和基于评分值的高质量读取的过滤。
分离、培养、细胞学分析和分子操作Magnaporthe oryzae
从温室收集新鲜健康的红米根状茎,并按所述进行表面消毒[90].分离、生长和维持M。oryzae、培养基组成、核酸提取均如前所述[90,91].将根茎组织切下(~20 μm),固定在pH 7.0的磷酸盐缓冲液中,在4℃下进行光镜检查。切片用甲苯胺蓝染色10 s,在尼康4500数码相机下观察。对于扫描电镜(SEM),新鲜根茎样品按照报道的方法进行处理和观察[92].
使用NanoDrop 2000分光光度计(Thermo Scientific, Wilmington, DE)评估菌丝/菌丝RNA样品的质量和数量260:一个280比值大于2.0被认为适合RNA质量。RT-PCR分析中,1 μg总RNA经2 μl RNase-free DNase (1 U/μl;Promega公司,Fitchburg WI, USA)使用SuperScript®II逆转录酶试剂盒(Invitrogen, Carlsbad, CA, USA)进行逆转录。所使用的正向和反向引物被设计用来扩增一种酒精氧化酶基因m . oryzae;正向引物:5 ' - ATGATGACTTCCAGGCCAAG -3 '和反向引物:5 ' - AAGCGATGGGGTACGTGTAG -3 '),预期PCR扩增子156 bp。PCR反应在以下条件下进行,最终体积为25 μl:(1) 10 mM引物(R + F);(2) 20ng基因组DNA或200ng cDNA;(3) 10×缓冲;(4) 0.5 U Taq。PCR按以下程序进行:94°C, 5 min, 1个周期;94°C为50秒,55°C为50秒,72°C为80秒,共34个循环;72°C, 10分钟,一个周期。RT-PCR产物采用1.5%琼脂糖凝胶电泳分析。
数据汇编、注释和微分表达式分析
过滤后的读取数据使用CLC Genomics Workbench 5.0进行组装,并带有包括脚手架选项在内的默认设置。使用EMBOSS trimest去除潜在的聚a尾[93]然后在iAssembler包中完成MIRA和CAP3 [94].整个数据集已存入GenBank短读档案(SRA),登录号:PRJNA196977、SRR828682、SRR830212、SRR830652、SRR833549、SRR831108、SRR834501、SRR834502和SRR831166。可在以下网址浏览:http://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA196977.
使用转录组计算工作台(TCW)对unigenes进行注释和查询[95],它是PAVE (Program for assemble and views ESTs) v3软件的扩展[96].使用singleTCW管理器,组装的unigenes (contigs和singletons)用UniProt分类数据库的一个子集进行注释[97]和来自植物ttfdb的推测转录因子[53],并对满足BLAST E-value截断值1E-10的匹配进行分配。读取计数被输入到TCW OlR数据库中,并计算RPKM(每千碱基每百万次读取)值。单基因DE p值用edgeR计算[41], GO p值用GOseq计算[42].
蛋白提取和SDS-PAGE
根茎根尖、伸长区和根的组织在液氮中冷冻,并在砂浆中研磨得到细粉。如Balbuena等人所述,将200 mg粉末等分用于苯酚蛋白提取。[76].使用BCA蛋白试剂盒(Thermo Fisher Scientific, Houston, TX)测定蛋白浓度,以BSA为标准。蛋白质提取分5个生物重复。凝胶电泳在12%聚丙烯酰胺凝胶变性条件下进行,每个凝胶使用20 mA。在标准条件下用胶体考马斯蓝染色。
凝胶内胰蛋白酶消化和LC-MS-MS分析
在蛋白质消化之前,每个生物复制的凝胶通道被切成10个等大小的片段,用干净的手术刀切成大约1毫米的立方体,并转移到96孔板设备(MultiScreen Solvinert Plates, Millipore)。根据舍甫琴科等人进行胰蛋白酶消化。[98].每个胰蛋白酶消化和干燥的样品在0.1% (v/v)甲酸中重建,并使用ProteomeX LTQ质谱仪(Thermo Fisher,圣何塞)进行纳米喷雾-液相色谱-串联质谱(nsi - lc -MS/MS)分析,如前所述[76].
数据库搜索
使用虚拟核糖体软件1.1版本翻译红水稻Illumina转录组组装(OlR)序列并扫描开放阅读框(orf) [99].对于每个序列,报告了最长的ORF。将蛋白质序列与随机序列(即诱饵序列)结合,使用内部开发的程序(DecoyDB Creator,可在http://www.oilseedproteomics.missouri.edu).使用Bioworks 3.3.1软件包(Thermo Fisher)下的SEQUEST对连接蛋白数据库(26,894个条目)进行检索,并使用搜索引擎处理器工具验证肽谱匹配(PSM) [One hundred.].如前所述,调整了光谱、肽和蛋白质的截断点,以实现在每个生物重复的蛋白质水平上的1%的错误发现率[76].
相对蛋白定量
光谱计数用于估计每个复杂蛋白质样品中的单个蛋白质数量。将含有常见肽的蛋白质进行分组,并根据每个蛋白质组的光谱计数进行相对定量。这样,在每个蛋白质组中,共享光谱只计算一次,避免了定量值不足。蛋白质组学模式实验室[101],评价两种根茎组织间的定量差异。谱数首先使用行西格玛归一化[101在PatternLab浏览器中找到。然后使用TFold测试模块进行两两比较[102来检测不同组织间积累蛋白质的差异。在至少3个生物重复中检测到的蛋白质被考虑用于TFold试验,bhq值设置为0.05。此外,为了最大化低丰度蛋白质检测,f -严格度参数也进行了优化[102].
功能注释和分类
使用Blast2GO工具根据基因本体(GO)术语对不同调控的蛋白质进行注释和功能分类[103].使用BLASTP程序对NCBI nr数据库使用默认参数和1×10进行比对6对于期望值。映射和注释步骤也使用BLAST2GO默认值执行。此外,GO术语来自植物GO Slim (http://www.geneontology.org/GO.slims.shtml)使用Blast2GO模块将本体分配给每个条目。生物过程和分子功能相关的GO组合图在第二层次表示。
分层聚类
采用欧氏距离作为距离度量,在PermutMatrix软件中使用UPGMA对根茎根尖和延伸区之间差异调控蛋白的光谱数据进行聚类[104].原始光谱数据除以每个聚类蛋白的平均光谱计数,然后进行log2变换。
初级代谢产物的提取和衍生化
从上述种植的植物中采集红水稻的叶、茎、根、根茎尖和根茎伸长区组织(每个组织来自不同植物的6个生物重复),在液氮中冷冻。所有样品保存在-80°C,直到需要进行GC-MS分析。主要代谢产物提取如下。样品被冻干,然后在微移管中使用单个5毫米钢球和1.0 mL甲醇:异丙醇:水(5:2:2)的萃取溶剂并涡旋破坏。收集上清液,16100 × g离心2 min,浓缩至干燥。用二次萃取溶剂(乙腈:水(1:1))对干燥的提取物进行重组。干燥上清液进行进一步分析,然后在16100 × g下离心5 min。20mg·ml的溶液中加入5 μl-1加入98%纯度的盐酸甲氧胺(Sigma, St. Louis, MO)在吡啶中,在30°C摇晃90分钟,以保护醛和酮基。加入45 μl MSTFA和1% TMCS (1 ml瓶,Pierce, Rockford IL),在37°C震动30分钟,使酸性基团三甲基硅化。
初级代谢产物的提取和衍生化
从上述种植的植物中采集红水稻的叶、茎、根、根茎尖和根茎伸长区组织(每个组织来自不同植物的6个生物重复),在液氮中冷冻。所有样品保存在-80°C,直到需要进行GC-MS分析。主要代谢产物提取如下。样品被冻干,然后在微移管中使用单个5毫米钢球和1.0 mL甲醇:异丙醇:水(5:2:2)的萃取溶剂并涡旋破坏。收集上清液,16100 × g离心2 min,浓缩至干燥。用二次萃取溶剂(乙腈:水(1:1))对干燥的提取物进行重组。干燥上清液进行进一步分析,然后在16100 × g下离心5 min。20mg·ml的溶液中加入5 μl-1加入98%纯度的盐酸甲氧胺(Sigma, St. Louis, MO)在吡啶中,在30°C摇晃90分钟,以保护醛和酮基。加入45 μl MSTFA和1% TMCS (1 ml瓶,Pierce, Rockford IL),在37°C震动30分钟,使酸性基团三甲基硅化。
主要代谢物GC-TOF - MS分析
主要代谢物在Pegasus 4D GC-TOF质谱系统(LECO, St. Joseph, MI)上分离、鉴定和定量,配备MPS-2 Prepstation样品机器人(Gerstel, Muehlheim,德国)和RTX®-5Sil质谱,Integra-Guard®色谱柱(30 m × 0.25 mm ID × 0.25 μm膜厚),Restek (GmbH, Bad Homburg,德国)。烤箱温度最初保持在50°C 1.0 min,提高到20°C·min-1至330℃,保持5.0 min。柱流量(He,恒定)为1ml·min-1.以无分裂方式注入1.0 μL样品。质谱从m / z35-500,速率为17谱·s-1.初级代谢物数据分析使用chromof 4.41版软件进行,该软件支持色谱图中所有质谱的自动反褶积,内置共洗脱代谢物的质谱校正,计算保留指数,并确定合适的片段质荷比用于选择性定量。
使用内部代谢物质谱库和LECO/Fiehn代谢组学库进行化合物鉴定。每个确定的代谢物被分配一个相似值,这是收集的谱和库质谱之间相似性的测量。只有当该值高于500作为临界值时,才分配标识。在色谱的统计比较特性中,处理后的样本被添加到样本表中,并分配给各自的组。对齐处理方法提供了保留时间(RT)和质谱匹配两个参数。RT匹配标准考虑了峰值之间的最大RT差和最大调制周期数。对于光谱匹配,定义了质量阈值和最小相似度匹配。除了初始峰值发现未发现的峰的单独信噪比外,还定义了用于统计评估的分析物的阈值(包含分析物的一类样品的最小样本数量或样品的最小百分比)。
植物激素的提取
采用Bieleski缓冲液(甲醇:氯仿:甲酸:水(12:5:2:1))作为植物激素分析的萃取溶剂。植物材料(100毫克鲜重)置于2.0 ml微量离心管中,在加入直径5毫米的钢球后,使用TissueLyser II (Qiagen, Valencia, CA)在1.0 ml Bieleski溶剂中以27 Hz频率提取3分钟。试管内容物超声3分钟,然后搅拌10分钟。离心(10分钟,15,000 rpm, 4°C)后冻干上清液。分别用50 μl流动相(乙腈:水(5:95),0.1%甲酸)溶解后进行UPLC-MS/MS分析。
UPLC-MS/MS分析植物激素
植物激素在三四极杆质谱仪(Xevo TQ, Waters, Milford, MA)中进行测量,使用选择的反应监测(SRM)质谱/质谱程序,并通过UPLC (ACQUITY UPLC系统,Waters)与ACQUITY UPLC HSS T3柱(1.8 μm, 2.1 × 100 mm, Waters)进行色谱分离。稳定的同位素标记标准化合物从OlChemim有限公司(Olomouc,捷克共和国)购买,并以已知浓度作为标准添加,以实现这些样品中植物激素的绝对定量。以0.3 ml·min的流速分离植物激素-1溶剂A(0.1%甲酸)和溶剂B(0.1%甲酸在乙腈中)按以下剖面设定线性梯度:0 min, 95% A;0.5 min, 95% A;7.0 min, 50% A;7.5 min, 5% A;10 min, 5% A;10.5 min, 95% A;13 min, 95% a。毛细管电压为2.5 kV。碰撞电池中的锥电压(V)和碰撞能量(eV)分别为:水杨酸(SA), 24 V, 24 eV;吲哚-3-乙酸(IAA), 18v, 24ev;N6-异戊烯腺嘌呤(iP), 34 V, 14 eV;茉莉酸(JA), 26 V, 10 eV;顺式玉米素(cZ), 36 V, 34 eV;反式玉米素(tZ), 34 V, 20 eV;脱落酸(ABA), 28 V, 12 eV;赤霉素酸(GA3) 34 V, 26 eV。使用MassLynx™和TargetLynx™软件(4.1版,Waters)处理数据。
缩写
- 德:
-
微分表达式
- 气:
-
气相色谱-飞行时间-质谱法
- GeLC-MS /女士:
-
凝胶电泳和液相色谱耦合串联质谱
- 走:
-
基因本体论
- 为:
-
组装和查看est的程序
- PSM:
-
Peptide-spectrum匹配
- RPKM:
-
每千碱基每百万次读取
- TCW:
-
转录组计算工作台
- TF:
-
转录因子
- UPLC-MS /女士:
-
超高效液相色谱-串联质谱。
参考文献
- 1.
Khush G:水稻产量的提高。自然科学进展,2003,29 (6 Pt 2): 344 - 344。
- 2.
Brar DS, Khush GS:水稻中的异种渗透。植物分子生物学,1997,35(1-2):35-47。
- 3.
Wing RA, Ammiraju JS, Luo M, Kim H, Yu Y, Kudrna D, Goicoechea JL, Wang W, Nelson W, Rao K,等:水稻图谱排列工程:释放野生水稻遗传潜力的黄金路径。植物分子生物学,2005,59(1):53-62。10.1007 / s11103 - 004 - 6237 - x。
- 4.
前川M, Inukai T, Rikiishi K, Matsuura T, Noda K:长稻杂交种根状茎性状的遗传。et Roehr。中国育种杂志,1998,30:69-72。
- 5.
Gichuhi E, Himi E,高桥H,前川M: 2012年JKUAT科学,技术和产业化会议论文集。长稻的染色体段是环境智能型水稻的重要农艺性状。2012年,723 - 729。
- 6.
杨华,胡玲,胡rek T, Reinhold-Hurek B:基于深度测序的水稻野生种长纹稻(Oryza longistaminata)根系转录组的全球特征。BMC基因组学杂志,2010,11:705-10.1186/1471-2164-11-705。
- 7.
宋文文,王丽丽,陈丽丽,金海生,皮利,Holsten T, Gardner J,王波,翟文霞,朱lh,等:水稻抗病基因编码的受体激酶样蛋白Xa21。科学通报,1995,27(4):344 - 344。10.1126 / science.270.5243.1804。
- 8.
王晓明,王晓明,王晓明,等:玉米野生近缘多年生和一年生习性的数量性状控制位点。应用理论,2004,39(7):544- 553。10.1007 / s00122 - 004 - 1778 - 6。
- 9.
Cox TS, Van Tassel DL, Cox CM, Dehaan LR:多年生谷物育种进展。作物草地学报,2010,61(7):513-521。10.1071 / CP09201。
- 10.
陈忠文,胡永飞,徐萍,李娟,邓新宁,周建文,李峰,陈森宁,陶德元:野生稻种间群体杂种不育性和株高的QTL分析。育种科学,2009,59(4):441-445。10.1270 / jsbbs.59.441。
- 11.
赵建勇,李娟,徐萍,周建文,胡飞,邓晓宁,邓伟,陶德元:水稻与长稻杂交不育性控制新基因。自然科学进展,2012,27(3):339-344。10.1007 / s10681 - 012 - 0691 - 3。
- 12.
刘胜生,张丽玲,林玉玲,刘胜生:野生植物杂草性的分子分析——影响高粱草(L)扩散和持久性的基因分析。中国科学:自然科学,2001,26(3):379 - 379。10.1073 / pnas.92.13.6127。
- 13.
Jang CS, Kamps TL, Skinner DN, Schulze SR, Vencill WK, Paterson AH:高粱根状茎富集表达基因的功能分类、基因组组织、顺式作用调控元件及其与数量性状位点的关系。中国生物医学工程学报,2006,29(3):344 - 344。10.1104 / pp.106.082891。
- 14.
张志刚,张志刚,张志刚,张志刚,张志刚,张志刚。高粱非根状茎基因型中根状茎特异性基因的进化命运。遗传(Edinb)。2009, 102(3): 266-273。10.1038 / hdy.2008.119。
- 15.
王克辉,彭海涛,林爱萍,金启勇,华晓青,姚松,边华文,韩宁,潘金文,王金华,等:竹根芽发育相关基因的鉴定。实验学报,2010,61(2):551-561。10.1093 / jxb / erp334。
- 16.
胡飞,陶迪,Sacks E,付碧,徐鹏,李娟,杨勇,McNally K, Khush GS, Paterson AH,等:水稻和高粱多年生性的收敛演化。中国科学:自然科学,2003,26(3):349 - 349。10.1073 / pnas.0630531100。
- 17.
胡峰,王东,赵霞,张涛,孙辉,朱林,张峰,李林,李强,陶东,等:水稻根状茎特异性基因的全基因组差异表达分析。中国生物医学工程学报,2011,11:18-10.1186/1471-2229-11-18。
- 18.
张志刚,张志刚,张志刚,张志刚,张志刚,等:嗜热真菌菌丝疫霉和嗜热霉的基因组分析。生物技术学报,2011,29(10):922-927。10.1038 / nbt.1976。
- 19.
朴志辉,崔桂杰,张克勤,林鸿华,金洪涛,赵基基,金锦昌:球状毛囊中毛囊绿素对植物病原真菌的抑菌活性。中国生物医学工程学报,2005,26(2):369 - 369。10.1016 / j.femsle.2005.09.013。
- 20.
Shanthiyaa V, Saravanakumar D, Rajendran L, Karthikeyan G, Prabakar K, Raguchander T:球状毛囊菌在马铃薯晚疫病生物防治中的应用。作物学报,2013,52:33-38。
- 21.
张广广,王芳芳,秦景昌,王栋,张建勇,张玉华,张世生,潘海燕:新型生物防治剂球状毛囊05号抗真菌代谢产物对土疫病的药效评价。中国生物防治,2013,64(1):90-98。10.1016 / j.biocontrol.2012.10.005。
- 22.
Harman GE, Howell CR, Viterbo A, Chet I, Lorito M:木霉种-机会性,无毒植物共生体。微生物学报,2004,2(1):43-56。10.1038 / nrmicro797。
- 23.
Kubicek CP, Herrera-Estrella A, Seidl-Seiboth V, Martinez DA, Druzhinina IS, Thon M, Zeilinger S, Casas-Flores S, Horwitz BA, Mukherjee PK,等:比较基因组序列分析强调霉菌寄生是木霉的祖先生活方式。中国生物工程学报,2011,12 (4):R40-10.1186/gb-2011-12-4-r40。
- 24.
王波,康庆杰,卢永珍,白丽青,王春春:揭开绿僵菌脱氨蛋白生物合成之谜。中国科学:自然科学,2012,29(4):379 - 379。10.1073 / pnas.1115983109。
- 25.
高qa,金凯,应生,张玉军,肖海峰,尚玉峰,段志斌,胡兴安,谢晓强,周刚,等:绿僵菌和赤僵菌模型昆虫病原真菌的基因组测序和转录组学比较。科学通报,2011,7 (1):e1001264-10.1371/journal.pgen.1001264。
- 26.
黄文文,蔡玉珍,Hyde KD, Corke H,孙M: 29种中药植物内生真菌的生物多样性。微生物学报,2008,33:61-75。
- 27.
Photita W, Taylor PWJ, Ford R, Hyde KD, Lumyong S:泰国草本植物炭疽菌的形态和分子特征。中国生物工程学报,2005,18(4):344 - 344。
- 28.
马奎斯,李志刚,李志刚,李志刚,李志刚。草地非系统性真菌内生真菌的研究。真菌学报,2012,5(3):289-297。10.1016 / j.funeco.2010.12.001。
- 29.
粘土K:真菌内生植物的草。环境科学学报,2000,21(3):379 - 379。10.1146 / annurev.es.21.110190.001423。
- 30.
Porras-Alfaro A, Bayman P:隐藏的真菌,涌现特性:内生真菌和微生物群落。植物科学进展,2011,29(3):344 - 344。10.1146 / annurev -发朵- 080508 - 081831。
- 31.
辛格LP,吉尔SS, Tuteja N:真菌共生体在植物非生物胁迫耐受性中的作用。植物信号行为学报,2011,6(2):175-191。10.4161 / psb.6.2.14146。
- 32.
孙晓明,李志强,李志强,王晓明,王晓明:一种真菌内生菌诱导宿主植物中冗余杀真菌途径基因的转录。中国生物医学工程学报,2013,26(3):344 - 344。
- 33.
Schardl CL, Young CA, Hesse U, Amyotte SG, Andreeva K, Calie PJ, Fleetwood DJ, Haws DC, Moore N, Oeser B,等:植物共生真菌作为化学工程师:对锁骨藤科生物碱位点动态的多基因组分析。科学通报,2013,9 (2):e1003323-10.1371/journal.pgen.1003323。
- 34.
Rout ME, Chrzanowski TH, Westlie TK, DeLuca TH, Callaway RM, Holben WE:细菌内生菌增强了入侵植物的竞争。学报学报,2013,100(9):1726-1737。10.3732 / ajb.1200577。
- 35.
许文华,陈建平,陈建平,陈建平。入侵植物内生真菌的多样性研究。机械工程学报,2008,29(3):344 - 344。10.3732 / ajb.0800024。
- 36.
刘志刚,李志刚,李志刚。连续田真菌内生共生与植物多样性。科学通报,1999,34(4):344 - 344。10.1126 / science.285.5434.1742。
- 37.
植物入侵的病原菌积累与长期动态。生态学杂志,2013,101(3):607-613。10.1111 / 1365 - 2745.12078。
- 38.
陆建平,刘天涛,林春峰:利用抑制消减杂交技术鉴定稻瘟病菌成熟附着体富集转录本。中国生物医学工程学报,2005,27(1):357 - 357。10.1016 / j.femsle.2005.02.032。
- 39.
Segers G, Bradshaw N, Archer D, Blissett K, Oliver RP:酒精氧化酶是一种新的fulvum致病性因子,而乙醛脱氢酶是可有可无的。植物与微生物相互作用。2001,14(3):367-377。10.1094 / MPMI.2001.14.3.367。
- 40.
Sambrook J, Russell DW:分子克隆-实验室手册。3 rdedition。纽约:冷泉港实验室出版社;2001.
- 41.
Robinson MD, McCarthy DJ, Smyth GK: edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。生物信息学,2010,26(1):139-140。10.1093 /生物信息学/ btp616。
- 42.
Young MD, Wakefield MJ, Smyth GK, Oshlack A: RNA-seq的基因本体分析:考虑选择偏差。中国生物医学工程学报,2010,11 (2):R14-10.1186/gb-2010-11-2 r14。
- 43.
麦道威尔,刚博士:植物激素控制根茎生长发育的动态模型。植物化学学报,2012,42:143-165。
- 44.
李,李永平,杨建平:β -扩张素表达与深水水稻节间伸长的关系。植物学报,2001,27(2):344 - 344。10.1104 / pp.010345。
- 45.
Morant AV, Jorgensen K, Jorgensen C, Paquette SM, Sanchez-Perez R, Moller BL, Bak S: β -葡萄糖苷酶作为植物化学防御雷管。植物化学学报,2008,29(3):344 - 344。10.1016 / j.phytochem.2008.03.006。
- 46.
van der Knaap E,宋文文,阮德龙,苏特M, Ronald PC, Kende H:赤霉素诱导的富亮氨酸重复受体样蛋白激酶在深水水稻中的表达及其与激酶相关蛋白磷酸酶的相互作用。植物营养学报,2004,27(2):357 - 357。10.1104 / pp.120.2.559。
- 47.
高夫·柯,雷蒙奈尔·KM:受体样激酶在植物防御中的作用和调控。中国生物医学工程学报,2007,1:167-175。
- 48.
Tameling WIL, Vossen JH, Albrecht M, Lengauer T, Berden JA, Haring MA, Cornelissen BJC, Takken FLW: I-2 NB-ARC结构域突变损害ATP水解导致自动激活。植物学报,2006,40(4):334 - 334。10.1104 / pp.105.073510。
- 49.
Christensen AB, Gregersen PL, Olsen CE, Collinge DB:一种类黄酮7- o -甲基转移酶在大麦叶片中表达,以应对病原体的攻击。植物分子生物学,1998,36(2):219-227。10.1023 /: 1005985609313。
- 50.
Gothandam KM, Nalini E, Karthikeyan S, Shin JS: OsPRP3是水稻花器官富含脯氨酸的特异性蛋白,它的过表达决定了花器官的细胞外基质结构,并具有耐寒性。植物分子生物学学报,2010,32(1):1 - 5。
- 51.
福冈S, Saka N, Koga H, Ono K, Shimizu T, Ebana K, Hayashi N, Takahashi A, Hirochika H, Okuno K,等:水稻脯氨酸蛋白功能缺失与持久性抗病性的关系。科学通报,2009,35(4):344 - 344。10.1126 / science.1175550。
- 52.
Shindo T, Van Der Hoorn RAL:木瓜蛋白酶样半胱氨酸蛋白酶:植物及其入侵者在分子战场上的关键角色。植物病理学杂志,2008,9(1):119-125。
- 53.
张H,金J,唐L,赵Y,顾X,高G,罗J: PlantTFDB 2.0:综合植物转录因子数据库的更新和改进。核酸决议2011,39(数据库issue): D1114-D1117。
- 54.
Iwasaki M, Nitasaka E:羽状基因是日本牵牛花(I pomoea nil)侧面器官极性建立所必需的。植物分子生物学,2006,62(6):913-925。10.1007 / s11103 - 006 - 9066 - 2。
- 55.
Cong B, Barrero LS, Tanksley SD: yabby样转录因子的调控变化导致番茄驯化过程中果实大小的进化。植物学报,2008,40(6):800-804。10.1038 / ng.144。
- 56.
夏春梅,王俊华,张志军:拟南芥叶片形态发生的转录因子YABBY和KNOX家族调控。中国生物医学工程学报,2010,36(1):357 - 357。10.1534 / genetics.110.118703。
- 57.
戴明明,赵颖,马秋峰,胡勇,Hedden PF,张强,周晓东:水稻YABBY1基因参与赤霉素代谢的反馈调控。中国农业科学,2007,29(1):1- 3。10.1104 / pp.107.096586。
- 58.
赵m, Morohashi K, Hatlestad G, Grotewold E, Lloyd A: TTG1-bHLH-MYB复合物通过直接靶向调控位点控制毛状体细胞命运和模式。发展,2008,135(11):1991-1999。10.1242 / dev.016873。
- 59.
Tsukagoshi H, Busch W, Benfey PN: ROS的转录调控控制了根从增殖到分化的转变。光子学报,2010,34(4):344 - 344。10.1016 / j.cell.2010.10.020。
- 60.
王晓明,王晓明,王晓明,等:大刍草分枝1基因表达模式和突变表型与大刍草生长抑制的关系。中国生物医学工程学报,2002,26(4):344 - 344。
- 61.
Takeda T, Suwa Y, Suzuki M, Kitano H, Ueguchi- tanaka M, Ashikari M, Matsuoka M, Ueguchi C: OsTB1基因负向调控水稻横向分枝。植物学报,2003,33(3):513-520。10.1046 / j.1365 - 313 x.2003.01648.x。
- 62.
Baldwin IT:植物挥发物。动物学报,2010,20 (9):R392-R397。10.1016 / j.cub.2010.02.052。
- 63.
沈波,郑志,洪晓明:玉米倍半萜环化酶基因的野生型和突变型分析。中国科学:自然科学,2000,26(3):379 - 379。10.1073 / pnas.240284097。
- 64.
Schnee C, Kollner TG, Held M, Turlings TC, Gershenzon J, Degenhardt J:单个玉米倍半萜合酶的产物形成挥发性防御信号,吸引玉米食草动物的天敌。自然科学进展,2006,29(4):379 - 379。10.1073 / pnas.0508027103。
- 65.
程安安,娄毅刚,毛一斌,陆松,王丽娟,陈晓宇:植物萜类化合物的生物合成及生态功能。植物学报,2007,49(2):179-186。10.1111 / j.1744-7909.2007.00395.x。
- 66.
Tholl D, Chen F, Petri J, Gershenzon J, Pichersky E:拟南芥花释放的倍半萜化合物是由两种倍半萜合酶组成的。植物学报,2005,42(5):757-771。10.1111 / j.1365 - 313 x.2005.02417.x。
- 67.
黄志刚,李志刚,李志刚等:植物挥发物的形成与功能:对传粉者的吸引和防御作用。植物学报,2002,5(3):237-243。10.1016 / s1369 - 5266(02) 00251 - 0。
- 68.
洪国军,薛晓宇,毛玉斌,王丽娟,陈晓宇:拟南芥MYC2与DELLA蛋白相互作用调控倍半萜烯合酶基因表达。植物细胞学报,2012,24(6):2635-2648。10.1105 / tpc.112.098749。
- 69.
Greenbaum D, Colangelo C, Williams K, Gerstein M:在基因组尺度上比较蛋白质丰度和mRNA表达水平。中国生物医学工程学报,2003,4 (9):117-10.1186/gb-2003-4-9-117。
- 70.
Schilmiller AL, Miner DP, Larson M, McDowell E, Gang DR, Wilkerson C, Last RL:一个生化工厂的研究:番茄毛状体深度表达序列标记测序和蛋白质组学。植物学报,2010,29(3):344 - 344。10.1104 / pp.110.157214。
- 71.
McDowell ET, Kapteyn J, Schmidt A, Li C, Kang JH, Descour A, Shi F, Larson M, Schilmiller A, An L,等:龙葵腺状毛状体类型的比较功能基因组分析。中国生物医学工程学报,2011,27(1):344 - 344。10.1104 / pp.110.167114。
- 72.
Hajduch M, Hearne LB, Miernyk JA, Casteel JE, Joshi T, Agrawal GK, Song Z, Zhou MY, Xu D, Thelen JJ:拟南芥种子灌浆的系统分析:利用一般线性模型评估转录本和蛋白质表达的一致性。中国生物医学工程学报,2010,32(4):344 - 344。10.1104 / pp.109.152413。
- 73.
傅晓明,陈晓明,陈晓明,陈晓明,陈晓明。基于非转录机制的蛋白质网络研究进展。公共科学图书馆,2011,9 (9):e1001144-10.1371/journal.pbio.1001144。
- 74.
Laurent JM, Vogel C, Kwon T, Craig SA, Boutz DR, house HK, Nozue K, Walia H, Whiteley M, Ronald PC,等:蛋白质丰度在不同分类群中比mRNA丰度更保守。蛋白质组学,2010,10(23):4209-4212。10.1002 / pmic.201000327。
- 75.
Horiguchi G, Kodama H, Iba K:拟南芥质体核糖体蛋白s6样蛋白基因突变揭示了拟南芥侧根分生组织正确组织所需的新发育过程。植物学报,2003,33(3):521-529。10.1046 / j.1365 - 313 x.2003.01651.x。
- 76.
何丽娟,何丽娟,王丽娟,王丽娟:古维管植物木贼根状茎发育过程的蛋白质组学分析。植物科学进展,2012,30(3):331。
- 77.
Horvath BM, Magyar Z, Zhang YX, Hamburger AW, Bako L, Visser RG, Bachem CW, Bogre L: EBP1在植物中通过细胞生长和增殖调节器官大小。中国农业科学,2006,26(4):489 - 489。10.1038 / sj.emboj.7601362。
- 78.
Stuart SF, Leatherbarrow RJ, Willison KR:酵母胞浆伴侣蛋白折叠肌动蛋白的两步机制。中国生物医学工程学报,2011,28(1):379 - 379。10.1074 / jbc.M110.166256。
- 79.
Yaffe MB, Farr GW, Miklos D, Horwich AL, Sternlicht ML, Sternlicht H: Tcp1复合物是微管蛋白生物发生的分子伴侣。自然科学学报,1992,27(3):344 - 344。10.1038 / 358245 a0。
- 80.
贺建平,陈建平,陈建平,陈建平,等:黄花苜蓿根系分生组织蛋白质组学分析及乙酰羟基酸合成酶抑制剂的作用。中国生物医学工程学报,2006,29(3):339 - 344。10.1021 / pr0600677。
- 81.
李小波,范小鹏,王小玲,蔡玲,杨文昌:棉花ACTIN1基因在纤维中有功能表达,参与纤维伸长。植物细胞学报,2005,17(3):859-875。10.1105 / tpc.104.029629。
- 82.
Whittaker DJ, Triplett BA:发育棉纤维中α -微管蛋白转录本积累的基因特异性变化。植物营养学报,2004,27(1):357 - 357。10.1104 / pp.121.1.181。
- 83.
黄S, Robinson RC, Gao LY, Matsumoto T, Brunet A, Blanchoin L, Staiger CJ:拟南芥VILLIN1产生抗解聚肌动蛋白丝电缆。植物细胞学报,2005,17(2):486-501。10.1105 / tpc.104.028555。
- 84.
Streeter JG:在田间种植的大豆植株的组织和茎分泌物中的尿囊素和尿囊酸。植物营养学报,2004,27(3):379 - 379。10.1104 / pp.63.3.478。
- 85.
Adie BAT, Perez-Perez J, Perez-Perez MM, Godoy M, Sanchez-Serrano JJ, Schmelz EA, Solano R: ABA是植物抵抗影响JA生物合成和防御激活的病原体的必要信号。植物细胞学报,2007,19(5):1665-1681。10.1105 / tpc.106.048041。
- 86.
Lundberg DS, Lebeis SL, Paredes SH, Yourstone S, Gehring J, Malfatti S, Tremblay J, Engelbrektson A, Kunin V, del里约热内卢TG,等:拟南芥根系核心菌群的研究。自然科学进展,2012,29(4):344 - 344。10.1038 / nature11237。
- 87.
Bulgarelli D, Rott M, Schlaeppi K, van Themaat EVL, Ahmadinejad N, Assenza F, Rauf P, Huettel B, Reinhardt R, Schmelzer E,等:拟南芥根居菌群结构和组装线索的揭示。自然科学进展,2012,29(4):344 - 344。10.1038 / nature11336。
- 88.
Kivlin SN, Emery SM, Rudgers JA:真菌共生体改变植物对全球变化的反应。学报学报,2013,100(7):1445-1457。10.3732 / ajb.1200558。
- 89.
He R, Kim MJ, Nelson W, Balbuena TS, Kim R, Kramer R, Crow JA, May GD, Thelen JJ, Soderlund CA,等:对芦苇芦苇芦苇(芦苇科)的转录组和蛋白质组学分析揭示了与侵入性和根茎特异性相关的基因。学报学报,2012,39(2):344 - 344。10.3732 / ajb.1100429。
- 90.
植物中真菌病原体的检测。微生物植物病原体检测与疾病诊断:真菌病原体。卷1。编辑Narayanasamy P.施普林格荷兰:施普林格Science+BusinessMedia B.V.;2011:5 - 199。
- 91.
李志强,李志强,李志强,等:水稻稻瘟病菌Mpg1基因的鉴定与鉴定。中国生物医学工程学报,2003,26(4):357 - 357。
- 92.
Tucker SL, Besi MI, Galhano R, Franceschetti M, Goetz S, Lenhert S, Osbourn A, Sesma A:水稻稻瘟病真菌器官特异性感染相关发育的常见遗传途径。植物细胞学报,2010,22(3):953-972。10.1105 / tpc.109.066340。
- 93.
Rice P, Longden I, Bleasby A: EMBOSS:欧洲分子生物学开放软件套件。植物学报,2000,16(6):276-277。10.1016 / s0168 - 9525(00) 02024 - 2。
- 94.
郑艳,赵玲,高娟,费志:iAssembler: Roche-454/Sanger转录组序列从头组装包。中国生物医学工程学报,2011,29(4):344 - 344。
- 95.
Soderlund C, Nelson W, Willer M, Gang DR: TCW:转录组计算工作台。公共科学学报,2013,8 (7):e69401-10.1371/journal.pone.0069401。
- 96.
Soderlund C, Johnson E, Bomhoff M, Descour A: PAVE:组装和查看est的程序。中国生物医学工程学报,2009,30(4):344 - 344。
- 97.
Apweiler R, Martin MJ, O'Donovan C, Magrane M, Alam-Faruque Y, Antunes R, Barrell D, Bely B, Bingley M, Binns D,等:通用蛋白质资源(UniProt)在2010年。中国生物医学工程学报,2010,38:D142-D148。
- 98.
舍甫琴科A,托马斯H,哈维斯J,奥尔森JV,曼M:蛋白质和蛋白质组的质谱表征的凝胶消解。光子学报,2006,30(6):457 - 457。
- 99.
Wernersson R:虚拟核糖体-一个全面的DNA翻译工具,支持序列特征注释的集成。中国生物医学工程学报,2006,34:W385-W388。10.1093 / nar / gkl252。
- One hundred.
Carvalho PC, Fischer JSG, Xu T, Cociorva D, Balbuena TS, Valente RH, Perales J, Yates JR, Barbosa VC:搜索引擎处理器:筛选和组织肽谱匹配。蛋白质组学,2012,12(7):944-949。10.1002 / pmic.201100529。
- 101.
Carvalho PC, Fischer JS, Chen EI, Yates JR, Barbosa VC:蛋白质组学的PatternLab:差分散弹枪蛋白质组学的工具。中国生物医学工程学报,2008,29(4):366 - 366。
- 102.
Carvalho PC, Yates JR, Barbosa VC:改进差分散弹枪蛋白质组学的TFold测试。生物信息学,2012,28(12):1652-1654。10.1093 /生物信息学/ bts247。
- 103.
Conesa A, Gotz S, Garcia-Gomez JM, Terol J, Talon M, Robles M: Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学,2005,21(18):3674-3676。10.1093 /生物信息学/ bti610。
- 104.
Caraux G, Pinloche S: PermutMatrix:以最佳线性顺序排列基因表达谱的图形环境。生物信息学,2005,21(7):1280-1281。10.1093 /生物信息学/ bti141。
确认
我们感谢美国国家科学基金会(Grant IOS-1044821)的财政支持。我们感谢亚利桑那大学的Rod Wing博士为我们提供了最初的植物储备,感谢WSU的Amy Hetrick、Anna Berim、Yuying Sang和Hong Yang在植物生长、组织收集和细胞学分析方面的帮助,感谢NCGR的Ryan Kim和Robin Kramer在测序方面的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
RH设计并进行了实验,分析了数据,并撰写了手稿。FS和TSB进行了肽鉴定和蛋白质组学数据分析。JJP收集植物激素和代谢物数据,并协助代谢物分析。MJK进行转录组组装。WN、MW和CAS进行转录组注释、DE分析和数据库构建。JAC和GDM辅助测序。JJT和CAS提供了技术建议,并为研究设计做出了贡献。DRG构思、设计和协调研究,并编辑手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
12870 _2013_1467_moesm6_esm.xlsx
附加文件6:红米根茎组织(根尖和延伸区)和根中GeLC-MS/MS鉴定的蛋白质列表(xlsx488 kb)
蛋白质
附加文件7:Magnaporthe oryzae在红米组织中发现。(xlsx28kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
他,R,塞尔瓦托,F,帕克,JJ。et al。红米的全系统比较(选用longistaminata)组织鉴定根茎特定基因和蛋白质,这些基因和蛋白质是栽培水稻改良的目标。BMC植物生物学14,46(2014)。https://doi.org/10.1186/1471-2229-14-46
收到了:
接受:
发表:
关键字
- 转录组
- 蛋白质组学
- 代谢组学
- 粉末
- 外来入侵物种
- 抗病性
- 稻瘟病
- 大米