- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
在叶绿体分裂过程中,DipM是肽聚糖水解所必需的gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba14gydF4y2Ba,文章号:gydF4y2Ba57gydF4y2Ba(gydF4y2Ba2014gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
叶绿体是从蓝藻内共生体进化而来的,随着时间的推移,它们的连续性一直通过叶绿体分裂来维持,这一过程是通过在分裂位点上的环状分裂复合体的收缩来完成的。分裂复合体保留了蓝藻分裂复合体的某些成分,这些成分在叶绿体内部起作用。它还含有宿主细胞发育的成分,这些成分在叶绿体外起作用,据信从细胞质侧产生收缩力,至少在红藻和绿藻中是这样。与这些谱系中的叶绿体相反,蓝藻中的叶绿体在两个包膜膜之间具有肽聚糖层,蓝藻也是如此。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们发现叶绿体在蓝藻中发生分裂gydF4y2Bac . paradoxagydF4y2Ba不涉及任何已知的宿主真核起源的叶绿体分裂蛋白,相反,肽聚糖吐槽和外膜分裂过程依赖于DipM蛋白在分裂位点的肽聚糖水解活性,就像在蓝藻细胞分裂中一样。此外,我们发现在苔藓中,DipM是正常叶绿体分裂所必需的gydF4y2BaPhyscomitrella金属盘gydF4y2Ba。gydF4y2Ba
结论gydF4y2Ba
这些结果表明,肽聚糖分裂的调控是叶绿体早期进化中叶绿体分裂的关键,该活性可能仍然参与了绿属叶绿体分裂。gydF4y2Ba
背景gydF4y2Ba
叶绿体出现在10亿多年前,当时蓝藻成为真核细胞中的内共生体。现在,一些证据表明,一种独特的内共生事件产生了Glaucophyta (Glaucophyta藻类),Rhodophyta(红藻类)和Viridiplantae(绿藻,叶藻和陆生植物)的叶绿体。所有其他的光合真核生物通过随后的内共生获得叶绿体,其中绿色或红色藻类被整合到先前的非光合真核生物[gydF4y2Ba1gydF4y2Ba].随着时间的推移,曾经存在于内共生体中的大部分基因已经丢失或转移到宿主核基因组中;那些仍被叶绿体使用的细胞被宿主翻译并定向返回细胞器,在那里它们执行它们的功能。与这种情况一致的是,叶绿体的复制是通过先前存在的细胞器的分裂进行的,而叶绿体的分裂是由核基因组中编码的蛋白质进行的[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba].人们认为,真核宿主细胞对叶绿体分裂的这种调节,确保了叶绿体在细胞分裂过程中和世代之间的永久遗传[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
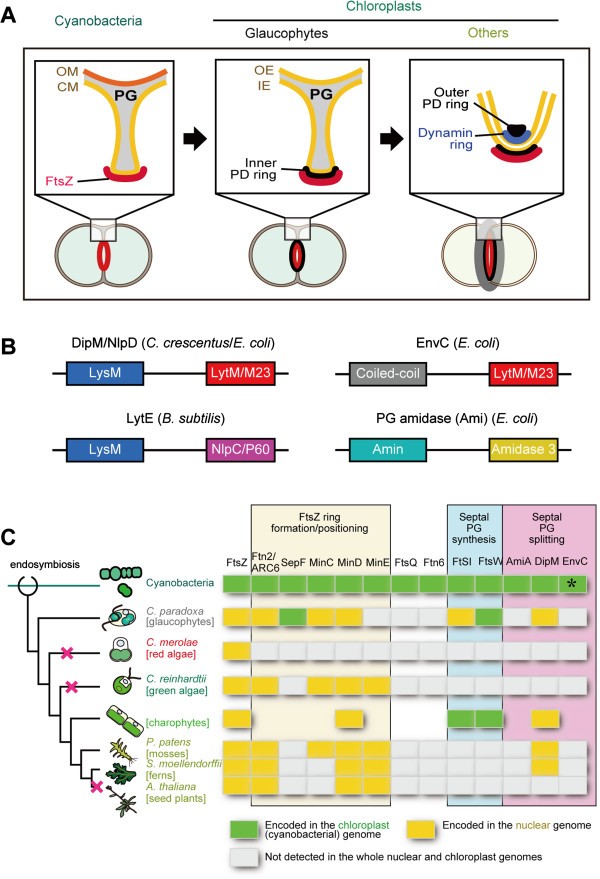
早期的电子显微镜研究证实了叶绿体的分裂(除glaucophytes;(见下文)是通过在分裂部位同时收缩内外包膜来实现的。此外,在包膜的胞质和基质两侧,即外质体分裂环和内质体分裂环上,也发现了围绕分裂位点的结构[gydF4y2Ba8gydF4y2Ba].最近的分子遗传学和生物化学研究表明,叶绿体的分裂是由包含两个包膜内外的分裂部位的一个大蛋白质复合物的收缩来进行的。分裂复合体包括源自蓝藻细胞动力学机制的蛋白质(位于分裂位点基质侧的功能)和源自真核宿主细胞的蛋白质(主要位于细胞质侧的功能)。在核编码的叶绿体分裂位点,蓝藻传下来的FtsZ蛋白自我组装成一个环状结构,这反过来导致其他真核宿主起源的叶绿体分裂蛋白的募集。FtsZ环的形成受到蓝藻菌后代ARC6、MinD和MinE蛋白的调控,调控方式与蓝藻菌细胞分裂相似。真核宿主起源的叶绿体分裂蛋白在进化过程中逐步整合到分裂复合体中。动力相关蛋白DRP5B和外PD环(由葡聚糖丝组成)是在红藻和绿藻分裂之前添加的(即它们在两个谱系中都是保守的)。相比之下,其他蛋白质,包括横跨外包膜的蛋白质PDV1和PDV2以及横跨内包膜的蛋白质MCD1是陆地植物所特有的[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
本文对叶绿体分裂机制的研究主要基于对红藻和陆生植物的研究。与这些谱系相反,蓝藻的叶绿体在两个膜膜之间有一个肽聚糖(PG)层,细菌也是如此。进化研究表明,在红藻和绿藻分化之前,蓝藻是最早从植物科的共同祖先中分离出来的[gydF4y2Ba1gydF4y2Ba].蓝藻中叶绿体的分裂gydF4y2Bac . paradoxagydF4y2Ba包括在分裂位点的基质一侧形成FtsZ环,如在其他谱系的蓝藻和叶绿体中[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].电子显微镜观察到一种类似于内PD环的结构[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].然而,外PD环不明显[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]和真核宿主起源的叶绿体分裂基因,包括gydF4y2Badrp5BgydF4y2Ba,均未在EST数据库中找到[gydF4y2Ba13gydF4y2Ba].因此,除叶绿体内部的部分(即内膜和间质侧)外,青绿植物的叶绿体分裂机制似乎与其他类系不同。gydF4y2Ba
在绿藻叶绿体的分裂过程中,内包膜比外包膜更早开始收缩,并伴有分裂部位PG层的长入,使人联想到细菌的细胞分裂。因此,在glaucophytes中,两个包膜在分裂位点的间隙要比叶绿体的其他部位大得多[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba)(图gydF4y2Ba1gydF4y2BaA).为了让外包膜收缩,分裂位点的PG层必须从最外层切割(这个过程称为PG分裂),就像细菌细胞分裂一样。发生在蓝藻叶绿体分裂中的PG分裂应该需要PG水解酶,就像细菌细胞分裂一样[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].此外,一些藻类和植物基因组编码参与PG合成的蓝藻蛋白质的同源物[gydF4y2Ba16gydF4y2Ba],尽管在除绿藻外的叶绿体中从未检测到pg。PG合成抑制剂[gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba19gydF4y2Ba或破坏核编码gydF4y2Ba墙gydF4y2Ba或gydF4y2BamragydF4y2Ba基因(gydF4y2Ba20.gydF4y2Ba会破坏绿藻,苔藓中的叶绿体分裂gydF4y2Bap .金属盘gydF4y2Ba,和石松(蕨类植物)gydF4y2Ba卷柏培gydF4y2Ba。这些观察结果表明,PG水解蛋白的同源物可能也与青绿植物以外的谱系中的叶绿体分裂有关。然而,PG在分裂位点的分裂与叶绿体分裂进程之间的关系尚未阐明。叶绿体分裂中PG动态的表征对于理解叶绿体分裂机制如何被真核宿主细胞从最初的蓝藻分裂机制修改,以及祖先藻类如何在进化的早期阶段调节叶绿体分裂非常重要。利用厚壁菌门(革兰氏阳性)进行细菌细胞分裂的最新研究gydF4y2Ba枯草芽孢杆菌gydF4y2Ba[gydF4y2Ba21gydF4y2Ba]和变形菌门(革兰氏阴性)gydF4y2Ba大肠杆菌gydF4y2Ba[gydF4y2Ba22gydF4y2Ba- - - - - -gydF4y2Ba24gydF4y2Ba),gydF4y2Ba茎菌属crescentusgydF4y2Ba[gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba],已鉴定出肽酶(DipM在gydF4y2Bac . crescentusgydF4y2Ba和LytEgydF4y2Ba枯草芽孢杆菌gydF4y2Ba)或酰胺酶(Ami ingydF4y2Ba大肠杆菌gydF4y2Ba)及其激活剂(NlpD和EnvC在gydF4y2Ba大肠杆菌gydF4y2Ba),均参与PG在分裂位点的水解。此外,还绘制了蓝叶植物的核基因组草图gydF4y2Bac . paradoxagydF4y2Ba最近出版[gydF4y2Ba28gydF4y2Ba].这些资料将有助于澄清上述问题。gydF4y2Ba
蓝藻和叶绿体分裂复合体的示意图和蓝藻起源的叶绿体分裂蛋白的分布。(一)gydF4y2Ba蓝藻之间的分裂复合体,以及蓝藻和其他谱系的叶绿体的示意图比较。蓝藻的叶绿体在内外膜之间有一个PG,蓝藻也是如此。为了使外包膜收缩,分裂位点的PG层必须从最外层切割(这个过程称为PG分裂),就像细菌细胞分裂一样。CM,细胞质膜;IE,内包膜;OE,外包膜;OM,外膜;PG,肽聚糖层。gydF4y2Ba(B)gydF4y2Ba细菌中参与PG分裂的DipM/NlpD、EnvC、LytE和PG酰胺酶(Ami)的结构域组织。DipM/NlpD和LytE通常包含3到5个LysM基序重复,但只显示一个LysM基序。n端LysM、卷曲卷曲结构域或Amin结构域将蛋白靶向到间隔,c端LytM/M23、NlpC/P60或Amidase 3结构域具有水解酶活性。gydF4y2Ba(C)gydF4y2Ba蓝藻起源的叶绿体分裂蛋白的分布(更新自[gydF4y2Ba32gydF4y2Ba])。光合真核生物的某些谱系具有DipM同源体,可能源于叶绿体的蓝藻祖先。分枝长度不代表系统发育距离。节点上的红色十字标记表示推导出的DipM丢失时间。氨基酸序列的GenBank登录号在附加文件中汇总gydF4y2Ba1gydF4y2Ba:表S1。EnvC在一些蓝藻物种中被发现(例如GI:427708140 ingydF4y2Ba念珠藻属gydF4y2Basp. PCC 7107),但不在gydF4y2Ba美国elongatusgydF4y2Ba。这些数据并不是单种的,而是多种植物的组合。gydF4y2Ba
在本研究中,通过调查gydF4y2Bac . paradoxagydF4y2Ba基因组分析证实,该藻类中不存在宿主真核起源的叶绿体分裂蛋白。相反,我们在蓝藻中发现了DipM蛋白的同源物gydF4y2Bac . paradoxagydF4y2Ba。这些结果表明,PG水解DipM参与蓝藻叶绿体分裂,就像它参与蓝藻细胞分裂一样。此外,我们还在赤藻和苔藓中发现了核编码的DipM同源物gydF4y2Bap .金属盘gydF4y2Ba是正常叶绿体分裂所必需的。由此可见,PG重塑通路被保留在绿藻叶绿体中,并在叶绿体分裂中发挥一定作用。gydF4y2Ba
结果gydF4y2Ba
的EST数据库早期检索gydF4y2Bac . paradoxagydF4y2Ba未鉴定出动力相关蛋白DRP5B,糖原素样蛋白PDR1(在红藻中鉴定gydF4y2Bac . merolaegydF4y2Ba,为外PD环的葡聚糖灯丝)[gydF4y2Ba3.gydF4y2Ba]和其他已知的起源于真核宿主细胞内共生事件后的叶绿体分裂蛋白[gydF4y2Ba13gydF4y2Ba].经过前期的搜寻工作,绘制出了基因组序列的草图gydF4y2Bac . paradoxagydF4y2Ba最终出版了[gydF4y2Ba28gydF4y2Ba]因此,我们再次在基因组数据库中搜索已知的叶绿体和蓝藻分裂蛋白。搜索新发现了Ftn2/ARC6、FtsI和MinC,它们来自祖先蓝藻菌(图gydF4y2Ba1gydF4y2BaB;额外的文件gydF4y2Ba1gydF4y2Ba:表S1),而DRP5B、PDR1等真核宿主来源的叶绿体分裂蛋白则不存在(图1)gydF4y2Ba1gydF4y2BaB).因此,在其他系系中,在细胞质侧、外膜层或膜间空间(内外膜之间的空间)起作用的叶绿体分裂机制的已知成分在蓝藻叶绿体中缺失。相反,gydF4y2Bac . paradoxagydF4y2Ba具有一种与FtsI同源的蛋白质,其定位于细菌分裂位点并交联糖链,以及一种与FtsW同源的蛋白质,其在分裂位点运输脂质链接肽聚糖前体[gydF4y2Ba29gydF4y2Ba].这些观察促使我们进行研究gydF4y2Bac . paradoxagydF4y2Ba在蓝藻分裂位点参与PG分裂的蛋白质的同源物。gydF4y2Ba
迄今为止,PG的水解及其在细菌分裂位点的调控已被研究gydF4y2Ba枯草芽孢杆菌gydF4y2Ba,gydF4y2Ba大肠杆菌gydF4y2Ba而且gydF4y2Bac . crescentusgydF4y2Ba[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba],但在蓝藻物种中没有。研究表明,在不同的细菌谱系中,不同的蛋白质组在分裂位点参与PG水解(图gydF4y2Ba1gydF4y2BaB)。gydF4y2Ba枯草芽孢杆菌gydF4y2Ba, LytE, LytF和CwlS定位于分裂位点,这些蛋白水解PG进行细胞分离[gydF4y2Ba21gydF4y2Ba].这三个蛋白具有相似的结构域组成:n端部分由3到5个LysM基序的重复组成,该基序在未被磷磷酸修饰的分裂位点结合新合成的PG链[gydF4y2Ba30.gydF4y2Ba].c端部分包含NlpC/P60gydF4y2BaDgydF4y2Ba,gydF4y2BalgydF4y2Ba-内肽酶基序[gydF4y2Ba21gydF4y2Ba)(图gydF4y2Ba1gydF4y2BaB)。gydF4y2Ba
在gydF4y2Bac . crescentusgydF4y2Ba, DipM导致间隔PG分裂。LytM/M23结构域的n端重复序列将DipM定位到中隔,c端LytM/M23结构域水解PG [gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba)(图gydF4y2Ba1gydF4y2BaB)。gydF4y2Ba大肠杆菌gydF4y2Ba具有DipM同源物NlpD,但NlpD不水解PG,相反,NlpD和另一个含有LytM结构域的蛋白EnvC在分裂位点定位并激活酰胺酶AmiA, AmiB和AmiC,然后这些酶在分裂位点水解PG [gydF4y2Ba22gydF4y2Ba- - - - - -gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
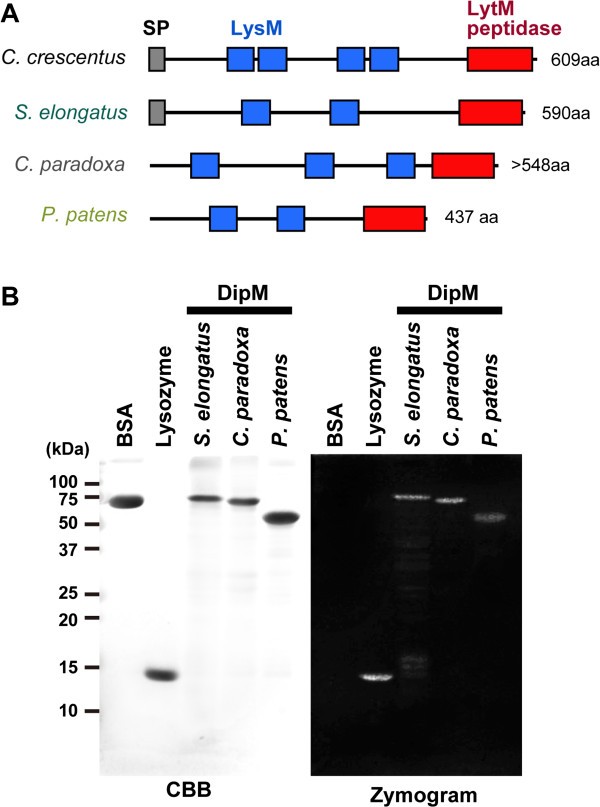
为了明确哪种PG水解机制负责蓝藻细胞分裂,以及该机制在叶绿体中是如何改变/丢失的,我们根据各自蓝藻和真核生物基因组数据库中存在的某些基序,搜索上述蛋白质的同源性。该研究在蓝藻中发现了Ami酰胺酶、DipM/NlpD和EnvC的同源物,但没有发现LtyE/LytF/CwlF的同源物(图gydF4y2Ba1gydF4y2BaC和gydF4y2Ba2gydF4y2Ba一个;额外的文件gydF4y2Ba1gydF4y2Ba:表S1)。在光合真核生物中,该研究仅在蓝藻中发现了DipM同源物gydF4y2Bac . paradoxagydF4y2Ba苔藓gydF4y2Bap .金属盘gydF4y2Ba(图gydF4y2Ba1gydF4y2BaC和gydF4y2Ba2gydF4y2Ba一个;额外的文件gydF4y2Ba1gydF4y2Ba:表S1)。此外,通过搜索EST数据库,我们在柴藻中发现了DipM同源物(即含有LysM和LytM结构域),gydF4y2BaChaetosphaeridium globosumgydF4y2Ba(GI: 372830473)gydF4y2BaKlebsormidium flaccidumgydF4y2Ba(GI:372624497)和石松植物(一种维管植物)gydF4y2Ba卷柏moellendorffiigydF4y2Ba(图gydF4y2Ba1gydF4y2BaC;额外的文件gydF4y2Ba1gydF4y2Ba:表S1)。在BLAST的搜索中,所有这些真核DipM同源物都与蓝藻DipM的亲缘关系最为密切,这表明这些真核蛋白都来自于原始的蓝藻内共生体。然而,由于序列相似性仅在有限的区域内明显,我们无法构建合理的序列比对来进行系统发育分析。除了上述起源于蓝藻的真核蛋白外,我们的研究还发现了其他的DipM同源物gydF4y2Bap .金属盘gydF4y2Ba它们与蓝藻以外的细菌蛋白质密切相关(GI:168061355;GI: 168053993)。另外两种蛋白质的来源gydF4y2Bap .金属盘gydF4y2Ba不清楚,但它可能是通过环境细菌的水平基因转移获得的。gydF4y2Ba
蓝藻和光合真核生物的DipM同源物显示PG水解酶活性。(一)gydF4y2Ba预测的畴结构gydF4y2Bac . crescentusgydF4y2Ba蓝藻中的DipM及其同源物gydF4y2Ba美国elongatusgydF4y2Ba,即蓝藻gydF4y2Bac . paradoxagydF4y2Ba苔藓gydF4y2Bap .金属盘gydF4y2Ba。SP,信号肽。GenBank的登录编号在附加文件中汇总gydF4y2Ba1gydF4y2Ba:表S1。为gydF4y2Bap .金属盘gydF4y2BaDipM蛋白,只有DipM1被显示。为gydF4y2Bac . paradoxagydF4y2BaDipM,推导出的氨基酸序列缺少n端部分的信息,因为我们无法获得全长的cDNA。gydF4y2Ba(B)gydF4y2BaDipM同源物PG水解酶活性的酶谱分析。gydF4y2Ba美国elongatusgydF4y2Ba(藻青菌),gydF4y2Bac . paradoxagydF4y2Ba(glaucophyte)和gydF4y2Bap .金属盘gydF4y2Ba(苔藓)DipM同源物在凝胶中水解murein sacculi(酶谱),亚甲基蓝染色阴性。5 μg牛血清白蛋白(BSA)、溶菌酶和重组DipM多肽用于含有纯化的SDS凝胶gydF4y2Ba美国elongatusgydF4y2Ba胞壁质sacculi。其中一种凝胶中的蛋白质用考马斯亮蓝(CBB)染色。另一种凝胶在复变性缓冲液中孵育,然后用亚甲基蓝染色检测囊泡裂解区域。为gydF4y2Bap .金属盘gydF4y2BaDipM蛋白,只检测DipM1。gydF4y2Ba
光合真核生物中的DipMgydF4y2Bac . paradoxagydF4y2Ba而且gydF4y2Bap .金属盘gydF4y2Ba显示PG水解酶活性gydF4y2Ba在体外gydF4y2Ba
以确定DipM是否同源gydF4y2Ba美国elongatusgydF4y2Ba,gydF4y2Bac . paradoxagydF4y2Ba而且gydF4y2Bap .金属盘gydF4y2Ba有能力,像DipM,水解PGgydF4y2Bac . crescentusgydF4y2Ba,分别生成重组蛋白(包括LysM和LytM结构域)gydF4y2Ba大肠杆菌gydF4y2Ba并在酶谱试验中检测了活性。为此,gydF4y2Ba美国elongatusgydF4y2BaDipM(重组蛋白,无信号肽),以及对照蛋白牛血清白蛋白(BSA)和溶菌酶,也应用于变性SDS凝胶含有gydF4y2Ba美国elongatusgydF4y2Ba并通过从凝胶中去除SDS重新折叠。随后,用PG结合染料对凝胶进行染色,这种染料应该能在囊泡被PG水解酶活性降解的所有区域产生清晰的区域(图)gydF4y2Ba2gydF4y2BaB).然而,正如预期的那样,BSA在测定中是不活跃的gydF4y2Bac . paradoxagydF4y2Ba而且gydF4y2Bap .金属盘gydF4y2Ba创造了一个清晰的区域gydF4y2Ba美国elongatusgydF4y2BaDipM和溶菌酶。这些结果表明,DipM的形式gydF4y2Bac . paradoxagydF4y2Ba而且gydF4y2Bap .金属盘gydF4y2Ba能够水解PGgydF4y2Ba在体外gydF4y2Ba。gydF4y2Ba
在蓝藻中,DipM定位于细胞分裂位点,参与细胞分裂gydF4y2Ba美国elongatusgydF4y2Ba
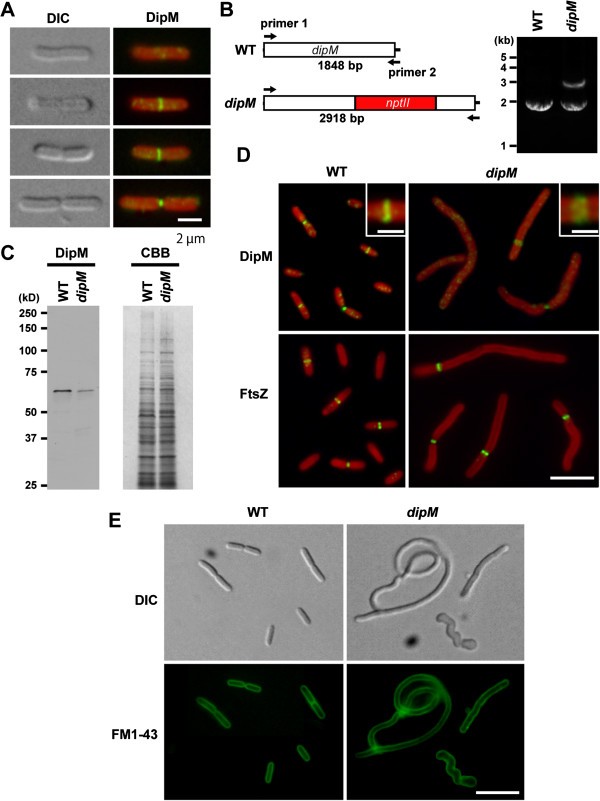
尽管初级结构的相似性表明gydF4y2Ba美国elongatusgydF4y2BaDipM与细胞分裂有关gydF4y2Bac . crescentusgydF4y2BaDipM和gydF4y2Ba大肠杆菌gydF4y2BaNlpD,该蛋白的功能尚未被鉴定。为了测试参与的程度gydF4y2Ba美国elongatusgydF4y2Ba我们首先检测了DipM在细胞分裂中的定位gydF4y2Ba美国elongatusgydF4y2Ba。免疫荧光显微镜使用抗体对抗gydF4y2Ba美国elongatusgydF4y2BaDipM显示,在收缩早期和晚期,DipM都定位于细胞分裂部位(图gydF4y2Ba3.gydF4y2BaA,就像DipM在的情况一样gydF4y2Bac . crescentusgydF4y2Ba[gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba]和NlpDgydF4y2Ba大肠杆菌gydF4y2Ba[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
在蓝藻中,DipM定位于细胞中部位置,参与细胞分裂gydF4y2Ba美国elongatus。gydF4y2Ba(一)gydF4y2Ba免疫荧光图像显示DipM定位在细胞中部位置(绿色荧光)gydF4y2Ba美国elongatusgydF4y2Ba。红色是叶绿素的自发荧光。差分干涉对比(DIC)图像的同一细胞也显示。gydF4y2Ba(B)gydF4y2Ba变异的gydF4y2Ba长尾蛇gydF4y2Ba轨迹。gydF4y2BanptIIgydF4y2Ba基因被插入gydF4y2BadipMgydF4y2Ba引物1和引物2 PCR检测基因座和插入。PCR从插入的染色体和完整的染色体分别产生2918 bp和1848 bp的产物。gydF4y2Ba美国elongatusgydF4y2Ba突变体中的多个基因组和两条条带的扩增是否表明突变细胞既具有突变又具有完整gydF4y2BadipMgydF4y2Ba位点。gydF4y2Ba(C)gydF4y2Ba免疫印迹分析显示,小鼠血清中DipM蛋白水平降低gydF4y2BadipMgydF4y2Ba突变体。各通道装载等量总蛋白,SDS-PAGE后考马斯亮蓝(CBB)染色确认装载相等。gydF4y2Ba(D)gydF4y2Ba野生型FtsZ环频率及DipM定位分析gydF4y2BadipMgydF4y2Ba突变细胞。的gydF4y2BadipMgydF4y2Ba突变体细胞由于细胞分裂缺陷而呈细长状,具有单个FtsZ环。本地化的DipM在gydF4y2BadipMgydF4y2Ba与野生型相比,突变型是相对扩散的。放大的DipM定位视图显示在插图中。gydF4y2Ba(E)gydF4y2Ba野生型和FM1-43染色gydF4y2BadipMgydF4y2Ba在细胞质膜上显示模式的突变体。的gydF4y2BadipMgydF4y2Ba突变细胞没有膜隔,这表明外膜和细胞质膜的收缩都受到了损害。比例尺= 2 μmgydF4y2Ba(一)gydF4y2Ba, 5 μmgydF4y2Ba(D)gydF4y2Ba, 1 μm (insets ofgydF4y2BaDgydF4y2Ba), 10 μmgydF4y2Ba(E)gydF4y2Ba。gydF4y2Ba
检测细胞分裂是否需要DipMgydF4y2Ba美国elongatusgydF4y2Ba,我们试图破坏gydF4y2BadipMgydF4y2Ba基因,将基因座替换为gydF4y2BanptIIgydF4y2Ba基因,赋予卡那霉素抗性。因为蓝藻细菌有多个基因组[gydF4y2Ba31gydF4y2Ba],用PCR方法确定突变是完全分离还是不完全分离。即使在将耐卡那霉素菌落连续5次转移到新培养皿后,我们仍无法完全分离出gydF4y2BadipMgydF4y2Badisruptant(图gydF4y2Ba3.gydF4y2BaB),这表明DipM蛋白的完全耗尽是致命的gydF4y2Ba美国elongatusgydF4y2Ba。免疫印迹分析显示,分离不完全的细胞中DipM水平降低gydF4y2BadipMgydF4y2Ba与野生型相比的突变型(图gydF4y2Ba3.gydF4y2BaC)。gydF4y2BadipMgydF4y2Ba突变细胞显示出细长的形状,表明细胞分裂缺陷。此外,突变体细胞比野生型细胞更宽,一些突变体细胞呈现扭曲形状(图gydF4y2Ba3.gydF4y2BaD和gydF4y2Ba3.gydF4y2BaE)可能是因为PG层的重塑受损gydF4y2BadipMgydF4y2Ba突变体。在Δ中也观察到类似的异质外观gydF4y2BadipMgydF4y2Ba突变体的gydF4y2Bac . crescentusgydF4y2Ba[gydF4y2Ba26gydF4y2Ba].因为种族不完全隔离gydF4y2BadipMgydF4y2Ba突变细胞仍能产生一定水平的DipM蛋白,且仍能分裂gydF4y2BadipMgydF4y2Ba突变体与野生型相似),我们检测了DipM的定位gydF4y2BadipMgydF4y2Ba突变体。免疫荧光显微镜显示,DipM定位在假设的分裂部位,但荧光信号低于野生型,定位相对弥散(图gydF4y2Ba3.gydF4y2BaD)gydF4y2BadipMgydF4y2Ba突变时,分裂位点的DipM定位和浓度受损,可能是由于缺乏DipM蛋白。gydF4y2Ba
FM1-43(膜染料)染色[gydF4y2Ba22gydF4y2Ba显示了拉长gydF4y2Ba长尾蛇gydF4y2Ba突变体细胞无膜隔(图gydF4y2Ba3.gydF4y2BaE),提示突变体细胞外膜和细胞质膜的收缩都受到损害。与这一观察相一致的是,拉长gydF4y2Ba长尾蛇gydF4y2Ba突变体细胞通常只有一个FtsZ环(图gydF4y2Ba3.gydF4y2BaD)。gydF4y2Ba
DipM定位于细胞分裂的部位,在蓝藻中参与细胞分裂gydF4y2Ba美国elongatusgydF4y2Ba
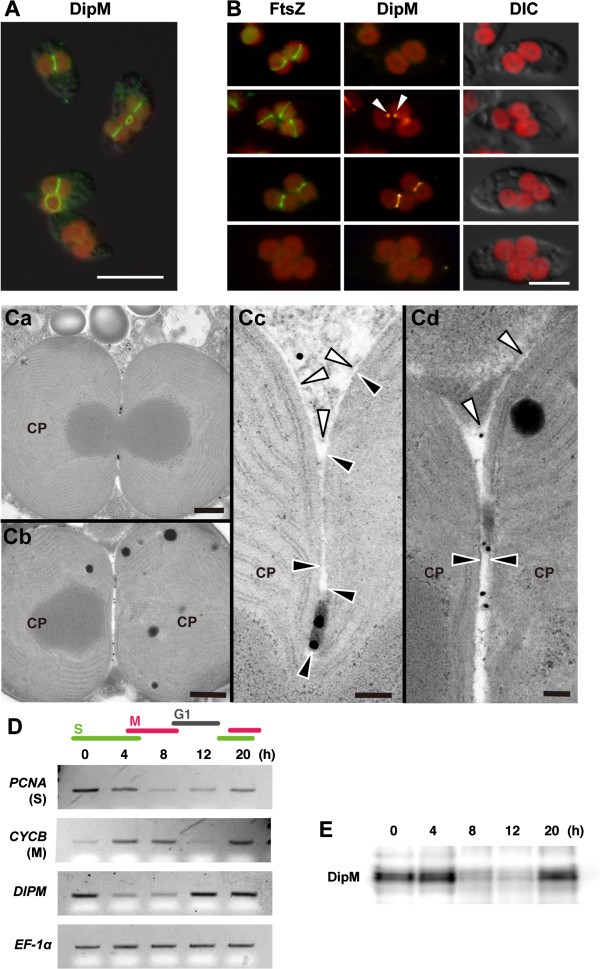
以上结果证实了DipM参与了蓝藻细胞分裂。然后,我们询问核编码的DipM是否与蓝藻中的叶绿体分裂有关gydF4y2Bac . paradoxagydF4y2Ba。细菌DipM具有信号肽,并分泌到周围质,在那里它结合/水解PG [gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba].因此,gydF4y2Bac . paradoxagydF4y2BaDipM可能定位于PG层存在的膜间隙的叶绿体分裂位点。免疫荧光显微镜使用抗gydF4y2Bac . paradoxagydF4y2BaDipM抗体显示DipM定位在叶绿体分裂位点gydF4y2Bac . paradoxagydF4y2Ba(图gydF4y2Ba4gydF4y2BaA)。FtsZ和DipM同时免疫染色显示,在FtsZ环形成后,分裂部位收缩前,DipM定位于分裂部位(图gydF4y2Ba4gydF4y2BaB).我们经常观察到一个单一的DipM染色点(图gydF4y2Ba4gydF4y2BaB,箭头)与FtsZ环的一部分在预期的划分位置(图gydF4y2Ba4gydF4y2BaB).这一观察结果表明,DipM定位,以及可能的PG水解,从一个特定的点开始,并扩展到整个分裂位点。免疫电子显微镜显示,DipM(金颗粒检测)定位于分裂部位膜间隙PG层(图gydF4y2Ba4gydF4y2BaC).即使内层包膜分裂后,DipM仍定位于PG层(图gydF4y2Ba4gydF4y2BaCb和gydF4y2Ba4gydF4y2BaCd),即当外包膜仍在收缩时。gydF4y2Bac . paradoxagydF4y2Ba目前,DipM在遗传上是不可控制的,因此对DipM功能进行分子遗传分析是不可行的。然而,DipM定位和PG水解活性的发现表明,核编码的DipM在分裂位点输入到膜间隙,在那里参与PG降解。gydF4y2Ba
在蓝藻中,DipM优先在S期表达,并定位于膜间隙的叶绿体分裂位点gydF4y2Bac . paradoxa。gydF4y2Ba(一)gydF4y2Ba免疫荧光图像显示DipM定位在叶绿体分裂部位(绿色荧光)gydF4y2Bac . paradoxagydF4y2Ba。红色是叶绿素的自发荧光。gydF4y2Ba(B)gydF4y2Ba免疫荧光图像显示FtsZ(绿色荧光)和DipM(黄色荧光)定位gydF4y2Bac . paradoxagydF4y2Ba。在FtsZ环形成后,DipM定位于分裂部位。gydF4y2Ba(C)gydF4y2Ba免疫电子显微照片显示DipM在叶绿体分裂位点PG层的定位。金颗粒指示了DipM的位置。白色和黑色箭头分别表示叶绿体(CP)的外膜和内膜。gydF4y2Ba(D)gydF4y2Ba半定量RT-PCR分析显示mRNA水平的变化gydF4y2BaDIPMgydF4y2Ba在同步培养期间。gydF4y2BaDIPMgydF4y2BamRNA水平在S期达到峰值。叶绿体分裂基因被框起来。gydF4y2Ba英孚gydF4y2Ba-gydF4y2Ba1gydF4y2Baα为定量对照。gydF4y2BaPCNAgydF4y2Ba而且gydF4y2BaCYCBgydF4y2Ba作为S期和m期标记物。用aphidicolin(一种DNA聚合酶抑制剂)将细胞抑制在S期,然后在持续光照下随着aphidicolin的去除重新启动细胞周期,如所述(Miyagishima et al., [gydF4y2Ba32gydF4y2Ba])。gydF4y2Ba(E)gydF4y2Ba免疫印迹分析显示同步培养过程中DipM蛋白水平的变化。DipM蛋白水平在S期达到峰值。每条通道都装载了等量的总蛋白质。比例尺= 10 μmgydF4y2Ba(一)gydF4y2Ba, 5 μmgydF4y2Ba(B)gydF4y2Ba, 500 nm (Ca和Cb), 100 nm (Cc和Cd)。gydF4y2Ba
在之前的一项研究中,我们显示了核编码的转录本和蛋白质水平gydF4y2Ba心gydF4y2Ba而且gydF4y2Ba我的gydF4y2Ba,而不是gydF4y2BaFTSZgydF4y2Ba,在细胞周期进程中发生变化,在S期叶绿体分裂时达到峰值[gydF4y2Ba32gydF4y2Ba].为了检验是否gydF4y2BaDIPMgydF4y2Ba转录和翻译也受到细胞周期的调节,gydF4y2Bac . paradoxagydF4y2Ba通过用蚜虫素阻止S期的细胞,并通过去除蚜虫素重新启动细胞周期来实现同步。s期标记物的半定量RT-PCR分析gydF4y2BaPCNAgydF4y2Ba, m相位标记,gydF4y2BaCYCBgydF4y2Ba(编码m期周期蛋白),表明培养是同步的(图gydF4y2Ba4gydF4y2BaD). RT-PCR(图gydF4y2Ba4gydF4y2BaD)和免疫印迹分析(图gydF4y2Ba4gydF4y2Ba解析:答案为EgydF4y2BaDIPMgydF4y2Ba转录体和DipM蛋白水平在细胞周期进程中发生变化,并在S期达到峰值gydF4y2Ba心gydF4y2Ba而且gydF4y2Ba我的gydF4y2Ba[gydF4y2Ba32gydF4y2Ba].因此,DipM的转录和翻译受到细胞周期的调控,从而使DipM在叶绿体分裂期间特异性表达。gydF4y2Ba
DipM是苔藓中正常叶绿体分裂所必需的gydF4y2Bap .金属盘gydF4y2Ba
这些结果表明,蓝藻和绿藻叶绿体之间的DipM功能是守恒的,其中DipM可能在分裂位点水解PG。这种保护是合理的,因为蓝藻叶绿体保留了一个PG层,这是由祖先的内共生蓝藻演化而来的。除青花植物外,在任何叶绿体(质体)中均未检测到PG层。然而,我们的数据库搜索在苔藓植物中发现了DipM同源物gydF4y2Bap .金属盘gydF4y2Ba还有蕨类植物gydF4y2Ba美国moellendorffiigydF4y2Ba。有趣的是,尽管没有证据表明PG的存在,这些谱系仍然保留了PG合成的基因,这些基因可能在叶绿体中起作用。此外,这些基因的突变以及PG合成的某些抑制剂会损害叶绿体的分裂[gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
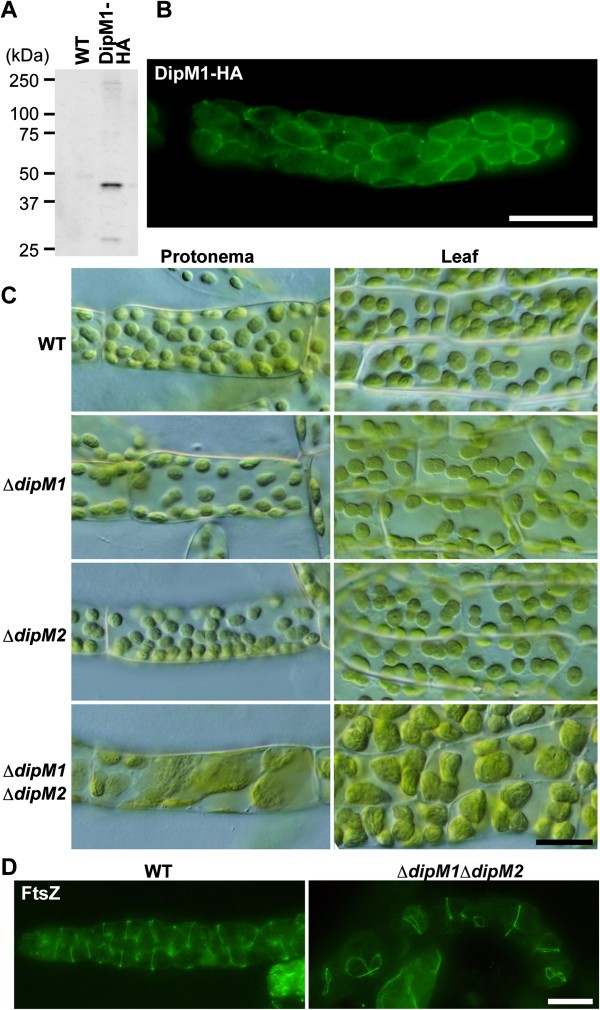
为了研究DipM在陆生植物中的功能,我们研究了DipM的定位和影响gydF4y2BadipMgydF4y2Ba苔藓叶绿体分裂的突变gydF4y2Bap .金属盘gydF4y2Ba。尽管经过多次努力,我们还是无法获得与之特异反应的抗体gydF4y2Bap .金属盘gydF4y2BaDipM1。因此,我们使用肌动蛋白启动子表达DipM1-HAgydF4y2Bap .金属盘gydF4y2Ba并用抗ha抗体检测DipM1-HA的定位。免疫印迹分析显示,转基因植株中有DipM1-HA的表达gydF4y2Bap .金属盘gydF4y2Ba(图gydF4y2Ba5gydF4y2Ba然而,检测到的条带尺寸(~45 kDa)小于DipM1-HA的预期尺寸(~52 kDa)(图gydF4y2Ba5gydF4y2BaA),说明n端部分被处理了gydF4y2Ba在活的有机体内gydF4y2Ba,尽管计算机预测没有n端信号或转运肽。使用ha抗体的免疫荧光显微镜显示,DipM1-HA定位于叶绿体表面(图gydF4y2Ba5gydF4y2BaB).基于DipM在细菌中的定位gydF4y2Bac . paradoxagydF4y2Ba, DipM1-HA可能存在于膜间隙。然而,相比之下gydF4y2Ba美国elongatusgydF4y2Ba(图gydF4y2Ba3.gydF4y2Ba),gydF4y2Bac . paradoxagydF4y2Ba, DipM1-HA(图gydF4y2Ba4gydF4y2Ba)定位在整个叶绿体表面,我们没有观察到任何环状定位或特定于叶绿体分裂部位的定位gydF4y2Bap .金属盘gydF4y2Ba(图gydF4y2Ba5gydF4y2BaB)。gydF4y2Ba
DipM是苔藓叶绿体分裂所必需的gydF4y2Ba金属盘。gydF4y2Ba(一)gydF4y2Ba免疫印迹分析显示DipM1-HA融合蛋白的表达。DipM1-HA由水稻肌动蛋白启动子表达,并用抗ha抗体检测。gydF4y2Ba(B)gydF4y2Ba免疫荧光图像显示DipM1-HA(绿色荧光)在叶绿体整个表面的定位。gydF4y2Ba(C)gydF4y2Ba∆表型gydF4y2BadipM1gydF4y2Ba,∆gydF4y2BadipM2gydF4y2Ba以及∆gydF4y2BadipM1gydF4y2Ba和∆gydF4y2BadipM2gydF4y2Ba双突变体。的∆gydF4y2BadipM1gydF4y2Ba和∆gydF4y2BadipM2gydF4y2Ba双突变细胞含有比野生型更少数量的大叶绿体,这表明叶绿体分裂缺陷。用差分干涉对比显微镜观察野生型和突变体原丝体和叶片细胞的叶绿体。gydF4y2Ba(D)gydF4y2Ba免疫荧光图像显示FtsZ在野生型(WT)和∆中的定位gydF4y2BadipM1gydF4y2Ba∆gydF4y2BadipM2gydF4y2Baprotonemal细胞。大部分叶绿体在∆gydF4y2BadipM1gydF4y2Ba∆gydF4y2BadipM2gydF4y2Ba具有单个FtsZ环,提示FtsZ环形成后叶绿体分裂需要DipM1和DipM2。比例尺= 20 μmgydF4y2Ba(B, C和D)gydF4y2Ba。gydF4y2Ba
为了研究DipM是否参与了叶绿体的分裂gydF4y2Bap .金属盘gydF4y2Ba,如与PG合成相关的蛋白质[gydF4y2Ba20.gydF4y2Ba,我们打乱了gydF4y2BaDipM1gydF4y2Ba而且gydF4y2BaDipM2gydF4y2Ba位点的gydF4y2Bap .金属盘gydF4y2Ba(附加文件gydF4y2Ba2gydF4y2Ba:图S1)。在野生型和Δ之间,原质细胞和叶片细胞的叶绿体大小和形状均无明显差异gydF4y2BadipM1gydF4y2Ba或ΔgydF4y2BadipM2gydF4y2Ba突变体(图gydF4y2Ba5gydF4y2BaC).然而,ΔgydF4y2BadipM1gydF4y2Ba和ΔgydF4y2BadipM2gydF4y2Ba双突变体细胞比野生型细胞含有更少数量的大叶绿体(图gydF4y2Ba5gydF4y2BaC).这种表型表明叶绿体分裂缺陷,类似于在gydF4y2Bap .金属盘gydF4y2Ba与细菌PG合成基因同源的基因失活的突变体[gydF4y2Ba20.gydF4y2Ba].这些观察结果表明,DipM1和DipM2在叶绿体分裂中发挥了冗余作用,可能是在膜间隙中gydF4y2Bap .金属盘gydF4y2Ba。为了确定需要DipM1和DipM2的叶绿体分裂过程的阶段,我们随后在Δ中检查了FtsZ定位gydF4y2BadipM1gydF4y2BaΔgydF4y2BadipM2gydF4y2Ba双突变体。免疫荧光显微镜使用抗gydF4y2Ba答:芥gydF4y2BaFtsZ2-1抗体显示FtsZ在增大的叶绿体中形成环状结构(图gydF4y2Ba5gydF4y2BaD).在我们的研究中,大多数叶绿体只有一个FtsZ环。这种情况类似于蓝藻中的FtsZ定位模式gydF4y2Ba长尾蛇gydF4y2Ba突变体。这个FtsZ定位模式在ΔgydF4y2BadipM1gydF4y2BaΔgydF4y2BadipM2gydF4y2Ba突变表明,在FtsZ环形成后,DipM1和DipM2是必需的,细菌DipM/NlpD也是如此[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
讨论gydF4y2Ba
最近的分子遗传和结构研究已经确定了参与叶绿体分裂的蛋白质,并提供了在进化过程中叶绿体分裂机制如何从蓝藻分裂机制被修改的见解。这些研究揭示了某些蓝藻分裂机制成分保留在叶绿体内,真核宿主细胞在叶绿体内外都提供了额外的机制[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba].然而,在蓝藻中,在叶绿体分裂位点的胞质侧起作用的真核宿主起源的成分都不明显。与其他植物系不同的是,在膜间空间PG的生长和PG的分裂伴随着叶绿体的分裂。因此,为了了解叶绿体分裂机制在进化早期是如何被重塑的,了解在蓝藻叶绿体分裂中PG层和附着的外膜是如何分离的是很重要的。gydF4y2Ba
变形菌门、厚壁菌门和蓝藻门PG分裂的比较gydF4y2Ba
尽管与基于ftsz的细胞质分裂复合体相比,其特征还不够明确,但最近的分子遗传学研究已经开始阐明细菌细胞分裂过程中PG分裂的分子机制[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba21gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba].在细菌细胞分裂中,分裂位点是通过小管蛋白样FtsZ - GTPase的局部聚合而建立的,该结构充当了组装其他“分裂体”组分的支架。分裂体的主要功能之一是促进PG层的合成,这将最终加强新的子细胞极。这涉及到几个与分裂体相关的PBPs(青霉素结合蛋白)[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].虽然由这些合成酶产生的间隔PG最初由子细胞共享,但它必须在形成后被分裂,以允许外膜的收缩(在革兰氏阴性细菌的情况下)和子细胞的最终分裂。正如革兰氏阴性菌和革兰氏阳性菌的细胞质分裂复合体的组成不同一样[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba],两者之间PG层结构和间隔PG分裂有显著差异。在革兰氏阳性菌中,这种间隔PG层通常在子细胞被膜融合分隔后的某个时间被分裂。然而,在革兰氏阴性细菌中,间隔PG层在形成后不久就会分裂,以使外膜的收缩紧紧跟随内膜(细胞质)的收缩[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].在这方面,电子显微镜显示,蓝藻的细胞分裂和蓝藻的叶绿体分裂更像厚壁菌门的细胞分裂,而不是变形菌门的PG长入和分裂,尽管蓝藻确实具有革兰氏阴性细菌的外膜特征[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba)(图gydF4y2Ba4gydF4y2BaC).厚壁菌门和蓝藻之间PG分裂的相似性可能与蓝藻中PG层的革兰氏阳性样特征有关[gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
尽管蓝藻和厚壁菌门之间有相似之处,但在蓝藻基因组中LytE同源物(即同时含有LysM和NlpC基序的蛋白质)并不明显,相反,我们的数据库搜索在蓝藻基因组中确定了DipM和EnvC同源物(图gydF4y2Ba1gydF4y2Ba).在gydF4y2Ba美国elongatusgydF4y2Ba时,不可能完全耗尽DipM(图gydF4y2Ba3.gydF4y2Ba),可能是因为完全耗竭是致命的。DipM下调的突变细胞由于细胞分裂缺陷而呈细长状,通常只有一个FtsZ环(图gydF4y2Ba3.gydF4y2Ba).这些结果与研究的结果相反gydF4y2Ba大肠杆菌gydF4y2Ba,其中仅删除NlpD不会引起明显的细胞分裂缺陷。当PG分裂因NlpD和EnvC或Ami蛋白组的缺失而受损时,gydF4y2Ba大肠杆菌gydF4y2Ba细胞形成由PG间隔以相当规则的间隔连接的链(即细胞质膜裂变发生时PG没有分裂)[gydF4y2Ba22gydF4y2Ba- - - - - -gydF4y2Ba24gydF4y2Ba].然而,在某种程度上与gydF4y2Ba长尾蛇gydF4y2Ba突变体(图gydF4y2Ba3.gydF4y2Ba),gydF4y2BaC. crescentus dipMgydF4y2Ba突变导致细胞成丝,但无法内陷细胞质和外膜[gydF4y2Ba25gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba].大概两者都是gydF4y2Bac . crescentusgydF4y2Ba而且gydF4y2Ba美国elongatusgydF4y2Ba时,FtsZ环和细胞质膜的收缩与PG的分裂紧密协调,其中DipM活性的下调也延缓了细胞质膜的收缩。gydF4y2Ba
蓝藻叶绿体中的PG分裂gydF4y2Ba
在非青衣植物的叶绿体分裂中,外PD环和动力相关蛋白DRP5B被认为从细胞质侧产生动力以收缩外膜[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba].相比之下,这些元素在青花植物中缺失,而外包膜内陷似乎是一个被动的过程,因为将膜系在PG层上导致外包膜向内移动,因为间隔PG在收缩过程中分裂。在变形菌门中,丰富的髓素结合外膜蛋白如Lpp和OmpA将外膜与PG结合,另外,最近的研究表明,丰富的外膜脂蛋白Pal定位于分裂位点,在细胞分裂过程中,需要Pal与内膜蛋白Tol相互作用才能将外膜系在PG上[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].然而,这些外膜蛋白的同源物在蓝藻和蓝藻基因组中不存在,除了在有限数量的蓝藻物种中部分类似于Lpp和OmpA的蛋白质。因此,需要进一步使用蓝藻进行研究,以了解蓝藻和蓝藻叶绿体的外膜或外包膜收缩与PG分裂是如何耦合的。gydF4y2Ba
我们的研究结果表明,在FtsZ环形成后,DipM定位在叶绿体分裂位点,并且DipM定位从一个特定的点开始,然后移动整个分裂位点的跨度(图gydF4y2Ba4gydF4y2BaB).这种DipM定位模式与之前通过电子显微镜观察到的结果是一致的,后者表明外包膜内陷从一个特定的点开始,并蔓延到整个分裂部位[gydF4y2Ba12gydF4y2Ba].考虑到gydF4y2Bac . paradoxagydF4y2BaDipM具有PG水解活性gydF4y2Ba在体外gydF4y2Ba(图gydF4y2Ba2gydF4y2Ba), PG分割从一个特定的点开始,然后继续到整个分割站点gydF4y2Bac . paradoxagydF4y2Ba。gydF4y2Ba
在gydF4y2Bac . paradoxagydF4y2Ba, DipM优先在S相表达(图gydF4y2Ba4gydF4y2BaD和gydF4y2Ba4gydF4y2BaE).我们之前的研究表明FtsZ在整个细胞周期中持续表达,而核编码的MinD和MinE的表达以及FtsZ环的形成仅限于S期[gydF4y2Ba32gydF4y2Ba].与核编码的叶绿体分裂基因相反,叶绿体编码的分裂基因(gydF4y2BaftsWgydF4y2Ba而且gydF4y2BasepFgydF4y2Ba,图gydF4y2Ba1gydF4y2BaC)不受宿主细胞周期的调控;gydF4y2Ba32gydF4y2Ba].这些结果表明,部分(但不是全部)叶绿体分裂基因的基于细胞周期的转录/翻译调控是叶绿体分裂与宿主细胞周期同步的原因。鉴于宿主真核起源的叶绿体分裂蛋白在gydF4y2Bac . paradoxagydF4y2Ba,内共生基因转移和转录/翻译调节的建立可能发生在真核宿主起源的分裂蛋白(如DRP5B和PDR1)的添加之前。考虑到细胞分裂而不是生长gydF4y2Ba美国elongatusgydF4y2Ba需要DipM(图gydF4y2Ba3.gydF4y2Ba),内共生基因转移和DipM表达时间与宿主细胞周期的耦合似乎足以使内共生细胞分裂的时间与宿主细胞周期同步。除线粒体和叶绿体外,许多真核生物都含有细菌或真核内共生体。在大多数情况下,内共生菌保留PG层,在某些情况下,如尾虫中的蓝藻内共生菌gydF4y2BaPaulinella chromatophoragydF4y2Ba[gydF4y2Ba35gydF4y2Ba]和硅藻gydF4y2BaRhopalodia gibbagydF4y2Ba[gydF4y2Ba36gydF4y2Ba],内共生体的细胞分裂时间与宿主细胞周期紧密耦合。因此,了解叶绿体分裂的调控,包括PG分裂,将有助于揭示永久内共生关系建立和进一步进化的共同特征。gydF4y2Ba
PG合成和分裂蛋白的系统发育分布,以及这些蛋白参与叶绿体分裂gydF4y2Ba
在我们进行的数据库搜索中,也在叶生植物、苔藓和一种石松植物(蕨类)中发现了DipM同源物,但在红藻、绿藻或种子植物中没有发现gydF4y2Ba1gydF4y2Ba).此外,我们的结果表明,在苔藓中FtsZ环形成后,叶绿体分裂需要DipMgydF4y2Bap .金属盘gydF4y2Ba(图gydF4y2Ba5gydF4y2Ba).DipM的系统发育分布与细菌中PG合成和PG合成抑制剂对叶绿体分裂的损害所涉及的酶的同源蛋白的系统发育分布一致[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].这与DipM同源物的PG水解酶活性一致gydF4y2Ba在体外gydF4y2Ba(图gydF4y2Ba2gydF4y2Ba)表明,部分植物系的叶绿体膜间隙中仍存在PG层。尽管PG从未在除绿藻外的叶绿体中被检测到,但最终解决这一问题需要更敏感的分析。在gydF4y2Bap .金属盘gydF4y2Ba, DipM本地化不局限于分部站点(图gydF4y2Ba5gydF4y2BaB).因此,PG将存在于整个膜间空间gydF4y2Bap .金属盘gydF4y2Ba,如果存在的话。如前所述,关于PG合成,DipM的系统发育分布表明,PG水解酶在不同谱系中也独立丢失了至少3次,来自祖先红藻、叶绿素和种子植物(图gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
结论gydF4y2Ba
正如蓝藻的细胞分裂一样,叶绿体也在蓝藻中分裂gydF4y2Bac . paradoxagydF4y2Ba涉及PG分裂,而不是由外PD环和动力相关蛋白收缩。PG的分裂是由DipM蛋白介导的,该活性可能仍参与绿藻叶绿体的分裂。gydF4y2Ba
方法gydF4y2Ba
数据库搜索gydF4y2Ba
DNA和蛋白质序列数据库访问国家生物技术信息中心(gydF4y2Bahttp://www.ncbi.nlm.nih.govgydF4y2Ba)和来自蓝藻基因组计划(gydF4y2Bahttp://cyanophora.rutgers.edu/cyanophora/home.phpgydF4y2Ba).利用基本局部比对搜索工具(Basic Local Alignment Search Tool, TBLASTN和BLASTP)根据氨基酸序列鉴定已知细菌细胞分裂基因的真核同源物[gydF4y2Ba37gydF4y2Ba].蛋白基序用PFAM (gydF4y2Bahttp://www.sanger.ac.uk/Software/Pfam/gydF4y2Ba).gydF4y2Ba
培养条件gydF4y2Ba
美国elongatusgydF4y2BaPCC 7942及其衍生物在30˚C的BG-11介质中连续光(30 μmol光子m)下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).gydF4y2Bac . paradoxagydF4y2BaUTEX555 (NIES-547)在C培养基(gydF4y2Bahttp://mcc.nies.go.jp/02medium-e.htmlgydF4y2Ba)在连续光(30 μmol光子mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).gydF4y2Bap .金属盘gydF4y2Ba无性系种群。gydF4y2Ba金属盘gydF4y2Ba及其衍生物在20℃的条件下,在添加了5mm酒石酸二铵(BCDAT)或添加了0.5%葡萄糖(BCDG培养基)的微量培养基(BCD培养基)上生长(gydF4y2Bahttp://www.plant-biotech.net/gydF4y2Ba(50 μmol光子mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)如所述[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
重组DipM蛋白及抗体的制备gydF4y2Ba
用引物5 ' -caccGGCAAACTGACCAAGTTCAGAT-3 '和5 ' - ctagcgagaagggagagagaggcgat -3 ' PCR扩增出编码该蛋白全长或部分片段的cDNA序列gydF4y2Ba美国elongatusgydF4y2BaDipM, 5 ' -caccGAGGAGCTCTTTTCAACTCCG-3 '和5 ' -TCAGCACCGCATGTCGAGGTAG-3 'gydF4y2Bac . paradoxagydF4y2BaDipM, 5 ' -caccGTGTTCAAGTGGCCGACTCTAAGG-3 '和5 ' -TCACAAACGGACCCATTTCAAT-3 'gydF4y2Bap .金属盘gydF4y2BaDipM1。这些PCR产物被克隆到pET100表达载体(Invitrogen)中,6xHis融合多肽在Rosetta (DE3)中表达。gydF4y2Ba大肠杆菌gydF4y2Ba细胞和纯化使用HisTrap HP柱(GE医疗保健)。抗血清gydF4y2Ba美国elongatusgydF4y2Ba而且gydF4y2Bac . paradoxagydF4y2Ba用相应的重组多肽在家兔中培养DipM。抗体通过与HiTrap nhs激活HP柱偶联的重组蛋白从各自的抗血清中亲和纯化(GE Healthcare)。gydF4y2Ba
ZymographygydF4y2Ba
酶谱学基本上如其他地方所述[gydF4y2Ba25gydF4y2Ba],除了细胞壁是由gydF4y2Ba美国elongatusgydF4y2Ba。为了制备细胞壁,细胞(1 L, OD730 = 1.0)在4000℃下离心收集gydF4y2BaggydF4y2Ba将细胞重悬于10 mL 5% SDS中,然后在冰上超声50次,占空比为10 s开和10 s关。sds不溶性部分通过15,000离心获得gydF4y2BaggydF4y2Ba将颗粒重悬于10 mL 50 mM Tris-HCl中,pH 7.5,含2 mg/mL Pronase (Roche), 37˚C下孵育过夜。所得细胞壁用0.1% SDS在15,000离心洗涤gydF4y2BaggydF4y2Ba3次,每次20分钟。将洗净的细胞壁(约100mg,湿重)悬浮在1ml蒸馏水中。gydF4y2Ba
经HisTrap柱纯化的DipM多肽各5 μg,溶菌酶和牛血清白蛋白用两种含有0.6%(湿w/v)细胞壁的SDS-PAGE凝胶(15%T)分离,同时运行。一个凝胶固定,用考马斯亮蓝染色。另一组在变性缓冲液(25 mM Tris-HCl, pH 8.0, 1% TritonX-100)中孵育过夜,用0.1%亚甲基蓝在0.01% KOH中染色3小时,并用蒸馏水染色。gydF4y2Ba
同步培养和半定量RT-PCRgydF4y2Bac . paradoxagydF4y2Ba
同步和半定量PCR方法如所述[gydF4y2Ba32gydF4y2Ba].gydF4y2Bac . paradoxagydF4y2Ba细胞培养至细胞密度为1 × 10gydF4y2Ba6gydF4y2Ba在24°C连续光下(40 μmol光子mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)和用普通空气曝气。为了使细胞停留在S期,在DMSO中加入1/ 1000体积的5 mg/ml蚜虫素溶液,细胞培养24小时。为了去除蚜虫素,用新鲜培养基在200℃离心清洗细胞两次gydF4y2BaggydF4y2Ba在相同条件下培养10分钟。gydF4y2Ba
RT-PCR用TRIzol试剂(Invitrogen)从5ml培养物中提取总RNA。经DNaseI处理后,利用ThermoScript RT (Invitrogen)随机六聚体将RNA合成cDNA,并用DNaseI处理。引物5 ' - cgagcaccttgggattccagg -3 '和5 ' -GCTTGTTGCCTTGGTGAAGTTG-3 '进行PCR反应gydF4y2BaPCNAgydF4y2Ba, 5 ' -AGGACAAACGCCACATGAACCC-3 '和5 ' -TACGAGGACTCCACGCCAGCC-3 'gydF4y2BaCYCBgydF4y2Ba, 5 ' -CCCCACAGCCTGAACAACTTC-3 '和5 ' -GAACGATGAGGACGTTGACAG-3 'gydF4y2BaDIPMgydF4y2Ba, 5 ' -GGCTACAACCCCGACAAGATTC-3 '和5 ' -CACGGCGGATGTCCTTGACG-3 'gydF4y2Ba英孚gydF4y2Ba-gydF4y2Ba1gydF4y2Baα。gydF4y2Ba
基因破坏gydF4y2Ba美国elongatusgydF4y2Ba
要使gydF4y2Ba长尾蛇gydF4y2Ba用引物5’-CCATTCATCGACTGTCGCAGTT-3’和5’-AGAAGGGAGATAGGCGATCGGG-3’扩增了相关基因组区(约1.7 kbp)。将扩增后的DNA克隆到pGEM-T易载体(Promega)中。通过引物5 ' -TGTGGAATTGTGAGCGGATAAC-3 '和5 ' -AAGTCAGCGTAATGCTCTGCCA-3 '从pUC4K载体(GenBank登录号× 06404)扩增出卡那霉素耐药基因。将扩增的卡那霉素耐药基因插入gydF4y2BaNrugydF4y2Ba我的网站gydF4y2BadipMgydF4y2Ba。卡那霉素抗性基因被插入到与基因相同的方向gydF4y2BadipMgydF4y2Ba基因被用于基因破坏。的gydF4y2BadipMgydF4y2Ba将该结构物转化野生型细胞,并在含卡那霉素(15 μg ml)的BG-11板上筛选gydF4y2Ba−1gydF4y2Ba).单个菌落在新盘子上被划了五次。使用引物5 ' -TAGGTAGTTTGTGGCGAATGGG-3 '和5 ' - cctctcaacacgtaaaagcgt -3 '进行PCR检测突变的分离。gydF4y2Ba
ha标记蛋白的基因破坏与表达gydF4y2Bap .金属盘gydF4y2Ba
灭活gydF4y2BaP. patens DipM1gydF4y2Ba而且gydF4y2BaDipM2gydF4y2Ba,分别用引物5’-CATATCGTTCACTGAGCAGCGTC-3’和5’-ATTGGTAGAGTTGGGCTGGCTTC-3’扩增基因组区gydF4y2BaDipM1gydF4y2Ba5 ' -GTTCAAGTGGTTGACTCCCAAGC-3 '和5 ' -CAGAACACCTTGCACGCTAGAGA-3 'gydF4y2BaDipM2gydF4y2Ba,分别。扩增后的DNA很容易克隆到pGEM-T中。从pTN81载体中剪切卡那霉素耐药基因gydF4y2Ba生态gydF4y2Ba并插入RV中gydF4y2BaMscgydF4y2Ba我的网站gydF4y2BaDipM1gydF4y2Ba。引物5 ' -AATGCTAACCCACAGATGGT-3 '和5 ' -ATGGCTCTGATACCAATTTTTAAG-3 '从9WH3载体扩增出湿霉素抗性基因,并将其插入gydF4y2BaNrugydF4y2Ba我的网站gydF4y2BaDipM2gydF4y2Ba。gydF4y2Ba
结果gydF4y2BaDipM1gydF4y2Ba(kanamycin-resistance)和gydF4y2BaDipM2gydF4y2Ba(抗湿霉素)失活盒从pGEM-T很容易被切断gydF4y2Ba不gydF4y2Ba我又引入了野生型gydF4y2Bap .金属盘gydF4y2Ba质子细胞的粒子轰击,如前所述[gydF4y2Ba39gydF4y2Ba].将转化后的苔藓在BCDG培养基上黑暗培养3 d,然后转移到含50 μg ml的BCDAT培养基上gydF4y2Ba−1gydF4y2BaG418或30 μg mlgydF4y2Ba−1gydF4y2Ba使用潮霉素2周。将所选苔藓转移到bccdat培养基上生长1周。然后将它们再次转移到选择培养基上。gydF4y2BaDipM1gydF4y2Ba而且gydF4y2BaDipM2gydF4y2Ba引物5 ' -tcaagcatcagcttacaagtggca-3 '和5 ' -atatctagttacaaaccctccttca-3 '经PCR检测,均为阳性gydF4y2BaDipM1gydF4y2Ba引物5 ' -cctacactgggatgctggctctaa-3 '和5 ' -gcagccactttcgctaggtattga-3 'gydF4y2BaDipM2gydF4y2Ba,分别(附加文件gydF4y2Ba2gydF4y2Ba:图S1)。要生成gydF4y2BadipM1gydF4y2BadipM2gydF4y2Ba双突变体gydF4y2BaDipM2gydF4y2Ba基因gydF4y2BadipM1gydF4y2Ba中断器被中断(附加文件gydF4y2Ba2gydF4y2Ba:图S1)。gydF4y2Ba
为了表达DipM1的c端HA表位融合,gydF4y2BaDipM1gydF4y2Ba用引物atggtgttcaagtggccgactc和ttacgcgtaatctggaacgtcataagggtatcctgcatagtccgggacgtcagagagagagcccgcatagaggaacatcgtatgggtacaaacggacccatttcaatggg(终止密码子和3xHA被划线)扩增cDNA,并将其插入gydF4y2BaSwagydF4y2Ba我定位了一个9W3H载体,它通过水稻肌动蛋白启动子驱动插入基因。合成的矢量被消化gydF4y2Ba不gydF4y2Ba我和被引入野生型gydF4y2Bap .金属盘gydF4y2Ba。在含30 μg ml的bccdat培养基上选择转化产物gydF4y2Ba−1gydF4y2Ba潮霉素。gydF4y2Ba
免疫荧光和免疫电子显微镜gydF4y2Ba
免疫荧光法检测血清中DipM和FtsZgydF4y2Ba美国elongatusgydF4y2Ba而且gydF4y2Bac . paradoxagydF4y2Ba基本上按所述进行[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].细胞固定在3% (w/v)多聚甲醛溶解在50 mM的管道- koh中,pH 6.8, 10 mM EGTA, 5 mM MgSO中gydF4y2Ba4gydF4y2Ba室温30分钟,用PBS- t (0.01% Tween-20在PBS中)清洗两次。0.05% Triton X-100在PBS-T中处理15 min后,在37°C下0.2 mg ml渗透30 mingydF4y2Ba−1gydF4y2Ba溶菌酶溶解于Tris-HCl, pH 7.5, 10 mM EDTA中,然后用PBS洗涤两次。在PBS-T(阻断缓冲液)中用2%牛血清白蛋白阻断30分钟后,在30°C下用阻断缓冲液稀释的第一个抗体标记细胞2小时。然后用阻断缓冲液洗涤两次,用Alexa Fluor 488山羊抗兔IgG (H + L) (Invitrogen)以1:10 00的浓度在阻断缓冲液中稀释,室温孵育1小时。用PBS-T洗涤两次后,荧光显微镜观察细胞(BX-51;奥林匹斯山)。用于同时检测中DipM和FtsZgydF4y2Bac . paradoxagydF4y2Ba使用Mix-n-Stain CF染料抗体标记试剂盒(Biotium;CF555用于DipM抗体,CF488用于FtsZ抗体)。抗体gydF4y2Ba美国elongatusgydF4y2BaDipM (1:50 0),gydF4y2Ba淡水藻类的一种gydF4y2BaPCC 7120 FtsZ(1:500检测gydF4y2Ba美国elongatusgydF4y2BaFtsZ;Agrisera),gydF4y2Bac . paradoxagydF4y2BaFtsZ [gydF4y2Ba32gydF4y2Ba](1:400),以及gydF4y2Bac . paradoxagydF4y2Ba按指示稀释DipM(1:500)。免疫荧光法检测血清中DipM1-HA和FtsZgydF4y2Bap .金属盘gydF4y2Ba根据PHYSCObase (gydF4y2Bahttp://moss.nibb.ac.jp/gydF4y2Ba).抗体gydF4y2Ba答:芥gydF4y2BaFtsZ2-1 [gydF4y2Ba41gydF4y2Ba](1:400)和抗血凝素抗体(1:100;Roche, 3 F10)按指示稀释。gydF4y2Ba
用于免疫电镜检测DipM中的gydF4y2Bac . paradoxagydF4y2Ba采用预包埋标记法,将细胞固定在4%多聚甲醛和0.2%戊二醛溶解于0.1 M磷酸盐缓冲液中,pH 7.4, 4˚C, 1 h,并用PBS-T洗涤三次。PBS-T洗涤三次后,Triton X-100和溶菌酶对细胞进行上述渗透。用阻断缓冲液阻断后,细胞与抗抗体发生反应gydF4y2Bac . paradoxagydF4y2BaDipM抗体(1:100在阻断缓冲液中)在室温下4小时。PBS-T洗涤四次后,细胞在4˚C下与1.4 nm金颗粒偶联二抗(阻断缓冲液1:80)反应过夜。PBS-T洗涤四次后,细胞用2%戊二醛在4˚C的磷酸盐缓冲液中固定过夜。然后,根据制造商的说明,用gold ENHANCE EM配方(纳米探针)增强金颗粒,然后在4˚C的磷酸盐缓冲液中用2%四氧化锇固定1小时。细胞脱水并嵌入喹啉-812中。薄切片(90nm厚)用铀和铅染色,在透射电镜下观察(JEM-1400Plus;JEOL)。gydF4y2Ba
免疫印迹gydF4y2Ba
用20mm Tris-HCl, pH7.5, 8 M尿素,0.1% Triton X-100和Complete Mini蛋白酶抑制剂混合物(Roche)超声破坏细胞。中断后,样品在15000的温度下离心gydF4y2BaggydF4y2Ba培养10 min后,用上清液进行免疫印迹。采用Bradford法(Bio-Rad)测定上清部分蛋白质含量。SDS-PAGE和免疫印迹分析如前所述[gydF4y2Ba41gydF4y2Ba].主要抗体gydF4y2Ba美国elongatusgydF4y2BaDipM (1:1,000),gydF4y2Bac . paradoxagydF4y2Ba按照指示稀释DipM(1:10 00)和HA表位(Roche, 3 F10, 1:10 00)。用辣根过氧化物酶偶联山羊抗兔或抗大鼠抗体检测一抗。使用ECL Prime Western Blotting检测系统(GE Healthcare)和VersaDoc 5000成像系统(Bio-Rad)检测信号。gydF4y2Ba
参考文献gydF4y2Ba
Keeling PJ:真核生物进化中质体内共生的数量、速度和影响。植物学报,2013,29(4):344 - 344。10.1146 / annurev - arplant - 050312 - 120144。gydF4y2Ba
Miyagishima SY:质体分裂机制:从细菌到细胞器。中国生物医学工程学报,2011,29(3):344 - 344。10.1104 / pp.110.170688。gydF4y2Ba
Yoshida Y, Miyagishima SY, Kuroiwa H, Kuroiwa T:质体分裂机制:形成、收缩和裂变。植物学报,2012,15:714-721。10.1016 / j.pbi.2012.07.002。gydF4y2Ba
派克KA:分裂和塑造:一个内共生体在行动。植物学报,2013,37(3):388 - 388。10.1007 / s00425 - 012 - 1739 - 2。gydF4y2Ba
Reski R:对我们目前关于叶绿体观点的挑战。中国生物医学工程学报,2009,29(3):344 - 344。gydF4y2Ba
Basak I, Moller SG:质体分裂调控的新兴方面。植物学报,2013,37(3):389-398。10.1007 / s00425 - 012 - 1743 - 6。gydF4y2Ba
Rodriguez-Ezpeleta N, Philippe H:质体起源:回放磁带。中国生物医学杂志,2006,16:R53-R56。10.1016 / j.cub.2006.01.006。gydF4y2Ba
黑岩T,黑岩H,酒井A,高桥H,户田K,伊藤R:质体和线粒体的分裂装置。中华医学杂志,1998,18(1):1-41。gydF4y2Ba
Sato M, Nishikawa T, Kajitani H, Kawano S:植物青花中FtsZ与肽聚糖的保守关系gydF4y2BaCyanophora paradoxagydF4y2Ba类似于细菌细胞分裂。植物学报,2007,27(3):379 - 379。10.1007 / s00425 - 007 - 0605 - 0。gydF4y2Ba
佐藤M,西川T,山崎T,川野S:植物FtsZ质体基因的分离gydF4y2BaCyanophora paradoxagydF4y2Ba(Glaucocystophyceae Glaucocystophyta)。地球物理学报,2005,29(3):344 - 344。10.1111 / j.1440-1835.2005.tb00361.x。gydF4y2Ba
Iino M,桥本H:青花分化的中间特征gydF4y2BaCyanophora paradoxagydF4y2Ba(Glaucocystophyta)在蓝藻和质体之间分裂。中国生物医学工程学报,2003,39:561-569。10.1046 / j.1529-8817.2003.02132.x。gydF4y2Ba
Sato M, Mogi Y, Nishikawa T, Miyamura S, Nagumo T, Kawano S:分藻藻的动态表面及其表面下区域的超微结构gydF4y2BaCyanophora paradoxagydF4y2Ba。植物学报,2009,29(3):344 - 344。10.1007 / s00425 - 008 - 0872 - 4。gydF4y2Ba
宫岛SY, Kabeya Y:叶绿体分裂:挤压光合俘虏。中华微生物学杂志,2010,13:738-746。10.1016 / j.mib.2010.10.004。gydF4y2Ba
de Boer PA:了解大肠杆菌细胞裂变的进展。中华微生物学杂志,2010,13:730-737。10.1016 / j.mib.2010.09.015。gydF4y2Ba
Egan AJ, Vollmer W:细菌细胞分裂的生理学研究。中国生物医学工程学报,2013,27(3):344 - 344。10.1111 / j.1749-6632.2012.06818.x。gydF4y2Ba
高野H, Takechi K:质体肽聚糖。生物化学学报,2003,19(4):344 - 344。gydF4y2Ba
Kasten B, Reski R: β-内酰胺类抗生素抑制苔藓叶绿体分裂(gydF4y2BaPhyscomitrella金属盘gydF4y2Ba),但番茄(Lycopersicon esculentum)中没有。植物营养学报,1997,15(3):357 - 357。10.1016 / s0176 - 1617(97) 80193 - 9。gydF4y2Ba
Katayama N, Takano H, Sugiyama M, Takio S, Sakai A, Tanaka K, Kuroiwa H, Ono K:抗生素抑制细菌肽聚糖合成途径对苔藓叶绿体分裂的影响。植物生理学报,2003,44:776-781。10.1093 /卡式肺囊虫肺炎/ pcg096。gydF4y2Ba
Matsumoto H, Takechi K, Sato H, Takio S, Takano H:干扰肽聚糖生物合成的抗生素治疗抑制了荚膜中叶绿体的分裂。公共科学学报,2012,7:e40734-10.1371/journal.pone.0040734。gydF4y2Ba
Machida M, Takechi K, Sato H, Chung SJ, Kuroiwa H, Takio S, Seki M, Shinozaki K, Fujita T, Hasebe M, Takano H:肽聚糖合成途径基因在苔藓叶绿体分裂中至关重要。美国国家科学研究院。2006, 30(4): 344 - 344。10.1073 / pnas.0510693103。gydF4y2Ba
Fukushima T, Afkham A, Kurosawa S, Tanabe T, Yamamoto H, Sekiguchi J:一种新的D, l -内肽酶基因产物YojL(改称CwlS)与LytE和LytF在枯草芽孢杆菌中发挥细胞分离作用。中国生物医学工程学报,2006,29(4):457 - 457。10.1128 / JB.00188-06。gydF4y2Ba
Uehara T, Dinh T, Bernhardt TG:子细胞分离和氨苄西林诱导的快速裂解需要lytm结构域因子gydF4y2Ba大肠杆菌gydF4y2Ba。中国生物医学工程学报,2009,29(4):344 - 344。10.1128 / JB.00505-09。gydF4y2Ba
Uehara T, Parzych KR, Dinh T, Bernhardt TG:子细胞分离受细胞动力学环激活细胞壁水解控制。中国生物医学工程学报,2010,29(2):344 - 344。10.1038 / emboj.2010.36。gydF4y2Ba
Peters NT, Dinh T, Bernhardt TG:由细胞分离酰胺酶及其激活剂的顺序募集产生的间隔环组装通路中的故障安全机制。中国生物医学工程学报,2011,29(3):344 - 344。10.1128 / JB.00316-11。gydF4y2Ba
莫尔华,李志刚,李志刚,李志刚,李志刚,李志刚:DipM是细胞分裂过程中肽聚糖重构的新因子gydF4y2Ba茎菌属crescentusgydF4y2Ba。中国生物医学工程学报,2010,37(3):344 - 344。10.1111 / j.1365-2958.2010.07224.x。gydF4y2Ba
Goley ED, Comolli LR, Fero KE, Downing KH, Shapiro L: DipM将肽聚糖重构与Caulobacter外膜组织联系起来。中国生物医学工程学报,2010,27(3):344 - 344。10.1111 / j.1365-2958.2010.07222.x。gydF4y2Ba
Poggio S, Takacs CN, Vollmer W, Jacobs-Wagner C:革兰氏阴性细菌中对细胞收缩至关重要的蛋白质gydF4y2Ba茎菌属crescentusgydF4y2Ba通过其肽聚糖结合的LysM结构域定位于分裂位点。中国生物医学工程学报,2010,27(3):344 - 344。10.1111 / j.1365-2958.2010.07223.x。gydF4y2Ba
Price DC, Chan CX, Yoon HS, Yang EC, Qiu H, Weber AP, Schwacke R, Gross J, Blouin NA, Lane C, Reyes-Prieto A, Durnford DG, Neilson JA, Lang BF, Burger G, Steiner JM, Löffelhardt W, Meuser JE, Posewitz MC, Ball S, Arias MC, Henrissat B,库蒂尼奥PM, Rensing SA, Symeonidi A, Doddapaneni H, Green BR, Rajah VD, Boore J, Bhattacharya D:gydF4y2BaCyanophora paradoxagydF4y2Ba基因组阐明了藻类和植物光合作用的起源。科学通报,2012,34(3):344 - 344。10.1126 / science.1213561。gydF4y2Ba
Mohammadi T, van Dam V, Sijbrandi R, Vernet T, Zapun A, Bouhss A, Diepeveen-de Bruin M, Nguyen-Disteche M, de Kruijff B, Breukink E:脂质连接细胞壁前体跨膜转运体FtsW的鉴定。环境科学学报,2011,30:425- 432。10.1038 / emboj.2011.61。gydF4y2Ba
Yamamoto H, Miyake Y, Hisaoka M, Kurosawa S, Sekiguchi J:大壁和小壁teichoic酸阻止植物性ldl -内肽酶LytF的侧壁定位gydF4y2Ba枯草芽孢杆菌gydF4y2Ba。中国生物医学工程学报,2008,29(4):457 - 457。10.1111 / j.1365-2958.2008.06397.x。gydF4y2Ba
潘德华,张志刚,陈志刚:DNA周期与生长速率的关系gydF4y2Ba聚球藻属gydF4y2Basp.菌株PCC 6301。中国生物医学工程学报,2000,27(3):457 - 457。gydF4y2Ba
Miyagishima SY, Suzuki K, Okazaki K, Kabeya Y:受藻细胞周期调控的核编码叶绿体分裂基因和蛋白的表达。分子生物学杂志,2012,29:2957-2970。10.1093 / molbev / mss102。gydF4y2Ba
Hoiczyk E, Hansel A:蓝藻细胞壁:来自不寻常原核包膜的新闻。中华微生物学杂志,2000,29(3):344 - 344。10.1128 / jb.182.5.1191 - 1199.2000。gydF4y2Ba
Yeh YC, Comolli LR, Downing KH, Shapiro L, McAdams HH: caulobacter toll - pal复合物对于外膜完整性和极性定位因子的定位至关重要。中国生物医学工程学报,2010,29(4):457 - 457。10.1128 / JB.00607-10。gydF4y2Ba
Melkonian M, Mollenhauer D: Robert Lauterborn(1869-1952)和他的gydF4y2BaPaulinella chromatophoragydF4y2Ba。生物工程学报,2005,29(3):344 - 344。10.1016 / j.protis.2005.06.001。gydF4y2Ba
普雷切特J, Kneip C, Lockhart P, Wenderoth K, Maier UG:细胞内球形体gydF4y2BaRhopalodia gibbagydF4y2Ba有蓝藻起源的固氮装置。中国生物医学工程学报,2004,29(4):477- 481。10.1093 / molbev / msh086。gydF4y2Ba
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ: gapping BLAST和ppi -BLAST:新一代蛋白质数据库搜索程序。中国生物医学工程学报,1997,25:389-3402。10.1093 / nar / 25.17.3389。gydF4y2Ba
西山T, Hiwatashi Y, Sakakibara I, Kato M, Hasebe M:苔藓的标记诱变和基因陷阱,gydF4y2BaPhyscomitrella金属盘gydF4y2Ba通过穿梭诱变。DNA res 2000, 7: 9-17。10.1093 / dnares / 7.1.9。gydF4y2Ba
Ichinose M, Tasaki E, Sugita C, Sugita M: cox1 pre-mRNA II组内含子的剪接需要PPR-DYW蛋白gydF4y2BaPhyscomitrella金属盘gydF4y2Ba。植物学报,2012,30(4):379 - 379。10.1111 / j.1365 - 313 x.2011.04869.x。gydF4y2Ba
Miyagishima SY, Wolk CP, Osteryoung KW:蓝藻细胞分裂基因的比较和突变分析。中国生物医学工程学报,2005,29(3):344 - 344。10.1111 / j.1365-2958.2005.04548.x。gydF4y2Ba
Nakanishi H, Suzuki K, Kabeya Y, Miyagishima SY:植物特异性蛋白MCD1与细菌来源的MinD共同决定叶绿体分裂的位置。动物学报,2009,19:151-156。10.1016 / j.cub.2008.12.018。gydF4y2Ba
确认gydF4y2Ba
我们感谢NIG的A. Yamashita和东海电子显微镜的Y. Ishihara的技术支持。本研究由日本科学促进会科学研究资助基金资助。25251039给S.M.)和日本科学技术振兴机构(JST)的进化科学技术核心研究(CREST)计划(给S.M.)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
SM设计了这项研究。SM和TF使用gydF4y2Bac . paradoxagydF4y2Ba。YK, CS和MS用gydF4y2Bap .金属盘gydF4y2Ba。SM完成了所有其他实验。SM写了手稿。经全体作者修改后,全体作者认可最终稿。gydF4y2Ba
电子辅助材料gydF4y2Ba
12870 _2013_1483_moesm1_esm.docgydF4y2Ba
附加文件1:表S1:蓝藻和叶绿体分裂蛋白的氨基酸或核苷酸序列的GenInfo标识符(GI)编号或位点id。(doc 53 kb)gydF4y2Ba
12870 _2013_1483_moesm2_esm.pnggydF4y2Ba
附加文件2:图S1:确认gydF4y2BaDipM1gydF4y2Ba而且gydF4y2BaDipM2gydF4y2Ba中断gydF4y2Bap .金属盘gydF4y2Ba。(A)插入突变gydF4y2BaP. patens DipM1gydF4y2Ba轨迹。的gydF4y2BanptIIgydF4y2Ba基因被插入gydF4y2BaDipM1gydF4y2BaPCR检测基因座和插入位点。PCR从插入的染色体和完整的染色体中分别得到3.9 kbp和1.9 kbp的产物。#3、#8和#11被用于进一步分析。(B)插入突变gydF4y2BaP. patens DipM2gydF4y2Ba轨迹。gydF4y2Ba成gydF4y2Ba基因被插入gydF4y2BaDipM2gydF4y2BaPCR检测基因座和插入位点。PCR从插入或完整的染色体分别产生3.2-kbp或1.2-kbp产物。1号和10号被用于进一步分析。(C)gydF4y2Ba成gydF4y2Ba基因被插入gydF4y2BaDipM2gydF4y2Ba∆的轨迹gydF4y2BaDipM1gydF4y2Ba突变体。如(B)所示,通过PCR检查插入位点。68号和82号被用于进一步分析。(png 313 kb)gydF4y2Ba
作者提交的图片原始文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/2.0gydF4y2Ba),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Miyagishima说Sy。,Kabeya, Y., Sugita, C.et al。gydF4y2Ba在叶绿体分裂过程中,DipM是肽聚糖水解所必需的。gydF4y2BaBMC植物生物学gydF4y2Ba14日,gydF4y2Ba57(2014)。https://doi.org/10.1186/1471-2229-14-57gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1471-2229-14-57gydF4y2Ba
关键字gydF4y2Ba
- 叶绿体分裂gydF4y2Ba
- DipMgydF4y2Ba
- 内共生gydF4y2Ba
- GlaucophytesgydF4y2Ba
- 肽聚糖gydF4y2Ba